Гидрофобные агонисты допамина, введенные в дерму
Формула / Реферат
1. Применение гидрофобного агониста допамина для получения лекарственного препарата для введения в дерму млекопитающего, так что при введении упомянутого гидрофобного агониста допамина в дерму наблюдается улучшенное системное всасывание по сравнению со всасыванием, наблюдаемым при введении упомянутого агониста допамина путем подкожного инъецирования ударной дозы.
2. Применение по п.1, причем млекопитающее является человеком, и упомянутый гидрофобный агонист допамина является соединением формулы (I)
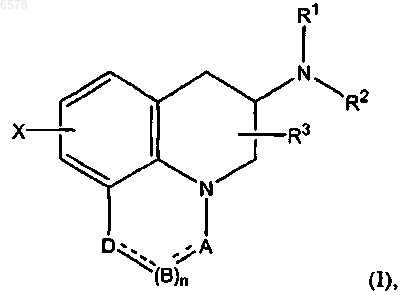
где R1, R2 и R3 одинаковы либо различны и представляют собой H, C1-6алкил (факультативно фенилзамещенный), C3-5алкенил, C3-5алкинил либо C3-10циклоалкил или где R3 соответствует вышеприведенному, а R1 и R2 циклизуются с присоединенным атомом N с образованием пирролидинильных, пиперидинильных, морфолинильных, 4-метилпиперазинильных или имидазолильных групп;
X - H, F, Cl, Br, I, OH, C1-6алкильная, C1-6алкоксильная группа, CN, карбоксамид, карбоксильная или (C1-6алкил)карбонильная группа;
A - CH, CH2, CHF, CHCl, CHBr, CHI, CHCH3, C=O, C=S, CSCH3, C=NH, CNH2, CNHCH3, CNHCOOCH3, CNHCN, SO2 или N;
B - CH, CH2, CHF, CHCl, CHBr, CHI, C=O, N, NH или NCH3;
D - CH, CH2, CHF, CHCl, CHBr, CHI, C=O, O, N, NH или NCH3 и
n - 0 или 1, и где ---- - одиночная или двойная связь,
при условии, что:
(1) когда n - 0 и A - CH2, CH-(галоген), где галоген соответствует приведенному выше определению, CHCH3, C=O, C=S, C=NH или SO2;
тогда D - CH2, CH-(галоген), где галоген соответствует приведенному выше определению, C=O, O, NH или N-CH3;
(2) когда n - 0 и A - CH, C-SCH3, C-NH2, C-NHCH3, C-NHCOOCH3, C-NHCN или N;
тогда D - CH или N;
(3) когда n - 1 и A - CH2, CH-(галоген), где галоген соответствует приведенному выше определению, CHCH3, C=O, C=S, C=NH или SO2; и B - CH2, CH-(галоген), где галоген соответствует приведенному выше определению, C=O, NH или N-CH3;
тогда D - CH2, C=O, O, NH или N-CH3;
(4) когда n - 1, и A - CH, C-SCH3, C-NH2, C-NHCH3, C-NHCOOCH3, C-NHCN или N; и B - CH или N;
тогда D-CH2, C=O, O, NH или N-CH3;
(5) когда n - 1, и A - CH2, CHCH3, C=O, C=S, C=NH или SO2; и B - CH или N;
тогда D - CH или N;
или его фармацевтически приемлемой солью.
3. Применение по п.2, причем упомянутый гидрофобный агонист допамина представляет собой (R)-5,6-дигидро-5-(метиламино)-4H-имидазо[4,5-ij]хинолин-2(1H)-тион или его фармацевтически приемлемую соль.
4. Применение по п.2, причем упомянутый гидрофобный агонист допамина представляет собой (R)-5,6-дигидро-5-(метиламино)-4H-имидазо[4,5-ij]хинолин-2(1H)-он или его фармацевтически приемлемую соль.
5. Применение по п.1, где подкожное инъецирование ударной дозы осуществляют в течение не более чем 10 мин.
6. Применение по п.5, где подкожное инъецирование ударной дозы осуществляют в течение не более чем 2 мин.
7. Применение по п.1, причем введение гидрофобного агониста допамина в дерму осуществляют инъецированием ударной дозы.
8. Применение по п.7, причем введение гидрофобного агониста допамина в дерму осуществляют в течение не более чем 10 мин.
9. Применение по п.8, причем введение гидрофобного агониста допамина в дерму осуществляют в течение не более чем 2 мин.
10. Применение по п.1, причем введение гидрофобного агониста допамина в дерму осуществляют путем многократного инъецирования ударной дозы.
11. Применение по п.1, причем при введении гидрофобного агониста допамина в дерму улучшается по меньшей мере один фармакокинетический параметр по сравнению с тем же параметром, наблюдаемым при введении агониста допамина путем подкожного инъецирования ударной дозы.
12. Применение по п.11, причем упомянутый фармакокинетический параметр включает повышение биодоступности гидрофобного агониста допамина.
13. Применение по п.11, причем упомянутый фармакокинетический параметр включает сокращение Tmax.
14. Применение по п.11, причем упомянутый фармакокинетический параметр включает увеличение Cmax.
15. Применение по п.11, причем упомянутый фармакокинетический параметр включает сокращение Tlag.
16. Применение по п.1, причем введение осуществляется через кожную микропору, образованную любым твердым выступом, электродвижущей силой, тепловой энергией либо газовой баллистикой.
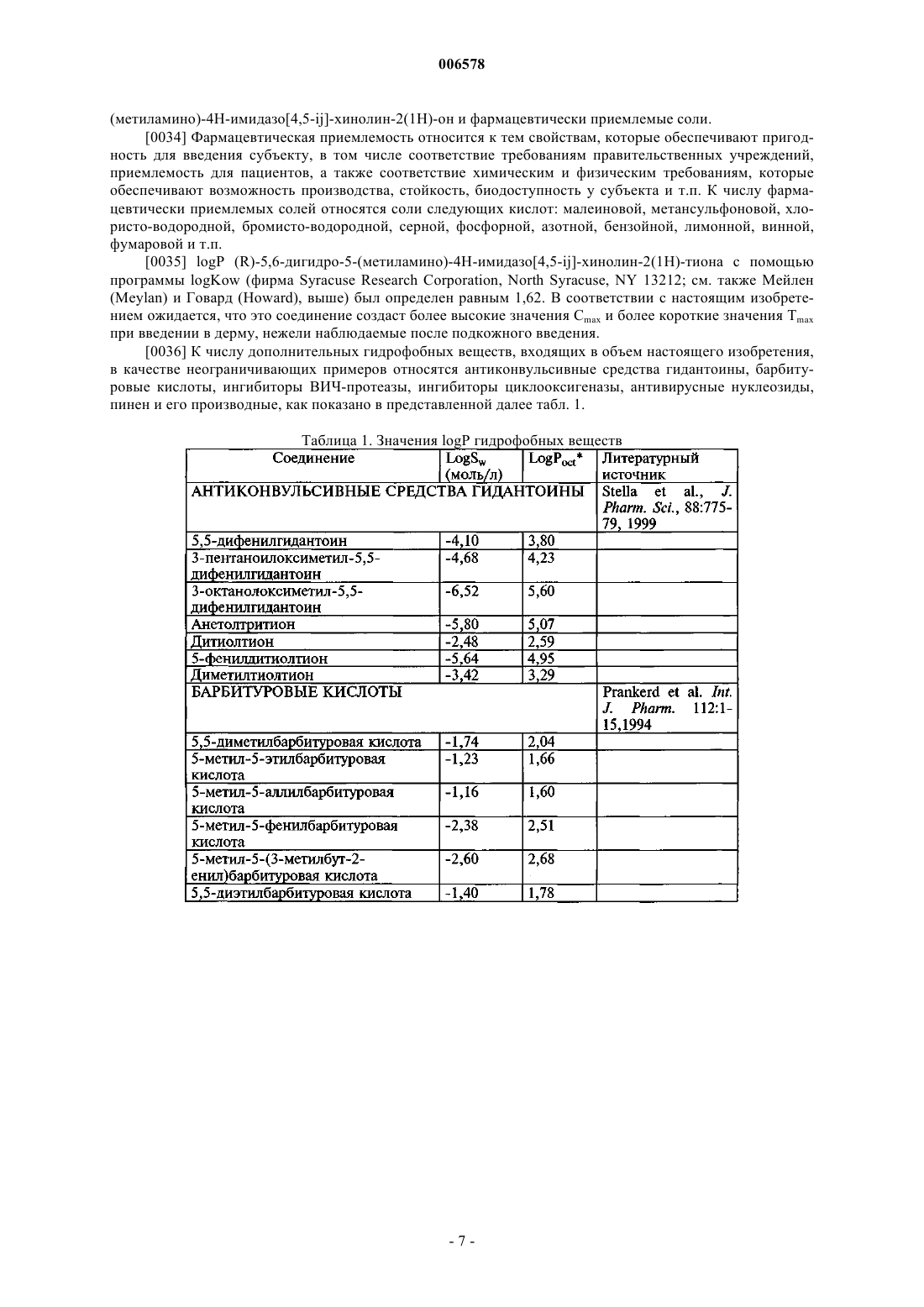
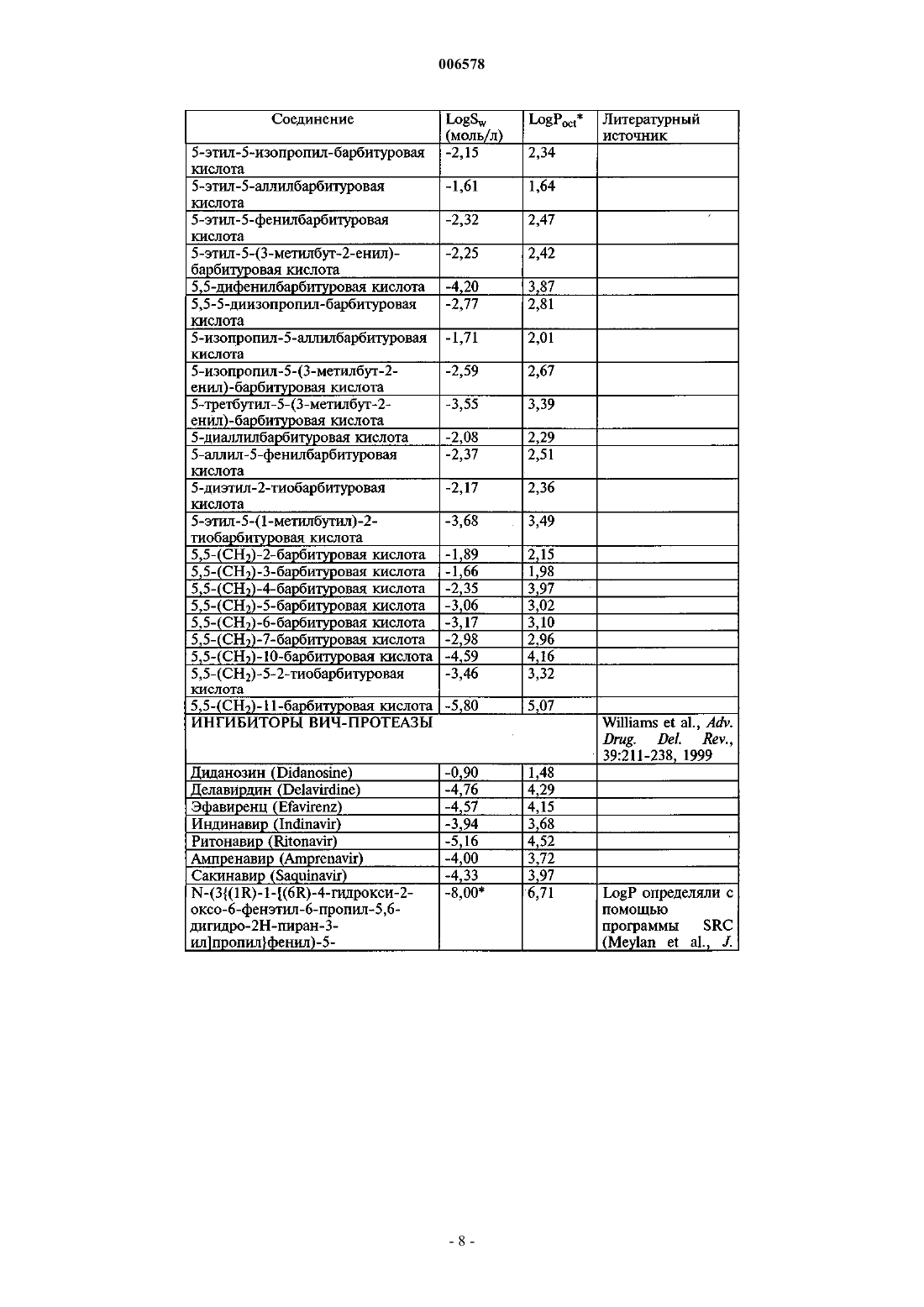
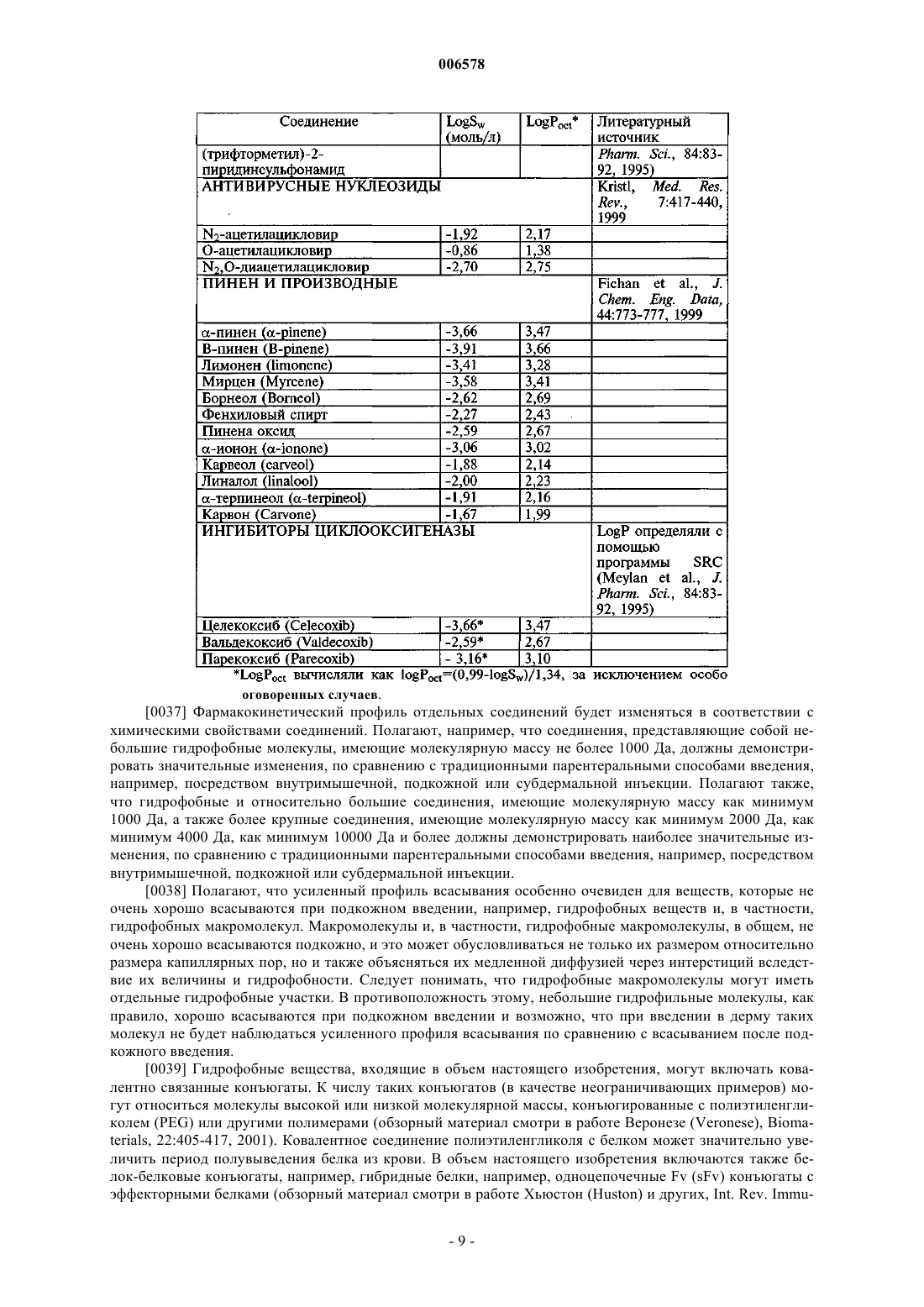
17. Применение по п.16, причем введение осуществляется по меньшей мере через одну полую иглу.
18. Применение по п.17, причем упомянутая по меньшей мере одна полая игла включает в себя комплект микроигл.
19. Применение по п.18, причем введение агониста допамина осуществляется при помощи инфузионного насоса, пьезоэлектрического насоса, электрического насоса, электромагнитного насоса, тарельчатой пружины, ионтофореза либо ультрафонофореза.
20. Применение по п.1, причем гидрофобный агонист допамина имеет logP около 1,5 или больше.
21. Применение по п.1, причем упомянутый агонист допамина имеет форму наночастиц или нанокристаллов.
Текст
006578 Перекрестная ссылка на родственные заявки[0001] Эта заявка представляет собой частичное продолжение заявки США 09/897,801, поданной 29 июня 2001 г. Предпосылки создания изобретения Область, к которой относится изобретение[0002] Настоящее изобретение относится к введению веществ в дерму и, конкретнее, к способам,композициям и устройствам для введения гидрофобных веществ в дерму. Следствием такого введения является системное всасывание, улучшенное по сравнению с всасыванием, наблюдающимся в случае подкожного введения. Описание известного уровня техники[0003] Издавна общепризнанным фактом является значение введения фармацевтических веществ,например, диагностических средств или лекарственных препаратов таким образом, чтобы обеспечивалось хорошее всасывание и биологическая эффективность. Такая биологическая эффективность зависит как от системного представления упомянутого вещества, что отражается фармакокинетическими параметрами, так и от действия лекарственного препарата, что отражается результатами определения фармакодинамических характеристик (обзорный материал см. в работах Кавелло (Cawello) и других, J. Clin.[0004] Гидрофобные вещества создают особую проблему при достижении необходимых биологических эффектов вследствие затруднений с получением композиций для доставки, в сочетании со значительным распределением этих веществ в жировой ткани и накоплением в такой ткани (Стайнер (Steiner) и другие, Drug Metab. Dispos., 19:8-14, 1991; Кси (Xie) и другие, Drug Metab. Dispos., 19:15-19, 1991; Хаф(Hough) и другие, Life Sci, 58:119-122, 1996). Как следствие, гидрофобные вещества часто демонстрируют не более чем ограниченное системное всасывание после введения большинством традиционных путей. К числу широко используемых путей системного введения относится введение подкожным, внутримышечным либо внутривенным путями. Все эти пути введения могут рассматриваться как чрезкожное введение, т.е. доставка веществ через кожу в место, находящееся под кожей. Для доставки веществ чрезкожным путем применяются, как правило, стандартные иглы, хотя использовались также и другие варианты подхода.[0005] С анатомической точки зрения, наружная поверхность тела состоит из двух основных слоев ткани, наружного эпидермиса и подлежащей дермы, которые вместе образуют кожу (см. обзор в Physiology, Biochemistry, and Molecular Biology of the Skin, второе издание под редакцией Л.А. Голдсмит (L.A.Goldsmith), Oxford University Press, New York, 1991). Эпидермис подразделяется на пять слоев общей толщиной от 75 до 150 мкм. Под эпидермисом располагается дерма, которая включает два слоя, самый поверхностный из которых называют сосочковым слоем, а глубже лежащий слой называют сетчатым. Сосочковый слой включает огромное количество сплетений мелких кровеносных и лимфатических сосудов. В противоположность этому, сетчатый слой является относительно бесклеточным и лишенным кровеносных сосудов и состоит из плотных пучков коллагеновых волокон и эластичной соединительной ткани. Под эпидермисом и дермой находится подкожная основа, которую называют также гиподермой, и которая состоит из соединительной и жировой ткани. Мышечная ткань располагается под подкожной основой.[0006] Как указывалось выше, как подкожная основа так и мышечная ткань традиционно использовались в качестве мест введения фармацевтических веществ. Дерма, однако, редко являлась местом введения веществ, и это может объясняться, по крайней мере отчасти, трудностью точного введения иглы в дерму. Более того, даже несмотря на то, что дерма, в частности, сосочковый слой дермы, как известно,имеет большое количество кровеносных сосудов, до сих пор не было понимания возможности использования преимущества, заключающегося в высокой степени васкуляризации, для достижения улучшенных,по сравнению с подкожным введением, показателей всасывания гидрофобных веществ. Это объясняется тем, что небольшие молекулы лекарственного препарата, как правило, быстро всасываются после введения в подкожную основу, точное попадание в которую представляется намного более легким и предсказуемым, нежели в дерму. С другой стороны, гидрофобные вещества, так же как и крупные молекулы,такие как молекулы белков, после подкожного введения, как правило, всасываются не быстро или не полностью. Поскольку гидрофобные вещества имеют склонность к распределению в подкожной жировой ткани, следует ожидать, что всасывание таких веществ в сосудистую систему после подкожного введения будет ограниченным (Уолдер (Walder), Immunopharmacol. Immunotoxicol., 13:101-119, 1991). Следует ожидать, что крупные молекулы белков после подкожного введения также будут медленно всасываться, и часто сообщается, что их биодоступность оказывается крайне изменчивой и неполной (Портер(Porter) и другие, Adv. Drug. Deliv. Rev., 50:157-171, 2001). Кроме того, гидрофобные белки после подкожного введения часто демонстрируют плохую всасываемость, определяемую посредством стандартных фармакокинетических параметров, по сравнению со значениями, полученными для белков, не являющихся гидрофобными (см., например, работу Томсен (Thomsen) и других, Pharmacol. Toxicol.,74:351-358, 1994). Несмотря на это, гидрофобные вещества, как правило, в дерму не вводятся.[0007] В многочисленных сообщениях в литературе представлялся способ, описывавшийся как "интрадермальное" введение. В таких литературных источниках, однако, термин "интрадермальное" часто применялся в соответствии со своим широко используемым значением "внутрикожное", т.е. введение в пределы кожного вещества. В объем этого понятия включается, главным образом, подкожная основа. В других литературных источниках так называемое "интрадермальное" введение инъецированных веществ обозначает не более чем местное введение упомянутого вещества без осуществления попыток обеспечения системной биодоступности инъецированных веществ.[0008] Один из таких вариантов обеспечения местного введения веществ повсеместно применяется при постановке туберкулиновой пробы (пробы Манту). При осуществлении этой процедуры очищенный безбелковый туберкулин с помощью иглы калибра 27 (0,360 мм) или 30 (0,251 мм) под небольшим углом вводится в поверхность кожи (Флинн (Flynn) и другие, Chest 106:1463-5, 1994). Следствием степени неопределенности места осуществления инъекции может быть, однако, получение некоторых ложноотрицательных результатов пробы. Более того, постановка упомянутой пробы включает ограниченное определенным участком осуществление инъекции для получения реакции на месте инъекции, и этот вариант(проба Манту) не привел к распространению способа инъецирования веществ в дерму с целью обеспечения их системного введения.[0009] Подобным же образом, местное "интрадермальное" инъецирование анестезирующих средств применяется для ослабления боли, связанной, например, с внутривенным введением катетера и с наложением швов на рваные раны (см., например, Крисвелл (Criswell) и другие, Anaesthesia, 46:691-692, 1991; Андерсон (Anderson) и другие, Ann. Emerg. Med., 19:519-22, 1990). Такое применение местных анестезирующих средств предназначено, однако, для локализации на месте инъекции, и системная доставка местных анестезирующих средств при этом не обеспечивается.[0010] Некоторые исследовательские группы сообщали о системном введении способом, который определялся ими как "интрадермальная" инъекция. В одном из таких сообщений было выполнено сравнительное исследование подкожного введения и того, что описывалось как "интрадермальная" инъекция(Отре (Autret) и другие, Therapie 46:5-8, 1991). В качестве экспериментального фармацевтического вещества использовался кальцитонин, белок, имеющий молекулярную массу около 3600, который обладает высокой растворимостью в воде в инъецируемой форме. Подобным же образом, Брессол и другие вводили водорастворимое вещество, цефтазидим натрия, способом, который определялся как "интрадермальная" инъекция (Брессол (Bressolle) и другие, J. Pharm. Sci. 82:1175-1178, 1993). Ни одна из этих работ не предоставляет никакой прогнозируемой информации относительно всасывания гидрофобных веществ после введения в дерму.[ОО 11] Другая группа сообщала о том, что описывалось как "интрадермальное" приспособление для доставки лекарственного препарата (патент США 5997501 на имя Гросс (Gross) и других). Указывалось на то, что инъекция осуществлялась с медленной скоростью, и местом инъекции предполагался некоторый участок под эпидермисом, т.е. поверхность раздела между эпидермисом и дермой либо внутренняя часть дермы или подкожной основы. Этим источником раскрывается введение с помощью специального приспособления посредством вливания с медленной скоростью, при котором не следует ожидать улучшенного системного всасывания, определяемого посредством фармакокинетических параметров, по сравнению с наблюдаемым в случае подкожного введения. Причина этого заключается в том, что при медленных скоростях вливания определителем скорости всасывания будет являться скорость вливания, а не кожные барьеры всасывания. Не следует ожидать, что кожное всасывание, как таковое, будет превосходить подкожное всасывание.[0012] Таким образом, сохраняется постоянная потребность в эффективных способах и средствах введения гидрофобных веществ таким образом, который обеспечивает быстрое и полное системное всасывание упомянутых соединений. Краткое изложение сущности изобретения[0013] Соответственно, автору настоящего изобретения удалось открыть вариант введения гидрофобных веществ, при котором обеспечивается улучшенное всасывание по сравнению с вызываемым при подкожном введении упомянутых веществ. Об улучшении всасывания свидетельствует улучшение, как минимум, одного фармакокинетического или фармакодинамического параметра. Упомянутый вариант включает избирательную доставку гидрофобных веществ в дерму. Доставка гидрофобных веществ осуществляется в дерму либо на участок, находящийся в непосредственной близости от дермы, благодаря чему всасывание происходит, главным образом, в дерме. Согласно варианту, которому отдается предпочтение, гидрофобное вещество вводится ударной дозой, т.е. в течение короткого периода времени от приблизительно 10 до приблизительно 15 мин или меньше и, согласно варианту, которому отдается большее предпочтение, в течение 2 мин или меньше. Удивление вызывает то, что следствием подобной доставки в дерму является улучшение фармакокинетических и/или фармакодинамических параметров,по сравнению с наблюдаемыми при подкожном введении.[0014] Таким образом, настоящее изобретение предоставляет, согласно одному из вариантов осуществления, способ системного введения вещества млекопитающему. Согласно варианту, которому отдается предпочтение, млекопитающим является человек, хотя домашние животные, например собаки и кош-2 006578 ки, сельскохозяйственные животные, например свиньи и коровы, экзотические животные, например зоопарковые животные и т.п., также включаются в объем настоящего изобретения.[0015] Термин "гидрофобное", используемый в отношении вещества, введенного в дерму или подкожную основу, означает, что упомянутое вещество имеет тенденцию к предпочтительному распределению в липофильных компартментах, таких, например, как обнаруживаемые в подкожных жировых тканях, нежели в водных внеклеточных жидкостях. Гидрофобность вещества может оцениваться стандартными методами, например посредством определения водно-масляного коэффициента распределения,предпочтительно n-октанол/водного коэффициента распределения (см., например, Бухвальд (Buchwald),Curr. Med. Chem., 5:353-380, 1998). Значения, как правило, выражаются в виде гидрофобности или логарифмического значения коэффициента распределения, logP, при соответствующих физиологических условиях. Такие условия будут зависеть от условий целевого участка введения у млекопитающего, включая температуру, рН, концентрацию и т.п. Кроме того, логарифмические значения октанол-водных коэффициентов распределения могут оцениваться с помощью различных вычислительных программ, например с помощью программы, разработанной фирмой Syracuse Research Corporation (Мейлен (Meylan) и Говард[0016] Пороговое значение logPoct, коррелирующее с распределением в жировой ткани, находится в пределах 1,0-2,0, как было показано Штайнером и другими для барбитуратных соединений (Штайнер(Steiner) и другие, Drug Metabolism and Disposition, 19:8-14, 1991; см., в частности, фиг. 4). Это было показано также для ряда основных лекарственных препаратов (Бетшарт (Betschart) и другие, Xenobiotica,18:113-121, 1988; см., в частности, фиг. 2). Таким образом, гидрофобные вещества, соответствующие настоящему изобретению, имеют пороговое значение logP, превышающее 1,00, предпочтительно как минимум около 1,5 или более. Для некоторых соединений была показана линейная взаимосвязь между поглощением жировой тканью и значениями logP до 5 и более (Бетшарт (Betschart) и другие, смотри выше). Таким образом, в некоторых вариантах осуществления настоящего изобретения желательно, чтобы гидрофобное соединение имело logPoct больше 1,5, например, как минимум, около 2,0 или выше, как минимум, около 2,5 или выше, как минимум, около 3,0 или выше, как минимум, около 3,5 или выше, как минимум, около 4,0 или выше или, как минимум, около 5,0 или выше.[0017] Упомянутыми гидрофобными веществами в соответствии с настоящим изобретением могут быть лекарственные препараты или диагностические средства, имеющие молекулы малого размера, или же крупные молекулы, например, белков, полисахаридов или других полимерных соединений. К числу гидрофобных веществ в соответствии с настоящим изобретением в качестве неограничивающих примеров относятся антиконвульсивные средства гидантоины, барбитуровые кислоты, ингибиторы ВИЧпротеазы, антивирусные нуклеозиды, трициклические азотсодержащие соединения для центральной нервной системы и расстройств, связанных с дисфункцией половой системы, а также многочисленные другие гидрофобные вещества. Настоящее изобретение является особенно применимым для трициклических азотсодержащих соединений, пригодных для лечения дисфункции половой системы у мужчин и женщин, как раскрывается в публикации РСТ заявки WO 00/4022. Соединения этого класса ранее раскрывались в патенте США 5273975 (оба документа, WO 00/40226 и патент США 5273975, включены в настоящее описание в полном объеме в качестве ссылки). К числу таких соединений относятся соединения, имеющие формулу (I) или их фармацевтически приемлемые соли, гдеR1, R2 и R3 одинаковы либо различны и представляют собой Н, С 1-6 алкил (факультативно фенилзамещенный), С 3-5 алкенил или алкинил либо С 3-10 циклоалкил или где R3 соответствует вышеприведенному, a R1 и R2 циклизуются с присоединенным атомом N с образованием пирролидинильных, пиперидинильных, морфолинильных, 4-метилпиперазинильных или имидазолильных групп;X - Н, F, Сl, Вr, I, ОН, C1-6 алкильная или алкоксильная группа, CN, карбоксамид, карбоксильная или (С 1-6 алкил)карбонильная группа; А - СН, СН 2, CHF, CHCl, СНВr, CHI, СНСН 3, С=О, C=S, CSCH3, C=NH, CNH2, CNHCH3,CNHCOOCH3, CNHCN, SO2 или N;D - CH, CH2, CHF, CHCl, CHBr, CHI, C=O, O, N, NH или NCH3; с различными оговорками, как указано в WO 00/40226. К числу предпочтительных соединений, применяемых в способах, соответствующих настоящему изобретению, относятся соединения, раскрываемые в пределах соединений этого же рода или конкретно-3 006578 в вышеупомянутом патенте США 5273975. К числу особо предпочтительных соединений относятся соединения формулы (II)[0018] Улучшенное системное всасывание, вызванное доставкой в дерму, может определяться любым из ряда стандартных фармакокинетических и/или фармакодинамических параметров, например повышением биодоступности, снижением Тmах, повышением Сmах, сокращением Tlag и т.п. Под биодоступностью подразумевается общее количество данной дозы, достигшее кровяного компартмента. Этот параметр определяется, как правило, площадью под кривой на графике зависимости концентрации от времени, т.е. AUC (площадь под кривой). Несмотря на то, что биодоступность теоретически включает общее количество, достигшее кровяного компартмента в течение неограниченного периода времени после введения дозы, практически же биодоступность измеряется в течение определенного периода времени, составляющего несколько часов после введения дозы, например, в течение около 2 ч, около 4 ч, около 6 ч,около 8 ч, около 12 ч, около 14 ч, около 24 ч после введения дозы или позднее.[0019] Термин "латентный период" или Tlag означает запаздывание между введением соединения и временем появления измеримых или обнаружимых уровней в крови или плазме. Несмотря на то, что Tlag будет зависеть от чувствительности аналитического метода, с помощью которого измеряются или определяются уровни вещества в крови или плазме, сокращение Tlag не зависит от аналитического метода,поскольку один и тот же аналитический метод используется для определения уровней в крови или плазме при сопоставимых условиях для демонстрации сокращения Tlag. Например, одна и та же аналитическая система используется для сравнения уровней в плазме после подкожного введения и после введения вещества в дерму. Более короткий промежуток времени для достижения обнаружимых уровней упомянутого вещества после введения в дерму, по сравнению с подкожным введением, указывает на улучшенное всасывание.[0020] Тmах является величиной, представляющей время до достижения максимальной концентрации упомянутого соединения в крови и Сmах обозначает максимальную концентрацию в крови, достигнутую при данной дозе и способе введения. Период времени до начала действия связывается с Tlag, Tmax иCmax, поскольку все эти параметры оказывают влияние на промежуток времени, необходимый для достижения концентрации в крови (либо ткани-мишени), требующейся для реализации биологического эффекта. Тmax и Сmax могут определяться визуальной проверкой графических результатов и часто могут предоставлять достаточный объем информации для сравнения двух способов введения соединения. Однако числовые значения могут более точно определяться посредством анализа с использованием кинетических моделей (как описывается ниже) и/или других средств, известных специалистам в данной области.[0021] Доставка в дерму может осуществляться с помощью любого из целого ряда разнообразных приспособлений, образующих кожные микропоры, например, образуемые любым твердым выступом,электродвижущей силой, тепловой энергией или газовой баллистикой. Такие приспособления называются в данном описании порообразующими приспособлениями, в частности, микропорообразующими приспособлениями или приспособлениями, обеспечивающими доступ к дерме. Согласно варианту, которому отдается предпочтение, доставка осуществляется с помощью одной или нескольких полых игл, хотя безыгольная баллистическая инъекция жидкостей или порошков в интрадермальное пространство, ионтофорез, электропорация или прямое осаждение жидкости, твердых веществ или других лекарственных дозированных форм в коже и т.п. также входят в объем настоящего изобретения до тех пор, пока упомянутым приспособлением для доставки образуется, как минимум, одна кожная микропора.[0022] Способы, соответствующие настоящему изобретению, могут включать, согласно одному из вариантов его осуществления, избирательную доставку гидрофобного вещества в дерму. Такая избирательная доставка включает преднамеренное размещение упомянутого вещества в дерме или на участке дермы, следствием чего явится или является доступ к и беспрепятственное всасывание упомянутого вещества в дерму, по сравнению с размещением на любом другом участке кожи. Избирательная доставка может включать, полностью или частично, признание того, что доставка упомянутого вещества производится в дерму. Согласно одному из аспектов этого варианта осуществления, следствием доставки упомянутого вещества в дерму является системное всасывание и, предпочтительно, обеспечивается улучшенное системное всасывание. Такое улучшенное системное всасывание может включать значительно более высокую биодоступность, и/или значительно более высокую Сmax, и/или значительно более короткий Тmax, и/или значительно более короткий Tlag. Согласно одной из версий этого варианта осуществления-4 006578 настоящего изобретения, подобная доставка предназначена для обеспечения системного всасывания и предпочтительно улучшенного системного всасывания. Такая избирательная доставка для обеспечения улучшенного системного всасывания может включать, в целом или частично, определение одного или нескольких фармакокинетических параметров, показывающих такое улучшение.[0023] Среди нескольких преимуществ, обеспечиваемых настоящим изобретением, можно, таким образом, отметить предоставление нового парентерального пути введения гидрофобных веществ, которым может обеспечиваться системная доставка упомянутых веществ; предоставление способа введения,пригодного для получения быстрого начала действия гидрофобных веществ; предоставление способов,пригодных для осуществления повторных введений ударных доз, имитирующих пульсообразное, быстрое высвобождение природных гормонов; предоставление способов, обеспечивающих возможность периодического и/или пульсообразного введения гидрофобных гормонов или миметиков, которые предотвращают любую отрицательную негативную модуляцию функции рецепторов, вызванную присутствием постоянных уровней гормонов в крови; предоставление способа введения, обеспечивающего высокую всасываемость и биодоступность с предоставлением возможности применения менее активного лекарственного препарата со снижением стоимости и уменьшением вероятности возникновения побочных эффектов; предоставление способа введения гидрофобного вещества, который может обеспечивать более высокие уровни в крови, нежели обеспечиваемые подкожным введением такой же самой дозы; предоставление способа введения, который обеспечивает повышенную эффективность упомянутого вещества без изменения скоростей системного удаления и без изменения фармакодинамических эффектов; предоставление способа, обеспечивающего предотвращение захвата упомянутого вещества подкожными липофильными компартментами с созданием депо-эффекта; предоставление способа, пригодного для применения в регулируемой схеме приема лекарственного препарата вследствие быстрого всасывания введенного вещества; и предоставление способа кожного введения, который, в случае его осуществления с помощью полой иглы, обеспечивает введение упомянутого вещества непосредственно вдерму во избежание метаболического расщепления и/или воздействия иммунологической активности, которые могут происходить в коже. Подробное описание изобретения[0024] В соответствии с настоящим изобретением, было открыто, что следствием введения гидрофобного вещества в дерму является улучшенное системное всасывание упомянутого вещества.[0025] Упомянутые гидрофобные вещества согласно настоящему изобретению характеризуются низкой водорастворимостью или нерастворимостью в воде, но растворимостью в неполярных растворителях. Гидрофобность вещества может оцениваться стандартными методами, например посредством определения водно-масляного коэффициента распределения, предпочтительно n-октанол/водного коэффициента распределения (см., например, Бухвальд (Buchwald), Сurr. Med. Chem., 5:353-380, 1998). Водномасляное распределение представляет собой отношение концентрации соединения в несмешиваемой с водой неполярной сольвентной фазе, например n-октаноле, к концентрации в водной фазе, контактирующей с упомянутой сольвентной фазой. Значения, как правило, выражаются в виде логарифмического значения коэффициента распределения, logP, при соответствующих физиологических условиях. Такие условия будут зависеть от условий целевого участка введения у млекопитающего, включая температуру,рН, концентрацию и т.п.[0026] В случае ионизирующихся веществ во внимание следует принимать значения рК или кологарифм константы диссоциации таких веществ, и эти значения иногда определяются одновременно с определением гидрофобности. Это объясняется тем, что коэффициент распределения представляет собой отношение концентрации вещества как нейтральной молекулы в несмешивающемся с водой растворителе к его концентрации в водной фазе. Таким образом, важно знать количество присутствующих нейтральных видов и это может определяться по рК упомянутого вещества и рН водного раствора. рКа представляет собой кологарифм константы равновесия кислоты, а рКb представляет собой кологарифм константы равновесия основы. Практически, кислота, имеющая рКа, на одну или несколько единиц превышающий 7,4,например 8,4 или выше, или основа, имеющая рКb, на одну или несколько единиц меньше 7,4, например 6,4 или меньше, при физиологическом рН, равном 7,4, находятся преимущественно в форме нейтральной молекулы, и эта нейтральная форма при проведении испытания на водно-масляное распределение будет распределяться, по сути, в масляной фазе.[0027] Еще одним фактором, который будет оказывать влияние на измеренное значение logP, кроме рН, является конкретный неполярный растворитель, использованный в водной фазе. Как правило, nоктанол является неполярным растворителем, поскольку это вещество имеет отношение углерода к кислороду, подобное отношению у липидного материала в животных жирах. Полагают, таким образом, что коэффициент распределения n-октанола отражает распределение вещества, введенного субъекту на участках тела, содержащих значительное количество жировой ткани.[0028] Коэффициент распределения вещества может определяться с помощью любого из целого ряда методов, известных в данной области. К их числу относятся (упоминаемые лишь в иллюстративных целях) потенциометрические методы, например, РСА 101, осуществляемый с помощью приспособления-5 006578 возможность определения как рКа, так и коэффициента распределения, методы с применением фильтрзондов (Томилинсон (Tomilinson), J. Pharm. Sci., 71:602-604, 1982); методы высокоэффективного жидкостного хроматографирования с обращенной фазой (смотри, например, Валко (Valko) и другие, Сurr. Med.[0029] Было показано, что logP соотносится с водорастворимостью согласно следующему уравнению (Ганш (Hansch) и другие, J. Org. Chem., 33:347-350, 1968):logSw = -l,341ogPoct + 0,99,где logSw - молярная растворимость и logPoct - водно-масляный коэффициент распределения. С помощью этого уравнения значения logPoct могут вычисляться по данным растворимости.[0030] Гидрофобные вещества, соответствующие настоящему изобретению, предпочтительно демонстрируют n-октанол-водный коэффициент распределения, как минимум, около 1,5 или выше, более предпочтительно, как минимум, около 2,0 или выше, и согласно некоторым вариантам осуществления настоящего изобретения, предпочтительно, как минимум, около 2,5 или выше, как минимум, около 3,0 или выше, как минимум, около 3,5 или выше либо, как минимум, около 4,0 или выше.[0031] Предполагается, что гидрофобные вещества, которые могут доставляться в дерму в соответствии с настоящим изобретением, должны включать фармацевтически или биологически активные вещества, в том числе диагностические средства, лекарственные препараты и другие вещества, которые обеспечивают терапевтические преимущества либо оказывают благоприятное воздействие на здоровье, например лекарственные питательные вещества.[0032] Упомянутыми гидрофобными веществами, в соответствии с настоящим изобретением, могут быть лекарственные препараты или диагностические средства, имеющие молекулы малого размера или же крупные молекулы, например, белков, полисахаридов или других полимерных соединений. К числу гидрофобных веществ в соответствии с настоящим изобретением в качестве неограничивающих примеров относятся антиконвульсивные средства гидантоины, барбитуровые кислоты, ингибиторы ВИЧпротеазы, антивирусные нуклеозиды, ингибиторы циклооксигеназы, трициклические азотсодержащие соединения для центральной нервной системы и расстройств, связанных с дисфункцией половой системы, а также многочисленные другие гидрофобные вещества.[0033] Настоящее изобретение является особенно применимым для трициклических азотсодержащих соединений формулы (I) или их фармацевтически приемлемых солей, гдеR1, R2 и R3 одинаковы либо различны и представляют собой Н, С 1-6 алкил (факультативно фенилзамещенный), С 3-5 алкенил или алкинил либо С 3-10 циклоалкил или где R3 соответствует вышеприведенному,a R1 и R2 циклизуются с присоединенным атомом N с образованием пирролидинильных, пиперидинильных, морфолинильных, 4-метилпиперазинильных или имидазолильных групп;X - Н, F, Cl, Вr, I, ОН, С 1-6 алкильная или алкоксильная группа, CN, карбоксамид, карбоксильная илиD - CH, CH2, CHF, CHCl, CHBr, CHI, C=O, O, N, NH или NCH3; с различными оговорками, как указано в WO 00/40226. К числу соединений, которым отдается особое предпочтение, относятся соединения формулы (II) где X - О (суманирол (sumanirole либо S (соединение III) (см. WO 00/40226 и патент США 5,273,975,которые включены в настоящее описание в полном объеме в качестве ссылки). К числу соединений, которым отдается особое предпочтение, относятся соединения ряда, пригодного для лечения дисфункции половой системы, в частности (R)-5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]-хинолин-2(1 Н)-тион и фармацевтически приемлемые соли, а также суманирол, который представляет собой (R)-5,6-дигидро-5-6 006578[0034] Фармацевтическая приемлемость относится к тем свойствам, которые обеспечивают пригодность для введения субъекту, в том числе соответствие требованиям правительственных учреждений,приемлемость для пациентов, а также соответствие химическим и физическим требованиям, которые обеспечивают возможность производства, стойкость, биодоступность у субъекта и т.п. К числу фармацевтически приемлемых солей относятся соли следующих кислот: малеиновой, метансульфоновой, хлористо-водородной, бромисто-водородной, серной, фосфорной, азотной, бензойной, лимонной, винной,фумаровой и т.п.(Meylan) и Говард (Howard), выше) был определен равным 1,62. В соответствии с настоящим изобретением ожидается, что это соединение создаст более высокие значения Сmах и более короткие значения Тmах при введении в дерму, нежели наблюдаемые после подкожного введения.[0036] К числу дополнительных гидрофобных веществ, входящих в объем настоящего изобретения,в качестве неограничивающих примеров относятся антиконвульсивные средства гидантоины, барбитуровые кислоты, ингибиторы ВИЧ-протеазы, ингибиторы циклооксигеназы, антивирусные нуклеозиды,пинен и его производные, как показано в представленной далее табл. 1. Таблица 1. Значения logP гидрофобных веществ[0037] Фармакокинетический профиль отдельных соединений будет изменяться в соответствии с химическими свойствами соединений. Полагают, например, что соединения, представляющие собой небольшие гидрофобные молекулы, имеющие молекулярную массу не более 1000 Да, должны демонстрировать значительные изменения, по сравнению с традиционными парентеральными способами введения,например, посредством внутримышечной, подкожной или субдермальной инъекции. Полагают также,что гидрофобные и относительно большие соединения, имеющие молекулярную массу как минимум 1000 Да, а также более крупные соединения, имеющие молекулярную массу как минимум 2000 Да, как минимум 4000 Да, как минимум 10000 Да и более должны демонстрировать наиболее значительные изменения, по сравнению с традиционными парентеральными способами введения, например, посредством внутримышечной, подкожной или субдермальной инъекции.[0038] Полагают, что усиленный профиль всасывания особенно очевиден для веществ, которые не очень хорошо всасываются при подкожном введении, например, гидрофобных веществ и, в частности,гидрофобных макромолекул. Макромолекулы и, в частности, гидрофобные макромолекулы, в общем, не очень хорошо всасываются подкожно, и это может обусловливаться не только их размером относительно размера капиллярных пор, но и также объясняться их медленной диффузией через интерстиций вследствие их величины и гидрофобности. Следует понимать, что гидрофобные макромолекулы могут иметь отдельные гидрофобные участки. В противоположность этому, небольшие гидрофильные молекулы, как правило, хорошо всасываются при подкожном введении и возможно, что при введении в дерму таких молекул не будет наблюдаться усиленного профиля всасывания по сравнению с всасыванием после подкожного введения.[0039] Гидрофобные вещества, входящие в объем настоящего изобретения, могут включать ковалентно связанные конъюгаты. К числу таких конъюгатов (в качестве неограничивающих примеров) могут относиться молекулы высокой или низкой молекулярной массы, конъюгированные с полиэтиленгликолем (PEG) или другими полимерами (обзорный материал смотри в работе Веронезе (Veronese), Biomaterials, 22:405-417, 2001). Ковалентное соединение полиэтиленгликоля с белком может значительно увеличить период полувыведения белка из крови. В объем настоящего изобретения включаются также белок-белковые конъюгаты, например, гибридные белки, например, одноцепочечные Fv (sFv) конъюгаты с эффекторными белками (обзорный материал смотри в работе Хьюстон (Huston) и других, Int. Rev. Immunol., 10:195-217, 1993). Одноцепочечные Fv-антитела могут также конъюгировать с небольшими молекулами, например, иммуносцинтиграфическими метками (см., например, Беген (Begen) и другие, Nat. Med.,2:979-984, 1996), и такие конъюгаты также входят в объем настоящего изобретения.[0040] Выражение "улучшенная фармакокинетика" означает, что достигается усиление фармакокинетического профиля, что определяется, например, с помощью стандартных фармакокинетических параметров, например, периода времени до достижения максимальной концентрации в плазме (Тmах), величины максимальной концентрации в плазме (Сmах) либо периода времени до появления минимально обнаружимой концентрации в крови либо плазме (Tlag). Выражение "усиленный профиль всасывания" означает, что всасывание улучшилось либо возросло, судя по результатам определения таких фармакокинетических параметров. Определение фармакокинетических параметров и определение минимально эффективных концентраций является установившейся практикой в данной области. Полагают, что получены большие значения по сравнению со стандартным путем введения, например подкожным введением или внутримышечным введением. При проведении подобных сравнений предпочтительно, хотя и не обязательно, чтобы введение в дерму и введение в контрольный участок, например подкожную основу, производилось одинаковыми дозами, т.е. одинаковым количеством лекарственного препарата одинаковой концентрации с использованием одинакового носителя. Введение в контрольный участок может производиться посредством введения ударной дозы и/или введение может производиться с той же самой скоростью, что и введение в дерму, т.е. со скоростью введения ударной дозы или с более медленной скоростью введения посредством вливания. Введение в контрольный участок со скоростью введения ударной дозы предпочтительно для достижения сравнимого усиления системного всасывания, ввиду того, что такое введение ударной дозы гидрофобных веществ в подкожную ткань демонстрирует уменьшенную скорость системного всасывания по сравнению с всасыванием гидрофильных веществ или веществ, обладающих меньшей гидрофобностью, нежели экспериментальное вещество (см., например, Фуджи (Fuji) и другие, Exp. Anim., 48:241-246, 1999). Таким образом, улучшение системного всасывания, отображаемое фармакокинетическими параметрами, оказывается более выраженным после введения в дерму, по сравнению со значениями, определенными после подкожного введения ударной дозы.[0041] Сравнение должно производиться также при одинаковой скорости введения с точки зрения количества и объема в единицу времени. Так, например, введение данного фармацевтического вещества в дерму при концентрации, например, 100 мкг/мл и со скоростью 100 мкл/мин в течение периода времени, равного 5 мин, должно предпочтительно сравниваться с введением такого же фармацевтического вещества в подкожное пространство в такой же концентрации 100 мкг/мл и с такой же скоростью 100 мкл/мин в течение периода времени, равного 5 мин.[0042] Введение гидрофобного вещества в дерму означает, что упомянутое вещество размещается таким образом, что легко достигает сосочкового слоя дермы, обильно снабженного кровеносными сосудами, и быстро всасывается в кровеносные капилляры и/или лимфатические сосуды, становясь системно биодоступным. Это может быть результатом размещения упомянутого вещества в верхней части дермы,например в сосочковом слое дермы либо в верхней части относительно меньше васкуляризованного сетчатого слоя дермы, благодаря чему упомянутое вещество легко диффундирует в сосочковый слой дермы.[0043] Кожа млекопитающих состоит из двух слоев, как обсуждалось выше, конкретно, эпидермиса и дермы. Эпидермис включает пять слоев, роговой слой, блестящий слой, зернистый слой, шиповатый слой и базальный слой; дерма состоит из двух слоев, верхнего сосочкового слоя дермы и более глубокого сетчатого слоя дермы. Толщина дермы и эпидермиса у людей различна у различных индивидов, и даже у одного индивида она различается в зависимости от местонахождения на теле. Например, сообщалось о том, что толщина эпидермиса колеблется в пределах от приблизительно 40 до приблизительно 90 мкм, а толщина дермы изменяется в пределах от менее чем 1 мм непосредственно под эпидермисом на некоторых участках тела до менее 2-около 4 мм на других участках тела, в зависимости от конкретного сообщения об экспериментальном исследовании (Хванг (Hwang) и другие, Ann. Plastic Surg., 46:327-331,2001; Саутвуд (Southwood), Plast. Reconstr. Surg., 15:423-429, 1955; Рашмер (Rushmer) и другие, Science,154:343-348, 1966). Настоящее изобретение, относительно введения людям, предусматривает доставку веществ в дерму в любом необходимом месте тела. Таким образом, глубина размещения упомянутого вещества будет зависеть от толщины дермы на нужном участке. Такое размещение может производиться,например, на глубине от приблизительно 1 мм в некоторых случаях в коже живота (Хванг (Hwang) и другие, см. выше) до приблизительно 4 мм в некоторых случаях в коже спины (Рашмер (Rushmer) и другие, см. выше).[0044] Для большинства участков человеческой кожи предпочтительно, чтобы вещество размещалось преимущественно на глубине, как минимум, около 0,3 мм, предпочтительнее на глубине, как минимум, около 0,4 мм и, наиболее предпочтительно на глубине, как минимум, около 0,5 мм и до глубины не более чем приблизительно 2,5 мм, предпочтительнее до глубины не более чем приблизительно 2,0 мм и наиболее предпочтительно до глубины не более чем приблизительно 1,7 мм, следствием чего будет быстрое всасывание макромолекулярных и/или гидрофобных веществ. Полагают, что следствием размещения упомянутого вещества преимущественно на больших глубинах и/или в нижележащей части сетчатого слоя дермы будет медленное всасывание в менее васкуляризованный сетчатый слой дермы либо в- 10006578 подкожную основу, причем следствием любого из этих вариантов будет снижение всасывания макромолекулярных и/или гидрофобных веществ. Контролируемая доставка вещества в дерму под сосочковым слоем дермы, а именно в сетчатый слой дермы, однако на участок, расположенный на достаточной высоте над поверхностью раздела между дермой и подкожной основой, обеспечит эффективное (кнаружи) перемещение упомянутого вещества к (ненарушенному) сосудистому и лимфатическому микрокапиллярному руслу (в сосочковом слое дермы), где оно может всасываться в большой круг кровообращения через эти микрокапилляры без изъятия в процессе перемещения любым другим кожным тканевым компартментом.[0045] Настоящим изобретением предоставляется способ лечения посредством доставки гидрофобного лекарственного препарата либо другого вещества человеку или животному путем непосредственного введения в дерму, где упомянутый лекарственный препарат или вещество вводится с помощью любого из целого ряда разнообразных приспособлений, обеспечивающих доступ к дерме. Было установлено,что вещества, введенные способами, соответствующими настоящему изобретению, оказываются клинически более пригодными и демонстрируют лучшие фармакокинетические параметры, нежели наблюдаемые в случае того же самого вещества, введенного посредством подкожной инъекции, например посредством подкожного введения ударной дозы.[0046] Приспособление для микропорации либо приспособление, обеспечивающее доступ к дерме,используемое для введения в дерму согласно настоящему изобретению, не является критическим до тех пор, пока оно проникает в кожу субъекта на необходимую заданную глубину, достигая дермы без прохождения сквозь нее в подкожную основу. В большинстве случаев, упомянутое приспособление будет проникать в кожу на глубину около 0,5-2 мм. Приспособление, обеспечивающее доступ к дерме может включать традиционные иглы для инъекции, катетеры либо микроиглы всех известных типов, используемые самостоятельно либо в виде комплектов из ряда игл. Приспособление, обеспечивающее доступ к дерме, может включать безыгольные инъекторы, в том числе баллистические безыгольные инъекторы. Термины "игла" и "иглы", используемые в настоящем описании, обозначают все такие иглоподобные приспособления. Термин "микроиглы", используемый в настоящем описании, обозначает приспособления меньше 30 калибра (0,251 мм), как правило, около 31-50 калибра (0,226-0,023 мм), где такие приспособления имеют цилиндрическую форму. Нецилиндрические приспособления, обозначаемые упомянутым термином "микроиглы", должны, таким образом, иметь сопоставимый диаметр и иметь пирамидальную, прямоугольную, восьмиугольную, клинообразную и другие геометрические формы.[0047] К числу приспособлений для микропорации либо приспособлений, обеспечивающих доступ к дерме, относятся также баллистические безыгольные инъекторы для введения жидкости, безыгольные инъекторы для введения порошка, безыгольные пьезоэлектрические, электрические, электромагнитные инъекторы, безыгольные газовые инъекторы, которые непосредственно проникают в кожу для обеспечения доступа с целью введения или непосредственно вводят вещества в определенное место в пределах дермального пространства. Заданная глубина доставки веществ с помощью приспособления, обеспечивающего доступ к дерме, может регулироваться практикующим врачом вручную или с/без помощи индикаторных устройств для указания достижения требуемой глубины. Однако предпочтительно упомянутое приспособление имеет конструктивное устройство для регулирования проникновения в кожу на требуемую глубину в пределах дермы. Это, как правило, осуществляется с помощью расширения или втулки, связанной с осью приспособления, обеспечивающего доступ к дерме, которым может придаваться форма опоры либо подставки, к которой крепятся иглы. Длина микроигл, используемых в качестве приспособления, обеспечивающего доступ к дерме, предпочтительно составляет менее чем 2 мм. Согласно настоящему изобретению, они могут использоваться как отдельные однопросветные микроиглы или же большое количество микроигл может собираться или изготовляться в виде прямолинейных или плоских комплектов с тем, чтобы увеличить скорость введения или количество вводимого вещества в течение данного промежутка времени. Микроиглы могут вставляться в различные приспособления, например держатели и корпуса, которые также могут использоваться для ограничения глубины проникновения. Приспособления, обеспечивающие доступ к дерме, соответствующие настоящему изобретению, могут также включать резервуары для размещения вещества перед доставкой либо насосы или другие приспособления для доставки лекарственного препарата или другого вещества под давлением. Согласно альтернативному варианту, устройство, в котором размещается приспособление, обеспечивающее доступ к дерме, может иметь внешнюю связь с такими дополнительными составными частями.[0048] Микроиглы, пригодные для введения в дерму, могут, например, иметь наружный диаметр около 250 мкм и открытую длину менее чем 2 мм. Такие микроиглы могут изготовляться из стали, других металлов, например меди, никеля, титана или их смесей, кремния, керамики, пластика или любого пригодного материала либо их комбинаций.[0049] Фармакокинетические показатели, подобные наблюдаемым в случае внутривенного введения, обеспечиваются посредством введения лекарственных препаратов в дерму в тесном контакте с капиллярными кровеносными сосудами и мелкими лимфатическими сосудами сосочкового слоя дермы. Следует понимать, что термины "микрокапилляры" или "капиллярные русла" относятся к сосудистым либо лимфатическим дренажным путям в пределах дермы.[0050] Не имея намерения ограничиваться какими-либо теоретическими механизмами действия,полагают, что быстрое всасывание, наблюдаемое при введении в дерму, является следствием наличия в дерме множества сплетений кровеносных и лимфатических сосудов. Однако наличие кровеносных и лимфатических сплетений в дерме само по себе не может обеспечить усиленного всасывания гидрофобных веществ, поскольку упомянутые вещества стремятся распределиться в липофильных компартментах с проявлением депо-эффекта, что, таким образом, снижает их биодоступность для всасывания. Усиленное всасывание, наблюдаемое при введении гидрофобного вещества в дерму, может, однако, объясняться отсутствием жировых клеток и, следовательно, существенным отсутствием липофильных компартментов в дерме. Другая возможная составляющая неожиданного усиленного всасывания, достигаемого при введении гидрофобных веществ в дерму, может являться следствием усиления кровотока и повышения капиллярной проницаемости, вызванных инъекцией в дерму. Известно, например, что булавочный укол с проникновением на глубину 3 мм вызывает увеличение кровотока, что, как полагают, не зависит от болевого стимула, а является следствием выделения гистамина тканями (Арилдсон (Arildsson) и другие,Microvascular Res. 59:122-130, 2000). Это соответствует наблюдению, заключающемуся в том, что острая воспалительная реакция, возникающая в ответ на повреждение кожи, вызывает временное увеличение кровотока и повышение капиллярной проницаемости (смотри Physiology, Biochemistry, and MolecularBiology of the Skin, второе издание под редакцией Л.А. Голдсмит (L.A. Goldsmith), Oxford UniversityPress, New York, 1991, стр. 1060; Уилем (Wilhem), Rev. Can. Вiol. 30:153-172, 1971). Одновременно с этим, предполагается, что инъекция в интрадермальный слой повышает интерстициальное давление. Известно, что возрастающее интерстициальное давление в пределах от нормального, составляющего приблизительно -7 мм рт.ст. (-933 Па) до приблизительно +2 мм рт.ст. (267 Па) расширяет лимфатические сосуды и увеличивает лимфоток (Скоуб (Skobe) и другие, J. Investig. Dermatol. Symp. Proc. 5:14-19, 2000). Полагают, таким образом, что повышенное интерстициальное давление, вызванное инъекцией в дерму,вызывает повышенный лимфоток и повышенное всасывание веществ, инъецированных в дерму.[0051] Способы введения, пригодные для осуществления настоящего изобретения, включают доставку лекарственных препаратов и других веществ людям или животным как в виде ударной дозы так и посредством вливания. Ударная доза представляет собой разовую дозу, доставляемую в одной единице объема в течение сравнительно короткого периода времени, как правило, около 10 мин или меньше, более предпочтительно около 2 мин или меньше. Введение ударной дозы может осуществляться с помощью приспособления, пригодного для обеспечения доступа к дерме, в состав которого входит также механизм для перемещения упомянутого вещества в дерму, например игла либо микроигла, соединенная со шприцем, приводимым в действие насосом. Согласно альтернативному варианту, доставка с помощью шприца и иглы может осуществляться вручную нажимом с контролированием времени инъецирования,которое составляет, как правило, около 2 мин или менее, с помощью секундной стрелки настенных или ручных часов.[0052] Введение посредством вливания включает введение жидкости с определенной скоростью,которая может быть постоянной или переменной, в течение относительно более продолжительного периода времени, как правило, превышающего приблизительно 10 мин. Для доставки вещества приспособление, обеспечивающее доступ к дерме, размещают в непосредственной близости от кожи субъекта,обеспечивая непосредственно направленный доступ в пределы дермы, и вещество или вещества доставляются или вводятся в дерму, где они могут действовать локально или всасываться в кровоток и распределяться системно. Упомянутое приспособление, обеспечивающее доступ к дерме, может соединяться с резервуаром, содержащим вещество либо вещества, подлежащие доставки. Доставка из упомянутого резервуара в дерму может происходить либо пассивно, без приложения внешнего давления либо других движущих средств к упомянутому веществу или веществам, подлежащим доставке, и/или активно, с приложением внешнего давления либо других движущих средств. Примерами предпочтительных средств, развивающих давление, являются насосы, шприцы, эластомерные мембраны, газовые, пьезоэлектрические, электрические, электромагнитные насосы, тарельчатые пружины или шайбы или их комбинации. В случае необходимости, скорость доставки упомянутого вещества может изменяться посредством регулирования средством, развивающим давление. В результате этого, упомянутое вещество поступает в дерму и всасывается в количестве и со скоростью, достаточными для обеспечения клинически эффективного результата. Выражение "клинически эффективные результаты", используемое в настоящем описании, включает как диагностически, так и терапевтически пригодные реакции, являющиеся следствием введения вещества либо веществ.[0053] Гидрофобные вещества, соответствующие настоящему изобретению, входят в состав композиции, пригодной для введения в дерму. Гидрофобное вещество может быть в форме раствора в неводном носителе или носителе, представляющем собой смесь воды и сорастворителя. К числу неводных носителей и/или сорастворителей относятся сахара и высокомолекулярные гидрофильные полимеры (см.,например, Ялковски (Yalkowsky), Solubility and Solubilization in Aqueous Media, Oxford University Press,New York, 1999). Неограничивающими примерами таких сорастворителей являются этанол, пропиленгликоль, глицерин, сорбит, полиэтиленгликоль 400, полиэтиленгликоль 4000, полоксамер 188, пропиленкарбонат, поливинилпирролидон, диметилизосорбид, N-метилпирролидон и их комбинации. Из числа- 12006578 таких композиций, носитель гидрофобного вещества будет включать, как минимум, один сорастворитель в концентрации от приблизительно 5 до приблизительно 95 маc.%. Предпочтительные композиции будут включать, как минимум, один сорастворитель в концентрации, как минимум, около 10 маc.%, как минимум, около 20 маc.%, как минимум, около 30 маc.%., как минимум, около 40 маc.%, до приблизительно 50 маc.% или более в водной среде. Применяться могут также смеси сорастворителей.[0054] Поверхностно-активные вещества, т.е. ПАВ, также могут присутствовать в композиции как солюбилизирующие агенты. Такие поверхностно-активные вещества могут быть анионными, катионными, цвиттерионными либо неионными (см., например, Ялковски (Yalkowsky), выше, стр. 236-320). К числу неограничивающих примеров поверхностно-активных веществ относятся фосфолипиды, например,лецитин, бензалкония хлорид, бензэтония хлорид, цетилпиридиния хлорид, диоктилнатрия сульфосукцинат, ноноксинол 9, ноноксинол 10, октоксинол 9, полоксамеры, полиоксиэтилен (8), каприловые/каприновые моно- и диглицериды (например, Labrasol (фирма Gattefosse, полиоксиэтилен (35) касторовое масло, полиоксиэтилен (20) цетостеариловый простой эфир, полиоксиэтилен (40) гидрогенизированное касторовое масло, полиоксиэтилен (10) олеиловый простой эфир, полиоксиэтилен (40) стеарат, полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80 (например, Tween 80 (фирма ICI,пропиленгликольлаурат (например, Lauroglycol (фирма Gattefosse, натрийлаурилсульфат, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат, сорбитанмоностеарат, тилоксапол и их смеси.[0055] В состав композиций, включающих поверхностно-активные вещества, входит предпочтительно от приблизительно 1 маc.% или меньше до приблизительно 15 маc.% поверхностно-активного вещества. Предпочтительные концентрации поверхностно-активных веществ составляют, как минимум,около 2 маc.%, как минимум, около 3 маc.%, как минимум, около 4 маc.% до приблизительно 5 маc.%.[0056] Гидрофобное вещество может быть также в форме наночастиц либо нанокристаллов, диспергированных либо суспендированных в водной среде. В такой композиции упомянутое гидрофобное вещество представлено в виде наночастиц, имеющих D90 менее чем приблизительно 1 мкм (D90 представляет собой такой диаметр, при котором наибольший размер 90 маc.% частиц оказывается меньше этого диаметра). В таких композициях, включающих наночастицы, средний размер частиц фракции составляет,как правило, от приблизительно 100 до приблизительно 800 нм, например, от приблизительно 150 нм до приблизительно 600 нм либо от приблизительно 200 до приблизительно 400 нм. Упомянутые наночастицы могут также иметь размер D25 от приблизительно 450 до приблизительно 1000 нм и более предпочтительно от приблизительно 500 до приблизительно 900 нм (D25 представляет собой такой диаметр, при котором наибольший размер 90 маc.% частиц оказывается меньше этого диаметра). Фармацевтические композиции, в состав которых входит гидрофобное вещество в любой из таких форм, представленных наночастицами, могут быть пригодными в способах, соответствующих настоящему изобретению.[0057] Известны многочисленные способы получения композиций терапевтических веществ в форме наночастиц. В некоторых из этих способов применяются механические средства, например, измельчающие устройства, для уменьшения размера частиц до нанодиапазона, в других осуществляется осаждение наночастиц из раствора. Иллюстративные способы раскрываются в патентных публикациях, представленных ниже. Патенты США:4,826,689;5,145,684;5,298,262;5,302,401;5,336,507;5,340,564;5,346,702;5,352,459;5,354,560;5,384,124;5,429,824;5,503,723;5,510,118;5,518,187;5,518,738;5,534,270;5,536,508;5,552,160;5,560,931;5,560,932;5,565,188;5,569,448;5,571,536;5,573,783;5,580,579;5,585,108;5,587,143;5,591,456;5,622,938;5,662,883;5,665,331;5,718,919;5,747,001. Публикации РСТ заявок WO 93/25190; WO 96/24336; WO 97/14407; WO 98/35666; 99/65469; WO 00/18374; WO 00/27369; WO 00/30615.[0058] Средний специалист в данной области сможет приспособить описанные способы для получения гидрофобного вещества в форме наночастиц.[0059] Ниже приведено описание иллюстративных примеров. Пример 1.[0060] Этот пример иллюстрирует улучшенное системное всасывание (R)-5,6-дигидро-5(метиламино)-4 Н-имидазо[4,5-ij]-хинолин-2-(1 Н)-тиона при введении в дерму.[0061] Упомянутое соединение (R)-5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]-хинолин-2-(1 Н)тион имеет значение logP, определенное с помощью программы logKow (фирма Syracuse Research Corporation, North Syracuse, NY 13212; смотри также Мейлен (Meylan) и Говард (Howard), выше), составляющее 1,62. Согласно настоящему изобретению было показано, что это соединение обеспечивает более высокие уровни в плазме и улучшенные фармакокинетические параметры при введении в дерму, нежели наблюдаемые при подкожном введении.[0062] Использовали шесть миниатюрных свиней породы Yucatan массой 20-25 кг. Растворы (R)5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]-хинолин-2-(1 Н)-тиона получали в концентрациях 10 мг/мл при рН 5,5 в цитратно/фосфатном буфере с достаточным количеством декстрозы для обеспечения изотоничности при введении (R)-5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]-хинолин-2-(1 Н)-тиона следующими путями:(А) внутривенно, ударная доза, (В) подкожная инъекция и (С) инъекция в дерму с помощью комплекта микроигл. В ходе осуществления полного "перевернутого" плана эксперимента было задействовано, в общем, 6 животных, каждое из которых получало 1,0 мг дозу всеми путями введения в 0,1 мл инъекционном объеме.[0063] Внутривенную дозу вводили с помощью катетера в ушную вену. Подкожную доставку осуществляли с помощью стандартной 0,5 дюймовой (12,7 мм) иглы 30 калибра (0,251 мм). Доставку в дерму осуществляли с помощью комплекта из 3 микроигл 34 калибра (0,160 мм) с 7 мм расстоянием между иглами на глубину 1 мм в правый бок животного между грудной клеткой и задней ногой. Подкожное и внутривенное введение осуществляли посредством инъецирования, выполнявшегося вручную. Введение в дерму осуществляли со скоростью 90 мкл/мин с помощью шприц-насоса.[0064] Согласно полному "перевернутому" плану эксперимента, каждому животному производили внутривенное, подкожное и интрадермальное введение. В течение двухнедельного периода каждое животное обрабатывалось трижды с минимальным 2-дневным периодом вымывания между последующими дозами. Лекарственный препарат применяли согласно схеме, представленной далее в табл. 2. Таблица 2. Схема применения лекарственного препаратаIV обозначает внутривенное введение, SC обозначает подкожное введение и ID обозначает введение в дерму.[0065] Пробы крови отбирали через "ворота" доступа полой вены непосредственно перед введением дозы через 5, 10, 15, 20, 30, 45, 60 мин и через 2, 3, 4, 6, 8, 10, 14 и 24 ч после введения. При применении данного способа отсчет времени начинали в момент завершения инъекции. Пробы венозной крови отбирали в вакутейнеры с этилендиаминтетрауксусной кислотой и центрифугировали при приблизительно 1000 g в течение 10 мин при температуре 4 С. После центрифугирования слой плазмы переносили в пластиковые пробирки для хранения и хранили в замороженном виде при температуре -70 С до проведения анализа.[0066] Анализ проб свиной плазмы осуществляли посредством высокоэффективного жидкостного хроматографирования. Результаты приведены ниже в табл. 3. Таблица 3. Концентрации в плазме (нг/мл) (R)-5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]-хинолин 2-(1 Н)-тиона после введения миниатюрным свиньям породы Yucatan различными путями Лекарственный препарат вводили внутривенным путем (IV), подкожным путем (SC) и посредством введения в дерму (ID). Внутривенную дозу в подгруппе, предназначенной для введения 1,0 мг, вводили в ушную вену.[0067] Как показано в табл. 3, при введении в дерму получали более высокие уровни лекарственного препарата в плазме, нежели получаемые при подкожном введении. Регрессионный анализ гетерогенности данных показал, что значения, полученные после введения в дерму и внутривенного введения,друг от друга не отличались, но отличались от данных, полученных после подкожного введения.[0068] Фармакокинетические параметры оценивались с помощью системы Watson Drug MetabolismLaboratory Information Management System, версия 6.2.0.02 (фирма Innaphase Corp., Philadelphia, Пенсильвания). Определяли следующие параметры: максимальная концентрация в плазме, Сmах, период времени до достижения максимальной концентрации лекарственного препарата в плазме, Тmах, площадь под кривой определяли до t=бесконечность, AUC(0-8) и период полувыведения концентрации в плазме, T1/2.[0069] Фармакокинетические параметры представлены в приведенной ниже табл. 4. Таблица 4. Средние фармакокинетические параметры (среднее квадратическое отклонение) (R)-5,6 дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]-хинолин-2-(1 Н)-тиона после введения миниатюрным свиньям породы Yucatan различными путями Лекарственный препарат вводили внутривенным путем (IV), подкожным путем (SC) и посредством введения в дерму (ID).[0070] Как показано в представленной таблице, после введения в дерму значения Сmах были последовательно больше, а значения Тmах были последовательно меньше значений соответствующих параметров, полученных после подкожного введения гидрофобного вещества (R)-5,6-дигидро-5-(метиламино)4 Н-имидазо[4,5-ij]-хинолин-2-(1 Н)-тиона.[0071] Поскольку в вышеприведенные способы и композиции могут быть внесены различные изменения без отступления от объема изобретения, предполагается, что все содержание вышеприведенного описания должно истолковываться в иллюстративном, а не в ограничительном смысле.[0072] Все источники, упомянутые в настоящем описании, включены в него в качестве ссылки. Обсуждение упомянутых источников в настоящем описании имеет целью лишь обобщение заявлений, сделанных их авторами и не является признанием того, что любой источник представляет известный уровень техники, относящийся к патентоспособности. Заявитель оставляет за собой право ставить под сомнение точность и уместность упомянутых источников. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение гидрофобного агониста допамина для получения лекарственного препарата для введения в дерму млекопитающего, так что при введении упомянутого гидрофобного агониста допамина в дерму наблюдается улучшенное системное всасывание по сравнению со всасыванием, наблюдаемым при введении упомянутого агониста допамина путем подкожного инъецирования ударной дозы. 2. Применение по п.1, причем млекопитающее является человеком, и упомянутый гидрофобный агонист допамина является соединением формулы (I) где R1, R2 и R3 одинаковы либо различны и представляют собой Н, C1-6 алкил (факультативно фенилзамещенный), С 3-5 алкенил, С 3-5 алкинил либо С 3-10 циклоалкил или где R3 соответствует вышеприведенному,a R1 и R2 циклизуются с присоединенным атомом N с образованием пирролидинильных, пиперидинильных, морфолинильных, 4-метилпиперазинильных или имидазолильных групп;D - CH, CH2, CHF, CHCl, CHBr, CHI, C=O, O, N, NH или NCH3; и n - 0 или 1, и где- одиночная или двойная связь,при условии, что(1) когда n - 0 и А - СН 2, СН-(галоген), где галоген соответствует приведенному выше определению,СНСН 3, С=О, C=S, C=NH или SO2; тогда D - CH2, СН-(галоген), где галоген соответствует приведенному выше определению, С=О, О,NH или N-CH3;(3) когда n - 1, и А - СН 2, СН-(галоген), где галоген соответствует приведенному выше определению, СНСН 3, С=О, C=S, C=NH или SO2; и В-СН 2, СН-(галоген), где галоген соответствует приведенному выше определению, С=О, NH или N-CH3; тогда D - СН 2, С=О, О, NH или N-CH3;(5) когда n - 1, и А - СН 2, СНСН 3, С=О, C=S, C=NH или SO2; и В-СН или N; тогда D - СН или N; или его фармацевтически приемлемой солью. 3. Применение по п.2, причем упомянутый гидрофобный агонист допамина представляет собой (R)5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]хинолин-2(1 Н)-тион или его фармацевтически приемлемую соль. 4. Применение по п.2, причем упомянутый гидрофобный агонист допамина представляет собой (R)5,6-дигидро-5-(метиламино)-4 Н-имидазо[4,5-ij]хинолин-2(1 Н)-он или его фармацевтически приемлемую соль. 5. Применение по п.1, где подкожное инъецирование ударной дозы осуществляют в течение не более чем 10 мин. 6. Применение по п.5, где подкожное инъецирование ударной дозы осуществляют в течение не более чем 2 мин. 7. Применение по п.1, причем введение гидрофобного агониста допамина в дерму осуществляют инъецированием ударной дозы. 8. Применение по п.7, причем введение гидрофобного агониста допамина в дерму осуществляют в течение не более чем 10 мин. 9. Применение по п.8, причем введение гидрофобного агониста допамина в дерму осуществляют в течение не более чем 2 мин. 10. Применение по п.1, причем введение гидрофобного агониста допамина в дерму осуществляют путем многократного инъецирования ударной дозы. 11. Применение по п.1, причем при введении гидрофобного агониста допамина в дерму улучшается по меньшей мере один фармакокинетический параметр, по сравнению с тем же параметром, наблюдаемым при введении агониста допамина путем подкожного инъецирования ударной дозы. 12. Применение по п.11, причем упомянутый фармакокинетический параметр включает повышение биодоступности гидрофобного агониста допамина. 13. Применение по п.11, причем упомянутый фармакокинетический параметр включает сокращение Тmах. 14. Применение по п.11, причем упомянутый фармакокинетический параметр включает увеличение Сmах. 15. Применение по п.11, причем упомянутый фармакокинетический параметр включает сокращение Tlag.- 16006578 16. Применение по п.1, причем введение осуществляется через кожную микропору, образованную любым твердым выступом, электродвижущей силой, тепловой энергией либо газовой баллистикой. 17. Применение по п.16, причем введение осуществляется по меньшей мере через одну полую иглу. 18. Применение по п.17, причем упомянутая по меньшей мере одна полая игла включает в себя комплект микроигл. 19. Применение по п.18, причем введение агониста допамина осуществляется при помощи инфузионного насоса, пьезоэлектрического насоса, электрического насоса, электромагнитного насоса, тарельчатой пружины, ионтофореза либо ультрафонофореза. 20. Применение по п.1, причем гидрофобный агонист допамина имеет logP около 1,5 или больше. 21. Применение по п.1, причем упомянутый агонист допамина имеет форму наночастиц или нанокристаллов.
МПК / Метки
МПК: A61M 5/158, A61N 1/30, A61K 31/4745, A61M 5/00
Метки: введенные, дерму, агонисты, допамина, гидрофобные
Код ссылки
<a href="https://eas.patents.su/18-6578-gidrofobnye-agonisty-dopamina-vvedennye-v-dermu.html" rel="bookmark" title="База патентов Евразийского Союза">Гидрофобные агонисты допамина, введенные в дерму</a>
Предыдущий патент: Контроли чувствительности для серологии крови, приготовленные из модифицированных клеток
Следующий патент: Выявление индуцибельных генов в микроорганизмах
Случайный патент: Смещенное отверстие клапана в насосе с возвратно-поступательным движением поршня