Сочетания ингибиторов транспорта желчных кислот в подвздошной кишке и агентов, секвестрирующих желчные кислоты, для сердечно-сосудистых показаний
Номер патента: 4877
Опубликовано: 26.08.2004
Авторы: Шух Джозеф Р., Келлер Брэдли Т., Гленн Кевин К.
Формула / Реферат
1. Терапевтическое сочетание, включающее эффективное количество первого соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второго соединения, секвестрирующего (связывающего) желчные кислоты, где количества первого и второго вместе составляют эффективное в отношении гиперлипидемического состояния количество данных соединений и где соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, представляет собой соединение, формулы В-5
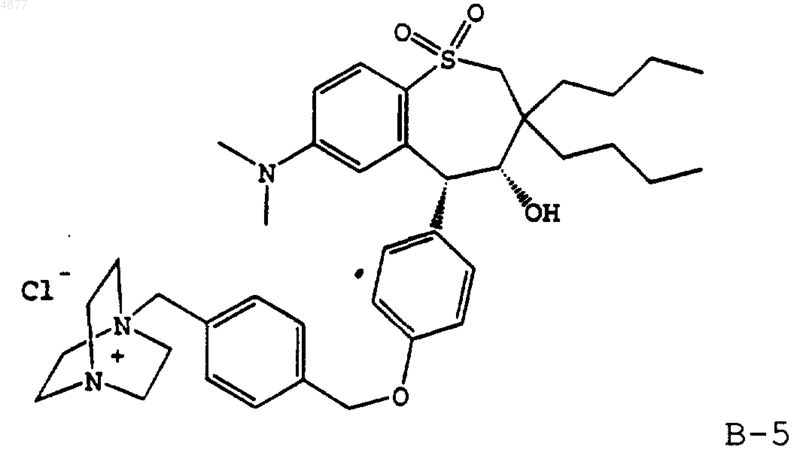
или его энантиомер, рацемат или фармацевтически приемлемую соль.
2. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является холестирамин или его фармацевтически приемлемая соль.
3. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является колестипол или его фармацевтически приемлемая соль.
4. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является амфифильный сополимер, имеющий домен поперечно-сшитой оболочки и домен внутреннего ядра, или его фармацевтически приемлемая соль.
5. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является полиаллиламин или его фармацевтически приемлемая соль.
6. Терапевтическое сочетание по п.5, где полиаллиламин представляет собой колесвелама гидрохлорид или его фармацевтически приемлемую соль.
7. Терапевтическое сочетание по п.5, где полиаллиламин представляет собой OmegaGel или его фармацевтически приемлемую соль.
8. Фармацевтическая композиция, включающая эффективное количество первого соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второго соединения, секвестрирующего желчные кислоты, где количества первого и второго вместе составляют эффективное в отношении гиперлипидемического состояния количество данных соединений, причем количество первого составляет примерно от около 0,01 до 1000 мг, а второго от около 250 до около 30000 мг, и где соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, представляет собой соединение формулы В-5

или его энантиомер, рацемат или фармацевтически приемлемую соль.
9. Фармацевтическая композиция по п.8, где соединение, секвестрирующее желчные кислоты, представляет собой холестирамин или его фармацевтически приемлемую соль.
10. Фармацевтическая композиция по п.8, где соединение, секвестрирующее желчные кислоты, представляет собой колестипол или его фармацевтически приемлемую соль.
11. Фармацевтическая композиция по п.8, где соединение, секвестрирующее желчные кислоты, представляет собой амфифильный сополимер, имеющий домен поперечно-сшитой оболочки и домен внутреннего ядра, или его фармацевтически приемлемую соль.
12. Фармацевтическая композиция по п.8, где соединение, секвестрирующее желчные кислоты, представляет собой полиаллиламин или его фармацевтически приемлемую соль.
13. Фармацевтическая композиция по п.12, где полиаллиламин представляет собой CholestaGel или его фармацевтически приемлемую соль.
14. Фармацевтическая композиция по п.12, где полиаллиламин представляет собой OmegaGel или его фармацевтически приемлемую соль.
15. Способ профилактики или лечения гиперлипидемического состояния, включающий введение пациенту, нуждающемуся в лечении, эффективного количества сочетания первого соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второго соединения, секвестрирующего желчные кислоты, где количества первого и второго вместе составляют эффективное антигиперлипидемическое количество данных соединений и где соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, представляет собой соединение формулы В-5
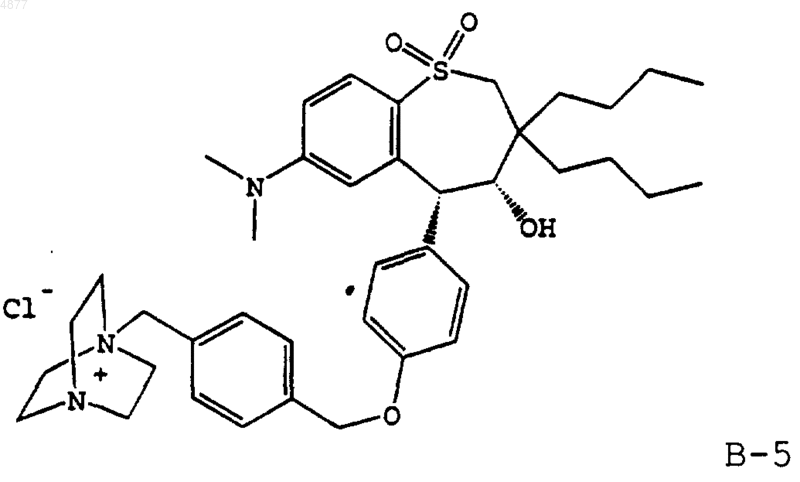
или его энантиомер, рацемат или фармацевтически приемлемую соль.
16. Способ по п.15, где суточная доза введения первого составляет примерно от около 0,01 до 1000 мг, а второго от около 250 до около 30000 мг.
17. Способ по п.15, где гиперлипидемическим состоянием является атеросклеротическое состояние.
18. Способ по п.15, где гиперлипидемическим состоянием является гиперхолестеринемия.
19. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой холестирамин или его фармацевтически приемлемую соль.
20. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой колестипол или фармацевтически приемлемую соль.
21. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой амфифильный сополимер, имеющий домен поперечно-сшитой оболочки и домен внутреннего ядра, или его фармацевтически приемлемую соль.
22. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой полиаллиламин или его фармацевтически приемлемую соль.
23. Способ по п.22, где полиаллиламин представляет собой CholestaGel или его фармацевтически приемлемую соль.
24. Способ по п.22, где полиаллиламин представляет собой OmegaGel или его фармацевтически приемлемую соль.
Текст
1 В данной заявке испрашивается приоритет на основании предварительной заявки США 60/143043, поданной 7 июля 1999 г., и предварительной заявки США 60/113955, поданной 23 декабря 1998 г. Предпосылки создания изобретения Область изобретения Настоящее изобретение относится к способам лечения сердечно-сосудистых заболеваний и, конкретно, оно относится к сочетаниям(комбинациям) соединений, композициям и способам их применения в медицине, особенно для профилактики и лечения гиперлипидемических состояний, таких как состояния,связанные с атеросклерозом, гиперхолестеринемией и другими заболеваниями коронарной артерии у млекопитающих. Более конкретно,данное изобретение относится к соединениям,ингибирующим соединение, транспортирующее(транспортер) желчные кислоты в подвздошной кишке (IBAT). Данное изобретение также относится к соединениям, секвестрирующим (удаляющим) желчные кислоты. Описание уровня техники Установлено, что гиперлипидемические состояния, связанные с повышенными концентрациями общего холестерина и холестерина липопротеинов низкой плотности (LDL), являются основными факторами риска сердечнососудистой недостаточности и особенно атеросклероза. Так как высокие уровни холестеринаLDL увеличивают риск атеросклероза, способы снижения уровня холестерина LDL в плазме могли бы быть терапевтически полезными для лечения атеросклероза и других заболеваний,связанных с накоплением липидов в кровеносных сосудах. Данные заболевания включают, не ограничиваясь ими, сердечно-сосудистую недостаточность, заболевание периферических сосудов и удар. Атеросклероз лежит в основе большей части заболеваний коронарной артерии (CAD),основной причины заболеваемости и смертности в современном обществе. Было показано,что высокий уровень холестерина LDL (выше приблизительно 180 мг/дл) и низкий уровень холестерина HDL (ниже 35 мг/дл) вносят важный вклад в развитие атеросклероза. Неблагоприятные соотношения HDL/LDL отрицательно влияют на другие заболевания или факторы риска, такие как заболевание периферических сосудов, удар и гиперхолестеринемия. Обнаружено, что нарушение рециркуляции желчных кислот из просвета кишечного тракта является причиной снижения уровня сывороточного холестерина. Были накоплены эпидемиологические данные, показывающие, что такое снижение приводит к улучшению состояния атеросклероза. Stedronsky в "Interaction of bile 2 обсуждает биохимию, физиологию и известные активные агенты, имеющие отношение к желчным кислотам и холестерину. Показано, что временные патофизиологические взаимодействия согласуются с нарушениями энтерогепатической (внутрипеченочной) циркуляции желчных кислот у людей с врожденной недостаточностью IBAT активности, как опубликовано Heubi, J.E., et al. См. "Primary BileBile Acid Transport", Gastroenterology, 83, 804811 (1982). В другом подходе к уменьшению рециркуляции желчных кислот система транспорта желчных кислот в подвздошной кишке является предполагаемой фармацевтической мишенью для лечения гиперхолестеринемии, основанной на нарушении энтерогепатической циркуляции с помощью специфических ингибиторов транспорта (Kramer, et al., "Intestinal Bile Acid Absorbtion", The Journal of Biological Chemistry,268(24) 18035-18046 (1993). В нескольких патентных заявках HoechstAktiengesellschaft раскрывает полимеры, включающие различные встречающиеся в природе составные части энтерогепатической циркуляционной системы и их производные, включая желчную кислоту, которые ингибируют физиологический транспорт желчных кислот с целью снижения уровня холестерина LDL, достаточного, чтобы являться эффективными лекарственными препаратами, в частности, для применения в качестве гипохолестеринемических агентов. Патентные заявки Hoechst, которые раскрывают такие соединения, ингибирующие транспорт желчных кислот, перечислены ниже.R1. Патентная заявка Канады 2025294.R2. Патентная заявка Канады 2078588.R3. Патентная заявка Канады 2085782.R4. Патентная заявка Канады 2085830.R8. Заявка ЕР 0563731. Избранные бензотиепины раскрыты в заявке номер WO 93/321146 для многочисленных применений, включая метаболизм жирных кислот и сердечно-сосудистые заболевания. Известно, что отдельные бензотиепины могут применяться в качестве гиполипемических и гипохолестеринемических агентов, особенно для лечения или профилактики атеросклероза, как раскрыто в заявке ЕР 508425. Патентная заявка Франции, FR 2661676, дополнительно раскрывает бензотиепины для применения в качестве гиполипемических и гипохолестеринемических агентов. Кроме того, патентная заявка WO 92/18462 перечисляет другие бензотиепины для применения в качестве гиполипемических и гипохолестеринемических агентов. Патент США 5994391 (Lee et al.). Каждый из бензотиепиновых гиполипемических 3 и гипохолестеринемических агентов, описанных в данных патентных заявках, ограничен амидом,связанным с атомом углерода, соседним по отношению к фенильному циклу сопряженного бициклобензотиепинового цикла. Дополнительно бензотиепины, которые могут применяться для лечения гиперхолестеринемии и гиперлипидемии, раскрыты в патентной заявке PCT/US 95/10863. Другие бензотиепины, которые могут применяться для профилактики и лечения гиперхолестеринемии и гиперлипидемии, а также фармацевтические композиции таких бензотиепинов, описаны вPCT/US 97/04076. Также бензотиепины и их композиции, которые могут применяться для профилактики и лечения гиперхолестеринемии и гиперлипидемии, описаны в заявке США 08/816065. В описании Wellcome Foundation Limited патентной заявки WO 93/16055 "Hypolipidemicvitro ингибирование транспорта желчных кислот коррелирует с гиполипидемической активностью. Данная публикация описывает ряд гиполипидемических бензотиазепиновых соединений. Дополнительно гиполипидемические бензотиазепиновые соединения (особенно 2,3,4,5 тетрагидробензо-1-ти-4-азепиновые соединения) раскрыты в патентной заявке WO 96/05188. Особенно применяемым бензотиазепином, раскрытым в WO 96/05188, является соединение формулы В-2. Дополнительно гиполипидемические бензотиазепиновые соединения описаны в патентной заявкеWO 96/16051.(3R,5R)-3-Бутил-3-этил-2,3,4,5-тетрагидро 7,8-диметокси-5-фенил-1-4-бензотиазепина 1,1 диоксид. Другие бензотиазепиновые соединения,которые могут применяться для контролирования уровня холестерина, описаны в патентной заявке РСТWO 99/35135. В данное описание включено соединение В-7.IBAT включают класс нафталиновых соединений, описанных T .Ichihashi et al. в J. Pharmacol.Exp.Ther., 284(1), 43-50 (1998). В данном 4 классе особенно полезным является соединениеS-8921 (метил 1-(3,4-диметоксифенил)-3-(3 этилвалерил)-4-гидрокси-6,7,8-триметокси-2 нафтоат). Структура S-8921 показана в формуле В-20. Дополнительно нафталиновые соединения или производные лигнина, которые могут применяться для лечения или профилактики гиперлипидемии или атеросклероза, описаны в патентной заявке РСТ WO 94/24087. Класс веществ, снижающих уровень холестерина LDL посредством другого механизма,включает секвестрирующие агенты, удаляющие желчные кислоты ("секвестранты (удалители) желчных кислот" или "соединения, секвестрирующие (удаляющие) желчные кислоты"). Такими агентами обычно являются анионнообменные полимеры, вводимые пациенту перорально. По мере прохождения агента через кишечник анионы желчных кислот удаляются с помощью агента и выводятся из организма. Предположительно, такие удаляющие агенты предотвращают реабсорбцию в кишечнике, например в подвздошной кишке, что вызывает в организме увеличение превращения холестерина в желчные кислоты и таким образом снижает уровень холестерина в сыворотке. Одним из таких агентов, удаляющих желчные кислоты,является холестирамин, стиролдивинилбензольный сополимер, содержащий катионные группы четвертичного аммония, способные связывать желчные кислоты. Полагают, что холестирамин связывает желчные кислоты в кишечном тракте,препятствуя, таким образом, их нормальной энтерогепатической циркуляции. Данный эффект описан Reihner et al., в "Regulation of hepatic cholesterol metabolism in humans: stimulatory effects of cholestyramine on HMG-CoA reductase activity and low density lipoprotein reseptor expression in gallstone patients", Journal ofLipid Research, 31, 2219-2296 (1990). Дальнейшее описание данного эффекта можно обнаружить у Suckling et al. в "Cholesterol lowering and(1991). Данный эффект приводит к увеличению синтеза желчных кислот в печени в результате использования холестерина в печени, а также к положительной регуляции печеночных рецепторов LDL, что увеличивает удаление холестерина и уменьшает уровни холестерина LDL в сыворотке. Другим агентом, удаляющим желчные кислоты, является колестипол, сополимер диэти 5 лентриамина и 1-хлор-2,3-эпоксипропана. Колестипол описан в патенте США 3692895. Часто побочным эффектом колестипола и холестирамина является желудочное расстройство. Другие агенты, секвестрирующие (связывающие, удаляющие) желчные кислоты, описаны в патенте США 5703188, выданном GeltexPharmaceuticals, Inc. Например, одним из таких агентов, удаляющих желчные кислоты, является сополимер хлорида 3-метакриламидопропилтриметиламмония с этиленгликольдиметакрилатом. Кроме того, агенты, секвестрирующие(связывающие, удаляющие) желчные кислоты,описаны в заявке РСТWO 98/57652, выданной Geltex Pharmaceuticals, Inc. Заявка WO 98/57652 описывает полиаллиламиновые полимеры. Примером агента, удаляющего желчные кислоты, является CholestaGel, регистрационный номер CAS 182815-44-7. CholestaGel представляет собой полимер хлорида N,N,Nтриметил-6-(2-пропениламино)-1-гексанаммония с (хлорметил)оксираном, 2-пропен-1 амином и гидрохлоридом N-2-пропенил-1 деканамина. Следующий класс веществ, предлагаемых в качестве агентов, удаляющих желчные кислоты, включает частицы, содержащие амфифильные сополимеры, имеющие домен поперечно-сшитой оболочки и домен внутреннего ядра (патентная заявкаPCT/US 97/11610). Структуры и препараты таких поперечносшитых сополимеров описаны в PCT/US 97/11345. Таким частицам дали тривиальное название "книдли" (K.В. Thurmond et al.,J.Am.Chem.Soc., 118(30), 7239-7240 (1996. В литературе были описаны некоторые варианты комбинированной терапии, предназначенные для лечения сердечно-сосудистых заболеваний. Сочетания ингибиторов IBAT с ингибиторами HMG СоА редуктазы, которые могут применяться для лечения сердечно-сосудистых заболеваний, раскрыты в патентной заявке США 09/037308. Сочетанная терапия с использованием флювастатина и ницеритрола описана J. Sasakiet al. (Id.). Данные исследователи сделали вывод, что сочетание флювастатина и ницеритрола"в дозе, составляющей 750 мг/дневную дозу, повидимому, не увеличивает и не ослабляет полезных эффектов флювастатина".L. Cashin-Hemphill et al. (J. Am. Med. Assoc., 264(23), 3013-3017 (1990 описывают благоприятные эффекты сочетанной терапии с использованием колестипола и ниацина на атеросклероз коронарных сосудов. Описанные эффекты включают отсутствие прогрессирования и регресс нативных бляшек в коронарной артерии. Сочетанная терапия с использованием аципимокса и симвастатина демонстрирует бла 004877 6 гоприятное влияние на уровень HDL у пациентов с высокими уровнями триглицеридов (N.(1997. Сочетанная терапия с использованием ситостанолового эфира маргарина и правастатина описана Н. Gylling et al. (J. Lipid Res., 37, 17761785 (1996. Как описано, в результате данной терапии одновременно ингибируется абсорбция холестерина и значительно снижается уровень холестерина LDL у людей с инсулиннезависимым диабетом.Brown et al. (New Eng. J. Med., 323(19),1289-1339 (1990 описывают сочетанную терапию с использованием ловастатина и колестипола, в результате которой уменьшается прогрессирование атеросклеротических бляшек и увеличивается регрессия бляшек по сравнению с использованием одного ловастатина.Buch et al. (патентная заявка РСТWO 99/11263) описывает сочетанную терапию,включающую амлодипино и статиновое соединение, предназначенную для лечения субъектов,страдающих от грудной жабы, атеросклероза,одновременно от гипертонии и гиперлипидемии, и для лечения симптомов остановки сердца. Buch et al. описывает в патентной заявке РСТWO 99/11259 сочетанную терапию,включающую амлодипин и аторвастатин.Dettmar and Gibson (патентная заявка ВеликобританииGB 2329334 А) заявляют терапевтическую композицию, которая может применяться для уменьшения уровней липопротеинов низкой плотности и холестерина в плазме,данная композиция включает ингибитор HMG СоА редуктазы и агент, образующий комплексы с желчью. Вышеприведенные ссылки демонстрируют, что в настоящее время существует необходимость в поиске безопасных, эффективных агентов, которые могут быть использованы для профилактики и лечения сердечно-сосудистых заболеваний. Краткое описание изобретения В данном документе описываются сочетанные терапии с использованием сердечнососудистых препаратов, которые можно применять для профилактики и лечения сердечнососудистых заболеваний, направленные на удовлетворение существующей в настоящее время потребности в поиске безопасных и эффективных средств. В одном из своих воплощений настоящее изобретение предоставляет сочетанную терапию, включающую применение первого количества ингибитора IBAT и второго количества другого сердечно-сосудистого терапевтического препарата, который может применяться для 7 профилактики или лечения гиперлипидемии,где упомянутое первое и второе количества вместе составляют эффективное антигиперлипидемическое количество данных соединений. Например, одно из многих воплощений настоящего изобретения предоставляет сочетанную,комбинированную терапию, включающую терапевтические дозировки ингибитора IBAT и соединения, удаляющего желчные кислоты. Предпочтительное воплощение настоящего изобретения предоставляет сочетанную терапию,включающую терапевтические дозировки бензотиепинового ингибитора IBAT и соединения,секвестранта, удаляющего желчные кислоты. Следующее воплощение настоящего изобретения включает применение любой из описанных здесь сердечно-сосудистых сочетанных терапий для профилактики или лечения гиперлипидемии. Следовательно, в одном воплощении настоящее изобретение предоставляет способ профилактики или лечения гиперлипидемического состояния, включающий введение пациенту, нуждающемуся в лечении, сочетания в дозированной лекарственной форме, где сочетание включает первое количество соединения,ингибирующего транспорт желчных кислот в подвздошной кишке, и второе количество соединения, удаляющего желчные кислоты, где первое количество и второе количество вместе составляют эффективное антигиперлипидемическое количество данных соединений. В другом воплощении настоящее изобретение предоставляет способ профилактики или лечения атеросклеротического состояния, включающий введение пациенту, нуждающемуся в лечении, комбинации в дозированной лекарственной форме, включающей первое количество соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второе количество соединения, удаляющего желчные кислоты, где первое количество и второе количество вместе составляют эффективное антиатеросклеротическое количество данных соединений. В следующем воплощении настоящее изобретение предоставляет способ профилактики или лечения гиперхолестеринемии, включающий введение пациенту, нуждающемуся в лечении, сочетания, комбинации в дозированной лекарственной форме, где указанная комбинация включает первое количество соединения,ингибирующего транспорт желчных кислот в подвздошной кишке, и второе количество соединения, удаляющего желчные кислоты, где первое количество и второе количество вместе составляют эффективное антигиперхолестеринемическое количество данных соединений. Далее сфера применения настоящего изобретения станет более понятной из подробного описания, приведенного ниже. Однако следует понимать, что приведенные ниже подробное описание и примеры, хотя и раскрывают пред 004877 8 почтительные воплощения данного изобретения, приведены только в качестве иллюстрации,так как различные изменения и модификации,не отступающие от духа и объема данного изобретения, являются очевидными специалисту в данной области из подробного описания. Подробное описание предпочтительных воплощений Нижеследующее подробное описание приводится для того, чтобы помочь специалистам в данной области при практическом осуществлении настоящего изобретения. Тем не менее,данное подробное описание не следует истолковывать как чрезмерно ограничивающее настоящее изобретение, так как рядовые специалисты в данной области могут осуществлять модификации и вариации воплощений, обсуждаемых в данном документе, не отступая от духа и объема раскрытия настоящего изобретения. Содержание каждой из ссылок, цитирующихся в данном документе, включая содержание ссылок, цитирующихся в пределах данных первичных ссылок, включено здесь в качестве ссылки во всей своей полноте. а. Определения. Следующие определения приводятся для того, чтобы помочь читателю в понимании подробного описания настоящего изобретения."Транспортер желчных кислот в подвздошной кишке" или "IBAT" является синонимом апикального натрийкозависимого транспортера желчных кислот или ASBT."Бензотиепиновый ингибитор IBAT" относится к ингибитору транспорта желчных кислот в подвздошной кишке, который включает терапевтическое соединение, включающее структуру 1,1-диоксид 2,3,4,5-тетрагидро-1-бензотиепина."Сочетанная, комбинированная терапия" относится к введению двух или более терапевтических агентов для лечения гиперлипидемического состояния, например, атеросклероза,и гиперхолестеринемии. Такое введение включает совместное введение данных терапевтических агентов, по существу, одновременно, например в одной дозированной форме, имеющей фиксированное соотношение активных ингредиентов, или в нескольких отдельных дозированных формах для каждого ингибирующего агента. Кроме того, такое введение также включает последовательное применение теравтических агентов каждого типа. В любом случае,режим лечения обеспечивает благоприятные эффекты от приема лекарственных препаратов при лечении гиперлипидемического состояния. Фраза "терапевтически эффективный" относится к определенному для сочетанной терапии объединенному количеству ингибиторов. Данное объединенное количество позволяет достичь цели, которая состоит в уменьшении или устранении гиперлипидемического состояния."Терапевтическое соединение" относится к соединению, которое может применяться для профилактики или лечения гиперлипидемического состояния, включая атеросклероз и гиперхолестеринемию.b. Сочетания (комбинации). Сочетания (комбинации) настоящего изобретения имеют ряд применений. Например, в результате регулирования дозировки и медицинского мониторинга индивидуальные дозы терапевтических соединений, использующихся в сочетаниях настоящего изобретения, будут ниже, чем обычные дозы терапевтических соединений при использовании в монотерапии. Уменьшение дозы обеспечивает преимущества,включающие уменьшение побочных эффектов индивидуальных терапевтических соединений по сравнению с монотерапией. Кроме того,уменьшение побочных эффектов сочетанной терапии по сравнению с монотерапией приводит к увеличению согласия пациентов с режимами лечения. К другому применению настоящего изобретения относятся сочетания, имеющие дополнительные эффекты или дополнительные способы действия. Например, ингибиторы IBAT уменьшают реабсорбцию желчных кислот в подвздошной кишке путем ингибирования соединений, транспортирующих желчные кислоты в стенке подвздошной кишки. Напротив, соединения, секвестрирующие (связывающие, удаляющие) желчные кислоты, действуют в кишечном тракте, удаляя желчные кислоты и иногда холестерин. Терапевтическое сочетание ингибитора IBAT и соединения, удаляющего желчные кислоты, при оптимально подобранных дозах, кроме того, уменьшает общую реабсорбцию желчных кислот и холестерина в пищеварительном тракте в большей степени, чем любой компонент сочетания в условиях монотерапии. Соединения, которые могут применяться в настоящем изобретении, охватывают широкий ряд терапевтических соединений. ИнгибиторIBAT, представляющий в настоящем изобретении особый интерес, включает соединение, приведенное в табл. 1, а также его диастереомеры,энантиомеры, рацематы, соли и таутомеры. Таблица 1 Указанное соединение обнаружило ряд неожиданных преимуществ перед другими соединениями IBAT (ИТЖК), ингибирующими транспорт желчных кислот, придающих заявленным сочетаниям весьма полезные свойства, а именно: 10 соединение формулы В-5 обладает кристаллической формой, упрощающей процессы получения, очистки и использования включающих его составов; соединение формулы В-5 негигроскопично, т.е. обладает стабильностью. В частности при хранении в течение 2 недель при температуре 40 С и 80% влажности, вес образца увеличивается только на 2,1%; соединение формулы В-5 не обладает системным действием, в частности демонстрируя нулевую концентрацию как в артериальной, так и в венозной крови при пероральном введении,позволяя т.о. избежать множества побочных эффектов, неизбежно сопровождающих действие средств с системной абсорбцией. Соединения, секвестрирующие (связывающие, удаляющие) желчные кислоты, которые могут применяться в сочетаниях и способах настоящего изобретения, включают широкий ряд структур и функций. Предпочтительные соединения настоящего изобретения, секвестрирующие (связывающие, удаляющие) желчные кислоты, описаны в табл. 2. Терапевтические соединения, приведенные в табл. 2, могут применяться в настоящем изобретении в разных формах, включая кислую форму, солевую форму, рацематы, энантиомеры, цвиттерионы и таутомеры. Каждый из патентных документов, указанных в табл. 2, включен в данный документ в качестве ссылки. Другие соединения, секвестрирующие (связывающие, удаляющие) желчные кислоты, которые могут применяться в данном документе, представляют собой частицы, включающие амфифильные сополимеры, имеющие домен поперечно-сшитой оболочки и домен внутреннего ядра (книдли, патентная заявкаPCT/US 97/11610, включена в данный документ в качестве ссылки). Книдли, представляющие особый интерес в настоящем изобретении,включают полистирол-b-поли(акриловую кислоту) (Ps-b-PAA), поперечно-сшитую с одним или несколькими полиаминами. Особенно предпочтительные книдли включают Ps-b-PAA,поперечно-сшитый с 1-(3-диметиламинопропил)-3-этилкарбодиимидметиодидом и триэтилентетрамином ("книдель А") или 1,7-диаза 4,10-диазоний-4,4,10,10-тетраметилундекан дииодидом ("книдель В"). Другим применимым агентом, удаляющим желчные кислоты, является DMP-504, описанный Gillies et al., Drug Соединения (например, соединения, ингибирующие транспорт желчных кислот в подвздошной кишке, или соединения, секвестрирующие (связывающие, удаляющие) желчные кислоты), которые могут применяться в настоящем изобретении, могут не иметь асимметричных атомов углерода, или альтернативно,данные соединения могут иметь один или несколько асимметричных атомов углерода. Если использующиеся соединения имеют один или несколько асимметричных атомов углерода,следовательно, они включают рацематы и стереоизомеры, такие как диастереомеры и энантиомеры, в чистом виде и в виде смесей. Такие стереоизомеры могут быть получены с помощью традиционных методов, либо путем использования энантиомеров в качестве исходных веществ, либо путем разделения изомеров соединений настоящего изобретения. Изомеры могут включать геометрические изомеры, например цис-изомеры или трансизомеры, относительно двойной связи. Подразумевается, что к соединениям, использующимся в настоящем изобретении, относятся все такие изомеры. Соединения, которые могут применяться в настоящем изобретении, также включают таутомеры. Соединения, которые могут применяться в настоящем изобретении, как описано ниже,включают их соли, сольваты и пролекарства. Дозировки, композиции и способы введения Композиции настоящего изобретения могут быть введены для профилактики или лечения гиперлипидемических заболеваний или состояний любым способом, предпочтительно пероральным, который обеспечивает контакт данных соединений с местом их действия в организме, например в подвздошной кишке, плазме или печени млекопитающего, например человека. Для профилактики или лечения состояний,указанных выше, соединения, применимые в композициях и способах настоящего изобретения, могут использоваться сами по себе. Фармацевтически приемлемые соли являются особенно подходящими для медицинских применений,так как они лучше растворяются в воде, чем 12 исходные соединения. Безусловно, такие соли должны иметь фармацевтически приемлемый анион или катион. Подходящие фармацевтически приемлемые кислотно-аддитивные соли соединений настоящего изобретения, когда возможно, включают производные неорганических кислот, таких как хлористо-водородная, бромисто-водородная, фосфорная, метафосфорная,азотная, сульфоновая и серная килоты, и органических кислот, таких как уксусная, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изотионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, янтарная, толуолсульфоновая, виннокаменная и трифторуксуная кислоты. Для медицинских целей особенно предпочтительными являются хлориды. Соли подходящих фармацевтически приемлемых оснований включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, и соли щелочно-земельных металлов, такие как соли магния и кальция. Анионы, применимые в настоящем изобретении, конечно, также должны быть фармацевтически приемлемыми и могут быть также выбраны из вышеприведенного списка. Соединения, которые могут применяться в настоящем изобретении, могут быть представлены с приемлемым носителем в виде фармацевтической композиции. Носитель, конечно,тоже должен быть приемлемым в смысле совместимости с другими ингредиентами композиции и не должен быть вредным для реципиента. Носитель может быть твердым или жидким,или тем и другим, и предпочтительно входит вместе с соединением в состав дозированной композиции, например, таблетки, которая может содержать от 0,05 до 95 мас.% активного соединения. Могут также присутствовать другие фармакологически активные вещества, включая другие соединения настоящего изобретения. Фармацевтические композиции данного изобретения могут быть получены с помощью любого из хорошо известных методов фармации, состоящего, по существу, в смешивании компонентов. Необязательно сочетание настоящего изобретения может включать композицию, включающую соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, и соединение, удаляющее желчные кислоты. В такой композиции соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, и соединение, удаляющее желчные кислоты,могут присутствовать в дозированной лекарственной форме, например в виде пилюли, капсулы или жидкости, которая содержит оба соединения. Данные соединения могут быть введены с помощью любого традиционного средства, доступного для применения вместе с фармацевтическими препаратами, либо в виде индивиду 13 альных терапевтических соединений, или в виде сочетания (комбинации) терапевтических соединений. Количество соединения, необходимое для достижения желательного биологического эффекта, конечно, зависит от ряда факторов, таких как конкретное выбранное соединение, предназначенное для применения, способ введения и клиническое состояние реципиента. В основном, общая дневная доза ингибитора IBAT может находиться в интервале приблизительно от 0,01 до 1000 мг/день, предпочтительно приблизительно от 0,1 до 50 мг/день,более предпочтительно приблизительно от 1 до 10 мг/день. Общая дневная доза соединения, удаляющего желчные кислоты, в основном может находиться в интервале приблизительно от 250 до 30000 мг/день, предпочтительно приблизительно от 500 до 15000 мг/день и более предпочтительно приблизительно от 500 до 5000 мг/день в одной или нескольких отдельных дозах. Дневные дозы, описанные в предыдущих параграфах для разных терапевтических соединений, могут быть введены пациенту в одной дозе или в виде пропорционально разделенных доз. Разделенные дозы могут быть введены от 2 до 6 раз в день. Дозы могут быть в виде композиции с замедленным высвобождением, эффективным для получения желательных результатов. В случае фармацевтически приемлемых солей определенные выше массы относятся к массе кислотного или основного эквивалента терапевтического соединения, получающегося из соли. Пероральная доставка сочетаний, комбинаций настоящего изобретения может включать композиции, как хорошо известно в данной области, предназначенные для обеспечения пролонгированной или непрерывной доставки лекарственного препарата к желудочнокишечному тракту с помощью любого из механизмов. Они включают, без ограничения, рНчувствительное высвобождение из дозированной формы, основанное на изменении рН в тонком кишечнике, медленную эрозию таблетки или капсулы, удерживание в желудке на основе физических свойств состава, биоадгезию дозированной формы к слизистой выстилке кишечного тракта или ферментативное высвобождение активного препарата из дозированной формы. Для некоторых из терапевтических соединений, которые могут применяться в настоящем изобретении (например, ингибитор IBAT или ингибитор СЕТР), желательным эффектом является продление промежутка времени, в течение которого молекула активного препарата доставляется к месту действия (например, к подвздошной кишке) путем манипуляции с дозированной формой. Таким образом, композиции с энтеропокрытием и с энтеропокрытием с кон 004877 14 тролируемым высвобождением входят в объем настоящего изобретения. Подходящие энтеропокрытия включают фталат ацетатцеллюлозы,фталат поливинилацетата, фталат гидроксипропилметилцелюлозы и анионные полимеры метакриловой кислоты и метилового эфира метакриловой кислоты. Сочетания, комбинации настоящего изобретения могут быть доставлены перорально в твердой, полутвердой или жидкой форме. В случае жидкой или полутвердой формы сочетания настоящего изобретения могут существовать, например, в виде жидкости, сиропа или содержаться в гелевой капсуле (например, в гелевом колпачке). В одном воплощении, если ингибитор IBAT применяется в сочетании настоящего изобретения, то ингибитор IBAT может быть предоставлен в виде жидкости, сиропа или содержаться в гелевой капсуле. В другом воплощении, если соединение, удаляющее желчные кислоты, применяется в сочетании настоящего изобретения, то соединение, удаляющее желчные кислоты, может быть предоставлено в виде жидкости, твердого вещества,диспергированного в жидкости, или содержаться в капсуле. Фармацевтические композиции в соответствии с настоящим изобретением включают композиции, подходящие для перорального,ректального, местного, защечного (например,подъязычного) и парентерального (например,подкожного,внутримышечного,внутрикожного или внутривенного) введения, хотя наиболее подходящий способ в каждом данном случае зависит от природы и тяжести состояния,подлежащего лечению, а также от природы конкретного используемого соединения. В большинстве случаев предпочтительным способом введения является пероральное введение. Фармацевтические композиции, подходящие для перорального введения, могут присутствовать в виде дискретных единиц, таких как капсулы, облатки, пастилки или таблетки, каждая из которых содержит заранее определенное количество по меньшей мере одного терапевтического соединения, применимого в настоящем изобретении; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде эмульсий масло-в-воде или вода-в-масле. Как указано, такие композиции могут быть получены с помощью любого подходящего фармацевтического метода, который включает стадию объединения активного соединения(ий) и носителя (который может состоять из одного или нескольких вспомогательных ингредиентов). В основном, композиции получают путем равномерного и однородного смешивания активного соединения с жидким или мелкоразмельченным твердым носителем,или с обоими и затем, при необходимости, придают продукту форму. Например, таблетка может быть получена путем прессования или фор 15 мования порошка или гранул соединения, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены путем прессования в подходящем устройстве соединения в свободно-текучем виде, таком как порошок или гранулы, необязательно смешанного со связующим агентом, смазочным агентом, инертным разбавителем и/или поверхностно-активным/ диспергирующим агентом(ами). Формованные таблетки могут быть получены путем формования в подходящем устройстве порошкообразного соединения, смоченного инертным жидким разбавителем. Фармацевтические композиции, подходящие для защечного (подъязычного) введения,включают таблетки, содержащие соединение настоящего изобретения во вкусовой основе,обычно сахарозе, и гуммиарабик или трагакант; и пастилки, содержащие соединение в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик. Фармацевтические композиции, подходящие для парентерального введения, обычно включают стерильные водные препараты соединения настоящего изобретения. Данные препараты предпочтительно вводят внутривенно,хотя введение может также осуществляться путем подкожной, внутримышечной или внутрикожной инъекции. Такие препараты традиционно могут быть получены путем смешивания соединения с водой и переведения полученного раствора в стерильную и изотоническую по отношению к крови форму. Композиции для инъекции в соответствии с данным изобретением обычно содержат от 0,1 до 5% мас./мас. соединения, раскрытого в данном документе. Фармацевтические композиции, подходящие для ректального введения, предпочтительно присутствуют в виде дозированных свечей. Они могут быть получены путем смешивания соединения настоящего изобретения с одним или несколькими традиционными твердыми носителями, например кокосовым маслом, и затем придания формы полученной смеси. Фармацевтические композиции, подходящие для местного применения на коже, предпочтительно находятся в виде мази, крема,лосьона, пасты, геля, спрея, аэрозоля или масла. Носители, которые могут применяться, включают петролатум (например, вазелин), ланолин,полиэтиленгликоли, спирты, а также сочетания двух или более из данных веществ. Активное соединение обычно присутствует в концентрации, составляющей от 0,1 до 50 мас.% от массы композиции, например от 0,5 до 2%. Также возможно чрескожное введение. Фармацевтические композиции, подходящие для чрескожного введения могут присутствовать в виде отдельных пластырей, приспособленных для того, чтобы оставаться в тесном контакте с эпидермисом реципиента в течение 16 длительного периода времени. Подходящим является, если такие пластыри содержат соединение настоящего изобретения в необязательно забуференном водном растворе, растворенное и/или диспергированное в липкой основе или диспергированное в полимере. Подходящая концентрация активного соединения составляет приблизительно от 1 до 35%, предпочтительно от 3 до 15%. Особого внимания заслуживает способ, при котором соединение может быть доставлено из пластыря посредством электротранспорта или ионофореза, например, как описано в Pharmaceutical Research, 3(6), 318 (1986). В любом случае, количество активного ингредиента, которое может быть объединено с веществами-носителями с получением дозированной формы, предназначенной для введения,зависит от пациента, подлежащего лечению, и конкретного способа введения. Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки, гелевые колпачки и гранулы, указанные выше, содержащие одно или несколько соединений, применимых в настоящем изобретении, смешанных по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также содержать, как известно в обычной практике, добавочные вещества,отличные от инертных разбавителей, например смазывающие агенты, такие как стеарат магния,или солюбилизирующие агенты, такие как циклодекстрины. В случае капсул, таблеток, порошков, гранул, гелевых колпачков и пилюль дозированные формы могут также включать забуферивающие агенты. Таблетки и пилюли могут быть также получены с энтеропокрытиями. Жидкие дозированные формы для перорального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно применяющиеся в данной области, такие как вода. Такие композиции могут также включать адъюванты, такие как увлажняющие агенты, эмульгирующие и суспендирующие агенты, а также подсластители, ароматизаторы и отдушки. Препараты для инъекций, например стерильные водные или маслянистые суспензии для инъекций, могут быть получены в соответствии с известными в данной области способами, с использованием подходящих диспергирующих агентов или отвердителей, а также суспендирующих агентов. Стерильные препараты для инъекций могут также представлять собой стерильный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. К приемлемым средам и растворителям, которые могут применяться, относится вода, раствор Рингера и изотонический 17 раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно применяются стерильные нелетучие масла. Для этого могут использоваться любые мягкие нелетучие масла, включая синтетические моно- или диглицериды. Кроме того, в получении препаратов для инъекций находят применение жирные кислоты, такие как олеиновая кислота. Фармацевтически приемлемые носители охватывают все вышеупомянутые носители и т.п. В сочетанной терапии введение двух или более терапевтических агентов, применимых в настоящем изобретении, может происходить последовательно, в отдельных композициях или может быть осуществлено путем одновременного введения в одной или в отдельных композициях. Введение может осуществляться пероральным способом или посредством внутривенных, внутримышечных или подкожных инъекций. Композиции могут находиться в виде шариков или в виде водных или неводных изотонических стерильных растворов или суспензий для инъекций. Данные растворы и суспензии могут быть получены из стерильных порошков или гранул, имеющих один или несколько фармацевтически приемлемых носителей или разбавителей, или связующее вещество, такое как желатин или гиброксипропилметилцеллюлоза,вместе с одним или несколькими агентами из смазывающего агента, косерванта, поверхностно-активного или диспергирующего агента. Фармацевтическая композиция, предназначенная для перорального введения, может находиться в виде, например, таблетки, капсулы, суспензии или жидкости. Капсулы, таблетки и др. могут быть получены с помощью традиционных способов, хорошо известных в данной области. Фармацевтическую композицию предпочтительно получают в виде дозированной формы, содержащей конкретное количество активного ингредиента или ингредиентов. Примерами дозированных форм являются таблетки или капсулы. Они могут преимущественно содержать одно или несколько терапевтических соединений в количестве, описанном выше. Например, в случае ингибитора IBAT доза находится в интервале, который может составлять приблизительно от 0,01 до 500 мг/день, или представляет собой любую другую дозу, в зависимости от конкретного ингибитора, как известно в данной области. В случае соединения,удаляющего желчные кислоты, доза находится в интервале, который может составлять приблизительно от 1000 до 30000 мг/день, или представляет собой любую другую дозу, в зависимости от конкретного соединения, удаляющего желчные кислоты, как известно в данной области. Активные ингредиенты могут быть также введены путем инъекции в виде композиции, в 18 которой, например, в качестве подходящего носителя может применяться физиологический раствор, декстроза или вода. Подходящей дневной дозой каждого активного терапевтического соединения является такая доза, которая обеспечивает такой уровень в сыворотке крови, какой обеспечивается в результате перорального введения, как описано выше. Терапевтические соединения могут быть также введены посредством сочетания способов пероральный/пероральный, пероральный/парентеральный или парентеральный/парентеральный. Фармацевтические композиции, предназначенные для применения в способах лечения настоящего изобретения, могут быть введены в пероральной форме или путем внутривенного введения. При сочетанной терапии предпочтительно пероральное введение. Дозировка для перорального введения может находиться в пределах режима, указанного для однократной дневной дозы, или для однократной дозы каждый следующий день, или для нескольких, разделенных доз в течение дня. Терапевтические соединения, которые составляют сочетанную терапию, могут быть введены одновременно,либо в объединенной дозированной форме, либо в отдельных дозированных формах, предназначенных для, по существу, одновременного перорального введения. Терапевтические соединения, которые составляют сочетанную терапию, могут быть также введены последовательно, причем каждое терапевтическое соединение вводят по режиму, указанному для двухстадийного приема. Таким образом, режим может требовать последовательного введения терапевтических соединений с раздельным приемом отдельных активных агентов. Период времени между несколькими стадиями приема может варьировать от нескольких минут до нескольких часов, в зависимости от свойств каждого терапевтического соединения, таких как активность,растворимость, биодоступность, период полужизни в плазме и кинетический профиль терапевтического соединения, а также в зависимости от эффекта от приема пищи, возраста и состояния пациента. Суточные изменения концентрации целевой молекулы также может определять интервал оптимальной дозы. Терапевтические соединения сочетанной, комбинированной терапии, введенные или одновременно, по существу одновременно, или последовательно,могут включать режим, требующий введения одного терапевтического соединения перорально, а другого терапевтического соединения внутривенно. Вводят ли терапевтические соединения сочетанной терапии пероральным или внутривенным способом, отдельно или вместе,каждое такое терапевтическое соединение будет содержаться в подходящей фармацевтической композиции, содержащей фармацевтически приемлемые эксципиенты, разбавители или дру 19 гие компоненты композиций. Примеры подходящих фармацевтически приемлемых композиций, содержащих терапевтические соединения,предназначенные для перорального введения,приведены выше. Режим лечения Режим дозирования для профилактики, облегчения или улучшения болезненного состояния, включающего гиперлипидемию как элемент заболевания, например атеросклероза, или лечения повышенного уровня холестерина в плазме или в крови, или для защиты от них с помощью соединений и/или композиций настоящего изобретения, выбирают в соответствии с рядом факторов. Данные факторы включают тип, возраст, вес, пол, диету и медицинское состояние пациента, тяжесть заболевания,способ введения, фармакологические характеристики, такие как активность, эффективность,фармакокинетика и токсикологические профили конкретного применяемого соединения, в случае использования системы доставки лекарственного препарата, и в случае, если соединение вводят как часть сочетания, комбинации лекарственных препаратов. Таким образом, применяемый в действительности режим дозирования может варьировать в широких пределах и, следовательно, может отклоняться от предпочтительного режима, приведенного выше. Сначала лечение пациента, страдающего от гиперлипидемического состояния, может начинаться с доз, указанных выше. Лечение обычно должно продолжаться, как необходимо,в течение периода от нескольких недель до нескольких месяцев или лет, до тех пор, пока гиперлипидемическое болезненное состояние не будет подавлено или устранено. Для определения эффективности сочетанной терапии состояние пациентов, подвергающихся лечению соединениями или композициями, раскрытыми в данном документе, обычно можно отслеживать,например, измеряя сывороточные уровни общего холестерина и холестерина LDL с помощью любого из методов, хорошо известных в данной области. Непрерывный анализ таких данных позволяет изменять режим лечения в процессе лечения так, чтобы в любой момент времени вводить оптимальные эффективные количествакаждого типа терапевтического соединения и,кроме того, определить продолжительность лечения. Таким образом, режим лечения/порядок дозирования могут быть рационально изменены в течение курса лечения так, чтобы вводить самое низкое количество терапевтических соединений, которые вместе проявляют удовлетворительную эффективность, и так, чтобы введение продолжалось в течение времени, необходимого для удовлетворительного лечения гиперлипидемического состояния. Потенциальным преимуществом сочетанной терапии, раскрытой в данном документе,может быть уменьшенное количество любого 20 индивидуального терапевтического соединения или всех терапевтических соединений, эффективное для лечения гиперлипидемических состояний, таких как атеросклероз и гиперхолестеринемия. Снижение дозы обеспечивает преимущества, включающие уменьшение побочных эффектов индивидуальных терапевтических соединений по сравнению с монотерапией. Одно из нескольких воплощений настоящего изобретения включает сочетанную, комбинированную терапию, включающую применение первого количества ингибитора IBAT и второго количества другого сердечнососудистого терапевтического препарата, применимого для профилактики или лечения гиперлипидемии или атеросклероза, где упомянутые первое и второе количества вместе составляют количество упомянутых соединений, эффективное против гиперлипидемического состояния или эффективное против атеросклеротического состояния. Например, одно из многих воплощений настоящего изобретения представляет сочетанную терапию, включающую терапевтические дозы ингибитора IBAT и соединения, удаляющего желчные кислоты. Предпочтительное воплощение настоящего изобретения представляет сочетанную терапию, включающую терапевтические дозы бензотиепинового ингибитора IBAT и соединения, удаляющего желчные кислоты. Следующее воплощение настоящего изобретения включает сердечно-сосудистую терапию, которая включает терапевтические дозы амфифильного сополимера, имеющего домен поперечно-сшитой оболочки и домен внутреннего ядра, в сочетании с другим агентом, удаляющим желчные кислоты. Другим агентом,удаляющим желчные кислоты, может быть, например, холестирамин или колестипол. Следующие неограничивающие примеры служат для иллюстрации различных аспектов настоящего изобретения.c. Примеры. Табл. 3 иллюстрирует примеры некоторых сочетаний настоящего изобретения, где сочетание, комбинация включает первое количество ингибитора IBAT и второе количество агента,удаляющего желчные кислоты, где упомянутые первое и второе количества вместе составляют количество упомянутых соединений, эффективное против гиперлипидемического состояния,или эффективное против атеросклеротического состояния. Биологические анализы Применение сочетаний настоящего изобретения может быть продемонстрировано с помощью нижеследующих анализов. Данные анализы проводят in vitro и на моделях животных, по существу, используя методы, которые могут продемонстрировать применение настоящего изобретения.[14 С]таурохолата (ТС) в клетках Н 14. Клетки почек детеныша хомяка (ВНК),трансфицированные кДНК человеческого IBAT(клетки Н 14), высевали в количестве 60000 клеток/лунку в 96-луночные планшеты Top-Count для культивирования тканей для проведения анализа в течение 24 ч после высевания, 30000 клеток/лунку для анализа в течение 48 ч и 10000 клеток/лунку для анализа в течение 72 ч. В день анализа монослой клеток осторожно промывали один раз с помощью 100 мкл буфера для анализа (среда Игла, модифицированная по Дульбекко, содержащая 4,5 г/л глюкозы+ 0,2% (мас./об.) не содержащего жирных кислот бычьего сывороточного альбумина (FAF)BSA). К каждой лунке добавляли 50 мкл двукратного концентрата тестируемого соединения в буфере для анализа вместе с 50 мкл 6 мкМ [14 С]-таурохолата в буфере для анализа(конечная концентрация [14 С]-таурохолата 3 мкМ). Культуральные планшеты инкубировали 2 ч при 37 С, после чего каждую лунку осторожно промывали с помощью 100 мкл физиологического раствора с фосфатным буфером по Дульбекко (PBS) с температурой 4 С, содержащего 0,2% (мас./об.) (FAF)BSA. Затем лунки осторожно промывали один раз 100 мкл 4 СPBS, не содержащего (FAF)BSA. К каждой добавляли 200 мкл жидкого сцинтиллятора, планшеты нагревали в закрытом состоянии и встряхивали 30 мин при комнатной температуре, после чего в каждой лунке измеряли количество радиоактивности на счетчике Packard TopCount.In vitro анализ соединений, ингибирующих поглощение [14 С]-аланина. Анализ поглощения аланина может быть проведен по способу, идентичному таурохолат 22 ному анализу за исключением того, что меченый таурохолат заменяют на меченный аланин.by Une et al., включенный в данный документ в качестве ссылки). Самцов крыс Wistar (200-300 г) анестезировали инактином 100 мг/кг. В желчные протоки вводили канюлю РЕ 10 длиной 10" (дюймов). Тонкий кишечник вынимали и выкладывали на марлевую прокладку. Канюлю (1/8" луерный замок, зауженный к концу адаптор для самок) вставляли на расстоянии 12 см от соединения тонкого кишечника и слепой кишки. На расстоянии 4 см от того же соединения был сделан продольный разрез (используя подвздошную кишку длиной 8 см). Для промывания сегмента кишечника использовали 20 мл теплого физиологического раствора с фосфатным буфером по Дульбекко, рН 6,5 (PBS). Дистальное отверстие каннюлировали с использованием силиконовой трубки длиной 20 см (0,02" внутр. диам. х 0,037" внешн. диам.). Проксимальную канюлю присоединяли к перистальтическому насосу и кишечник промывали в течение 20 мин теплым PBS со скоростью 0,25 мл/мин. Температуру сегмента кишки непрерывно отслеживали. В начале эксперимента 2,0 мл контрольного образца ([14 С]-таурохолата 0,05 мКи/мл с 5 мМ немеченным таурохолатом) помещали в сегмент кишки с помощью 3 мл шприца и начинали сбор образца желчи. Контрольный образец вливали со скоростью 0,25 мл/мин в течение 21 мин. Порции образцов желчи собирали каждые 3 мин в течение первых 27 мин процедуры. После 21 мин вливания образца петлю подвздошной кишки промывали 20 мл теплого PBS (используя 30 мл шприц) и затем петлю промывали в течение 21 мин теплым PBS со скоростью 0,25 мл/мин. Вторую перфузию начинали, как описано выше, но, кроме того, вводили тестируемое соединение (21 мин - введение и затем 21 мин промывание) и желчь собирали каждые 3 мин в течение первых 27 мин. При необходимости проводили третью перфузию, как описано выше, обычно с использованием контрольного образца. Измерение концентрации желчных кислот в фекалиях крысы. Общее количество фекалий от индивидуально размещенных крыс собирали в течение 24 или 48 ч, сушили в токе азота, растирали в порошок, перемешивали и взвешивали. Приблизительно 0,1 г отбирали и экстрагировали органическим растворителем (бутанол/вода). После разделения и высушивания остаток растворяли в 23 метаноле и количество присутствующих желчных кислот измеряли с помощью ферментного анализа,используя взаимодействие 3 гидроксистероиддегидрогеназы с желчными кислотами с восстановлением NAD (см.Mashige, F. et al., Clin.Chem., 27, 1352 (1981),включенный в данный документ в качестве ссылки). Анализ введения препарата крысе через желудочный зонд. Самцам крыс Wistar (275-300 г) вводили ингибиторы IBAT, используя перорально желудочные зонды. Лекарственный препарат или среду для лекарства (0,2% TWEEN 80 в воде) вводят один раз в день (9:00-10:00 утра) в течение 4 дней в различных дозах в конечном объеме 2 мл на килограмм массы тела. (TWEEN 80 представляет собой поверхностно-активное вещество 20 молярный моноолеатполиэтиленоксид сорбитана, произведенный ICI SpecialtyChemicals, Wilmington, Delaware, USA). Собирали фекалии в течение последних 48 ч периода лечения и анализировали на содержание желчных кислот, используя ферментативный анализ,как описано ниже. Эффективность соединения определяли путем сравнения увеличения концентрации фекальных желчных кислот (FBA) у крыс, получающих лекарственный препарат, со средним значением концентрации FBA у крыс,получающих носитель. Поглощение [3 Н]-таурохолата в мембранных везикулах ворсистого эпителия (BBMV). Мембраны ворсистого эпителия подвздошной кишки кролика получали из замороженной слизистой оболочки с помощью метода осаждения кальцием, описанного Malathi et al.(Biochimica Biophysica Acta, 554, 259 (1979),включен в данный документ в качестве ссылки). Способ для измерения таурохолата, по существу, являлся таким, как описан Kramer et al. (Biochimica Biophysica Acta, 554, 259 (1979), включен в данный документ в качестве ссылки), за исключением того, что аналитический объем составлял 200 мкл вместо 100 мкл. Коротко говоря, при комнатной температуре 190 мкл раствора, содержащего 2 мкМ [3 Н]-таурохолата(0,75 мкКи), 20 мМ Tris, 100 мМ NaCl, 100 мМ маннитол, рН 7,4, инкубировали 5 с с 10 мкл мембранных везикул ворсистого эпителия (60120 мкг белка). Инкубацию инициировали путем добавления BBMV при энергичном перемешивании и реакцию останавливали путем добавления 5 мл охлажденного во льду буфера(20 мМ Hepes-Tris, 150 мМ KCl), сразу после этого фильтровали через найлоновый фильтр(АСАТ). Микросомы печени хомяка и кишечника крысы получали из ткани по описанной ранее методике (J.Biol.Chem., 255, 9098 (1980), вклю 004877 24 чен в данный документ в качестве ссылки) и использовали в качестве источника фермента АСАТ. Анализ включал 2,0 мл инкубационной среды, содержащей 24 мкМ олеоил-СоА (0,05 мкКи) в 50 мМ фосфате натрия, 2 мМ DTT, буфера рН 7,4, содержащего 0,25% BSA и 200 мкг микросомального белка. Анализ инициировали добавлением олеоил-СоА. Реакция протекала 5 мин при 37 С, ее завершали путем добавления 8,0 мл смеси хлороформ/метанол (2:1). К экстракционной смеси добавляли 125 мкг олеата холестерина в смеси хлороформ/метанол в качестве носителя, и органическую и водную фазы экстракционной смеси разделяли путем центрифугирования после энергичного перемешивания. Хлороформную фазу высушивали и затем наносили на ТСХ пластинки с силикагелем 60 и проявляли смесью гексан/этиловый эфир (9:1). Количество образовавшегося эфира холестерина определяли путем измерения количества радиоактивности, включенной в пятна на пластинке ТСХ, содержащие олеат холестерина, с помощью Packard Instaimager. Измерение концентрации печеночного холестерина (HEPATIC CHOL). Ткань печени взвешивали и гомогенизировали в смеси хлороформ/метанол (2:1). После гомогенизации и центрифугирования супернатант отделяли и сушили в атмосфере азота. Остаток растворяли в изопропаноле и содержание холестерина измеряли с помощью ферментного анализа, используя сочетание холестериноксидазы и пероксидазы, как описаноHGM СоАредуктазы печени (HGM СоА). Микросомы печени получали путем гомогенизации образцов печени в фосфатносахарозном буфере, затем отделяли путем центрифугирования. Вещество осадка ресуспендировали в буфере и аликвоту анализировали на активность HGM СоА-редуктазы путем инкубации в течение 60 мин при 37 С в присутствии 14C-HGM-CoA (Dupont-NEN). Реакцию останавливали путем добавления 6 н. НСl, после чего центрифугировали. Аликвоту супернатанта разделяли с помощью тонкослойной хроматографии, пятно, соответствующее продукту ферментативной реакции, соскабливали с пластинки,экстрагировали и радиоактивность определяли путем сцинтилляционного счета (ссылка: Akerlund, J. and Bjorkhem, I., (1990), J.Lipid Res., 31,2159). Измерение активности холестерин 7 гидроксилазы в печени (7-OHase). Печеночные микросомы получали путем гомогенизации образцов печени в фосфатносахарозном буфере, затем отделяли путем центрифугирования. Вещество осадка ресуспенди 25 ровали в буфере и аликвоту анализировали на активность холестерин 7-гидроксилазы путем инкубации в течение 5 мин при 37 С в присутствии NADPH. После экстракции петролейным эфиром органический растворитель упаривали и остаток растворяли в смеси ацетонитрил/метанол. Продукт ферментативной реакции разделяли путем введения аликвоты экстракта в колонку ВЭЖХ с обращенной фазой C18 и количественно определяли элюирующееся вещество с помощью УФ детектора при 240 нм (ссылка:(SER.CHOL) измеряли с помощью ферментного анализа с использованием набора от Wako FineChemicals (Richmond, VA); холестерин С 11,по каталогу 276-64909. Холестерин HDL (HDLCHOL) анализировали, используя тот же набор,после осаждения VLDL и LDL с помощью HDL холестеринового реагента, Sigma Chemical Co., по каталогу 352-3 (декстран сульфатный метод). Общие сывороточные триглицериды (контрольные) (TGI) анализировали с помощью ферментативной реакции с использованием(VLDL + LDL) рассчитывали как разность между общим холестерином и холестерином HDL. Измерение концентрации желчных кислот в фекалиях хомяка (FBA). Все фекалии от индивидуально размещенных хомяков собирали в течение 24 или 48 ч,сушили в токе азота, растирали в порошок и взвешивали. Приблизительно 0,1 г отбирали и экстрагировали органическим растворителем(бутанол/вода). После разделения и высушивания остаток растворяли в метаноле и количество присутствующих желчных кислот измеряли с помощью ферментного анализа, используя реакцию 3-гидроксистероиддегидрогеназы с желчными кислотами с восстановлением NAD.(1981), включенный в данный документ в качестве ссылки). Модель для оценки лекарственных препаратов, снижающих уровень липидов на собаках. Самцов коротконогих гончих собак, полученных из такого источника, как питомник Маршалла, весом 6-12 кг кормили один раз в день в течение 2 ч и давали воду по потребности. Собак случайным образом определяли в группы дозирования, состоящие из 6-12 собак каждая, такие как среда для лекарства, в.ж.; 1 мг/кг, в.ж.; 2 мг/кг, в.ж.; 4 мг/кг, в.ж.; 2 мг/кг,р.о. (порошок в капсуле). Внутрижелудочное введение дозы терапевтического вещества, растворенного в водном растворе (например, 0,2% раствор Tween 80 [полиоксиэтилена моноолеат,Sigma Chemicals Co., St.Louis, МО]) может быть 26 осуществлено с помощью желудочного зонда. Перед началом получения дозы образцы крови брали из латеральной подкожной вены передней конечности утром перед кормлением для оценки уровней холестерина (общего и HDL) и триглицеридов в сыворотке. В течение нескольких последующих дней животные получали дозу утром, перед кормлением. Животным позволяли есть 2 ч, после чего остатки пищи удаляли. Фекалии собирали в течение двух дней в конце исследования и анализировали на содержание желчных кислот или липидов. В конце периода лечения также отбирали образцы крови для сравнения с уровнями липидов в сыворотке до исследования. Статистически достоверное значение определяли с помощью стандартного Ттеста Стьюдента при р 0,05. Измерение липидов в сыворотке собак. Кровь собирали из латеральной подкожной вены передней конечности собак, не получающих пищу, в пробирки для отделения сыворотки(Vacutainer SST, Becton Dickinson and Co.,Franklin Lakes, NJ) . Кровь центрифугировали 20 мин при 2000 об./мин и сыворотку декантировали. Общий холестерин измеряли в 96 луночном формате с помощью ферментного диагностического набора Wako (холестерин СII)(Wako Chemicals, Richmond, VA), с использованием реакции холестериноксидазы с образованием пероксида водорода, который измеряли колориметрически. Стандартную кривую для концентраций холестерина от 0,5 до 10 мкг получали, используя первые две колонки планшета. Образцы сыворотки (20-40 мкл, в зависимости от ожидаемой концентрации липидов) или известные сывороточные контрольные образцы добавляли в отдельные лунки с повторами. Воду добавляли в таком количестве, чтобы довести объем в каждой лунке до 100 мкл. К каждой лунке добавляли аликвоту окрашивающего реагента объемом 100 мкл и планшеты считывали при 500 нм после 15 мин инкубации при 37 С. Холестерин HDL анализировали с помощью набора Sigma352-3 (Sigma Chemical Co.,St.Louis, МО), с использованием декстрансульфата и ионов Mg для избирательного осаждения LDL и VLDL. Каждый сывороточный образец объемом 150 мкл добавляют в отдельные пробирки для микроцентрифугирования с последующим добавлением 15 мкл холестеринового реагента HDL (Sigma 352-3). Образцы перемешивали и центрифугировали 5 мин при 5000 об./мин. Затем аликвоту супернатанта объемом 50 мкл смешивали с 200 мкл физиологического раствора и анализировали по методу,использующемуся для измерения общего холестерина. Триглицериды измеряли с помощью набора Sigma337 в формате 96-луночного планшета. По данной методике измеряют глицерин после его высвобождения в результате взаимо 27 действия триглицеридов с липопротеинлипазой. Для получения стандартной кривой используют стандартные растворы глицерина (Sigma 339-11) с концентрацией, находящейся в интервале от 1 до 24 мкг. Образцы сыворотки (20-40 мкл, в зависимости от ожидаемой концентрации липидов) или известные сывороточные контрольные образцы добавляли в лунки с повторами. Воду добавляли в таком количестве, чтобы довести объем в каждой лунке до 100 мкл и к каждой лунке также добавляли окрашивающий реагент объемом 100 мкл. После перемешивания и инкубации в течение 15 мин планшеты считывали при 540 нм и значения концентраций триглицеридов рассчитывали по стандартной кривой. В опыте также использовали дубликат планшета с использованием контроля ферментного реагента для корректировки эндогенного глицерина в образцах сыворотки. Измерение желчных кислот в фекалиях собаки. Для определения концентрации фекальных желчных кислот (FBA) собирали образцы фекалий каждого животного. Сбор фекалий проводили в течение последних 48 ч исследования, в течение двух последовательных 24-часовых периодов между 9:00 и 10:00 утра каждый день,перед введением препаратов и кормлением. Отдельные двухдневные сборы фекалий от каждого животного взвешивали, объединяли и гомогенизировали с дистиллированной водой в процессоре (Cuisinart) до получения гомогенной взвеси. Приблизительно 1,4 г гомогената экстрагировали в конечной концентрации 50% третичный бутанол/дистиллированная вода (2:0,6) в течение 45 мин в водяной бане при 37 С и центрифугировали 13 мин при 2000 хg. Концентрацию желчных кислот (ммоль/день) определяли с помощью 96-луночной ферментативной аналитической системы (1,2). Аликвоту фекального экстракта объемом 20 мкл добавляли к двум сериям каждого из тройных повторов лунок в 96-луночном аналитическом планшете. Для контроля качества анализа также анализировали стандартизированный раствор таурохолата натрия и стандартизированный раствор фекального экстракта (предварительно полученный из объединенных образцов и охарактеризованный по концентрации присутствующих в нем желчных кислот). Подобным образом к двум сериям тройных повторов лунок добавляли двадцатимикролитровые аликвоты таурохолата натрия,серийно разбавленные для получения стандартной кривой. К каждой лунке добавляли реакционную смесь, содержащую 1 М гидразингидрата,0,1 М пирофосфата и 0,46 мг/мл NAD. Затем к одной из двух серий тройных повторов добавляли аликвоту фермента 3-гидроксистероиддегидрогеназы (HSD; 0,8 ед./мл) или аналитического буфера (0,1 М пирофосфат натрия) объемом 50 мкл. Все реагенты были получены от 28 инкубации при комнатной температуре измеряли оптическую плотность при 340 нм и рассчитывали среднее значение каждой серии тройных повторов образцов. Различие в оптической плотностиHSD фермент использовали для определения концентрации желчных кислот(мМ) в каждом образце на основе стандартной кривой таурохолата. Для расчета соответствующей концентрации FBA в ммоль/кг/день использовали концентрацию желчных кислот в экстракте, массу гомогената фекалий (граммы) и массу тела животного. Для определения увеличения (значение дельта) концентрации FBA в результате лечения среднюю концентрациюFBA (ммоль/кг/день), полученную для группы,получающей носитель (среду для лекарства),вычитали из концентрации FBA, полученной для группы, получающей лекарственный препарат. Анализ абсорбции холестерина в кишечнике. Показано, что ряд соединений ингибирует абсорбцию холестерина из кишечного тракта. Данные соединения снижают уровень холестерина в сыворотке путем уменьшения абсорбции в кишечнике как экзогенного (пищевого), так и эндогенного (секретируемого из желчного пузыря в кишечный тракт) холестерина. У хомяков применение двойного изотопного метода плазменного соотношения для измерения абсорбции холестерина в кишечнике было усовершенствовано и оценено, как описано Turley et al. (J. Lipid Res., 35, 329-339 (1994),включенный в данный документ в качестве ссылки). Самцы хомяков весом 80-100 г получали пищу и воду по потребности в комнате с 12 часовыми чередующимися периодами света и темноты. Четыре часа в световом периоде каждому хомяку вводили вначале внутривенно дозу 2,5 мкКи [1,2-3 Н]холестерина, суспендированного в Intralipid (20%), и затем перорально дозу[4-14 С] холестерина в масле из среднецепочечных триглицеридов (МСТ). Внутривенно дозу давали путем введения смеси Intralipid объемом 0,4 мл в дистальную бедренную вену. Пероральную дозу давали путем введения масляной смеси МСТ объемом 0,6 мл в желудок через зонд, представляющий собой полиэтиленовую трубку. Через 72 ч хомяков обескровливали и определяли количество 3 Н и 14 С в плазме и в исходном количестве вводимой метки с помощью жидкостной сцинтилляционной спектрометрии. Абсорбцию холестерина рассчитывали на основе следующего уравнения: Процент абсорбированного холестерина =% пероральной дозы на мл 72-часового образца плазмых 100% в.в. дозы на мл 72-часового образца плазмы 29 МТР выделяли из ткани печени или из культуры клеток (например, клеток HepG2) с помощью стандартных методов, как описано(1996), включен в данный документ в качестве ссылки). Последующие анализы активности МТР проводили как описано(Proc.Natl.Acad.Sci., 93, 11991-11995 (1996),включен в данный документ в качестве ссылки). Основой данного анализа является измерение переноса меченых триглицеридов от популяции донорных везикул к популяции акцепторных везикул в присутствии МТР. Ингибиторы МТР оценивали путем добавления их к смеси перед введением МТР. Донорные везикулы получали путем обработки ультразвуком водной смеси яичных фосфолипидов, кардиолипина,3 Н-меченного фосфолипида и 14 С-меченных триглицеридов. Акцепторные везикулы получали путем обработки ультразвуком водной смеси фосфолипидов яйца. Растворы везикул смешивали вместе, в присутствии или в отсутствии добавленных ингибиторов МТР, и добавляли МТР для инициации реакции переноса. Анализ завершают через 60 мин путем добавления 0,5 мл целлюлозы DE-52, затем центрифугируют для осаждения донорных молекул. Количество 3 Н и 14 С в осадке и исходное количество метки в смеси определяют с помощью жидкостной сцинтилляционной спектрометрии. Скорость переноса липидов оценивают на основе кинетической зависимости первого порядка, используя выражение[S] = [S]oe-kt где [S]o и [S] обозначают долю метки 14 С в осадке донорной мембраны в моменты времени 0 и t соответственно, а коэффициент k обозначает долю метки, переносимую в единицу времени. Анализ липидов плазмы у кроликов. Липиды плазмы анализировали с помощью стандартных методов, как описано J.R. Schuh etal., J.Clin.Invest., 91, 1453-1458 (1993), включен в данный документ в качестве ссылки. Группы самцов новозеландских белых кроликов сажали на стандартную диету (100 г/день), дополненную 0,3% холестерина и 2% кукурузного масла(Zeigler Bothers, Inc., Gardners, PA). Воду давали по потребности. Группы контрольных и обработанных животных умерщвляли после 1 и 3 месяцев лечения. Ткани удаляли для характеристики атеросклеротических бляшек. Для определения концентрации липидов в плазме брали образцы крови. Липиды плазмы. Плазму для анализа липидов получали путем забора крови из ушной вены в ЭДТАсодержащие пробирки, (Vacutainer; Becton DickensonCo., Rutherford, NJ), с последующим отделением клеток путем центрифугирования. Общий холестерин определяли с помощью ферментного анализа с использованием реакцииChem., 20, 470-475 (1974), включен в данный документ в качестве ссылки). Холестерин HDL также измеряли с помощью ферментного анализа после избирательного осаждения LDL иVLDL под действием декстрансульфата и магния (G.R. Warnick et al., Clin.Chem., 28, 13791388 (1982), включен в данный документ в качестве ссылки). Уровни триглицеридов в плазме определяли путем измерения количества глицерина, высвобождающегося под действием липопротеинлипазы, посредством анализа с использованием связанного фермента (G. Bucolo et al.,Clin.Chem., 19, 476-482 (1973), включен в данный документ в качестве ссылки). Атеросклероз. Животных умерщвляли путем инъекции пентобарбитала. Торакальные аорты быстро удаляли, фиксировали погружением в 10% нейтральный забуференный формалин и окрашивали маслянистым красным О (0,3%). После одного продольного надреза вдоль стенки, противоположной устью, сосуды закрепляли открытыми для оценки площади, занимаемой бляшками. Процент площади, покрытой бляшками, определяют из значений общей исследуемой площади и окрашенной площади путем порогового анализа с использованием анализатора изображения подлинного окрашивания (Videometric 150;American Innovision, Inc., San Diego, CA) , сопряженного с цветовой камерой (Toshiba 3CCD), установленной на аналитическом микроскопе. Тканевой холестерин измеряли с помощью ферментного анализа, как описано, после экстракции смесью хлороформ/метанол (2:1) в соответствии с методом, описанным Folch etal. (J. Biol.Chem., 226, 497-509 (1957), включен в данный документ в качестве ссылки). Сосудистый ответ in vitro. После инъекции пентобарбитала натрия абдоминальные аорты быстро вырезают и помещают в насыщенный кислородом бикарбонатный буфер Кребса. После удаления периваскулярной ткани вырезают круговые сегменты диаметром 3 мм, помещают при 37 С в мускульную (muscle) баню, содержащую бикарбонатный раствор Кребса, и подвешивают между двумя неокрашенными стальными проволоками,одна из которых присоединена к преобразователю усилия (Grass Instrument Co., Quincy, MA). Изменение усилия в ответ на добавление к водяной бане ангиотензина II записывали на регистрирующем устройстве. Примеры, описанные в данном документе,могут быть проведены путем замены описанных в общем или конкретно терапевтических соединений или инертных ингредиентов на применяемые в предшествующих примерах. Очевидно, что в пределах описанного изобретения разными способами могут осуществляться вариации. Такие вариации не должны считаться отклонением от духа и объема на 31 стоящего изобретения, и подразумевается, что все такие модификации и эквиваленты, являющиеся очевидными специалисту в данной области, включены в объем нижеприведенной формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Терапевтическое сочетание, включающее эффективное количество первого соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второго соединения,секвестрирующего (связывающего) желчные кислоты, где количества первого и второго вместе составляют эффективное в отношении гиперлипидемического состояния количество данных соединений и где соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, представляет собой соединение, формулы В-5 или его энантиомер, рацемат или фармацевтически приемлемую соль. 2. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является холестирамин или его фармацевтически приемлемая соль. 3. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является колестипол или его фармацевтически приемлемая соль. 4. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является амфифильный сополимер,имеющий домен поперечно-сшитой оболочки и домен внутреннего ядра, или его фармацевтически приемлемая соль. 5. Терапевтическое сочетание по п.1, где соединением, секвестрирующим желчные кислоты, является полиаллиламин или его фармацевтически приемлемая соль. 6. Терапевтическое сочетание по п.5, где полиаллиламин представляет собой колесвелама гидрохлорид или его фармацевтически приемлемую соль. 7. Терапевтическое сочетание по п.5, где полиаллиламин представляет собой OmegaGel или его фармацевтически приемлемую соль. 8. Фармацевтическая композиция, включающая эффективное количество первого соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второго соединения, секвестрирующего желчные кислоты, где количества первого и второго вместе составляют эффективное в отношении гиперлипидемического состояния количество данных соедине 004877 32 ний, причем количество первого составляет примерно от около 0,01 до 1000 мг, а второго от около 250 до около 30000 мг, и где соединение,ингибирующее транспорт желчных кислот в подвздошной кишке, представляет собой соединение формулы В-5 или его энантиомер, рацемат или фармацевтически приемлемую соль. 9. Фармацевтическая композиция по п.8,где соединение, секвестрирующее желчные кислоты, представляет собой холестирамин или его фармацевтически приемлемую соль. 10. Фармацевтическая композиция по п.8,где соединение, секвестрирующее желчные кислоты, представляет собой колестипол или его фармацевтически приемлемую соль. 11. Фармацевтическая композиция по п.8,где соединение, секвестрирующее желчные кислоты, представляет собой амфифильный сополимер, имеющий домен поперечно-сшитой оболочки и домен внутреннего ядра, или его фармацевтически приемлемую соль. 12. Фармацевтическая композиция по п.8,где соединение, секвестрирующее желчные кислоты, представляет собой полиаллиламин или его фармацевтически приемлемую соль. 13. Фармацевтическая композиция по п.12,где полиаллиламин представляет собой CholestaGel или его фармацевтически приемлемую соль. 14. Фармацевтическая композиция по п.12,где полиаллиламин представляет собойOmegaGel или его фармацевтически приемлемую соль. 15. Способ профилактики или лечения гиперлипидемического состояния, включающий введение пациенту, нуждающемуся в лечении,эффективного количества сочетания первого соединения, ингибирующего транспорт желчных кислот в подвздошной кишке, и второго соединения, секвестрирующего желчные кислоты, где количества первого и второго вместе составляют эффективное антигиперлипидемическое количество данных соединений и где соединение, ингибирующее транспорт желчных кислот в подвздошной кишке, представляет собой соединение формулы В-5 или его энантиомер, рацемат или фармацевтически приемлемую соль. 16. Способ по п.15, где суточная доза введения первого составляет примерно от около 0,01 до 1000 мг, а второго от около 250 до около 30000 мг. 17. Способ по п.15, где гиперлипидемическим состоянием является атеросклеротическое состояние. 18. Способ по п.15, где гиперлипидемическим состоянием является гиперхолестеринемия. 19. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой холестирамин или его фармацевтически приемлемую соль. 20. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет 34 собой колестипол или фармацевтически приемлемую соль. 21. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой амфифильный сополимер, имеющий домен поперечно-сшитой оболочки и домен внутреннего ядра, или его фармацевтически приемлемую соль. 22. Способ по п.15, где соединение, секвестрирующее желчные кислоты, представляет собой полиаллиламин или его фармацевтически приемлемую соль. 23. Способ по п.22, где полиаллиламин представляет собой CholestaGel или его фармацевтически приемлемую соль. 24. Способ по п. 22, где полиаллиламин представляет собой OmegaGel или его фармацевтически приемлемую соль.
МПК / Метки
МПК: A61P 9/00, A61K 45/06
Метки: транспорта, агентов, желчных, показаний, ингибиторов, кислоты, кишке, секвестрирующих, сочетания, кислот, желчные, подвздошной, сердечно-сосудистых
Код ссылки
<a href="https://eas.patents.su/18-4877-sochetaniya-ingibitorov-transporta-zhelchnyh-kislot-v-podvzdoshnojj-kishke-i-agentov-sekvestriruyushhih-zhelchnye-kisloty-dlya-serdechno-sosudistyh-pokazanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Сочетания ингибиторов транспорта желчных кислот в подвздошной кишке и агентов, секвестрирующих желчные кислоты, для сердечно-сосудистых показаний</a>
Предыдущий патент: Устойчивые к порче композиции опиоидных агонистов для перорального введения
Следующий патент: Фармацевтическая композиция для лечения сахарного диабета
Случайный патент: Способ проходки вертикального шахтного ствола












