Соединения, проявляющие активность в отношении св1
Формула / Реферат
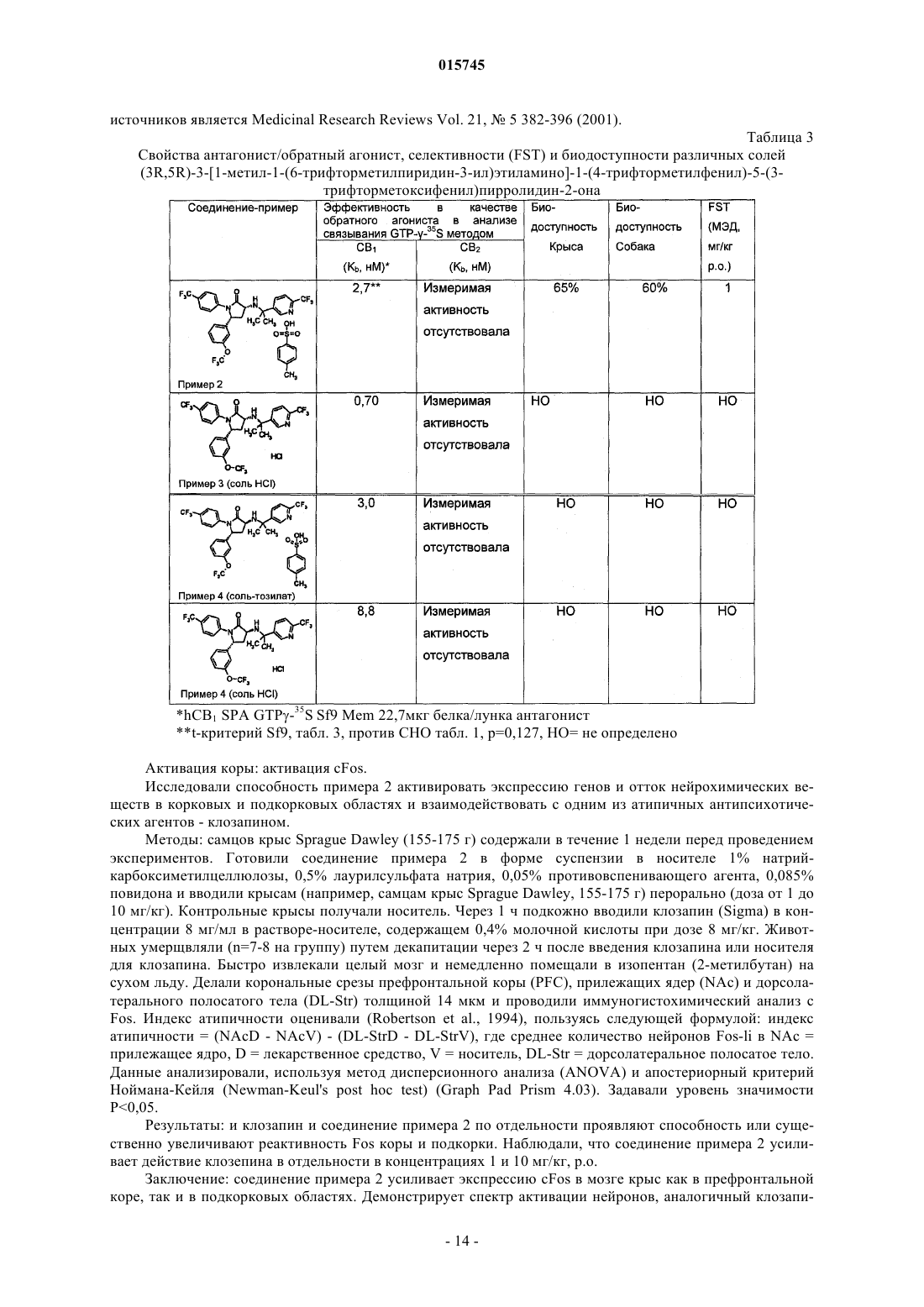
1. Соединение формулы
или фармацевтически приемлемая соль такого соединения.
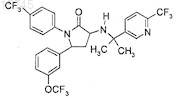
2. Соединение по п.1, имеющее формулу
или фармацевтически приемлемая соль такого соединения.
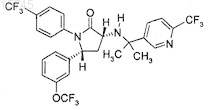
3. Промежуточное соединение формулы
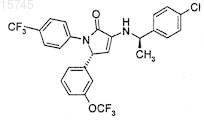
4. Применение соединения по п.1 или 2 в качестве терапевтического средства.
5. Применение соединения по п.1 или 2 для лечения расстройства, выбранного из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим агентом.
6. Применение соединения по п.1 или 2 в комбинации с антипсихотическим средством одновременного, раздельного или последовательного введения для лечения расстройства, выбранного из увеличения веса, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством.
7. Применение соединения по п.1 или 2 для изготовления лекарственного средства для лечения расстройства, выбранного из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством.
8. Применение соединения по любому из пп.1 или 2 для изготовления лекарственного средства для применения в комбинированной терапии для лечения расстройства, выбранного из увеличения веса, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством, причем указанное лекарственное средство применяют в сочетании с антипсихотическим средством путем одновременного, раздельного или последовательного введения.
Текст
Дата публикации и выдачи патента Номер заявки которые благодаря способности блокировать рецепторы CB1 по механизму обратного агонизма пригодны для снижения массы тела у млекопитающих, лечения когнитивных нарушений, связанных с шизофренией, снижения возникшего в результате лечения увеличения веса, наблюдаемого при лечении антипсихотическими препаратами, и имеют повышенную биодоступность.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 015745 Уровень техники По настоящей заявке испрашивается приоритет согласно предварительной заявке на патент США 60/862540, поданной 23 октября 2006 г. Семейство рецепторов CB1 было обнаружено преимущественно в центральной и периферической нервной системе и, в меньшей степени, в ряде периферических органов. Рецептор СВ 2 обнаружен преимущественно в иммунной системе. Был исследован фармакологический и терапевтический потенциал лигандов каннабиноидных рецепторов (Exp. Opin. Ther. Patents 1998, 8, 301-313; Ann. Rep. Med. Chem.,A. Doherty, Ed.; Academic Press, NY 1999, Vol. 34, 199-208; Exp. Opin. Ther. 2000, 10, 1529-1538; Trends inPharma. Sci. 2000, 21, 218-224). Агонисты рецептора CB1 связывают со стимуляцией аппетита, анемическими свойствами, аналгезией, снижением внутриглазного давления при глаукоме и облегчением мышечных спазмов при множественном склерозе. Антагонисты рецептора CB1, напротив, проявили свою эффективность в снижении аппетита и массы тела в моделях ожирения на животных. Тем не менее,большинство соединений, которые модулируют активность рецептора CB1, имеют фармакологическое свойство обратного агонизма, которое снижает базальный уровень передачи сигнала через рецептор CB1,а также активность блокирования стимуляции рецептора, зависящей от агониста CB1. Ряд селективных соединений центрального действия на рецептор CB1 в настоящее время находится в разработке для лечения ожирения. Тем не менее, все еще остается потребность в соединениях, действующих на рецептор CB1, которые обладали бы повышенной эффективностью in vivo, которые были бы низкомолекулярными и обладали бы свойствами фармакокинетики и фармакодинамики, обеспечивающими терапевтическую пользу при минимизации нежелательных явлений. См., например, WO 2007/020502. В дополнение к расстройству побуждений было показано, что обратные агонисты CB1 дополнительно усиливают активность антипсихотических средств в тестах. Хотя современные антипсихотические средства лечения более или менее эффективны в контролировании позитивных симптомов, такие терапевтические средства не так эффективны в лечении негативных и когнитивных симптомов, что приводит к тому, что многие пациенты не способны вести нормальный образ жизни. Обобщенные данные позволяют предположить, что лекарственные средства, которые усиливают активность нейронов в определенных областях мозга, в частности в областях гиппокампа, полосатого тела и коры, будут эффективными в лечении как негативных, так и когнитивных симптомов. Кроме того, был продемонстрирован эффект потери веса, обусловленный соединениями, действующими на рецептор CB1, в моделях увеличения веса, индуцированного антипсихотическим лечением, на животных, и, следовательно, эти соединения могут также оказаться эффективными в контролировании появившегося вследствие лечения увеличения веса и метаболического синдрома, которые наблюдаются при современных антипсихотических методах лечения. Более того, было показано, что соединения, действующие на рецептор CB1, снижают потребление алкоголя в моделях алкоголизма на животных и поэтому могут быть пригодны для лечения злоупотребления веществами. В то время как пероральное введение является предпочтительным путем доставки лекарственных средств, многие соединения, действующие на рецептор CB1, имеют недостаток, заключающийся в слабой биодоступности при пероральном введении, как следствие их ограниченной растворимости в водной среде и метаболической неустойчивости. Вследствие высокой липофильности эндогенных лигандов каннабиноидных рецепторов и комплементарного сайта, с которым они связываются на рецепторе CB1, известные соединения, действующие на рецептор CB1, также высоколипофильны. Эта высокая липофильность приводит к слабой растворимости в водной среде, которая ограничивает всасывание и биодоступность при пероральном введении. См., например, WO 2007/020502. Кроме того, соединения, которые быстро метаболизируются печенью, могут подвергаться метаболическим превращениям после всасывания из тонкого кишечника и перед достижением общего кровообращения. Во время этого процесса возможно образование химически активного промежуточного продукта(ов) метаболизма, который впоследствии может реагировать с другими нуклеофилами в организме (такими как белки, ДНК, РНК и т.д.). Это может привести к проблемам, связанным с токсичностью. Этот так называемый "эффект первого прохождения" также ограничивает биодоступность лекарственного средства. См., например, WO 2007/020502. В заключение необходимо отметить, что существует потребность в соединениях, действующих на рецептор CB1, которые обладают хорошей биодоступностью, повышенной эффективностью in vivo, являются высокоселективными по сравнению с СВ 2, являются более легко растворимыми, чем применявшиеся ранее молекулы, и не образуют химически активных метаболитов, которые могли бы впоследствии вызывать проблемы, связанные с токсичностью. Настоящее изобретение удовлетворяет эту потребность, а также обеспечивает соответствующие преимущества. Краткое описание изобретения Настоящее изобретение обеспечивает соединение формулы (I) или фармацевтически приемлемую соль указанного соединения. Настоящее изобретение, кроме того, обеспечивает соединение формулы (Ia) или фармацевтически приемлемую соль указанного соединения. Настоящее изобретение обеспечивает промежуточное соединение формулы (II) Настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение согласно любой из формул (I) или (Ia) и фармацевтически приемлемый носитель, разбавитель или наполнитель. В другом варианте реализации настоящее изобретение обеспечивает фармацевтическую композицию, в которой соединение формулы (Ia) присутствует с оптической чистотой более 90% э.и. В другом варианте реализации настоящего изобретения предложена фармацевтическая композиция,в которой соединение формулы (Ia) присутствует с оптической чистотой более 95% э.и. Один из вариантов реализации настоящего изобретения обеспечивает соединение согласно любой из (I) или (Ia) для применения в терапии. Настоящее изобретение обеспечивает соединение согласно любой из формул (I) или (Ia) для применения в лечении расстройств, выбранных из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса,наблюдаемого во время лечения атипичным антипсихотическим средством. Настоящее изобретение обеспечивает соединение согласно любой из формул (I) или (Ia) в изготовлении лекарственного препарата для лечения расстройства, выбранного из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений,связанных с шизофренией, злоупотребления веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством. Настоящее изобретение обеспечивает способ лечения состояния, которое можно вылечить путем блокирования рецепторов CB1 по механизму обратного агонизма у млекопитающего, который включает введение пациенту эффективного количества соединения согласно любой из формул (I) или (Ia), или фармацевтически приемлемой соли такого соединения. Один из вариантов реализации настоящего изобретения обеспечивает способ лечения состояния у млекопитающего, который включает введение млекопитающему эффективного количества соединения согласно любой из формул (I) или (Ia) в комбинации с антипсихотическим средством одновременно, раздельно или последовательно. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой расстройство пищевого поведения, связанное с чрезмерным потреблением пищи. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой ожирение. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой шизофрению. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние-2 015745 представляет собой когнитивное нарушение, связанное с шизофренией. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой злоупотребление веществами или алкогольную зависимость. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет синдром отмены курения. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой возникшее в результате лечения увеличение веса, наблюдаемое во время прекращения курения. Один из вариантов реализации настоящего изобретения обеспечивает соединение согласно любой из формул (I) или (Ia) для применения в комбинации с антипсихотическим агентом одновременно, раздельно или последовательно, при лечении нарушения, выбранного из увеличения веса, ожирения, шизофрении, когнитивного нарушения, связанного с шизофренией, злоупотребления веществами или алкогольной зависимости, прекращения курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством. В еще одном варианте реализации настоящее изобретение обеспечивает применение соединения согласно любой из формул (I) или (Ia) для изготовления лекарственного средства для применения в комбинированной терапии нарушения, выбранного из увеличения веса, ожирения, шизофрении, когнитивного нарушения, связанного с шизофренией, злоупотребления веществами или алкогольной зависимости,прекращения курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством, при этом указанный лекарственный препарат вводят в сочетании с антипсихотическим средством путем одновременного, раздельного или последовательного введения. Настоящее изобретение обеспечивает способ лечения состояния у млекопитающего, улучшению которого способствует блокирование рецепторов CB1 по механизму обратного агонизма, при этом указанный способ включает введение пациенту эффективного количества соединения согласно любой из формул (I) или (Ia) или фармацевтически приемлемой соли такого соединения в комбинации с антипсихотическим агентом одновременно, раздельно или последовательно. Настоящее изобретение обеспечивает способ лечения состояния у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения согласно любой из формул(I) или (Ia) или фармацевтически приемлемой соли такого соединения. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой шизофрению. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой увеличение веса. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой ожирение. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой когнитивное нарушение, связанное с шизофренией. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой злоупотребление веществами или алкогольную зависимость. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой прекращение курения. Один из вариантов реализации настоящего изобретения обеспечивает способ, в котором состояние представляет собой увеличение веса, наблюдаемое во время лечения атипичным антипсихотическим агентом. Соединения формулы (I) содержат центры асимметрии и могут поэтому находиться в форме смесей диастереоизомеров, рацемических смесей, отдельных энантиомеров и отдельных диастереомеров, таких как соединения формулы (Ia). Все подобные изомерные формы указанных соединений формулы (I) следует рассматривать как аспекты настоящего изобретения. Хотя соединения формулы (I) в рацемической форме являются полезными средствами, обычно предпочтительным является введение соединений формулы (I), которые обогащены одной из энантиомерных форм. Предпочтительный аспект настоящего изобретения обеспечивает соединения формулы(Ia), которые представляют собой, по существу, чистые энантиомеры. Соответственно, каждый из следующих конкретных классов соединений формул (I) и (Ia) следует считать аспектами настоящего изобретения:(a) соединения с энантиомерной чистотой выше 80% энантиомерного избытка;(b) соединения с энантиомерной чистотой выше 90% энантиомерного избытка;(c) соединения с энантиомерной чистотой выше 95% энантиомерного избытка и(d) соединения с энантиомерной чистотой выше 99% энантиомерного избытка. Эти энантиомерно чистые соединения можно получить путем очистки требуемого энантиомера соединения формулы (I) из смеси энантиомеров данного соединения. Требуемый энантиомер соединения(I) также можно получить путем синтеза согласно следующим общим схемам, путем использования предшественников, которые являются, по существу, энантиомерно чистыми. Для специалистов в данной-3 015745 области очевидно, что любое разделение конечных соединений или промежуточных соединений обеспечит соединения формулы (I), по существу, в энантиомерно чистой форме, в результате чего можно получить, например, соединения формулы (Ia), и они будут использовать наиболее удобный способ. Также должно быть очевидно, что, по существу, чистый диастереомер можно выделить из смеси диастереомеров, применяя способы, известные в данной области. Способы очистки диастереомеров включают применение хроматографии и кристаллизации. Смесь энантиомеров можно разделить на отдельные, по существу, чистые энантиомеры с помощью метода, известного как разделение (resolution). Энантиомеры можно разделить путем применения хроматографии, используя хиральную неподвижную фазу. Подходящие хиральные твердые фазы включают неподвижные фазы на основе полисахаридов, такие как Chiralpak AD и Chiracel OJ (продаваемые Chiral Technologies, Inc.). Дополнительно энантиомеры основных соединений можно разделить путем превращения в смесь диастереомерных солей путем обработки хиральной кислотой. Необходимую диастереомерную соль выделяют, например, путем кристаллизации. По существу, энантиомерно чистое основное соединение можно выделить путем обработки основанием. Примеры хиральных кислот включают (-)-винную кислоту, (+)-винную кислоту, (-)-миндальную кислоту, (+)-миндальную кислоту, (-)-дитолуоилвинную кислоту и (+)-дитолуоилвинную кислоту. Энантиомеры кислых соединений можно разделить аналогичным образом, используя, по существу, энантиомерно чистое основание. Примеры таких оснований включают R-метилбензиламин, Sметилбензиламин и бруцин. Другой способ разделения рацемической смеси включает реакцию, по существу, с энантиомерно чистым хиральным реагентом (называемым в данной заявке хиральным вспомогательным соединением) с образованием ковалентной связи. Эта реакция дает смесь диастереомеров, которую очищают методами, известными в данной области. Затем все хиральное вспомогательное соединение или его часть можно отщепить от молекулы, в результате чего будет получено соединение, которое является, по существу, энантиомерно чистым. В некоторых случаях центр асимметрии, введенный хиральным вспомогательным соединением, можно сохранить в конечном продукте. Для среднего специалиста в данной области очевидно, что некоторые описанные промежуточные соединения формулы (II) могут существовать в формах с различными положениями присоединения водорода, и поэтому они рассматриваются как таутомерные. Отдельные таутомеры, а также смеси таутомеров рассматриваются как аспект настоящего изобретения. Каждая из форм таутомера может существовать, превращаться в другие формы и претерпевать таутомеризацию в указанных условиях. Очевидно, что в данном описании, если не указано другое, указание на соединения формул (I) или(Ia) включают фармацевтически приемлемые соли таких соединений. Очевидно, что соединения согласно настоящему изобретению, описанные ниже, могут существовать в различных кристаллических формах, полученных путем кристаллизации в контролируемых условиях. Соединения формул (I) и (Ia) селективны в отношении рецептора CB1 по сравнению с рецепторомCB2. Кроме того, существуют данные, указывающие на то, что эти лиганды рецептора CB1 действуют как антагонисты функции рецептора CB1, а также обладают свойствами обратных агонистов. Так, можно утверждать, что соединения формул (I) и (Ia) являются модуляторами рецептора CB1 и, соответственно,полезны для предотвращения и лечения состояний, связанных с рецептором CB1. Такие состояния включают, например, нарушения памяти, когнитивные расстройства, негативные симптомы шизофрении, расстройства, связанные со злоупотреблением веществами (в частности, опиатами, алкоголем и никотином),ожирение, метаболические расстройства и расстройства пищевого поведения, связанные с чрезмерным потреблением пищи. См. DSM-IV-TR., Diagnostic and Statistical Manual of Mental Disorders. Revised, 4 е изд., Редакция (2000). См. также DSM-IV, Diagnostic and Statistical Manual of Mental Disorders 4th Ed.,(1994). DSM-IV и DSM-IV-TR были подготовлены Целевой рабочей группой по номенклатуре и статистике Американской психиатрической ассоциации и содержат описание диагностических категорий. Для специалиста в данной области очевидно, что существуют альтернативные номенклатуры, нозологии и системы классификации патологических физиологических состояний и что эти системы эволюционируют вместе с прогрессом медицинской науки. Соединения формул (I) или (Ia) также можно применять для облегчения увеличения веса, вне зависимости от того, можно ли классифицировать набравшего вес субъекта как страдающего ожирением в клиническом смысле. В качестве практической реализации описанных способов терапии можно вводить эффективное количество соединения формул (I) или (Ia) пациенту, нуждающемуся в таком лечении или профилактике. Необходимость профилактического введения согласно способам настоящего изобретения определяют по хорошо известным факторам риска. Эффективное количество отдельного соединения определяет, в конечном итоге, лечащий врач, отвечающий за конкретный случай, но оно зависит от таких факторов, как конкретное заболевание, от которого нужно вылечить, тяжесть заболевания, и другие заболевания или патологические состояния, от которых страдает пациент, выбранного пути введения, других лекарственных средств и терапии, которая может одновременно требоваться пациенту, а также других факторов по усмотрению лечащего врача. Величина профилактической или терапевтической дозы соединения формулы (I) или (Ia) будет, конечно же, варьироваться в зависимости от природы и тяжести указанного па-4 015745 тологического состояния, от которого нужно вылечить, а также от конкретного соединения формулы (I) или (Ia) и пути его введения. Дозу можно вводить в виде одной ежедневной дозы, либо общую дневную дозировку можно вводить, разделив на дозы для двух, трех или четырех приемов в день. Более того, на основании свойств отдельного соединения, выбранного для введения, и/или характеристики лекарственной формы (т.е. измененное высвобождение) дозу можно вводить реже, например, еженедельно, дважды в неделю, ежемесячно и т.д. Разовая доза для менее частого введения может быть, соответственно, больше. При введении трансдермальным путем или посредством непрерывного внутривенного введения раствора введение дозировки, конечно же, будет скорее непрерывным, чем с перерывами, на протяжении всего режима дозирования. Подробное описание Выше в тексте и на протяжении всего описания настоящего изобретения следующие термины, если не указано иначе, имеют приведенные ниже значения."Агонист" и "агонисты" обозначают такие соединения, которые стимулируют функциональный ответ рецептора."Нейтральный антагонист" или "нейтральные антагонисты" обозначает такие соединения, которые не изменяют базальный уровень активности рецептора, но блокируют функциональную активность агонистов и обратных агонистов путем возвращения функционального ответа к таковому в базальном (фоновом) состоянии."Обратный агонист" или "обратные агонисты" обозначают такие соединения, которые демонстрируют присущую им отрицательную активность путем обращения конститутивной активности рецептора. Обратные агонисты действуют как антагонисты, т.е. ингибируют или обращают активность агонистов."Антагонист" или "антагонисты" обозначают соединения, которые являются нейтральными антагонистами."Ожирение" - это состояние, заключающееся в большом количестве жира в организме. Человека считают страдающим ожирением, если он или она имеет индекс массы тела (BMI), равный 30 кг/м 2 или выше. Человека с BMI=27-30 обычно считают имеющим лишний вес. Традиционно, люди с нормальным весом имеют BMI от 19,9 до 25,9. Ожирение может возникать по любой причине, либо генетической,либо обусловленной условиями внешней среды. Примеры расстройств, которые могут приводить к ожирению или быть причиной ожирения, включают переедание, пониженную физическую активность и патологические состояния, при которых снижена активность метаболизма."Фармацевтически приемлемые соли" и "соли" относятся к относительно нетоксичным, неорганическим и органическим солям присоединения кислоты, и солям присоединения основания, соединений согласно настоящему изобретению. См., например, S.M. Berge, et al., "Pharmaceutical Salts", J. Pharm. Sci.,66, 1-19 (1977). Предполагается, что "фармацевтическая композиция" и "композиция" охватывают продукт, содержащий активный ингредиент, предпочтительно присутствующий в фармацевтически эффективных количествах, и инертный ингредиент(ы) (фармацевтически приемлемые вспомогательные вещества), который образует носитель, а также любой продукт, который получен прямо или опосредованно в результате комбинирования, комплексообразования или агрегации любых двух или более указанных ингредиентов,или в результате диссоциации одного или более указанных ингредиентов, или в результате других типов реакций или взаимодействий одного или более указанных ингредиентов. Соответственно, фармацевтические композиции согласно настоящему изобретению охватывают любые композиции, полученные путем смешивания соединения формулы (I) или (Ia) и любых фармацевтически приемлемых носителей."Предотвращение" (ожирения) относится к предотвращению возникновения ожирения, если указанное лечение осуществляют перед началом развития состояния тучности. Кроме того, если лечение применяют к уже тучным субъектам, ожидают, что такое лечение предотвратит или предотвратит развитие медицинских осложнений ожирения (например, артериосклероза, диабета II типа, синдрома поликистозных яичников, сердечно-сосудистых заболеваний, остеоартрита, дерматологических расстройств, гипертонии, устойчивости к инсулину, гиперхолестеринемии, гипертриглицеридемии и желчекаменной болезни). В данном изобретении "лечение", если не указано другое, означает обращение, снижение выраженности, подавление развития или предотвращение расстройства или патологического состояния, к которому применим такой термин, или одного или более симптомов такого расстройства или патологического состояния. Термин "терапия" в данном изобретении, если не указано другое, относится к акту лечения,при этом "лечение" непосредственно определено выше. В данном изобретении, если не указано другое, "р.о." означает перорально. В данном изобретении, если не указано другое, "s.c." обозначает подкожно. В данном изобретении, если не указано другое, "Ret." обозначает удерживание. В данном изобретении, если не указано другое, "ДМСО" обозначает диметилсульфоксид. Для терапевтического применения, обсуждаемого в данном изобретении, соль заявленных соединений должна быть фармацевтически приемлемой. Дополнительные подробности относительно фармацев-5 015745 тически приемлемых солей можно найти в Journal of Pharmaceutical Science, 66, 1 (1977). Продукты и примеры Условия методов ВЭЖХ для всех продуктов и примеров. Метод А. Колонка ЖХ: Zorbax Eclipse XDB C8 4,6150 мм, 5 мкм. Градиент: 20-90% ацетонитрил в/0,01% трифторуксусная кислота 13,0 мин. Температура колонки: 40 С; температура автосэмплера: окружающей среды; расход: 2,0 мл/мин; сигнал детектировали на длине волны 260 и 215 нм. Метод В. Колонка ЖХ: Zorbax SB-фенил 4,6150 мм, 5 мкм. Изократический: 36% А и 64% В, где А=0,05 М NH4OAc в воде (рН 5,0), B=ACN в течение 10 мин. Температура колонки: 35 С; температура автосэмплера: окружающей среды; расход: 2,0 мл/мин; сигнал детектировали на длине волны 206 нм. Метод С. Колонка ЖХ: Zorbax RX-C18 4,6250 мм, 5 мкм. Градиент: 50-90% ацетонитрил в/0,03 М фосфатный буфер (фосфатный буфер=5,52 г NaH2PO4 и 1,4 мл H3PO4 в 2 л Milli-Q H2O) 15 мин. Температура колонки: 40 С; температура автосэмплера: окружающей среды; расход: 1,5 мл/мин; сигнал детектировали на длине волны 260 нм. Метод D. Колонка ЖХ: Phenomenex Gemini C18 2,050 мм, 3,0 мкм. Градиент: 5-100% ACN ACN в/0,1% муравьиной кислоты 7,0 мин, затем поддерживали при 100% в течение 1,0 мин. Температура колонки: 5010 С; температура автосэмплера: окружающей среды; расход: 1,0 мл/мин; сигнал детектировали на длине волны 300 нм."Preparation of 6-(haloalkyl)-3-pyridinecarboxylic acids". Mueller, Peter. (Bayer A.-G., Germany). Заявка на европейский патент (2003), 13 стр. ЕР 1340747 А 1 20030903. 1 Н-ЯМР (ДМСО-d6, 500 МГц):9,19 (с, 1 Н),8,53 (дд, 1 Н, J=1,5, 8,5 Гц), 8,04 (д, 1 Н, J=8 Гц), 4,38 (кв., 2 Н, J=7 Гц), 1,34 (т, 3 Н, J=7 Гц). Процедура В. 2-(6-Трифторметилпиридин-3-ил)пропан-2-ол. Охлаждали содержимое реакционного сосуда, заполненного инертным газом, содержащего 6 трифторметилникотиновой кислоты этиловый эфир технического класса (45,6 моль; 10,00 кг) и третбутилметиловый эфир (71,6 л; 53,0 кг) до 10-15 С и затем переносили раствор в отдельный реакционный сосуд с инертной атмосферой, охлажденный до 5-12 С, содержащий 3 М хлорид метилмагния (136,8 моль; 45,6 л; 46,2 кг) и тетрагидрофуран (76,5 л; 68,0 кг). В процессе добавления наблюдали умеренный экзотермический эффект и температуру поддерживали в диапазоне 15-25 С. Подтверждали полное поглощение исходного эфира методом ВЭЖХ и охлаждали содержимое реактора до 0-3 С. Содержимое реакционного сосуда медленно добавляли в отдельный реактор, охлажденный до 0-5 С, содержащий хлористо-водородную кислоту (203 моль; 16,67 л; 20,0 кг) и воду (81,0 л, 81,0 кг), и наблюдали образование газа. Разделяли фазы и экстрагировали водную фазу один раз трет-бутилметиловым эфиром (59,5 л; 44,0 кг). Смешанные органические фазы промывали 20% раствором хлорида натрия (189,3 моль; 46,5 л; 55,3 кг). Органический раствор фильтровали, концентрировали до приблизительно 1 объема и разбавляли ацетонитрилом (31,8 л; 25,0 кг). Концентрировали раствор до приблизительно 1 объема и получали указанное в названии соединение в форме масла технического качества (7,9 кг; 84,4%, согласно ВЭЖХ) в ацетонитриле. Неочищенный материал использовали в форме раствора без дополнительной очистки. Чистый образец продукта можно получить, следуя описанной ниже процедуре. Очистка (необязательная): загружали указанное в названии соединение (1,81 кг, 8,82 моль) в делительную воронку объемом 33 л с метил-трет-бутиловым эфиром (3 л, 2,2 кг), водой (500 мл) и насыщенным раствором бикарбоната натрия (500 мл) и перемешивали в течение 10 мин. Отделяли ярко-желтую-6 015745 водную фазу и переносили органическую фазу в сосуд объемом 22 л. В сосуд добавляли сульфат магния(200 г, 1,66 моль), перемешивали 10 мин, затем фильтровали. Концентрировали экстракт с получением масла и дважды выпаривали с ацетонитрилом (23 л), в результате чего получали указанное в названии соединение в форме масла весом 1,64 кг (90,6%). 1H-ЯМР (ДМСО-d6, 500 МГц):8,85 (д, 1 Н, J=2,5 Гц),8,10 (дд, 1 Н, J=2,8 Гц), 7,81 (д, 1 Н, J=8 Гц), 5,42 (с, 1 Н), 1,47 (с, 6 Н). Процедура С. N-[1-Метил-1-(6-трифторметилпиридин-3-ил)этил]ацетамид. В реакционный сосуд, содержащий 2-(6-трифторметилпиридин-3-ил)пропан-2-ол (52 моль; 12,8 кг),добавили ацетонитрил (67,4 л; 53,0 кг) и охладили до 0-5 С. Медленно добавили концентрированную серную кислоту (372 моль; 19,8 л; 36,5 кг), поддерживая внутреннюю температуру в диапазоне 0-15 С. Нагревали раствор до 25-30 С в течение 24 ч, завершение реакции определяли методом ВЭЖХ. Охлаждали смесь до 0 С при перемешивании и добавляли воду (95,0 л; 95,0 кг). Добавляли раствор водного аммиака (57,5 кг) до получения рН до 8,0-9,0, а затем добавляли трет-бутилметиловый эфир (81,1 л; 60,0 кг). Отделяли нижнюю водную фазу, концентрировали органическую фазу до приблизительно 3 объемов и охлаждали реакционную смесь до -5-0 С. Полученные в результате твердые вещества фильтровали и сушили под вакуумом до достижения постоянного веса и получали (13,4 кг; 87,3%, согласно ВЭЖХ) указанного в названии соединения в форме бледно-желтого твердого вещества при чистоте 81,8%. 1 Н-ЯМР Нагревали смесь N-[1-метил-1-(6-трифторметилпиридин-3-ил)этил]ацетамида (93,5 моль, 19,1 кг),концентрированной хлористо-водородной кислоты (805,9 моль; 66,2 л; 79,4 кг) и воды (79,4 л; 79,4 кг) до 95-100 С при перемешивании в атмосфере азота в течение 24 ч. Охлаждали реакционную смесь до 2035 С и определяли завершение реакции методом ВЭЖХ. Охлаждали реакционный сосуд до 10-20 С и добавляли трет-бутилметиловый эфир (105,4 л; 78,0 кг). Разделяли фазы и отбрасывали органическую фазу. К водной фазе добавляли 15% гидроксид натрия (910,9 моль; 205 л; 242,9 кг) и наблюдали рН, равный 9,5-10,5. Экстрагировали водную фазу этилацетатом (389 мл; 380,0 кг), объединяли органические фазы, водную фазу не использовали. Концентрировали раствор до приблизительно 2 объемов, добавляли трет-бутилметиловый эфир (174 л; 129,1 кг) и концентрировали раствор до приблизительно 2 объемов. Разбавляли реакционную смесь н-гептаном (168 л; 115,0 кг), концентрировали раствор до приблизительно 2 объемов и разбавляли дополнительным количеством н-гептана (30 л, 20,7 кг). Охлаждали содержимое реакционной смеси до 0-5 С и перемешивали смесь в течение 2 ч при 0-5 С. Фильтровали и сушили полученные твердые вещества под вакуумом при 35-45 С, в результате чего получали указанное в названии соединение (14,19 кг; 74,3%, согласно ВЭЖХ) в форме темно-коричневого порошка с чистотой 97,9%. Процедура Е. 1-Метил-1-(6-трифторметилпиридин-3-ил)этиламин; соединение с толуол-4 сульфоновой кислотой. Добавляли раствор 1-метил-1-(6-трифторметилпиридин-3-ил)этиламина (280 г, 1,37 моль) в метилтрет-бутиловом эфире (1,4 л) к раствору моногидрата паратолуолсульфоновой кислоты (212,5 г, 1,23 моль) в тетрагидрофуране (980 мл). Наблюдали рН 2,0 и увеличение температуры до 28 С. Охлаждали до 18 С и фильтровали твердые вещества. Промывали фильтрат метил-трет-бутиловым эфиром (1,4 л). Фильтрат сушили под вакуумом при температуре окружающей среды и получали 408 г (79%) указанного в названии соединения в форме белого твердого вещества. 1 Н-ЯМР (ДМСО-d6, 500 МГц):8,94 (д, 1 Н,J=2,5 Гц), 8,53 (ушир.с, 3 Н), 8,2 (дд, 1 Н, J=5,5, 8 Гц), 8,02 (д, 1 Н, J=8 Гц), 7,46 (д, 2 Н, J=8 Гц), 7,10 (д, 2 Н,J=7,5 Гц), 2,27 (с, 3 Н), 1,68 (с, 6 Н). Процедура F. 1-Метил-1-(6-трифторметилпиридин-3-ил)этиламин. В 5-литровой колбе с 3 горлышками взвешивали 1-метил-1-(6-трифторметилпиридин-3-ил)этиламин, соединение с толуол-4-сульфоновой кислотой (990 г, 2,63 моль). Добавляли метил-трет-бутиловый эфир (2,48 л), в результате образовывалась суспензия, которую охлаждали в ледяной ванне. Добавляли 5 М раствор гидроксида натрия (578,64 мл, 2,89 моль), в результате получали двухфазную смесь с рН 12,2. Разделяли фазы и экстрагировали органическую фазу водой (125 мл). Органическую фазу удаляли и концентрировали при пониженном давлении, в результате получали остаток (200 г). Органическую фазу экстрагировали смесью метил-трет-бутилового эфира (990 мл) и тетрагидрофурана (1,32 л). Отделяли органическую фазу и концентрировали ее при пониженном давлении с получением еще одного остатка(200 г). Согласно наблюдениям рН водной фазы составлял рН 10,1 добавляли 5N NaOH (157,8 мл, 0,789 моль) до достижения рН 13. Экстрагировали водную фазу дихлорметаном (1,32 л). Разделяли фазы и концентрировали органическую фазу с получением третьего остатка. Объединяли три остатка амина,суспендировали в гептане (1 л) при перемешивании и концентрировали суспензию с получением 427 г(79,5%) очищенного указанного в названии соединения в форме белого кристаллического вещества. 1 НЯМР (CDCl3, 500 МГц):8,91 (д, 1 Н, J=2,5 Гц), 8,05 (дд, 1 Н, J=2,8 Гц), 7,64 (д, 1 Н, J=8,5 Гц), 1,68 Растворяли 1-метил-1-(6-трифторметилпиридин-3-ил)этиламин из процедуры F (1,0 г, 4,9 ммоль) в ацетоне (10 мл) при температуре окружающей среды и перемешивали в течение 5 мин. Продолжая перемешивание, по каплям добавляли концентрированную (12,18N) хлористо-водородную кислоту (0,4 мл,4,9 ммоль) и наблюдали образование белого твердого вещества. Охлаждали реакционную смесь до 0 С и продолжали перемешивание в течение 30 мин. Полученное твердое вещество фильтровали и промывали ацетоном (2 мл). Сущили под вакуумом при 40 С, в результате получали указанное в названии соединение (0,73 г, 62%) в форме белого твердого вещества: 1 Н-ЯМР (400 МГц, ДМСО-d6)9,17 (с (ушир.), 3 Н),9,02 (д, 1 Н, J=2,4 Гц), 8,32 (дд, 1 Н, J=8,0, 2,0 Гц), 7,97 (д, 1 Н, J=8,4 Гц), 1,71 (с, 6 Н); 13 С ЯМР (100 МГц,ДМСО-d6)148,0, 146,2 (кв., JCF=34,0 Гц), 142,4 (д, JCF=0,8 Гц), 136,0, 121,9 (кв., JCF=273 Гц), 120,8 (т,JCF=2,6 Гц), 54,9, 27,5. Процедура Н. -5-(3-Трифторметоксифенил)-1-(4-трифторметилфенил)-3-(4-трифторметилфениламино)-1,5-дигидропиррол-2-он. Перемешивали 3-(трифторметокси)бензальдегид (25,0 г, 132 ммоль) и этилпируват (15,3 г, 132 ммоль) в ледяной уксусной кислоте (125 мл) при температуре окружающей среды в течение 10 мин. Продолжая перемешивание, по каплям добавляли 4-(трифторметил)анилин (46,7 г, 290 ммоль) на протяжении 15 мин, нагревали раствор до 30 С и перемешивали 22-24 ч. Охлаждали раствор до 26 С, добавляли изопропиловый спирт (125 мл) и воду (125 мл). Перемешивали раствор при комнатной температуре в течение 15 мин, фильтровали осадок и промывали смесью 1:1 изопропиловый спирт-вода (100 мл 2). Сушили под вакуумом при 40 С, в результате чего получали указанное в названии соединение (60,46 г,84%) в форме белого порошка: ВЭЖХ (метод С) время удерживания: 10,9 мин. MS (m/z): 545,1 (M-1). 1 НЯМР (500 МГц, ДМСО-d6)8,76 (с, 1 Н), 7,86 (д, 2 Н, J=8,5 Гц), 7,70 (д, 2 Н, J=8,5 Гц), 7,56 (д, 2 Н, J=9,0 Гц), 7,47 (д, 2 Н, J=8,5 Гц), 7,44-7,41 (м, 1 Н), 7,37 (с, 1 Н), 7,29 (д, 1 Н, J=8,0 Гц), 7,22 (д, 1 Н, J=8,0 Гц), 6,66 Смешивали этанол (120 мл), ледяную уксусную кислоту (15 мл), воду (3,0 мл, 164,7 ммоль), трифторуксусную кислоту (6,2 мл, 82,4 ммоль), -5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)-3(4-трифторметилфениламино)-1,5-дигидропиррол-2-он (30,0 г, 54,9 ммоль) и 2,5-диметокситетрагидрофуран (10,7 мл, 82,4 ммоль). Нагревали раствор до 50 С и перемешивали реакционную смесь в течение 15-18 ч. Прекращали нагревание раствора, добавляли воду (35 мл) и охлаждали реакционную смесь до -19 С. Суспензию фильтровали и твердое вещество промывали смесью 1:4 вода-метанол (20 мл). Переносили фильтрат в делительную воронку и промывали 6% солевым раствором (280 мл), к органической фазе добавляли 6% солевой раствор (100 мл), метанол (40 мл), диэтиловый эфир (100 мл) и насыщенный раствор бикарбоната натрия (43 мл). Разделяли фазы, к органической фазе добавляли метанол(60 мл) и концентрировали раствор до приблизительно 1 объема, содержащего (+)-5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)пирролидин-2,3-дион. Добавляли метанол (60 мл) и (R)-4-хлор-метилбензиламин (7,8 мл, 55,0 ммоль) и перемешивали при комнатной температуре в течение 24 ч. За ходом реакции следили методом ВЭЖХ до завершения (метод В), затем охлаждали раствор до -7 С и продолжали перемешивание при этой температуре в течение 72 ч. К реакционной смеси добавляли предварительно смешанный раствор гидроксида калия (0,69 г, 10,5 ммоль) в метаноле (11 мл), нагревали раствор до 10 С и перемешивали в течение еще 4 ч. Охлаждали раствор до -7 С, фильтровали суспензию и споласкивали полученный продукт метанолом (5 мл 3). Сушили твердое вещество под вакуумом и получали (R)-1-(4-трифторметилфенил)-3-[1(R)-(4-хлорфенил)этиламино]-5-(3-трифторметоксифенил)-1,5 дигидропиррол-2-он (12,3 г, 47,7%) в форме белого твердого вещества: ВЭЖХ (метод В): время удерживания: 4,3 мин. MS (m/z): 539,0 (M-1). 1 Н-ЯМР (500 МГц, ДМСО-d6)7,76 (д, 2 Н, J=8,5 Гц), 7,62 (д, 2 Н,J=9,0 Гц), 7,38-7,36 (м, 2 Н), 7,30-7,27 (м, 3 Н), 7,10 (дд, 1 Н, J=8,5, 1,0 Гц), 7,05 (д, 1 Н, J=7,5 Гц), 6,95 (с,1 Н), 6,06 (д, 1 Н, J=8,0 Гц), 5,96 (д, 1 Н, J=3,0 Гц), 5,22 (д, 1 Н, J=3,0 Гц), 4,35-4,32 (м, 1 Н), 1,43 (д, 3 Н, J=6,5 Гц). Пример 1. 4-Метилбензолсульфонат (3R,5R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-1-(4-трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-она (1:1).(R)-1-(4-трифторметилфенил)-3-[(1R)-1-(4-хлорфенил)этиламино]-5-(3-трифторметоксифенил)-1,5-дигидропиррол-2-он (50,0 г, 92,4 ммоль), толуол (200 мл) и воду (100 мл) при температуре окружающей среды в течение 10 мин. К этому двухфазному раствору добавляли трифторуксусную кислоту (50,0 мл, 0,66 моль) и наблюдали легкий экзотермический эффект (23-30 С). За ходом реакции следили путем ВЭЖХ (метод А) и через 1-2 ч переносили раствор в делительную воронку и удаляли водную фазу. Промывали органическую фазу 5N хлористо-водородной кислотой (200 мл 2), водой (200 мл) и подвергали органическую фазу анализу, чтобы убедиться в исчезновении (R)-4-хлор-метилбензиламина. Органический раствор помещали в реакционную колбу и оставляли. В отдельной колбе смешивали гидрохлорид 1-метил-1-(6-трифторметилпиридин-3-ил)этиламина (33,4 г, 138,6 ммоль),толуол (150 мл), 2N гидроксид натрия (110 мл, 212,6 ммоль) и перемешивали при температуре окружающей среды в течение 30 мин. Отделяли органическую фазу и переносили в чистую колбу. Перемешивали раствор и добавляли уксусную кислоту (52 мл), в результате наблюдали некоторое повышение температуры (с 23 до 32 С). Добавляли полученный ранее раствор (5R)-5-(3-трифторметоксифенил)-1-(4 трифторметилфенил)пирролидин-2,3-диона (37,3 г, 92,4 ммоль, теоретически) в толуоле (200 мл) к реакционной смеси и нагревали до 45 С при перемешивании в течение 14-18 ч. Анализировали раствор путем ВЭЖХ (метод А) и наблюдали исчезновение димера (5R)-3-гидрокси-5-(3-трифторметоксифенил)-1-(4 трифторметилфенил)-1,5-дигидропиррол-2-она (см. ниже), охлаждали раствор до температуры окружающей среды. Переносили раствор в делительную воронку и промывали пурпурный раствор 3% водным хлоридом натрия (120 мл 2), насыщенным бикарбонатом натрия (120 мл) и 3% солевым раствором (120 мл). Переносили органическую фазу в колбу, концентрировали до приблизительно 2 объемов (100 мл) и добавляли свежий толуол (150 мл). Перемешивали пурпурную реакционную смесь в течение 5 мин при барботировании азота и добавляли триацетоксиборгидрид натрия (39,2 г, 184,9 ммоль) одной порцией при температуре окружающей среды. Медленно добавляли трифторуксусную кислоту (50,0 мл, 655,3 ммоль) и наблюдали экзотермический эффект (с 23 до 34 С), следя, чтобы внутренняя температура не превысила 35 С. Перемешивали реакционную смесь при температуре окружающей среды в течение 2-4 ч, за ходом реакции следили путем ВЭЖХ (метод А) до завершения. Добавляли воду (250 мл), метил трет-бутиловый эфир (150 мл) и разделяли фазы. Промывали органическую фазу 2N гидроксидом натрия (150 мл), водой(150 мл 2) и переносили органическую фазу, содержащую продукт, в колбу. Концентрировали раствор до приблизительно 2 объемов (100 мл), добавляли свежий толуол (450 мл) и снова концентрировали до приблизительно 2 объемов (100 мл). Добавляли свежий толуол (450 мл), нагревали раствор до 50 С при перемешивании и добавляли моногидрат паратолуолсульфоновой кислоты (14,1 г, 73,9 ммоль) в форме раствора в этаноле (60 мл). Охлаждали реакционную смесь до температуры окружающей среды и перемешивали в течение 1 ч. Фильтровали осадок, промывали толуолом (50 мл 2) и сушили под вакуумом при 40 С, в результате чего получали указанное в названии соединение (31,6 г, 44,8%) в форме белого порошка: ВЭЖХ (метод А) время удерживания: 8,0 мин. МСВР (m/z): 592,1641 (М+1). 1 Н-ЯМР (500 МГц, ДМСО-d6)9,08 (д, J=2,2 Гц, 1 Н), 8,42 (дд, J=8,2, 2,2 Гц, 1 Н), 8,02 (д, J=8,2 Гц, 1 Н), 7,64-7,62 (м,2 Н), 7,52-7,47 (м, 4 Н), 7,41-7,38 (м, 1 Н), 7,33 (д, J=7,7 Гц, 1 Н), 7,28 (с, 1 Н), 7,19 (д, J=8,2 Гц, 1 Н), 7,117,10 (м, 2 Н), 5,37 (дд, J=9,3, 6,0 Гц, 1 Н), 4,34 (с, 1 Н), 2,78-2,72 (м, 1 Н), 2,27 (с, 3 Н), 2,04 (дд, J=21,4, 11,0 Гц, 1 Н), 1,88 (с, 3 Н), 1,87 (с, 3 Н). Пример 2. Очистка 4-метилбензолсульфонат (3R,5R)-3-[1-метил-1-(6-трифторметилпиридин-3 ил)этиламино]-1-(4-трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-она, (1:1). Смешивали 4-метилбензолсульфонат (3R,5R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-1-(4-трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-он, (1:1) (5,0 г, 6,55 ммоль),толуол (75 мл) и 10% водный раствор карбоната натрия (25 мл) при температуре окружающей среды в течение 1 ч. Разделяли фазы и промывали органическую фазу водой (25 мл 2). Помещали органическую фазу в колбу и концентрировали до приблизительно 2 объемов (10 мл). Добавляли свежий толуол(50 мл), концентрировали раствор до приблизительно 2 объемов (10 мл) и добавляли свежий толуол (65 мл). Нагревали раствор до 55 С при перемешивании и добавляли моногидрат паратолуолсульфоновой кислоты (1,27 г, 6,55 ммоль) в форме раствора в этаноле (5,5 мл). Охлаждали реакционную смесь до температуры окружающей среды и перемешивали в течение 1 ч. Фильтровали полученную суспензию, промывали твердое вещество толуолом (5 мл 2) и сушили под вакуумом при 40 С, в результате чего получали указанное в названии соединение (4,5 г, 90,4%) в форме белого кристаллического вещества: ВЭЖХ(3R,5R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-1-(4 трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-он, (1:1) также можно получить с использованием процедуры Ia(R)-(+)Метилбензиламин (45,0 мл, 349,8 ммоль) добавляли к органической фазе, описанной в процедуре I, содержащей -5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)пирролидин-2,3 дион. Перемешивали раствор при температуре окружающей среды в течение 72 ч. Реакционную смесь концентрировали и очищали путем хроматографии на силикагеле (5-15% EtOAc-гексан), в результате чего получали (S)-1-(4-трифторметилфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5 дигидропиррол-2-он (32,4 г, 37%) в форме темно-коричневой пленки и (R)-1-(4-трифторметилфенил)-3R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5-дигидропиррол-2-он (26,0 г, 29%) в форме бледно-оранжевого масла. Трифторуксусную кислоту (21,6 мл, 285 ммоль) по каплям добавляли к двухфазной смеси (R)-1-(4 трифторметилфенил)-3-R)-1-фенилэтиламино)-5-(3-трифторметоксифенил)-1,5-дигидропиррол-2-она(28,9 г, 57,1 ммоль) в толуоле (144 мл) и воды (58 мл). Перемешивали при температуре окружающей среды в течение 60 мин. Наблюдали значительное образование (R)-5-[3-трифторметоксифенил]-1-(4 трифторметилфенил)пирролидин-2,3-диона (ЖХМС 85%, время удерживания = 4,27 мин, метод D) MS(m/z): 402 (M-1). Водную фазу отделяли, а фазу в толуоле промывали водой, буфером с рН 7 и насыщенным раствором хлорида натрия. Уксусную кислоту (26,2 мл, 456 ммоль) и 1-метил-1-(6-трифторметилпиридин-3 ил)этиламин (23,3 г, 114 ммоль) добавляли к раствору в толуоле, содержащему (R)-5-[3-трифторметоксифенил]-1-(4-трифторметилфенил)пирролидин-2,3-дион. Нагревали до 55 С в течение 18 ч. На- 11015745 блюдали значительное образование (R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-5-(3 трифторметоксифенил)-1-(4-трифторметилфенил)-1,5-дигидропиррол-2-она (ЖХМС 100%, время удерживания = 5,59 мин, метод D, MS (m/z): 590 (M+1). Концентрировали при пониженном давлении. Растворяли неочищенный (R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-5-(3-трифторметоксифенил)-1-(4-трифторметилфенил)-1,5-дигидропиррол-2-он в уксусной кислоте (285 мл) и добавляли цианоборгидрид натрия (7,2 г, 114 ммоль). Перемешивали 1,75 ч при температуре окружающей среды и концентрировали при пониженном давлении. Растворяли остаток в этилацетате и промывали насыщенным раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия. Сушили раствор на сульфате натрия и концентрировали при пониженном давлении. Очищали остаток путем хроматографии на силикагеле (10-30% этилацетат-гексан), в результате чего получали (3R,5R)-3-[1-метил-1-(6 трифторметилпиридин-3-ил)этиламино]-1-(4-трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-он (18,0 г, 53%) в форме желтого масла и (3S,5R)-3-[1-метил-1-(6-трифторметилпиридин-3 ил)этиламино]-1-(4-трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-он (0,92 г, 2,7%) в форме масла.(3R,5R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-1-(4-трифторметилфенил)-5-(3 трифторметоксифенил)пирролидин-2-он. 1 Н-ЯМР (400 МГц, ДМСО-d6)8,96 (д, 1 Н, J=2,2 Гц), 8,24 (дд, 1 Н, J=8,4, 1,8 Гц), 7,80 (д, 1 Н, J=8,4 Гц), 7,57 (д, 2 Н, J=8,8 Гц), 7,47 (д, 2 Н, J=8,4 Гц), 7,36 (дд, 1 Н, J=7,8, 7,8 Гц), 7,26 (д, 1 Н, J=7,9 Гц), 7,21 (с,1 Н), 7,12 (д, 1 Н, J=8,1 Гц), 5,25 (дд, 1 Н, J=9,7, 6,2 Гц), 3,47-3,39 (м, 1 Н), 2,89 (д, 1 Н, J=4,4 Гц), 2,70 (ддд,1 Н, J=13,3, 6,9, 5,2 Гц), 1,65 (дд, 1 Н, J=21,8, 10,4 Гц), 1,48 (с, 3 Н), 1,44 (с, 3 Н). MS (m/z): 592 (M+1). Получение соли: тозилат - добавляли 1 экв. паратолуолсульфоновой кислоты и кристаллизовали из изопропанола. Выход 85%, MS (m/z): 592 (M+1). Получение соли: гидрохлорид - добавляли 1 экв. хлористо-водородной кислоты в диэтиловом эфире, в результате чего образовывалась соль-гидрохлорид, и рекристаллизовали из изопропанола. Выход 63%, MS (m/z): 592 (M+1).H-ЯМР (400 МГц, ДМСО-d6)8,92 (с, 1 Н), 8,19 (д, 1 Н, J=7,9 Гц), 7,78-7,70 (м, 3 Н), 7,64 (д, 2 Н,J=8,8 Гц), 7,39-7,34 (м, 1 Н), 7,20-7,12 (м, 2 Н), 7,10 (с, 1 Н), 5,62 (д, 1 Н, J=8,3 Гц), 3,50-3,43 (м, 1 Н), 2,86 (д,1 Н, J=4,0 Гц), 2,43-2,33 (м, 1 Н), 2,09-2,02 (м, 1 Н), 1,46 (с, 3 Н), 1,43 (с, 3 Н), MS (m/z): 592 (M+1). Получение соли: тозилат - добавляли 1 экв. паратолуолсульфоновой кислоты и кристаллизовали из изопропанола-гептана. Выход: 80%, MS (m/z): 592 (M+1). Функциональные in vitro тесты СВ 1 и СВ 2 Анализ связывания GTP35S методом SPA с иммобилизованными антителами. На мембранах клеток человека или крысы, экспрессирующих рецептор CB1 или СВ 2, тестировали 4 метилбензолсульфонат (3R,5R)-3-[1-метил-1-(6-трифторметилпиридин-3-ил)этиламино]-1-(4-трифторметилфенил)-5-(3-трифторметоксифенил)пирролидин-2-она (в настоящем изобретении - примере 2) на активность в качестве антагониста/обратного агониста связывания ГТФ. Измеряли связывание GTP35S в 96-луночном формате с использованием модифицированной методики иммобилизованного антитела,описанной ранее (DeLapp et al. 1999). Вкратце, инкубировали мембраны клеток СНО или Sf9, экспрессирующих CB1 или СВ 2 соответственно (Applied Cell Sciences, Gaithersburg, M, США; PerkinElmer Life Sciences, Boston, MA, США); приготовленных, как было описано ранее (DeLapp et al., 1999), соединенияпримеры и 500 пМ GTP35S (PerkinElmer Life Sciences, Boston, MA, США) в течение 30 мин при комнатной температуре в буфере для анализа на связывание ГТФ (20 мМ Hepes, 100 мМ NaCl, 5 мМ MgCl2,рН 7,4). Проводили анализ дозозависимого ответа в присутствии насыщающей дозы полного агониста(метанандамид). В 96-луночные планшеты дополнительно добавляли смесь, содержащую 0,27% детергент Nonidet P40 (Roche, Indianapolis, IN, США), анти-G антитело (конечное разведение 1:300; Covance,Princeton, NJ, США) и 1,25 мг гранул для анализа на близость сцинциллятора к AT кролика (GE Healthcare, Piscataway, NJ, США), планшеты запечатывали и инкубировали в течение еще 3 ч. Центрифугировали планшеты при 700g в течение 10 мин на центрифуге Beckman GS-6R и считывали сигнал в течение 1 мин в каждой лунке на счетчике сцинцилляции Wallac MicroBeta TriLux scintillation (PerkinElmer, Boston, MA, США). Для анализа данных сначала из всех лунок вычитали фоновое значение. Определяли процентную эффективность агониста путем нормализации результатов ответа на дозу агониста/обратного агониста на ответ полного агониста (метанандамида). Рассчитывали результат процентного ингибирования антагонистом путем нормализации относительно результатов, полученных с насыщающей концентрацией агониста (метанандамида). Данные анализировали путем аппроксимации по 4-параметрическому логистическому уравнению при помощи программ Activity Base и XLFit3 (IDBS, Emeryville, CA, США). Определяли значения Kb, используя модифицированную зависимости Cheng-PrusoffKb=IC50/(1+[агонист]/EC50),- 12015745 где IC50 определяют путем аппроксимации четырехпараметрическими кривыми, [агонист]=EC50 полного агониста, а ЕС 50 определяют по четырехпараметрической аппроксимации кривой ответа в зависимости от концентрации полного агониста (Cheng and Prusoff 1973). Рассчитывали средние значения Kb как среднее по меньшей мере трех независимых измеренийстандартная ошибка среднего (SEM). В табл. 1 сведены свойства антагониста/обратного агониста примера 2 в клетках СНО, экспрессирующих рецепторы CB1 человека или крысы, или клетках Sf9, экспрессирующих рецепторы СВ 2 человека. Можно сделать вывод, что пример 2 демонстрирует эффективный антагонизм в отношении CB1 человека и крысы при отсутствии измеряемого антагонизма в отношении рецептора СВ 2 человека. Эти данные указывают на то, что пример 2 является эффективным антагонистом/обратным агонистом рецепторов CB1 и человека и крысы и не демонстрирует антагонизма в отношении рецепторов СВ 2 человека. В табл. 2 сведены свойства агониста примера 2 в мембранах клеток Sf9, экспрессирующих рецепторы CB1 или СВ 2 человека. Эти данные указывают на то, что пример 2 является обратным агонистом рецептора CB1 человека, о чем свидетельствует его отрицательная эффективность в качестве агониста (табл. 2), что указывает на то, что соединение снижает базальную конститутивную активность рецептора CB1 invitro. Пример 2 не демонстрирует измеримой активности в качестве агониста СВ 2 (табл. 2). Источники.In vitro функциональный тест на активность антагониста/обратного агониста СВ 1 и СВ 2 по связыванию ГТФ для примера 2 в мембранах клеток СНО или Sf9, экспрессирующих каннабиноидные рецепторы человека или крысыIn vitro функциональный тест на активность агониста CB1 и СВ 2 по связыванию ГТФ для соединения 2 в мембранах клеток Sf9, экспрессирующих каннабиноидные рецепторы человека Тест с принудительным плаванием (FST). За 7-10 дней до проведения тестов получили самцов мышей NIH-Swiss (Harlan Sprague-Dawley, вес 20-25 г). Содержали по 12 мышей/клетка. Тестировали только тех животных, которые весили 25-30 г. В день тестирования животных переносили в лабораторию по меньшей мере за 1 ч до начала введения соединений. После начала введения дозы вводили с интервалом 6-8 мин между каждыми введениями, причем каждой мыши перорально вводили либо носитель (1% CMC, 0,5% SLS, 0,08% повидона, 0,05% противовспенивающего агента или соединения примера 2, р.о. Затем мышей помещали в чистые клетки (4 мыши на клетку). Через 90 мин начинали тестирование после предварительной обработки (90 мин) соединением примера 2 или носителем.FST с мышами: прозрачные пластиковые цилиндры (диаметр: 10 см; высота: 25 см) с мышами NIHSwiss заполняли до 6 см водой при температуре 22-25 С в течение 6 мин. Регистрировали продолжительность неподвижного состояния в течение последних 4 мин 6-минутного теста. Мышь считали неподвижной, если она плавала на поверхности без движения или осуществляла только движения, необходимые для того, чтобы держать голову над водой. Полученные данные анализировали методом дисперсионного анализа ANOVA, используя критерий post-hog Даннета (=0,05; JMP). Регистрировали минимальные эффективные дозы (МЭД): самая низкая доза соединения, которая вызывает статистически значимое снижение наблюдаемого времени неподвижного состояния по сравнению с контролем, получавшим носитель. Биодоступность. Способы оценки биодоступности хорошо известны в данной области. Например, одним из такихt-критерий Sf9, табл. 3, против СНО табл. 1, р=0,127, НО= не определено Активация коры: активация cFos. Исследовали способность примера 2 активировать экспрессию генов и отток нейрохимических веществ в корковых и подкорковых областях и взаимодействовать с одним из атипичных антипсихотических агентов - клозапином. Методы: самцов крыс Sprague Dawley (155-175 г) содержали в течение 1 недели перед проведением экспериментов. Готовили соединение примера 2 в форме суспензии в носителе 1% натрийкарбоксиметилцеллюлозы, 0,5% лаурилсульфата натрия, 0,05% противовспенивающего агента, 0,085% повидона и вводили крысам (например, самцам крыс Sprague Dawley, 155-175 г) перорально (доза от 1 до 10 мг/кг). Контрольные крысы получали носитель. Через 1 ч подкожно вводили клозапин (Sigma) в концентрации 8 мг/мл в растворе-носителе, содержащем 0,4% молочной кислоты при дозе 8 мг/кг. Животных умерщвляли (n=7-8 на группу) путем декапитации через 2 ч после введения клозапина или носителя для клозапина. Быстро извлекали целый мозг и немедленно помещали в изопентан (2-метилбутан) на сухом льду. Делали корональные срезы префронтальной коры (PFC), прилежащих ядер (NAc) и дорсолатерального полосатого тела (DL-Str) толщиной 14 мкм и проводили иммуногистохимический анализ сFos. Индекс атипичности оценивали (Robertson et al., 1994), пользуясь следующей формулой: индекс атипичности = (NAcD - NAcV) - (DL-StrD - DL-StrV), где среднее количество нейронов Fos-li в NAc = прилежащее ядро, D = лекарственное средство, V = носитель, DL-Str = дорсолатеральное полосатое тело. Данные анализировали, используя метод дисперсионного анализа (ANOVA) и апостериорный критерий Ноймана-Кейля (Newman-Keul's post hoc test) (Graph Pad Prism 4.03). Задавали уровень значимости Р 0,05. Результаты: и клозапин и соединение примера 2 по отдельности проявляют способность или существенно увеличивают реактивность Fos коры и подкорки. Наблюдали, что соединение примера 2 усиливает действие клозепина в отдельности в концентрациях 1 и 10 мг/кг, р.о. Заключение: соединение примера 2 усиливает экспрессию cFos в мозге крыс как в префронтальной коре, так и в подкорковых областях. Демонстрирует спектр активации нейронов, аналогичный клозапи- 14015745 ну. Дополнение клозапина соединением примера 2 приводит к росту экспрессии cFos, стимулируемой клозапином в областях мозга, играющих критическую роль в управлении когнитивной функцией и негативными симптомами. Наблюдали общее влияние примера 2 на клозапин, которое обусловливает большую атипичность нейронного профиля в отношении влияния вентральное - дорсальное полосатое тело. Стимуляция высвобождения нейротрансмиттеров - моноаминов и обновления в областях мозга,связанных с когнитивной функцией. Методы: самцам крыс Sprague-Dawley (260-300 г, Taconic Farms, Germantown, Нью-Йорк, США) за 5-7 дней до начала эксперимента имплантировали канюлю (BAS, West Lafayette, IN) в префронтальной коре (PFC). Приблизительно за 16 ч до начала эксперимента вводили через канюлю щуп концентрического типа с 4 мм мембранным наконечником, выступающим ниже канюли, собирали микродиализат из префронтальной коры и анализировали на моноамины и их метаболиты. Рассчитывали все данные микродиализа как процентное изменение относительно исходной (базальной) концентрации в диализате, при этом 100% задавали как среднее по трем конечным значениям перед инъекцией, и каждая группа включала 5-6 крыс. Данные анализировали методом дисперсионного анализа, а затем с применением апостериорного критерия Бонферрони (Bonferroni). Результаты: соединение примера 2 обеспечивало увеличение уровня моноамина и метаболитов в коре мозга крыс в дозе 1 мг/кг, р.о. Поведение, связанное с поиском этанола: 12-часовое потребление этанола у крыс, склонных к употреблению спирта (Р-крысы). Оценивали способность соединения примера 2 снижать потребление этанола у крыс, которые в результате селекционного разведения имеют склонность к пероральному потреблению больших количеств спирта (Р-крысы). Дополнительно изучали действие соединения примера 2 в условиях, в которых можно оценить влияние соединения на мотивацию или контроль поведения под действием этанола. Методы: исследовали влияние соединения примера 2 на потребление спирта самками крыс, склонных к потреблению спирта (Р), в условиях свободного доступа. Для сравнения тестировали стандартный антагонист опиоидов налтрексон. Мониторировали добровольное потребление 15% об./об. этилового спирта. Соединение примера 2 суспендировали в носителе (1% CMC, 0,5% SLS, 0,08% повидон, 0,05% противовспенивающий агент Dow Corning 1510 US) и вводили р.о. за 3 ч перед началом темного цикла. Кроме того, следили за двигательной активностью при помощи инфракрасного датчика. Результаты: в результате перорального введения соединения примера 2 потребление спирта, но не воды, снижалось дозозависимым образом. Налтрексон в более высоких дозах, также проявлял способность снижать потребление алкоголя. Соединение примера 2 не вызывало существенного изменения двигательной активности крыс до дозы 10 мг/кг. Поведение, связанное с поиском этанола: модель реакции с растущим соотношением, поддерживаемой этанолом. Исследовали способность соединения примера 2 снижать мотивацию, контролирующую потребление этанола. Методы: исследовали самок мышей, склонных к употреблению алкоголя (Р) в схеме с растущим соотношением, в которой реакция приводит к получению 15% об./об. этилового спирта. В условиях схемы растущего соотношения требования ответа для получения этанола увеличиваются с 1 до 2, а затем с шагом 2 после получения 3 доз этанола. Результаты: введение соединения примера 2 снижает поведение, направленное на поиск этанола дозозависимым образом. Соединение примера 2 обеспечивает дозозависимое снижение значения точки прерывания (количество усилий, которое крысе необходимо выполнить, чтобы получить следующую дозу этанола) [F(4,20)=4,52, p=0,009].In vivo эффективность в модели пищевого поведения. Методы: соединение примера 2 вводили самцам крыс Long-Evan с ожирением, вызванным диетой(DIO). DIO вызывали следующим образом: сосунков без ограничения кормили пищей, содержащей 40% жира, 39% углеводородов и 21% белка по количеству калорий в течение по меньшей мере 12 недель. Эффективность соединения определяли по Т 17 (доза, необходимая для достижения разницы по сравнению с группой, получающей носитель, в 17 г). Эта доза соответствует минимальному биологически значимому снижению веса на 3-4% по сравнению с лечением носителем в течение 2 недель. Результаты: введение соединения примера 2 один раз в день перорально на протяжении 14 дней исследования обеспечивает снижение кумулятивного потребления пищи. В соответствии со снижением потребления пищи наблюдали кумулятивное снижение массы тела после 14 дней лечения соединением примера 2, в дозе по Т 17 0,13 мг/кг. Количественный анализа конституции тела методом количественного ядерного магнитного резонанса (КЯМР) показал значительное снижение массы жира при дозах в диапазоне 0,1-10 мг/кг при минимальном изменении безжировой массы в одной из самых высоких доз. Модель увеличения веса при лечении атипичными антипсихотическими агентами. Методы: худых взрослых самок крыс Sprague-Dawley держали в условиях с неограниченным доступом к обычному корму для грызунов Purina LabDiet 5001 (12,3% жира) и воде. Одной группе (n=7) вво- 15015745 дили носитель (1% молочной кислоты) в дни 1-14, а остальным вводили оланзапин (2 мг/кг, р.о.). Отслеживали потребление пищи, мониторировали массу тела и изменение жировой массы после двух недель лечения. После 14 дней получения лекарственного средства животных, получавших оланзапин, делили на группы (n=8 на группу), и в течение дней 15-28 одной группе вводили 0,3 мг/кг соединения примера 2 плюс оланзапин, второй группе - 1 мг/кг соединения примера 2 плюс оланзапин, а последней группе носитель плюс оланзапин. Результаты: при однократном введении оланзапина в течение 14 дней наблюдали увеличение кумулятивного потребления пищи, массы тела и массы жира в результате лечения по сравнению с контролями, получавшими носитель. Добавление соединения примера 2 к лечению оланзапином привело к значительному снижению роста массы жира при обеих дозах соединения примера 2, при этом изменения безжировой массы не наблюдали. Выводы: значительное снижение массы тела и снижение потребления пищи по сравнению с контролями, получавшими носитель в результате ежедневного введения соединения примера 2 в течение 14 дней самцам крыс Long-Evans с ожирением, вызванным диетой, которых содержали на высококалорийной диете. Согласно расчетам, эффективная доза (Т 17) примера, обеспечивающая изменение массы тела по сравнению с контролем, составила 0,13 мг/кг/день. Анализ изменения конституции тела показал, что снижение массы тела является результатом значительного снижения массы жира при дозах до 10 мг/кг(самая высокая исследованная доза). Согласно оценке, однократное ежедневное введение соединения примера 2 в течение 14 дней самкам крыс Sprague-Dawley, получавшим оланзапин в течение двух недель,способствует обеспечению значительного снижения массы жира по сравнению с контролями, получающими оланзапин. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или фармацевтически приемлемая соль такого соединения. 2. Соединение по п.1, имеющее формулу или фармацевтически приемлемая соль такого соединения. 3. Промежуточное соединение формулы 4. Применение соединения по п.1 или 2 в качестве терапевтического средства. 5. Применение соединения по п.1 или 2 для лечения расстройства, выбранного из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим агентом. 6. Применение соединения по п.1 или 2 в комбинации с антипсихотическим средством одновременного, раздельного или последовательного введения для лечения расстройства, выбранного из увеличения веса, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и возникшего в результате лечения увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим- 16015745 средством. 7. Применение соединения по п.1 или 2 для изготовления лекарственного средства для лечения расстройства, выбранного из расстройства пищевого поведения, связанного с чрезмерным потреблением пищи, ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством. 8. Применение соединения по любому из пп.1 или 2 для изготовления лекарственного средства для применения в комбинированной терапии для лечения расстройства, выбранного из увеличения веса,ожирения, шизофрении, когнитивных нарушений, связанных с шизофренией, злоупотребления психоактивными веществами или алкогольной зависимости, синдрома отмены курения и увеличения веса, наблюдаемого во время лечения атипичным антипсихотическим средством, причем указанное лекарственное средство применяют в сочетании с антипсихотическим средством путем одновременного, раздельного или последовательного введения.
МПК / Метки
МПК: C07D 401/12, A61P 25/00, C07D 207/38, A61K 31/4025
Метки: проявляющие, св1, отношении, активность, соединения
Код ссылки
<a href="https://eas.patents.su/18-15745-soedineniya-proyavlyayushhie-aktivnost-v-otnoshenii-sv1.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, проявляющие активность в отношении св1</a>
Предыдущий патент: Способ получения светлого нефтепродукта и устройство для осуществления способа
Следующий патент: Способ переработки бурового раствора на водной основе и/или образовавшегося при бурении шлама
Случайный патент: Способ конверсии углеводородного сырья с электролитическим извлечением галогенов