Нетоксичные для нервной ткани плазминоген-активирующие факторы для лечения инсульта
Номер патента: 13707
Опубликовано: 30.06.2010
Авторы: Зенген Вольфганг, Шлойнинг Вольф-Дитер, Зенген Мариола, Медкаф Роберт
Формула / Реферат
1. Применение активирующего плазминоген фактора для производства лекарственного средства для лечения инсульта в течение по меньшей мере 3 ч после его начала, где указанный активирующий плазминоген фактор не оказывает нейродегенеративного эффекта t-PA немутантного типа по данным сравнительных экспериментов на модели повреждения каиновой кислотой и модели для проверки поражения полосатого тела, индуцированного NMDA.
2. Применение по п.1, где нейродегенеративный эффект активирующего плазминоген фактора по меньшей мере в 100 раз ниже эффекта t-PA дикого типа.
3. Фармацевтическая композиция для лечения инсульта в течение по меньшей мере 3 ч после его начала, содержащая активирующий плазминоген фактор, где активирующий плазминоген фактор не оказывает нейродегенеративного эффекта t-PA немутантного типа по данным сравнительных экспериментов на модели повреждения каиновой кислотой и модели для проверки поражения полосатого тела, индуцированного NMDA.
Текст
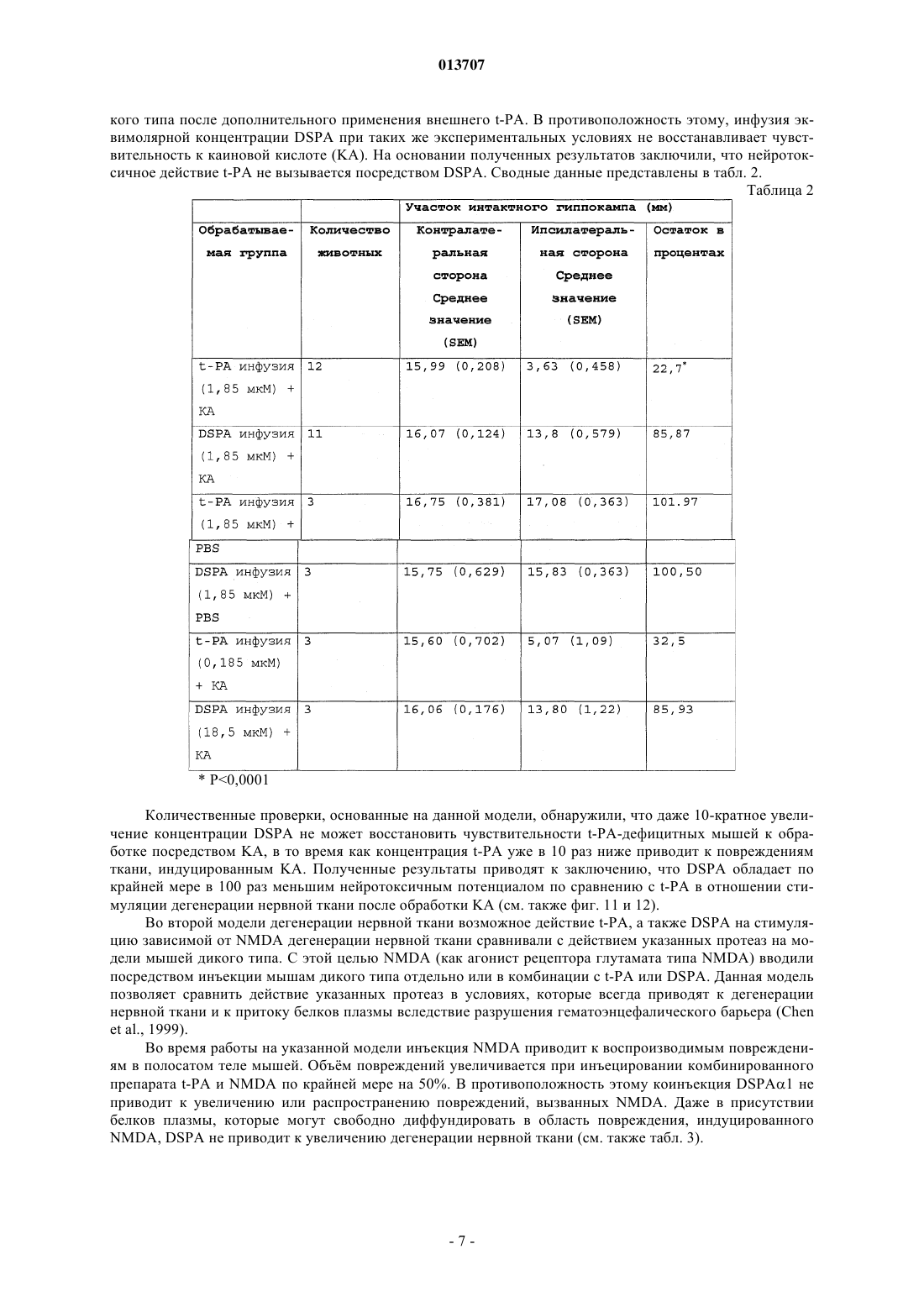
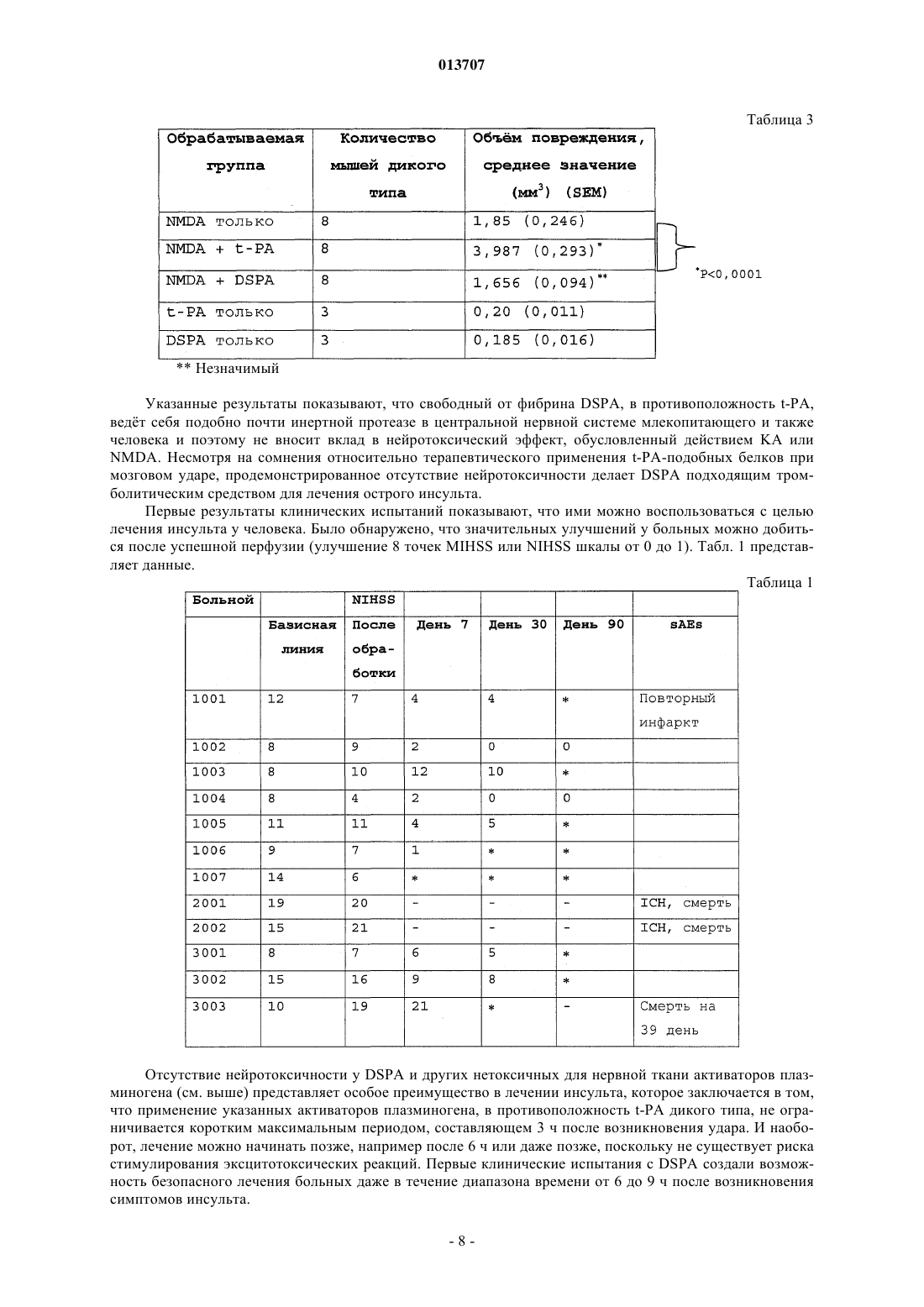
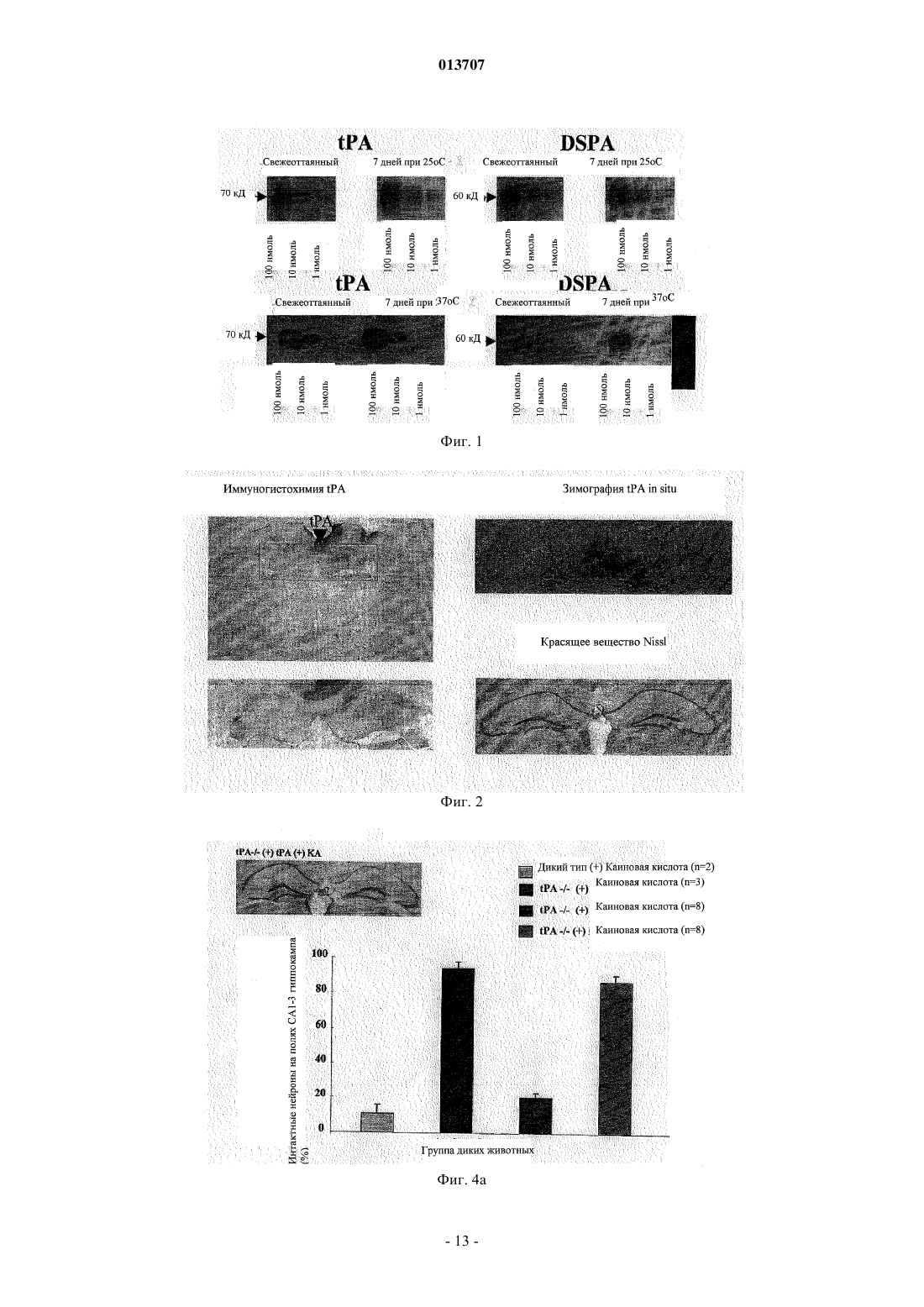
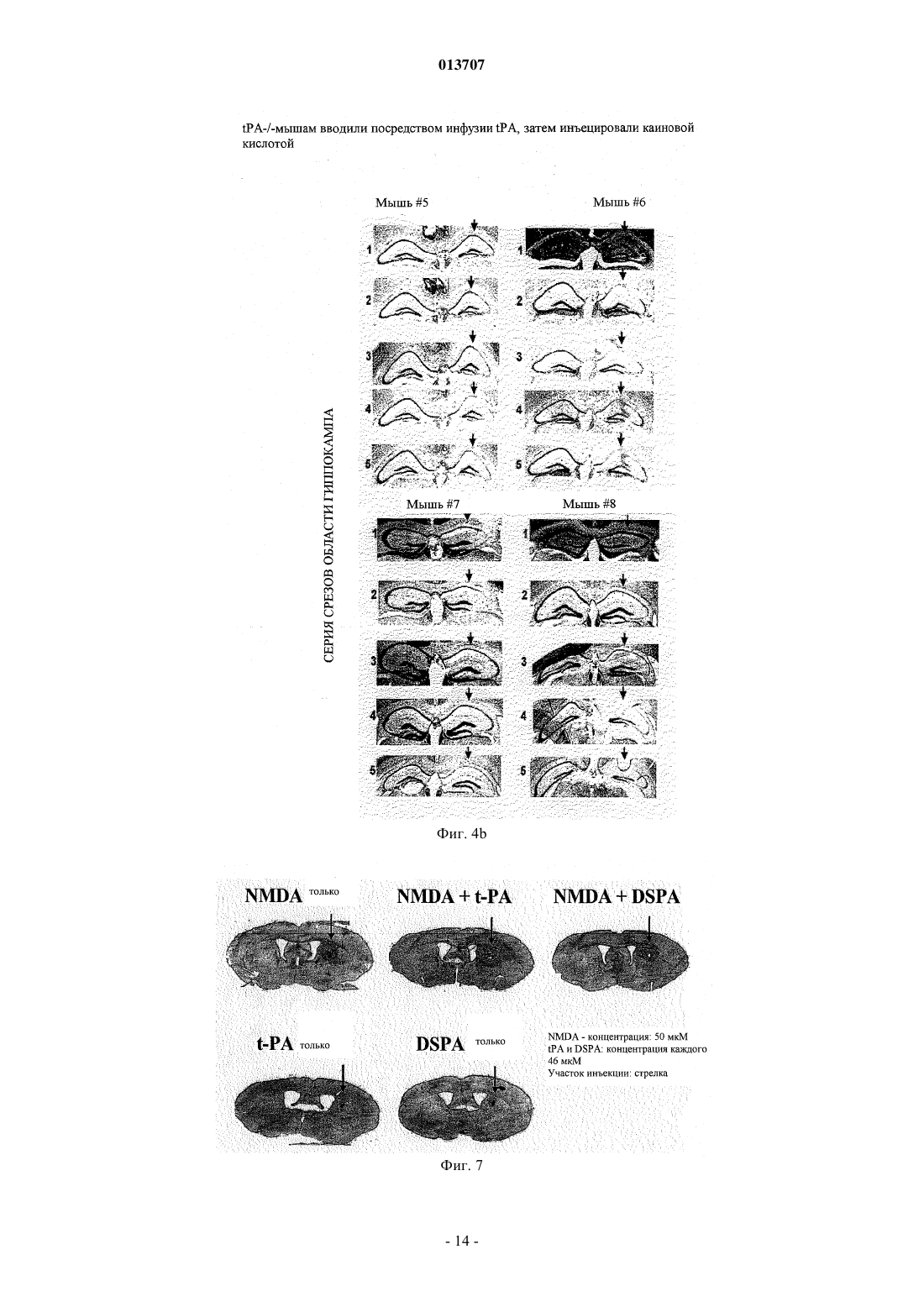
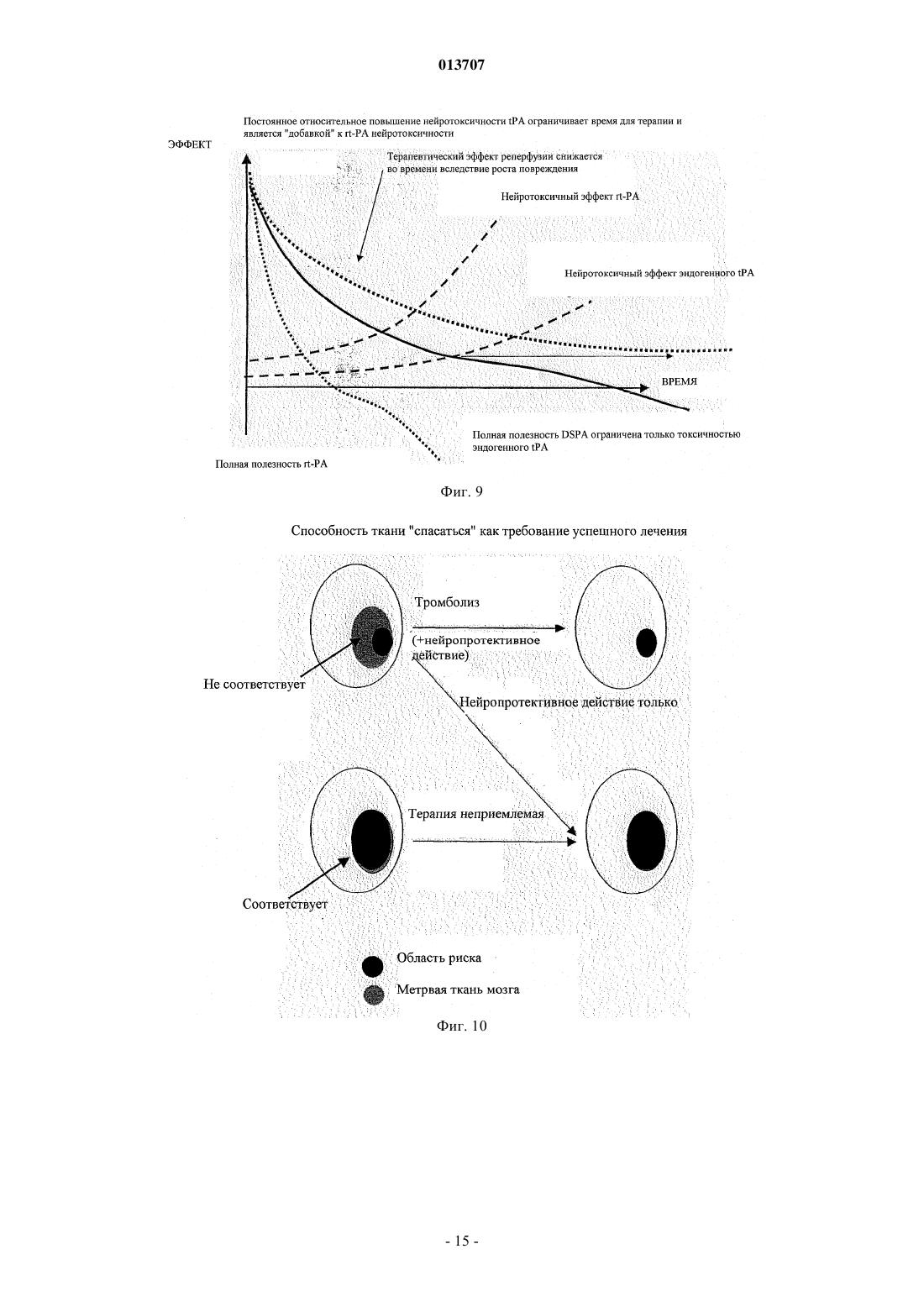
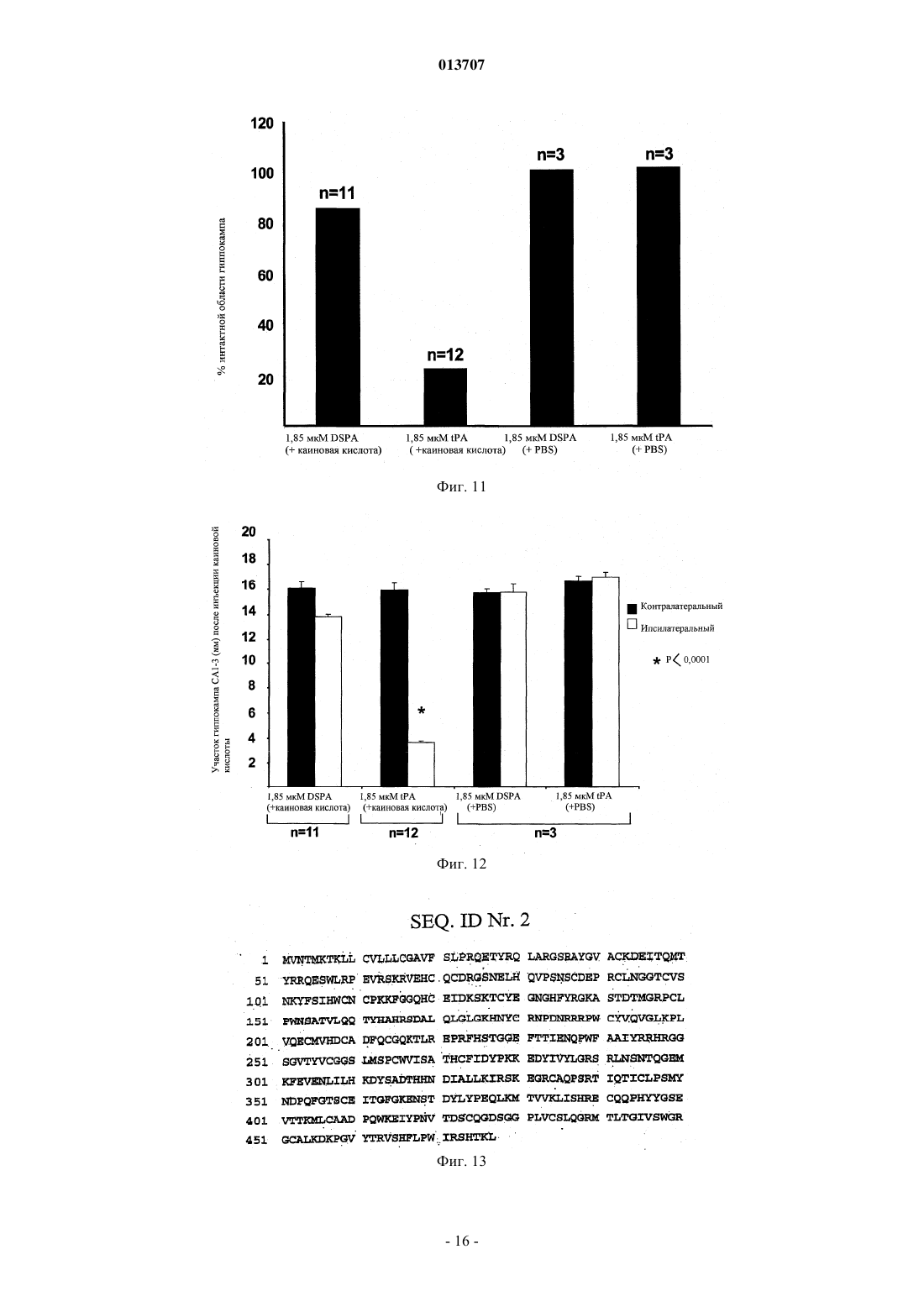
013707 Изобретение относится к терапевтическому применению нетоксичных для нервной ткани активаторов плазминогена, особенно из слюны Desmodus rotundus (DSPA), предпочтительно для лечения инсульта. Под термином "инсульт" суммируются различные клинические состояния, которые коррелируют друг с другом по клиническим симптомам. Согласно соответствующему патогенезу существует первое различие между указанными клиническими проявлениями при так называемом ишемическом инсульте и геморрагическом инсульте. Ишемические инсульты (ишемия) характеризуются ослаблением или прекращением кровообращения в головном мозге из-за отсутствия артериального кровоснабжения. Часто такое явление вызывается тромбозом артериосклеротического суженого сосуда или артерио-артериальной эмболией, соответственно кардиальной эмболией. Геморрагические инсульты обусловлены разрывом снабжающих головной мозг артерий, поврежднных в результате артериальной гипертонии. Однако только приблизительно 20% всех случаев мозговых инсультов приходится на геморрагические инсульты. Таким образом, наиболее важным является инсульт вследствие тромбоза сосудов. По сравнению с ишемией других тканей, ишемия нервной ткани в значительной степени сопровождается некрозом поражнных клеток. Более высокая распространнность некроза в нервной ткани может быть объяснена благодаря новому пониманию явления эксцитотоксичность, которая представляет собой сложный каскад из множества реакционных стадий. Каскад инициируется ишемическими нейронами вследствие отсутствия кислорода, которые затем мгновенно лишаются АТФ и деполяризуются. В результате повышается постсинаптическое высвобождение нейромедиатора глутамата, который активирует мембранносвязанные рецепторы глутамата, регулирующие функцию катионных каналов. Однако вследствие повышенного высвобождения глутамата рецепторы глутамата становятся сверхактивированными. Рецепторы глутамата регулируют функцию потенциалзависимых катионных каналов, которые открываются при связывании глутамата с рецептором. Это приводит к притоку Na+ и Са+ в клетку, нарушая в значительной степени Са+-зависимый клеточный метаболизм. Особенно активация Са+-зависимых ферментов катаболизма может быть причиной смерти (Lee, Jin-Mo et al., "The changing landscape of ischaemic brain injury mechanisms"; Dennis W. Zhol "Glutamate neurotoxicity and diseases of the nervous system"). Хотя механизм нейротоксичности, опосредованный глутаматом, вс ещ полностью не исследован,полагают, что глутамат в значительной степени способствует гибели нервной клетки после ишемии мозга (Jin-Mo Lee, et al.). Кроме защиты жизненно важных функций и стабилизации физиологического параметра, в терапии острой ишемии мозга приоритет принадлежит открытию просвета в закрытом сосуде. "Открытие" сосуда можно осуществлять различными способами. Простое механическое "открытие", как, например, РТСА после сердечного приступа, не привело до сих пор к удовлетворительным результатам. Только с успехами в области фибринолиза можно достичь приемлемого улучшения физического состояния больных. Улучшения можно достичь путм местной аппликации с помощью катетера (PROCAT, изучение с проурокиназой). Однако несмотря на первые положительные результаты, указанный способ вс ещ официально не признан в качестве фармацевтического лечения. Природный фибринолиз основан на протеолитической активности сериновой протеазы плазмина,который образуется из его неактивного предшественника посредством катализа (активации). Природная активация плазминогена катализируется активаторами плазминогена u-РА (активатор плазминогена урокиназного типа) и t-PA (тканевой активатор плазминогена), которые имеются в организме. В отличие отu-PA, t-PA образует так называемый активаторный комплекс вместе с фибрином и плазминогеном. Таким образом, каталитическая активность t-PA зависит от фибрина и повышается в его присутствии приблизительно в 550 раз. Кроме фибрина, фибриноген также может стимулировать t-РА-опосредованный катализ плазминогена до плазмина, хотя и в меньшей степени. В присутствии фибриногена активность tPA увеличивается только в 25 раз. Также продукты расщепления фибрина (продукты деградации фибрина (FDP стимулируют активность t-PA. Ранние попытки лечения острого инсульта тромболитическими средствами приходятся на 1950-ые годы. Первые обширные клинические испытания со стрептокиназой, фибринолитическим агентом из бета-гемолитического стрептококка, начались только в 1995 г. Вместе с плазминогеном стрептокиназа образует комплекс, который посредством катализа превращает другие молекулы плазминогена в плазмин. Терапия стрептокиназой имеет серьзные недостатки, так как стрептокиназа является бактериальной протеазой и поэтому она может вызывать аллергические реакции в организме. Кроме того, вследствие стрептококковой инфекции, вызывающей продукцию антител, у больного может развиваться так называемая стрептокиназная устойчивость, затрудняющая лечение. Кроме того, клинические испытания,проводимые в Европе (Multicenter Acute Stroke Trial of Europe (MAST-E), Multicenter Acute Stroke Trial ofItaly (MAST-I и Австралии (Australian Streptokinase Trial (AST, указывают на повышение риска смертности и риска внутримозгового кровотечения (внутримозговое кровоизлияние, ICH) после лечения больных стрептокиназой. Указанные испытания следовало закончить заблаговременно.-1 013707 В качестве альтернативы может быть применена урокиназа, также классический фибринолитический агент. В противоположность стрептокиназе, урокиназа не проявляет антигенных характеристик,поскольку она присутствует в различных тканях организма. Она является активатором плазминогена и не зависит от кофактора. Урокиназа продуцируется в культуре клеток почек. Большой опыт по терапии тромболитическими средствами накоплен в отношении активатора плазминогена тканевого типа, так называемого rt-PA (см. европейский патент ЕР 0093619, патент США 4766075), который продуцируется в рекомбинантных клетках хомячка. В 90-ые годы по всему миру были проведены клинические испытания по применению t-PA на остром инфаркте миокарда в качестве главного показателя, которые привели к отчасти непонятным и противоречивым результатам. В ходе так называемого Европейского исследования острого инсульта (ECASS) больных лечили внутривенно посредством rt-PA с интервалом времени 6 ч после появления симптомов инсульта. По истечении 90 дней уровень смертности, а также индекс Barthel проверяли в качестве показателя инвалидизации или независимой жизнеспособности больных. Значительного улучшения жизнеспособности не наблюдали, но наблюдали, хотя и незначительное, увеличение случаев смертности. Таким образом, можно заключить, что лечение больных, которое подбирается индивидуально в соответствии с их историей болезни, тромболитическим средством, rt-PA, немедленно после возникновения инсульта может быть целесообразным. Однако обычное применение rt-PA с интервалом времени 6 ч после возникновения удара не рекомендуется,поскольку использование в течение указанного интервала времени повышает риск внутримозгового кровоизлияния (ICH) (С. Lewandowski С and Wiliam Barsan, 2001: Treatment of Acute Stroke; in: Annals ofEmergency Medicine 37:2; S. 202 ff.). Лечение инсульта тромболитиками также было предметом клинического испытания, проводимого Национальным Институтом по исследованию неврологических нарушений и удара (National Institute ofNeurologic Disorder and Stroke) (так называемое испытание инсульта, проводимое NINDS посредством rtPA) в США. Указанное испытание было направлено на изучение эффекта лечения посредством rt-PA,вводимого внутривенным путм, в пределах только 3 ч после появления симптомов. Больных проверяли три месяца после лечения. Благодаря наблюдаемому положительному эффекту от указанного лечения в отношении жизнеспособности больных, лечение посредством rt-PA в пределах ограниченного времени из 3 ч было рекомендовано, хотя авторы обнаружили высокий риск возникновения ICH. С помощью двух следующих исследований (ECASS II Trial: Alteplase Thrombolysis for Acute Noninterventional Therapy in Ischaemic Stroke (ATLANTIS проверяли, может ли положительный эффект лечения посредством rt-PA в пределах 3 ч после появления инсульта быть повторен при лечении в пределах 6 ч времени. Однако на этот вопрос нельзя ответить утвердительно, поскольку не наблюдали улучшения клинических симптомов или какого-либо уменьшения случаев смертности. Высокий риск развития ICH оставался. Полученные, отчасти, противоречивые результаты привели к тому, что rt-PA можно применять с большой осторожностью. Уже в 1996 г. публикация Американской кардиологической ассоциации(American Heart Association) продемонстрировала скептическое отношение докторов относительно лечения инсульта тромболитическими средствами; в то же время такого скептицизма относитально применения фибринолитика в терапии инфаркта миокарда не существует (van Gijn J, MD, FRCP, 1996, Circulation 1996, 93:1616-1617). Рациональное объяснение скептическому отношению к указанной проблеме впервые было дано в кратком описании всех испытаний, проводимых в отношении инсульта, которое было опубликовано в 1997 г. (обновлено в марте 2001 г.). Согласно данному обзору, лечение тромболитиками (урокиназа,стрептокиназа, rt-PA или рекомбинантная урокиназа) в течение первых 10 дней после появления инсульта привело к высокому уровню смертности, в то время как общее количество умерших людей или инвалидизированных больных было снижено в случаях, когда тромболитики применяли в пределах 6 ч после возникновения удара. Указанный эффект был следствием, главным образом, ICH. Поэтому широкое применение тромболитика для лечения инсульта не рекомендовалось. Ранее такие результаты послужили поводом для саркастического утверждения некоторыми другими авторами, что больные после инсульта имеют выбор либо умереть, либо остаться инвалидами (SCRIP 1997:2265, 26). Однако до сих пор терапия посредством rt-PA представляет собой единственное лечение острой ишемии мозга, утвержднное Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) в США. Однако имеется органичение применения rt-PA в течение 3 ч после возникновения инсульта. Одобрение применения rt-PA было достигнуто в 1996 г. До этого, в 1995 г. появились первые сообщения об отрицательном побочном эффекте, обусловленном применением rt-PA, которые предоставили объяснение его драматического действия в случаях применения указанного тромболитика в лечении инсульта за пределами 3-часового интервала. Таким образом, глиальные макрофаги и нервные клетки гиппокампа продуцируют t-PA, который принимает участие в глутамат-опосредованной эксцитотоксичности. Такое заключение было сделано на основании сравнительного изучения, проводимого на мышах с дефицитом t-PA и мышах дикого типа, которым в гиппокамп вводили агонисты глутамата соответствен-2 013707 но. Мыши с недостаточностью t-PA проявили высокую устойчивость к внешнему (интратекальному) глутамату (Tsirka SE et al., Nature, Vol. 377, 1995, "Excitoxin-induced neuronal degeneration and seizure andmediated by tissue plasminogen activator"). Данные результаты были подтверждены в 1998 г., когда исследователю Wang et al. удалось доказать увеличение количества некротической нервной ткани в два раза у мышей с дефицитом t-PA, которым вводили t-PA внутривенно. Указанное отрицательное воздействие внешнего t-PA на мышей дикого типа составляло только приблизительно 33% (Wang et al., 1998, Nature,"Tissue plasminogen activator (t-PA) increases neuronal damage after focal cerebral ischaemia in wild type andt-PA deficient mice"). Дальнейшие результаты, касающиеся стимуляции эксцитотоксичности посредством t-PA, были опубликованы авторами Nicole et al. в начале 2001 г. (Nicole О., Docagne F Ali С; Margaill I; Carmeliet P;MacKenzie ET, Vivien D and Buisson A, 2001: The proteolytic activity of tissue-plasminogen activator enhances NMDA receptor-mediated signaling; in: Nat Med 7, 59-64). Им удалось доказать, что t-PA, высвобождаемый деполяризованными кортикальными нейронами, может взаимодействовать с так называемойNR1 субъединицей рецептора глутамата типа NMDA, что приводит к расщеплению NR1. РасщеплениеNR1 приводит к увеличению активности рецептора, что способствует большему повреждению ткани после применения агониста рецептора глутамата NMDA. Агонист NMDA вызывает эксцитотоксичность. Таким образом, t-PA проявляет нейротоксичное действие путм активации рецептора глутамата NMDA типа. Согласно следующей концепции, нейротоксичность t-PA является непрямым результатом превращения плазминогена в плазмин. Согласно данной модели, плазмин является эффектором нейротоксичности (Chen ZL and Strickland S, 1997: Neuronal Death in the hippocampus is promoted by plasmin-catalyseddegradation of laminin. Cell: 91, 917-925). Итоговые данные зависящего от времени нейротоксичного действия t-PA представлены на фиг. 9. Полученные данные свидетельствуют о повышенной токсичности рекомбинантного t-PA по сравнению с токсичностью эндогенного t-PA. Вероятно, повышенная токсичность рекомбинантного t-PA является следствием того, что rt-PA способен проникать в ткань в высоких концентрациях. Несмотря на нейротоксичный побочный эффект и увеличение смертных случаев, t-PA был утверждн FDA. Такое решение можно только объяснить отсутствием безопасных и эффективных альтернатив, таким образом, это решение является результатом весьма практичного анализа стоимости и эффективности. Поэтому потребность в безопасных терапевтических методах вс ещ существует. Однако если такие методы были вс же основаны на применении тромболитиков, в случае, если невозможно найти альтернативы тромболизу, проблему нейротоксичности следует учитывать (см., например, Wang et al. а.а.О.; Lewandowski and Barson 2001 а.а.О.). Поэтому дальнейшая проверка известных тромболитических средств, включая DSPA (Desmodus rotundus Plasminogen Activator), с целью разработки новых лекарственных препаратов для лечения инсульта была остановлена, хотя в принципе все тромболитические средства являются потенциально применимыми. Особенно для DSPA, ранее была отмечена его пригодность в случае данного медицинского показания (Medan P; Tatlisumak T; Takano K; Carano RAD; Hadley SJ; Fisher M: Thrombolysis with recombinantInternational Symposium on Thrombolic Therapy in Acute Ischaemic Stroke). DSPA является активатором плазминогена с высокой гомологией (сходство) по отношению к t-PA. Поэтому и вдобавок к разочарованию в связи с нейротоксичным побочным действием t-PA дальнейших ожидаемых результатов от DSPA,как подходящего лекарственного средства для лечения инсульта, не было получено. Вместо этого, современные стратегии, нацеленные на улучшение методов лечения тромболитическими средствами, основываются на применении тромболитического вещества не внутривенно, а внутриартериально через катетер, расположенный в прямой близости к тромбу. Первый опыт имеется с рекомбинантной урокиназой. Таким образом, вероятно, можно снизить необходимую дозу для тромболиза и к тому же отрицательные побочные эффекты. Однако такое применение требует больших технических расходов и не везде доступно. Кроме того, больной должен быть подготовлен ко времени для введения препарата. Время, однако, часто ограничено. Таким образом, подготовка предусматривает дополнительный риск. Теперь новые идеи связаны с антикоагулянтами, такими как гепарин, аспирин или анкрод, который является активным веществом яда малайской гремучей змеи. Однако результаты двух дальнейших клинических испытаний, проводимых с целью проверки действия гепарина (International Stroke Trial (IST)and Trial of ORG 10172 in Acute Stroke Treatment (TOAST), не показали значительного уменьшения уровня смертности или профилактики инсульта. Далее, новые методы лечения не концентрируют внимание ни на тромбе, ни на разжижении крови или противосвртывающей терапии, но направлены на повышение жизнеспособности клеток, поврежднных приостановкой кровоснабжения (международные публикации WO 01/51613 А 1 и WO 01/51614A1). Для достижения этого применяют антибиотики из группы хинонов, аминогликозиды или хлорамфеникол. С целью лечения инсульта полагают начать с применения цитихолина прямо после возникновения удара. В организме цитихолин расщепляется до цитидина и холина. Продукты расщепления образу-3 013707 ют часть нейронной клеточной мембраны и, таким образом, поддерживают регенерацию поврежднной ткани (патент США 5827832). Недавнее исследование, посвященное безопасным методам лечения, основывается на новых данных о том, что часть фатальных последствий инсульта только косвенно обусловлена остановкой кровоснабжения, но прямо связана с эксцитотоксичностью или нейротоксичностью, включающей сверхактивированные рецепторы глутамата. Данный эффект увеличивается посредством t-PA (см. выше). Поэтому идея заключается в том, чтобы снизить эксцитотоксичность путм применения так называемых нейропротекторов. Их можно использовать отдельно или в комбинации с фибринолитическими средствами, чтобы снизить до минимума нейротоксичные эффекты. Они могут привести к снижению эксцитотоксичности прямо, например, как в случае с антагонистом рецептора глутамата, или косвенно путм ингибирования потенциалзависимых натриевых или кальциевых каналов (Jin-Mo Lee et al. a.a.O.). Конкурентное ингибирование (антагонистическое действие) рецептора глутамата типа NMDA является возможным, например, 2-амино-5-фосфоновалератом (APV) или 2-амино-5-фосфоногептаноатом(АРН). Неконкурентное ингибирование может быть достигнуто, например, веществами, связывающимися с фенилциклидиновой стороной каналов. Такими веществами могут быть фенилциклидин, MK-801,декстрорфан или кетамин. До сих пор лечение нейропротекторами не имело ожидаемого успеха, возможно, из-за того, что нейропротекторы должны быть комбинированы с тромболитическими агентами для проявления защитного действия. Это применимо к другим веществам (см. также фиг. 10). Комбинация t-PA и нейропротективных агентов приводит только к ограниченному повреждению. Тем не менее, нейротоксичности фибринолитического агента, как такового, не избежать. Поэтому целью настоящего изобретения является разработка новой терапевтической концепции для лечения инсульта у человека. Согласно изобретению применение нетоксичных плазминогенактивирующих факторов предполагается, как обозначено в п.1 формулы изобретения, для терапевтического лечения инсульта. Другие благоприятные примеры использования являются предметом независимых пунктов формулы изобретения соответственно, а также других зависимых пунктов формулы изобретения. Основной идеей изобретения является использование активатора плазминогена при лечении инсульта, где зрелый фермент проявляет активность, которая избирательно повышается фибрином во много раз, а именно более чем в 650 раз. Применение активаторов плазминогена согласно изобретению основывается на следующих данных: вследствие тканевого повреждения в мозге, вызванного мозговым ударом, гематоэнцефалический барьер повреждается или разрушается. Таким образом, циркулирующий в крови фибриноген может проникнуть в нейронную ткань головного мозга. Здесь он активирует t-PA, который косвенно путм активации рецептора глутамата или плазминогена приводит к дальнейшему повреждению ткани. Для того чтобы избежать подобного действия, изобретение предлагает использовать активатор плазминогена, который является высокоизбирательным по отношению к фибрину и - как инверсия аргумента - проявляет сниженную способность к активации фибриногеном. Таким образом, активатор плазминогена не, или по сравнению с t-PA, по крайней мере, в значительно меньшей степени, активируется фибриногеном, проникающим из крови в нейронную ткань в результате повреждения гематоэнцефалического барьера, поскольку активатор t-PA фибрин не может проникнуть в нейронную ткань из-за его размера. Поэтому активаторы плазминогена, согласно изобретению, не являются токсичными для нервной ткани. Согласно предпочтительному аспекту изобретения используют нетоксичные активаторы плазминогена, которые содержат по крайней мере один элемент из так называемой триады зимогена. Сопоставимая триада, как известно, составляет каталитический центр сериновых протеаз семейства химотрипсина,состоящий из трх взаимодействующих аминокислот аспартата 194, гистидина 40 и серина 32. Однако эта триада не существует в t-PA, который также принадлежит к семейству химотрипсиноподобных сериновых протеаз. Однако известно, что направленный мутагенез нативного t-PA с целью введения по крайней мере одной из вышеуказанных аминокислот в подходящее положение приводит к снижению активности профермента (одна цепь t-PA) и повышению активности зрелого фермента (двойная цепь t-PA) в присутствии фибрина. Поэтому введение по крайней мере одной аминокислоты триады или аминокислоты с соответствующей функцией в триаде может повысить зимогенность t-PA (т.е. отношение между активностью зрелого фермента и активностью профермента). В результате специфичность фибрина повышается в значительной степени. Такой эффект имеет место вследствие конформационного взаимодействия между введнным аминокислотным остатком и/или аминокислотными остатками последовательности дикого типа. Известно, что мутагенез нативного t-PA, направленный на замещение Phe305 остатком His (F305H) и замещение Ala 292 остатком Ser (A292S), приводит к 20-кратному увеличению зимогенности, в то время как вариант F305H только уже приводит к 5-кратному повышению зимогенности (EL Madison, Koberegulatory Triad of Asp-His-Ser; Science: 262, 419-421). В присутствии фибрина указанные мутанты t-PA проявляют активность в 30000 раз выше (F305H) и 130000 раз выше (F305H, A292S) соответственно.-4 013707 Кроме того, указанные мутанты включают в себя замещение Arg275 на R275E с целью предотвращения расщепления связи плазмином на участке расщепления Arg275-Ile276, тем самым, препятствуя превращению одноцепочечный t-PA в двухцепочечную форму. Введение мутантного сайта R275E только приводит к 6900-кратному увеличению специфичности t-PA к фибрину (K. Tachias, Madison EL 1995: Variants of Tissue-type Plasminogen Activator Which Display Substantially Enhanced Stimulation by Fibrin, in:Journal of Biological Chemistry 270, 31: 18319-18322). Положения 305 и 292 в молекуле t-PA гомологичны положениям His40 и Ser32 известной триады химотрипсиновых сериновых протеаз. Путм соответствующих замещений, вводя гистидин или соответственно серин, указанные аминокислоты могут взаимодействовать с аспартатом 477 молекулы t-PA, что приводит к образованию функциональной триады в мутантах t-PA (Madison et al., 1993). Указанные мутанты t-PA могут быть использованы для лечения инсульта согласно изобретению,поскольку они не проявляют или, по сравнению с t-PA дикого типа, проявляют нейротоксичность в значительно меньшей степени благодаря повышенной специфичности указанных мутантов к фибрину. С целью раскрытия упомянутых выше мутантов t-PA F305H; F305H, A292S только или в комбинации сR275E, авторы включили в описание публикации Madison et al., (1993) и Tachias and Madison (1995) посредством ссылки. Увеличение специфичности активаторов плазминогена по отношению к фибрину может быть достигнуто иначе путм точечной мутации Asp194 (или аспартата в гомологичном положении). Активаторы плазминогена принадлежат к группе сериновых протеаз семейства химотрипсина и поэтому содержат консервативную аминокислоту Asp194, которая ответственна за стабильность каталитической активной конформации зрелых протеаз. Известно, что Asp194 взаимодействует с His40 в зимогенной форме сериновых протеаз. После того как зимоген активируется путм расщепления, данное специфическое взаимодействие нарушается, и боковая цепь Asp194 претерпевает вращение приблизительно на 170 с образованием нового солевого мостика с Ile16. Указанный солевой мостик вносит существенный вклад в поддержание стабильности оксианионного кармана каталитического центра зрелых сериновых протеаз. Он также присутствует в t-PA. Введение точечной мутации, заменяющей Asp194, на первый взгляд, препятствует образованию или соответственно стабильности каталитической конформации сериновых протеаз. Несмотря на это, мутированные активаторы плазминогена проявляют повышенную активность в присутствии их кофактора,фибрина, особенно по сравнению со зрелой формой дикого типа, что можно объяснить до некоторой степени тем, что взаимодействие с фибрином приводит к изменению конформации, стимулирующей каталитическую активность (L. Strandberg, Madison EL, 1995: Variants of Tissue-type Plasminogen Activatorwith Substantially Enhanced Response and Selectivity towards Fibrin co-factors, in: Journal of Biological Chemistry 270, 40: 2344-2349). В заключение, мутанты активаторов плазминогена с заменой Asp194 проявляют повышенную активность в присутствии фибрина, что делает возможным их использование согласно изобретению. В предпочтительном аспекте согласно изобретению используют мутант t-PA, у которого Asp194 заменяют глутаматом (D194E) или соответственно аспарагином (D194N). У таких мутантов t-PA активность снижается от 1 до 2000 раз в отсутствие фибрина, в то время как в присутствии фибрина активность повышается от 498000 до 1050000 раз. Указанные мутанты также могут включать в себя замещение Arg15 на R15E, которое предотвращает расщепление плазмином одноцепочечного t-РА у пептидной связи Arg15-Ile16, приводящее к двухцепочечной молекуле t-PA. Эта единственная мутация повышает активацию t-PA фибрином в 12000 раз. С целью раскрытия мутаций t-PA у положений 194 и 15, публикации Strandberg and Madison (1995) включены полностью в описание посредством ссылки. Повышения зависимости активаторов плазминогена от фибрина также можно достичь путм введения точечных мутаций в так называемую петлю, подвергаемую автолизу. Этот элемент имеется в трипсине; он также может быть обнаружен как гомологичная часть в сериновых протеазах и характеризуется тремя гидрофобными аминокислотами (Leu, Pro и Phe). Петля, подвергаемая автолизу, в молекулах активаторов плазминогена ответственна за взаимодействие с плазминогеном. Точечные мутации в данной области могут привести к тому, что белок-белковое взаимодействие между плазминогеном и активаторами плазминогена не может эффективно образовываться. Указанные мутации являются функционально значимыми только в отсутствие фибрина. Напротив, в присутствии фибрина обусловливают повышенную активность активаторов плазминогена (K. Song-Hua, Tachias K., Lamba D, Bode W, MadisonEL, 1997: Identification of a Hydrophobic exocite on Tissue Type Plasminogen Activator That Modulates Specificity for Plasminogen, in: Journal of Biological Chemistry 272; 3, 1811-1816). В предпочтительном аспекте точечные мутации t-PA находятся в положениях от 420 до 423. Если указанные остатки замещаются путм направленного мутагенеза, то зависимость t-PA от фибрина повышается вплоть до 61000 раз (K. Song-Hua et al.). Song-Hua et al. проверили точечные мутации L420A,L420E, S421G, S421E, P422A, P422G, P422E, F423A и F423E. Данные публикации полностью включены посредством ссылки для раскрытия применения согласно изобретению. Согласно следующему благоприятному аспекту используют модифицированный тканевой активатор плазминогена с аминокислотной последовательностью, соответствующей SEQ ID No. 1 (фиг. 13).-5 013707 Данный модифицированный t-PA отличается от t-PA дикого типа заменой гидрофобных аминокислот в положении от 420 до 423 в петле автолиза, которые являются следующими: His420, Asp421, Ala422 иCys423. Данный t-PA предпочтительно содержит фенилаланин в положении 194. Кроме того, положение 275 может быть занято глутаматом. Предпочтительно, когда положение 194 занято фенилаланином. Кроме того, модифицированную урокиназу можно применять согласно изобретению. Урокиназа согласно изобретению может содержать аминокислотную последовательность, соответствующую SEQ IDNo. 2 (фиг. 14), в которой гидрофобные аминокислоты автолитической петли заменены на Val420,Thr421, Asp422 и Ser423. Предпочтительно урокиназа имеет остатки Ile275 и Glu194. Данный мутант проявляет в сравнении с урокиназой дикого типа 500-кратное увеличение специфичности к фибрину. Оба мутанта - урокиназу, а также t-PA - анализировали посредством полуколичественного анализа и проявили повышенную специфичность к фибрину по сравнению с t-PA дикого типа. Активатор плазминогена (DSPA) из слюны обыкновенного вампира (Desmodus rotundus) также проявляет повышенную активность в присутствии фибрина, особенно 100000-кратное повышение. Таким образом, эти данные предпочтительно использовать согласно изобретению. Термин DSPA включает в себя четыре разные протеазы, которые выполняют важную для обыкновенного вампира функцию, а именно, увеличивают продолжительность кровотечения из ран (Cartwright, 1974). Указанные четыре протеазы (DSPA1, DSPA2, DSPA, DSPA) проявляют высокое сходство (гомология) друг с другом и с t-PA человека. Они также проявляют подобные физиологические активности,что подводит их под общепринятую классификацию под общим обозначением DSPA. DSPA раскрывают в европейском патенте ЕР 0352119 А 1 и патентах США 6008019 и 5830849, которые включены в текст полностью в виде ссылки с целью раскрытия. До сих пор DSPA являлась наиболее проанализированной из данной группы протеазой. Она имеет аминокислотную последовательность с гомологией выше 72% в сравнении с известной аминокислотной последовательностью t-PA человека (Kratschmar et al., 1991). Однако имеется два существенных различия между t-PA и DSPA. Во-первых, все DSPA имеют полную протеазную активность, проявляемую одноцепочечной молекулой, поскольку она, в противоположность t-PA, не превращается в двухцепочечную молекулу (Gardell et al., 1989; Kratzschmar et al., 1991). Во-вторых, каталитическая активность DSPA почти абсолютно зависит от фибрина (Gardell et al., 1989; Bringmann et al., 1995; Toschie et al., 1998). Например,активность DSPA увеличивается в 100000 раз в присутствии фибрина, в то время как активность t-PA увеличивается только в 550 раз. В противоположность, активность DSPA в меньшей степени индуцируется фибриногеном, так как она увеличивается только в 7-9 раз (Bringmann et al., 1995). В заключение,DSPA в большей степени зависит от фибрина и является намного более специфичным по отношению к фибрину, чем t-PA дикого типа, который активируется фибрином только в 550 раз. Учитывая фибринолитические свойства и значительное сходство с t-PA, DSPA рассматривают в качестве интересного кандидата для разработки тромболитического средства. Несмотря на это, терапевтическое применение DSPA в качестве тромболитического средства ранее было ограничено лечением инфаркта миокарда, потому что вследствие вклада t-PA в индуцированную глутаматом нейротоксичность необоснованных надежд не существует, что активатор плазминогена, который является родственным tPA, с достаточным основанием может быть использован для лечения острого инсульта. Неожиданно было обнаружено, что DSPA не проявляет нейротоксичного действия, даже хотя он и обладает высоким сходством (гомология) с t-PA и даже хотя физиологические эффекты молекул сравнимы в большей степени. Представленное выше заключение приводит к мысли, что после всего сказанногоDSPA можно успешно использовать в качестве тромболитического агента для терапии инсульта, не вызывая риска повреждения нервной ткани. Особенно заслуживающим внимания является тот факт, чтоDSPA можно применять позже 3 ч после возникновения симптомов инсульта. Следующий вариант настоящего изобретения, который вытекает из представленных выше данных,заключается в выборе направления модифицировать или продуцировать активаторы плазминогена такими, чтобы они имели существенные характеристики DSPA, особенно отсутствие нейротоксичности,свойственной t-PA. Основанием для такого варианта является исследованная взаимосвязь между структурой и биохимическими эффектами, которая позволяет трансформировать нейротоксичные активаторы плазминогена в нетоксичные для нервной ткани активаторы плазминогена и, тем самым, продуцировать нетоксичные для нервной ткани активаторы плазминогена на основе известных или недавно выявленных нейротоксичных активаторов плазминогена. Новый вариант основан на сравнительных проверках in vivo нейродегенеративного действия t-PA, с одной стороны, и DSPA, с другой стороны, которые осуществляют с помощью так называемой модели каиновой кислоты и модели для проверки поражения полосатого тела, индуцированного NMDA. Модель каиновой кислоты (также модель повреждения каиновой кислотой) основана на стимуляции нейротоксичного глутаматного каскада путм внешнего применения каиновой кислоты (KA) в качестве агониста рецептора глутамата типа каиновой кислоты (тип KA) и NMDA и АМРА глутаматных рецепторов. Используя в качестве экспериментальной модели t-PA-дефицитных мышей, можно показать,что чувствительность лабораторных животных к каиновой кислоте только достигает уровня мышей ди-6 013707 кого типа после дополнительного применения внешнего t-PA. В противоположность этому, инфузия эквимолярной концентрации DSPA при таких же экспериментальных условиях не восстанавливает чувствительность к каиновой кислоте (KA). На основании полученных результатов заключили, что нейротоксичное действие t-PA не вызывается посредством DSPA. Сводные данные представлены в табл. 2. Таблица 2 Р 0,0001 Количественные проверки, основанные на данной модели, обнаружили, что даже 10-кратное увеличение концентрации DSPA не может восстановить чувствительности t-РА-дефицитных мышей к обработке посредством KA, в то время как концентрация t-PA уже в 10 раз ниже приводит к повреждениям ткани, индуцированным KA. Полученные результаты приводят к заключению, что DSPA обладает по крайней мере в 100 раз меньшим нейротоксичным потенциалом по сравнению с t-PA в отношении стимуляции дегенерации нервной ткани после обработки KA (см. также фиг. 11 и 12). Во второй модели дегенерации нервной ткани возможное действие t-PA, а также DSPA на стимуляцию зависимой от NMDA дегенерации нервной ткани сравнивали с действием указанных протеаз на модели мышей дикого типа. С этой целью NMDA (как агонист рецептора глутамата типа NMDA) вводили посредством инъекции мышам дикого типа отдельно или в комбинации с t-PA или DSPA. Данная модель позволяет сравнить действие указанных протеаз в условиях, которые всегда приводят к дегенерации нервной ткани и к притоку белков плазмы вследствие разрушения гематоэнцефалического барьера (Chenet al., 1999). Во время работы на указанной модели инъекция NMDA приводит к воспроизводимым повреждениям в полосатом теле мышей. Объм повреждений увеличивается при инъецировании комбинированного препарата t-PA и NMDA по крайней мере на 50%. В противоположность этому коинъекция DSPA1 не приводит к увеличению или распространению повреждений, вызванных NMDA. Даже в присутствии белков плазмы, которые могут свободно диффундировать в область повреждения, индуцированногоNMDA, DSPA не приводит к увеличению дегенерации нервной ткани (см. также табл. 3). Незначимый Указанные результаты показывают, что свободный от фибрина DSPA, в противоположность t-PA,ведт себя подобно почти инертной протеазе в центральной нервной системе млекопитающего и также человека и поэтому не вносит вклад в нейротоксический эффект, обусловленный действием KA илиNMDA. Несмотря на сомнения относительно терапевтического применения t-PA-подобных белков при мозговом ударе, продемонстрированное отсутствие нейротоксичности делает DSPA подходящим тромболитическим средством для лечения острого инсульта. Первые результаты клинических испытаний показывают, что ими можно воспользоваться с целью лечения инсульта у человека. Было обнаружено, что значительных улучшений у больных можно добиться после успешной перфузии (улучшение 8 точек MIHSS или NIHSS шкалы от 0 до 1). Табл. 1 представляет данные. Таблица 1 Отсутствие нейротоксичности у DSPA и других нетоксичных для нервной ткани активаторов плазминогена (см. выше) представляет особое преимущество в лечении инсульта, которое заключается в том,что применение указанных активаторов плазминогена, в противоположность t-PA дикого типа, не ограничивается коротким максимальным периодом, составляющем 3 ч после возникновения удара. И наоборот, лечение можно начинать позже, например после 6 ч или даже позже, поскольку не существует риска стимулирования эксцитотоксических реакций. Первые клинические испытания с DSPA создали возможность безопасного лечения больных даже в течение диапазона времени от 6 до 9 ч после возникновения симптомов инсульта.-8 013707 Данный вариант неограниченного временем лечения не токсичными для нервной ткани активаторами представляет особую важность, поскольку он позволяет в течение первого времени лечить больных с симптомами острого инсульта безопасно даже в тех случаях, когда установление диагноза задерживается или начальный момент удара трудно определить с достаточной уверенностью. На предыдущем уровне техники указанная группа больных была не допущена до тромболитической терапии активаторами плазминогена из-за риска неблагоприятной оценки. Следовательно, существенное противопоказание для наджного применения тромболитического средства в случаях инсульта устраняется.DSPA, а также другие нетоксичные для нервной ткани активаторы плазминогена не проявляют побочных эффектов, выраженных в повреждении ткани. Однако их целесообразно применять в комбинации с нейропротективным агентом для лечения инсульта с целью ограничения тканевых повреждений, индуцированных имеющимся в организме человека глутаматом. Для этого могут быть применены нейропротективные агенты, ингибирующие рецептор глутамата конкурентно или неконкурентно. Применимыми для этого комбинациями являются, например, комбинации с известными ингибиторами рецепторов глутамата типа NMDA, типа каиновой кислоты или типа хисквалата, например, APV, APH, фенциклидин,MK-801, декстрорфан или кетамин. Другая комбинация с катионами может быть благоприятной, так как катионы, особенно Zn-ионы,блокируют катионный канал, регулируемый рецептором глутамата, и поэтому могут снижать нейротоксичные эффекты. В следующем благоприятном аспекте, не токсичные для нервной ткани активаторы плазминогена могут быть комбинированы по крайней мере с одним другим терапевтическим агентом или с фармацевтически приемлемым носителем. Комбинация с терапевтическим агентом, который способствует уменьшению тканевого повреждения путм оживления клеток, является особенно предпочтительной, поскольку она вносит вклад в регенерацию уже поврежднной ткани или служит для предотвращения дальнейших случаев удара. Благоприятными примерами являются комбинации с антибиотиками, такими как хиноны, противосвртывающими средствами, такими как гепарин или гирудин, а также с цитихолином или ацетилсалициловой кислотой. Комбинация по крайней мере с одним ингибитором тромбина также может быть благоприятной. Предпочтительно тромбомодулин и аналоги тромбомодулина, аналогичные, например, солулину, триабину или паллидипину, могут быть использованы. Следующие комбинации с противовоспалительными веществами являются благоприятными, поскольку они влияют на инфильтрацию лейкоцитами. Методы сравнительной проверки t-PA и DSPA. 1. Животные. Мыши дикого типа (с 57/Black 6) и t-PA-дефицитные мыши (t-РА-/-мыши) (с 57/Black 6) (Carmeliet etal., 1994) предоставлены Dr. Peter Carmeliet, Leuven, Belgium. 2. Экстракция белка из ткани головного мозга. Оценку протеолитической активности в ткани мозга после инфузии либо t-PA, либо DSPA1 осуществляли посредством зимографического анализа (Granelli-Piperno and Reich, 1974). После проведения инфузии в гиппокамп мышей в течение периода времени семь дней мышей анестезировали, затем перфузией транскардиально вводили PBS и мозги удаляли. Область гиппокампа удаляли, переносили в пробирки Эппендорфа и инкубировали в равном объме (мас./об.) (приблизительно 30-50 мкм) 0,5% NP-40 буфера для лизиса, не содержащего протеазные ингибиторы (0,5% NP-40, 10 мМ трис-HCl рН 7,4, 10 мМNaCl, 3 мМ MgCl2, 1 мМ EDTA). Экстракты мозга гомогенизировали с помощью ручного стеклянного гомогенизатора и оставляли на льду в течение 30 мин. Затем образцы центрифугировали и супернатант удаляли. Количество имеющихся белков определяли (Bio-Rad-reagent). 3. Зимографический анализ протеаз. Протеолитическую активность в образцах и экстрактах ткани мозга определяли посредством зимографического анализа согласно методу Granelli, Piperno and Reich (1974). Образцы с рекомбинантными белками (вплоть до 100 нМ) или экстрактами ткани мозга (20 мкг) подвергали электрофорезу в (10%) ПААГ (SDS-PAGE) при невосстанавливающих условиях. Гели удаляли с пластин, промывали 1% тритоном X 100 в течение 2 ч и накладывали на агарозный гель, содержащий полимеризованный фибриноген и плазминоген (Granelli, Piperno and Reich, 1974). Гели инкубировали при 37 С в увлажннной камере до появления зон протеолиза. 4. Инфузия t-PA, DSPA внутрь гиппокампа и последующая инъекция каиновой кислоты. Модель повреждения каиновой кислотой была основана на исследованиях Tsirka et al. (1995). Животных инъецировали внутрибрюшинно (i.p.) атропином (4 мг/кг) и затем анестезировали посредствомi.p. инъекции пентобарбитола натрия (70 мг/кг). Потом мышей помещали в стереотаксическую рамку и между лопатками мышам подкожно имплантировали микроосмотический насос (Alzet model 1007D, Alzet CA. USA), содержащий 100 мкл либо PBS, либо рекомбинантный t-PA человека (0,12 мг/мл, 1,85 мкМ) или DSPA1 (1,85 мкМ). Насосы соединяли посредством стерильных трубок с канюлей в мозге и вставляли сквозь отверстие, сделанное в черепе трепанационным сверлом, в месте, координаты которого были: брегма - 2,5 мм, медиолатеральная - 0,5 мм и направленная вперд - 1,6 мм, чтобы ввести жидкость-9 013707 близко к середине. Канюлю фиксировали в желаемом положении и с помощью насосов вливали соответствующие растворы со скоростью 0,5 мкл/ч в течение всего 7 дней. Через два дня после инфузии протеаз мышей вновь анестезировали и их вновь помещали в стереотаксическую рамку. Потом 1,5 нмоль каиновой кислоты (KA) в 0,3 мкл PBS вводили посредством инъекции с одной стороны гиппокампа. Координаты были: брегма - 2,5 мм, медиолатеральная - 1,7 мм и направленная вперд - 1,6 мм. Эксайтотоксин (KA) был доставлен в течение 30 с. После обработки каиновой кислотой инъекционную иглу оставляли при тех же координатах в течение других 2 мин для предотвращения оттока жидкости. 5. Процедура обработки головного мозга. Через пять дней после инъекции KA, животных анестезировали и посредством перфузии вводили 30 мл PBS, затем 70 мл 4% раствора параформальдегида, фиксировали в том же фиксаже, инкубировали в 30% сахарозе в течение 24 ч. Венечные срезы (40 мкм) мозга приготавливали на охлаждающем микротоме и либо прокрашивали контрастным красителем тионином (BDH, Australia) , либо обрабатывали для иммуногистохимической проверки, как описано ниже. 6. Количественная оценка потери нервной ткани в гиппокампе. Количественную оценку потери нервной ткани в СА 1-СА 3 подполях гиппокампа осуществляли, как описано ранее (Tsirka et al., 1995; Tsirka et al., 1996). Пять последовательных частей дорсального гиппокампа от всех обрабатываемых групп приготавливали, заботясь о том, что части действительно содержали зону СА-инъекции и поврежднную область. Подполя гиппокампа (СА 1-СА 3) у этих срезов отслеживали по рисункам гиппокампа, сделанным посредством аппарата камера-люцида. Все участки подполей измеряли путм сравнения с 1 мм нормами, локализированными при таком же увеличении. Участки ткани с жизнеспособными пирамидальными нейронами (имеющие нормальную морфологию) и участки ткани, лишнные нейронов (клетки не присутствуют, тионином не прокрашиваются) определяли. Размеры участков, представляющих интактные нейроны, и участков с потерянными нейронами в пределах каждого подполя гиппокампа усредняли на протяжении срезов, и стандартные отклонения определяли. 7. Интрастриарные эксцитотоксичные повреждения, обусловленные введением NMDA с t-PA илиDSPA или без активатора плазминогена. Мышей дикого типа (с 57/Black 6) анестезировали и помещали в стереотаксическую рамку (см. выше). Затем мышей инъецировали с одной стороны посредством 50 нмоль NMDA в левый слой, инъецировали отдельно или в комбинации либо с 46 мкМ rt-РА, либо 46 мкМ DSPA1. В качестве контроля также вводили отдельно t-PA и DSPA (оба при концентрации 46 мкМ). Координаты инъекции были: брегма - 0,4 мм, медиолатеральная - 2,0 мм и направленная вперд - 2,5 мм. Растворы (1 мкл общего объма для всех обработок) подавали в течение периода 5 мин со скоростью 0,2 мкл/мин, и иглу оставляли в том же месте в течение ещ 2 мин после инъецирования, чтобы снизить до минимума отток жидкости. Через 24 ч мышей анестезировали и посредством перфузии вводили 30 мл PBS, далее 70 мл 4% раствора формальдегида, фиксировали в том же фиксаже в течение 24 ч с последующей инкубацией в 30% сахарозе в течение 24 ч. Затем мозги разрезали (40 мкм) на охлаждающем микротоме и помещали на покрытые желатином стеклянные предметные сткла. 8. Количественная оценка объма повреждения после инъекции NMDA. Количественную оценку объма повреждения полосатого тела осуществляли методом, описаннымCallaway et al. (2000). Последовательные венечные срезы, перекрывающие поврежднные области, приготовляли. Поврежднные области делали видимыми с помощью метода Callaway и объм повреждения оценивали количественно путм использования миниатюрного вычислительного устройства с формирователем изображения (MCID, Imaging Research Inc., Brock University, Ontario, Canada). 9. Иммуногистохимия. Иммуногистохимические исследования проводили обычными способами. Венечные срезы погружали в раствор 3% H2O2 и 10% метанола в течение 5 мин с последующей инкубацией в 5% нормальной козьей сыворотке в течение 60 мин. Срезы инкубировали в течение ночи либо с анти-GFPA антителом(Schering AG, Berlin). После отмывки срезы инкубировали с соответствующими биотинилированными вторичными антителами (Vector Laboratories, Burlingame, CA, USA). Затем следовала конечная инкубация с комплексом авидин/биотин (Vector Laboratories, Burlingame, CA, USA) в течение 60 мин до визуализации с 3,3-диаминбебсидином/0,03% H2O2. Затем срезы накладывали на покрытые желатином предметные сткла, сушили, обезвоживали и покрывали покровными стклами с раствором полимера нафталина в толуоле. В. Результаты. 1. Введнный посредством инфузии t-PA или DSPA диспергирует в гиппокампе t-PA-/-мышей и сохраняет протеолитическую активность. Первоначальные эксперименты были предприняты для того, чтобы подтвердить, что как DSPA, так и t-PA сохраняют их протеолитическую активность в течение периода инфузии 7 дней. К концу этого- 10013707 периода аликвоты t-PA и DSPA (100 нмоль) инкубировали при 37 С и при 30 С в течение 7 дней на водяной бане. Для того чтобы определить протеолитическую активность, 5-кратно последовательно разведнные пробы подвергали электрофорезу SPS-PAGE при невосстанавливающих условиях и протеолитическую активность оценивали посредством зимографического анализа. Аликвоту t-PA и DSPA, которые держали замороженными в течение периода 7 дней, использовали в качестве контроля. Как видно из фиг. 1, существует только минорная потеря активности DSPA или t-PA при инкубации либо при 30 С, либо при 37 С в течение указанного периода времени. 2. Активность t-PA и DSPA восстанавливается в экстрактах гиппокампа, приготовленных из мозга tPA-/-мышей после инфузии. Вначале следовало подтвердить, что введнные посредством инфузии протеазы присутствовали в мозге животных, подвергаемых инфузии, и также сохраняли их протеолитическую активность, находясь в указанном отделе. Для того чтобы адресоваться к этой точке, t-PA-/-мышам вводили посредством инфузии либо t-PA, либо DSPA в течение семи дней (см. выше). Затем мышам посредством инфузии вводили PBS и мозг удаляли. Ипсилатеральную и контралатеральную области гиппокампа изолировали, а также область мозжечка (взятая как отрицательный контроль). Образцы тканей (20 мкг) подвергали электрофорезу SDS-PAGE и зимографическому анализу согласно описанию в разделе методы. Как можно видеть из фиг. 2, активности t-PA и DSPA определялись в ипсилатеральной области гиппокампа, в то время как некоторое количество активности определялось на контралатеральной стороне гиппокампа. Полученные данные указывают на то, что введнные инфузией протеазы не только сохраняют их активность в мозге, но также проникают в область гиппокампа. В качестве контроля, никакой активности не обнаружили в экстракте, приготовленном из мозжечка. 3. Оценка DSPA иммуногистохимическим анализом. Для того чтобы подтвердить, что DSPA действительно проникает в область гиппокампа, венечные срезы мозга у t-PA-/-мышей анализировали иммуногистохимически после инфузии DSPA. DSPA-антиген обнаруживали в области гиппокампа с наиболее заметным окрашиванием в области участка инфузии. Полученные данные подтверждают, что введнный посредством инфузии DSPA является растворимым и действительно присутствует в гиппокампе. 4. Инфузия DSPA не восстанавливает опосредованную каиновой кислотой дегенерацию нервной ткани in vivo.t-PA-/-мыши характеризуются устойчивостью к каиновой кислоте (KA), опосредующей дегенерацию нервной ткани. Однако инфузия rt-PA в гиппокамп полностью восстанавливает чувствительность кKA-опосредованному повреждению. Для того чтобы определить, можно ли заменить DSPA на t-PA в данной модели, t-PA-/-мышам вводили посредством инфузии в гиппокамп либо t-PA, либо DSPA, используя миниосмотический насос. Для обеих групп 12 мышей тестировали. Через 2 дня животных инъецировали каиновой кислотой и оставляли восстанавливаться. Через 5 дней животных убивали и мозг удаляли и обрабатывали (см. выше). В качестве контроля t-PA-/-мышам также вводили посредством инфузии PBS до обработки KA (N=3). Венечные срезы мозга приготавливали и нейроны обнаруживали окрашиванием Nissl. Как показано на фиг. 4, t-РА-/-мыши, которым посредством инфузии вводили PBS, оказались устойчивыми к последующему введению KA. Однако инфузия рекомбинантным t-PA восстановила чувствительность к обработке посредством KA. В противоположность этому, инфузия такой же концентрации DSPA в область гиппокампа не изменила чувствительность животных к KA. Количественный анализ результатов был основан на данных, полученных от 12 мышей в каждой группе. У 2 из 12 мышей, которым вводили посредством инфузии DSPA, наблюдали незначительную степень дегенерации нервной ткани. Причина такого результата неясна и, возможно, не связана с присутствием DSPA. Объединнные данные учитывают указанный минорный эффект, который наблюдали в случае этих 2 животных. Все 12 мышей, обработанных t-PA, оказались чувствительными к обработкеKA. Полученные результаты показывают, что в случае инфузии t-PA или DSPA1 в эквимолярных концентрациях только введение t-PA привело к восстановлению восприимчивости к дегенерации нервной ткани, вызванной KA. 5. Инфузия DSPA не приводит к активации микроглии. Восстановление у t-PA-/-мышей восприимчивости к KA, вызванное инфузией t-PA, также приводит к активации микроглии (Rogove et al., 1999). Для того чтобы оценить степень активации микроглии после инфузии t-PA или DSPA и последующей обработки посредством KA, венечные срезы мозга мышей подвергали иммуногистохимическому окрашиванию для активированных клеток микроглии, используя Мас-1 антитело. Восстановление восприимчивости к KA после инфузии t-PA привело к чткому увеличению Мас-1 положительных клеток. Такой результат не наблюдали у мышей, которым вводили DSPA посредством инфузии. Следовательно, присутствие DSPA не приводит к активации клеток микроглии после обработки KA. 6. Титрование DSPA и t-PA в области гиппокампа мышей. Концентрация t-PA, применяемая для инфузии, основана на концентрации, описанной Tsirka et al.(1995) (100 мкл 0,12 мг/мл [1,85 мкМ]). Эксперименты, в которых повреждение ткани было вызвано об- 11013707 работкой KA, повторяли с использованием концентрации t-PA в 10 раз ниже (0,185 мкМ) и концентрацииDSPA в 10 раз выше (18,5 мкМ). Низкая концентрация t-PA была способна восстановить чувствительность к обработке KA (п=3). Интерес привлекли данные, что инфузия DSPA при повышенной в 10 раз концентрации вызвала незначительную потерю нейронов после обработки KA. Полученные данные показывают, что DSPA не приводит к повышению чувствительности к KA. 7. Действие t-PA и DSPA на NMDA-зависимую дегенерацию нервной ткани у мышей дикого типа. Действие t-PA и DSPA также проверяли на модели дегенерации нервной ткани у мышей дикого типа. Инъекция t-PA в полосатое тело данных мышей, вероятно, привела к усилению нейродегенеративных эффектов, вызванных аналогом глутамата NMDA (Nicole et al., 2001).NMDA вводили в стриарную область мозга мышей дикого типа в присутствии t-PA или DSPA (каждый 46 мкМ) в общем объме 1 мкл. После 24 ч мозг удаляли и размер повреждений оценивали количественно согласно методу Callaway (Callaway et al., 2000) (см. выше). Как видно из фиг. 7, инъекцияNMDA только вызвала воспроизводимое повреждение у всех обработанных мышей (N=4). В случаях,когда t-PA и DSPA применяли вместе, размер повреждений увеличивался приблизительно на 50%(Р 0,01, n=4). В противоположность этому, коинъекция NMDA и такой же концентрации DSPA не привела к увеличению размера повреждения по сравнению с NMDA только. Инъекция t-PA или DSPA только не привела к определяемой дегенерации нервной ткани. Отсутствие эффекта при введении t-PA только находится в соответствии с результатами, полученными Nicole etal. (2001). Полученные данные показывают, что присутствие DSPA не повышает дегенерацию нервной ткани даже во время нейродегенеративного события. Для того чтобы подтвердить, что инъекция DSPA действительно распространяется в область гиппокампа, иммуногистохимический анализ осуществляли на венечных срезах путм использования антитела к DSPA. Проверка показала, что DSPA действительно проникает в стриарную область. Кинетический анализ активации плазминогена с помощью непрямого хромогенного теста. Непрямые хромогенные тесты активности t-PA осуществляли с помощью субстрата Lysплазминогена (American Diagnostica) и спектроцима PL (American Diagnostica) согласно Madison E.L.,Goldsmith E.J., Gerard R.D., Gething M.-J., Sambrook J.F. (1989) Nature 339 721-724; Madison E.L.O., Goldsmith E.J., Gething M.J., Sambrook J.F. and Bassel-Duby R.S. (1990) Proc. Natl. Acad. Sci. U.S.A 87, 35303533, а также Madison E.L., Goldsmith E.J., Gething M.-J., Sambrook J.F. и Gerard R.D. (1990) J. Biol. Chem. 265, 21423-21426. Тесты выполняли как в присутствии, так и в отсутствие кофактора DESAFIB (AmericanDiagnostica). DESAFIB представляет собой препарат растворимых мономеров фибрина, полученных путм расщепления высокоочищенного фибриногена человека протеазой батроксобин. Батроксобин расщепляет связь Arg16-Gly17 в А-цепи фибриногена и, тем самым, высвобождает фибринопептид А. Полученный дес-АА-фибриноген, представляющий собой мономеры фибрина 1, является растворимым в отсутствие пептида Gly-Pro-Arg-Pro. Концентрация Lys-плазминогена варьировала от 0,0125 до 0,2 мкМ в присутствии DESAFIB и от 0,9 до 16 мкМ в отсутствие кофактора. Непрямые хромогенные тесты в присутствии различных стимулов. Непрямые хромогенные стандартные тесты выполняли согласно публикациям, цитированным выше. Пробы общего объма 100 мкл, содержащие 0,25-1 нг фермента, 0,2 мкМ Lys-плазминогена и 0,62 мМ спектроцима PL, использовали. Тесты выполняли либо в присутствии буфера, 25 мкг/мл DESAFIB,100 мкг/мл бромциановых фрагментов фибриногена (American Diagnostica) или 100 мкг/мл стимулятора пептида Р 368, состоящего из 13 аминокислот. Анализы проводили в титрационных микропланшетах и оптическую плотность определяли при длине волны 405 нм каждые 30 с в течение 1 ч в "Molecular Devices Thermomax". Температура реакции была 37 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение активирующего плазминоген фактора для производства лекарственного средства для лечения инсульта в течение по меньшей мере 3 ч после его начала, где указанный активирующий плазминоген фактор не оказывает нейродегенеративного эффекта t-PA немутантного типа по данным сравнительных экспериментов на модели повреждения каиновой кислотой и модели для проверки поражения полосатого тела, индуцированного NMDA. 2. Применение по п.1, где нейродегенеративный эффект активирующего плазминоген фактора по меньшей мере в 100 раз ниже эффекта t-PA дикого типа. 3. Фармацевтическая композиция для лечения инсульта в течение по меньшей мере 3 ч после его начала, содержащая активирующий плазминоген фактор, где активирующий плазминоген фактор не оказывает нейродегенеративного эффекта t-PA немутантного типа по данным сравнительных экспериментов на модели повреждения каиновой кислотой и модели для проверки поражения полосатого тела, индуцированного NMDA.
МПК / Метки
МПК: A61P 9/10, A61K 38/49, A61P 9/00, C12N 9/72
Метки: нетоксичные, плазминоген-активирующие, нервной, лечения, инсульта, факторы, ткани
Код ссылки
<a href="https://eas.patents.su/18-13707-netoksichnye-dlya-nervnojj-tkani-plazminogen-aktiviruyushhie-faktory-dlya-lecheniya-insulta.html" rel="bookmark" title="База патентов Евразийского Союза">Нетоксичные для нервной ткани плазминоген-активирующие факторы для лечения инсульта</a>