Препаративная форма для лечения гиперактивности при дефиците внимания, фармацевтическая композиция на ее основе и способ лечения гиперактивности при дефиците внимания
Формула / Реферат
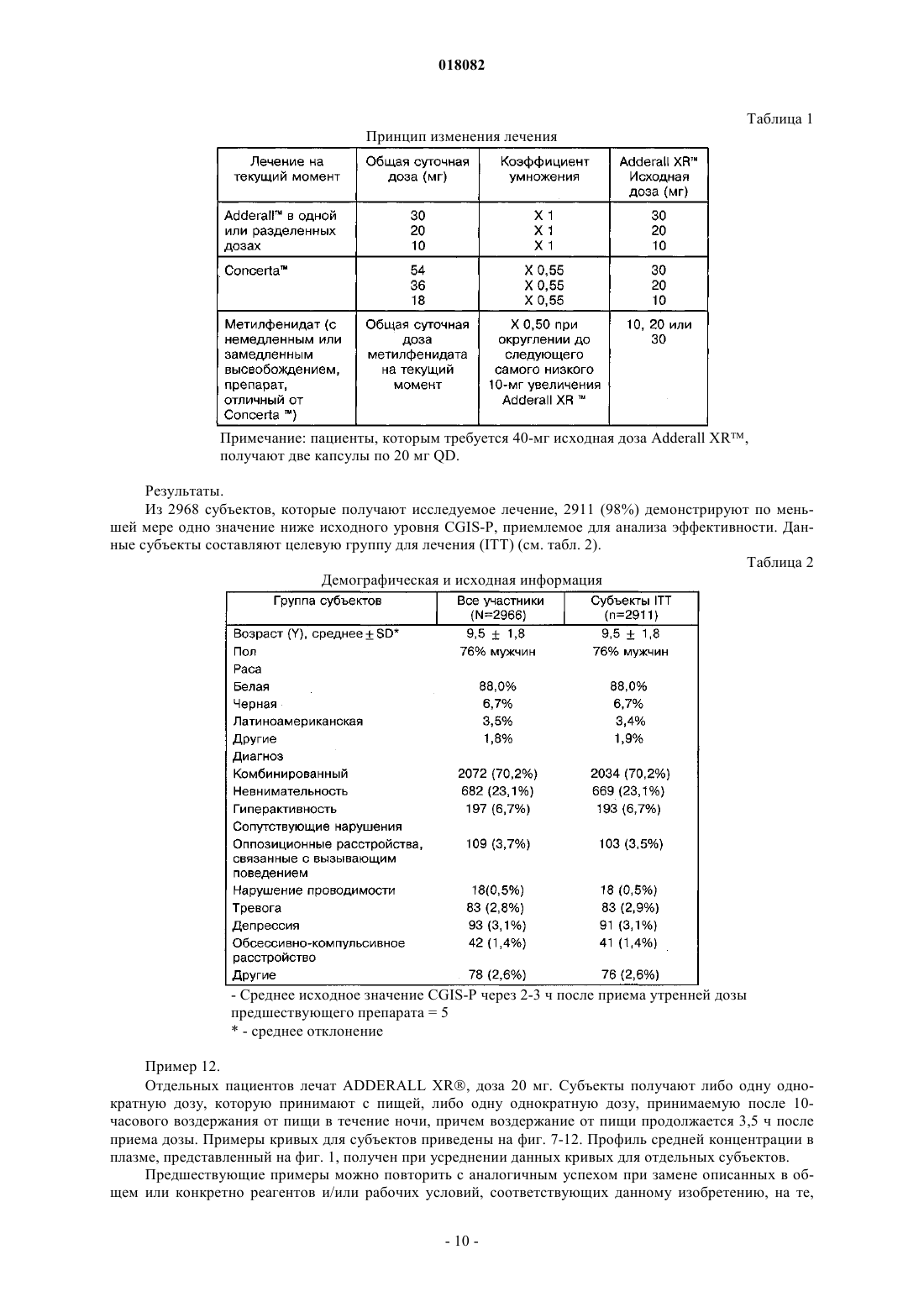
1. Препаративная форма с замедленным высвобождением действующего вещества, предназначенная для приема один раз в день для лечения гиперактивности при дефиците внимания (ADHD), характеризующаяся тем, что действующее вещество представляет собой смесь равных количеств сульфата декстроамфетамина, аспартата амфетамина, сахарата декстроамфетамина и сульфата амфетамина с профилем средней концентрации в плазме, соответствующем профилю на фиг. 1.
2. Форма по п.1, в которой действующее вещество представлено в матрице.
3. Форма по п.2, в которой матрица является полимерной.
4. Форма по п.1, в которой действующее вещество представлено в ядре, которое имеет покрытие с фармацевтически приемлемым не растворимым в воде полимерным пленкообразователем.
5. Форма по п.4, в которой покрытие содержит этилцеллюлозу.
6. Форма по п.4, в которой покрытие дополнительно содержит агент, регулирующий растворение.
7. Применение препаративной формы по п.1 в производстве лекарственного средства для лечения гиперактивности при дефиците внимания (ADHD).
8. Фармацевтическая композиция для лечения гиперактивности при дефиците внимания (ADHD), содержащая препаративную форму по п.1 и целевые добавки.
9. Применение фармацевтической композиции по п.8 в производстве лекарственного средства для лечения гиперактивности при дефиците внимания (ADHD).
Текст
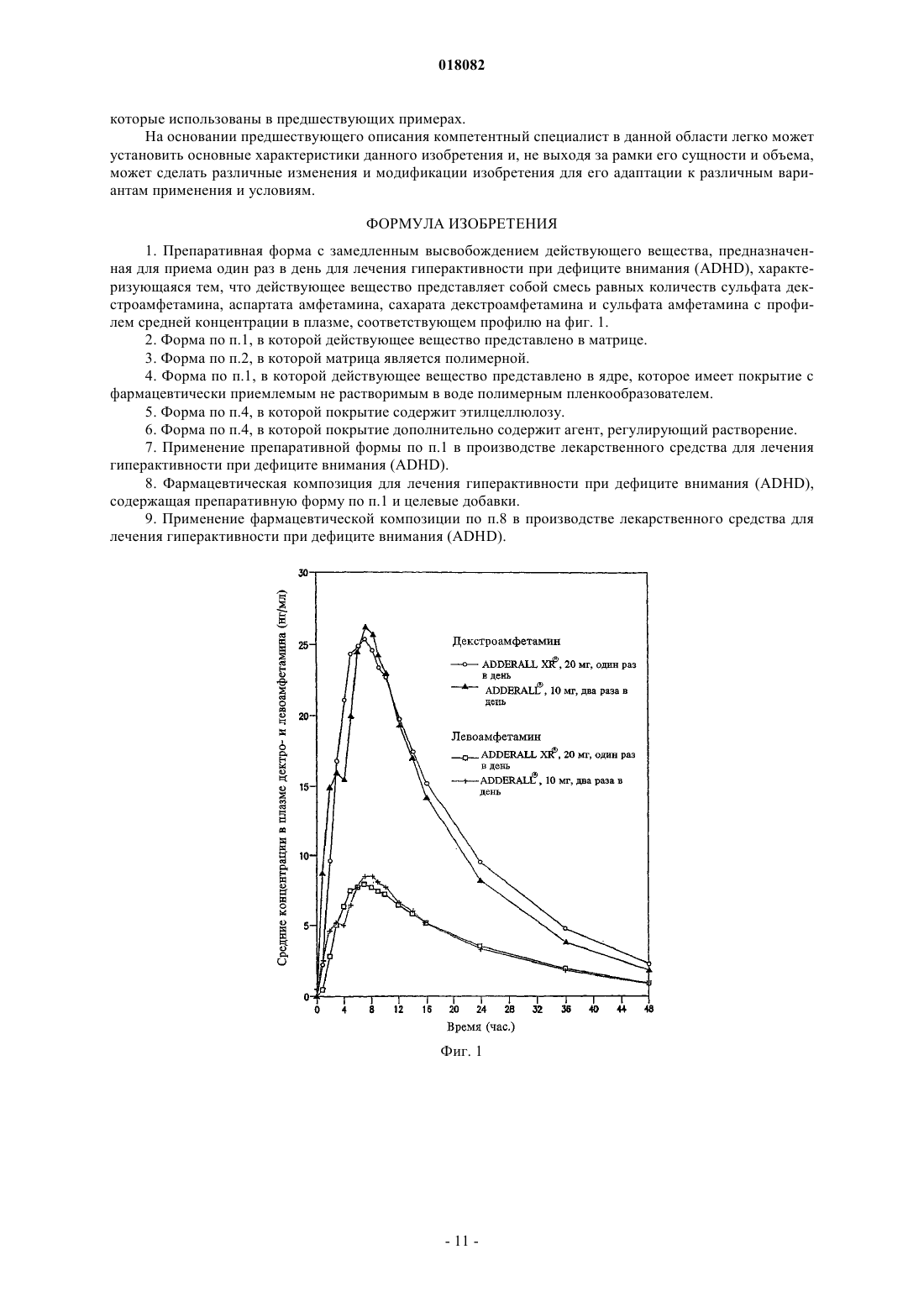
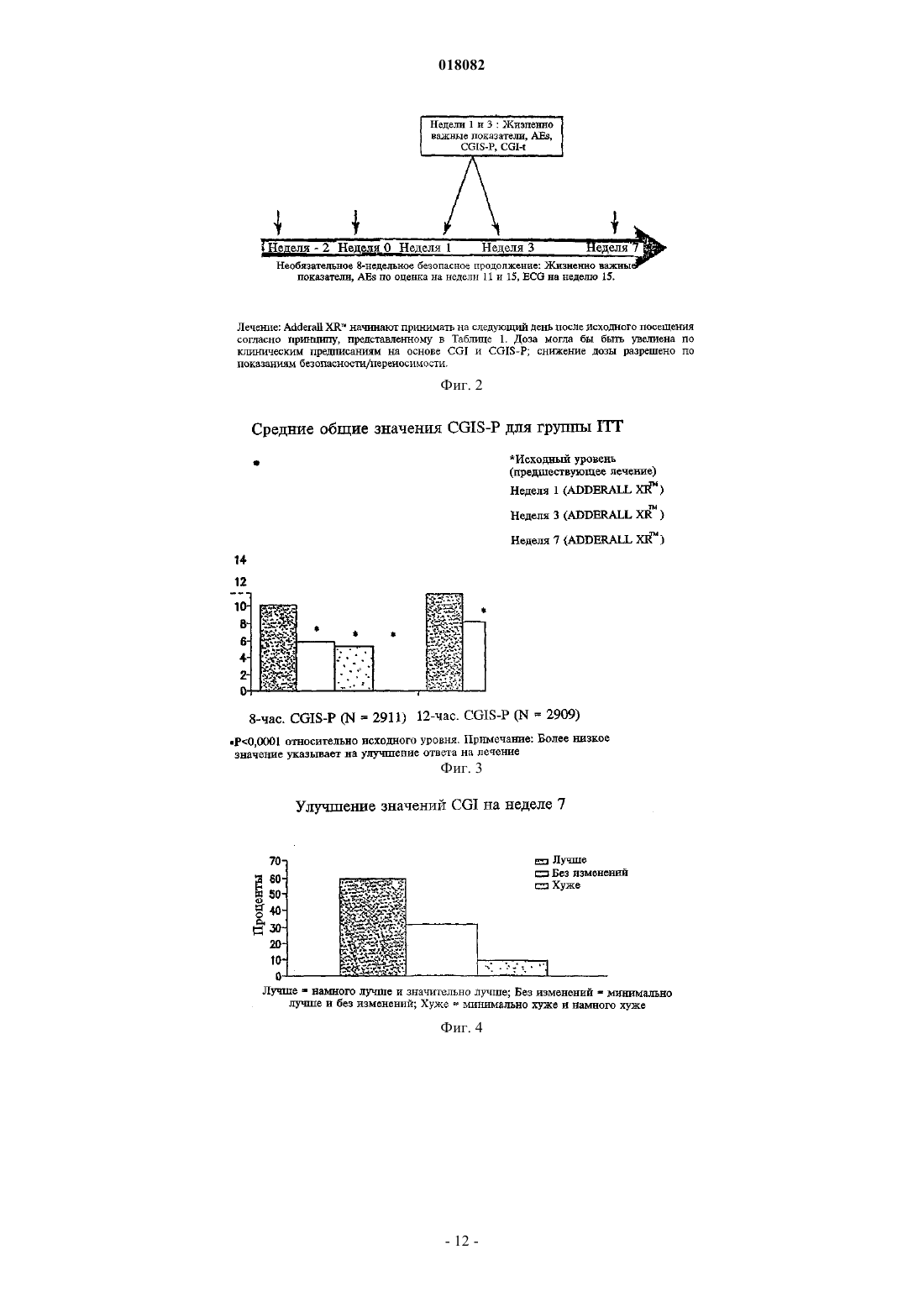
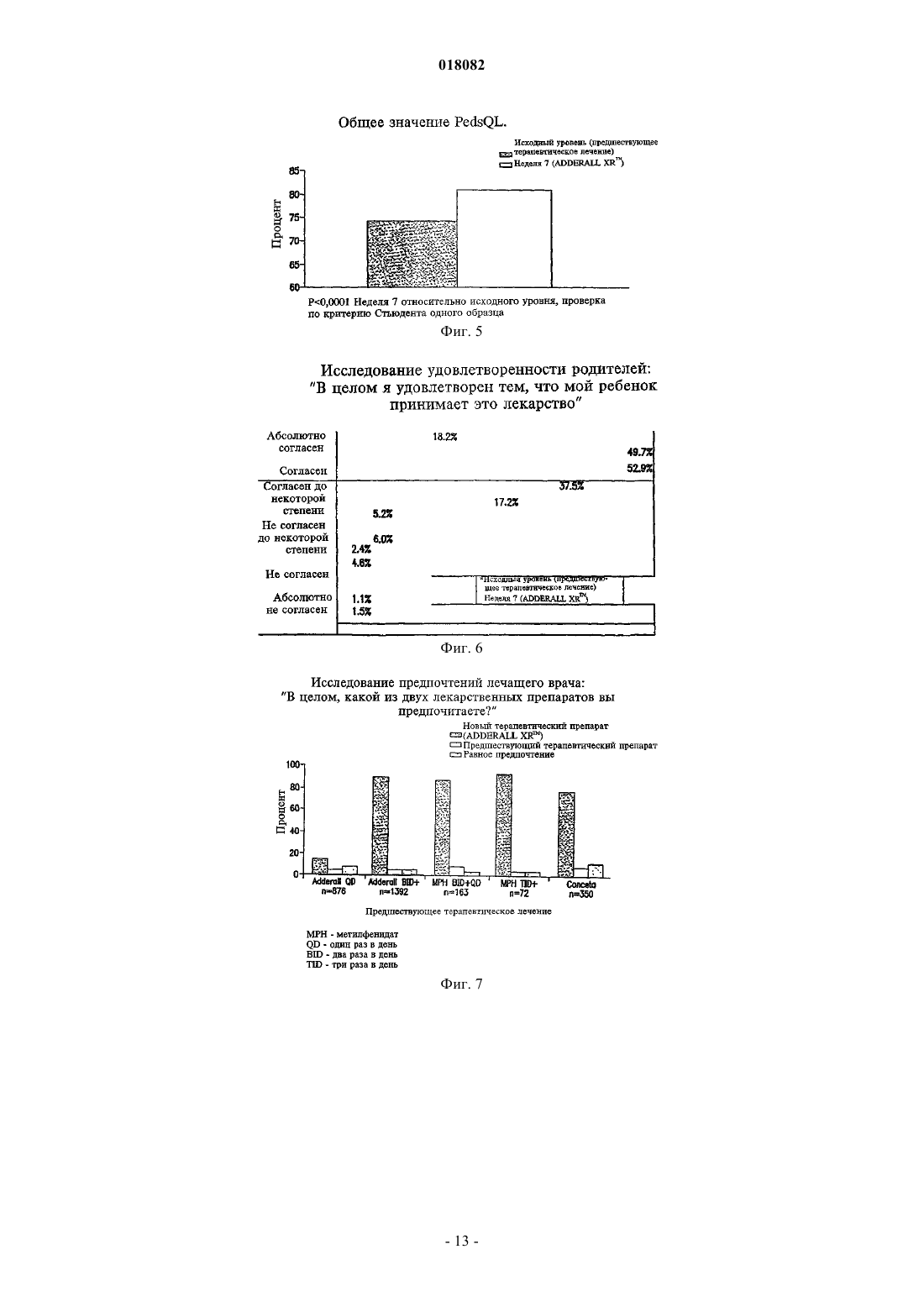
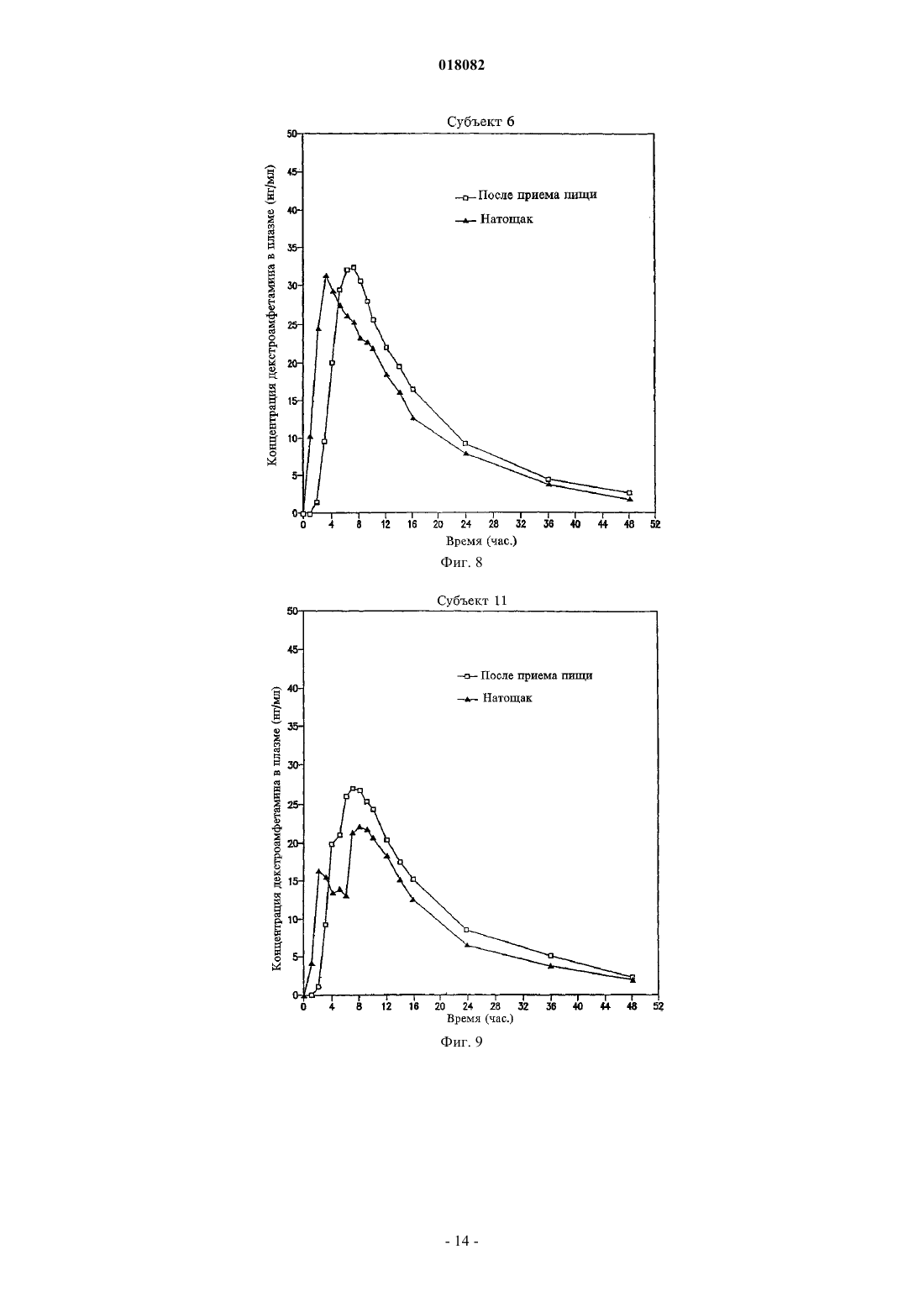
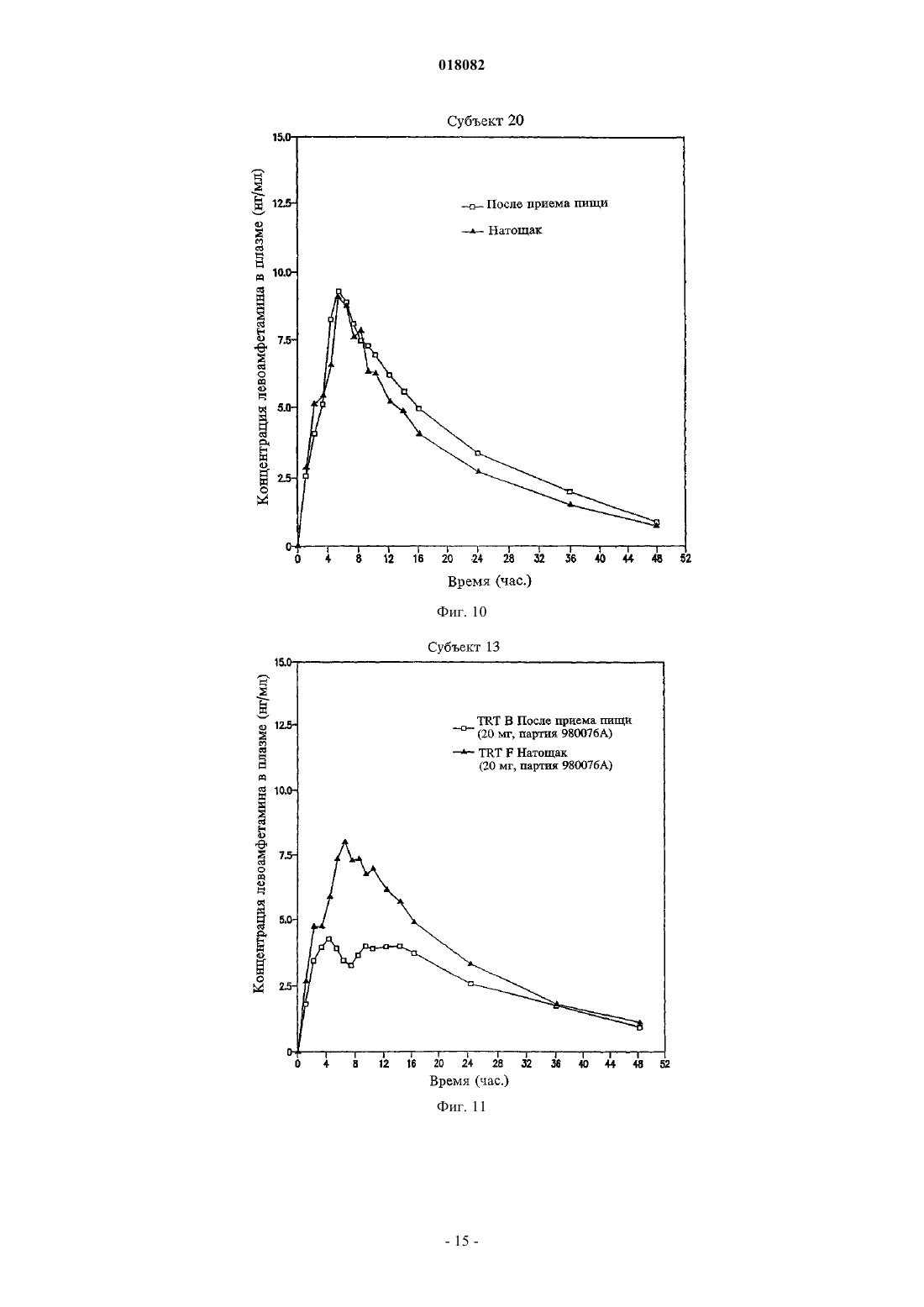
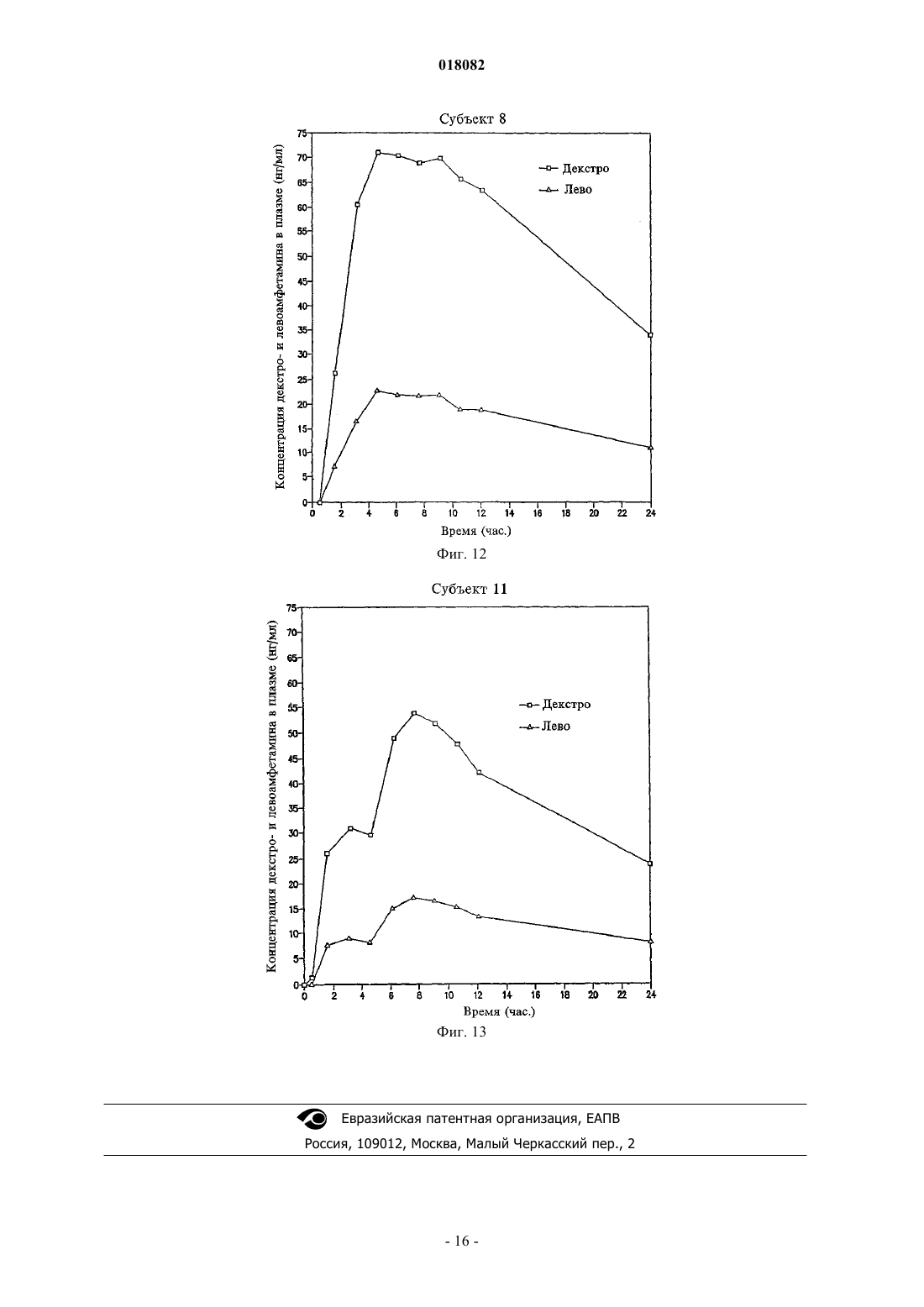
ПРЕПАРАТИВНАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ ГИПЕРАКТИВНОСТИ ПРИ ДЕФИЦИТЕ ВНИМАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ГИПЕРАКТИВНОСТИ ПРИ ДЕФИЦИТЕ ВНИМАНИЯ Настоящее изобретение относится к препаративной форме с замедленным высвобождением смеси равных количеств сульфата декстроамфетамина, аспартата амфетамина, сахарата декстроамфетамина и сульфата амфетамина с профилем средней концентрации в плазме,соответствующем профилю на фиг. 1, для лечения гиперактивности при дефиците внимания. Настоящее изобретение относится также к применению вышеуказанной препаративной формы. Настоящее изобретение относится также к фармацевтической композиции и ее применению на основе названной препаративной формы. Область техники, к которой относится изобретение Изобретение относится к области медицины и фармакологии, конкретно к фармацевтической композиции для получения форм для перорального введения с замедленным высвобождением (SR) по крайней мере одной соли амфетамина для лечения гиперактивности при дефиците внимания (ADHD). Предшествующий уровень техники Известна фармацевтическая композиция для амфетамина и/или его солей для его приема один раз в день, содержащая по меньшей мере одну соль амфетамина в двух дозах с импульсным типом высвобождения, а именно дозу с немедленным высвобождением и дозу с импульсным высвобождением через несколько часов после введения (заявка WO 00/23055). Препараты, соответствующие заявке WO 00/23055 (полное описание которой включено в данном контексте в виде ссылки), например препараты ADDERALL XR, дают двойное высвобождение активных солей амфетамина, одно - дозированной формы с немедленным высвобождением и другое дозированной формы с задержанным высвобождением. Как правило, время задержки между формами с немедленным высвобождением (высвобождением при введении) и задержанным высвобождением составляет 2-6 ч, предпочтительно приблизительно от 3 до приблизительно 5 ч, более предпочтительно от приблизительно 3 до приблизительно 4 ч и, как правило, приблизительно 4 ч. Изобретательской задачей является расширение ассортимента средств данного назначения, пригодного для одноразового введения в течение дня и дающего тот же профиль средней концентрации препарата в плазме крови пациента, что и препарат амфетамина с пульсирующим видом высвобождения. Изобретательская задача состоит также в способе лечения нарушений, в частности лечения нарушений типа гиперактивности при дефиците внимания, с ее использованием. Сущность изобретения Указанные задачи решаются в предложенной препаративной форме для лечения гиперактивности при дефиците внимания (ADHD), предназначенной для приема один раз в день, характеризующейся замедленным высвобождением смеси равных количеств сульфата декстроамфетамина, сахарата декстроамфетамина, аспартата амфетамина и сульфата амфетамина, которая обеспечивает профиль средней концентрации в плазме у людей, больных ADHD, являющийся практическим таким же, как на фиг. 1. Другим вариантом выполнения изобретения является препаративная форма, в которой смесь равных количеств сульфата декстроамфетамина, сахарата декстроамфетамина, аспартата амфетамина и сульфата амфетамина представлена в матрице, например в полимерной матрице. Другим вариантом выполнения изобретения является препаративная форма, в которой смесь равных количеств сульфата декстроамфетамина, сахарата декстроамфетамина, аспартата амфетамина и сульфата амфетамина представлена в ядре, имеющем покрытие с фармацевтически приемлемым не растворимым в воде полимерным пленкообразователем, например этилцеллюлозой. В некоторых вариантах покрытие может дополнительно содержать агент, регулирующий растворение. Другой независимый вариант изобретения предусматривает использование препаративной формы для приема один раз в день, характеризующейся замедленным высвобождением смеси равных количеств сульфата декстроамфетамина, сахарата декстроамфетамина, аспартата амфетамина и сульфата амфетамина, которая обеспечивает профиль средней концентрации в плазме у людей, больных ADHD, который является практическим таким, как представлено на фиг. 1, при изготовлении лекарственного средства для лечения гиперактивности при дефиците внимания (ADHD). Другим независимым вариантом выполнения изобретения является фармацевтическая композиция амфетамина, содержащая препаративную форму для приема один раз в день, характеризующейся замедленным высвобождением смеси равных количеств сульфата декстроамфетамина, сахарата декстроамфетамина, аспартата амфетамина и сульфата амфетамина, которая обеспечивает профиль средней концентрации в плазме у людей, больных ADHD, который имеет практически такой же исходный наклон кривой, как показано на фиг. 1. Другой независимый вариант изобретения предусматривает использование фармацевтической композиции амфетамина, содержащей препаративную форму для приема один раз в день, характеризующуюся замедленным высвобождением смеси равных количеств сульфата декстроамфетамина, сахарата декстроамфетамина, аспартата амфетамина и сульфата амфетамина, обеспечивающую профиль средней концентрации в плазме у людей, больных ADHD, который является практическим таким, как представлено на фиг. 1, при изготовлении лекарственного средства для лечения гиперактивности при дефиците внимания (ADHD). Далее будут указаны материалы, приемы, технологии и конструкции из числа традиционно используемых, которые позволяют утверждать, что перечисленные существенные признаки патентуемых композиций представляют собой ясное для специалиста раскрытие поставленной технической задачи. Формы с замедленным высвобождением одного или более амфетаминов и/или солей амфетамина,соответствующие изобретению, предпочтительно рецептированы таким образом, чтобы обеспечивать профиль концентрации в плазме in vivo (т.е. измеряемый по общей концентрации амфетаминов и/или солей амфетамина (часто при раздельном определении D- и L-изомеров) в плазме крови пациентов), ко-1 018082 торый практически равен профилю концентрации в плазме in vivo, достигаемый при использовании препаратов с пульсирующим высвобождением тех же самых амфетаминов и/или солей амфетамина при введении пациенту, например таких, которые достигаются при использовании ADDERALL XR, Shire USInc., вкладыш в упаковку и маркировка которых в соответствии с FDA (Управление по контролю за продуктами и лекарствами) полностью включены в данном контексте в виде ссылки. Кроме того, предпочтительно, чтобы данный профиль замедленного высвобождения (при профиле концентрации в плазме,отличающемся от профиля высвобождения) был, как правило, первого порядка или имел двухфазные либо сигмоидные характеристики. Особенно предпочтительно, когда препараты с замедленным высвобождением, соответствующие изобретению, демонстрируют однодозный профиль концентрации в плазме in vivo практически такой же,как показано на фиг. 1. Последняя показывает почти ровные средние (по более чем приблизительно 20 пациентам) кривые концентрации в плазме для солей как декстроамфетамина, так и левоамфетамина вADDERALL XR (суммарная кривая средней концентрации в плазме для общего уровня амфетамина представляет собой просто сумму двух кривых, представленных на фиг. 1). Поскольку препараты, соответствующие изобретению, дают практически одинаковые кривые средней концентрации в плазме, их можно назвать быстродействующими препаратами с замедленным высвобождением относительно включения изначальных наклонов подъема кривой. В основном один и тот же "профиль" в данном контексте означает, что две кривые имеют практически одинаковую AUC (площадь под кривой) и Cmax, например, данные параметры для каждой кривой представляют собой 20% от каждой из других или даже ближе, например 10, 5, 2% и т.п., причем данные параметры обычно полностью определены и установлены. См., например, монографию J.G. Wagner. Основы клинической фармакокинетики (Fundamentals of Clinical Pharmacokinetics), Drug IntelligencePublications, Inc., Hamilton, Illinois, 1975; Руководство для промышленности. Биодоступность и биоэквивалентность. Исследования лекарственных продуктов для перорального применения. Основные проблемы (Guidance for Industry. Bioavailability and Bioequivalence Studies for(время от нуля до бесконечности) составляет 556,6 нгч/мл и Cmax составляет 28,0 нг/мл для dамфетамина и 205,1 нгч/мл и 8,7 нг/мл, соответственно, для l-амфетамина. Конечно, кривые для плазмы,полученные в данном изобретении, могут даже лучше соответствовать целевой кривой, такой как представлена на фиг. 1, например, практически (например, 20%) совпадая с исходным наклоном подъема,формами кривой после пика, значениям Tmax (7,1 ч для d-амфетамина и 7,4 ч для l-амфетамина для фиг. 1) и т.п. Поскольку на фиг. 1 представлены данные для таблеток по 20 мг (т.е. содержащих две пульсирующие дозы по 10 мг), кривые для плазмы (и, например, AUC и Cmax), соответствующие другим суточным дозам, таким как 10, 30, 40, 50, 60, 70, 80, 90 мг, будут в целом линейно пропорциональны кривым, представленным на фиг. 1, в соответствии с включенной дозировкой. В другом независимом варианте осуществления соответствующие изобретению препараты с быстрым SR, для дозы 20 мг ADDERALL XR, представленные на фиг. 1, демонстрируют кривые концентрации в плазме, имеющие исходные (например, от 2 ч после введения до 4 ч после введения) наклоны от приблизительно 3,7 до приблизительно 11,4 нг/млч для декстроамфетаминов и от приблизительно 1,4 до приблизительно 3 нг/млч для левоамфетаминов, предпочтительно от приблизительно 4 до приблизительно 8 нг/млч и от приблизительно 1,5 до приблизительно 2,2 нг/млч соответственно. Точный наклон для данного субъекта будет варьировать в соответствии с обычными факторами, включая такие, как принимал пациент пищу или нет. Для других доз, например, таких как вышеуказанные, наклоны кривой варьируют прямо (линейно) пропорционально дозе. В одном варианте осуществления препараты быстрого действия с замедленным высвобождением,соответствующие изобретению, используют для получения профиля средней концентрации в плазме,практически такого же, как профиль в примере 5 (комбинация примеров 1 и 2) заявки WO 00/23055, несмотря на более позднее описание того, что традиционная технология получения препаратов с замедленным высвобождением непригодна для амфетаминов (отметим, что профиль в плазме, соответствующий примеру 5, представленный на фиг. 7 заявки WO 00/23055, не является средним профилем, как профиль,приведенный на фиг. 1 данной заявки, но представляет собой профиль для одного субъекта). SRпрепараты, соответствующие изобретению, будут эффективны при лечении, например, ADHD, так же как ADDERALL XR. Например, они будут обладать неожиданно высокой эффективностью при лечении ADHD, установленной на основании данных, представленных в примере 11. Они также будут эффективныдля лечения ADHD с низкой частотой побочных эффектов, включая привыкание, наркоманию,толерантность, тахифилаксию и т.п. Предпочтительными солями является те, которые входят в коммерческий продукт ADDERALLXR, т.е. сульфат декстроамфетамина, сахарат декстроамфетамина, аспартат амфетамина моногидрат и сульфат амфетамина. Предпочтительные профили концентрации в плазме солей амфетаминов in vivo могут быть достигнуты путем получения твердой дозированной формы солей амфетаминов, которая способна обеспечить замедленное высвобождение одной или более солей амфетаминов за период времени, например, 8-12 ч или более длительный, предпочтительно 10-12 ч. Например, могут быть получены соли амфетаминов в ядре, которое имеет покрытие, обеспечивающее высвобождение солей амфетамина в течение времени,такое как фармацевтически приемлемый не растворимый в воде пленкообразующий агент в виде монокомпонента или с агентом, регулирующим растворение. Кроме того, можно получить двухфазный профиль высвобождения путем комбинирования гранул с немедленным высвобождением с гранулами с замедленным высвобождением. Другие способы получения замедленного высвобождения лекарственного препарата, включающие те, которые далее обсуждаются ниже, известны и могут быть использованы для обеспечения доставки с замедленным высвобождением, которая приводит в результате к рассмотренному выше профилю концентрации в плазме in vivo. Подходящие системы с замедленным высвобождением включают SR-покрытия, например, на гранулах, SR-матрицах (т.е. когда не требуются никакие покрытия), SR-осмотические системы и т.п., причем соли амфетамина дают профиль высвобождения первого порядка, двухфазный, сигмоидный и т.п. для получения профиля в плазме, эквивалентного системам пульсирующего высвобождения тех же самых лекарственных препаратов, как обсуждается выше. Обыкновенным является приведение в соответствие с желательным профилем целевой концентрации в плазме с использованием SR. Гранулы с замедленным высвобождением можно получить путем покрытия обычных содержащих лекарственный препарат ядер (сердцевин) не растворимым в воде полимером или комбинацией не растворимых в воде и водорастворимых полимеров. Обычно это представляет собой не комбинацию слоев, а комбинацию полимеров в одном покрытии. Полученные в результате гранулы (или маленькие таблетки) затем могут быть помещены в капсулу. В отличие от гранул в оболочке капсулы таблетки в оболочке капсулы (например, одна таблетка с немедленным высвобождением и одна таблетка с задержанным высвобождением в оболочке капсулы для обеспечения общего замедленного высвобождения) также могут быть использованы для достижения требующегося профиля в плазме. Различные полимерные материалы можно использовать для достижения характера высвобождения,необходимого для получения в результате требующегося профиля концентрации в плазме, например,чтобы повысить скорость быстрой доставки в течение первых 4-8 ч доставки. Например, многократная дозированная форма (например, как описано ниже), соответствующая данному изобретению, может доставлять быстродействующие и окончательные дозы фармацевтически активных солей амфетамина для достижения требующегося профиля лекарственного препарата в плазме реципиенту за период приблизительно 8-12 ч при однократном пероральном приеме. При этом уровни лекарственного препарата в плазме крови для фармацевтически активных солей амфетамина будут достигать пика чрезвычайно быстро,например в течение приблизительно 8 ч или меньше по необходимости, который затем медленно снижается в течение, например, последующих 12 или более часов. Таким образом, требующийся профиль концентрации в плазме может достигаться при использовании суточной дозировки солей амфетамина с быстрым задержанным высвобождением. Примеры эффективных конструкций гранул включают следующие. Сахарное ядро (содержащая сахар сердцевина), покрытый амфетамином, с полимерным покрытием,сахарное ядро, покрытое амфетамином, с покрытием смесью амфетамина и полимера, покрытым полимером,сахарное ядро, покрытое амфетамином, с покрытием смесью амфетамина в относительно высокой концентрации и полимера, покрытым смесью амфетамина в более низкой концентрации и полимера, покрытой полимером,гранула, содержащая амфетамин с полимерным покрытием,гранула, содержащая амфетамин, с покрытием смесью амфетамина и полимера, покрытым полимером,гранула, содержащая амфетамин, с покрытием смесью амфетамина в относительно высокой концентрации и полимера, покрытым смесью амфетамина в более низкой концентрации и полимера, покрытой полимером,таблетка или капсула, содержащая множество типов гранул, как описано выше, имеющих различное время высвобождения амфетамина и/или различные скорости высвобождения амфетамина. Как замечено, могут быть также использованы гранулы SR-матрицы, т.е. не имеющие никаких необходимых слоев для достижения замедленного высвобождения. Компоненты, используемые в данных матрицах, выбирают из традиционных SR-полимеров. В другой конструкции в рецептуру наряду с имеющими слои гранулами или гранулами матрицы могут быть включены препараты с немедленным высвобождением, которые обеспечивают один путь для достижения требующегося исходного быстрого высвобождения. Такие препараты с немедленным высвобождением являются полностью традиционными(см., например, заявку WO 00/23055). Детали применения вышеупомянутых и других конструкций для достижения требующегося профиля в плазме, как обсуждалось выше, являются полностью традиционными и могут быть определены компетентными специалистами в области техники самое большее с помощью нескольких рутинных параметрических экспериментов и обыкновенных корректировок, например, включающих особенности по-3 018082 лимеров и их смесей, относительные количества компонентов, толщину покрытия, диаметр гранул, число слоев и их композиции и т.п. Так, например, для данной конструкции (например, одной из приведенных в примерах в данном контексте) могут быть определены профили растворения и измерены профили в плазме in vivo. Затем последние можно обычным образом сравнить с целевым профилем в плазме (например, профилем для ADDERALL XR) и скорректировать различия с помощью полностью традиционного состава и подведения профилей растворения, как в упомянутых случаях, но без ограничения ими. Подходящие материалы, которые могут быть использованы в SR-препаратах, соответствующих изобретению, хорошо известны и включают без ограничения перечисленным поливинилацетат, ацетат целлюлозы, ацетатбутират целлюлозы, ацетатпропионат целлюлозы, этилцелюлозу, жирные кислоты и их сложные эфиры, алкилспирты, воски, зеин (проламин из зерна) и водные полимерные дисперсии, такие как Eudragit RS и RL30D, Eudragit NE30D, Aquacoat, Surelease, Kollicoat SR30D и латекс ацетата целлюлозы. Способы получения ядер включают:a) экструзию-сферонизацию - лекарственный препарат(ы) и другие дополнительные компоненты гранулируют с добавлением связующего раствора. Мокрую массу пропускают через экструдер, оборудованный ситом определенного размера. Далее экструдат сферонизируют. Полученное драже (пеллеты) высушивают и просеивают для дальнейшего применения;b) грануляцию с большим усилием сдвига - лекарственный препарат(ы) и другие дополнительные компоненты перемешивают в сухом виде, а затем увлажняют смесь добавлением связующего раствора в гранулятор/смеситель интенсивного смешения со сдвиговым усилием. Гранулы после увлажнения перемешивают до получения однородной массы при комбинированном воздействии перемешивания и измельчения. Полученные в результате гранулы или драже высушивают и просеивают для дальнейшего применения;c) наслаивание раствора или суспензии - раствор или дисперсию лекарственного препарата(ов) с добавлением или без добавления связующего компонента напыляют на исходные ядра с определенным размером частиц в процессоре с псевдоожиженным слоем или другом подходящем оборудовании. Таким образом лекарственный препарат наносится на поверхность исходных ядер. Драже, нагруженные лекарственным препаратом, высушивают для дальнейшего применения. Для целей данного изобретения частицы ядра предпочтительно имеют диаметр в интервале приблизительно 500-1500 мкм, более предпочтительно 100-800 мкм. Затем данные частицы могут быть покрыты в устройстве с псевдоожиженным слоем чередующейся последовательностью выбранных слоев покрытия. Композиция предпочтительно в форме вышеописанных гранул может быть включена в твердые желатиновые капсулы либо с дополнительными наполнителями, либо в виде монокомпонента. Типичные наполнители для введения в состав капсул включают, но без ограничения перечисленным, инертные наполнители, такие как микрокристаллическая целлюлоза, полисахариды сои, фосфат кальция дигидрат,лактоза, сахароза, сорбит и любой другой инертный наполнитель. Кроме того, в них могут присутствовать компоненты, способствующие сыпучести, такие как вспененный диоксид кремния, силикагель,стеарат магния, стеарат кальция или любой другой материал, придающий порошкам сыпучесть. Далее,если это необходимо для применения, может быть добавлен смазывающий компонент, например полиэтиленгликоль, лейцин, глицерилбегенат, стеарат магния или стеарат кальция. Композиция может быть также введена в таблетку, в особенности путем инкорпорации в матрицу таблетки, которая быстро образует дисперсию частиц после приема. Для инкорпорации в такую таблетку данных частиц в таблетку должен быть добавлен наполнитель/связующий компонент, который может включить частицы, но не допустит их разрушения во время процесса таблетирования. Материалы, которые подходят для данной цели, включают, но без ограничения перечисленным, микрокристаллическую целлюлозу (AVICEL), полисахарид сои (EMCOSOY), предварительно желатинизированные крахмалы (STARCH 1500, NATIONAL 1551) и полиэтиленгликоли (CARBOWAX). Материалы предпочтительно присутствуют в интервале 5-75% (мас./мас.) при более предпочтительном интервале 25-50%(мас./мас.). Кроме того, возможно добавление разрыхлителей, чтобы диспергировать гранулы после приема таблетки. Подходящие разрыхлители включают, но без ограничения перечисленным, перекрестносшитую натрийкарбоксиметилцеллюлозу (AC-DI-SOL), натрийкрахмалгликолят (EXPLOTAB, PRIMOJEL) и перекрестно-сшитый поливинилпирролидон (Plasone-XL). Данные материалы предпочтительно присутствуют в количестве 3-15% (мас./мас.) при более предпочтительном интервале 5-10%(мас./мас.). Смазывающие компоненты также могут быть добавлены, чтобы обеспечить надлежащее таблетирование, и они могут включать, но без ограничения перечисленным, стеарат магния, стеарат кальция, стеариновую кислоту, полиэтиленгликоль, лейцин, глицерилбегенат и гидрогенизированное растительное масло. Данные смазывающие компоненты предпочтительно присутствуют в количествах от 0,1 до 10%(мас./мас.), при более предпочтительном интервале 0,3-3,0% (мас./мас.). Таблетки формуют, например, следующим образом. Частицы вводят в смеситель вместе с AVICEL, разрыхлителями и смазывающим компонентом,перемешивают в течение заданного числа минут для получения однородной смеси, которую затем помещают в загрузочную воронку пресса, с помощью которого прессуют таблетки. Используемая сила сжатия достаточна для формования таблеток, однако недостаточна для разрушения гранул или покрытий. Различные энтеросолюбильные материалы, например ацетатфталат целлюлозы, фталат гидроксипропилметилцеллюлозы, поливинилацетатфталат и акриловые полимеры EUDRAGIT могут быть использованы в качестве гастрорезистентных энтеросолюбильных покрытий для высвобождения лекарственного препарата в кишке при необходимости. Энтеросолюбильные материалы, которые растворимы при более высоких значениях рН, часто используются для специфических для толстой кишки систем доставки, и они полностью обычным образом применимы в SR-системах, соответствующих данному изобретению. Энтеросолюбильные полимеры, используемые в данном изобретении, также могут быть модифицированы обычным образом посредством смешивания с другими известными продуктами для покрытий, которые не являются рН-чувствительными. Примеры таких продуктов для покрытий включают нейтральные сложные эфиры метакриловой кислоты с небольшой долей триметиламмонийэтилметакрилатхлорида, который в настоящее время имеется в продаже под торговыми названиямиEUDRAGIT и EUDRAGIT RL, дисперсии нейтральных сложных эфиров без каких-либо функциональных групп, которые продаются под торговыми названиями EUDRAGIT NE30D и EUDRAGITNE30, и другие рН-независимые продукты для покрытий. Слой обычного защитного покрытия может быть также нанесен непосредственно на наружную поверхность ядра, либо ядра из матрицы, содержащей лекарственный препарат, либо ядра, покрытого лекарственным препаратом, посредством принятых технологий покрытия, таких как покрытие в поддоне или покрытие в псевдоожиженном слое с использованием растворов полимеров в воде или подходящих органических растворителях, либо путем использования водных дисперсий полимеров. Подходящие материалы для защитного слоя включают водные дисперсии производных целлюлозы, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон,сополимер поливинилпирролидона/винилацетата, этилцеллюлоза (AQUACOAT, SURELEASE),EUDRAGIT RL 30D, OPADRY и т.п. Примерные уровни покрытия составляют от 1 до 6%, предпочтительно 2-4% (мас./мас.). На композицию, соответствующую данному изобретению, может быть далее необязательно нанесен наружный слой покрытия OPADRY, OPADRY II (Colorcon) и соответствующие цветные и бесцветные марки Colorcon могут быть использованы для защиты драже от того, чтобы оно становилось липким,и для окрашивания продукта. Примерные уровни защитного или цветного покрытия составляют от 1 до 6%, предпочтительно 2-3% (мас./мас.). В состав наружного покрытия могут быть включены многие ингредиенты, например для обеспечения более быстрого (немедленного) высвобождения, такие как пластификаторы: ацетилтриэтилцитрат,триэтилцитрат, ацетилтрибутилцитрат, дибутилсебакат, триацетин, полиэтиленгликоли, пропиленгликоль и другие, смазывающие компоненты: тальк, коллоидный диоксид кремния, стеарат магния, стеарат кальция, диоксид титана, силикат магния и т.п. Необязательные модифицирующие компоненты защитного слоя, которые могут быть использованы для нанесения поверх энтеросолюбильного и других покрытий, включают барьерный слой от проникновения воды (полупроницаемый полимер), который может быть последовательно нанесен после энтеросолюбильного или другого покрытия для снижения скорости проникновения воды через энтеросолюбильный слой и, таким образом, увеличения времени задержки высвобождения лекарственного препарата. Покрытия для замедленного высвобождения, обыкновенно известные компетентному специалисту в данной области, могут быть использованы для этой цели с помощью принятых технологий покрытия,таких как нанесение покрытия в резервуаре или покрытие с применением псевдоожиженного слоя при использовании растворов полимеров в воде или подходящих органических растворителях или при использовании водных дисперсий полимеров. Например, могут быть использованы, но без ограничения перечисленным, следующие материалы: ацетат целлюлозы, ацетатбутират целлюлозы, ацетатпропионат целлюлозы, этилцеллюлоза, жирные кислоты и их сложные эфиры, воски, зеин и водные полимерные дисперсии, такие как EUDRAGIT RS и RL30D, EUDRAGIT NE 30D, AQUACOAT, SURELEASE,и латекс ацетата целлюлозы. Может быть также использована комбинация вышеуказанных полимеров и гидрофильных полимеров, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза (KLUCEL,Hercules Corp.), гидроксипропилметилцеллюлоза (METHOCEL, Dow Chemical Corp.), поливинилпирролидон. Принципы технологии получения препаратов с замедленным высвобождением, применимые к данному изобретению, включая указанные в данном контексте способы, описаны, например, в разделе, написанном R.K. Chang и J.R. Robinson, глава 4: "Замедленное высвобождение лекарственного препарата из таблеток и частиц через покрытие" ("Sustained Drug Release from Tablets and Particles Through Coating") в монографии "Фармацевтические дозированные формы: таблетки" ("Pharmaceutical Dosage Forms: Tab-5 018082K.E. Avis, A.J. Shukla и R.K. Chang, Interpharm Press, INC., 1999, описания которых полностью включены в данном контексте в виде ссылки. Полные описания выше- и нижеприведенных заявок, патентов и публикаций включены в данном контексте в виде ссылки. Перечень чертежей На фиг. 1 представлены концентрации в плазме дектро- и левоамфетина (нг/мл) в зависимости от времени после введения; фиг. 2 - диаграмма режима посещений; фиг. 3 - средние общие значения CGIS-P для группы ITT; фиг. 4 - представлено улучшение значений CGI на седьмой неделе лечения; фиг. 5 - общее значение PedsQL; фиг. 6 - исследование мнения родителей; фиг. 7 - исследование предпочтений лечащего врача; фиг. 8 и 9 - концентрация декстроамфетамина в плазме пациента 6; фиг. 10 - концентрация декстроамфетамина в плазме пациента 20; фиг. 11 - концентрация декстроамфетамина в плазме пациента 13; фиг. 12 и 13 - концентрация лево- и декстроамфетамина в плазме пациентов 8 и 11. В предшествующем материале и последующих примерах все температуры приведены без поправок в градусах Цельсия, и, пока не указано иначе, все части и проценты даны в пересчете на массу. Гранулы с SR-покрытием Пример 1. Гранулы, нагруженные смесью солей амфетамина (MASL) - 500 г Этилцеллюлоза (ETHOCEL N-10, Dow Chemical) - 15,46 г Этилацетат - 515 г Этилцеллюлозу (15,46 г) растворили в 515 г этилацетата. В колонку Верстера ввели 500 г гранулMASL, которые затем покрыли покрывающей смесью в следующих условиях: температура 40 С, давление напыления 1 бар и скорость напыления 10 г/мин. Линию промыли этилацетатом, высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 97 мас.% гранул MASL и 3 мас.% этилцеллюлозного покрытия. Пример 2. Гранулы, нагруженные смесью солей амфетамина (MASL) - 500 г Этилцеллюлоза (ETHOCEL N-10, Dow Chemical) - 37,78 г Гидроксипропилцеллюлоза (Klucel LF, Aqualon) - 8,70 г Метиленхлорид - 744 г Метанол - 186 г Этилцеллюлозу (37,78 г) и гидроксипропилцеллюлозу (8,70 г) растворили в смеси метиленхлорида и метанола (4:1). В колонку Верстера ввели 500 г гранул MASL, которые затем покрыли покрывающей смесью в следующих условиях: температура 40 С, давление напыления 1 бар и скорость напыления 10 г/мин. Линию промыли метанолом, высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 92 мас.% гранул MASL и 8 мас.% этилцеллюлозного/гидроксипропилцеллюлозного покрытия. Пример 3. Гранулы, нагруженные смесью солей амфетамина (MASL) - 500 гSurelease (173,92 г) развели в 43,48 г воды. В колонку Верстера (Versa-Glatt, Glatt Air Techniques) ввели 500 г гранул MASL, которые затем покрыли покрывающей смесью в следующих условиях: температура на входе 60 С, давление напыления 1 бар и скорость напыления 6 г/мин. Линию промыли водой,высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 92 мас.% гранул MASL и 8 мас.% этилцеллюлозного покрытия. Пример 4. Гранулы, нагруженные смесью солей амфетамина - 500 гEudragit RS30D - 111,49 г Триэтилцитрат - 10,03 г Вода - 115,94 г Триэтилцитрат примешивали к этилцеллюлозе в течение 30 мин. Пластифицированную этилцеллюлозу разводили водой и отфильтровали через сито 60 меш. В колонку Верстера ввели 500 г гранулMASL, которые затем покрыли покрывающей смесью в следующих условиях: температура 40 С, давление напыления 1 бар и скорость напыления 6 г/мин. Линию промыли этилацетатом, высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 92 мас.% гранул MASL и 8 мас.% этилцеллюлозного покрытия. Пример 5. Гранулы, нагруженные смесью солей амфетамина - 500 г Смесь солей амфетамина - 48,5 г Глицерилбегенат (Compritol 888, Gattefosse) - 436,5 г Смесь солей амфетамина диспергировали в расплавленном глицерилбегенате. Содержащий лекарственный препарат горячий расплав напылили на гранулы, нагруженные смесью солей амфетамина, в колонке Верстера в следующих условиях: температура на входе 30 С, давление напыления 2 бар и скорость напыления 10 г/мин. Пример 6. Гранулы, нагруженные смесью солей амфетамина - 500 гEudragit L100 - 25,25 г Этилцеллюлоза (Ethocel N-10, Dow Chemical) - 25,25 г Триэтилцитрат - 5,05 г Ацетон - 833,4 г Метанол - 277,8 г Гидроксипропилцеллюлозу и этилцеллюлозу растворили в смеси ацетона и метанола. Потом к раствору полимеров добавили триэтилцитрат. В колонку Верстера ввели 500 г гранул MASL, которые затем покрыли покрывающей смесью в следующих условиях: температура 40 С, давление напыления 1 бар и скорость напыления 10 г/мин. Линию промыли метанолом, высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 90 мас.% гранул MASL и 10 мас.% этилцеллюлозного/гидроксипропилцеллюлозного покрытия. Гранулы/таблетки на основе SR-матрицы Пример 7. Амфетамина аспартат - 50 г Амфетамина сульфат - 50 г Декстроамфетамина сахарат - 50 г Декстроамфетамина сульфат - 50 г Микрокристаллическая целлюлоза - 400 г Полиэтиленоксид, Polyox WSR 303 - 1380 г Стеарат магния - 20 г Все соли амфетамина, микрокристаллическую целлюлозу и полиэтиленоксид просеяли через сито 60 меш и загрузили в V-образный смеситель с барабанным усилителем. Порошковую смесь перемешивали в течение 15 мин, при этом с включенным барабанным усилителем в течение 3 мин в середине процесса перемешивания. Порошковую смесь выгрузили и просеяли через сито 60 меш. В просеянную порошковую смесь ввели смазывающий компонент стеарат магния в V-образном смесителе в течение 3 мин. Порошковую смесь со смазывающим компонентом спрессовали в роликовом уплотнителе с образованием гранул. Пример 8. Амфетамина аспартат - 50 г Амфетамина сульфат - 50 г Декстроамфетамина сахарат - 50 г Декстроамфетамина сульфат - 50 г Микрокристаллическая целлюлоза - 1780 г Стеарат магния - 20 г Все соли амфетамина и микрокристаллическую целлюлозу просеяли через сито 60 меш и загрузили в V-образный смеситель с барабанным усилителем. Порошковую смесь перемешивали в течение 15 мин,при этом с включенным барабанным усилителем в течение 3 мин в середине процесса перемешивания. Порошковую смесь выгрузили и просеяли через сито 60 меш. В просеянную порошковую смесь ввели смазывающий компонент стеарат магния в V-образном смесителе в течение 3 мин. Порошковую смесь со смазывающим компонентом спрессовали в таблетки при использовании оборудования 3/32". Пример 9. Минитаблетки - 500 гSurelease (127,7 г) развели в 85,1 г воды. В колонку Верстера (Versa-Glatt, Glatt Air Techniques) ввели 500 г минитаблеток, которые затем покрыли покрывающей смесью в следующих условиях: температура на входе 60 С, давление напыления 1 бар и скорость напыления 6 г/мин. Линию промыли водой,высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 94 мас.% минитаблеток MASL и 6 мас.% этилцеллюлозного покрытия. Пример 10. Гранулы, нагруженные смесью солей амфетамина - 500 гSurlease (дисперсия на основе этил целлюлозы, Colorcon) - 272,7 г Вода - 68,2 гSurelease (272,7 г) развели 68,2 г воды. В колонку Верстера (Versa-Glatt, Glatt Air Techniques) ввели 500 г гранул MASL, которые затем покрыли покрывающей смесью в следующих условиях: температура на входе 60 С, давление напыления 1 бар и скорость напыления 6 г/мин. Линию промыли водой, высушили драже в течение примерно 20 мин и выделили с получением продукта, содержащего 88 мас.% гранул MASL и 12 мас.% этилцеллюлозного покрытия. Данные по растворению для уровней покрытия 8 и 12% могут быть обобщены следующим образом: Пример 11. Предпосылки. Двухкомпонентный препарат с замедленным высвобождением Adderall (смесь солей d- и lамфетамина), разработанный для получения пульсирующего высвобождения лекарственного средства,дает терапевтический эффект при лечении нарушения типа дефицита внимания/гиперактивности(ADHD), который продолжается в течение дня при введении одной дозы утром. Данный препарат Adderall в капсулах состоит из 2 типов гранул Microtrol смеси солей амфетамина в соотношении 50:50 в одной капсуле. Гранулы с немедленным высвобождением разработаны для высвобождения содержимого лекарственного препарата в период времени, близкий периоду, характерному для таблеток Adderall. Гранулы с замедленным высвобождением разработаны для высвобождения содержимого лекарственного препарата приблизительно через 4 ч после перорального приема капсулы. В исходном исследовании препарата Adderall XR 20 мг QD (для приема один раз в день) показывают сравнимые биосовместимость и фармакокинетические профили с Adderall 10 мг BID (для приема два раза в день) с немедленным высвобождением, с интервалом 4 ч, и делают заключение о том, что Adderall XR 20 мг QD биоэквивалентен Adderall 10 мг BID (см. работу Michaels и соавт., представленную NCDEU 2001). Цели работы. Эффективность и пролонгированное действие Adderall XR при лечении детей с ADHD демонстрируют в 2 предшествующих основных исследованиях двойным слепым методом: одном, проведенном в классе, созданном в лабораторных условиях (см. McCracken et al., на рассмотрении), и другом, проведенном на модели домашних и школьных учреждений (см. статью Biederman и соавт., Pediatrics 2002, в печати). Данное широкомасштабное испытание с открытой меткой проводят в основном для оценки эффективности Adderall XR при лечении ADHD в учреждениях общей медицинской практики. Способы. В данном материале представлены непроверенные данные этого предполагаемого 7-недельного исследования с открытой меткой, проведенного в 378 центрах по всей стране. 8-Недельное продолжение является необязательным после завершения данной начальной фазы (см. фиг. 2). Субъекты. Включают детей в возрасте от 6 до 12 лет с диагнозом ADHD по DSM-IV (Руководство по диагностике и статистике психических расстройств IV), в данное время принимающих стабильные дозы ADDERALL с немедленным высвобождением или любой препарат метилфенидата. Критерии включения: хорошее физическое состояние при нормальном кровяном давлении, пульсе и электрокардиограмме (ЭКГ), значение по Общей шкале оценок Коннерса, определяемое родителями(CGIS-P) 12 для мальчиков и 10 для девочек, известная реакция на лечение психостимуляторами. Критерии исключения: неконтролируемое симптоматическое сочетанное психиатрическое расстройство; IQ(коэффициент умственного развития) 80; судорожные нарушения или болезнь Туретта в анамнезе, сопутствующие лекарственные препараты, такие как клонидин, гвайнфацин, противосудорожные препараты или любые лекарственные средства, которые действуют на кровяное давление или сердце. Измерения. Первоначальная эффективность: обоснованный CGIS-P. Исходный уровень: через 2-3 ч после приема утренней дозы психостимулирующего лекарственного средства оценивают степень контроля симптомов и проводят дополнительные определения через 8 и 12 ч после введения дозы. После начала лечения Adderall XR: перед посещением клиники в недели 1, 3 и 7 дозу вводит одно и то же лицо, представленное родителем/ухаживающим персоналом, в 8 ч и снова в 12 ч после утренней дозы Adderall XR. Дополнительная эффективность: шкалы общего клинического впечатления (CGI). Определяет клинический врач. Дает общую оценку клинического статуса в течение времени. Субъектов разделяют по тяжести заболевания относительно исходного уровня, когда они получают предшествующее лечение психостимуляторами. CGI-S представляет собой шкалу с 7 отметками, лежащими в интервале от 1 (нормальное состояние/абсолютное отсутствие болезни) до 7 (чрезвычайно высокая стадия развития болезни). Субъектов разделяют по улучшению состояния в недели 1, 3 и 7 по CGI-I, шкале с 7 отметками, лежащими в интервале от 1 (очень значительное улучшение) до 7 (очень значительное ухудшение). Основные аспекты удовлетворительности лечения: педиатрическое качество жизни (PedsQL). Утвержденное измерение, оценивающее специфические для возраста показатели качества жизни у здоровых детей и детей с острыми и хроническими состояниями здоровья. Дополняется родителями/ухаживающим персоналом на стадии исходного уровня и в конце начальной фазы исследования (неделя 7). Дополнительные аспекты удовлетворительности лечения: удовлетворенность лечением и акты по шкалам предпочтительности позволяют оценить приемлемость ADDERALL XR как родителями/ухаживающим персоналом, так и лечащим врачом (отдельные шкалы для врача и родителей). Акт удовлетворительности, выданный на исходном уровне и в неделю 7. Акт предпочтительности, выданный в неделю 7. Основные аспекты безопасности: исследование физического состояния при отборе (включая рост и массу тела). ЭКГ на исходном уровне и в конце исследования, жизненные показатели, включая пульс, кровяное давление и массу тела при каждом посещении во время исследования, добровольные сообщения о неблагоприятных событиях (AEs) регистрируют при каждом посещении. Заключение. У детей, получающих стабильные дозы различных стимулирующих лекарственных препаратов,значения CGIS-P после приема дозы в 8 и 12 ч приводит к значительному улучшению в симптоматикеADHD после замены на Adderall XR. После перехода на Adderall XR значительное улучшение очевидно также на основании улучшения значений CGI и педиатрических измерений качества жизни. В данном клиническом экспериментальном исследовании в условиях реальной жизни результаты обследования относительно удовлетворения и предпочтительности как от лечащих врачей, так и от родителей/ухаживающего персонала (хотя не полностью отраженные в данном контексте) также предполагают значительное преимущество при лечении Adderall XR по сравнению с лекарственной терапией, соответствующей предшествующему уровню техники. Данные результаты, по-видимому, отражают (1) стабильную эффективность и более длительное действие ADDERALL XR, (2) устранение необходимости в дополнительных дневных дозах для пациентов из групп, получающих многократную суточную дозу (на исходном уровне), и (3) схемы лечения,характеризующиеся более низкими суточными дозами стимулирующих лекарственных средств и более высоким уровнем ранее выявленной симптоматики ADHD при схемах лечения ADHD в учреждениях общей медицинской практики. Частота неблагоприятных событий, происходящих в период лечения, является низкой, и большинство AEs слабыми по своей природе, исследуемое лекарственное средство хорошо переносится. AdderallXR представляет собой безопасное и эффективное лекарственное средство для лечения детей с ADHD врачами общей практики, и хотя у пациентов может быть показан значительный положительный эффект при использовании других схем лечения стимуляторами, можно получить дополнительный значительный положительный эффект при переходе пациентов на данный продукт в дозировке для приема один раз в день. Клинические результаты отображены также на фиг. 2-6. Примечание: пациенты, которым требуется 40-мг исходная доза Adderall XR,получают две капсулы по 20 мг QD. Результаты. Из 2968 субъектов, которые получают исследуемое лечение, 2911 (98%) демонстрируют по меньшей мере одно значение ниже исходного уровня CGIS-P, приемлемое для анализа эффективности. Данные субъекты составляют целевую группу для лечения (ITT) (см. табл. 2). Таблица 2 Демографическая и исходная информация- Среднее исходное значение CGIS-P через 2-3 ч после приема утренней дозы предшествующего препарата = 5- среднее отклонение Пример 12. Отдельных пациентов лечат ADDERALL XR, доза 20 мг. Субъекты получают либо одну однократную дозу, которую принимают с пищей, либо одну однократную дозу, принимаемую после 10 часового воздержания от пищи в течение ночи, причем воздержание от пищи продолжается 3,5 ч после приема дозы. Примеры кривых для субъектов приведены на фиг. 7-12. Профиль средней концентрации в плазме, представленный на фиг. 1, получен при усреднении данных кривых для отдельных субъектов. Предшествующие примеры можно повторить с аналогичным успехом при замене описанных в общем или конкретно реагентов и/или рабочих условий, соответствующих данному изобретению, на те,- 10018082 которые использованы в предшествующих примерах. На основании предшествующего описания компетентный специалист в данной области легко может установить основные характеристики данного изобретения и, не выходя за рамки его сущности и объема,может сделать различные изменения и модификации изобретения для его адаптации к различным вариантам применения и условиям. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Препаративная форма с замедленным высвобождением действующего вещества, предназначенная для приема один раз в день для лечения гиперактивности при дефиците внимания (ADHD), характеризующаяся тем, что действующее вещество представляет собой смесь равных количеств сульфата декстроамфетамина, аспартата амфетамина, сахарата декстроамфетамина и сульфата амфетамина с профилем средней концентрации в плазме, соответствующем профилю на фиг. 1. 2. Форма по п.1, в которой действующее вещество представлено в матрице. 3. Форма по п.2, в которой матрица является полимерной. 4. Форма по п.1, в которой действующее вещество представлено в ядре, которое имеет покрытие с фармацевтически приемлемым не растворимым в воде полимерным пленкообразователем. 5. Форма по п.4, в которой покрытие содержит этилцеллюлозу. 6. Форма по п.4, в которой покрытие дополнительно содержит агент, регулирующий растворение. 7. Применение препаративной формы по п.1 в производстве лекарственного средства для лечения гиперактивности при дефиците внимания (ADHD). 8. Фармацевтическая композиция для лечения гиперактивности при дефиците внимания (ADHD),содержащая препаративную форму по п.1 и целевые добавки. 9. Применение фармацевтической композиции по п.8 в производстве лекарственного средства для лечения гиперактивности при дефиците внимания (ADHD).
МПК / Метки
МПК: A61K 31/137, A61K 9/54, A61K 9/22, A61P 25/18
Метки: основе, способ, гиперактивности, внимания, лечения, композиция, препаративная, форма, фармацевтическая, дефиците
Код ссылки
<a href="https://eas.patents.su/17-18082-preparativnaya-forma-dlya-lecheniya-giperaktivnosti-pri-deficite-vnimaniya-farmacevticheskaya-kompoziciya-na-ee-osnove-i-sposob-lecheniya-giperaktivnosti-pri-deficite-vnimaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Препаративная форма для лечения гиперактивности при дефиците внимания, фармацевтическая композиция на ее основе и способ лечения гиперактивности при дефиците внимания</a>
Предыдущий патент: Гибкое изолирующее изделие
Следующий патент: Производные пиримидина, применимые в качестве ингибиторов pi3 киназы, и способы их применения
Случайный патент: Трубное соединение