Лекарственное средство
Номер патента: 13052
Опубликовано: 26.02.2010
Авторы: Решетов Александр Леонидович, Верещагина Ирина Анатольевна
Формула / Реферат
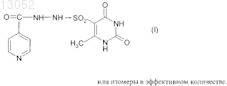
1. Лекарственное средство, включающее активное вещество и целевые добавки, отличающееся тем, что в качестве активного вещества оно содержит (2,4-дигидрокси-6-метил-5-пиримидил)-(4-пиридинкарбонилгидразинил)сульфон формулы (III)
2. Лекарственное средство по п.1, отличающееся тем, что оно дополнительно содержит по меньшей мере одно противотуберкулезное средство.
3. Лекарственное средство по п.2, отличающееся тем, что в качестве противотуберкулезных средств оно содержит изониазид, рефампицин, пиразинамид.
4. Лекарственное средство по одному из пп.1-3, отличающееся тем, что оно изготовлено в виде таблеток, комбинированных таблеток, капсул, сиропа и инъекций.
Текст
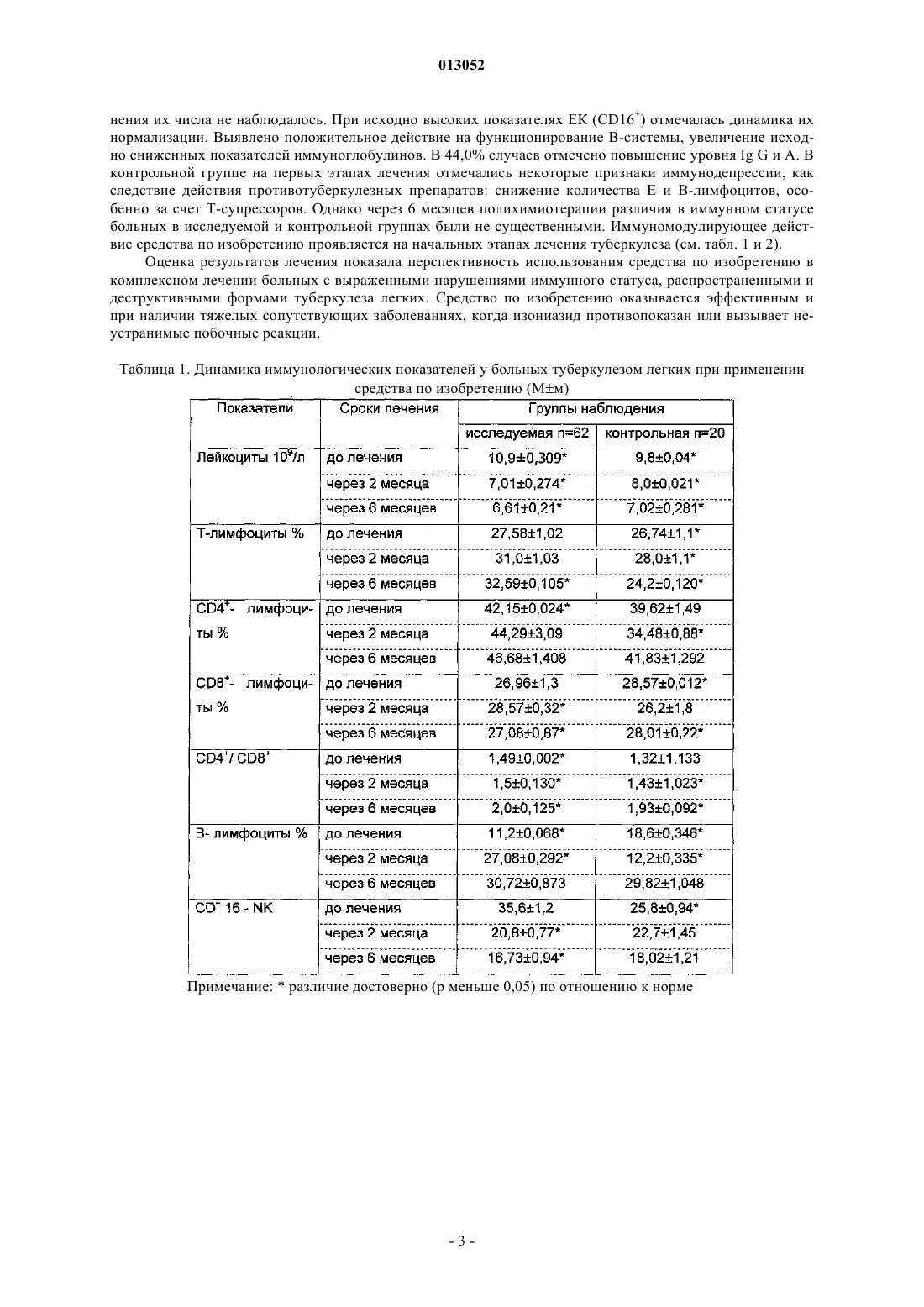
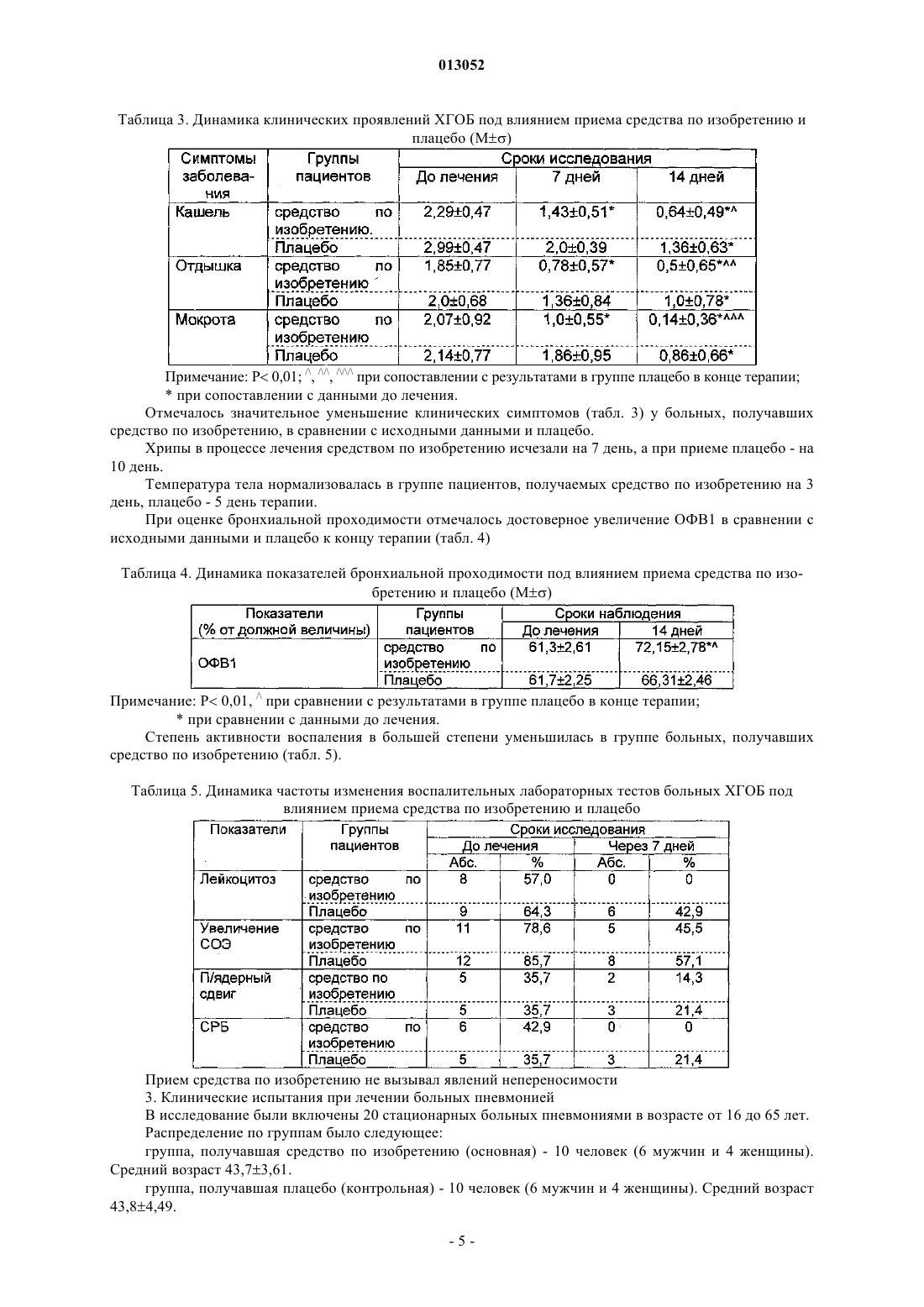
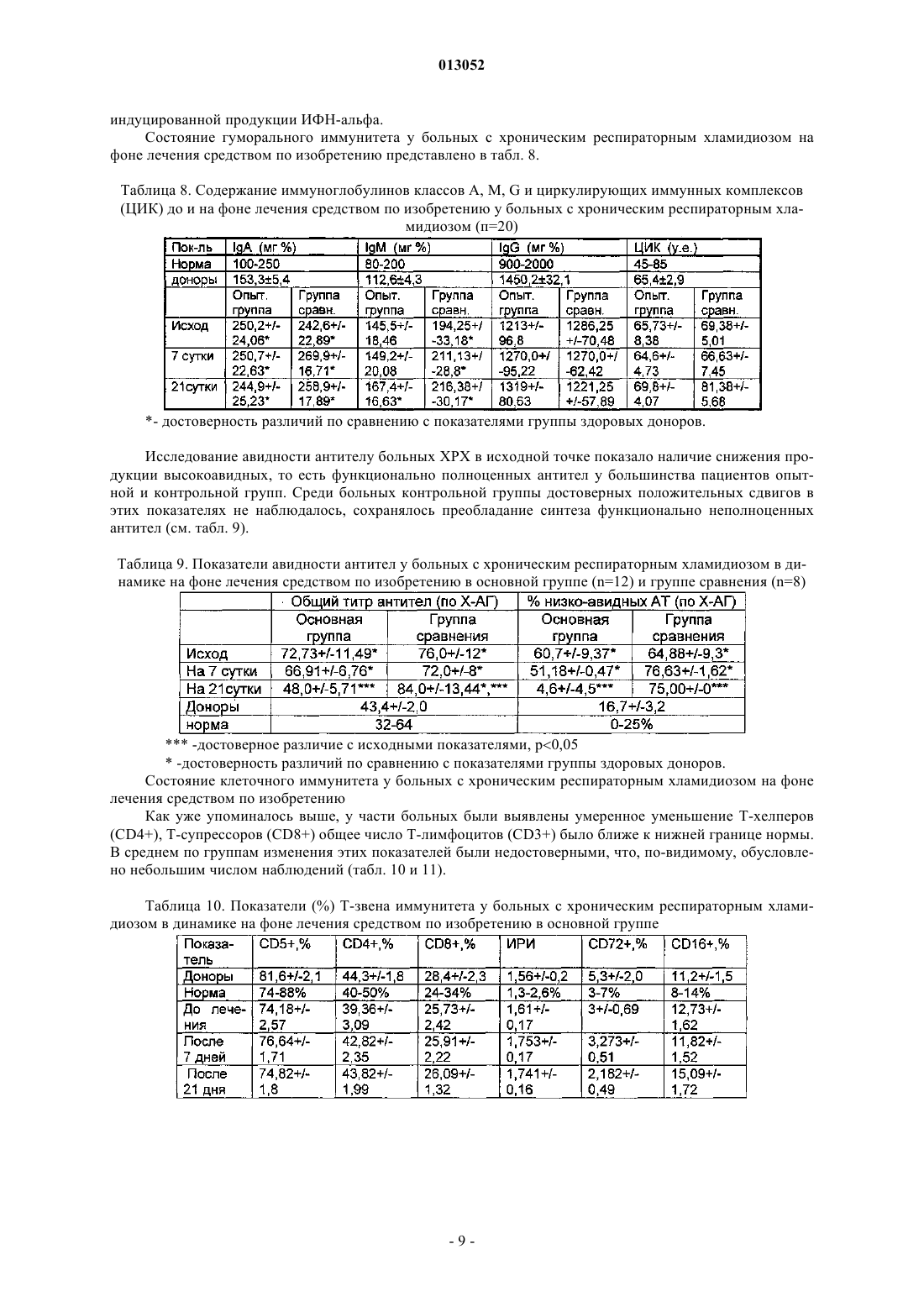
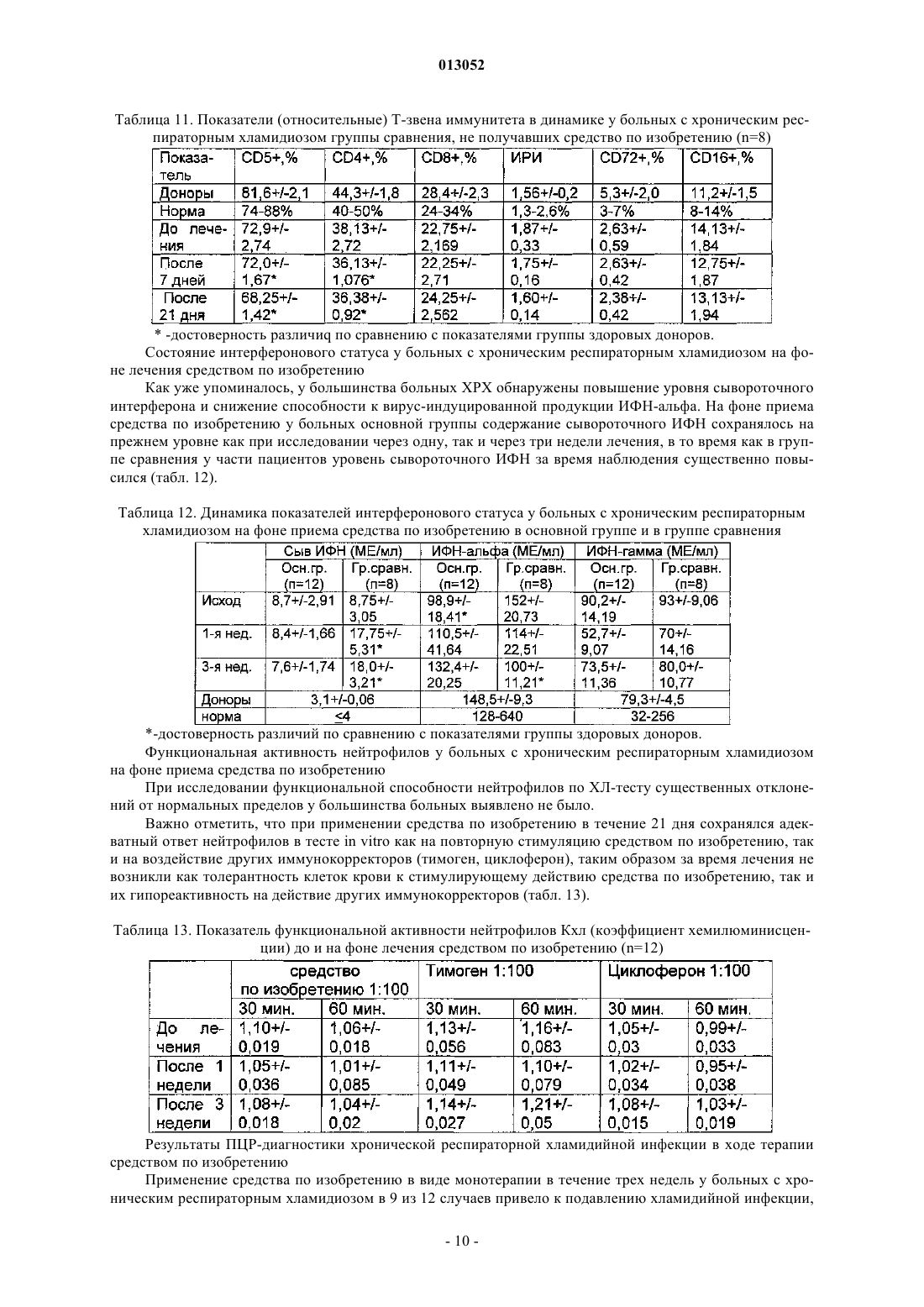
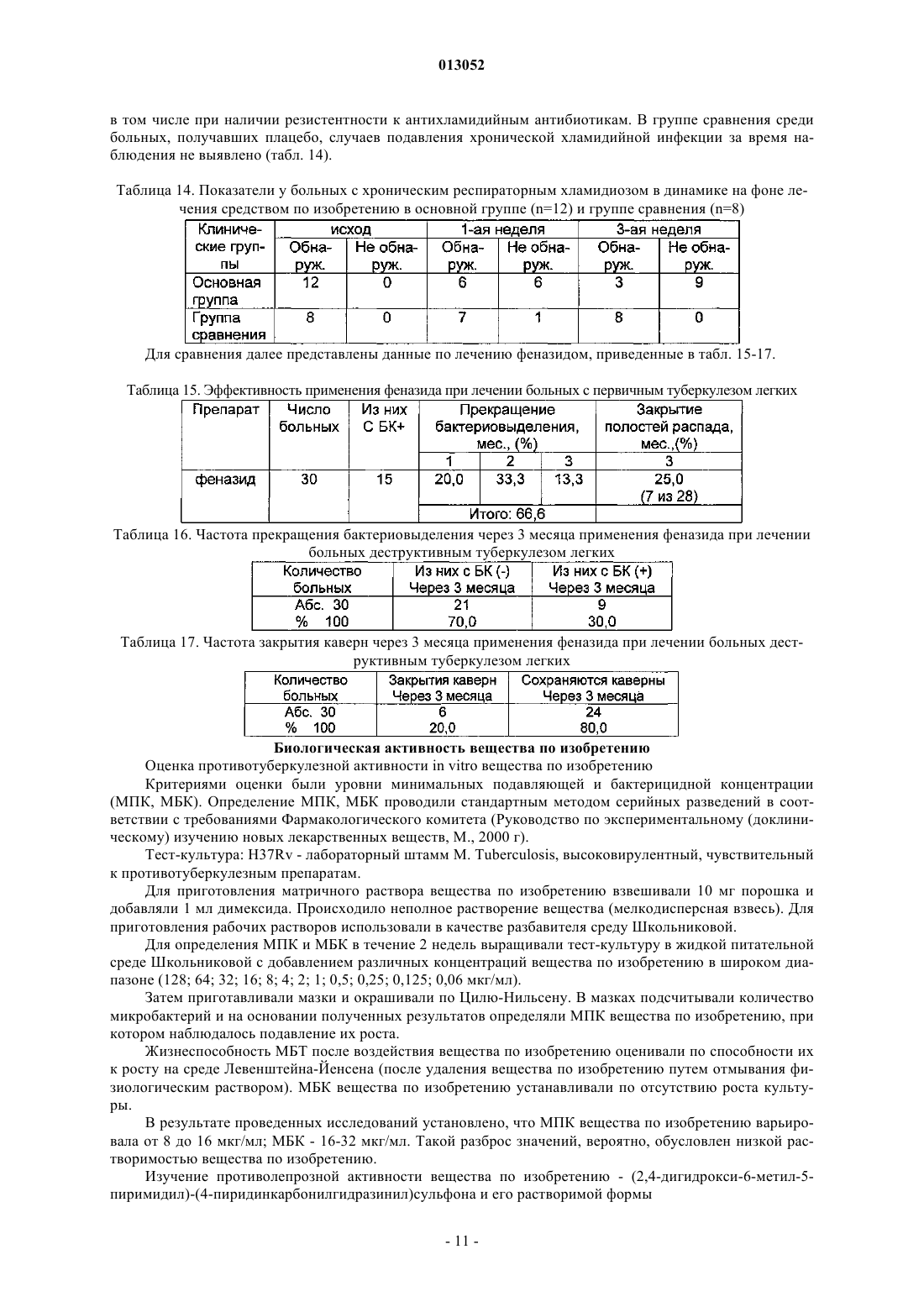
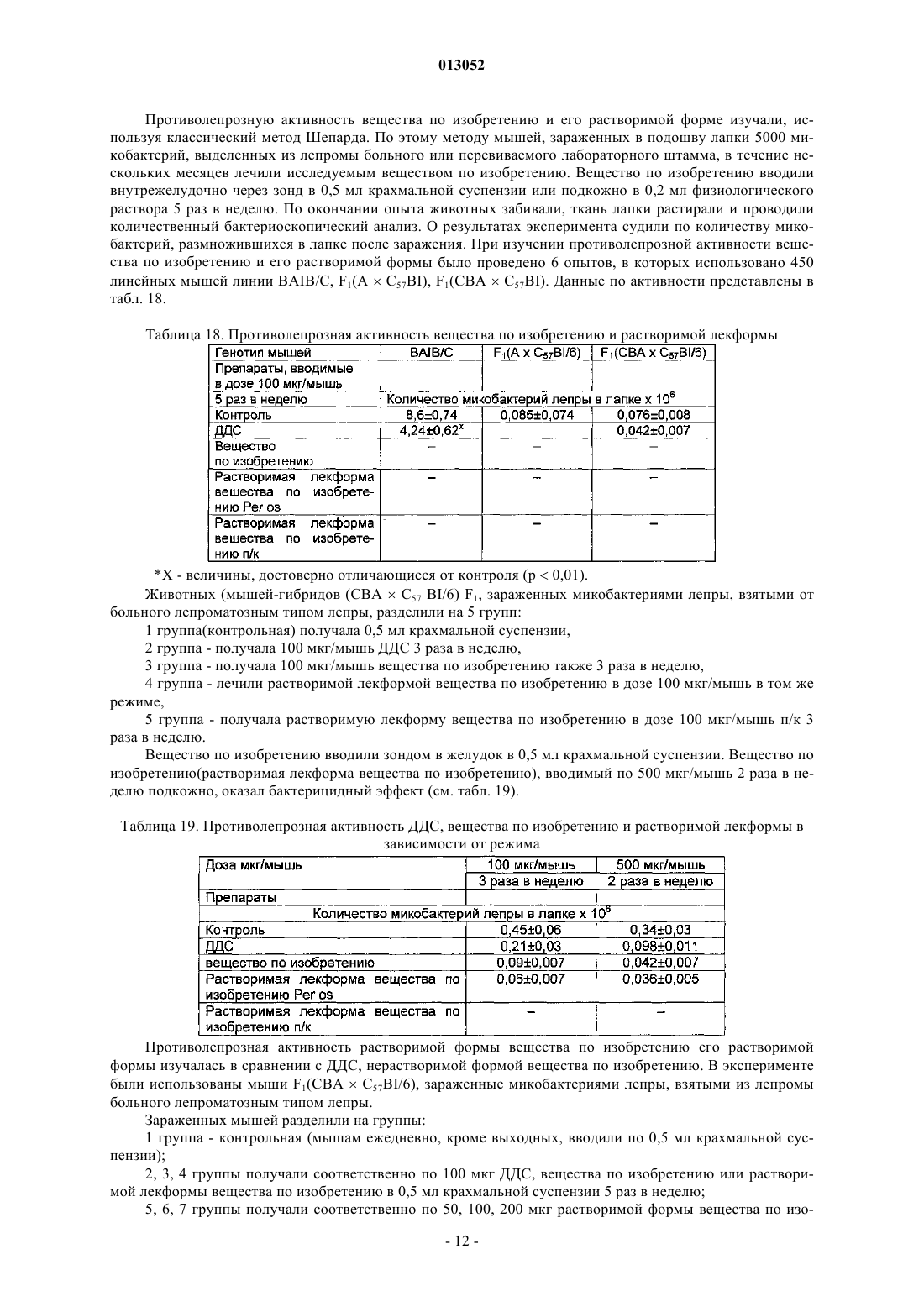
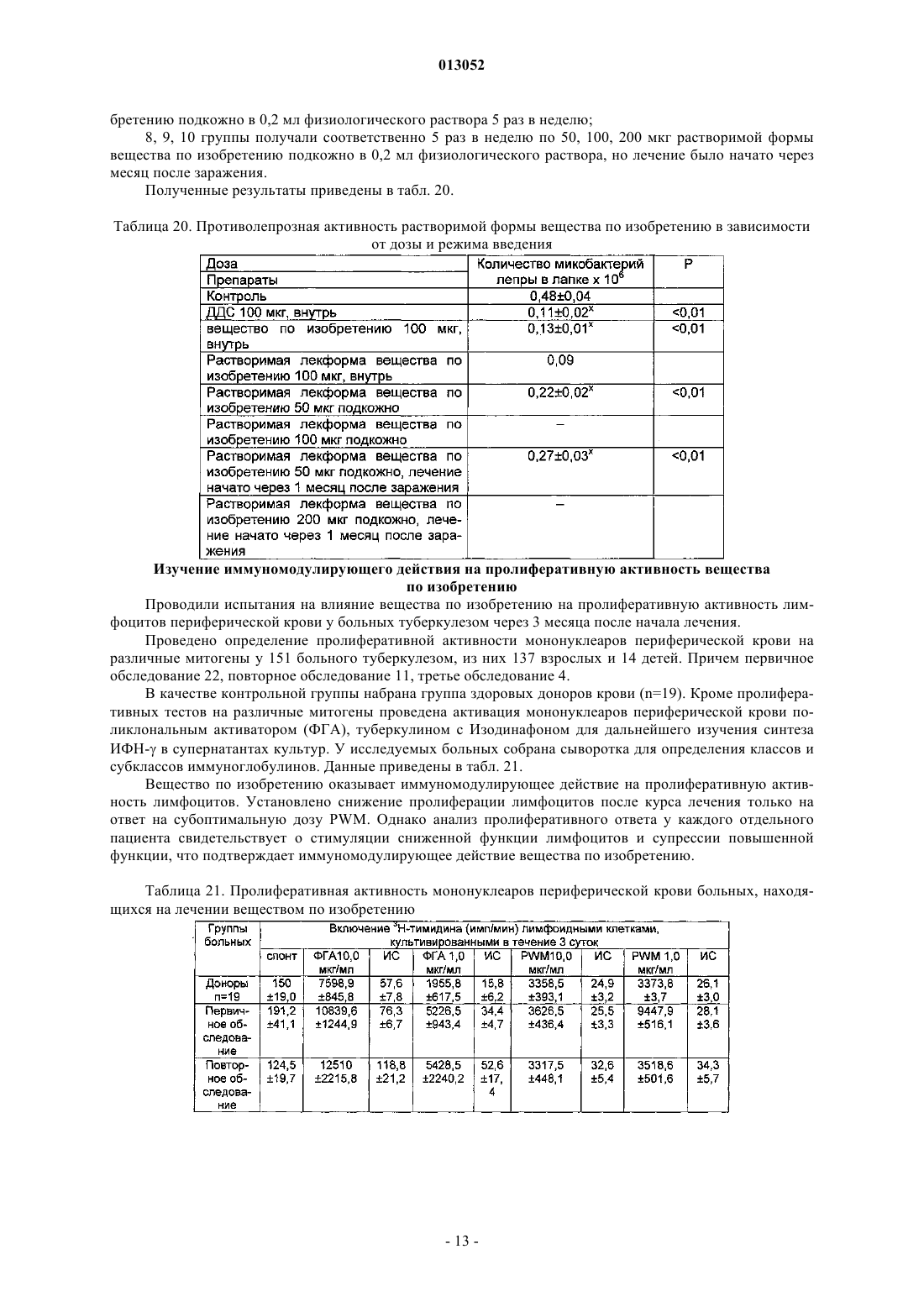
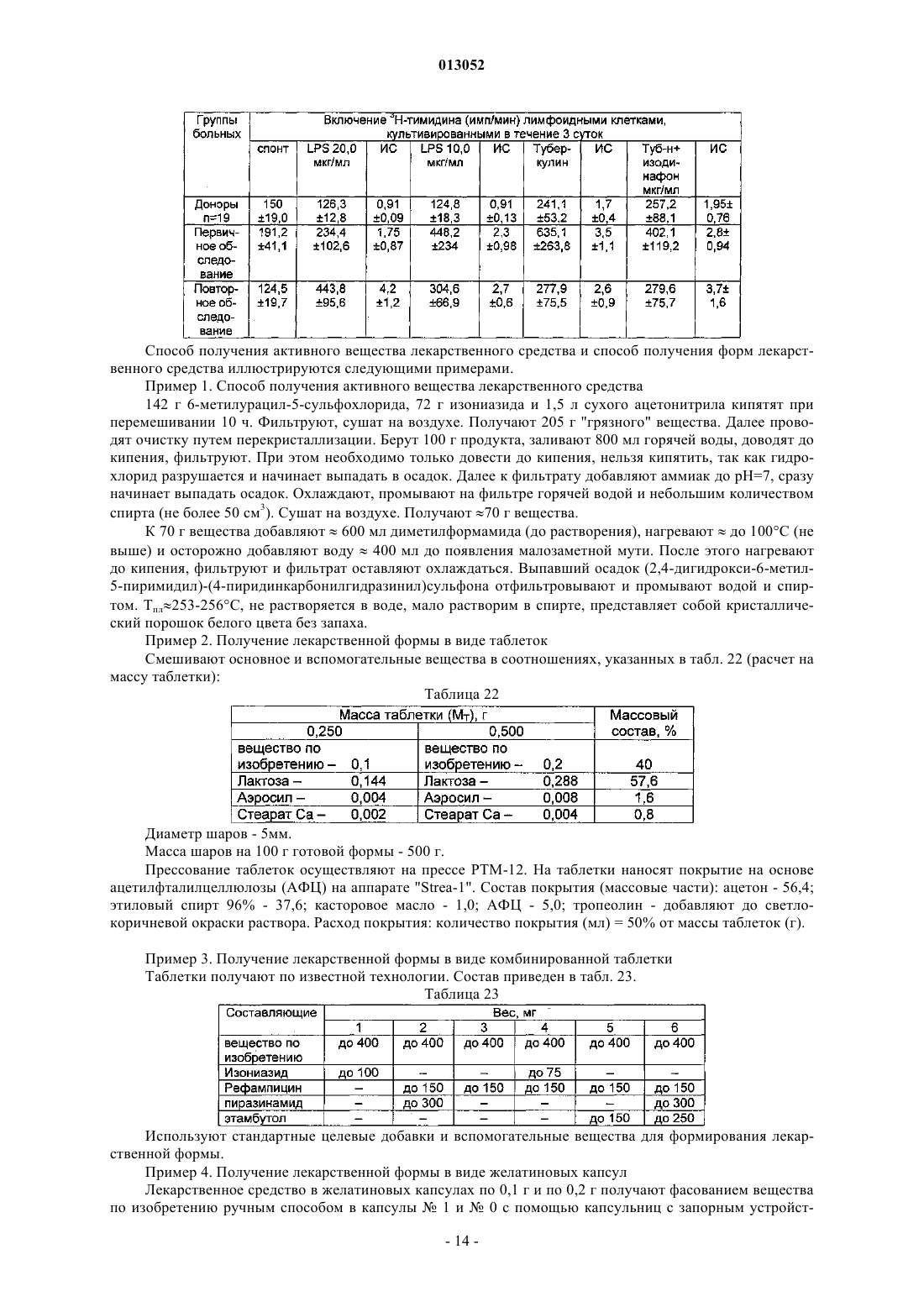
013052 Представленное изобретение относится к лекарственному средству, которое может быть использовано в медицине в комплексной терапии микробактериозов (туберкулез, лепра и так далее), неспецифических заболеваний легких, хламидиозе и герпетической инфекции, протекающих на фоне вторичного иммунодефицитного состояния организма. В настоящее время из уровня техники известно большое количество лекарственных средств того же назначения. Так, например, известен препарат изониазид (гидразид изоникотиновой кислоты -ГИНК) (см. Машковский М.Д., Лекарственные средства, т.2, Харьков, Тор-синг, 1997, с.с.332-333) формулы (I) Существенным недостатком изониазида является его высокая токсичность (LD50 равно 150 мг/кг), а также возникающие при длительном лечении расстройства пищеварения, деятельности почек, нервно психические, гематологические, аллергические проявления и токсические гепатиты. Известен препарат феназид (см. патент РФ 2080114), который представля ет собой хелатный комплекс двухвалентного железа изониазида формулы (II). Хотя этот препарат и обладает меньшей токсичностью, по сравнению с изониазидом, однако его уровень достаточно высок (LD50 равно 250-833 мг/кг). Кроме того, большим недостатком является то,что феназид не может применяться при сердечно-легочной недостаточности и тяжелых формах ишемической болезни сердца. Задачей данного изобретения является разработка нового лекарственного средства, которое сохраняло бы те же лечебные свойства, но имело более низкую (примерно в 50 раз меньше) токсичность, было стабильно в процессе хранения, а также у которого побочные эффекты были бы сведены к минимуму. Задача решается предложенным лекарственным средством, включающим активное вещество и целевые добавки, отличие которого состоит в том, что в качестве активного вещества оно содержит (2,4 дигидрокси-6-метил-5-пиримидил)-(4-пиридинкарбонилгидразинил)сульфон формулы (III) или изомеры в эффективном количестве. Предпочтительно лекарственное средство дополнительно содержит по меньшей мере одно противотуберкулезное средство. Предпочтительно лекарственное средство в качестве противотуберкулезного средства может содержать изониазид, рефампицин, пиразинамид. Предпочтительно лекарственное средство может быть изготовлено в виде таблеток, комбинированных таблеток, капсул, сиропа и инъекций. Получают (2,4-дигидрокси-6-метил-5-пиримидил)-(4-пиридинкарбонилгидразинил)сульфон формулы (III) по известной реакции путем взаимодействия 6-метилурацил-5-сульфохлорида с изониазидом в сухом ацетонитриле кипячением при перемешивании. Средство по изобретению может вводиться обычным образом перорально или парентерально (подкожно, внутривенно, внутримышечно, внутрибрюшинно). Дозировка зависит от возраста, состояния и веса пациента, а также от вида введения. Согласно изобретению, предлагаемое лекарственное средство содержит активного вещества в количестве от 0,1 до 4 г. Предложенные лекарственные средства изготавливаются обычным образом. Наряду с активным веществом лекарственные средства могут при этом содержать обычные вспомогательные вещества, принятые в технологии приготовления лекарств, такие как связующие для таблеток, наполнители, консерванты, вещества, разбрызгиваемые на таблетки, регуляторы текучести, мягчители, смачиватели, диспергаторы, эмульгаторы, растворители, пролонгаторы действия, антиокислители и/или пропелленты (смотри Н. Sucker et al.: Phar-mazeutische Technologie, Thieme-Verlag, Stuttgard, 1991). Кроме того, предложенные лекарственные средства вместо отдельных активных веществ могут содержать комбинации различных активных веществ, чтобы использовать совместно качества отдельных-1 013052 активных веществ при применении, или также потому, что отдельные активные вещества в сочетании обладают синергизмом, то есть, дают в итоге супераддитивное усиление действия. Клинические испытания Были проведены клинические испытания на больных туберкулезом органов дыхания, при лечении обострений хронического гнойного-обструктивного бронхита, при лечении больных пневмониями, а также на больных воспалительными заболеваниями респираторного тракта, вызванными внутриклеточными возбудителями (хламидиями). 1. Клинические испытания на больных туберкулезом органов дыхания Под наблюдением находились 62 больных с различными формами туберкулеза легких. Контрольную группу составляли 20 больных туберкулезом органов дыхания сходные по полу, возрасту, клиниколабораторным и рентгенологическим характеристикам процесса с исследуемой группой. Подавляющее большинство больных в исследуемой группе (55 человек - 88,8%) были мужчины, женщины составили только 11,2% (7 человек). Возрастной состав больных колебался от 18 до 70 лет. Все пациенты были с впервые выявленными формами туберкулеза. Наиболее частыми клиническими формами были инфильтративный туберкулез, туберкулезный плеврит, казеозная пневмония. У большинства наблюдаемых больных туберкулезный процесс носил распространенный характер. Полости распада определялись в 93,5% случаев, чаще всего они были множественные или с размерами каверн более 4-х см в диаметре. Бактериовыделение определялось у 42 человек (67,7%), которое в 53,2% случаев было массивным. У 1 больного выявлена лекарственная устойчивость ко всем противотуберкулезным препаратам. У больных при поступлении выявился интоксикационный синдром, который в 42,0% случаев имел выраженный характер (лихорадка, воспалительные изменения крови, снижение массы тела). Иммунологическое обследование, проведенное больным, включало оценку субпопуляционного состава лимфоцитов с использованием моноклональных антител к CD3+, CD4+, CD8+, CD16+, CD20+, CD25+ и определение концентрации иммуноглобулинов методом радиальной иммунодиффузии по Манчини. Функциональную активность Тклеток определяли в РБТЛ на ФТА и РТМЛ с ФГА и ППД. Специфический гуморальный и клеточный ответ оценивался по уровню противотуберкулезных антител в серологических реакциях (РПК, РИГА,ИФА) и в РБТЛ с ППД. Исследование иммунного статуса больных туберкулезом показало, что практически у всех них имелись те или иные нарушения иммунитета. У большинства из них процесс протекал на фоне сниженного абсолютного или относительного числа лимфоцитов, исходно низких показателей и дефицита Т-хелперов и Т-супрессоров. Отмечены более высокие исходные показатели ЕК (CD16+), что,по-видимому, компенсирует недостаток Т-лимфоцитов. У 40 больных (70,0%) были снижены показатели иммуноглобулинов, особенно классов А и G. Химиотерапия больным проводилась по традиционной схеме с применением 4-х противотуберкулезных препаратов (рефампицин, пиразинамид, стрептомицин или этамбутол, вместо изониазида больным в исследуемой группе назначалось средство по изобретению по 800 мг в сутки). Другие препараты, обладающие иммуномодулирующим действием, не применялись. Результаты исследования Эффективность комплексной полихимиотерапии оценивалась через 1, 2, 4 и 6 месяцев лечения. Положительный результат лечения в ближайшие сроки наблюдения (1-2 месяца) отмечен у 58 (93,5%) больных в исследуемой группе и у 12 (60,0%) в контрольной группе. Дезинтоксикация наступила у 42(67,7%) больных в исследуемой группе через 1 месяц и через 2 месяца ещ у 17 (27,4%) человек, в контрольной группе 45,0 и 25,0% соответственно. Уменьшилась интенсивность бактериовыделения у 19(30,6%) в исследуемой группе и у 4 (20,0%) человек в контрольной группе. Положительная рентгенологическая динамика процесса выявлена через 1 месяц в 51,8% наблюдений и ещ через 2 месяца в 42,5% в исследуемой группе, а в контрольной группе в 35,0 и 30,0% соответственно. Она проявлялась рассасыванием инфильтрации и части очагов, значительным уменьшением в размерах полостей распада. Наиболее значительные рентгенологические изменения отмечены у больных с выраженной экссудативной реакцией и стойкими изменениями иммунного статуса. Среди больных, закончивших 4-х месячный курс химиотерапии, негативация мокроты наступила в 95% в исследуемой группе и в 80% в контрольной группе. В 51,6% случаев в исследуемой группе и в 40,0% в контрольной группе закрылись полости распада. После 6 месяцев лечения только у 1 больного в исследуемой группе и у 2-х больных в контрольной группе сохранялось бактериовыделение и полости распада в легких. Переносимость больными средства по изобретению была удовлетворительная, у 3-х больных в исследуемой группе наблюдалась побочная реакция в виде кожной сыпи, других побочных реакций не отмечено. В тоже время у 2-х больных в группе, где применялось средство по изобретению, с клиническими признаками персистирующего хронического гепатита, повышением уровня биллирубина и трансаминаз в сыворотке крови, через 1 месяц химиотерапии произошла нормализация лабораторных показателей. После курса химиотерапии со средством по изобретению в течение 1-2 месяца анализ иммунологических сдвигов выявил разнонаправленность изменений показателей иммунитета. В исследуемой группе отмечены тенденции к увеличению содержания CD4+. При исходно сниженном содержании CD8+ изме-2 013052 нения их числа не наблюдалось. При исходно высоких показателях ЕК (CD16+) отмечалась динамика их нормализации. Выявлено положительное действие на функционирование В-системы, увеличение исходно сниженных показателей иммуноглобулинов. В 44,0% случаев отмечено повышение уровня Ig G и А. В контрольной группе на первых этапах лечения отмечались некоторые признаки иммунодепрессии, как следствие действия противотуберкулезных препаратов: снижение количества Е и В-лимфоцитов, особенно за счет Т-супрессоров. Однако через 6 месяцев полихимиотерапии различия в иммунном статусе больных в исследуемой и контрольной группах были не существенными. Иммуномодулирующее действие средства по изобретению проявляется на начальных этапах лечения туберкулеза (см. табл. 1 и 2). Оценка результатов лечения показала перспективность использования средства по изобретению в комплексном лечении больных с выраженными нарушениями иммунного статуса, распространенными и деструктивными формами туберкулеза легких. Средство по изобретению оказывается эффективным и при наличии тяжелых сопутствующих заболеваниях, когда изониазид противопоказан или вызывает неустранимые побочные реакции. Таблица 1. Динамика иммунологических показателей у больных туберкулезом легких при применении средства по изобретению (Мм)-3 013052 Таблица 2. Динамика иммунологических показателей у больных туберкулезом легких при применении средства по изобретению (Мм) Примечание:различие достоверно (р 0,05) по отношению к норме 2. Клинические испытания по лечению обострений хронического гнойно-обструктивного бронхита(ХГОБ) В процессе клинических испытаний было обследовано 28 больных ХГОБ. 14 больных получали средство по изобретению и 14 больных - плацебо. Эффективность лечения оценивали на основании редукции основных симптомов заболевания (кашля, одышки, изменения характера мокроты) в баллах по четырехбальной шкале в зависимости от степени выраженности клинических симптомов, а также исчезновения лихорадки и хрипов (в днях). Кашель, одышка: 3 балла - симптомы постоянно; 2 балла - больше, чем два раза; 1 балл - один раз; 0 - нет симптомов. Мокрота: 3 - гнойная; 2 - слизисто-гнойная; 1 - слизистая; 0 - нет мокроты. Степень активности воспаления оценивали по лабораторным данным. Активный воспалительный процесс считался при повышении лейкоцитов, увеличении СОЭ, наличии п/я сдвига, СРБ в сыворотке крови. Исследование проводили до лечения и повторяли на 7, 14 день терапии. Бактериологическое исследование мокроты продемонстрировало, что основными возбудителями ХГОБ были пневмококк, клебсиелла пневмонии, стафилококк, которые определялись в ассоциациях. Всем больным проводили исследование бронхиальной проходимости (ОФВ 1) до лечения и на 14 день терапии на аппарате " Flowscreen ". Режим терапии был следующим: 1. Подбор антибактериальной терапии эмпирически. 2. Прием средства по изобретению и плацебо в капсулах 200 мг два раза в день 14 дней.-4 013052 Таблица 3. Динамика клинических проявлений ХГОБ под влиянием приема средства по изобретению и плацебо (М) Примечание: Р 0,01; /, //, /// при сопоставлении с результатами в группе плацебо в конце терапии;при сопоставлении с данными до лечения. Отмечалось значительное уменьшение клинических симптомов (табл. 3) у больных, получавших средство по изобретению, в сравнении с исходными данными и плацебо. Хрипы в процессе лечения средством по изобретению исчезали на 7 день, а при приеме плацебо - на 10 день. Температура тела нормализовалась в группе пациентов, получаемых средство по изобретению на 3 день, плацебо - 5 день терапии. При оценке бронхиальной проходимости отмечалось достоверное увеличение ОФВ 1 в сравнении с исходными данными и плацебо к концу терапии (табл. 4) Таблица 4. Динамика показателей бронхиальной проходимости под влиянием приема средства по изобретению и плацебо (М) Примечание: Р 0,01, / при сравнении с результатами в группе плацебо в конце терапии;при сравнении с данными до лечения. Степень активности воспаления в большей степени уменьшилась в группе больных, получавших средство по изобретению (табл. 5). Таблица 5. Динамика частоты изменения воспалительных лабораторных тестов больных ХГОБ под влиянием приема средства по изобретению и плацебо Прием средства по изобретению не вызывал явлений непереносимости 3. Клинические испытания при лечении больных пневмонией В исследование были включены 20 стационарных больных пневмониями в возрасте от 16 до 65 лет. Распределение по группам было следующее: группа, получавшая средство по изобретению (основная) - 10 человек (6 мужчин и 4 женщины). Средний возраст 43,73,61. группа, получавшая плацебо (контрольная) - 10 человек (6 мужчин и 4 женщины). Средний возраст 43,84,49.-5 013052 У всех больных на основе клинико-диагностических критериев была выявлена внебольничная пневмония. Характеристика клинического течения пневмоний представлена следующим образом: Характеристика течения пневмонии Рентгенологические изменения характеризовались инфильтрацией легочных полей очагового, в том числе сливного характера (у троих больных основной и троих больных контрольной групп) и в одном случае (основная группа) интерстициального характера. Локализация пневмонии по данным рентгенологического исследования отражена следующим образом: Локализация пневмонии В исследование включались пациенты, страдающие пневмонией легкого и среднетяжелого течения. Все больные были введены в исследование не позднее 7-дневного срока от момента начала заболевания. Средняя продолжительность госпитализации до начала исследования составляла 4 дня. Всем больным назначались антибиотики в средних терапевтических дозировках, больным с типичным течением - полусинтетические пенициллины и цефалоспорины I-II поколений, с атипичным - макролидные антибиотики. Двое больных основной группы и один контрольной группы дополнительно получали сердечно-сосудистые препараты. Основные сопутствующие заболевания, выявленные в терапевтических группах, представлены следующим образом: Сопутствующая патология у больных пневмонией Обязательным условием участия в клиническом испытании являлось информированное письменное согласие пациента. В исследование не включались больные, имеющие аллергические реакции на препараты группы изониазида в анамнезе, серьезные нарушения функции печени или почек, терминальную стадию заболевания, беременность или риск беременности, тяжелые психоневрологические заболевания, а также больные, принимавшие участие в клиническом исследовании в течение последних 30 дней. Статический анализ показал отсутствие достоверных различий по исследуемым показателям между группами. Методы исследования В течение 21 дня больным проводился курс лечения средством по изобретению в дозе 0,22 раза в сутки или плацебо. Рандомизация терапевтических групп осуществлялась по таблице случайных чисел методом балансирующего числа. Каждый больной проходил полное клиническое и рентгенологическое обследование, исходно и на-6 013052 10 сутки от начала исследования. Критерии оценки эффективности включали: изменение характера и частоты кашля, количества мокроты, выраженность потливости, головных и мышечных болей, слабости, динамика рентгенологических изменений (полная, неполная, отсутствует), частота возникновения эпизодов острой суперинфекции на фоне проводимого лечения. Оценка проводилась лечащим врачом, а также самостоятельно больным при ведении дневника. Каждый критерий оценивался больным количественно в баллах от 0 до 4. На основании анализа дневника дольного и объективных показателей к 10 дню определялся общий результат лечения: Клинические результаты Положительная динамика клинико-рентгенологических симптомов была отмечена у большинства больных как основной, так и контрольной групп. Однако более выраженной она оказалась у больных основной группы. Так, к десятому дню лишь 4 больных основной и 7 больных контрольной групп имели редкий кашель. Больные основной группы к этому времени выделяли меньшее количество мокроты. Более выраженной в основной группе пациентов оказалась и динамика симптомов интоксикации (слабость,миалгии, потливость). Тяжесть состояния на 10 сутки оценивалась в 36,2+3,4 балла в основной и 47,3+4,8 балла в контрольной группе. Отсутствие положительной рентгенологической динамики было отмечено у 2 больных контрольной группы, у 1 из больных этой группы отмечался эпизод респираторной суперинфекции (ОРВИ). У больных обеих групп к 10 дню лечения отмечалось уменьшение количества лейкоцитов в крови и нормализация СОЭ. Динамика изменений основных биохимических параметров крови (АЛТ, билирубин, креатинин), а также патологических изменений мочи как до, так и в ходе лечения выявлено не было. Таблица 6. Динамика основных клинических показателей Комплексная оценка клинической эффективности средства по изобретению Выраженных побочных эффектов при приеме средства по изобретению, потребовавших его отмены или уменьшения дозы, не было отмечено ни у одного больного. 3. Клинические испытания при лечении больных с воспалительными заболеваниями респираторного тракта, вызванными внутриклеточными возбудителями (хламидиями) Первая группа (основная) - 12 человек получали по 400 мг средства по изобретению ежедневно; вторая группа- 8 человек плацебо. Всем больным, включенным в исследование, была назначена монотерапия. Лечение продолжалось в течение 21 дня. Больные получали по 1 капсуле средства по изобретению - 0,2 два раза в сутки. Паци-7 013052 ентам, включенным в группу плацебо, применяли идентичные по внешнему виду капсулы с индифферентным наполнителем в аналогичных дозировках. Клинико-лабораторное, иммунологическое и инструментальное обследование проводилось до начала лечения, на 7 день от начала приема средства по изобретению и непосредственно после окончания курса. Методы исследования, этические нормы, критерии отбора и исключения пациентов из исследования, а также другие обязательные критерии протокола исследования выполнены в соответствии с утвержденным Протоколом клинических испытаний. Все больные, включенные в данное исследование, находились под диспансерным наблюдением в 7 ГКБ. При оценке эффективности средства по изобретению использовался набор традиционных клиниколабораторных и инструментальных параметров, выполненных по программе диспансерного наблюдения данной категории пациентов (табл. 7). Таблица 7 Все больные, включенные в исследование, и группы исследования были сопоставимы между собой по основным критериям, характеризующим пациентов и длительность заболеваний. На основании данных подробного клинического обследования больных были проанализированы сопутствующие заболевания, находящиеся в фазе стойкой медикаментозной ремиссии или не входящие в перечень Критерии исключения пациентов из исследований. Критериями включения в настоящее исследование являлись: наличие хронических рецидивирующих инфекций респираторного тракта (хронический фарингит,фаринготрахеит, хронический рецидивирующий ларингит, хронический бронхит); наличие положительной реакции на Chlamidia trachomatis на мазках из зева методом полимеразной цепной реакции (ПЦР). Критерии исключения: наличие острых вирусных инфекций и других состояний, изменяющих параметры иммунного, интерферонового статуса, системы фагоцитов; необходимость в приеме медикаментов (по поводу основного или сопутствующего заболеваний),которые могут повлиять на показатели иммунного, интерферонового статуса и активности фагоцитов. У наблюдаемых больных, включенных в настоящее исследование, были признаки хронического воспаления респираторного тракта, в виде рецидивирующего фарингита, трахеита, в ряде случаев рецидивирующего ларингита. Практически у всех пациентов в анамнезе были частые повторные курсы антибактериальной терапии. Иммунологическое и вирусологическое обследование проводили в динамике до лечения, через 1 неделю и через 3 недели от начала лечения. Исследование иммунного статуса включало определение 6 субпопуляций лимфоцитов: CD3+,CD4+, CD8+, CD72+, CD16+, DR+, иммунорегуляторного индекса (ИРИ), иммуноглобулинов классов А,М, G, циркулирующих иммунных комплексов (ЦИК), функциональной активности антител (авидность антител). Изучение интерферонового статуса включало определение уровня сывороточного интерферона(ИФН), способности продуцировать ИФН- (под воздействием вируса болезни Ньюкалса), а также способности продуцировать ИФН- под воздействием ФГА и КонА. Состояние системы фагоцитов оценивали в оригинальном хемилюминесцентном тесте по спонтанной активности нейтрофилов, а также по способности активироваться (коэффициент ХЛ) при инкубации их с 3-мя разведениями вещества по изобретению и двумя иммунотропными препаратами (тимоген и циклоферон). Детекцию Chlamidia thrachomatis проводили с помощью полимеразной цепной реакции (ПЦР). Материалом для выделения ДНК служили эпителиальные клетки из зева, слюна, лейкоциты и лимфоциты периферической крови. В работе были использованы диагностические наборы производства НПФ "Литех". При обследовании больных ХРХ были обнаружены изменения в системе иммунитета и интерфероногенезе. Так был достоверно повышен уровень IgA в сыворотке крови, у половины больных повышен уровень IgM, снижен уровень IgG, у большинства больных обеих групп преобладала продукция низкоавидных, то есть функционально неполноценных антител, было снижено содержание В-лимфоцитов. В субпопуляциях лимфоцитов в целом наблюдалась тенденция к снижению содержания общих Тлимфоцитов, Т-хелперов, Т-супрессоров. Выраженные изменения выявлены у больных ХРХ и в системе интерферона. Так у большинства пациентов в сыворотке крови был повышен уровень интерферона и снижена способность к вирус-8 013052 индуцированной продукции ИФН-альфа. Состояние гуморального иммунитета у больных с хроническим респираторным хламидиозом на фоне лечения средством по изобретению представлено в табл. 8. Таблица 8. Содержание иммуноглобулинов классов А, М, G и циркулирующих иммунных комплексов(ЦИК) до и на фоне лечения средством по изобретению у больных с хроническим респираторным хламидиозом (п=20)- достоверность различий по сравнению с показателями группы здоровых доноров. Исследование авидности антителу больных ХРХ в исходной точке показало наличие снижения продукции высокоавидных, то есть функционально полноценных антител у большинства пациентов опытной и контрольной групп. Среди больных контрольной группы достоверных положительных сдвигов в этих показателях не наблюдалось, сохранялось преобладание синтеза функционально неполноценных антител (см. табл. 9). Таблица 9. Показатели авидности антител у больных с хроническим респираторным хламидиозом в динамике на фоне лечения средством по изобретению в основной группе (n=12) и группе сравнения (n=8)-достоверное различие с исходными показателями, р 0,05-достоверность различий по сравнению с показателями группы здоровых доноров. Состояние клеточного иммунитета у больных с хроническим респираторным хламидиозом на фоне лечения средством по изобретению Как уже упоминалось выше, у части больных были выявлены умеренное уменьшение Т-хелперов(CD4+), Т-супрессоров (CD8+) общее число Т-лимфоцитов (CD3+) было ближе к нижней границе нормы. В среднем по группам изменения этих показателей были недостоверными, что, по-видимому, обусловлено небольшим числом наблюдений (табл. 10 и 11). Таблица 10. Показатели (%) Т-звена иммунитета у больных с хроническим респираторным хламидиозом в динамике на фоне лечения средством по изобретению в основной группе-9 013052 Таблица 11. Показатели (относительные) Т-звена иммунитета в динамике у больных с хроническим респираторным хламидиозом группы сравнения, не получавших средство по изобретению (n=8)-достоверность различиq по сравнению с показателями группы здоровых доноров. Состояние интерферонового статуса у больных с хроническим респираторным хламидиозом на фоне лечения средством по изобретению Как уже упоминалось, у большинства больных ХРХ обнаружены повышение уровня сывороточного интерферона и снижение способности к вирус-индуцированной продукции ИФН-альфа. На фоне приема средства по изобретению у больных основной группы содержание сывороточного ИФН сохранялось на прежнем уровне как при исследовании через одну, так и через три недели лечения, в то время как в группе сравнения у части пациентов уровень сывороточного ИФН за время наблюдения существенно повысился (табл. 12). Таблица 12. Динамика показателей интерферонового статуса у больных с хроническим респираторным хламидиозом на фоне приема средства по изобретению в основной группе и в группе сравнения-достоверность различий по сравнению с показателями группы здоровых доноров. Функциональная активность нейтрофилов у больных с хроническим респираторным хламидиозом на фоне приема средства по изобретению При исследовании функциональной способности нейтрофилов по ХЛ-тесту существенных отклонений от нормальных пределов у большинства больных выявлено не было. Важно отметить, что при применении средства по изобретению в течение 21 дня сохранялся адекватный ответ нейтрофилов в тесте in vitro как на повторную стимуляцию средством по изобретению, так и на воздействие других иммунокорректоров (тимоген, циклоферон), таким образом за время лечения не возникли как толерантность клеток крови к стимулирующему действию средства по изобретению, так и их гипореактивность на действие других иммунокорректоров (табл. 13). Таблица 13. Показатель функциональной активности нейтрофилов Кхл (коэффициент хемилюминисценции) до и на фоне лечения средством по изобретению (n=12) Результаты ПЦР-диагностики хронической респираторной хламидийной инфекции в ходе терапии средством по изобретению Применение средства по изобретению в виде монотерапии в течение трех недель у больных с хроническим респираторным хламидиозом в 9 из 12 случаев привело к подавлению хламидийной инфекции,- 10013052 в том числе при наличии резистентности к антихламидийным антибиотикам. В группе сравнения среди больных, получавших плацебо, случаев подавления хронической хламидийной инфекции за время наблюдения не выявлено (табл. 14). Таблица 14. Показатели у больных с хроническим респираторным хламидиозом в динамике на фоне лечения средством по изобретению в основной группе (n=12) и группе сравнения (n=8) Для сравнения далее представлены данные по лечению феназидом, приведенные в табл. 15-17. Таблица 15. Эффективность применения феназида при лечении больных с первичным туберкулезом легких Таблица 16. Частота прекращения бактериовыделения через 3 месяца применения феназида при лечении больных деструктивным туберкулезом легких Таблица 17. Частота закрытия каверн через 3 месяца применения феназида при лечении больных деструктивным туберкулезом легких Биологическая активность вещества по изобретению Оценка противотуберкулезной активности in vitro вещества по изобретению Критериями оценки были уровни минимальных подавляющей и бактерицидной концентрации(МПК, МБК). Определение МПК, МБК проводили стандартным методом серийных разведений в соответствии с требованиями Фармакологического комитета (Руководство по экспериментальному (доклиническому) изучению новых лекарственных веществ, М., 2000 г). Тест-культура: H37Rv - лабораторный штамм М. Tuberculosis, высоковирулентный, чувствительный к противотуберкулезным препаратам. Для приготовления матричного раствора вещества по изобретению взвешивали 10 мг порошка и добавляли 1 мл димексида. Происходило неполное растворение вещества (мелкодисперсная взвесь). Для приготовления рабочих растворов использовали в качестве разбавителя среду Школьниковой. Для определения МПК и МБК в течение 2 недель выращивали тест-культуру в жидкой питательной среде Школьниковой с добавлением различных концентраций вещества по изобретению в широком диапазоне (128; 64; 32; 16; 8; 4; 2; 1; 0,5; 0,25; 0,125; 0,06 мкг/мл). Затем приготавливали мазки и окрашивали по Цилю-Нильсену. В мазках подсчитывали количество микробактерий и на основании полученных результатов определяли МПК вещества по изобретению, при котором наблюдалось подавление их роста. Жизнеспособность МБТ после воздействия вещества по изобретению оценивали по способности их к росту на среде Левенштейна-Йенсена (после удаления вещества по изобретению путем отмывания физиологическим раствором). МБК вещества по изобретению устанавливали по отсутствию роста культуры. В результате проведенных исследований установлено, что МПК вещества по изобретению варьировала от 8 до 16 мкг/мл; МБК - 16-32 мкг/мл. Такой разброс значений, вероятно, обусловлен низкой растворимостью вещества по изобретению. Изучение противолепрозной активности вещества по изобретению - (2,4-дигидрокси-6-метил-5 пиримидил)-(4-пиридинкарбонилгидразинил)сульфона и его растворимой формы- 11013052 Противолепрозную активность вещества по изобретению и его растворимой форме изучали, используя классический метод Шепарда. По этому методу мышей, зараженных в подошву лапки 5000 микобактерий, выделенных из лепромы больного или перевиваемого лабораторного штамма, в течение нескольких месяцев лечили исследуемым веществом по изобретению. Вещество по изобретению вводили внутрежелудочно через зонд в 0,5 мл крахмальной суспензии или подкожно в 0,2 мл физиологического раствора 5 раз в неделю. По окончании опыта животных забивали, ткань лапки растирали и проводили количественный бактериоскопический анализ. О результатах эксперимента судили по количеству микобактерий, размножившихся в лапке после заражения. При изучении противолепрозной активности вещества по изобретению и его растворимой формы было проведено 6 опытов, в которых использовано 450 линейных мышей линии BAIB/C, F1(AC57BI), F1(CBAC57BI). Данные по активности представлены в табл. 18. Таблица 18. Противолепрозная активность вещества по изобретению и растворимой лекформы Х - величины, достоверно отличающиеся от контроля (р 0,01). Животных (мышей-гибридов (СВАС 57 BI/6) F1, зараженных микобактериями лепры, взятыми от больного лепроматозным типом лепры, разделили на 5 групп: 1 группа(контрольная) получала 0,5 мл крахмальной суспензии,2 группа - получала 100 мкг/мышь ДДС 3 раза в неделю,3 группа - получала 100 мкг/мышь вещества по изобретению также 3 раза в неделю,4 группа - лечили растворимой лекформой вещества по изобретению в дозе 100 мкг/мышь в том же режиме,5 группа - получала растворимую лекформу вещества по изобретению в дозе 100 мкг/мышь п/к 3 раза в неделю. Вещество по изобретению вводили зондом в желудок в 0,5 мл крахмальной суспензии. Вещество по изобретению(растворимая лекформа вещества по изобретению), вводимый по 500 мкг/мышь 2 раза в неделю подкожно, оказал бактерицидный эффект (см. табл. 19). Таблица 19. Противолепрозная активность ДДС, вещества по изобретению и растворимой лекформы в зависимости от режима Противолепрозная активность растворимой формы вещества по изобретению его растворимой формы изучалась в сравнении с ДДС, нерастворимой формой вещества по изобретению. В эксперименте были использованы мыши F1(CBAC57BI/6), зараженные микобактериями лепры, взятыми из лепромы больного лепроматозным типом лепры. Зараженных мышей разделили на группы: 1 группа - контрольная (мышам ежедневно, кроме выходных, вводили по 0,5 мл крахмальной суспензии); 2, 3, 4 группы получали соответственно по 100 мкг ДДС, вещества по изобретению или растворимой лекформы вещества по изобретению в 0,5 мл крахмальной суспензии 5 раз в неделю; 5, 6, 7 группы получали соответственно по 50, 100, 200 мкг растворимой формы вещества по изо- 12013052 бретению подкожно в 0,2 мл физиологического раствора 5 раз в неделю; 8, 9, 10 группы получали соответственно 5 раз в неделю по 50, 100, 200 мкг растворимой формы вещества по изобретению подкожно в 0,2 мл физиологического раствора, но лечение было начато через месяц после заражения. Полученные результаты приведены в табл. 20. Таблица 20. Противолепрозная активность растворимой формы вещества по изобретению в зависимости от дозы и режима введения Изучение иммуномодулирующего действия на пролиферативную активность вещества по изобретению Проводили испытания на влияние вещества по изобретению на пролиферативную активность лимфоцитов периферической крови у больных туберкулезом через 3 месяца после начала лечения. Проведено определение пролиферативной активности мононуклеаров периферической крови на различные митогены у 151 больного туберкулезом, из них 137 взрослых и 14 детей. Причем первичное обследование 22, повторное обследование 11, третье обследование 4. В качестве контрольной группы набрана группа здоровых доноров крови (n=19). Кроме пролиферативных тестов на различные митогены проведена активация мононуклеаров периферической крови поликлональным активатором (ФГА), туберкулином с Изодинафоном для дальнейшего изучения синтеза ИФН- в супернатантах культур. У исследуемых больных собрана сыворотка для определения классов и субклассов иммуноглобулинов. Данные приведены в табл. 21. Вещество по изобретению оказывает иммуномодулирующее действие на пролиферативную активность лимфоцитов. Установлено снижение пролиферации лимфоцитов после курса лечения только на ответ на субоптимальную дозу PWM. Однако анализ пролиферативного ответа у каждого отдельного пациента свидетельствует о стимуляции сниженной функции лимфоцитов и супрессии повышенной функции, что подтверждает иммуномодулирующее действие вещества по изобретению. Таблица 21. Пролиферативная активность мононуклеаров периферической крови больных, находящихся на лечении веществом по изобретению Способ получения активного вещества лекарственного средства и способ получения форм лекарственного средства иллюстрируются следующими примерами. Пример 1. Способ получения активного вещества лекарственного средства 142 г 6-метилурацил-5-сульфохлорида, 72 г изониазида и 1,5 л сухого ацетонитрила кипятят при перемешивании 10 ч. Фильтруют, сушат на воздухе. Получают 205 г "грязного" вещества. Далее проводят очистку путем перекристаллизации. Берут 100 г продукта, заливают 800 мл горячей воды, доводят до кипения, фильтруют. При этом необходимо только довести до кипения, нельзя кипятить, так как гидрохлорид разрушается и начинает выпадать в осадок. Далее к фильтрату добавляют аммиак до рН=7, сразу начинает выпадать осадок. Охлаждают, промывают на фильтре горячей водой и небольшим количеством спирта (не более 50 см 3). Сушат на воздухе. Получают 70 г вещества. К 70 г вещества добавляют 600 мл диметилформамида (до растворения), нагреваютдо 100 С (не выше) и осторожно добавляют воду 400 мл до появления малозаметной мути. После этого нагревают до кипения, фильтруют и фильтрат оставляют охлаждаться. Выпавший осадок (2,4-дигидрокси-6-метил 5-пиримидил)-(4-пиридинкарбонилгидразинил)сульфона отфильтровывают и промывают водой и спиртом. Тпл 253-256 С, не растворяется в воде, мало растворим в спирте, представляет собой кристаллический порошок белого цвета без запаха. Пример 2. Получение лекарственной формы в виде таблеток Смешивают основное и вспомогательные вещества в соотношениях, указанных в табл. 22 (расчет на массу таблетки): Таблица 22 Диаметр шаров - 5 мм. Масса шаров на 100 г готовой формы - 500 г. Прессование таблеток осуществляют на прессе РТМ-12. На таблетки наносят покрытие на основе ацетилфталилцеллюлозы (АФЦ) на аппарате "Strea-1". Состав покрытия (массовые части): ацетон - 56,4; этиловый спирт 96% - 37,6; касторовое масло - 1,0; АФЦ - 5,0; тропеолин - добавляют до светлокоричневой окраски раствора. Расход покрытия: количество покрытия (мл) = 50% от массы таблеток (г). Пример 3. Получение лекарственной формы в виде комбинированной таблетки Таблетки получают по известной технологии. Состав приведен в табл. 23. Таблица 23 Используют стандартные целевые добавки и вспомогательные вещества для формирования лекарственной формы. Пример 4. Получение лекарственной формы в виде желатиновых капсул Лекарственное средство в желатиновых капсулах по 0,1 г и по 0,2 г получают фасованием вещества по изобретению ручным способом в капсулы 1 и 0 с помощью капсульниц с запорным устройст- 14013052 вом. Состав: вещество по изобретению - 0,1 г и 0,2 г без наполнителей и консервантов. Навеску вещества по изобретению 10,0 г помещают на пластину капсульницы, распределяют по поверхности пластины и далее в соответствии с описанием процесса работы с капсульницей. Желатиновые капсулы состоят из хинолина эпу - 0,05%, титана диоксида- 1,0%, желатина - до 100%. Входящие в состав капсул вещества разрешены к медицинскому применению в России. Пример 5. Получение лекарственной формы в виде суспензии (сиропа). На 100 мл конечной лекарственной формы берут вещество по изобретению - до 4 г, фруктозы - до 20 г, ароматизаторы, а также целевые добавки до сохранения свежеприготовленной суспензии (путем доведения ее кипяченой водой до 100 мл) сроком до 10 дней в прохладном защищенном от света месте. Целевые добавки и вспомогательные вещества - пропиленгликоль, натрия цикламат, камедь ксантановая, фруктозовый сироп, натрия бензоат, натрия сахаринат моногидрат, этанол 95%, аромат апельсиновый 51.941/А, натрия цитрат дигидрат, мальтодекстрин KMS Х-50, дистиллированная вода - вводят в обычных количествах, используемых для приготовления суспензий (сиропов), по известной технологии. Приготовленную суспензию перед каждым употреблением взбалтывать. Пример 6. Получение лекарственной формы в виде инъекций. Лекарственное средство для инъекций представляет собой рассыпку порошка лекарственного средства, включающего активное вещество и его фармацевтически приемлемые соли в дозировке 0,1-0,5 г. Получение лекарственного средства в виде инъекций осуществляют по известной методике в соответствии со следующей схемой. Лечебный эффект вышеуказанных форм заявленного лекарственного средства аналогичен. Преимущества заявленного лекарственного средства состоят в следующем. Токсичность заявленного лекарственного средства составляет 7000 мг/кг, а токсичность Феназида 2000 мг/кг. Поскольку токсичность Феназида в 3,5 раза выше, заявленное лекарственное средство может применяться при резистентных формах заболеваний, а также в больших дозировках и более длительное время. В ходе доклинического изучения на культурах микобактерий было установлено, что заявленное лекарственное средство в концентрации 20 мкг/мл обладает бактерицидным, а в концентрациях 8-10 мкг/мл бактериостатическим действием в отношении чувствительных к изониазиду лабораторных штаммов микобактерий туберкулеза, в то время как у Феназида эти показатели завышены почти в 2 раза, что указывает на более высокую антибактериальную активность. Кроме того, заявленное лекарственное средство лишено побочных эффектов, которые присущи Феназиду: не может применяться при сердечно-легочной недостаточности, тяжелых формах ишемической болезни сердца. Современная концепция лечения больных туберкулезом предусматривает наряду с базисной химиотерапией назначение различных иммуномодулирующих средств, что увеличивает риск развития побочных реакций и повышает стоимость лечения. Большие перспективы в повышении эффективности химиотерапии больных туберкулезом открывает применение препаратов, обладающих наряду с антимикобактериальным иммунокорригирующим действием. Таким является заявленное лекарственное средство. Заявленное лекарственное средство стабильно в процессе хранения. Не меняет внешний вид, физи- 15013052 ческие характеристики и биологические свойства в течение нескольких лет, например 3 лет и более. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лекарственное средство, включающее активное вещество и целевые добавки, отличающееся тем,что в качестве активного вещества оно содержит (2,4-дигидрокси-6-метил-5-пиримидил)-(4 пиридинкарбонилгидразинил)сульфон формулы (III) 2. Лекарственное средство по п.1, отличающееся тем, что оно дополнительно содержит по меньшей мере одно противотуберкулезное средство. 3. Лекарственное средство по п.2, отличающееся тем, что в качестве противотуберкулезных средств оно содержит изониазид, рефампицин, пиразинамид. 4. Лекарственное средство по одному из пп.1-3, отличающееся тем, что оно изготовлено в виде таблеток, комбинированных таблеток, капсул, сиропа и инъекций.
МПК / Метки
МПК: A61P 31/22, A61K 31/513, A61P 31/04, A61P 31/06, A61P 31/08
Метки: лекарственное, средство
Код ссылки
<a href="https://eas.patents.su/17-13052-lekarstvennoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственное средство</a>
Предыдущий патент: Масло из микробных клеток, композиция, содержащая масло, и способ получения масла
Следующий патент: Двуслойная таблетка, содержащая телмисартан и амлодипин
Случайный патент: Способ экструдирования непрерывно формованной массы