Способ получения антигенных структур, усиливающих специфическую перекрестную реактивность
Номер патента: 5313
Опубликовано: 30.12.2004
Авторы: Мусио Гонсалес Верена Лусила, Пентон Ариас Эдуардо, Дуарте Кано Карлос, Крус Рикондо Луис Хавьер, Гильен Ньето Херардо Энрике, Агилар Рубидо Хулио Сесар, Реес Акоста Освальдо, Гарай Перес Ильда Элиса, Иглесиас Перес Энрике
Формула / Реферат
1. Способ получения антигенных структур, способных усиливать специфическую перекрестную реактивность, включающий стадии:
A) отбор представляющего интерес эпитопа;
B) получение разветвленных структур с эпитопами, отобранными на стадии (A), с помощью способа синтеза, выбранного из следующей группы: 1) синтеза на ядре аспарагиновой кислоты или лизина; 2) синтеза на ядре органических молекул и 3) прямого связывания пептидов с разветвленным ядром; причем B- и T-клеточные эпитопы могут быть объединены на одном ядре;
C) конъюгирование одной или различных разветвленных структур, полученных на стадии (B), с одной или различными молекулами-носителями с помощью способа связывания, выбранного из группы, состоящей из 1) конъюгирования с использованием альдегида глутаровой кислоты, 2) с использованием янтарного ангидрида, 3) с использованием сложного эфира N-гидроксисукцинимида b-малеимидопропионовой кислоты (MPS) и 4) любого способа, не требующего использования спейсерных агентов с ароматическими боковыми цепями;
D) объединение конъюгатов, полученных на стадии (C), включая добавление CD4-связывающего пептида или содержащего его конъюгата; и
E) введение полученного препарата в квасцы или любой другой приемлемый адъювант.
2. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к областям вируса иммунодефицита человека типа 1 или 2.
3. Способ по п.2, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к вариабельным областям вируса иммунодефицита человека типа 1 или 2.
4. Способ по п.3, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к третьей вариабельной области (V3) вируса иммунодефицита человека типа 1 или 2.
5. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к вирусу гепатита B.
6. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к вирусу гепатита C.
7. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к вирусу Денге.
8. Способ по п.1, отличающийся тем, что олигомеры, содержащиеся в структурах, полученных на стадии (B), относятся к полисахаридным областям Neisseria meningitidis.
9. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), являются пептидомиметиками антигенных полисахаридов.
10. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к антигенным областям микроорганизма или патогена.
11. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к аутоантигенам.
12. Способ по п.11, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (B), относятся к гонадотропинсекретирующему гормону.
13. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (C), является поверхностным антигеном гепатита B, HBsAg.
14. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (C), является белком p64K Neisseria meningitidis.
15. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (C), является ядерным белком вируса иммунодефицита человека.
16. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (C), является ядерным антигеном гепатита B или ядерным антигеном гепатита C.
17. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (C), является полисахаридом.
18. Способ по п.17, отличающийся тем, что молекула-носитель, используемая на стадии (C), является декстраном.
19. Способ по п.1, отличающийся тем, что молекулу-носитель и разветвленную структуру, используемые на стадии (C), связывают ковалентно, электростатически или на основе гидрофобности.
20. Антигенная структура, способная усиливать специфическую перекрестную реактивность, включающая разветвленные антигенные эпитопы, связанные с белками-носителями.
21. Антигенная структура по п.20, отличающаяся тем, что эпитопы разветвленной области имеют пептидную или олигосахаридную природу.
22. Антигенная структура по п.21, отличающаяся тем, что эпитопы пептидной природы представляют собой пептидную консенсусную последовательность вариабельных областей, выбираемых из подтипов, подгрупп, серотипов или ассоциаций другого типа.
23. Антигенная структура по п.21, отличающаяся тем, что эпитопы пептидной природы представляют собой пептидные библиотеки пептидных последовательностей, выбираемых из микроорганизмов или пептидомиметиков.
24. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к вирусу иммунодефицита человека типа 1 или 2.
25. Антигенная структура по п.24, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к вариабельным областям вируса иммунодефицита человека типа 1 или 2.
26. Антигенная структура по п.25, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к вариабельной области V3 вируса иммунодефицита человека типа 1 или 2.
27. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к областям вируса гепатита B.
28. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к областям вируса гепатита C.
29. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к областям вируса Денге.
30. Антигенная структура по п.21, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к полисахаридным антигенам Neisseria meningitidis.
31. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей являются пептидомиметиками полисахаридных или белковых антигенов.
32. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к микроорганизмам или патогенам.
33. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы из разветвленных пептидных областей относятся к аутоантигенам.
34. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к гонадотропинсекретирующему гормону.
35. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является поверхностным антигеном вируса гепатита B, HBsAg.
36. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является белком p64K Neisseria meningitidis.
37. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является нуклеокапсидным антигеном ВИЧ.
38. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является нуклеокапсидным антигеном HBV (HBcAg).
39. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является полисахаридом.
40. Антигенная структура по п.39, отличающаяся тем, что молекула-носитель является декстраном.
41. Применение антигенной структуры по любому из пп.20-40 в диагностической системе на антигены вируса иммунодефицита человека типа 1 и 2, вируса гепатита C, вируса гепатита B, вируса Денге, Neisseria meningitidis, гонадотропинсекретирующего гормона.
42. Применение антигенной структуры по любому из пп.20-40 в профилактических и терапевтических вакцинах, направленных на вирус иммунодефицита человека типа 1 и 2, вирус гепатита C, вирус гепатита B, вирус Денге, Neisseria meningitidis, гонадотропинсекретирующий гормон.
43. Вакцинная композиция, включающая антигенную структуру по любому из пп.20-40 в сочетании с приемлемым адсорбирующим веществом или адъювантом.
44. Вакцинная композиция по п.43, для системного введения шыш введения через слизистую оболочку.
45. Применение вакцинной композиции по п.43 или 44 для профилактики инфекционных заболеваний, аутоиммунной реакции или рака.
46. Применение вакцинной композиции по п.43 или 44 для лечения инфекционных заболеваний, аутоиммунной реакции или рака.
Текст
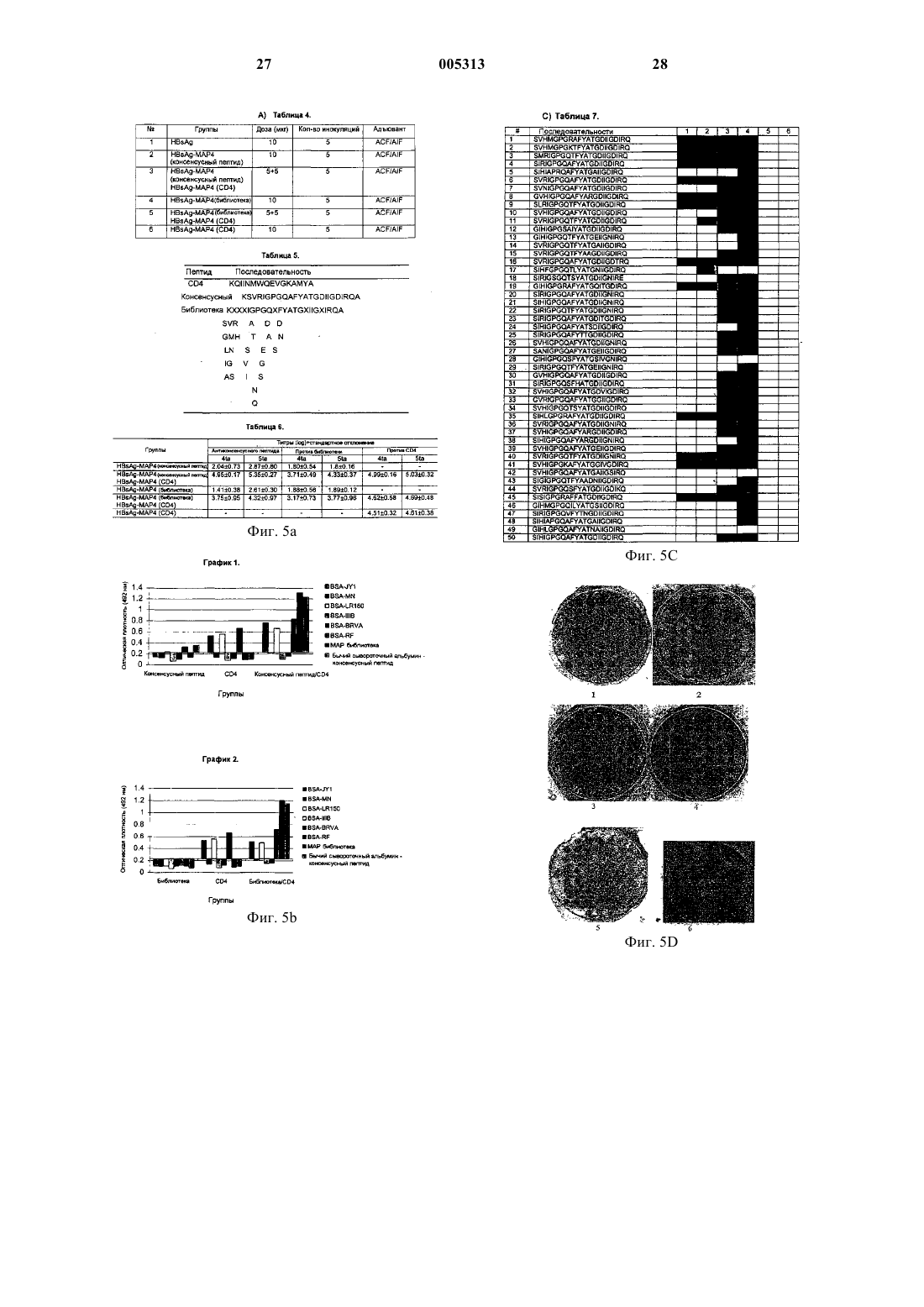
1 Область техники Настоящее изобретение относится к одной из областей медицины, в частности к препаратам для вакцинации на основе новых антигенных структур, усиливающих перекрестную реактивность. Предпосылки изобретения Пептиды характеризуются плохой иммуногенностью, поэтому их необходимо связывать с белками-носителями, которые обеспечивают необходимую помощь Т-клеток для образования специфических антител (Herrington, D.A. et al.,1987, Nature 328:257-259). В процессе конъюгирования пептида с белком-носителем могут быть утрачены антигенные свойства вследствие неспецифического конъюгирования. Пептиды можно связывать с белком-носителем в главной части представляющего интерес эпитопа. Во избежание проблем, связанных с конъюгированием пептида, предложен другой способ представления пептида в иммунной системе. Например, мультиантигенный пептид (MAP) создан путем введения В- и Т-клеточного эпитопа в разветвленное ядро лизина (Tam, J.P. et al., 1988,Proc. Natl. Acad. Sci. 86:5409-54132-5) (Tam, J.P.,1989, Methods Enzymol. 168:7-15) (Tam, J.P.,1990, WO 90/11778) (Tam, J.P., 1993, WO 93/03766). Главным преимуществом данной системы является ее структура и точно определенный состав, а также высокое соотношение представляющего интерес эпитопа в молекуле. Некоторые исследования по иммунологии подтверждают, что применение MAP является более эффективным, чем конъюгирование пептида(Wang, C.Y. et al., 1991, Science 254:285-288). Указанный вывод не всегда является верным,так как в других исследованиях получен противоположный результат (Riley, E.M. et al., 1996,Veterinary Immunology and Immunopathology 55:243-253), причем такое противоречие может быть связано с белком-носителем. Перекрестная реактивность и нейтрализация ранее были описаны для синтетического пептида (Wang, C.Y. et al., 1991, Science 254:285-288). Некоторые исследователи также отмечают, что антипептидные антитела против области V3 ВИЧ-1 вызывают перекрестную нейтрализацию разных полевых изолятов(Wang, C.Y. et al., 1991, Science, 254:285-288). Коротко говоря, перекрестная нейтрализация и реактивность связаны со структурой пептида. В качестве примера можно привести пептиды петли V3 ВИЧ-1. Метод на основе MAP служит для стимуляции нейтрализующей реакции против V3 у человека (Geoffrey, J. et at., 1996, Journal of Infectious Diseases, 173:330-3398). Недостатком указанного метода является то, что для достижения эффекта нейтрализации необходимо инокулировать очень большое количество (500 мкг)Allergy Immunol. 15:105-13). Установлено, что при использовании смеси нескольких MAP на основании выбора другой области V3 для достижения широкого спектра нейтрализации клинических штаммов, необходимое общее количество MAP будет несовместимо с общепринятой практикой иммунизации. Перекрестная реактивность определяется как способность иммуногена взаимодействовать с родственными лигандами (Paul, FundamentalW. Immunology, 4th edition). Несмотря на то, что явление перекрестной реактивности было известно уже в начале развития иммунологии,лишь некоторые вакцинные препараты получают на основе перекрестной реактивности. Это,по-видимому, объясняет, почему большинство вакцин, используемых в соответствии с программами иммунизации, не защищает от патогенных микроорганизмов с высокой вариабельностью в нескольких клинических изолятах. Перекрестная реактивность гомологичных пептидов является свойством каждой последовательности. Данное свойство можно усилить в зависимости от форм представления пептида иммунной системе. Неочевидно, что усиление перекрестной реактивности происходит вместе с увеличением иммуногенности. Исследование Ти В-клеточного пептида показывает, что индукция антител с перекрестной реактивностью и/или нейтрализацией не находится в прямой зависимости от иммуногенности пептида(Kasmi, К. С. et al., 1998, Molecular Immunology 35: 905-918). Разработаны разные методы достижения иммунной реакции, способной распознавать большое число антигенных вариантов патогенного микроорганизма. Одним из таких методов является создание рекомбинантного многоэпитопного полипептида (МЕРr) для наиболее важных вариантов. Представление В-клеточного эпитопа в системе МЕРr не всегда дает хорошие результаты (Flynn, J.N. et al., 1997, J. Virol,71:7586-92). С одной стороны, создание химерного полипептида продуцирует молекулу с непредсказуемой трехмерной структурой, которая не выявляет должным образом все эпитопы. Такая структура стимулирует реакцию на определенный эпитоп или полностью подавляет реакцию на другие эпитопы. С другой стороны,возникает непредсказуемое доминирование разных эпитопов. Другой метод предполагает создание пептидных библиотек в качестве иммуногена. Обычно создают пептидную библиотеку высоко вариабельных областей. Данная библиотека включает большое число пептидных последовательностей. Однако недостатком такой библиотеки является плохое представление каждого эпитопа. Он теряется среди большого количества разных последовательностей, что делает непредсказуемой иммунную реакцию на требуемом уровне (Allen, D. et. al., 1998, J. ofImmunol. 24:2789-2795). Еще одним методом является создание консенсусного пептида, охватывающего широкий спектр последовательностей V3 в случае ВИЧ. Данный метод основан на исследовании вариабельности эпитопов в полевых или клинических изолятах с целью выявления каждого положения более консервативной аминокислоты во всех изолятах (Holley, L.H. et al., 1991,Proc. Natl. Acad. Sci. 88:6800-6804). Описание изобретения Целью данного изобретения является создание способа получения антигенных структур с высокой перекрестной реактивностью, способных усиливать иммуногенность пептидных антигенов, которые предназначены для системного введения и/или введения через слизистую оболочку. Данный способ предполагает создание разветвленных структур, конъюгированных с белками-носителями в требуемых соотношениях. Добавление аналогичных структур, несущих другой В-клеточный эпитоп, позволяет увеличить перекрестную реактивность. Это также способствует увеличению иммуногенности совместно вводимых антигенов. Указанный препарат может содержать другие антигены и адъюванты. Поэтому одним из объектов настоящего изобретения является способ синтеза антигенных структур, усиливающих специфическую перекрестную реактивность. Описанный выше способ включают нижеследующие стадии:A) выбор представляющих интерес эпитопов;B) получение разветвленных структур, содержащих эпитопы, выбранные на стадии (А),методом синтеза, который может представлять собой синтез на ядре лизина или аспарагиновой кислоты; синтез на ядре органических молекул; синтез на разветвленном ядре; связывание пептидов с разветвленным ядром; или объединение на одном ядре Вклеточных эпитопов, Т-клеточных эпитопов или тех и других вместе;C) конъюгирование одной или нескольких разветвленных структур, полученных на стадии(В), с одной или несколькими молекуламиносителями методом конъюгирования с использованием альдегида глутаровой кислоты, янтарного ангидрида, сложного эфира N-гидроксисукцинимида -малеимидопропионовой кислоты (MPS) или спейсерного агента без ароматических боковых цепей, так как известно, что такие группы не распознают связанные разветвленные структуры;D) объединение конъюгатов, полученных на стадии (С), для получения препарата с добавлением CD4-связывающего пептида или конъюгата, имеющего эпитоп, усиливающий перекре 005313 4 стную реактивность и иммуногенность полученной антигенной структуры; и наконец Е) введение в квасцы или любой другой адъювант. В способе по настоящему изобретению пептиды в структурах, полученных на стадии(В), могут представлять области ВИЧ-1 или ВИЧ-2, более предпочтительно вариабельные области подобные петле V3. Кроме того, можно использовать области с некоторой степенью вариабельностью из других вирусов, таких как вирус гепатита С, вирус гепатита В и вирус Денге. Можно использовать другие антигены полисахаридных областей Neisseria meningitidis,пептидомиметики полисахардных ангигенов или любую другую область микроорганизма или патогена. Кроме того, при осуществлении способа по настоящему изобретению можно использовать области аутоантигенов или родственных антигенов для получения противораковой вакцины, например, области гонадотропинсекретирующего гормона. К белкам-носителям, которые можно использовать в способе по настоящему изобретению, относятся поверхностный антиген вируса гепатита В (HBsAg), белок р 64 К Neisseria meningitidis, ядерный антиген ВИЧ, ядерный антиген вируса гепатита В. Для аналогичных целей можно также использовать полисахаридные молекулы, подобные декстранам. Способ по настоящему изобретению включает конъюгирование одной или нескольких разветвленных структур, полученных на стадии (В), с одной или несколькими молекулами-носителями путем ковалентного конъюгирования, электростатического или гидрофобного взаимодействия. Другим объектом настоящего изобретения является антигенная структура, полученная описанным выше способом, которая усиливает специфическую перекрестную реактивность имеющихся эпитопов. Указанная структура содержит вышеописанные эпитопы в виде разветвленных антигенов, связанных к белкаминосителями, составляющими 1-30% конечной структуры. Выбранные эпитопы могут иметь полисахаридную или пептидную природу. Пептиды могут быть консенсусными пептидами из вариабельных областей, выбираемых с учетом подтипов, подгрупп, серотипов или в соответствии с любой другой классификацией. Кроме того, указанные пептиды могут представлять пептидные библиотеки или миметические пептиды микроорганизма. В частности, пептиды в разветвленных структурах могут представлять вариабельные области ВИЧ-1 или ВИЧ-2 в петле V3, а также области других вирусов, характеризующиеся 5 некоторой вариабельностью и разнообразием,таких как вирусы гепатита В, гепатита С и вирус Денге. Указанные структуры содержат антигены полисахаридных областей Neisseria meningitidis,пептидомиметики для полисахаридных антигенов или любые области микроорганизма или патогена. Кроме того, в антигенной структуре по настоящему изобретению могут быть использованы области аутоантигенов или родственных антигенов для создания противораковой вакцины, например, области гонадотропинсекретирующего гормона. К белкам-носителям, которые можно использовать в способе по настоящему изобретению, относятся поверхностный антиген вируса гепатита В (HBsAg), белок р 64 КNeisseria meningitidis, ядерный антиген ВИЧ,ядерный антиген вируса гепатита В. Для аналогичных целей можно также использовать полисахаридные молекулы, подобные декстранам. Данное изобретение относится также к применению вышеописанных антигенных структур для создания диагностических систем,профилактических или лечебных вакцин против инфекционных, аутоиммунных или раковых заболеваний, предназначенных для системного введения. В частности, для петли V3 продемонстрирована возможность значительного увеличения перекрестной реактивности и перекрестной нейтрализации в результате добавления конъюгатов, имеющих CD4-связывающий пептид в той же структуре, созданной для повышения эффективности дающих перекрестную реакцию антител против пептидов вариабельных областей. Добавление таких структур увеличивает перекрестную реактивность и иммуногенность совместно вводимых антигенов против V3. Данный способ действительно облегчает появление дающих перекрестную реакцию антител в методах вакцинации на их основе, при этом не исключена возможность его применения в других методах вакцинации просто для увеличения иммуногенности к гомологичному пептиду. Данное изобретение относится к способу получения новых химических структур на основе дифференциального представления Вклеточных эпитопов из разных микроорганизмов в иммунной системе. Такая вариабельность может быть связана с патогенностью. Кроме того, можно использовать невариабельные Вклеточные эпитопы, способные вызывать защитную иммунную реакцию, подобные Вклеточным эпитопам из клеточных антигенов. Все они в разветвленных структурах на белкахносителях способны усиливать перекрестную реактивность и иммуногенность. Предлагаемый способ позволяет нетрадиционным путем получить антигены, используемые для приготовления вакцины, с более высокой плотностью эпитопов, что увеличивает им 005313 6 муногенность и антипептидную перекрестную реактивность. Кроме того, данный способ позволяет уменьшить количество разветвленных структур, что увеличивает титры антител благодаря дифференциальному представлению помимо вышеописанных новых отличительных особенностей. Важно отметить, что можно увеличить перекрестную реактивность пептидов из вариабельных областей, не влияя на их иммуногенность, как это показано в примерах. С другой стороны, данный способ позволяет связывать разные разветвленные структуры с одним и тем же носителем. Аналогичным образом показано, что объединение структур по настоящему изобретению с подобными структурами, имеющими CD4-связывающий пептид,увеличивают иммуногенность и перекрестную реактивность против V3. Новая структура может включать разветвленную часть, имеющую только В-клеточные эпитопы, так как Т-клеточные эпитопы предоставляет носитель. Структуры MAP, используемые в качестве элементов вакцины, исключают применение носителя, поэтому Т-клеточные эпитопы структур по настоящему изобретению могут быть необязательно введены в синтетическую часть или в носитель. Подобная методика обеспечивает лучшее представление В-клеточных эпитопов, так как они не образуют компактных кластеров. Кроме того, используя разветвленные структуры, связанные с белкаминосителями, можно усилить перекрестную реактивность и/или иммуногенность при помощи меньшего количества иммуногена по сравнению с использованием только разветвленных структур (например, MAP). И наконец, установлено, что комбинации указанных конъюгатов оказывают синергичное действие на иммуногенность и перекрестную реактивность. Препарат по настоящему изобретению можно вводить через слизистую оболочку, что в настоящее время имеет очень важное значение для практического осуществления данного способа. Примеры Пример 1. Способ получения антигенных структур. Способы синтеза пептидов, MAP и разветвленных структур описаны в научной литературе (Tam, J.P. et. al., 1988, Proc. Natl. Acad.Chem. Soc. 117:3893-3899). Антигенные структуры получают, сшивая разветвленные структуры с белками-носителями. В качестве спейсерного агента используют янтарный ангидрид(SA). Это делает возможным ковалентное связывание двух антигенов при помощи аминогрупп. Белок-носитель активируют янтарным ангидридом на тампоне, пропитанном буфером с рН 8,5, в течение 30 мин. Оставшиеся реаген 7 ты удаляют диализом во избежание попадания перекрестносшивающего агента между молекулами разветвленной структуры (MAP) и пептидилирования. Конъюгирование выполняют, активируя карбоксильные группы белка реагентомECDI (растворимый карбодиимид). Затем добавляют синтетический антиген. Конъюгированную структуру отделяют гель-фильтрацией. И наконец, полученные структуры исследуют методами ELISA и вестерн-блоттинга с использованием АсМ и сыворотки мышей. Пример 2. Способ получения антигенных структур с использованием разных спейсерных агентов. Антигенные структуры получают, используя разные спейсерные агенты. При получении конъюгированной структуры хорошего иммунологического качества желательно, чтобы связывание с белком производилось на достаточно большом расстоянии от остатков, имеющих важное значение для эпитопа. Во избежание указанного явления используют разные спейсерные агенты: альдегид глутаровой кислоты, сложный эфир м-малеимидо-бензоил-N-гидроксисукцинимида (MBS), карбодиимиды, сложный эфирN-гидроксисукцинимида -малеимидопропионовой кислоты (MPS), янтарный ангидрид и тому подобные. Во время иммунизации могут образовываться антитела против белковносителей и/или связующего агента. Хороший связующий агент не должен вызывать образования антител против себя. Установлено, что гуморальный ответ на синтетические мультиантигенные пептидыJY1 ВИЧ-1 и конъюгированных с двумя разными белками-носителями с использованием сложного эфира м-малеимидобензоил-N-гидроксисукцинимида (MBS), сложного эфира Nгидроксисукцинимида -малеимидопропионовой кислоты (MPS) или янтарного ангидрида,имеет разную природу. Великолепная реакция против JY1 при отсутствии сильной реакции в отношении связующего агента наблюдается при использовании в качестве спейсера янтарного ангидрида. В отличие от этого MBS не вызывает образования антител при сильной реакции в отношении связующего агента. Полученные результаты показывают, что не все спейсерные агенты, описанные в научной литературе, действуют одинаково, поэтому при получении антигенных структур указанного типа нельзя использовать все спейсерные агенты, известные в данной области. Пример 3. Конструирование, синтез и конъюгирование новых разветвленных структур с HBsAg. Новые разветвленные структуры синтезируют с учетом того, что ранее известные антигенные структуры (то есть конъюгаты MAP 005313 8 белок) вызывают высокие титры антител против представляющих интерес пептидов. Причем в данном случае не использован Th-клеточный эпитоп, так как он предоставляется белкомносителем. Таким образом облегчается синтез таких структур, появляется возможность ввести более длинные В-клеточные эпитопы и избежать образования нежелательных трехмерных структур благодаря колинейности между В- иTh-клеточными эпитопами. Разветвленные структуры индивидуально связывают с HBsAg,как это описано в примере 1. MAP синтезируют способом, описанным Дж. Тэмом и др. (J. Tamet. al., 1988). Затем разветвленные структуры и конъюгаты разделяют хроматографией с гельфильтрацией и определяют концентрацию методом с использованием кумассии. Пример 4. Исследование потенциирования иммунной реакции и усиления перекрестной реактивности. Для исследования влияния конъюгирования MAP с белком-носителем на иммуногенность и перекрестную реактивность производят иммунизацию самок мышей Balb/c в возрасте 68 недель, распределенных в две группы по 10 особей в каждой, которым подкожно вводят испытуемый препарат в адъюванте FCA/FIA. Первой группе вводят MAP8 (TT-JY1) и второй группе вводят HBsAg-MAP8 (TT-JY1). Дозы соответственно равны 50 и 10 мкг. Мышей иммунизируют в 0-14-28-40 день и берут у них пробы крови на 36-й и 51-й день. HBsAg-MAP8(TT-JY1) получают, используя в качестве спейсера янтарный ангидрид, как это описано в примере 1. MAP8 (TT-JY1) имеет восемь копий Тклеточного эпитопа, аминокислоты 830-844 из столбнячного токсина (ТТ), и восемь копий Вклеточного эпитопа, содержащего 15 центральных аминокислот из области V3 gp 120 штаммаJY1 ВИЧ-1 (Cruz, L.J. et al., 2000, Journal of Peptide Science 6:217-224). После введения третьей и четвертой дозы исследуют гуморальный ответ на эпитоп JY1 и других пептидов V3. Производят количественное определение IgG в сыворотке при помощи непрямого анализа ELISA, используя пептиды, связанные с бычьим сывороточным альбумином (BSA) (Gomez, C.E. et al.,1998, J. Virol. Methods 71: 7-1618). Собранную сыворотку разводят в отношении 100-1. Статистические анализы выполняют в соответствии с критерием Стьюдента. Значения вероятности менее 0,05 считаются статистически значимыми и менее 0,01 считаются в высшей степени значимыми. После введения третьей дозы не обнаружено различия в иммуногенности к гомологичному пептиду, хотя масса инокулированного конъюгата была в пять раз меньше. Поэтому при использовании конъюгатов возможна большая экономия антигена, что является важным преимуществом (фиг. 1 А). В группе мышей, иммунизированной HBsAg 9MAP8 (JY1-TT), имеет место перекрестная реактивность в отношении других пептидов V3 в отличие от мышей, инокулированных МАР 8(TT-JY1), у которых отсутствует перекрестная реактивность, несмотря на одинаковые уровни гуморальных ответов. После введения четырех доз HBsAg-MAP8 (TT-JY1) достигается более сильная реакция на эпитоп JY1 по сравнению с МАР 8 (TT-JY1). Некоторое количество дающих перекрестную реакцию антител образуется в группе, получавшей MAP8 (TT-JY1), но их количество весьма ограничено по сравнению с введением HBsAg-MAP8 (JY1-TT). Увеличение иммуногенности имеет очень важное значение,поскольку в научной литературе появились сообщения об использовании смесей MAP для выработки антител против нескольких эпитопов. Однако в некоторых случаях невозможно инокулировать человеку весь объем, необходимый для достижения требуемого действия (то есть нейтрализации и т.д.), из-за возникновения побочных эффектов. В конечном счете очень важно индуцировать интенсивный гуморальный ответ при использовании ограниченной массы антигена. Поэтому совершенно очевидно преимущество таких структур (то есть конъюгатаMAP и белка-носителя), рассмотренных в данном описании изобретения. Принимая во внимание, что при использовании меньшего количества антигена может быть достигнута более широкая перекрестная реактивность, можно уменьшить количество разных эпитопов, используемых в сыворотке. И наконец, использование таких конъюгатов представляет один из подходов к созданию бивалентных вакцин, в которых носитель сам по себе является защитным иммуногеном подобно HBsAg. Пример 5. Исследование гуморального ответа у мышей, иммунизированных МАР 8 (TTJY1) и ТАВ 9. Для исследования различий, связанных с представлением эпитопа JY1 в иммунной системе (I.S.), используют рекомбинантный белок ТАВ 9 (Duarte, С.A. et al., 1994, AIDS Res HumV3 из нескольких изолятов ВИЧ-1; LR150, JY1,RF, MN, BRVA и IIIB в указанном порядке. В данном эксперименте сравнивают указанный белок, состоящий из 15 аминокислот, включая центральную часть петли MAP, и МАР 8 (TTJY1). Целью исследования является распознавание пептидов V3, входящих в состав ТАВ 9, и определение различий путем картирования эпитопов с использованием Аlа-замещенных пептидов, охватывающих всю последовательностьJY1. При наличии в последовательности остатка Аlа его заменяют остатком Gly. Самок мышейBalb/c в возрасте 6-8 недель, распределенных в две группы по 10 особей в каждой, иммунизируют подкожной инъекцией испытуемого препарата в адъюванте CFA/IFA, содержащем 100 мкг белка ТАВ 9 и 16,4 мкг MAP8 (TT-JY1). 10 Масса обоих иммуногенов включает одинаковое количество эпитопа JY1. Мышей иммунизируют в 0, 14, 28, 56 день и берут пробы крови на 67-й день. Реакцию IgG против JY1 в сыворотке измеряют методом ELISA. Статистический анализ выполняют в соответствии с критерием Стьюдента. Значения вероятности менее 0,05 считаются статистически значимыми и менее 0,01 считаются в высшей степени значимыми. Для исследования перекрестной реактивности в отношении пептидов V3 измеряют уровень IgG-реакции в сыворотке при помощи непрямого анализа ELISA, используя пептиды,связанные с BSA (Gomez, C.E. et а 1., 1998, J.Virol. Methods, 71:7-1618). Собранную сыворотку разводят в отношении 100-1. Картирование эпитопов на целлюлозной мембране описано Рональдом Фрэнком (Frank,R., 1992, Tetrahedron 48:9217-9232). Сыворотку, собранную у групп после введения четырех доз, тестируют в отношении нескольких пептидов V3. Установлено, что мыши,иммунизированные МАР 8 (TT-JY1), способны обнаружить четыре из пяти испытанных пептидов V3 (LR150, RF, MN, BRVA). Из них три пептида (RF, MN, BRVA) характеризуются величинами оптической плотности (А 492 нм) выше 1,25, что свидетельствует о сильной реактивности. В частности, для пептида RF значение А 492 нм выше 2,5. Полученные результаты подтверждают преимущество MAP для представления В-клеточных эпитопов иммунной системы. В случае белка ТАВ 9, содержащего все пептиды, не опознаны два испытанных пептида (RF иBRVA). Пептиды MN и III В обнаружены при очень низких значениях А 492 нм менее 0,75. Только пептиды JY1 и LR150 опознаны при очень высоких значениях А 492 нм. Авторы данного изобретения пришли к выводу, что представление антигена иммунной системе при помощиMAP делает возможной перекрестную реактивность в отношении других пептидов V3, не включенных в иммуноген. Благодаря этому можно оптимизировать количество антигенов,относящихся к совокупности гомологичных последовательностей. Результат, полученный для белка ТАВ 9, показывает, что включение нескольких последовательностей в рекомбинантный белок не всегда является обоснованным техническим решением. На самом деле МАР 8 (TT-JY1) вызывает лучшую реакцию. Для выявления различий в представлении эпитопов иммунной системе выполняют картирование эпитопов, используя перекрывающиеся и Аlа-замещенные пептиды из последовательности JY1. Установлено, что сыворотка, собранная в обеих группах, распознает ту же аминокислотную последовательность LGQALY. В группе, получавшей MAP8 (TT-JY1), во взаимодействии непосредственно участвует аминокислотаL-Q-Y. В отличие от этого в случае ТАВ 9 взаи 11 модействует в основном аминокислотаL-Q-LY. Незначительное отличие, включающее всего одну аминокислоту, по-видимому, является причиной разного распознавания испытанных пептидов V3. Можно предположить, что данный эпитоп находится в разных трехмерных структурах обоих иммуногенов. В заключение следует отметить, что пептиды в белке ТАВ 9 имеют другое представление в иммунной системе по сравнению с MAP. Данный эксперимент показывает, что такое разное представление определяет профили перекрестной реактивности в обоих иммуногенах. Пример 6. Сравнение иммуногенности при разном представлении пептидов иммунной системе. Для оценки иммуногенности нескольких вариантов представления пептидов в иммунной системе используют самок мышей Balb/c, распределенных в девять групп по 8 особей в каждой. Животных иммунизируют в 0-14-28 день и берут пробы крови через 10 дней после последней иммунизации. Все данные суммированы в таблице 2. МАР 4 (TT-JY1) имеет четыре Вклеточных эпитопа (все JY1) и четыре Тклеточных эпитопа (все ТТ 830-844). Пептид (TTJY1) имеет последовательно расположенные Вклеточные (JY1) и Т-клеточные (ТТ) эпитопы. Линейный полимер синтезируют полимеризацией от остатка Сys, добавленного с обеих сторон исходного пептида (Cruz, L.J. et al., 2000,Biotechnologia Aplicada 17:35-38). Кроме того,пептид синтезируют на поверхности декстрановых гранул. HBsAg-пептид (TT-JY1), HBsAgМАР 4 (TT-JY1) и HBsAg-MAPS (TT-JY1) получают конъюгированием, используя янтарный ангидрид (AS) в качестве спейсера, как описано в примере 1. Группу мышей, которым вводятHBsAg (группа 9), используют в качестве контрольной группы. Реакцию IgG против JY1 в сыворотке измеряют методом ELISA. Статистические анализы выполняют в соответствии с критерием Стьюдента. Значения вероятности менее 0,05 считаются статистически значимыми и менее 0,01 считаются в высшей степени значимыми. Установлено, что конъюгаты MAP-HBsAg(группы 7 и 8) вызывают значительно более сильный гуморальный ответ против эпитопаJY1 по сравнению с MAP и полимером. Вышеуказанные группы характеризуются гораздо лучшими результатами по сравнению с группой,получавшей пептид (группа 4). Результаты, полученные для конъюгата декстран-пептид(группа 5) (фиг. 3 В), не отличаются от результатов, полученных для конъюгатов HBsAg-МАР. Однако необходимо отметить, что масса инокулированных конъюгатов в четыре раза меньше. Данный эксперимент показывает, что конъюгирование MAP с HBsAg значительно увеличивает гуморальный ответ против эпитопа JY1 по сравнению с MAP. Хотя MAP созданы, чтобы 12 избежать конъюгирования пептидов с белкаминосителями, авторы данного изобретения показали, что в результате конъюгирования иммунный ответ превышает гуморальный ответ в четыре раза большей массы отдельно вводимогоMAP. Можно сделать вывод о том, что конъюгаты MAP и белка-носителя (то есть HBsAg) являются наиболее эффективными из испытанных иммуногенов. Пример 7. Исследование перекрестной реактивности, вызываемой разными способами представления синтетических пептидов иммунной системе. Для определения уровня перекрестной реактивности, вызываемой разными способами представления пептида JY1, собранную сыворотку, соответствующую разным схемам иммунизации, используют для получения примерно 10-5 титра против JY1 и сравнивают перекрестную реактивность полученных образцов с панелью из пяти пептидов V3 из разных изолятов ВИЧ-1. Во всех случаях самок мышей Balb/c,распределенных в группы по 10 особей в каждой, инокулируют при помощи подкожной инъекции объемом 100 мкл. Иммунизацию производят в 0, 14, 28, 56 и 99 день. У животных берут пробы крови через 10 дней после введения последней дозы. Не все группы инокулируют пять раз. Данные суммированы в табл. 3. Группы с одинаковой схемой введения исключают из одного эксперимента. Результаты данного эксперимента показывают, что перекрестная реактивность является отличительной особенностью самого пептидаV3 JY1, так как она имеет место в каждом испытанном варианте представления в иммунной системе (группы 2, 3, 8 и 9). Кроме того, такая перекрестная реактивность может быть выше,чем реакция, вызываемая иммуногеном, содержащим все испытанные пептиды (группы 1, 2, 3,8 и 9) (фиг. 4 В). Перекрестные реактивности МАР 4 (TT-JY1), МАР 8 (TT-JY1), HBsAg-МАР 4(TT-JY1) и HBsAg-MAPS (TT-JY1) не являются различающимися. Однако важно отметить, что мыши, иммунизированные конъюгатами, получали меньшее количество белка; им были введены только четыре дозы вместо пяти доз, введенных мышам, инокулированным MAP. Анализ перекрестной реактивности для MAP после введения четырех доз (пример 4) свидетельствует о более низком уровне по сравнению с конъюгатами, действие которых усиливается после конъюгирования. Таким образом, данный эксперимент подтверждает результаты, полученные в примере 4. Пример 8. Иммунологическая оценка новых конъюгатов разветвленная структураHBsAg. Распознавание в сыворотке с использованием панели пептидов V3. Для оценки возможных взаимодействий между разными конъюгатами в вакцинном препарате и для демонстрации повышенной имму 13 ногенности и перекрестной реактивности смесей конъюгатов выполняют эксперимент с использованием мышей. Самок мышей Balb/c, распределенных в 10 групп по 10 особей в каждой, инокулируют 100 мкл вакцины при помощи подкожной инъекции. В зависимости от иммунизации группы распределяют следующим образом: 1, HBsAg-MAP4(CD4-связывающий пептид из gp120). Пептидные последовательности суммированы в табл. 5. Мышам в группах 1, 2 и 4 вводят конъюгат в дозе 10 мкг; мышам в группах 3 и 5 вводят только 5 мкг конъюгата. Мышей иммунизируют в 0, 14, 28, 56 и 84 день. У мышей берут пробы крови через 10 дней после последней иммунизации. Данные суммированы в табл. 4. Перекрестно реагирующие антитела исследуют при помощи панели, включающей 50 пептидов V3 из разных изолятов ВИЧ-1, синтезированных на целлюлозной мембране. Помимо этого, перекрестно реагирующие антитела определяют методом ELISA в отношении пяти пептидов, ранее испытанных в примере, показанном на фиг. 1. Сыворотку, собранную в каждой группе, разводят в отношении 1/100. Гуморальный ответ в сыворотке измеряют методом ELISA, определяя анти-IG реакцию на консенсусный пептид, СD4-связывающий пептид из gp120 и пептидную библиотеку последовательностей V3. Статистические анализы выполняют в соответствии с критерием Стьюдента. Значения вероятности менее 0,05 считаются статистически значимыми и менее 0,01 считаются в высшей степени значимыми. После введения пяти доз гуморальный ответ на консенсусный пептид в группах, получавших HBsAg-MAP4 (пептидная библиотека последовательностей V3) и HBsAg-MAP4 (консенсусный пептид из V3), является очень слабым (таблица 6). Интересно отметить, что сыворотка, полученная у животных, иммунизированных HBsAg-MAP4 (пептидная библиотека последовательностей V3), не взаимодействует с испытанными пептидами V3, а также с МАР 4(консенсусный пептид из V3) и консенсусным пептидом, связанным с BSA. Однако в группе,инокулированной смесью HBsAg-MAP4 (CD4 связывающий пептид из gp120) и HBsAg-MAP4V3), происходит интенсивный гуморальный ответ против консенсусного пептида и МАР 4V3). Такие реакции не являются следствием(CD4-связывающий пептид из gp120), не взаимодействует с указанными пептидами. Таким образом, можно сделать вывод о том, что гуморальный ответ против консенсусного пептида и библиотеки V3 усиливается благодаря синергичному действию смеси конъюгатов. Затем,МАР 4 (СD4-связывающий пептид из gp120) вызывает иммуноусиливающий эффект противV3 при использовании в два раза меньшей массы иммуногена в смеси по сравнению с отдельно инокулируемыми конъюгатами. Аналогичное синергичное действие имеет место в группе мышей, которым вводили HBsAg-MAP4 (консенсусный пептид из V3) и HBsAg-MAP4 (CD4 связывающий пептид из gp120). Данный эксперимент показывает, что у мышей, иммунизированных смесями конъюгатов (группы 3 и 5), индуцируются антитела против В-клеточных эпитопов, входящих в состав препарата (табл. 6). Указанные конъюгаты получают отдельно и затем смешивают в требуемых соотношениях. Поэтому три разных смеси конъюгатов характеризуются одинаковыми уровнями антипептидного гуморального ответа. Гуморальный ответ против консенсусного пептида и пептидной библиотеки значительно выше при инокуляции HBsAg-MAP4 (консенсусный пептид из V3) и HBsAg-MAP4 (пептидная библиотека последовательностей V3) в смеси с CD4-связывающим пептидом из gp120 по сравнению с иммунизацией отдельными препаратами. Анти-консенсусный ответ усиливает ответ против пептидной библиотеки достигает высокого уровня, показанного на фиг 5b (графики 1 и 2). Тем не менее, в смеси инокулирована половина дозы, необходимой для отдельных конъюгатов. Полученный результат свидетельствует о том, что можно усилить ответ против V3 в препаратах, содержащих МАР 4 (CD4 связывающий пептид из gp120) (фиг. 5, графики 1 и 2). На увеличение перекрестной реактивности указывают данные ELISA для пептида V3. Сыворотку, полученную в данном эксперименте,испытывают при помощи панели пептидов V3 в белке ТАВ 9, ранее показанной на фиг. 1. Что касается взаимодействия между консенсусным иCD4-связывающим пептидами, то установлено,что данная смесь образует высокие титры благодаря перекрестно реактивным антителам, индуцированными CD4-связывающим пептидом, и нормальной реактивности консенсусного пептида, увеличивающейся вследствие усиливающего действия(CD4 связывающий пептид из gp120). Помимо этого,сыворотку, полученную в группах 3 и 5, анализируют после введения четвертой и пятой доз при помощи панели, включающей 50 пептидовV3) и HBsAg-MAP4 (CD4-связывающий пептид из gp120 после введения четырех доз опознано 26% (13/50) испытуемого пептида. Указанное значение увеличивается до 30% (15/50) после введения пяти доз. После введения четырех доз 53% (7/13) распознаваемых пептидов обладают очень высокой реактивностью, и после введения пяти доз указанный показатель снижается до 46% (7/15). Смесь, вводимая группе 3, HBsAg-MAP4(СВ 4-связывающий пептид из gp120) после введения четырех доз взаимодействует с 72%(36/50) пептидов и после введения пяти доз взаимодействует с 92% (46/50) пептидов. После введения четырех доз 50% (18/36) распознаваемых пептидов характеризуются очень высокой реактивностью, и после введения пяти доз указанный показатель составляет 48% (22/46). Можно сделать вывод о том, что смесьgp120) вызывает более сильную перекрестную реактивность, чем аналогичная смесь с пептидной библиотекой. Поскольку консенсусный пептид создан в результате выбора часто встречающихся аминокислот в каждом положении на панели, включающей 50 пептидов, и библиотека получена на основании той же панели, авторы изобретения пришли к выводу, что лучшим способом вызвать образование дающих перекрестную реакцию антител является создание препарата, включающего смесь MAP консенсусного пептида, связанного с белком-носителем, и другой конъюгат, обладающий синергичным действием. Пример 9. Сравнение иммунной реакции,вызываемой линейным пептидом V3 (JY1) иMAP, связанным с другими белкаминосителями. Для исследования влияния конъюгирования разветвленных структур (в данном случаеMAP) с другими белками-носителями на иммуногенность и перекрестную реактивность линейный пептид JY1 и его структуру MAP связывают с другими белками-носителями (HBsAg,KLH, P64k). Пептид и MAP связывают с другими белками-носителями, используемыми в группах 59, при помощи янтарного ангидрида. MAP, вводимый животным в группе 10, связывают сHBsAg, используя MPS в качестве связующего агента. Самок мышей Ваlb/с, распределенных в девять групп по 8 особей в каждой, инокулируют в 0-14-28-56 день и через 10 дней после последней инокуляции производят экстракцию. Группы иммунизированных животных, дозы и адъюванты приведены в табл. 8. Гуморальный ответ измеряют методомJY1 в сыворотке. Перекрестную реактивность также оценивают методом ELISA, используя панель пептидов аналогично примеру 5, и в качестве контрольного образца используют неродственный пептид. При помощи F-теста анализируют отклонения от однородности, используя t-критерий Стьюдента. Значения р 0,05 считаются статистически значимыми и р 0,01 считаются в высшей степени значимыми. Гуморальный ответ на конъюгат белокМАР во всех случаях превосходит результат,полученный при использовании конъюгата пептид-белки (фиг. 6 В). Ответ против HBsAgMAP8 (TT-JY1) аналогичен ответу KLH-MAP8(TT-JY1), и в обоих случаях полученный результат превосходит ответ, полученный при использовании конъюгата P64k-MAP8 (TT-JY1). С другой стороны, гуморальный ответ против конъюгатов MAP также является значительно более высоким (р 0,05) по сравнению с результатом, полученным при использовании одного(TT-JY1), хотя очень важно отметить, что общее количество антигена в данном конъюгате является более низким. Полученные результаты показывают, что использование разветвленных структур, связанных с белками-носителями, оптимизирует общее количество используемого иммуногена и является вполне приемлемым для значительного усиления иммунной реакции. Перекрестная реактивность наблюдается при иммунизации всеми конъюгатами по крайней мере против более чем двух гетерологичных пептидов V3 и возрастает после введения третьей и четвертой доз (фиг. 6 С). Кроме того, результаты показывают, что перекрестная реактивность является более высокой для связанных(фиг. 6 С). Пример 10. Определение иммуногенности и перекрестной реактивности в сыворотке после иммунизации с использованием другого изолятаV3 в разветвленных структурах. Чтобы показать, что усиливающее действие, оказываемое на иммуногенность и перекрестную реактивность, не зависит от выбранной последовательности V3, иммуногенность и перекрестную реактивность измеряют после иммунизации разветвленными структурами другого пептида V3, соответствующего изоляту V3. Последовательность пептида RF показана в таблице 1 на фиг. 1. Самок мышей Balb/c в возрасте восьмидесяти недель инокулируют в 0, 14 и 28 день и производят экстракцию до иммунизации и после введения третьей дозы. Инокулируемыми антигенами являются MAP8 (TT-RF) и разветвленная структура, полученная в результате связывания MAP на основе RF с HBsAg, при использовании в качестве связующего агента янтарного ангидрида, описанного выше в примере 17 1. Используемые дозы соответственно равны 40 и 10 мкг. Как хорошо показано на фиг. 7, разветвленная структура, связанная с HBsAg, и MAP значительно увеличивают уровни перекрестной реактивности, и результаты статистического анализа свидетельствуют о существенном увеличении иммуногенности и перекрестной реактивности в сыворотке группы мышей, иммунизированных разветвленным конъюгатом HBsAgMAP8 (TT-RF). Пример 11. Иммунологический анализ разных MAP, конъюгированных с белкаминосителями. Для исследования эффекта потенциирования иммуногенности разных MAP, ковалентно связанных с белками-носителями, синтезируют четырехмерные MAP и соответствующий линейный пептид. MAP4-(NM) и пептид MN содержат эпитоп из петли 4, полученный из ОМР Р 1.15, штамм В 385 Neisseria meningitidis(HYTRQNNADVFVPAVVG). MAP4-(D) и пептид D содержат эпитоп, полученный из раннего/ позднего белка вируса Денге 2 (LTTRNGEPHMAP4-(NM) и пептид MN конъюгируют с белками-носителями KLH и P64k, используя в качестве связующего агента сложный эфир Nгидроксисукцинимида -малеимидопропионовой кислоты (MPS). Реакцию конъюгирования осуществляют дериватизацией белков, с избытком спейсерного агента в фосфатном буфере объемом 50 ммоль/л ДМФ при рН 6 в течение 30 мин. Избыток MPS удаляют диализом. В процессе синтеза MAP4-(NM) и пептида MN к С-концу добавляют цистеин с образованием группы -SH. Производные белки, полученные при взаимодействии с имидом малеиновой кислоты, произвольно взаимодействуют со свободными тиоловыми группами в соответствующих пептидах и MAP в течение 3 ч при комнатной температуре. Полученные конъюгаты очищают хроматографией с гель-фильтрацией.MAP4-(D) и пептид D конъюгируют с белками KLH и P64k прямым способом с использованием растворимого карбодиимида. MAP4-(D) и пептид D содержат карбоксильную группу в С-конце, позволяющую осуществлять прямое связывание с аминогруппами белков-носителей(KLH и P64k). Для оценки иммуногенности разных конъюгированных MAP самок мышей Balb/c,распределенных в двенадцать групп по 8 особей в каждой, иммунизируют при помощи подкожной инъекции. Инокуляцию производят в 0-1428 день. У мышей берут пробы крови через 10 дней после последней инокуляции. Группы иммунизированных животных, дозы и адъюванты указаны в табл. 8. Гуморальный ответ измеряют методомELISA, измеряя общее количество IgG против соответствующего пептида в сыворотке. 18 При помощи F-теста анализируют отклонения от однородности, используя t-критерий Стьюдента. Значения р 0,05 считаются статистически значимыми и р 0,01 считаются в высшей степени значимыми. Как показано на фиг. 8 В, более высокие титры соответствуют конъюгатам KLH-MAP4(D) и P64k-MAP4-(D). Во всех случаях титры конъюгатов белок-МАР значительно выше, чем у конъюгатов белок-пептиды, которые вызывают реакцию такой же интенсивности, как в группах мышей, иммунизированных толькоMAP. На основании результатов данного эксперимента можно сделать вывод о том, что конъюгирование разветвленных структур, содержащих последовательности других патогенов, с белками-носителями позволяет существенно увеличить иммуногенность для выбранного пептида. Пример 12. Исследование перекрестной реактивности после назальной иммунизации разветвленными конъюгатами. Для демонстрации вызывания гуморального ответа с высокой перекрестной реактивностью после назальной иммунизации используют самок мышей Balb/c в возрасте 10-12 недель,распределенных в группы по 8 особей в каждой,которых инокулируют 10 мкг HBsAg, связанного с (TT-JY1) МАР 8. В качестве контрольных групп используют мышей, распределенных в группы по 8 особей в каждой, которым вводят 40 мкг (TT-JY1) МАР 8. Гуморальный ответ против обоих иммуногенов измеряют методомELISA, измеряя общее количество IgG против пептида JY1, при этом также анализируют перекрестную реактивность, используя панель,включающую 5 пептидов V3. В контрольной группе не обнаружена реакция против JY1, в отличие от этого в группе мышей, иммунизированных конъюгатом HBsAg-MAP8 (TT-JY1),возникла сильная реакция против гомологичного пептида в 100% случаев; кроме того, перекрестная реактивность обнаружена для более чем 2 пептидов из панели, которая усиливается с увеличением числа инокуляций. Полученные результаты свидетельствуют о важной роли конъюгирования для получения ответа; использование антигена улучшает иммунную реакцию против связанного MAP. Кроме того, впервые стала возможна сильная иммунная реакция после иммунизации через слизистую оболочку в сыворотке и на поверхности слизистой оболочки. Другие разветвленные структуры получены с аналогичными результатами способами по примерам 2 и 3 с использованием в качестве молекул-носителей ядерного антигена из вирусов гепатита В и С и из вируса Денге. Кроме того, при использовании пептида из гонадотропинсекретирующего гормона в качестве синтетической части разветвленной структуры, связанной с вышеуказанными антигенами, 19 наблюдается значительное уменьшение размера гонад по сравнению с контрольными животными, иммунизированными только пептидами, и неиммунизированными мышами. Пример 13. Анализ перекрестной нейтрализации разных изолятов ВИЧ-1, полученных при использовании сыворотки с высокими уровнями перекрестной реактивности. Для оценки перекрестной нейтрализации сыворотки с высокой перекрестной реактивностью для петли V3 выполняют анализ in vitro,используя разные лабораторные изоляты ВИЧ 1. Для указанных анализов отбирают пулы сыворотки с учетом уровня перекрестной реактивности. При выполнении данного анализа используют HBsAg-MAP8 (TT-JY1) (пример 4),HBsAg-MAP8 (TT-RF) (пример 10) и смесьHBsAg-MAP4 (CD4) с HBsAg-MAP4 (консенсусный пептид) (пример 8). Данное исследование показывает, что гуморальный ответ, вызванный каждым иммуногеном, обладает способностью оказывать нейтрализующее действие на гетерологические изоляты. Очевидно, что смесь с CD4 увеличивает уровень перекрестной нейтрализации. Отдельные пептиды или их конъюгат не вызывают обнаруживаемой перекрестной нейтрализации. Пример 14. Синтез разветвленных структур с использованием разных ядер. Для увеличения количества В-клеточных эпитопов в одном молекулярном звене выполняют непрямой синтез, включающий раздельный синтез ядра и пептидов. Такая система позволяет избежать ошибок, присущих синтезу больших последовательностей, и обеспечивает более высокое введение В- и Т-клеточных эпитопов в ядро, имеющее требуемые функциональные группы. Разветвленное ядро синтезируют, осуществляя взаимодействие аминогруппы 1,6 диаминогексана с карбоксильными группами,карбоксилом аминокислоты Boc-Lys (Воc)-ОН,используя дициклогексилкарбодиимид (DCC) в качестве активатора. Затем удаляют защитные группы при помощи 37% трифторуксусной кислоты (TFA) в дихлорметане (DCM) и получают ядро с 4 реакционноспособными концами, что делает возможным создание тетравалентной разветвленной структуры и достижение второго и третьего уровней связывания для Boc-Lys(Воc)-ОН при выполнении аналогичного цикла реакций для получения ядра с 16 аминокислотными реакционноспособными концами. Затем указанные группы подвергают взаимодействию с карбоксильной группой бромуксусной кислоты. Ядро очищают ВЭЖХ с обращенной фазой на колонке С 8. Предварительно синтезируют пептид JY1, имеющий цистеин в С-конце, который взаимодействует в требуемых отношениях с полученным ядром. Тиоэфир получают в результате взаимодействия между гетероатомной 20 группой ядра и тиоловой группой цистеина в основных условиях (рН 8-9) (фиг. 9). Степень введения определяют методом SDS-PAGE и хроматографией с гель-фильтрацией. Получают разветвленные пептиды с длиной цепи 40-50 кДа. Разветвленную структуру связывают с разными белками-носителями, используя связующие агенты, указанные в примере 2. Полученные разветвленные структуры, содержащие белок и MAP, затем используют в разных схемах иммунизации, где очевидно их превосходство в отношении иммуногенности и перекрестной реактивности. Описанная система обладает разными преимуществами, например, полученные отдельно В- или Т-клеточные пептиды можно вводить в уникальную матрицу, имеющую требуемые функциональные группы (4-6 Н). Антигенные пептиды можно синтезировать и конъюгировать с С- и N-концами, при этом можно произвести очистку отдельных детерминант и избежать ошибок, присущих синтезу длинных последовательностей. Краткое описание чертежей Фиг. 1A) Исследование иммуногенности после введения трех и четырех доз. Группы: 1. MAP8(TT-JY1) и 2. HBsAg-MAP8 (TT-JY1). Дозы соответственно равны 50 и 10 мкг.B) Исследование перекрестие реактивных антител после введения трех и четырех доз. Сыворотку, полученную в обеих группах, испытывают при постоянном разведении, равном 100-1. Выполняют непрямой анализ ELISA с сенсибилизацией конъюгатами V3-BSA.C) Таблица 1. Аминокислотные последовательности пептидов V3 испытанного ВИЧ-1. Фиг. 2 Исследование распознавания нескольких пептидов V3 в сыворотке, полученной после введения четырех доз. Группы: 1. MAP8 (TTJY1); 2. ТАВ 9. Дозы соответственно равны 16,4 и 100 мкг. Фиг. 3A) Таблица 2. Краткое описание схемы иммунизации.B) Сравнительное исследование иммуногенности при разных способах представления эпитопа JY1 в иммунной системе. Фиг. 4A) Таблица 3. Краткое описание схемы иммунизации.V3 в сыворотке после инокуляции Ags, представляющего эпитоп HY1 разными способами иммунной системе. Фиг. 5 а Таблица 4. Краткое описание схемы иммунизации. Таблица 5. Аминокислотные последовательности CD4-связывающего пептида из gp120, 21 консенсусного пептида из V3 и пептидной библиотеки последовательностей V3 из ВИЧ-1. Таблица 6. Результаты иммуногенности после введения четырех и пяти доз. Фиг. 5b График 1. Исследование перекрестно реактивных антител после введения пяти доз в сыворотке, полученной в группах 2, 3 и 6, указанных в табл. 3. График 2. Исследование перекрестно реактивных антител после введения пяти доз в сыворотке, полученной в группах 4, 5 и 6, указанных в табл. 3. Фиг. 5 с Таблица 7. Исследование распознавания при помощи панели пептидов V3, синтезированных на целлюлозной мембране. Профиль качественного изменения показывает относительную интенсивность распознавания в полученной сыворотке после введения четырех и пяти доз: 1 и 2, смесь конъюгатов HBsAg-MAP4V3) и HBsAg-MAP4 (CD4-cвязывaющий пептид из gp120); 3 и 4, смесь конъюгатов HBsAgMAP4 (консенсусный пептид из V3) и HBsAgMAP4 (СD4-связывающий пептид из gp120); 5,HBsAg после введения пяти доз; 6, HBsAgMAP4 (CD4-связывающий пептид из gp120) после введения пяти доз. Четыре цвета разной насыщенности показывают степень взаимодействия антитела с пептидами. Белый: отсутствие распознавания, светло-серый: слабо положительное, темно-серый: положительное; черный: сильно положительное. Фиг. 5d Рисунки, соответствующие результатам,приведенным в табл. 5. Рисунки: 1 и 2, смесь конъюгатов HBsAg-MAP4 (пептидная библиотека последовательностей V3) и HBsAg-MAP4(CD4-связывающий пептид из gp120); 3 и 4,смесь конъюгатов HBsAg-MAP4 (консенсусный пептид из V3) и HBsAg-MAP4 (СD4 связывающий пептид из gp120) после введения соответственно четырех и пяти доз; 5, HBsAg после введения пяти доз; 6, HBsAg-MAP4 (CD4 связывающий пептид из gp120) после введения пяти доз. Сыворотку, полученную во всех группах, испытывают при постоянном разведении,равном 100-1. Фиг. 6A) Таблица 8. Краткое описание схемы иммунизации.B) Определение иммуногенности в разных группах после введения трех доз.C) График 1. Исследование перекрестной реактивности после введения трех доз в сыворотке, полученной в группах 4-10, указанных в табл. 3. Пулы сыворотки анализируют при постоянном разведении, равном 1/100. Непрямой анализ ELISA выполняют, покрывая планшеты разными пептидами, связанными с BSA. 22 График 2. Исследование перекрестной реактивности после введения четырех доз в сыворотке, полученной в группах 4-10, указанных в таблице 3. Пулы сыворотки анализируют при постоянном разведении, равном 1/100. Непрямой анализ ELISA выполняют, покрывая планшеты разными пептидами, связанными с BSA. Фиг. 7 А) Исследование распознавания разных пептидов V3 в сыворотке, полученной после введения трех доз. Группа 1, MAP8 (TT-RF); 2,HBsAg-MAP8 (TT-RF). Дозы соответственно равны 40 и 10 мкг. Фиг. 8A) Таблица 8. Краткое описание схемы иммунизации.ELISA после введения трех доз. Фиг. 9 Получение разветвленных пептидов и антигенных структур. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения антигенных структур,способных усиливать специфическую перекрестную реактивность, включающий стадии:A) отбор представляющего интерес эпитопа;B) получение разветвленных структур с эпитопами, отобранными на стадии (А), с помощью способа синтеза, выбранного из следующей группы: 1) синтеза на ядре аспарагиновой кислоты или лизина; 2) синтеза на ядре органических молекул и 3) прямого связывания пептидов с разветвленным ядром; причем В- и Т-клеточные эпитопы могут быть объединены на одном ядре;C) конъюгирование одной или различных разветвленных структур, полученных на стадии(В), с одной или различными молекуламиносителями с помощью способа связывания,выбранного из группы, состоящей из 1) конъюгирования с использованием альдегида глутаровой кислоты, 2) с использованием янтарного ангидрида, 3) с использованием сложного эфираN-гидроксисукцинимида -малеимидопропионовой кислоты (MPS) и 4) любого способа, не требующего использования спейсерных агентов с ароматическими боковыми цепями;D) объединение конъюгатов, полученных на стадии (С), включая добавление СD4 связывающего пептида или содержащего его конъюгата; и Е) введение полученного препарата в квасцы или любой другой приемлемый адъювант. 2. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к областям вируса иммунодефицита человека типа 1 или 2. 23 3. Способ по п.2, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к вариабельным областям вируса иммунодефицита человека типа 1 или 2. 4. Способ по п.3, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к третьей вариабельной области (V3) вируса иммунодефицита человека типа 1 или 2. 5. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к вирусу гепатита В. 6. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к вирусу гепатита С. 7. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к вирусу Денге. 8. Способ по п.1, отличающийся тем, что олигомеры, содержащиеся в структурах, полученных на стадии (В), относятся к полисахаридным областям Neisseria meningitidis. 9. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), являются пептидомиметиками антигенных полисахаридов. 10. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к антигенным областям микроорганизма или патогена. 11. Способ по п.1, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к аутоантигенам. 12. Способ по п.11, отличающийся тем, что пептиды, содержащиеся в структурах, полученных на стадии (В), относятся к гонадотропинсекретирующему гормону. 13. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (С),является поверхностным антигеном гепатита В,HBsAg. 14. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (С),является белком р 64 К Neisseria meningitidis. 15. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (С),является ядерным белком вируса иммунодефицита человека. 16. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (С),является ядерным антигеном гепатита В или ядерным антигеном гепатита С. 17. Способ по п.1, отличающийся тем, что молекула-носитель, используемая на стадии (С),является полисахаридом. 18. Способ по п.17, отличающийся тем, что молекула-носитель, используемая на стадии (С),является декстраном. 24 19. Способ по п.1, отличающийся тем, что молекулу-носитель и разветвленную структуру,используемые на стадии (С), связывают ковалентно, электростатически или на основе гидрофобности. 20. Антигенная структура, способная усиливать специфическую перекрестную реактивность, включающая разветвленные антигенные эпитопы, связанные с белками-носителями. 21. Антигенная структура по п.20, отличающаяся тем, что эпитопы разветвленной области имеют пептидную или олигосахаридную природу. 22. Антигенная структура по п.21, отличающаяся тем, что эпитопы пептидной природы представляют собой пептидную консенсусную последовательность вариабельных областей,выбираемых из подтипов, подгрупп, серотипов или ассоциаций другого типа. 23. Антигенная структура по п.21, отличающаяся тем, что эпитопы пептидной природы представляют собой пептидные библиотеки пептидных последовательностей, выбираемых из микроорганизмов или пептидомиметиков. 24. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к вирусу иммунодефицита человека типа 1 или 2. 25. Антигенная структура по п.24, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к вариабельным областям вируса иммунодефицита человека типа 1 или 2. 26. Антигенная структура по п.25, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к вариабельной области V3 вируса иммунодефицита человека типа 1 или 2. 27. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к областям вируса гепатита В. 28. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к областям вируса гепатита С. 29. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к областям вируса Денге. 30. Антигенная структура по п.21, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к полисахаридным антигенам Neisseria meningitidis. 31. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей являются пептидомиметиками полисахаридных или белковых антигенов. 32. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы раз 25 ветвленных пептидных областей относятся к микроорганизмам или патогенам. 33. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы из разветвленных пептидных областей относятся к аутоантигенам. 34. Антигенная структура по любому из пп.21-23, отличающаяся тем, что эпитопы разветвленных пептидных областей относятся к гонадотропинсекретирующему гормону. 35. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является поверхностным антигеном вируса гепатита В,HBsAg. 36. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является белком р 64 К Neisseria meningitidis. 37. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является нуклеокапсидным антигеном ВИЧ. 38. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является нуклеокапсидным антигеном HBV (HBcAg). 39. Антигенная структура по п.20, отличающаяся тем, что молекула-носитель является полисахаридом. 40. Антигенная структура по п.39, отличающаяся тем, что молекула-носитель является декстраном. 26 41. Применение антигенной структуры по любому из пп.20-40 в диагностической системе на антигены вируса иммунодефицита человека типа 1 и 2, вируса гепатита С, вируса гепатита В, вируса Денге, Neisseria meningitidis, гонадотропинсекретирующего гормона. 42. Применение антигенной структуры по любому из пп.20-40 в профилактических и терапевтических вакцинах, направленных на вирус иммунодефицита человека типа 1 и 2, вирус гепатита С, вирус гепатита В, вирус Денге, Neisseria meningitidis, гонадотропинсекретирующий гормон. 43. Вакцинная композиция, включающая антигенную структуру по любому из пп.20-40 в сочетании с приемлемым адсорбирующим веществом или адъювантом. 44. Вакцинная композиция по п.43, для системного введения или введения через слизистую оболочку. 45. Применение вакцинной композиции по п.43 или 44 для профилактики инфекционных заболеваний, аутоиммунной реакции или рака. 46. Применение вакцинной композиции по п.43 или 44 для лечения инфекционных заболеваний, аутоиммунной реакции или рака.
МПК / Метки
МПК: C07K 14/00, C08G 73/02, A61P 43/00, A61K 31/74
Метки: способ, реактивность, получения, усиливающих, специфическую, перекрестную, структур, антигенных
Код ссылки
<a href="https://eas.patents.su/16-5313-sposob-polucheniya-antigennyh-struktur-usilivayushhih-specificheskuyu-perekrestnuyu-reaktivnost.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения антигенных структур, усиливающих специфическую перекрестную реактивность</a>
Предыдущий патент: Способ получения гетерологичного секретируемого белка из клеток яичника китайского хомячка, выращиваемых на микроносителях
Следующий патент: Фармацевтическая композиция дронедарона для парентерального введения
Случайный патент: Новые соединения, фармацевтические композиции, содержащие их, и способы их использования