Способ лечения неопластического заболевания при введении фенилацетилглутамина, фенилацетилизоглутамина и/или фенилацетата
Формула / Реферат
1. Фармацевтическая композиция, включающая в водном растворе
a) соединение формулы I

где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом, или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II
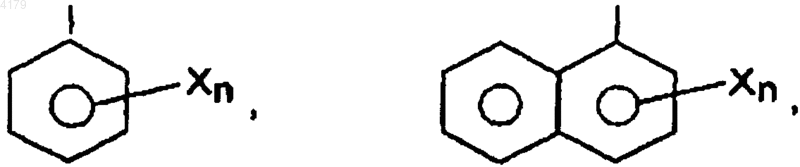
где X является галогеном, низшим (C1-6)алкилом, низшим (C1-6)алкокси, циклоалкилом, циклоалкокси, (C6-12)арилом или гидрокси, и n равно 0, 1, 2, 3 или 4; и
b) соединение формулы III
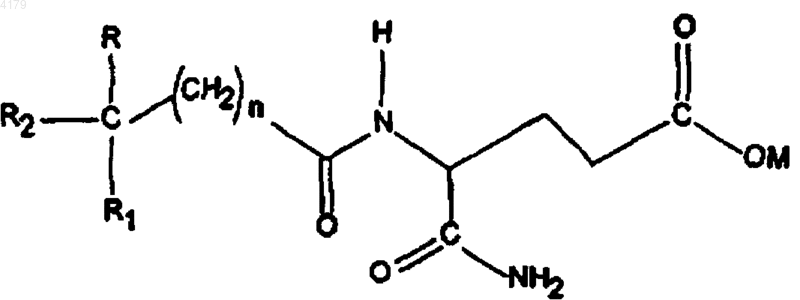
где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II;
в которой соединение формулы I находится в соотношении 4:1 по массе к соединению формулы III и объединенная концентрация соединения формулы I и соединения формулы III составляет от 200 до 350 мг/мл.
2. Фармацевтическая композиция по п.1, в которой в соединении формулы I M является водородом или натрием; n равно 0; R является H или C3H7; R1 выбирают из группы, состоящей из H, CH3, CH3-O-, C2H5 и C3H7; R2 выбирают из формулы II, где X является Cl, F или OH и где в соединении формулы III M является водородом или натрием; n равно 0; R выбирают из группы, состоящей из H и C3H7; R1 выбирают из группы, состоящей из H, CH3, CH3-O-, C2H3 и C3H7; R2 выбирают из формулы II, где X является Cl, F или OH.
3. Фармацевтическая композиция по п.1, в которой соединение формулы I является фенилацетилглутамином или его фармацевтически приемлемыми солями, и соединение формулы III является фенилацетилизоглутамином или его фармацевтически приемлемыми солями.
4. Фармацевтическая композиция по п.2 или 3, в которой объединенная концентрация составляет 300 мг/мл.
5. Способ лечения неопластического заболевания, включающий
a) введение пациенту фармацевтической композиции, включающей
i) соединение формулы IV
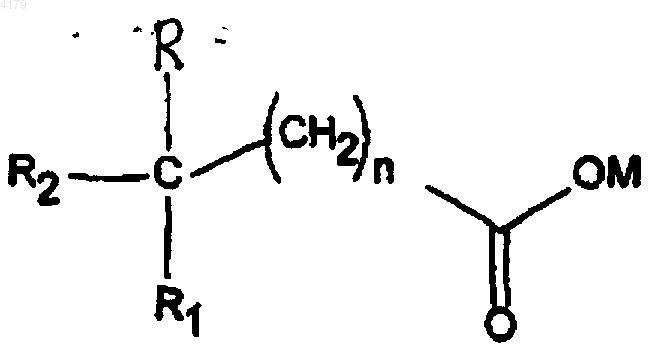
где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6 )алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II
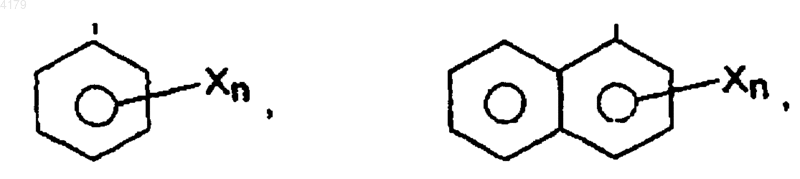
где X является галогеном, низшим (C1-6)алкилом, низшим (C1-6)алкокси, циклоалкилом, циклоалкокси, (C6-12)арилом или гидрокси, и n равно 0, 1, 2, 3 или 4; и
ii) соединение формулы I
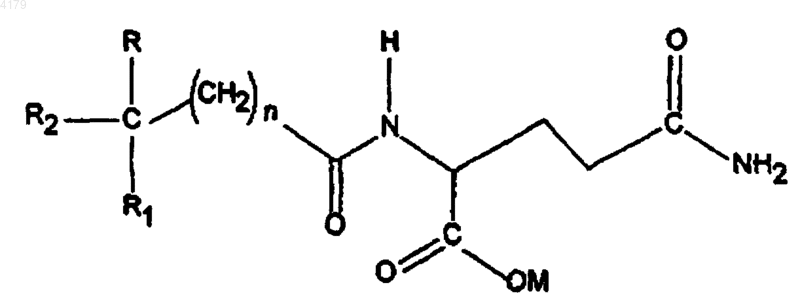
где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II,
где соединение формулы IV и соединение формулы I находятся в соотношении 4:1 по массе; и
iii) воду, достаточную для образования водного раствора соединения формулы IV и соединения формулы I, причем объединенная концентрация соединения формулы IV и соединения формулы I составляет от 70 до 150 мг/мл,
b) введение композиции со скоростью инфузии от 100 до 400 мл/ч, предпочтительно со скоростью инфузии от 250 до 300 мл/ч, причем введение композиции производят со скоростью, достаточной для достижения уровня дозирования от 0,1 до 2,6 г/кг/день, предпочтительно уровень дозирования составляет от 0,2 до 0,9 г/кг/день.
6. Способ по п.5, где в соединении формулы IV M является водородом или натрием; n равно 0; R является H или C3H7; R1 выбирают из группы, состоящей из H, CH3, CH3-O-, C2H5 и C3H7; R2 выбирают из формулы II, где X является Cl, F или OH; и в котором в соединении формулы I M является водородом или натрием; n равно 0; R является H и C3H7; R1 выбирают из группы, состоящей из H, CH3, CH3-O-, C2H5 и C3H7; R2 выбирают из заместителей формулы II, где X является Cl, F или OH.
7. Способ по п.5, в котором соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями и соединение формулы I является фенилацетилглутамином или его фармацевтически приемлемыми солями.
8. Фармацевтическая композиция, включающая в водном растворе
a) соединение формулы IV
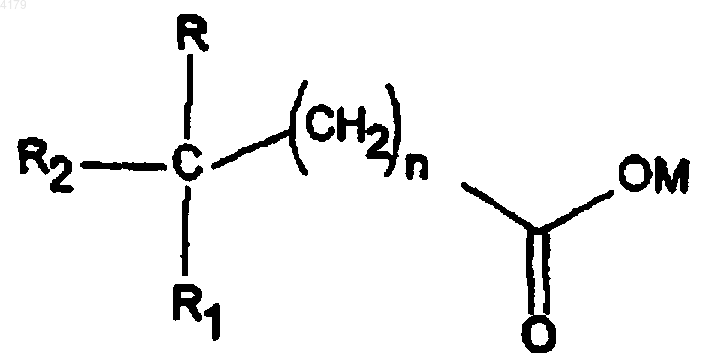
где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II

где X является галогеном, низшим (C1-6)алкилом, низшим (C1-6)алкокси, циклоалкилом, циклоалкокси, (C6-12)арилом или гидрокси, и n равно 0, 1, 2, 3 или 4;
b) соединение формулы III
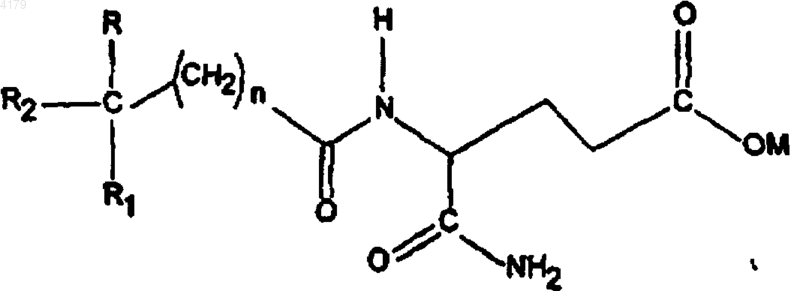
где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II; и
в которой соединение формулы IV и соединение формулы III находятся в соотношении 4:1 по массе и объединенная концентрация соединения формулы IV и соединения формулы III составляет от 70 до 150 мг/мл.
9. Фармацевтическая композиция по п.8, в которой в соединении формулы IV M является водородом или натрием; n равно 0; R является H или C3H7; R1 выбирают из группы, состоящей из H, CH3, CH3-O-, C2H5 и C3H7; R2 выбирают из формулы II, где X является Cl, F или OH; и где в соединении формулы III M является водородом или натрием; n равно 0; R является H или C3H7; R1 выбирают из группы, состоящей из H, CH3, CH3-O-, C2H5 и C3H7; R2 выбирают из формулы II, где X является Cl, F или OH.
10. Фармацевтическая композиция по п.8, в которой соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями, и соединение формулы III является фенилацетилизоглутамином или его фармацевтически приемлемыми солями.
11. Фармацевтическая композиция по любому из пп.7 или 10, в которой объединенная концентрация составляет 80 мг/мл.
12. Фармацевтическая композиция, включающая фенилацетилглутамин или фенилацетилизоглутамин и воду, достаточную для образования водного раствора с концентрацией от 200 до 350 мг/мл.
13. Способ лечения неопластического заболевания, включающий
a) введение фармацевтической композиции по любому из пп.1-4 или 12 пациенту со скоростью инфузии от 100 до 400 мл/ч, предпочтительно со скоростью инфузии от 250 фю 300 мл/ч; причем композицию вводят со скоростью, достаточной для достижения уровня дозирования от 0,6 до 25 г/кг/день, предпочтительно от 5,0 до 12,0 г/кг/день.
14. Способ лечения неопластического заболевания, включающий
a) введение фармацевтической композиции по любому из пп.8-12 пациенту со скоростью инфузии от 100 до 400 мл/ч, предпочтительно со скоростью инфузии от 250 до 300 мл/ч; причем композицию вводят со скоростью, достаточной для достижения уровня дозирования от 0,1 до 2,6 г/кг/день, предпочтительно от 0,2 до 0,9 г/кг/день.
15. Фармацевтическая композиция, включающая водный раствор соединения формулы IV
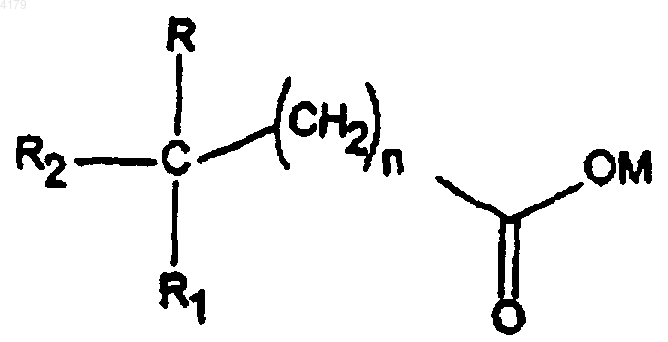
где n равно 0-5; M является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из H, низшего (C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из заместителей формулы II

где X является галогеном, низшим (C1-6)алкилом, низшим (C1-6)алкокси, циклоалкилом, циклоалкокси, арилом или гидрокси, и n равно 0, 1, 2, 3 или 4; и
в которой концентрация соединения формулы IV составляет от 70 до 150 мг/мл.
16. Композиция по п.15, где соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями.
17. Композиция по п.15, в которой соединение формулы IV является предшественником фенилуксусной кислоты, предпочтительно фенилмасляной кислотой или ее фармацевтически приемлемыми солями.
Текст
1 Предпосылки изобретения 1. Область изобретения. Настоящее изобретение в основном относится к области лечения неопластических заболеваний. Конкретнее, оно касается внутривенного введения высококонцентрированных растворов фенилацетилглутамина и фенилацетилизоглутамина или фенилацетилглутамина и фенилацетата или их солей или производных с высокими скоростями инфузии и высокими дозами. 2. Описание предшествующего уровня техники. Исследования факторов роста и ингибиторов роста в течение последних тридцати лет указывают на возможное существование защитной системы в организме человека, дополнительной к иммунной системе. Эту защитную систему индукторов дифференциации и регуляторов экспрессии онкогенов и супрессорных генов опухолей можно назвать биохимической защитной системой или BDS. В то время,как основной целью иммунной системы является защита организма от внешней инвазии, основная цель BDS заключается в защите организма от дефектных клеток. Неопластические заболевания человека (раки, злокачественные и доброкачественные опухоли) являются примерами заболеваний, с которыми борется BDS. Одной группой соединений, которые обеспечивают компоненты BDS, являются аналоги естественных аминокислот и карбоновые кислоты. Не связываясь теорией, механизмом защиты от рака с помощью аналогов естественных аминокислот, может быть индукция дифференциации, конъюгации глутамина для торможения роста опухолевых клеток, понижающая регуляция онкогенов, таких как ras, или повышающая регуляция генов детоксикации, таких как GSTP1 и GSTM1 и супрессорных генов опухолей, таких как р 53, гена ретинобластомы и гена нейрофиброматоза типа 1, возможно за счет снижения метилирования гиперметилированных генов. Независимо от детального механизма действия,известно, что аналоги естественных аминокислот индуцируют аномальные клетки подвергаться конечной дифференциации и погибать в результате запрограммированной гибели клеток. В отличие от некроза, связанного с химиотерапией или лучевой терапией, погибшие клетки постепенно удаляются и замещаются нормальными клетками, приводя к заживлению органа и восстановлению функции. Изучение аналогов естественных аминокислот в качестве потенциальных противоопухолевых агентов, в дальнейшем в основном антинеопластонов, началось в 1967 году с наблюдения о существенном дефиците содержания сывороточных пептидов у пациентов, страдающих раком. В течение 80-х годов Burzynski сообщил о выделении фракций антинеопластонов из мочи человека и применении этих фрак 004179 2 ций для лечения рака у человека, патент США 4470970, полное описание которого включается в качестве ссылки. Среди композиций, представленных для лечения рака, были а) 3 фенилацетиламино-2,6-пиперидиндион и b) смесь фенилацетата натрия и фенилацетилглутамина в соотношении 4:1 по массе. Композиция (b) относится в дальнейшем к антинеопластону AS2-1 или просто AS2-1. Было установлено, что 3-фенилацетиламино-2,6-пиперидиндион гидролизуется под действием гидроокиси натрия при растворении и нейтрализации в фенилацетилглутамин и фенилацетилизоглутамин в соотношении 4:1. Были приготовлены лекарственные формы вышеуказанных композиций и они показали хорошую активность в доклинических испытаниях. 3-Фенилацетиламино-2,6-пиперидиндион оказывает цитостатическое действие в культивируемых человеческих опухолевых клетках молочной железы линии MDA-MB-231. Также наблюдали зависимое от дозы торможение кривых роста клеточных линий КМСН-1, KYN-1 иKIM-1, крысиной лимфомы Nb2 и аденокарциномы ободочной кишки человека при применении 3-фенилацетиламино-2,6-пиперидиндиона. Были проведены опыты in vivo, в которых 3-фенилацетиламино-2,6-пиперидиндион или А 10 вводили мышам, которым имплантировали клетки S180 или опухолевые клетки молочной железы R-27. В опыте с S180 уровни у цАМФ в печени и опухолях обработанных мышей были достоверно выше по сравнению с контрольными мышами после введения 3-фенилацетиламино 2,6-пиперидиндиона. В опыте с R-27 после инъекции А 10 наблюдали ингибирование поглощения 3 Н-TdR и торможение кривой роста.AS2-1 или фенилуксусная кислота приводит к зависимому от дозы торможению роста клеток карциномы молочной железы линииHBL-100 и Ki-1 и также способствует конечной дифференциации или фенотипической реверсии клеток линий промиелоцитарной лейкемии человека HL-60, хронической лимфоцитарной лейкемии, нейробластомы, мышиной фибросаркомы V7T, резистентной к гормонам аденокарциномы простаты РС 3, астроцитомы, медуллобластомы, злокачественной меланомы и карциномы яичников. AS2-1 или фенилуксусная кислота вызывает адипоцитное превращение в культивируемых предраковых мезенхимных клетках С 3 Н 10 Т 1/2 и усиливает продукцию гемоглобина в эритролейкемических клетках К 562. Кроме того, и в отличие от имеющихся в настоящее время обычных химиотерапевтических препаратов, таких как 5-аза-2-дезоксицитидин, фенилуксусная кислота не вызывает прогрессирования опухоли в предраковых клетках С 3 Н 10 Т 1/2. В доклинических токсикологических исследованиях было установлено, что LD50 A10 у мышей составляет 10,33 г/кг/день. 3 При вскрытии погибших животных был выявлен генерализованный застой во внутренних органах, отек легких и геморрагические изменения в альвеолах. На вскрытии выжившие опытные животные были идентичны контрольным животным. В опытах по хронической токсичности не было выявлено отрицательных эффектов через 180 суток.LD50 AS2-1 у мышей равнялось 2,33 г/кг/день. При вскрытии погибших животных был выявлен генерализованный застой во внутренних органах, отек легких и геморрагические изменения в альвеолах, а также пятна Тадеу и застой в тимусе. В опытах по хронической токсичности при введении до дозы 1,11 г/кг/день не было выявлено отрицательных эффектов через 365 дней. Было установлено, что А 10 и AS2-1 не являются мутагенами в тесте Эймса и А 10 не обладает тератогенным действием в отношении плодов крыс. Заслуживающим внимания вопросом, касающимся токсикологических исследований,является то, что фенилацетилглутамин, компонент AS2-1, и также продукт разложения 3 фенилацетиламино-2,6-пиперидиндиона обычно не обнаруживают у мышей, но обычно обнаруживают у людей. На основании этого можно предположить, что люди могут проявлять большую устойчивость к обоим А 10 и AS2-1,чем мыши, и, таким образом, для людей возможны большие дозы обеих композиций. Это предположение явилось правильным, как будет показано ниже. В токсикологических исследованиях у людей в фазе I клинических испытаний внутривенное введение А 10 в дозах до 2,21 г/кг/день было связано с минимальными побочными эффектами, включающими лихорадочную реакцию,боль в мышцах и суставах, мышечные сокращения в горле, боль в области живота небольшой продолжительности и единичные случаи тошноты, головокружения и головной боли (DrugsExptl.Clin.Res., 1986, 12 Suppl.l, 47-55). Пероральное введение AS2-1 в дозах до 238 мг/кг/день было связано с временным незначительным снижением числа лейкоцитов у одного пациента. Инъекционное введение AS2-1 в дозах до 160 мг/кг/день было связано с минимальными побочными эффектами, включающими незначительную тошноту и рвоту, кожную аллергическую реакцию, умеренное повышение кровяного давления, лихорадочную реакцию,незначительное снижение числа лейкоцитов (в каждом случае у одного пациента) и незначительное нарушение равновесия электролитов у трех пациентов. В клинических опытах было установлено,что 3-фенилацетиламино-2,6-пиперидиндион,А 10, и AS2-1 были эффективны в лечении рака. 4 антинеопластона AS2-1 для внутривенных инъекций (100 мг/мл активных ингредиентов) вводили пациентам в дозах не более 0,16 г/кг/день. Из 21 случая неопластического заболевания наблюдали шесть полных ремиссий, две частичных ремиссии, семь стабилизации и шесть случаев прогрессирования заболевания. Провели фазу II клинических испытаний, в которых пациентам с астроцитомой вводили А 10 (100 мг/мл) в дозах от 0,5 до 1,3 г/кг/день или AS2-1 (100 мг/мл) в дозах от 0,2 до 0,5 г/кг/день в течение 67-706 дней (в: Recent Advances in Chemotherapy. Adam. D., ed. Munich:Futuramed, 1992). Из 20 пациентов у четырех был полный ответ, у двух - частичный ответ, у десяти - стабилизация и у четырех - прогрессирование заболевания. У Samid, патент США 5605930 (полное содержание которого включено в качестве ссылки) один фенилацетат натрия использовали для лечения рака у человека и вводили в дозах не более 0,3 г/кг/день. Однако наблюдали недостатки при низких концентрациях, скоростях потока и дозах растворов для внутривенного введения. Первое,BurzynskiExptl.Clin.Res., 12 Suppl. 1, 11-16 (1986 сообщили о полной редукции колоний опухолевых клеток линий HBL-100 и Ki No 1 под действием 5,0 мг/мл или фенилуксусной кислоты, или антинеопластона AS2-1. Аналогично наблюдали цитостаз человеческих опухолевых клеток карциномы молочной железы линии MDA-MB-231 при использовании концентраций 3-фенилацетиламино-2,6-пиперидиндиона 2,0 мг/мл иAS2-1 - 3,0 мг/мл. Однако 3-фенилацетиламино 2,6-пиперидиндион слабо растворим в воде, и при введении крысам через рот максимальный уровень в плазме составляет примерно 0,2 мг/мл, грубо в 10 раз меньше чем цитостатическая концентрация, наблюдаемая в опытах с тканевыми культурами. При обычных схемах введения антинеопластона AS2-1 максимальные концентрации в плазме крови фенилуксусной кислоты равняются примерно 0,43 мг/мл, грубо в 7 раз меньше чем цитостатическая концентрация, наблюдаемая в опытах с тканевыми культурами. К тому же, как 3-фенилацетиламино 2,6-пиперидиндион, продукты его гидролиза,так и AS2-1 быстро выделяются in vivo. Также, при поглощении антинеопластонов опухолевой тканью образуется градиент концентрации между внешней стороной опухолевой ткани, в которой концентрация антинеопластона будет равна концентрации в плазме крови,и точкой или точками внутри опухолевой ткани,в которых концентрация антинеопластона будет минимальной и может равняться нулю. Следовательно, относительно низкие концентрации противоопухолевых агентов в плазме ведут к тому, что в некой внутренней части опухолевой ткани не происходит значительного поглощения 5 противоопухолевого агента, и она остается в ее опухолевом состоянии. Второе, введение раствора, включающего продукты гидролиза 3-фенилацетиламино-2,6 пиперидиндиона, с низкими скоростями инфузии от 2,5 мл/ч до 84 мл/ч часто приводит к повышению уровня продуктов выделения в плазме крови. Примером продукта выделения подобного расщепления является мочевая кислота. Это повышение мешает лечению, приводя к необходимости либо снижать дозы, либо прерывать лечение для введения дополнительных препаратов, например аллопуринола, для снижения уровня продукта выделения, например мочевой кислоты. Следовательно, желательно иметь лекарственные формы для внутривенного введения композиций аналогов аминокислот с противоопухолевой активностью, где лекарственные формы для внутривенного введения обеспечивают высокие концентрации в плазме крови активного ингредиента или ингредиентов для полного проникновения в опухоли эффективных количеств активного ингредиента или ингредиентов. Также желательно, чтобы подобные лекарственные формы для внутривенного введения не приводили к повышенным уровням продуктов выделения в плазме крови. Краткое описание изобретения Настоящее изобретение относится к способу лечения неопластического заболевания, в том числе рака, включающему введение пациенту фармацевтической композиции, включающей фенилацетилглутамин формулы I и фенилацетилизоглутамин формулы III. Соединение формулы I находится в соотношении 4:1 по массе к фенилацетилизоглутамину формулы III. Формула I представляется структурой где R и R1 независимо выбираются из группы,состоящей из Н, низшего алкокси (C1-6) или низшего алкила (C1-6); R2 выбирается из группы,состоящей из арила (C6-12); М является водородом, образующим соль катионом, таким как натрий, калий или аммоний, низшим алкилом (C16), циклоалкилом или арилом (C6-12), и n равно 05. Предпочтительно М является водородом, образующим соль катионом, алкилом (C1-6), циклоалкилом или арилом (С 6-12). Более предпочтительно М является водородом или натрием; n равно 0; R выбирается из группы, состоящей из Н и С 3 Н 7; R1 выбирается из группы, состоящей из Н, СН 3, СН 3-O-, С 2 Н 5 и С 3 Н 7; R2 является арилом, выбранным из группы, состоящей из формулы II:(C1-6), низшим алкокси (C1-6), циклоалкилом,циклоалкокси, арилом (C6-12), или гидрокси, и n равно 0, 1, 2, 3 или 4. Более предпочтительно R2 является фенилом или выбирается из группы формулы II, где X выбирается из Cl, F или ОН. Наиболее предпочтительно R2 является фенилом или фенилхлоридом. Кроме того, соединение формулы I можно использовать в виде рацемической смеси или в виде отдельных оптических изомеров или любой их комбинации. Формула III представляется структурой: где R и R1 независимо выбираются из группы,состоящей из Н, низшего алкокси (C1-6) или низшего алкила (C1-6); R2 выбирается из группы,состоящей из арила (C6-12); М является водородом, образующим соль катионом, таким как натрий, калий или аммоний, диэтаноламином,циклогексиламином, естественной аминокислотой с молекулярной массой менее чем 500 kD,низшим алкилом (С 1-6), циклоалкилом или арилом (C6-12) , и n равно 0-5. Предпочтительно М является водородом или натрием; n равно 0; R выбирается из группы, состоящей из Н и С 3 Н 7;(C1-6), низшим алкокси (С 1-6), циклоалкилом,циклоалкокси, арилом (С 6-12), замещенным арилом или гидрокси, и n равно 0, 1, 2, 3 или 4. Более предпочтительно R2 является фенилом формулы II, где X выбирается из Cl, F или ОН. Наиболее предпочтительно R2 является фенилом или фенилхлоридом. Таким же образом соединение формулы III можно использовать в виде рацемической смеси или в виде отдельных оптических изомеров или любой их комбинации. В композиции объединенная концентрация фенилацетилглутамина формулы I и фенилацетилизоглутамина формулы III в водном растворе равняется от 200 мг/мл до 350 мг/мл, и композицию вводят со скоростью инфузии от 2,5 мл/ч до 400 мл/ч, предпочтительно от 100 мл/ч до 400 мл/ч. В дополнительном воплощении настоящее изобретение относится к способу лечения неопластического заболевания, в том числе рака,включающему введение фармацевтической композиции, фармацевтической композиции,включающей фенилуксусную кислоту формулы где R и R1 независимо выбираются из группы,состоящей из Н, низшего алкокси (C1-6) или низшего алкила (C1-6); R2 выбирается из группы,состоящей из арила (С 6-12); М является водородом, образующим соль катионом, таким как натрий, калий или аммоний, низшим алкилом (C16), циклоалкилом или арилом (С 6-12), и n равно 05. Предпочтительно М является водородом или натрием; n равно 0; R выбирается из группы,состоящей из Н и С 3 Н 7; R1 выбирается из группы, состоящей из Н, СН 3, СН 3-O-, C2H5 и С 3 Н 7;R2 является арилом, выбранным из группы, состоящей из формулы II, где X является галогеном, низшим алкилом (C1-6), низшим алкокси(C1-6), циклоалкилом, циклоалкокси, арилом (С 612), или гидрокси, и n равно 0, 1, 2, 3 или 4. Более предпочтительно R2 является фенилом, выбранным из группы формулы II, где X выбирается из Cl, F или ОН. Наиболее предпочтительно R2 является фенилом или фенилхлоридом. В другом воплощении соединение формулы IV присутствует в соотношении 4:1 по массе к соединению формулы I, обычно в водном растворе. В композиции объединенная концентрация соединения формулы I и соединения формулы IV равняется от 70 мг/мл до 150 мг/мл, и композицию вводят со скоростью инфузии от 2,5 до 400 мл/ч, предпочтительно от 100 до 400 мл/ч. В еще одном воплощении настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы IV в соотношении 4:1 к соединению формулы III, где объединенная концентрация соединения формулы IV и соединения формулы III составляет от 200 до 350 мг/мл, и композицию вводят со скоростью инфузии от 2,5 до 400 мл/ч, предпочтительно от 100 до 400 мл/ч. Эти скорости потока значительно выше,чем любые известные, о которых сообщалось ранее для противоопухолевых препаратов. Высокие скорости потока полезны при лечении рака, поскольку они позволяют достичь в крови концентраций активных агентов антинеопластона А 10 грубо в два раза больше, чем с обычными, более низкими скоростями инфузии. Высокие скорости потока позволяют достичь концентраций в крови, сравнимых с таковыми, которые, как было показано, проявляют противоопухолевую активность в тканевой культуре и также позволяют достичь более высокого проникновения в опухолевую ткань. Следовательно, высокие скорости потока более эффективны,чем более низкие скорости потока при лечении рака. Описание иллюстративных воплощений 8 В описании изобретения термин антинеопластон А 10 определяется как смесь натриевых солей фенилацетилглутамина и фенилацетилизоглутамина в соотношении 4:1. Термины антинеопластон AS2-1 и AS21 определяются как смесь натриевых солей фенилуксусной кислоты и фенилацетилглутамина в соотношении 4:1. Термин пациент включает людей и пациентов в ветеринарии. Изобретение описывает предпочтительные воплощения, известные на время подачи этой заявки, представляющие наилучший способ,который можно ожидать в настоящее время для реализации и использования фармацевтических композиций по настоящему изобретению в способах настоящего изобретения. А. Получение фармацевтических композиций. Фармацевтические композиции по настоящему изобретению включают в одном воплощении соединение формулы I: Формула I где R и R1 независимо выбираются из группы,состоящей из Н, низшего алкокси (C1-6) или низшего алкила (C1-6); R2 выбирается из группы,состоящей из арила (C6-12) и замещенного арила; М является водородом, образующим соль катионом, таким как натрий, калий или аммоний,алкилом (C1-6), циклоалкилом или арилом(C6-12), и n равно 0-5. Предпочтительно М является водородом или натрием; n равно 0; R выбирается из группы, состоящей из Н и С 3 Н 7; R1 выбирается из группы, состоящей из Н, СН 3,СН 3-O-, С 2 Н 5 и С 3 Н 7; R2 является арилом (С 6-12),выбранным из группы, состоящей из формулы(C1-6), низшим алкокси (C1-6), циклоалкилом,циклоалкокси, арилом (С 6-12) или гидрокси, и n равно 0, 1, 2, 3 или 4. Более предпочтительно R2 является фенилом, выбранным из группы формулы II, где X выбирается из Cl, F или ОН. Наиболее предпочтительно R2 является фенилом или фенилхлоридом. Соединение формулы I находится в соотношении 4:1 по массе к соединению формулы где R и R1 независимо выбирают из группы,состоящей из Н, низшего алкокси (C1-6) или низшего алкила (C1-6); R2 выбирается из группы,состоящей из арила (C6-12); M является водородом, образующим соль катионом, таким как натрий, калий или аммоний, алкилом (C1-6), циклоалкилом или арилом (C6-12), и n равно 0-5. Предпочтительно М является водородом или натрием; n равно 0; R выбирается из группы,состоящей из Н и С 3 Н 7; R1 выбирается из группы, состоящей из Н, СН 3, СН 3-O-, С 2 Н 5 и С 3 Н 7;R2 является арилом, выбранным из группы, состоящей из формулы II, где X является галогеном, низшим алкилом (C1-6), низшим алкокси(C6-12) или гидрокси, и n равно 0, 1, 2, 3 или 4. Более предпочтительно R2 является фенилом,выбранным из группы формулы II, где X выбирается из Cl, F или ОН. Наиболее предпочтительно R2 является фенилом или фенилхлоридом. В композиции объединенная концентрация соединения формулы I и соединения формулыIII составляет от 200 до 350 мг/мл. В предпочтительном аспекте этого воплощения изобретения соединение формулы I является фенилацетилглутамином или его фармацевтически приемлемыми солями, и соединение формулы III является фенилацетилизоглутамином или его фармацевтически приемлемыми солями, и объединенная концентрация соединения формулы I и соединения формулы III составляет 300 мг/мл. Обычно будет использоваться рацемическая смесь каждого соединения, однако, также можно использовать отдельные оптические изомеры. Во втором воплощении фармацевтические композиции по настоящему изобретению включают водный раствор соединения формулы IV: Формула IV где R и R1 независимо выбираются из группы,состоящей из H, низшего алкокси (C1-6) или низшего алкила (C1-6); R2 выбирается из группы,состоящей из арила (С 6-12); М является водородом, образующим соль катионом, таким как натрий, калий или аммоний, алкилом (C1-6), циклоалкилом или арилом (С 6-12), и n равно 0-5. Предпочтительно М является водородом или натрием; n равно 0; R выбирается из группы,состоящей из Н и С 3 Н 7; R1 выбирается из группы, состоящей из Н, СН 3, СН 3-O-, С 2 Н 5 и С 3 Н 7;R2 является арилом, выбранным из группы, состоящей из формулы II, где X является галоге 004179(C6-12) или гидрокси, и n равно 0, 1, 2, 3 или 4. Более предпочтительно R2 является фенилом,выбранным из группы формулы II, где X выбирается из Cl, F или ОН. Наиболее предпочтительно R2 является фенилом или фенилхлоридом. Соединение формулы IV находится в соотношении 4:1 по массе к соединению формулыI, и в композиции объединенная концентрация соединения формулы I и соединения формулыIV равняется от 70 до 150 мг/мл. Одно воплощение этого аспекта изобретения включает введение фармацевтических композиций, включающих соединения формулы IV и формулы I, со скоростью инфузии от 100 до 400 мл/ч. В предпочтительном аспекте этого воплощения изобретения фармацевтические композиции вводят со скоростью инфузии от 250 до 300 мл/ч, большей частью достаточной для достижения дозы от 0,1 до 2,6 г/кг/день. В еще более предпочтительном воплощении фармацевтическую композицию вводят со скоростью от 250 до 300 мл/ч, большей частью достаточной для достижения дозы от 0,2 до 0,9 г/кг/день. В предпочтительном аспекте этого воплощения изобретения соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями, и соединение формулы I является фенилацетилглутамином или его фармацевтически приемлемыми солями, и объединенные концентрации соединения формулы IV и соединения формулы I составляют 80 мг/мл. В еще одном воплощении изобретения соединение формулы IV находится в соотношении 4:1 по массе к соединению формулы III, и в композиции объединенная концентрация соединения формулы IV и соединения формулы III равняется от 70 до 150 мг/мл. В предпочтительном аспекте этого воплощения изобретения соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями, и соединение формулы III является фенилацетилизоглутамином или его фармацевтически приемлемыми солями, и объединенная концентрация соединения формулы IV и соединения формулыIII составляет 80 мг/мл. В дополнительных воплощениях настоящего изобретения фармацевтическая композиция включает раствор либо соединения формулы I, либо соединения формулы III. В одном аспекте этого воплощения изобретения фармацевтическая композиция включает фенилацетилглутамин или его фармацевтически приемлемые соли, находящиеся в растворе в концентрации от 200 до 350 мг/мл. В другом аспекте этого воплощения изобретения фармацевтическая композиция включает фенилацетилизоглу 11 тамин или его фармацевтически приемлемые соли, находящиеся в растворе в концентрации от 200 до 350 мг/мл. В особенно предпочтительных аспектах этих воплощений настоящего изобретения растворы являются водными растворами. В других воплощениях настоящего изобретения фармацевтическая композиция включает водный раствор соединения формулы IV,где соединение формулы IV находится в концентрации от 70 до 150 мг/мл. В одном аспекте этого воплощения изобретения соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями. В другом аспекте этого воплощения соединение формулы IV является предшественником фенилуксусной кислоты, таким как фенилмасляная кислота или ее фармацевтически приемлемыми солями. Предпочтительными соединениями формулы I являются фенилацетилглутамин и натриевая соль фенилацетилглутамина и его Lоптические изомеры; формулы III, фенилацетилизоглутамин и натриевая соль фенилацетилизоглутамина и формулы IV, фенилуксусная кислота и фенилацетат натрия. Фенилацетилглутамин можно выделить из жидкостей организма человека, например мочи,или можно синтезировать способами, известными в этой области, например обработкой фенилуксусной кислоты N,N'-дисукцинимидилкарбонатом в ацетонитриле с последующим взаимодействием с L-глутамином в присутствииNaHCO3, в смеси ацетонитрила/воды 1:1. Фенилацетилглутамин также можно синтезировать реакцией фенилацетилхлорида с L-глутамином в присутствии NаНСО 3 в водном растворе. Еще одним способом синтеза, который можно использовать, является обработка 3-фенилацетиламино-2,6-пиперидиндиона гидроокисью натрия. Фенилацетилизоглутамин можно синтезировать реакцией фенилацетилхлорида с Lглутамином с образованием фенилацетилглутамина с последующим нагреванием в вакууме при 160 С с получением 3-фенилацетиламино 2,6-пиперидиндиона, который затем можно обработать гидроокисью натрия. Также фенилацетилизоглутамин можно получить обработкой фенилуксусной кислоты N,N'-дисукцинимидилкарбонатом в ацетонитриле с последующим взаимодействием с L-изоглутамином в присутствии NaHCO3 в смеси ацетонитрила/воды 1:1. Однако для второго синтеза необходим Lизоглутамин, который является дорогим, так что первый путь предпочтительнее по экономическим соображениям. Фенилуксусную кислоту можно выделить из жидкостей организма человека, например мочи, или ее можно синтезировать способами,известными в этой области, такими как кипяче 004179 12 ние с обратным холодильником бензилцианида с разбавленной серной или соляной кислотой. Другие соединения формул I, III и IV можно синтезировать способами, известными в этой области. Например, соли добавления кислоты можно получить из соединений в форме свободных оснований при взаимодействии последних с одним эквивалентом пригодной, нетоксичной, фармацевтически приемлемой кислоты с последующей отгонкой растворителя, используемого для реакции, и, если требуется, перекристаллизации соли. Свободное основание можно получить из соли добавления кислоты в реакции соли с водным раствором соли с пригодным основанием, таким как карбонат натрия,гидроокись натрия и тому подобное. Фармацевтически приемлемые соли означают соли, имеющие биологическую активность исходного соединения и теряющие токсическую активность при выбранном уровне введения. Кроме того, установить то, является ли соль фармацевтически приемлемой, можно способами, известными специалистам в этой области. Фармацевтически приемлемые соли фенилацетилглутамина, фенилацетилизоглутамина и фенилуксусной кислоты включают, но не ограничиваются, неорганические соли натрия, калия и аммония, и органические соли диэтаноламина,циклогексиламина и аминокислот. Предпочтительно соль является солью натрия. Пригодные кислоты для получения солей добавления кислоты для соединений по настоящему изобретению включают, но не ограничиваются, уксусную, бензойную, бензолсульфоновую, винную, бромистоводородную, соляную,лимонную, фумаровую, глюконовую, глюкуроновую, глутаминовую, молочную, яблочную,малеиновую, метансульфоновую, памовую, салициловую, стеариновую, янтарную, серную и винную кислоты. Группа кислот, пригодных для образования нетоксичных, фармацевтически приемлемых солей хорошо известна практикам в области фармацевтических композиций (смотри, например, Stephen N. Berge, et al.,J.Pharm.Sciences, 66:1-19 (1977. Соединения по настоящему изобретению также могут существовать в различных стереоизомерных формах за счет наличия одного или более асимметричных центров в соединении. Настоящее изобретение включает все стереоизомерные формы соединений, а также их смеси, включая рацемические смеси. Если желательно, то можно получить отдельные стереоизомеры способами, известными в этой области,например разделением стереоизомеров на хиральных хроматографических колонках. Кроме того, соединения по настоящему изобретению могут существовать в несольватированных, а также сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. В основном, сольватированные формы считаются 13 равноценными с несольватированными формами для целей настоящего изобретения. В настоящих композициях можно использовать предшественники фенилацетилглутамина, фенилацетилизоглутамина и фенилуксусной кислоты. Предшественники фенилацетилглутамина, фенилацетилизоглутамина и фенилуксусной кислоты определяются как соединения, которые могут метаболизироваться с образованием фенилацетилглутамина, фенилацетилизоглутамина и фенилуксусной кислоты у людей. Фармацевтически приемлемыми предшественниками фенилацетилглутамина, фенилацетилизоглутамина и фенилуксусной кислоты являются предшественники, которые теряют токсическую активность при выбранном уровне введения либо сами по себе, либо в виде любого промежуточного продукта метаболизма между предшественником и конечным продуктом. Определить то, какие предшественники фенилацетилглутамина, фенилацетилизоглутамина и фенилуксусной кислоты являются фармацевтически приемлемыми, можно при использовании способов, известных специалистам в этой области. Предпочтительным предшественником фенилацетилглутамина и фенилацетилизоглутамина является 3-фенилацетиламино-2,6 пиперидиндион. Предпочтительным предшественником фенилуксусной кислоты для применения по настоящему изобретению является фенилбутират, структура которого является следующей: фенилбутират Для соединений формул I, III и IV после синтеза может потребоваться очистка. Для отделения желаемого соединения от других соединений или примесей можно использовать любые известные способы, например, среди прочих, ВЭЖХ и кристаллизацию из воды. Соединения можно определять количественно любым известным способом. Для приготовления фармацевтической композиции антинеопластона А 10 готовят водный раствор натриевой соли фенилацетилглутамина и натриевой соли фенилацетилизоглутамина в соотношении 4:1 так, что концентрация фенилацетилглутамина в растворе находится в пределах между 160 и 280 мг/мл и предпочтительно между 230 и 250 мг/мл, и концентрация фенилацетилизоглутамина в растворе находится в пределах между 40 и 70 мг/мл, и предпочтительно между 55 и 65 мг/мл. Приготовление раствора можно проводить, используя любой способ, известный специалистам в этой области. Следует отметить, что раствор должен готовиться стерильным, и рН подводится до значения, равного или близкого к рН плазмы крови 7,4, например, рН 7,0. Активные ингредиенты, 004179 14 если желательно, можно получить, как любые соединения формул I и III, перед приготовлением раствора. Для приготовления фармацевтической композиции антинеопластона AS2-1 по настоящему изобретению готовят водный раствор фенилацетата натрия и натриевой соли фенилацетилглутамина в соотношении 4:1 по массе так,что концентрация фенилацетата находится в пределах между 56 и 120 мг/мл и предпочтительно между 62 и 66 мг/мл; и концентрация фенилацетилглутамина равняется между 14 и 30 мг/мл, и предпочтительно между 15 и 17 мг/мл. Приготовление раствора можно проводить, используя любой способ, известный специалистам в этой области. Следует отметить, что раствор должен готовиться стерильным, и рН подводится до значения равного или близкого к физиологическому рН 7,4, например рН 7,0. Активные ингредиенты можно получить, как любые соединения формул IV и I, перед приготовлением раствора, если желательно такое использование. Как для антинеопластона А 10, так и антинеопластона AS2-1 концентрация используемых активных ингредиентов значительно выше, чем таковые, использованные для любых известных,о которых сообщалось ранее, водных растворов композиций противоопухолевых препаратов. Необязательно все композиции по настоящему изобретению могут включать другие агенты, такие как буферный агент, глюкоза, другие сахара, консерванты и т.д., пригодные для использования в фармацевтических композициях для внутривенного введения, какие известны в этой области. В. Введение фармацевтических композиций. Фармацевтические композиции по настоящему изобретению вводят внутривенно. Способы внутривенного введения широко известны в этой области. Одно воплощение настоящего изобретения включает введение фармацевтических композиций, включающих соединения формулы I и формулы III в соотношении 4:1 со скоростью инфузии от 100 до 400 мл/ч. В этом воплощении изобретения объединенная концентрация соединения формулы I и соединения формулы III равняется от 200 до 350 мг/мл. В настоящем изобретении скорость потока при внутривенной инфузии антинеопластона А 10 может находиться в пределах между 2,5 и 400 мл/ч для введения взрослым и маленьким детям. Предпочтительно, чтобы скорость внутривенного потока равнялась от 100 до 400 мл/ч. Типичные скорости потока равняются 250 мл/ч для взрослых и 100-250 мл/ч для маленьких детей, скорости потока обычно выше для более старших детей. Эти скорости потока значительно выше,чем любые известные, о которых сообщалось ранее для противоопухолевых препаратов. Вы 15 сокие скорости потока полезны при лечении рака, поскольку они позволяют достичь в крови концентраций активных агентов антинеопластона А 10 грубо в два раза выше, чем с обычными более низкими скоростями потока. Высокие скорости потока позволяют достичь в крови концентраций, которые сравнимы с таковыми,которые, как было показано, обладают противоопухолевой активностью в тканевой культуре и также позволяют достичьболее высокого проникновения в опухолевую ткань. Следовательно, при лечении рака высокие скорости потока более эффективны, чем более низкие скорости инфузии. Высокая скорость потока при инфузии антинеопластона А 10 и высокая концентрация антинеопластона А 10 вызывают диуретический эффект. Диуретический эффект полезен для пациента в целях предупреждения перегрузки жидкостью в результате больших объемов для инфузии. Диуретический эффект также полезен для пациента в обеспечении механизма удаления продуктов выделения, которые в противном случае могут накапливаться в организме. Композицию антинеопластона А 10 по настоящему изобретению можно вводить с высокой скоростью потока по настоящему изобретению один или более, чем один раз в день, например от 4 до 12 раз в день в течение периода времени между 15 мин и 24 ч. Обычная схема введения составляет 6-8 инфузий/день, каждая инфузия продолжительностью примерно от 90 мин до 120 мин. В случае реакции гиперчувствительности(обычно выражается в виде высыпаний на коже) у пациентов к антинеопластону А 10, можно следовать протоколу десенсибилизации. Общую суточную дозу вводят в 96 инъекциях (т.е. каждые 15 мин) со скоростью потока 1 мл/мин - 4 мл/мин (240 мл/ч). Суточная доза антинеопластона А 10 может находиться между 0,6 и 25 г/кг/день. Предпочтительно суточная доза антинеопластона А 10 находится в пределах между 5,0 и 12,0 г/кг/день. Обычно суточная доза антинеопластона А 10 равняется примерно 8,0 г/кг/день. Одно воплощение настоящего изобретения включает введение фармацевтических композиций, включающих соединения формулы IV и формулы III в соотношении 4:1 со скоростью инфузии от 100 до 400 мл/ч. В этом воплощении изобретения объединенная концентрация соединения формулы IV и соединения формулыIII равняется от 70 до 150 мг/мл. В предпочтительном аспекте этого воплощения изобретения фармацевтические композиции вводят со скоростью инфузии от 250 до 300 мл/ч, большей частью достаточной для достижения дозы 0,1 - 2,6 г/кг/день. В еще более предпочтительном воплощении фармацевтическую композицию вводят со скоростью от 250 до 300 мл/ч, в боль 004179 16 шинстве случаев достаточной для достижения дозы 0,2 - 0,9 г/кг/день. Настоящее изобретение также направлено на внутривенную инфузию антинеопластонаAS2-1. Скорость потока при внутривенной инфузии антинеопластона AS2-1 может находиться в пределах между 2,5 и 400 мл/ч при введении взрослым и может варьировать между 25 и 400 мл/ч при введении маленьким детям. Предпочтительно, чтобы скорость внутривенного потока равнялась от 100 до 400 мл/ч для взрослых и маленьких детей. Типичные скорости потока составляют 250 мл/ч для взрослых и 100250 мл/ч для маленьких детей, скорости потока обычно выше для более старших детей. Эти скорости потока значительно выше,чем любые известные, о которых сообщалось ранее для противоопухолевых препаратов. Высокие скорости потока полезны при лечении рака, поскольку они позволяют достичь в крови концентрации активных агентов антинеопластона AS2-1 грубо в два раза выше, чем с обычными, более низкими скоростями инфузии. Как описано выше, высокие скорости потока позволяют достичь в крови концентраций, которые сравнимы с таковыми, которые, как было показано, обладают противоопухолевой активностью в тканевой культуре и также позволяют достичь более высокого проникновения в опухолевую ткань. Высокая скорость потока при инфузии антинеопластона AS2-1 и высокая концентрация антинеопластона AS2-1 вызывает диуретический эффект. Диуретический эффект полезен для пациента в целях предупреждения перегрузки жидкостью в результате больших объемов для инфузии и в обеспечении механизма удаления продуктов выделения, которые в противном случае могут накапливаться в организме, как описано выше. Композицию антинеопластона AS2-1 по настоящему изобретению можно вводить с высокой скоростью по настоящему изобретению один или более чем один раз в день, например от 4 до 12 раз в день в течение периода времени между 5 мин и 24 ч. Обычная схема введения составляет 6-8 инфузий/день, каждая инфузия продолжительностью примерно от 10 до 120 мин. В случае реакции гиперчувствительности(обычно выражается в виде высыпаний на коже) у пациентов к AS2-1 можно следовать протоколу десенсибилизации. Общую суточную дозу вводят в 96 инъекциях (т.е. каждые 15 мин) со скоростью потока 1 мл/мин - 4 мл/мин (240 мл/ч). Суточная доза антинеопластона AS2-1 может находиться между 0,1 и 2,6 г/кг/день. Предпочтительно, суточная доза антинеопластонаAS2-1 находится в пределах между 0,2 и 0,9 г/кг/день. Обычно суточная доза антинеопластона AS2-1 равняется примерно 0,4 г/кг/день. 17 Другое воплощение изобретения включает лечение неопластического заболевания при введении двух фармацевтических композиций. Согласно этому воплощению первая фармацевтическая композиция включает и водный раствор соединения формулы I и соединения формулыIII, находящихся в соотношении 4:1 по массе. Объединенная концентрация соединения формулы I и соединения формулы III, находящихся в первой фармацевтической композиции, составляет от 200 до 350 мг/мл, и первую фармацевтическую композицию вводят со скоростью инфузии от 100 до 400 мл/г. Вторая фармацевтическая композиция включает и водный раствор соединения формулы IV и соединения формулы I, находящихся в соотношении 4:1 по массе. Альтернативно вторая фармацевтическая композиция включает водный раствор соединения формулы IV и соединения формулы III. Объединенная концентрация соединения формулы IV и соединения формулы I (или формулы III), находящихся во второй фармацевтической композиции, равняется от 70 до 150 мг/мл, и вторую фармацевтическую композицию вводят со скоростью инфузии от 100 до 400 мл/ч. В предпочтительном аспекте этого воплощения изобретения первая и вторая фармацевтические композиции вводят со скоростью инфузии 250 - 300 мл/ч, большей частью достаточной для достижения дозы 0,6 - 25 г/кг/день для первой фармацевтической композиции и 0,1- 2,6 г/кг/день для второй фармацевтической композиции. В другом предпочтительном аспекте этого воплощения изобретения первая и вторая фармацевтические композиции вводят со скоростью инфузии 250 - 300 мл/ч, большей частью достаточной для достижения дозы 5,0 12,0 г/кг/день для первой фармацевтической композиции и 0,2 - 0,9 г/кг/день для второй фармацевтической композиции. Другое воплощение изобретения обеспечивает способ лечения неопластического заболевания. Этот способ включает введение пациенту со скоростью инфузии от 100 до 400 мл/ч фармацевтической композиции, которая включает водный раствор соединения формулы IV,где соединение формулы IV находится в концентрации от 70 до 150 мг/мл. В одном аспекте этого воплощения изобретения фармацевтическая композиция вводится со скоростью от 250 до 300 мл/ч, большей частью достаточной для достижения дозы от 0,1 до 2,6 г/кг/день. В другом аспекте этого воплощения изобретения фармацевтическую композицию вводят со скоростью от 250 до 300 мл/ч,большей частью достаточной для достижения дозы от 0,2 до 0,9 г/кг/день. В еще одном аспекте соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями. Соединение формулы IV может быть также предшественником фенилук 004179 18 сусной кислоты, таким как фенилмасляная кислота или ее фармацевтически приемлемые соли. Схема лечения, описанная выше, пригодна для лечения пациентов, страдающих от всех видов неопластического заболевания, включая рак как твердых, так и мягких тканей, и злокачественные и доброкачественные опухоли. В частности, неопластические заболевания, которые преимущественно чувствительны к лечению при использовании раскрытой схемы лечения по этому изобретению, включают карциному надпочечника, карциному мочевого пузыря,карциному молочной железы, глиому поздних стадий, полиморфную глиобластому, астроцитому, включая анапластическую и астроцитому ранних стадий, глиому ствола мозга, примитивные нейроэктодермальные опухоли, включая медуллобластому и пинеалобластому, рабдоидную опухоль центральной нервной системы,олигодендроглиому, смешанную глиому, нейрофиброму, шванному, глиому зрительных путей, эпендимому, герминогенные опухоли, менингиому, карциному ободочной и прямой кишки, карциному пищевода, первичный и метастатический рак печени, карциному головы и шеи, аденокарциному легкого, крупноклеточную недифференцированную карциному легкого, бронхоальвеолярную карциному легкого,плоскоклеточную карциному легкого, немелкоклеточную карциному легкого, неходжкинскую лимфому, хроническую лейкемию, мезотелиому, злокачественную меланому, злокачественную фиброзную гистиоцитому, множественную миелому, нейробластому, нейроэндокринные опухоли, карциному яичника, карциному поджелудочной железы, примитивные нейроэктодермальные опухоли вне центральной нервной системы, аденокарциному простаты, карциному почки, саркому, карциному тонкого кишечника,карциному желудка, карциному матки, карциному вульвы и карциному неизвестного происхождения. Следующие примеры включены для демонстрации предпочтительных воплощений изобретения. Специалистами в этой области будет оценено, что способы, раскрытые в примерах, которые последуют, представляют способы, раскрытые изобретателем для хорошего функционирования в практике изобретения и,таким образом, их можно рассматривать в качестве предпочтительных способов для их применения на практике. Однако специалисты в этой области в свете настоящего раскрытия поймут,что можно внести много изменений в специфические воплощения, которые раскрываются, и по-прежнему получить подобный и такой же результат, не отступая от изобретения. Пример 1. Сорок три пациента с диагнозом первичных злокачественных опухолей мозга лечили при суточном внутривенном введении антинеопластона А 10 в средней дозе 7,9 19 г/кг/день и антинеопластона AS2-1 в средней дозе 0,39 г/кг/день. Из 43 пациентов оценке подвергли 36, и у 16 был достигнут полный или частичный ответ по завершении терапии без серьезных побочных эффектов. У всех сорока трех пациентов, кроме одного, диагноз первичной опухоли мозга был подтвержден гистологически. Оставшийся пациент страдал от первичной опухоли мозга в стволе мозга, откуда без адекватной безопасности невозможно было взять пробу для биопсии. У четырнадцати пациентов диагностировали полиморфную глиобластому, и шести пациентам был поставлен диагноз анапластической астроцитомы. Пациенты находились в возрасте от 2 лет до 71 года. Пациентов выбирали по значению индекса Карнофски от 40 до 100, вероятности выживания в течение двух месяцев и возраста больше 1 года. Исключили пациентов с печеночной недостаточностью, с неподдающейся адекватной регуляции гипертонией или беременных, или кормящих грудью женщин. Все пациенты ранее подверглись операции или химиотерапии и/или лучевой терапии с негативным результатом. Композицию антинеопластона А 10 приготовили, как описано выше, с 230 - 250 мг/мл фенилацетилглутамина и 55 - 65 мг/мл фенилацетилизоглутамина и при подведении рН до 7,0. Композицию антинеопластона AS2-1 приготовили, как описано выше, с 62 - 66 мг/мл фенилацетата натрия и 15 - 17 мг/мл фенилацетилглутамина и при подведении рН до 7,0. Пациенты получали внутривенные инъекции антинеопластонов с помощью однополостного подключичного катетера (Broviac, Groshong, или равноценный). Пациенты получали постепенно возрастающие дозы с помощью множественных прерывающихся инъекций, используя портативный двухканальный программируемый насос Abbott Provider 6000 шесть раз в день. Скорости инфузии для взрослых составили 250 мл/ч и для лиц моложе 18 лет скорости инфузии равнялись 50-100 мл/ч, в зависимости от переносимости. Инфузии проводили в периоды времени от 91 дня до 3509 дней при средней продолжительности лечения 661 день. Средняя доза А 10 равнялась 7,91 г/кг/день, и средняя доза AS2-1 составила 0,39 г/кг/день. Максимальная общая доза антинеопластона А 10 равнялась 551,865 кг и максимальная общая дозаAS2-1 составила 59,348 кг. Перед началом лечения подвергнутые оценке пациенты полностью восстановились после операции, если она проводилась, или прекратили химиотерапию по меньшей мере за 4 недели (6 недель, если химиотерапия состояла из нитрозомочевин) и/или прекратили лучевую терапию по меньшей мере за 6 недель. 20 Полный ответ оценивали как полное исчезновение всех сравнимых увеличивающихся опухолей в исследованиях с виазулизацией(ЯМР и т.д.) в течение четырех недель или более. Частичный ответ оценивали как более чем 50% снижение суммарного произведения наибольших перпендикулярных диаметров сравнимых увеличивающихся опухолей по меньшей мере в течение 4 недель без появления новых участков поражения. Состояние стабильного заболевания оценивали как менее чем 50% изменение (либо увеличение, либо снижение) суммарного произведения наибольших перпендикулярных диаметров сравнимых увеличивающихся опухолей минимум в течение 12 недель. Состояние прогрессирующего заболевания оценивали как более чем 50% увеличение суммарного произведения наибольших диаметров сравнимых увеличивающихся опухолей или появления новых участков поражения. Из 36 оцениваемых пациентов у 7 (19,5%) был получен полный ответ. У девяти (25%) пациентов получили частичный ответ. Стабильное заболевание наблюдали у 12 пациентов (33,3%). Прогрессирующее заболевание развилось у 8 пациентов (22,2%). Отмечали ряд случаев проявления побочных реакций на препараты во время исследования, включая гипернатриемию, гипохлоремию,гиперхлоремию, гипокалиемию, высыпания на коже, сонливость, слабость, тошноту и рвоту,головную боль, невнятную речь, спутанное сознание, галлюцинации, лихорадку и задержку жидкости. Большая часть случаев проявления побочных реакций на препараты была слабой и значительно не прерывала курса лечения. Например, имелось 23 случая гипернатриемии с показателями не выше, чем 150 мэкв/л, двенадцать случаев - не выше, чем 160 мэкв/л и два случая - не выше, чем 170 мэкв/л. Гипохлоремию установили в шести случаях и гиперхлоремию - в двух случаях. Было семь случаев гипокалиемии с показателями выше, чем 2,8 мэкв/л. Фактором, лимитирующим дозу антинеопластона А 10, оказался объем жидкости для внутривенного введения, а для AS2-1 фактором, лимитирующим дозу, была повышенная сонливость и слабость. Из 16 пациентов, классифицированных как с полным или частичным ответом, 13 остались живыми, как и восемь пациентов со стабильным заболеванием, прогрессирующим заболеванием и не подвергнутые оценке. Большая часть выживших пациентов жива и сейчас, через четыре года после постановки диагноза о патологии, и два пациента, один страдающий от олигодендроглиомы и один от астроцитомы ранней стадии, живут примерно 12 лет с момента постановки диагноза о патологии. Следовательно, лечение рака внутривенным введением высококонцентрированных вод 21 ных растворов антинеопластона А 10 и антинеопластона AS2-1 с высокими скоростями потока и высокими суточными дозами по настоящему изобретению приводит к частичному или полному ответу почти у 50% оцениваемых пациентов с минимальными побочными реакциями. Пример 2. Фазу II клинических испытаний антинеопластона А 10 и AS2-1 провели у двенадцати пациентов с глиомой в поздней стадии. У семи пациентов диагностировали полиморфную глиобластому, четырем пациентам поставили диагноз анапластической астроцитомы и одному пациенту поставили диагноз глиомы ствола мозга со множественными метастазами. Пациенты получали непрерывные инфузии антинеопластона А 10 и AS2-1 в течение от 41 дней до 713 дней. Дозы антинеопластона А 10 равнялись от 0,9 г/кг/день до 1,7 г/кг/день, и дозы AS2-1 составили от 0,2 г/кг/день до 0,8 г/кг/день. Случаи побочных реакций на препараты слабой природы и единичного проявления были отмечены у пяти пациентов в исследовании. У двух пациентов проявилось слабое, временное снижение числа лейкоцитов, и у одного пациента обнаружилось временное снижение числа эритроцитов и гемоглобина. У двух пациентов была гипокалиемия и гипоглицемия, у одного пациента имелась повышенная задержка жидкости, и у одного пациента один раз во время лечения были желудочные спазмы и тошнота. Полный ответ наблюдали у двух пациентов, и частичный ответ был отмечен у двух пациентов. У четырех пациентов была стабилизация, и у четырех пациентов имелось прогрессирующее заболевание. Пример 3. Фазу II испытаний антинеопластона А 10 и AS2-1 провели на 11 пациентах с опухолями мозга. Дозы антинеопластона А 10 равнялись от 3,9 до 12,9 г/кг/день и дозы AS2-1 составили от 0,20 до 0,40 г/кг/день. Оценивали восемь пациентов. По окончании лечения частичный ответ наблюдали у пяти пациентов. Пациенты страдали опухолями мозга. Инъекции антинеопластона А 10 и AS2-1 проводили 6 раз х сутки со скоростью 250 мл/ч, используя подключичный катетер и двухканальный инфузионный насос, как описано в примере 1. Продолжительность лечения находилась в пределах от 44 дней до 480 дней при средней продолжительности лечения 195 дней. Дозы антинеопластона А 10 равнялись от 3,9 до 12,9г/кг/день при средней дозе 7,2 г/кг/день. ДозыAS2-1 были равными от 0,20 до 0,40 г/кг/день при средней дозе 0,29 г/кг/день. Максимальная общая доза антинеопластона А 10 составила 381,738 кг и максимальная общая доза AS2-1 составила 9,702 кг. Из восьми подвергнутых оценке в исследовании пациентов частичный ответ наблюдали у пяти пациентов, стабильное заболевание на 004179 22 блюдали у двух пациентов, у одного пациента развилось прогрессирующее заболевание. Установили несколько случаев проявления возможных побочных реакций на препараты,состоящих из гипернатриемии, гипохлоремии,повышенного креатинина, аллергии, сонливости, слабости, лихорадки и артралгии. Проявление побочных реакций на препараты было слабым и не оказало существенного влияния на продолжение лечения; в частности, было два случая гипернатриемии с показателями не выше 150 мэкв/л и четыре случая не выше чем 160 мэкв/л. Установили один случай гипохлоремии с 82 мэкв/л, как и было три случая гипокалиемии с показателями не ниже чем 2,5 мэкв/л. Следовательно, лечение рака внутривенным введением высококонцентрированных водных растворов антинеопластона А 10 и антинеопластона AS2-1 с высокими скоростями потока и высокими суточными дозами по настоящему изобретению привело к частичному или полному ответу у 62,5% оцениваемых пациентов с минимальными побочными реакциями на препараты. Пример 4. Фазу II испытаний антинеопластона А 10 и AS2-1 провели у 15 пациентов с глиомой ствола мозга. Дозы антинеопластона А 10 находились в пределах от 5,27 до 16,06 г/кг/день, и дозы AS2-1 были в пределах от 0,20 до 0,57 г/кг/день. Полный ответ наблюдали у двух пациентов и двух пациентов получили частичный ответ. К исследованию допустили пятнадцать пациентов, страдающих глиомами ствола мозга, из которых 14 были оцениваемыми. Пациенты получали инъекции антинеопластона А 10 и AS2-1 6 раз х сутки, как описано в примере 1. Дозы антинеопластона А 10 находились в пределах от 5,27 до 16,06 г/кг/день при средней дозе 9,47 г/кг/день. Дозы AS2-1 колебались от 0,20 до 0,57 г/кг/день при средней дозе 0,37 г/кг/день. Максимальная общая доза антинеопластона А 10 равнялась 311,985 кг и AS2-1 - 9,912 кг. Из 14 подвергнутых оценке пациентов полный ответ наблюдался у двух пациентов и у двух пациентов получили частичный ответ согласно определениям, представленным в примере 1. Стабильное заболевание наблюдали у пяти пациентов, и у пяти пациентов развилось прогрессирующее заболевание. Установили несколько случаев проявления побочных реакций на препараты, возможно связанных с лечением антинеопластоном А 10 иAS2-1. Они состояли из гипернатриемии, гипокалиемии, аллергических высыпаний на коже,повышенной активности трансаминаз, сонливости, слабости, одышки, тошноты и рвоты, диареи, лихорадки и артралгии. Было восемь случаев гипернатриемии с показателями не выше, чем 150 мэкв/л, три случая не выше, чем 165 мэкв/л и один случай - 189 мэкв/л. В двух случаях установили гипокалиемию не ниже, чем 2,5 23 мэкв/л. Случаи проявления побочных реакций на препараты были слабыми и не оказали существенного влияния на продолжение лечения. Следовательно, лечение рака внутривенными введениями высококонцентрированных водных растворов антинеопластона А 10 и антинеопластона AS2-1 с высокими скоростями потока и высокими суточными дозами по настоящему изобретению привело к частичному или полному ответу почти у 30% оцениваемых пациентов с минимальными побочными реакциями на препараты. Пример 5. Фазу II испытаний антинеопластона А 10 и AS2-1 провели у 12 взрослых пациентов со смешанной глиомой. Оцениваемыми были девять пациентов. Дозы антинеопластона А 10 равнялись от 3,5 до 12,1 г/кг/день, и дозыAS2-1 находились в пределах от 0,24 до 0,40 г/кг/день. Из девяти оцениваемых пациентов полный ответ был установлен у трех пациентов,и у одного пациента получили частичный ответ. Пациенты получали инъекции антинеопластона А 10 и AS2-1, как описано в примере 1. Продолжительность лечения находилась в пределах от 32 дней до 615 дней при средней продолжительности лечения 191 день. Дозы антинеопластона А 10 равнялись от 3,5 до 12,1 г/кг/день при средней дозе 7,6 г/кг/день. ДозыAS2-1 составили от 0,24 до 0,40 г/кг/день при средней дозе 0,33 г/кг/день. Максимальная общая доза антинеопластона А 10 равнялась 192,907 кг, и для AS2-1 она была равной 11,189 кг. Из 12 пациентов оцениваемыми были девять пациентов. Из этих девяти полный ответ был установлен у трех пациентов, и у одного пациента получили частичный ответ согласно определениям, данным в примере 1. Стабильное заболевание наблюдали у двух пациентов, у трех пациентов развилось прогрессирующее заболевание. Столкнулись с несколькими случаями проявления побочных реакций на препараты, которые, возможно, связаны с лечением антинеопластоном А 10 и AS2-1. Они состояли из гипернатриемии, гиперхлоремии, гипокалиемии, диареи и тошноты. Имелось восемь случаев гипернатриемии с показателями не выше, чем 150 мэкв/л и два случая не выше, чем 160 мэкв/л. Наблюдали по одному случаю гиперхлоремии с 111 мэкв/л и гипокалиемии с 3,1 мэкв/л. Случаи проявления побочных реакций на препараты были слабыми и не имели существенного влияния на продолжение введения антинеопластонов. Краткое описание наблюдений по токсичности в клинических испытаниях Частоту случаев проявления побочных реакций на препараты анализировали по данным,собранным от 1003 пациентов с различными типами злокачественных заболеваний, зарегистрированных в 67 протоколах фазы II испытаний, 004179 24 одобренных FDA. Некоторые, но не все, протоколы фазы II описываются детально в примерах выше. Вследствие того, что во многих случаях пациенты, которые приняли участие в клинических исследованиях, страдали от рака в поздних стадиях с вероятностью короткой продолжительности жизни, часто было трудно установить, относятся подобные эффекты за счет поздних стадий заболеваний или курса лечения антинеопластонами. В любом случае только 1,7% пациентов испытали тяжелую токсичность(стадии 3 или 4). В фазе II клинических испытаний антинеопластона А 10 и AS2-1, и также в особых исключениях, 0,3% пациентов испытали токсичность стадии 4, в частности имелись единичные случаи гипернатриемии, тромбоцитопении и гипербилирубинемии. У 1,4% пациентов имелась токсичность стадии 3, в частности гипернатриемия, гипокальциемия, гипокалиемия, гипомагнеземия, повышение активности глутаматоксало-ацетат-трансаминазы сыворотки или повышение активности глутамат-пируват-трансаминазы сыворотки. Токсичность стадии 2 наблюдали у 18,6% пациентов, и она включала лихорадку при отсутствии инфекции (3,3%), гипокалиемию(1,9%) и нейрокортикальные симптомы, такие как спутанное сознание, сонливость (1,5%). 0,50,9% пациентов испытали аллергию, гипомагнеземию, нейрослуховые симптомы, рвоту, нейроцеребральные симптомы, такие как головокружение и невнятная речь, тошноту или гиперхлоремию. Менее чем у 0,5% пациентов имелись пониженный уровень гемоглобина, гипокальциемия, увеличение активности глутаматпируват-трансаминазы сыворотки, задержка жидкости, нейромоторная слабость или нейрозрительные симптомы; также наблюдали единичные случаи озноба, диареи, гранулоцитопении, лейкопении, лимфоцитопении, головной боли, полинефропатии и повышение активности глутамат-оксало-ацетат-трансаминазы сыворотки. Токсичность стадии I в форме лабораторных аномалий и незначительных симптомов испытало большинство пациентов, включая гипернатриемию (54,3%), гипокалиемию (18,0%),аллергию (14,2%), нейрокортикальные симптомы (9,1%), нейромоторную слабость (7,8%),рвоту (7,6%), гипохлоремию (7,1%), тошноту без рвоты (6,8%) и лихорадку при отсуствии инфекции (6,0%). Локальную токсичность наблюдали у 7,5% пациентов, наиболее часто в виде артралгии с миалгией, артрита, также наблюдали узловатую эритему. Дополнительную токсичность стадии I наблюдали у 1,0-5,0% пациентов с гиперхлоремией, головной болью, нейроцеребральными симптомами, диареей, задержкой жидкости, гипомагнеземией, нейрослуховыми симптомами, 25 гипонатриемией и одышкой. Редкие (менее чем 1,0%) случаи побочных реакций на препараты включали гипокальциемию, озноб, констипацию, нейрозрительные симптомы, повышение активности глутамат-оксало-ацетат-трансаминазы сыворотки и глутамат-пируват-трансаминазы сыворотки, гипертонию, повышенную эпидермизацию, тромбоцитопению и единичные случаи повышения активности щелочной фосфатазы, уровня билирубина, креатинина или гранулоцитопении, повышенного гемоглобина и гиперкальциемии. Почти все пациенты испытывали повышенный диурез (98,3%) и небольшую жажду,наиболее вероятно объясняемые введением больших объемов жидкостей внутривенно. Высокая частота проявления гипернатриемии наиболее вероятно объясняется приемом антинеопластонов в виде солей натрия, дегидратацией и злокачественными опухолями, особенно мозга и печени. Максимальные вводимые дозы равнялись 25 г/кг/день антинеопластона А 10 и 2,59 г/кг/день AS2-1. Все композиции и способы, раскрытые и заявленные в формуле изобретения, можно получить и выполнить без чрезмерного экспериментирования в свете настоящего раскрытия. Несмотря на то, что композиции и способы по этому изобретению были раскрыты в выражении предпочтительных воплощений, специалистам в этой области будет очевидно, что можно использовать изменения для композиций и способов и на стадиях или в последовательности стадий способа, описанного здесь, не отступая от концепции изобретения. Более конкретно будет очевидным, что некоторые препараты,близкие как в химическом, так и физиологическом отношении, могут заменить препараты,описанные здесь, в то время как будут достигнуты такие же или подобные результаты. Считается, что все подобные аналогичные заместители и модификации, очевидные для специалистов в этой области, находятся внутри характера, объема и концепции изобретения, определенных прилагаемой формулой изобретения. Литература Следующие источники литературы в той степени, в которой они обеспечивают примерные методические или другие детали, дополнительные к определенным здесь далее, включены в качестве ссылки. где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом, или (С 6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего(C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (С 6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего(C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II; в которой соединение формулы I находится в соотношении 4:1 по массе к соединению формулы III и объединенная концентрация соединения формулы I и соединения формулы III составляет от 200 до 350 мг/мл. 2. Фармацевтическая композиция по п.1, в которой в соединении формулы I М является водородом или натрием; n равно 0; R является Н или С 3 Н 7; R1 выбирают из группы, состоящей из Н, СН 3, СН 3-O-, C2H5 и С 3 Н 7; R2 выбирают из формулы II, где X является Cl, F или ОН и где в соединении формулы III M является водородом или натрием; n равно 0; R выбирают из группы,состоящей из Н и С 3 Н 7; R1 выбирают из группы,состоящей из Н, СН 3, СН 3-O-, C2H3 и С 3 Н 7; R2 выбирают из формулы II, где X является Cl, F или ОН. 3. Фармацевтическая композиция по п.1, в которой соединение формулы I является фенилацетилглутамином или его фармацевтически приемлемыми солями, и соединение формулыIII является фенилацетилизоглутамином или его фармацевтически приемлемыми солями. 4. Фармацевтическая композиция по п.2 или 3, в которой объединенная концентрация составляет 300 мг/мл. 5. Способ лечения неопластического заболевания, включающий: 27 а) введение пациенту фармацевтической композиции, включающей: где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего(C1-6)алкокси и низшего (С 1-6)алкила; R2 выбирают из формулы II где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего(C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II,где соединение формулы IV и соединение формулы I находятся в соотношении 4:1 по массе; иiii) воду, достаточную для образования водного раствора соединения формулы IV и соединения формулы I, причем объединенная концентрация соединения формулы IV и соединения формулы I составляет от 70 до 150 мг/мл,b) введение композиции со скоростью инфузии от 100 до 400 мл/ч, предпочтительно со скоростью инфузии от 250 до 300 мл/ч, причем введение композиции производят со скоростью,достаточной для достижения уровня дозирования от 0,1 до 2,6 г/кг/день, предпочтительно уровень дозирования составляет от 0,2 до 0,9 г/кг/день. 6. Способ по п.5, где в соединении формулы IV М является водородом или натрием; n равно 0; R является Н или С 3 Н 7; R1 выбирают из группы, состоящей из Н, СН 3, СН 3-O-, C2H5 и С 3 Н 7; R2 выбирают из формулы II, где X является Cl, F или ОН; и в котором в соединении формулы I M является водородом или натрием; n равно 0; R является Н и С 3 Н 7; R1 выбирают из группы, состоящей из Н, СН 3, СН 3-O-, С 2 Н 5 и С 3 Н 7; R2 выбирают из заместителей формулы II,где X является Cl, F или ОН. 7. Способ по п.5, в котором соединение формулы IV является фенилуксусной кислотой 28 или ее фармацевтически приемлемыми солями и соединение формулы I является фенилацетилглутамином или его фармацевтически приемлемыми солями. 8. Фармацевтическая композиция, включающая в водном растворе: а) соединение формулы IV где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего (C16)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (C6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего (C16)алкокси и низшего (C1-6)алкила; R2 выбирают из формулы II; и в которой соединение формулы IV и соединение формулы III находятся в соотношении 4:1 по массе и объединенная концентрация соединения формулы IV и соединения формулыIII составляет от 70 до 150 мг/мл. 9. Фармацевтическая композиция по п.8, в которой в соединении формулы IV М является водородом или натрием; n равно 0; R является Н или С 3 Н 7; R1 выбирают из группы, состоящей из Н, СН 3, СН 3-O-, С 2 Н 5 и С 3 Н 7; R2 выбирают из формулы II, где X является Cl, F или ОН; и где в соединении формулы III M является водородом или натрием; n равно 0; R является Н или С 3 Н 7;II, где X является Cl, F или ОН. 10. Фармацевтическая композиция по п.8, в которой соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями, и соединение формулыIII является фенилацетилизоглутамином или его фармацевтически приемлемыми солями. 11. Фармацевтическая композиция по любому из пп.7 или 10, в которой объединенная концентрация составляет 80 мг/мл. 12. Фармацевтическая композиция, включающая фенилацетилглутамин или фенилацетилизоглутамин и воду, достаточную для образования водного раствора с концентрацией от 200 до 350 мг/мл. 13. Способ лечения неопластического заболевания, включающий: а) введение фармацевтической композиции по любому из пп.1-4 или 12 пациенту со скоростью инфузии от 100 до 400 мл/ч, предпочтительно со скоростью инфузии от 250 до 300 мл/ч; причем композицию вводят со скоростью,достаточной для достижения уровня дозирования от 0,6 до 25 г/кг/день, предпочтительно от 5,0 до 12,0 г/кг/день. 14. Способ лечения неопластического заболевания, включающий: а) введение фармацевтической композиции по любому из пп.8-12 пациенту со скоростью инфузии от 100 до 400 мл/ч, предпочтительно со скоростью инфузии от 250 до 300 мл/ч; причем композицию вводят со скоростью, достаточной для достижения уровня дозирования от 0,1 до 2,6 г/кг/день, предпочтительно от 0,2 до 0,9 г/кг/день. 15. Фармацевтическая композиция, включающая водный раствор соединения формулы где n равно 0-5; М является водородом, образующим соль катионом, (C1-6)алкилом, циклоалкилом или (С 6-12)арилом; R и R1 независимо выбирают из группы, состоящей из Н, низшего(C1-6)алкокси и низшего (C1-6)алкила; R2 выбирают из заместителей формулы II где X является галогеном, низшим (C1-6) алкилом, низшим (C1-6)алкокси, циклоалкилом, циклоалкокси, арилом или гидрокси, и n равно 0, 1,2, 3 или 4; и в которой концентрация соединения формулы IV составляет от 70 до 150 мг/мл. 16. Композиция по п.15, где соединение формулы IV является фенилуксусной кислотой или ее фармацевтически приемлемыми солями. 17. Композиция по п.15, в которой соединение формулы IV является предшественником фенилуксусной кислоты, предпочтительно фенилмасляной кислотой или ее фармацевтически приемлемыми солями.
МПК / Метки
МПК: A61K 31/195, A61P 35/00
Метки: введении, фенилацетилизоглутамина, неопластического, заболевания, фенилацетата, фенилацетилглутамина, лечения, способ
Код ссылки
<a href="https://eas.patents.su/16-4179-sposob-lecheniya-neoplasticheskogo-zabolevaniya-pri-vvedenii-fenilacetilglutamina-fenilacetilizoglutamina-i-ili-fenilacetata.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения неопластического заболевания при введении фенилацетилглутамина, фенилацетилизоглутамина и/или фенилацетата</a>
Предыдущий патент: Лекарственное средство для лечения пациентов с опийной наркоманией и способ их лечения
Следующий патент: Гетероарильные производные аминогуанидинов и алкоксигуанидинов (варианты), способ их получения и их применение в качестве ингибиторов протеаз
Случайный патент: Способ защищенного дебетования электронного платежного средства.




















