Новые 19-норстероиды, замещенные в положении 11&beta, способ и промежуточные продукты для их получения, применение в качестве лекарственных средств и содержащие их фармацевтические композиции
Формула / Реферат
1. Соединения общей формулы (I)
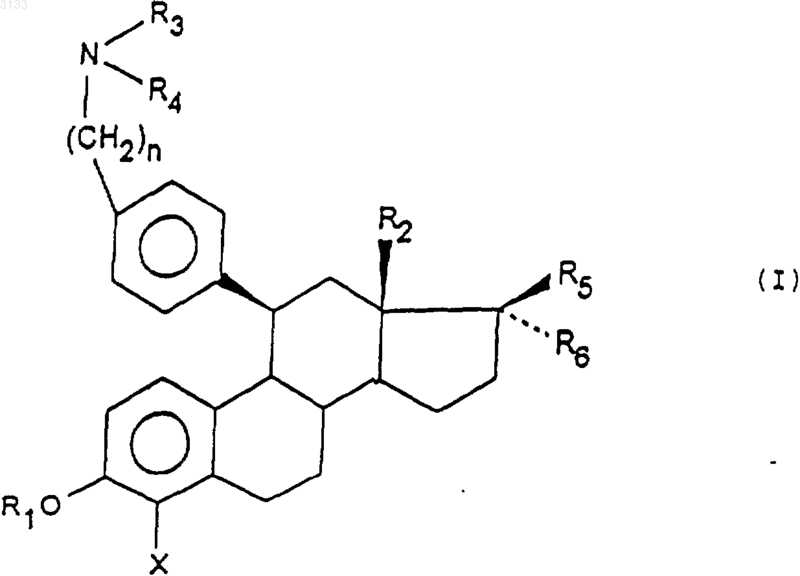
в которой
R1 обозначает атом водорода иди радикал ацил,
R2 обозначает радикал (C1-C4)алкил,
X обозначает атом галогена или атом водорода,
n равно 3, 4 или 5,
R3 и R4 обозначает (C1-C4)алкил или R3 и R4 образуют вместе с атомом азота, с которым они связаны, группу пироолидинил или пиперидинил,
R5 обозначает OH и
R6 обозначает H, (C1-C4)алкил возможно замещенный одним или тремя атомами галогена или R5 и R6 вместе с атомом углерода, с которым они связаны, образуют группу фуранил или дигидрофуранил или оба образуют оксогруппу,
а также их соли присоединения оснований и кислот.
2. Соединения по п.1 формулы (I')
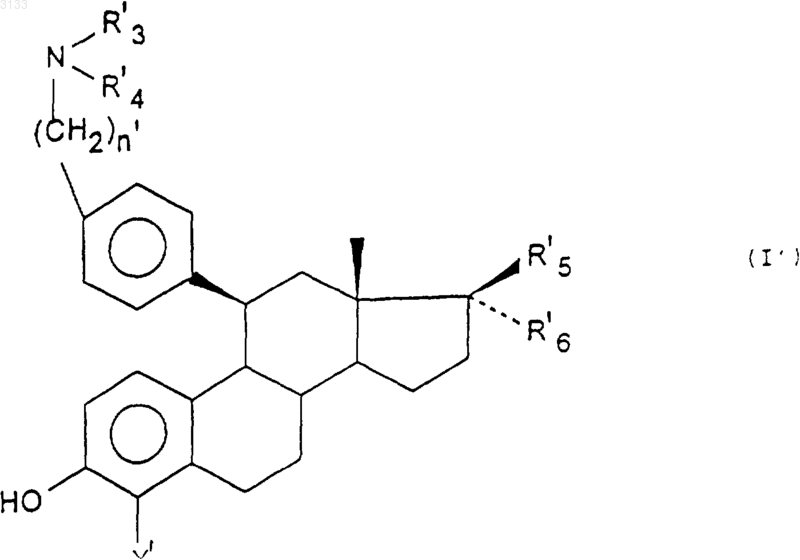
в которой
X' обозначает атом хлора, брома или водорода,
n' равно 3,
R'3, R'4, R'5, и R'6 имеют значения, указанные в п.1 для R3, R4, R5, и R6, а также их соли присоединения оснований и кислот.
3. Соединения по п.1 или 2, в которых X является атомом хлора.
4. Соединения по одному из пп.1-3, в которых X является атомом водорода.
5. Соединения формулы (I) или (I') по любому из пп.1-4, названия которых приводятся ниже:
3-гидрокси-11b -[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он;
3-гидрокси-11b -[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он;
3-гидрокси-11b -[4-[3-(диметиламино)пропил]фенил]эстра-1,3,5(10)-триен-17-он;
4-хлор-3-гидрокси-11b -[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он;
4-хлор-3-гидрокси-11b -[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он;
4-хлор-3-гидрокси-11b -[4-[3-(диэтиламино)пропил]фенил]эстра-1,3,5(10)-триен-17-он;
11b -[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17b -диол;
11b -[4-[3-(диметиламино)пропил]фенил]эстра-1,3,5(10)-триен-3,17b -диол;
11b -[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17b -диол;
4-хлор-11b -[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17b -диол;
4-хлор-11b -[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17b -диол;
11b -[4-[3-(1-пиперидинил)пропил]фенил]-17a -(трифторметил)эстра-1,3,5(10)-триен-3,17b -диол;
4-хлор-11b -[4-[3-(диэтиламино)пропил] фенил]эстра-1,3,5(10)-триен-3,17b -диол;
17a -метил-11b -[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-диол;
4-хлор-17a -метил-11b -[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17b -диол;
(17R)-11b -[4-[3-(диметиламино)пропил]фенил]спиро(эстра-1,3,5(10)-триен-17,2'(5'Н)-фуран)-3-ол;
(17R)-4',5'-дигидро-11b -[4-[3-(диметиламино)пропил]фенил]спиро(эстра-1,3,5(10)-триен-17,2'(3'Н)-фуран)-3-ол.
6. Способ получения соединений формулы (I) по п.1, согласно которому соединение формулы (II)
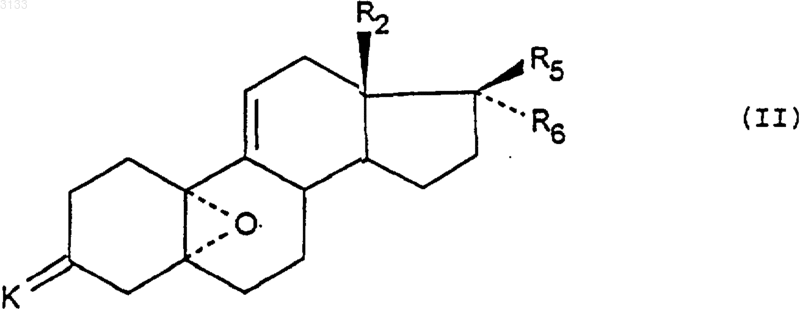
в которой R2, R5 и R6 имеют указанные в п.1 значения и K означает защитную группу для функциональной 3-кетогруппы, последовательно подвергают следующим реакциям:
а) воздействию соединения формулы (III)
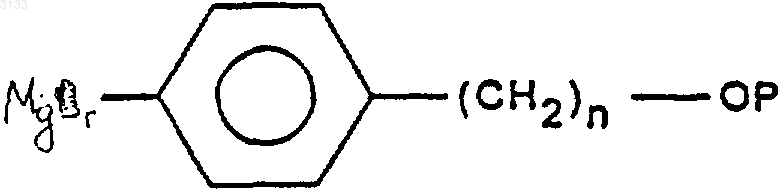
в которой P означает защитную группу для функциональной спиртовой группы и n означает целое число, равное 3, 4 или 5, затем, при желании, удалению защитных групп от одной или нескольких защищенных реакционноспособных функциональных групп, чтобы получить соединение формулы (IIIa)
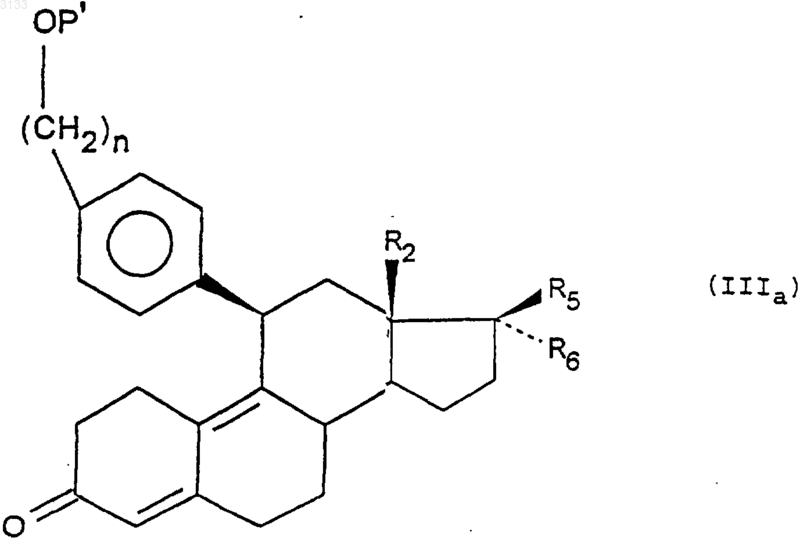
где P' имеет такие же значения, как P, а также означает водород;
б) воздействию, при желании, галогенирующего агента, чтобы получить соединение формулы (IIIb)
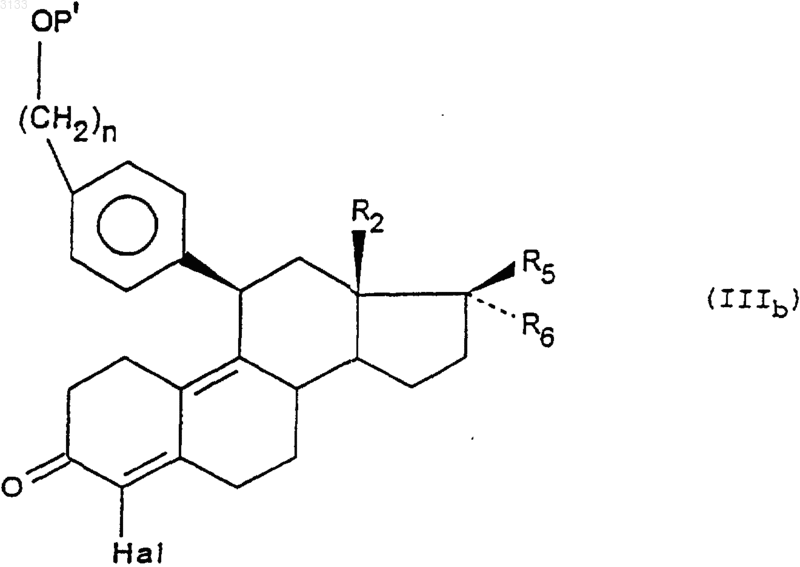
где Hal означает атом галогена;
в) воздействию агента ароматизации цикла (A) на соединения формул (IIIa) и (IIIb), при желании, после защиты и/или активации функциональной группы ОН, затем воздействию основания для получения соединения формулы (IV)
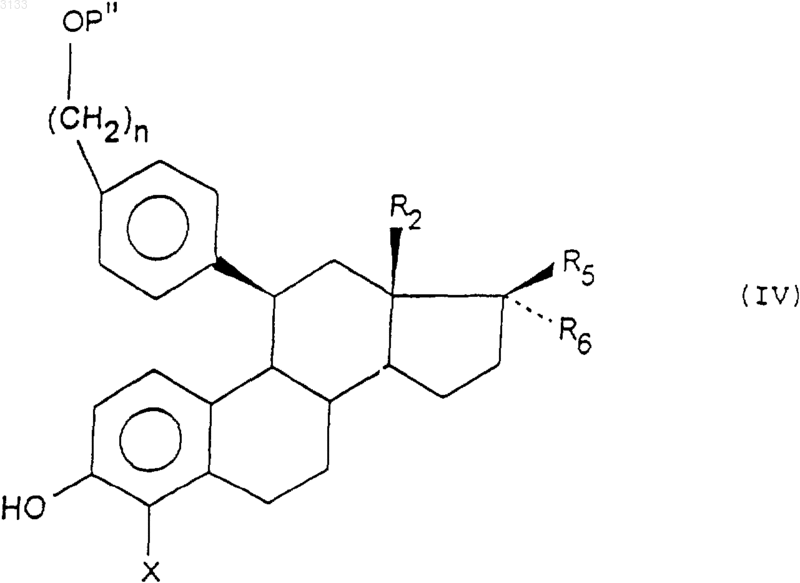
где P" имеет такие же значения, как P', и может означать, кроме того, активирующую группу;
X имеет указанное в п.1 значение;
г) воздействию амина формулы (V)

где R3 и R4 имеют указанные в п.1 значения, причем это соединение может находиться в форме соли, чтобы получить некоторые из соединений формулы (I),
причем соединения формул (IIIa), (IIIb), (IV) и (I) при необходимости в соответствующем порядке подвергают одной или нескольким следующим реакциям:
- введению/удалению защитных групп в случае группы или групп OH;
- алкилированию/ацилированию группы или групп OH;
- воздействию восстановителя, когда R5 и R6 вместе образуют оксогруппу;
- воздействию металлоорганического соединения или соединения CF3SiMe3 на соединения формулы (IV) или (I), где R5 и R6 вместе образуют оксогруппу;
- воздействию восстановителя двойной связи, когда R5 и R6 образуют группу фуранил, вместе с атомом углерода, с которым они связаны;
- воздействию агента лактонизации на соединения формулы (IV) или (I), где R5 и R6 вместе образуют оксогруппу;
- солеобразованию.
7. Применение соединения формулы (I) по п.1, а также их солей присоединения фармацевтически приемлемых кислот или оснований, в качестве лекарственных средств.
8. Применение соединения формулы (I) или (I') по любому из пп.2-5, а также их солей присоединения фармацевтически приемлемых кислот или оснований в качестве лекарственных средств.
9. Применение соединения по п.5, а также их солей присоединения фармацевтически приемлемых кислот в качестве лекарственных средств.
10. Фармацевтические композиции, включающие одно или несколько соединений по любому из пп.1-5.
11. Соединения общих формул (IIIa), (IIIb), (IV) по п.6 в качестве промежуточных продуктов.
Текст
1 Настоящее изобретение относится к 19 норстероидам, замещенным в положении 11,способу и промежуточным продуктам для их получения, их применению в качестве лекарственного средства и содержащим их фармацевтическим композициям. Остеопороз является патологией, которая характеризуется количественным и качественным ослаблением костной ткани в степени, которая приводит к вертебральным или периферическим переломам, самопроизвольным или в случае минимального травматизма. Хотя это заболевание имеет много факторов своего происхождения, такой фактор как менопауза у женщины является основным фактором потери костной ткани или остеопении. Эта остеопения проявляется в разрежении и изменении губкообразной структуры кости,что имеет следствием усиление скелетной хрупкости и опасность переломов. Потеря костной ткани очень усиливается после менопаузы в соответствии с угнетением овариальной функции и достигает 3-5%, замедляясь после 65 лет. В терапевтических целях гормональная постменопаузальная недостаточность может быть компенсирована заместительной гормонотерапией, где эстроген играет главную роль в сохранении костного капитала. Однако эстрогенотерапия в процессе осуществления иногда сопровождается нежелательным эффектом в отношении генитальной системы (эндометриальная гиперплазия, опухоль груди ), который представляет собой основной недостаток и ограничивает ее применение. Следовательно, нужно найти другие соединения, чем эстрадиол, которые обладали бы разъединенной эстрогенной активностью, а именно эстрогенной активностью в отношении костей, но которые совершенно не обладали бы или обладали бы в незначительной степени активностью в отношении эндометриальной гиперплазии, а также не обладали бы активностью в отношении пролиферации опухоли груди. Таким образом, объектом изобретения являются соединения общей формулы (I)R2 означает углеводородный радикал, линейный или разветвленный, насыщенный или ненасыщенный с 1-6 атомами углерода;D означает остаток незамещенного или замещенного, насыщенного или ненасыщенного пяти- или шестичленного цикла; Х означает атом галогена или атом водорода;n равно 3, 4 или 5; либо R3 и R4, одинаковые или разные, означают атом водорода, группу (СН 2)m-Аr,(CH2)m-Het или (CH2)m-Alk; либо R3 и R4 вместе с атомом азота, с которым они связаны, образуют моно- или полициклический, незамещенный или замещенный, насыщенный или ненасыщенный, ароматический или неароматический 3-15-членный гетероцикл,возможно включающий 1-3 дополнительных гетероатома, выбираемых среди кислорода, серы и азота; Аr означает арильную карбоциклическую группу с 6-18 атомами углерода;Het означает ароматический или неароматический, насыщенный или ненасыщенный гетероцикл с 1-9 атомами углерода и 1-5 гетероатомами, выбираемыми среди атомов кислорода, азота или серы;Alk означает неароматический, линейный,разветвленный или циклический, насыщенный или ненасыщенный углеводородный радикал с 1-12 атомами углерода; причем радикалы Аr, Het и Alk могут быть замещены или незамещены;m означает 0, 1, 2 или 3; а также их соли присоединения оснований или кислот. Под галогеном понимают иод, бром, хлор или фтор. Под группой (СН 2)m понимают простую связь в случае, где m равно нулю; СН 2, (СН 2)2 и(СН 2)3. Под термином Аr, означающим арильную карбоциклическую группу с 6-18 атомами углерода, понимают производное циклического ароматического углеводорода, такое, как фенил,нафтил, фенантренил, или же производное бициклического или трициклического конденсированного углеводорода, включающего бензольный цикл, такое как инданил, инденил, дигидронафтил, тетрагидронафтил или флуоренил. Соединение осуществляется на уровне бензольного цикла. Предпочтительно речь идет о фениле. Под термином Het, представляющим собой ароматический или неароматический, насыщенный или ненасыщенный гетероцикл с 1-9 атомами углерода и 1-5 гетероатомами, выбираемыми среди атомов кислорода, азота и серы,понимают в частности:- конденсированные гетероциклы, как, например, бензофуранил, бензотиенил, бензимидазолил, бензотиазолил, нафто[2,3-b]тиенил,тиантренил, изобензофуранил, хроменил, ксантенил, феноксатиинил, индолизинил, изоиндолил, 3 Н-индолил, индолил, индазолил, пуринил,хинолизинил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, карбазолил, карболинил, акридинил, феназинил, фенотиазинил, феноксазинил, индолинил, изоиндолинил,имидазопиридил, имидазопиримидинил, или конденсированные полициклические системы,образованные моноциклическими гетероциклами, такими, как указанные выше, как, например,фуро[2,3-b]пиррол или тиено[2,3-b]фуран;- или насыщенные гетероциклы, такие как пирролидин, пиперидин и морфолин. Термином Alk, представляющим собой производное неароматического, линейного, разветвленного или циклического, насыщенного или ненасыщенного углеводорода, обозначают,в случае ациклических углеводородов, алкильные радикалы, такие как метил, этил, пропил,изопропил, бутил, изобутил, трет-бутил, нпентил, н-гексил, 2-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 2,2-диметилпентил, 3,3-диметилпентил, 3-этилпентил, ноктил, 2,2-диметилгексил, 3,3-диметилгексил, 3 метил-3-этилпентил, нонил, 2,4-диметилгептил или н-децил; алкенильные радикалы, такие как винил, пропенил, изопропенил, аллил, 2 метилаллил, бутенил или изобутенил; или алкинильные радикалы, такие как этинил, пропинил,пропаргил, бутинил или изобутинил; и, в случае циклических радикалов, циклоалкильные радикалы, такие как циклопропил, циклобутил, циклопентил или циклогексил. Предпочтительно речь идет о метиле и этиле. Под CO-Alk радикалом предпочтительно понимают СОСН 3 и СОС 2 Н 5; под СО-Аr предпочтительно понимают бензоил, когда m отличается от нуля; (СН 2)m-Аr предпочтительно означает бензил. Когда R3 и R4 вместе с атомом азота, с которым они связаны, образуют гетероцикл, то речь идет особенно о моно- или бициклических гетероциклах, возможно включающих другой гетероатом, выбираемый среди атомов кислорода и азота, таких как следующие насыщенные гетероциклы: пирролил, имидазолил, индолил,пиридил, пиразинил, пиримидинил, пиридазинил, тиазолил, оксазолил, фуразолинил, пиразолинил, тиазолинил; или, более предпочтительно,насыщенные гетероциклы: Когда различные группы Alk, Ar, Het, а также остаток пяти- или шестичленного цикла,указанного выше, замещены, то они могут пред 003133 4 ставлять собой особенно следующие радикалы: галоген, а именно фтор, хлор, бром или иод; алкоксил, такой как метокси, этокси, пропилокси, изопропилокси, бутилокси; алкилтиорадикал, такой как метилтио, этилтио, пропилтио, изопропилтио, бутилтио; амино; алкиламино, такой как метиламино или этиламино; диалкиламино, такой как диметиламино,диэтиламино, метилэтиламино, причем каждый из этих диалкиламино-радикалов может находиться в окисленной форме; аминоалкил, такой как аминометил или аминоэтил; диалкиламиноалкил, такой как диметиламинометил или -этил; диалкиламиноалкилокси, такой как диметиламиноэтилокси; гидроксил, который может быть ацилирован; ацил, такой как ацетил, пропионил,бутирил, бензоил; свободный карбоксил; этерифицированный до сложноэфирной группы карбоксил, такой как алкоксикарбонил,например, метоксикарбонил или этоксикарбонил; циано; трифторметил; арил, такой как фенил; аралкил, такой как бензил; алкил, алкенил или алкинил, причем эти радикалы сами могут быть замещены галогеном, алкилом, алкоксилом, алкилтио, амино, алкиламино или диалкиламино, указанными выше. Выражение замещенный указывает на то, что могут присутствовать один или несколько одинаковых или разных заместителей. В качестве примера, когда алкильная группа представляет собой метил, замещенный одним или несколькими атомами галогена, речь может идти в частности, СН 2 Сl, CH2F, CHF2 и СF3. В случае остатка Het, заместители могут быть у NH или атома углерода. Значения R1, R2, R3 и R4 являются независимыми друг от друга. Изобретение относится также к солям соединений формулы (I), таким как, например,соли, образованные с неорганическими или органическими кислотами по аминогруппе. Тогда речь может идти о соляной, бромоводородной,азотной, серной, фосфорной, уксусной, муравьиной, пропионовой, бензойной, малеиновой,фумаровой, янтарной, винной, лимонной, щавелевой, глиоксиловой, аспарагиновой кислотах; алкансульфокислотах, таких, как метан -или этансульфокислоты; арилсульфокислотах, таких, как бензол- или п-толуолсульфокислоты; и аралкарбоновых кислотах. Когда соединения формулы (I) содержат карбоксильную группу,изобретение относится к солям щелочных, щелочно-земельных металлов или аммония, которые могут быть замещены. Более конкретно, объектом изобретения являются соединения общей формулы (I), описанной выше, в которой D означает остаток пятичленного цикла формулыR2 имеет вышеуказанное значение; либо R5 означает радикал ОН, O-(CH2)mAlk, O-(CO)-Alk, O-(СН 2)m-Аr, O-(СО)-Аr, О(CH2)m-Het, O-(СО)-Het и R6 означает атом водорода; замещенный или незамещенный алкильный, алкенильный или алкинильный радикал с 1-6 атомами углерода, причем m, Alk, Аr иHet имеют вышеуказанные значения; либо R5 и R6 вместе с несущими их атомом углерода образуют один из следующих циклов: где Z представляет собой группу -(CH2)l или-СН=СН-(СН 2)l, причем l означает целое число от 1 до 4 и l означает целое число, равное 1 или 2; либо R5 и R6 вместе образуют оксогруппу; также как их соли присоединения кислот или оснований. Более конкретно, объектом изобретения являются соединения формулы (I), описанной выше, отвечающие общей формуле (I')n' равно 3; либо R'3 или R'4, одинаковые или разные,означают алкил с 1-6 атомами углерода; либо R'3 и R'4, вместе с атомом азота, с которым они связаны, образуют насыщенный моно- или полициклический 3-15-членный остаток, возможно включающий дополнительный гетероатом, выбираемый среди атомов кислорода, серы и азота;R'5 и R'6 имеют такое же значение, как указанное для R5 и R6; также как их соли присоединения кислот и оснований. Более конкретно, объектом изобретения являются соединения формулы (I), описанной выше, отвечающие общей формуле (I'), в которой: либо R'5 означает группу ОН и R'6 означает атом водорода; 6 замещенный или незамещенный алкильный, алкенильный или алкинильный радикал с 1-6 атомами углерода; либо R'5 и R'6 вместе с несущим их атомом углерода образуют один из следующих циклов; либо R'5 и R'6 вместе образуют оксогруппу; также как их соли присоединения кислот или оснований. Более конкретно, объектом изобретения являются соединения формулы (I), отвечающие общей формуле (I'), описанной выше, в которойX' означает атом хлора или атом водорода;n' равно 3; либо R'3 и R'4, одинаковые или разные, означают алкильный радикал с 1-6 атомами углерода; либо R'3 и R'4, вместе с атомом азота образуют следующие насыщенные гетероциклы и либо R'5 означает группу ОН и R'6 означает атом водорода; замещенный или незамещенный алкильный, алкенильный или алкинильный радикал с 1-6 атомами углерода; либо R'5 и R'6, вместе с несущим их атомом углерода образуют один из следующих циклов; либо R'5 и R'6 вместе образуют оксогруппу; также как их соли присоединения кислот или оснований. В особенности предметом изобретения являются соединения общей формулы (I), в которой Х=Н, либо соединения общей формулы (I),в которой Х=Сl или Вr, и преимущественно Сl. Особенно предметом изобретения являются соединения формулы (I), а также их соли присоединения кислот, названия которых приведены ниже 3-гидрокси-11-[4-[3-(1-пиперидинил) пропил]фенил]эстра-1,3,5(10)-триен-17-он; 3-гидрокси-11-[4-[3-(1-пирролидинил) пропил]фенил]эстра-1,3,5(10)-триен-17-он; 3-гидрокси-11-[4-[3-(диметиламино) пропил]фенил]эстра-1,3,5(10)-триен-17-он; 4-хлор-3-гидрокси-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 4-хлор-3-гидрокси-11-[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен-17 он; 4-хлор-3-гидрокси-11-[4-[3-(диэтиламино)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 11-[4-[3-(1-пирролидинил)пропил]фенил] эстра-1,3,5(10)-триен-3,17-диол; 11-[4-[3-(диметиламино)пропил]фенил] эстра-1,3,5(10)-триен-3,17-диол;(17R)-4',5'-дигидро-11-[4-[3-(диметиламино)пропил]фенил]спиро (эстра-1,3,5(10)-триен 17,2'(3'Н)фуран)-3-ол. Объектом изобретения является способ получения соединений формулы (I), описанной выше, согласно которому соединение формулы в которой D и R2 имеют вышеуказанные значения и К означает защитную группу для функциональной 3-кетогруппы, последовательно подвергают следующим реакциям: а) воздействию соединения формулы (III) в которой М означает производное металла, Р означает группу, защитную для функциональной спиртовой группы, и n означает целое число, равное 3, 4 или 5, затем, в желательном случае, удалению защитных групп от одной или нескольких защищенных реакционноспособных функциональных групп, чтобы получить соединение формулы (IIIa) где Р' имеет такие же значения, как Р, а также означает водород; б) воздействию, при желании, галогенирующего агента, чтобы получить соединение формулы (IIIb) где Hal означает атом галогена; в) при желании, после защиты и/или активации функциональной группы ОН, воздействию агента ароматизации цикла (А) на соединения формул (IIIa) и (IIIb), затем воздействию основания, для получения соединения формулы где Р" имеет такие же значения, как Р', и может означать, кроме того, активирующую группу; Х имеет вышеуказанное значение; г) воздействию амина формулы (V) где R3 и R4 имеют вышеуказанные значения,причем это соединение может находиться в форме соли, чтобы получить некоторые из соединений формулы (I),причем соединения формул (IIIa), (IIIb),(IV) и (I), при необходимости подвергают в соответствующем порядке одной или нескольким следующим реакциям:- введение/удаление защитных групп в случае группы или групп ОН;- алкилирование/ацилирование группы или групп ОН;- воздействие восстановителя, когда D означает остаток пятичленного цикла, такой, как указан выше, и R5 и R6 вместе образуют оксогруппу;- воздействие металлоорганического соединения или соединения CF3SiMe3 на соединения формулы (IV) или (I), где D означает остаток пятичленного цикла, указанный выше, и R5 и R6 вместе образуют оксогруппу;- воздействие агента лактонизации на соединения формулы (IV) или (I), где D означает остаток пятичленного цикла, указанные выше, и- воздействие восстановителя двойной связи, когда D означает остаток пятичленного цикла, указанный выше, и R5 и R6 вместе с несущим атомом углерода образуют группу O-(СН 2)l, СН=СН-;- воздействие восстановителя, когда D означает остаток пятичленного цикла, указанный выше и, R6 означает алкенил или алкинил c 2-6 атомами углерода;- солеобразование. Воздействие соединения формулы (III) на соединение формулы (II) предпочтительно осуществляют в присутствии соли меди, такой как хлорид меди-(1). Воздействие галогенизирующего агента,такого, как N-бромсукцинимид или N-хлорсукцинимид, на соединения формулы(IIIa) осуществляют, в частности, в присутствии диполярного апротонного растворителя,такого как диметилформамид. Реакцию ароматизации с последующей реакцией омыления (воздействием основания) осуществляют обычными способами, такими,как описанные в европейском патенте 0097572. Предпочтительно используют смесь уксусного ангидрида с ацетилбромидом в качестве агента ароматизации, затем основание, такое как гидроксид натрия в метаноле в качестве агента омыления. Под активацией спирта понимают введение, в частности, мезилата, тозилата или трифторметансульфоната, которое благоприятствует нуклеофильному замещению амина формулы(V), в соединения формулы (IV). Мезилат, тозилат или трифторметансульфонат соединений формулы (IIIa) или (IIIb), где Р' означает атом водорода, получают в присутствии основания,такого, как триэтиламин. Можно также предусматривать замещение спирта атомом галогена. Реакции введения и удаления защитных групп представляют собой обычные способы,известные специалисту. Довольно полный обзор приводится в следующей работе: Защитные группы в органическом синтезе T.W. Greene,John Wiley and Sons, 1981 г. Защитная группа Р может представлять собой алкил с 1-4 атомами углерода, бензил,тетрагидропиранил, группу RCRDRESi, в которойRC, RD и RE, одинаковые или разные, независимо друг от друга, означают каждый алкил с 1-4 атомами углерода или фенил. Особенно речь идет о группах Si(СН 3)2 С(СН 3)3 или Si(C6H5)2C(CH3)3 или -Si(СН 3)3. В качестве примера, реакции удаления защитных групп из соединений формулы (IIIa) или(IIIb), когда Р' означает трет.-бутилдифенилсилил, можно осуществлять путем воздействия тетра-бутиламмонийфторида в виде раствора в тетрагидрофуране. Когда Р' означает тетрагидропиранил, эту защитную группу удаляют в присутствии водной кислоты в спирте в качестве растворителя и предпочтительно путем воздействия соляной кислоты в метаноле. Воздействие соединения формулы R3-NHR4 на соединение формулы (IV) осуществляют в 10 обычных условиях нуклеофильного замещения,например, в присутствии апротонного растворителя, такого, как тетрагидрофуран; ОР" тогда предпочтительно означает группу О-SО 2-СН 3,OSO2-С 6 Н 5-п-СН 3, ОSО 2 С(С 6 Н 5)3. ОР также может представлять собой галоген (предпочтительно бром или иод). Реакции алкилирования или ацилирования группы ОН в положении 3 или 17 осуществляют обычными способами, известными специалисту. Восстановление 17-кетогруппы до соответствующего спирта (R5 = ОН и R6 = Н) осуществляют обычными способами, особенно путем воздействия боргидрида щелочного металла,такого, как боргидрид натрия в метанол или этаноле, или путем воздействия литийалюминийгидрида. Воздействие металлорганического соединения на 17-кетогруппу позволяет получать продукты формулы (I), в которой D означает остаток пятичленного цикла, указанный выше,R5, означает гидроксил и R6 означает возможно замещенный алкильный, алкенильный, алкинильный радикал. Алкил-, алкенил- или алкинилсодержащее металлоорганическое производное выбирают среди магнийорганических соединений формулы AlkMgHal и литийорганических соединений формулы AlkLi, в которых Alk означает алкильную, алкенильную или алкинильную группу самое большее с 8 атомами углерода и Hal означает атом галогена. В предпочтительном варианте осуществления способа, Hal означает атом хлора, брома или иода, предпочтительно атом брома. Реакцию предпочтительно проводят в присутствии хлорида церия. В предпочтительном варианте осуществления способа, Hal означает атом хлора, брома или иода, предпочтительно атом брома. Для получения соединений формулы (I),где R5 означает гидроксил и R6 означает группу СF3, реакцию проводят путем воздействия СF3Si(СН 3)3 на 17-кетогруппу, после чего воздействуют реагентом для удаления защитной группы, таким, как тетрабутиламмонийфторид. Реакцию лактонизации 17-кетогруппы проводят по способу STURTZ (G. STURTZ и J.J. YAOUANC, Synthesis, 289 [1980]), особенно в присутствии аллилбисдиметиламидофосфата, в присутствии алкиллития, такого, как нбутиллитий в тетрагидрофуране. Реакцию полного или частичного восстановления, когда R6 означает алкенил или алкинил или когда R5 и R6 вместе с несущим их атомом углерода образуют группу О-(СН 2)l,СН=СН-, можно осуществлять либо полностью путем воздействия водорода в присутствии катализатора, такого, как палладий-на-угле или катализатор на основе родия, такой, как реактив Вилкинсона, либо частично (алкинил становится алкенилом) путем воздействия отравленного 11 катализатора, такого, как палладий-на-сульфате бария, отравленный пиридином или триэтиламином. Реакции этерификации и солеобразования осуществляют обычными способами, известными специалисту. Более конкретно, предметом изобретения является способ получения соединений формулы (I'), указанной выше, согласно которому соединение общей формулы (II') в которой К, R'5 и R'6 имеют вышеуказанные значения, или в которой R'5 означает группу CN и R'6 означает защищенный гидроксил, подвергают последовательно следующим реакциям: а) воздействие соединения формулы (III') в которой М и Р имеют вышеуказанные значения, затем удалению защитных групп от одной или нескольких защищенных реакционноспособных функциональных групп, чтобы получить соединение формулы (III'a) б) воздействие, в желательном случае, галогенирующего реагента, чтобы получить соединение формулы (III'b) где Наl' означает атом хлора или брома; в) активация функциональной группы ОН,затем воздействие реагента ароматизации цикла(А) на соединения формулы (III'а) или (III'b),затем воздействие основания, для получения соединения формулы (IV') где X' и Р" имеют вышеуказанное значение; г) воздействие амина формулы (V') 12 где R'3 и R'4 имеют вышеуказанные значения,чтобы получить некоторые из соединений формулы (I'),причем соединения формул (III'a), (III'b),(IV') и (I'), при необходимости, подвергают одной или нескольким следующим реакциям:- введение/удаление защитных групп в случае группы или групп ОН;- алкилирование/ацилирование группы или групп ОН;- воздействие металлоорганического соединения или СF3Si(СН 3)3 на соединения формулы (IV') или (I'),где R'5 и R'6 вместе образуют оксогруппу;- воздействие агента лактонизации на соединения формулы (IV') или (I'), где R'5 и R'6 вместе образуют оксогруппу;- воздействие восстановителя двойной связи, когда R'5 и R'6 вместе с несущим их атомом углерода образуют группу О-(СН 2)l,-СН=СН-;- воздействие восстановителя, когда R'6 означает алкенил или алкинил с 2-6 атомами углерода;- солеобразование. Соединения общей формулы (I), также как их соли присоединения фармацевтически приемлемых кислот обладают, в частности, эстрогенной, антиэстрогенной и антипролиферативной активностями. На этом основании соединения формулы(I) могут быть использованы при лечении нарушений, связанных с гипофолликулинией, как,например, аменореи, дисменореи, повторяющиеся преждевременные роды, предменструальные нарушения; при лечении некоторых эстрогенозависимых патологий, таких как аденомы или рак карциномы предстательной железы,карцинома молочной железы и ее метастазы,или при лечении доброкачественных опухолей молочной железы, в качестве антиутеротрофического средства, а также при заместительной терапии менопаузы или перименопаузы. Под симптомами и последствиями, связанными с менопаузой, более конкретно понимают приливы крови к лицу, потовыделения, атрофию и сухость влагалища, симптомы, относящиеся к моче, и в течение длительного времени уменьшение массы костной ткани и повышение опасности перелома, а также потерю сердечно-сосудистой защиты, обеспечиваемой эcтрогенами. В особенности, соединения формулы (I), а также их соли присоединения фармацевтически приемлемых кислот или оснований, могут быть использованы для профилактики или лечения остеопороза. Соединения формулы (I) и их соли присоединения фармацевтически приемлемых кислот или оснований могут быть использованы для профилактики или лечения остеопороза у человека. 13 Их также можно использовать для профилактики или лечения вторичных остеопорозов(например, кортизоновых или связанных с иммобилизацией). Соединения формулы (I) и их соли присоединения фармацевтически приемлемых кислот или оснований, обладают в частности разъединенной эстрогенной активностью. Под разъединенной эстрогенной активностью понимают эстрогенную активность полностью на уровне костей и минимальную активность на уровне матки, что, таким образом, имеет следствием отсутствие эндометриальной пролиферации (активность намного ниже таковой эстрадиола). Кроме того, соединения согласно изобретению обладают следующими преимуществами:- они обладают антиэстрогенной и/или антипролиферативной активностью на уровне молочной железы. В противоположность эстрадиолу, они не стимулируют рост человеческих опухолевых клеток молочной железы и даже могут ингибировать их рост. Соединения согласно изобретению, следовательно, особенно предпочтительны для лечения менопаузы у женщин группы риска рака молочной железы(семейные анамнезы), следовательно, их использование исключает заместительную терапию эстрадиолом. Они также могут быть использованы при лечении рака молочной железы;- они вызывают понижение содержания холестерина в сыворотке до уровня, по крайней мере, эквивалентного таковому, вызываемому эстрадиолом. Таким образом, они усиливают сердечно-сосудистую защиту;- наконец, соединения согласно изобретению не обладают никакой эстрогенной активностью на уровне матки, не вызывают необходимости их введения в сочетании с прогестомиметическим соединением. Следовательно, предметом изобретения являются соединения формулы (I) и их соли присоединения фармацевтически приемлемых кислот или оснований в качестве лекарственных средств, или активного начала для получения лекарственного средства. Более конкретно предметом изобретения являются соединения формулы (I) и их соли присоединения фармацевтически приемлемых кислот или оснований, в качестве лекарственных средств, предназначенных для профилактики или лечения остеопороза. Изобретение также относится к фармацевтическим композициям, включающим в качестве действующего начала, по крайней мере, одно из лекарственных средств, указанных выше. Соединения формулы (I) используются в пищеварительном тракте, парентерально или локально, например, путем введения через кожу. Они могут быть в форме простых или дражированных таблеток, желатиновых капсул,гранул, суппозиториев, вагинальных шариков, 003133 14 препаратов для инъекций, мазей, кремов, гелей,микросфер, имплантатов, внутривлагалищных колец, пластырей, которые получают обычными способами. Действующее начало или действующие начала могут быть туда включены с эксципиентами, обычно используемыми в этих фармацевтических композициях, такими как тальк, гуммиарабик, лактоза, крахмал, стеарат магния,масло какао, водные или неводные наполнители, жиры животного или растительного происхождения, парафиновые производные, гликоли,различные смягчающие компоненты, диспергаторы или эмульгаторы, консерванты. Пригодную дозировку изменяют в зависимости от степени поражения излечиваемого субъекта и пути введения; она может изменяться, например, от 1 до 1000 мг в день для взрослого путем введения перорально. Соединения общей формулы (II) или (II') представляют собой известные соединения,описанные в европейском патенте 0057115. Соединения формулы (III) являются известными или легко получаются специалистом из соответствующих ароматических галогенидов. Амины формулы (V) также известны или легко получаются специалистом. Предметом изобретения также являются, в качестве промежуточных продуктов, соединения формулы (IlIa), (IIIb), (III'a), (III'b), (IV) или(IV). Нижеприводимые примеры иллюстрируют изобретение, однако, не ограничивая его объема охраны. Указанными в примерах растворителями являются следующие: этилацетат (AcOEt), триэтиламин (TEA),дихлорметан (CH2Cl2), хлороформ (СНСl3), метанол (МеОН), гидроксид аммония (NH4OH),изопропанол (iPrOH). Препаративный пример 1. 11-[4-(3-Гидроксипропил)фенил]эстра-4,9-диен-3,17-дион. Стадия А. Алкилирование. 3-(4-Бромфенил)-2-пропинол. В атмосфере инертного газа, к раствору 55,2 г 97%-ного 4-бромиодбензола в 230 мл диметилформамида добавляют 56 мл триэтиламина, 12,2 мл пропаргилового спирта, 1 г иодида меди и 1,1 г PdCl2[P(С 6 Н 5)3]2, все время поддерживая температуру 47 С. После перемешивания в течение 3-х ч 15 мин при комнатной температуре, выливают в воду, экстрагируют,промывают, сушат и выпаривают при пониженном давлении, получая 48,3 г сырого продукта,который очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметана с этилацетатом в соотношении 95/5. Получают 36,37 г чистого целевого продукта. (Т.пл. = 80 С) Rf (дихлорметан/этилацетат=95/5):0,32; ИК-спектр (хлороформ), см-1: 3609 (ОН); 2240 15 Стадия Б. Восстановление. 3-(4-Бромфенил)пропанол. В атмосфере инертного газа, к раствору 36,4 г 3-(4-бромфенил)-2-пропинола (стадия А) в 200 мл этанола с 5% толуола добавляют 200 мл толуола, 7,9 г реактива Вилкинсона и вводят водород при давлении 1900 мбар в течение 5 ч. Выпаривают при пониженном давлении, получая 45,9 г сырого продукта, который очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметана с этилацетатом в соотношении 95/5. Получают 30,1 г целевого продукта. Rf (диxлopмeтaн/этилaцeтaт=95/5): 0,28; ИК-спектр(хлороформ), см-1: 3626 (ОН); 1592 и 1489 (ароматическая часть). Стадия В. Защита спиртовой группы.(1,1-Диметилэтил)диметил 3-(4-бромфенил)пропил]окси]силан. В атмосфере инертного газа, к раствору 30,1 г 3-(4-бромфенил) пропанола (стадия Б) в 300 мл дихлорметана добавляют 11,4 г имидазола и 23 г диметил-трет.-бутилсилилхлорида. После перемешивания в течение 45 мин при комнатной температуре, промывают водой, сушат и выпаривают при пониженном давлении,получая 47,46 г сырого продукта, который очищают (после добавления 1,5 г продукта идентичного опыта) путем ректификации. Получают 44,88 г чистого целевого продукта. Rf (дихлорметан/этилацетат=95/5):0,8 ИК-спектр (хлороформ), см-1:OSi: 1527 и 836 Ароматика (см-1): 1590 (f) и 1489. Стадия. Введение арильной группы в положение 11 стероида. 11-[4-(3-Гидроксипропил)фенил]эстра 4,9-диен-3,17-дион. Получение магнийорганического соединения В инертной атмосфере и при комнатной температуре, к 2,67 г магния (стружки) в 5 мл тетрагидрофурана в течение 50 мин при температуре кипения с обратным холодильником,после инициирования 1,2-дибромэтаном, добавляют раствор 32,9 г (1,1-диметилэтил)диметил 3-(4-бромфенил)пропил]окси]силана (стадия В) в 100 мл тетрагидрофурана и кипятят с обратным холодильником в течение 5 ч. (Титр,определяемый путем иодометрии: 0,86 М). Раскрытие эпоксида К смеси, состоящей из 120 мл магнийорганического соединения, полученного в предыдущей стадии, и 600 мг хлорида меди, в инертной атмосфере при температуре 0-5 С, добавляют раствор 17,18 г 5, 10-эпокси-3,3-[1,2-этандиилбис(окси)]-17-[(триметилсилил)окси]эстра 9(11)-ен-17-карбонитрила (полученного по способу, описанному J.C. Gasc и L. Nedelec, Tetrahedron, Letters, 2005 [1971]) в 100 мл тетрагидрофурана, перемешивают в течение 45 мин при 16 этой температуре, затем выливают в раствор хлорида аммония, экстрагируют, промывают и выпаривают при пониженном давлении, получая 43,5 г сырого продукта. Кислотный гидролиз К раствору 43,5 г полученного в предыдущей стадии продукта в 300 мл метанола, в инертной атмосфере и при комнатной температуре, добавляют 60 мл 6 М соляной кислоты и перемешивают в течение 1 часа при комнатной температуре. После отгонки метанола добавляют этилацетат, промывают, сушат и выпаривают при пониженном давлении, получая 30 г сырого продукта (т.пл. =254 С). Расщепление циангидрина К раствору 30 г полученного в предыдущей стадии продукта в 200 мл метанола, в инертной атмосфере и при комнатной температуре, добавляют 8 мл раствора гидроксида натрия и перемешивают в течение 1 ч 15 мин при комнатной температуре. После отгонки метанола добавляют этилацетат, промывают, сушат и выпаривают при пониженном давлении, получая 27,9 г сырого продукта, который очищают сначала путем хроматографии, элюируя смесью дихлорметана с метанолом в соотношении 95/5 и получая 13 г целевого продукта (т.пл. = 192 С;Rf (дихлорметан/метанол=95/5): 0,28); затем путем растворения в смеси из 70 мл дихлорметана и 70 мл диизопропилового эфира, которую концентрируют вплоть до кристаллизации. Получают 11,92 г чистого целевого продукта. Т.пл.=192 С. Rf (дихлорметан/этилацетат = 95/5):0,28. ЯМР (дейтерохлороформ, 300 МГц), в м.д.: 0,55 (с, СН 3 в положении 18);1,33(ОН);3,66 (м, СН 2-ОН); 4,41 (д, Н 11); 5,80 (с,Н 4). Пример 1. 3-Гидрокси-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен 17-он. Стадия А. Образование мезилата. 11-[4-[3-[(метансульфонил)окси]пропил] фенил]эстра-4,9-диен-3,17-дион. К раствору 3,41 г 11-[4-(3-гидроксипропил)фенил]эстра-4,9-диен-3,17-диона, полученного в препаративном примере 1, в 30 мл дихлорметана, в инертной атмосфере и при комнатной температуре, добавляют 1,53 мл триэтиламина и 0,72 мл метансульфонилхлорида в виде раствора в 2 мл дихлорметана, поддерживая температуру 0-5 С, и перемешивают в течение 40 мин при этой температуре. После промывки и высушивания выпаривают при пониженном давлении, получая 4,15 г сырого целевого продукта. Т.пл.=196 С; 17 Стадия Б. Ароматизация цикла А. 3-Гидрокси-11-[4-[3-[(метилсульфонил) окси]пропил]фенил] эстра-1,3,5(10)-триен-17 он. а) Ароматизация. К раствору 4,15 г диенона, полученного в предыдущей стадии, в 40 мл дихлорметана, в инертной атмосфере и при комнатной температуре, при охлаждении на бане со льдом добавляют 4 мл уксусного ангидрида и 2 мл ацетилбромида и перемешивают в течение 1 ч. б) Омыление. Выпаривают при пониженном давлении, в инертной атмосфере добавляют 20 мл тетрагидрофурана и, при охлаждении на бане со льдом,добавляют 20 мл метанола, затем 28 мл 2 н. раствора гидроксида натрия. Перемешивают в течение 40 мин, подкисляют с помощью 2 н. соляной кислоты, экстрагируют этилацетатом, промывают рассолом, затем выпаривают при пониженном давлении, получая 4,54 г сырого продукта, который очищают путем хроматографии,элюируя смесью дихлорметана с этилацетатом в соотношении 9/1. Получают 3,18 г целевого продукта и 590 мг побочного продукта (3-кето 5(10),9(11)-диен). Rf (дихлорметан/этилацетат = 9/1):0,23. ЯМР-спектр(дейтерохлороформ,300 МГц),в м.д.: 0,43 (с, СН 3 в положении 18); 2,92 (с, OSO2CH3); 4,02 (м, Н 11); 4,12 (м, CH2OSO2-); 4,61 (с, ОН в положении 3); 6,41 (дд, Н 2); 6,61 (Н 4); 6,81 (д, Н 1); 6,89 и 7,01 (Н ароматические). Стадия В. Введения амина. 3-Гидрокси-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он. К раствору 1,45 г мезилата, полученного в стадии Б, в 15 мл тетрагидрофурана, в инертной атмосфере и при комнатной температуре, добавляют 2,96 мл пиперидина, кипятят с обратным холодильником в течение 3-х ч, доводят температуру до комнатной, добавляют этилацетат, промывают раствором гидрокарбоната натрия, рассолом, затем выпаривают при пониженном давлении, получая 1,48 г сырого продукта, который очищают путем хроматографии,элюируя смесью дихлорметана с этилацетатом и гидроксидом аммония в соотношении 90/10/0,5. Получают 1,2 г целевого продукта. 18 Следуют методике примера 1, стадия В,исходя из 456 мг мезилата, полученного в стадии Б примера 1, и 0,79 мл пирролидинила. Получают 441 мг сырого продукта, который очищают путем хроматографии, элюируя смесью этилацетата с триэтиламином в соотношении 7/3, затем путем кристаллизации из диизопропилового эфира. Получают 347 мг целевого продукта. Т. пл.=180 С.(дейтерохлороформ,300 МГц),в м.д.: 0,44 (с, СН 3 в положении 18); 1,75 (N-CH2-CH2 цикла); 2,50 (N-CH2-CH2 цикла); 4,03 (уш. т, Н 11); 6,25 (дд, Н 2); 6,51 (д, Н 4); 6,75 (д, Н 1); 6,84 и 6,99 (Н ароматические). Пример 3. 3-Гидрокси-11-[4-[3-(диметиламино)пропил]фенил]эстра-1,3,5(10)-триен-17 он. Следуют методике примера 1, но используя в качестве амина диметиламин. Пример 4. 4-Хлор-3-гидрокси-11-[4-[3-(1 пиперидинил)пропил]фенил]эстра-1,3,5(10)триен-17-он. Стадия А. Хлорирование. 4-Хлор-11-[4-(3-гидроксипропил)фенил] эстра-4,9-диен-3,17-дион. К раствору 11,9 г 11-[4-(3-гидроксипропил)фенил]эстра-4,9-диен-3,17-диона, полученного в препаративном примере 1, в 100 мл диметилформамида, в инертной атмосфере и при температуре 60 С, добавляют 4,93 г Nхлорсукцинимида и перемешивают в течение 10 мин при этой температуре. Выливают в воду,экстрагируют, промывают, сушат, выпаривают при пониженном давлении, получая 16,2 г сырого целевого продукта, который очищают путем хроматографии, элюируя смесью дихлорметата с ацетоном в соотношении 85/15. Получают 9,34 г чистого целевого продукта.(дейтерохлороформ,300 МГц),в м.д.: 0,56 (с, СН 3 в положении 18); 3,24 (дт, Н экваториальный); 3,65 (т, СН 2-ОН); 4,42 (д, Н 11); 7,09 (Н ароматические). Стадия Б. Образование мезилата. 4-Хлор-11-[4-[3-[(метилсульфонил)окси] пропил]фенил]эстра-4,9-диен-3,17-дион. К раствору 9,34 г спирта, полученного в стадии А, в 90 мл дихлорметана, в инертной атмосфере и при комнатной температуре, добавляют 3,86 мл триэтиламина и 1,82 мл метансульфонилхлорида в виде раствора в 5 мл дихлорметана, поддерживая температуру 0-5 С, и перемешивают в течение 30 мин при этой температуре. После промывки и высушивания, выпаривают при пониженном давлении, получая 11 г сырого целевого продукта. Rf (дихлорметан/ацетон = 85/15):0,3.(Н ароматические). Стадия В. Ароматизация цикла А. 4-Хлор-3-Гидрокси-11-[4-[3-[(метансульфонил)окси]пропил]фенил]эстра-1,3,5(10)триен-17-он. а) Ароматизация. К раствору 10,37 г диенона, полученного в предыдущей стадии, в 100 мл дихлорметана, в инертной атмосфере и при комнатной температуре, при охлаждении на бане со льдом, добавляют 10 мл уксусного ангидрида и 2 мл ацетилбромида и перемешивают в течение 6 ч при комнатной температуре. б) Омыление. Выпаривают при пониженном давлении,добавляют 50 мл тетрагидрофурана и, при охлаждении на бане со льдом, добавляют 50 мл метанола, затем 70 мл 2 н. раствора гидроксида натрия. Перемешивают в течение 45 мин, подкисляют с помощью 70 мл 2 н. соляной кислоты,экстрагируют этилацетатом, промывают рассолом, затем выпаривают при пониженном давлении, получая 11,5 г сырого продукта, который очищают путем хроматографии, элюируя смесью циклогексана с этилацетатом в соотношении 9/1. Получают 6 г целевого продукта(Rf=0,27) и 768 мг побочного продукта (4-хлор 1,3,5(10),9(11)-тетраеноновое производное, не содержащее гидроксильной группы в положении 3; Rf=0,39). Rf (дихлорметан/этилацетат = 9/1):0,27. ЯМР-спектр(дейтерохлороформ,250 МГц),в м.д.: 0,43 (с, СН 3 в положении 18); 2,93 (с, OSO2 СН 3) 4,02 (м, Н 11); 4,14 (CH2OSO2-); 5,46 (с, ОН в положении 3); 6,64 (Н 2); 6,81 (Н 1); 6,92 (Н ароматические). Стадия Г. Введение амина. 4-Хлор-3-гидрокси-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он. К раствору 1,5 г мезилата, полученного в предыдущей стадии, в 15 мл тетрагидрофурана,в инертной атмосфере и при комнатной температуре, добавляют 2,96 мл пиперидина, кипятят с обратным холодильником в течение 3-х ч, доводят температуру до комнатной, добавляют этилацетат, промывают раствором гидрокарбоната натрия, рассолом, затем выпаривают при пониженном давлении, получая 1,66 г сырого продукта, который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/0,5. Получают 1,2 г целевого продукта. Rf 20 ла); 4,01 (уш. т, Н 11); 6,61 (д, Н 2); 6,79 (д, Н 1); 6,89 (Н ароматические). Пример 5. 4-Хлор-3-Гидрокси-11-[4-[3-(1 пирролидинил)пропил]фенил]эстра-1,3,5(10)триен-17-он. Следуют методике примера 4, стадия Г, но исходя из 517 мг мезилата (пример 4, стадия В) и 0,84 мл пирролидина. Получают 510 мг сырого продукта, который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/1. Получают 380 мг целевого продукта. Rf(дейтерохлороформ,300 МГц),в м.д.: 0,42 (с, СН 3 в положении 18); 1,75 (N-CH2-CH2 цикла); 2,46 (N-CH2-CH2 цикла); 4,02 (уш. с, Н 11); 6,56 (д, Н 2); 6,79 (д, Н 1); 6,89 (AA'BB'; Н ароматические). Пример 6. 4-Хлор-3-Гидрокси-11-[4-[3(диэтиламино)пропил]фенил]эстра-1,3,5(10)триен-17-он. Следуют методике примера 4, стадия Г, но исходя из 517 мг мезилата (пример 4, стадия В) и 1 мл диэтиламина. Получают 500 мг сырого продукта, который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/1. Получают 385 мг целевого продукта. Rf(дейтерохлороформ,300 МГц),в м.д.: 0,42 (с, СН 3 в положении 18); 0,95 (N-CH2-СН 3) ; 2,49 (N-CH2-СН 3); 4,02 (т, Н 1); 6,59 (д, Н 2); 6,80 (д, Н 1); 6,90 (AA'BB'; Н ароматические). Пример 7. 11-[4-[3-(1-Пирролидинил) пропил]фенил]эстра-1,3,5(10)-триен-3,17-диол. К раствору 310 мг продукта, полученного в примере 2, в 3 мл метанола, при температуре 05 С, добавляют 54 мг 97%-ного боргидрида натрия, перемешивают в течение 1 ч при этой температуре, добавляют рассол, экстрагируют,промывают, сушат и выпаривают при пониженном давлении, получая 320 мг сырого продукта,который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/1. Получают 217 мг чистого целевого продукта. Rf (дихлорметан/метанол/гидроксид аммония):0,23. ЯМР-спектр(дейтерохлороформ,300 МГц),в м.д.: 0,33 (с, СН 3 в положении 18); 1,76 (N-CH2-CH2 цикла); 2,52 (N-СН 2-СН 2 цикла); 3,69 (дд, Н 17); 3,96 (уш., т, Н 11); 6,27 (дд,Н 2); 6,47 (д, Н 4); 6,76 (д, Н 1); 6,83 и 6,98 (Н ароматические). Пример 8. 11-[4-[3-(Диметиламино)пропил]фенил]эстра-1,3,5(10)-триен-3,17-диол. Следуют методике примера 7 (восстановление с помощью боргидрида натрия), но исходя из продукта, полученного в примере 3.C5D5N; 300 МГц),в м.д.: 0,32 (с, СН 3 в положении 18); 2,18 (с, N-СН 3); 3,67 (Н 17); 3,95 (Н 11); 6,46 (дд, Н 2); 6,64 (д, Н 4); 6,81 (д, Н 1); 6,88 7,00 (Н ароматические). Пример 9. 11-[4-[3-(1-Пиперидинил) пропил]фенил]эстра-1,3,5(10)-триен-3,17-диол. Следуют методике примера 7 (восстановление с помощью боргидрида натрия), но исходя из продукта, полученного в примере 1.(уш. т, Н 11); 6,32 (дд, Н 2); 6,47 (д, Н 4); 6,78 (д,Н 1); 6,82 6,98 (Н ароматические). Пример 10. 4-Хлор-11-[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен 3,17-диол. Следуют методике примера 7, но исходя из 257 мг продукта, полученного в примере 5, и 42 мг 97%-ного боргидрида натрия. Получают 221 мг сырого продукта, который очищают путем кристаллизации, получая 154 мг чистого целевого продукта. Rf (дихлорметан/метанол/ гидроксид аммония = 90/10/1):0,15. ЯМР-спектр(дейтерохлороформ,300 МГц),в м.д.: 0,33 (с, СН 3 в положении 18); 1,73 (м, N-CH2-CH2 цикла); 2,37; 2,50 (N-СН 2 и С 6 Н 5-СН 2 цепи); 2,43 (м, N-CH2-CH2 цикла); 3,71 (дд, Н 17); 3,93 (уш. т, Н 11); 6,58 (д, Н 2); 6,76 (д, Н 1); 6,91 (Н ароматические). Пример 11. 4-Хлор-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17 диол. Следуют методике примера 7, но исходя из 305 мг продукта, полученного в примере 4, и 48 мг 97%-ного боргидрида натрия. Получают 275 мг сырого продукта, который очищают путем кристаллизации из ацетона, получая 170 мг чистого целевого продукта. Rf (дихлорметан/ метанол/гидроксид аммония = 90/10/1):0,25. ЯМР-спектр(дд, Н 17); 3,95 (т, Н 11); 6,58 (д, Н 2); 6,79 (д, Н 1); 6,88 (Н ароматические). Пример 12. 4-Хлор-11-[4-[3-(диэтиламино)пропил]фенил]эстра-1,3,5(10)-триен-3,17 диол. Следуют методике примера 7, но исходя из 262 мг продукта, полученного в примере 5, и 42 мг 97%-ного боргидрида натрия. Получают 231 мг сырого продукта, который очищают путем хроматографии, получая 223 мг чистого целевого продукта. Rf (дихлорметан/метанол/гидроксид аммония = 90/10/ 1):0,18.(т, Н 17); 3,95 (т, Н 11); 6,57 (д, Н 2); 6,78 (д, Н 1); 6,91 (Н ароматические). Пример 13. 17-Метил-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен 3,17-диол. В течение двух часов при пониженном давлении нагревают 1,2 г тонко измельченного гептагидрата хлорида церия (СеСl37 Н 2 О), доводят до комнатной температуры в атмосфере инертного газа, добавляют 12 мл тетрагидрофурана, перемешивают в течение двух часов при комнатной температуре, затем при температуре-68 С добавляют 1,9 мл раствора метиллития в диэтиловом эфире. После перемешивания в течение 30 минут при температуре -72 С добавляют 300 мг продукта примера 1 в виде раствора в 3 мл тетрагидрофурана, оставляют стоять для повышения температуры до комнатной, отфильтровывают, промывают, сушат и выпаривают при пониженном давлении, получая 325 мг сырого продукта, который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/0,5. Rf (дихлорметан/метанол/гидроксид аммония = 90/10/0,5):0,25. ЯМР-спектр(дейтерохлороформ,300 МГц),в м.д.: 0,45 (с, СН 3 в положении 18); 1,29 (СН 3 в положении 17); 4,00 (уш. т, Н 11); 6,35 (дд, Н 2); 6,49 (д, Н 4); 6,79 (д, Н 1); 6,81 и 6,98 (Н ароматические). Пример 14. 4-Хлор-17-метил-11-[4-[3(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)триен-3,17-диол. Следуют методике примера 13, но исходя из 300 мг продукта, полученного в примере 4, и 12 мл раствора метиллития в диэтиловом эфире. Получают 312 мг сырого продукта, который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/1 и получая 275 мг чистого целевого продукта.(10)-триен-3,17-диол. 1) Получение 17-триметилсилилокси 17-трифторметильного производного. В течение двух часов при температуре 120 С сушат 83 мг тетрагидрата тетраметиламмонийфторида, доводят до комнатной темпера 23 туры в атмосфере инертного газа и добавляют 236 мг полученного в примере 1 продукта, 3 мл тетрагидрофурана и 0,3 мл триметил(трифторметил)силана (CF3Si(СН 3)3), поддерживая температуру 0-5 С. Выдерживают для повышения температуры до 10 С и перемешивают в течение 2,5 ч при температуре 0-5 С, затем выливают в рассол, экстрагируют, промывают, сушат и выпаривают при пониженном давлении, получая 340 мг сырого продукта. 2) Удаление защитной группы спиртовой функции. К раствору 340 мг вышеполученного сырого продукта в 4 мл тетрагидрофурана, в инертной атмосфере и при комнатной температуре,добавляют 2 мл тетрабутиламмонийфторида в виде 1 М раствора в тетрагидрофуране, перемешивают в течение двух часов при комнатной температуре, выливают в воду, экстрагируют,промывают, сушат и выпаривают при пониженном давлении, получая 530 мг сырого продукта,который очищают путем хроматографии, элюируя смесью дихлорметана с метанолом и гидроксидом аммония в соотношении 90/10/1, затем смесью этилацетата с триэтиламином в соотношении 95/5. Получают 96 мг чистого целевого продукта. Rf (дихлорметан/триэтиламин = 95/5):0,25. ЯМР-спектр(дейтерохлороформ,300 МГц),в м.д.: 0,50 (с, СН 3 в положении 18); 4,03 (уш.т, Н 11); 6,36 (дд, Н 2); 6,52 (дд, Н 4); 6,78 (д, Н 1); 6,85 и 6,96 (Н ароматические). Пример 16. (17R)-11-[4-[3-(Диметиламино)пропил]фенил]спиро(эстра-1,3,5(10)-триен-17,2'(5'Н)-фуран)3-ол. Следуют методике примера 1, но исходя из диметиламина и 11-[4-(3-гидроксипропил) фенил]спиро(эстра-4,9-диен-17,2'(5'Н)фуран)-3 она. Пример 17. (17R)-4',5'-Дигидро-11-[4-[3(диметиламино)пропил]фенил]спиро(эстра-1,3,5(10)-триен-17,2'(3'Н)-фуран)3-ол. Восстановление осуществляют путем гидрирования полученного в примере 16 продукта при использовании 10%-ного палладия-на угле.(Н ароматические). Фармакологические тесты 1 - Воздействие на пролиферацию клеток молочной железы. Пролиферативную активность молекул изучали по сравнению с таковой эстрадиола на человеческих клетках молочной железы MCF-7 при культивировании. Для выявления агонистического эффекта эстрадиола и/или тестируемых молекул содержащую клетки культуральную среду (обога 003133 24 щенную факторами роста и стероидами) заменяли обедненной средой, кроме того, лишенной стероидов (модифицирования по способу Дульбекко среда Игла, дополненная 5% сыворотки без стероидов и без фенолового красного). Клетки выдерживают в этой обедненной среде в течение двух дней до начала опыта. После культивирования в течение 7 дней в присутствии изучаемых продуктов пролиферацию клеток оценивали путем определения содержания ДНК. В каждом опыте эффект эстрадиола в концентрации 10-10M (рост клеток в присутствии эстрадиола минус рост клеток в присутствии растворителя) принимают за 100% агонистической активации. Активность молекул оценивали по сравнению с этим внутренним стандартом. Молекулы, стимулирующие рост клеток, идентичный таковому, наблюдаемому при использовании одного растворителя, относили к инактивным, молекулы, стимулирующие рост клеток ниже такового, наблюдаемого при использовании только растворителя, классифицировали как ингибитор. Активность Эстрадиол Агонист Пример 12 Ингибитор Пример 7 Ингибитор Пример 9 Ингибитор Пример 13 Ингибитор Пример 11 Смешанная Смешанная активность означает - незначительная агонистическая активность при очень слабых концентрациях и ингибирующая активность при более высоких концентрациях. Заключение: тестируемые продукты не являются агонистами роста клеток MCF-7, некоторые даже являются ингибиторами роста. 2 - Сродство к человеческому рецептору эстрогена (REH). Цитозольный экстракт клеток SF9, содержащий человеческий рекомбинантный рецептор эстрогена, получали путем сверхпродуцирования в системе клеток бакуловируса насекомых по общей методике, описанной N.R. WEBB и др. (Journal of Methods in Cell and MolecularBiology, 2,4, 173-188 [1990] и применение которой описано для экспрессии человеческих гормональных рецепторов, например, человеческого глюкокортикоидного рецептора (G.Kit (PharMibgen, номер по каталогу 21000 К) для генерирования рекомбинантного бакуловируса,содержащего фрагмент кДНК в векторе экспрессии HEGO, описанный L.TORA и др. (TheEMDO Journal, 8,7, 1981-1986 [1989]), который включает область, кодирующую человеческий рецептор эстрогена дикого типа с глицином в положении 400. Таким образом полученный рекомбинантный вирус использован для экспримированияSF9 (АТСС CRL1711) по известной методике,указанной выше. На матрасе Falcon площадью 175 см 2 в среде TNM-FN SIGMA, дополненной 10% фетальной телячьей сыворотки (SVF) и 50 мкг/мл гентамицина, культивировали 2 х 107 клеток SF9. После инфекции, затем инкубации при температуре 27 С в течение 40-42 часов,клетки лизировали в 1 мл буфера для лизиса (20 ммоль Трис-HCl, рН=8; 0,5 ммоль этилендиаминтетрауксусной кислоты (ЭДТУ), 2 ммоль дитиотреитола, 20% глицерина, 400 ммоль КСl) путем цикла замораживание-размораживание,который повторяли еще два раза. Супернатант,содержащий человеческий рекомбинантный рецептор эстрогена, хранили в жидком азоте в количестве 0,5 мл. Супернатант инкубировали при температуре 0 С в течение 24-х ч с постоянной концентрацией (Т) меченого тритием эстрадиола в присутствии возрастающих концентраций либо немеченого эстрадиола (0-1000 х 10-9 М), либо немеченого тестируемого продукта (0-25000 х 10-9 М). Связанное количество меченого тритием эстрадиола (В) затем определяли в каждом инкубаторе по способу адсорбции при использовании нанесенного на уголь декстрана. 3 - Расчет относительного сродства к связыванию (ARL). Вычерчивают следующие 2 кривые: процент связанного, меченого тритием гормона 100 х В/ВО в зависимости от логарифма концентрации стандартного немеченого гормона или в зависимости от логарифма концентрации тестируемого немеченого продукта. Определяют прямую по следующему уравнению:I50=100(В 0/В 0+Bmin/B0)/2=100(1+Bmin/B0) = 50(1+Bmin/B0),где В 0 = концентрация связанного, меченого тритием гормона в отсутствие любого немеченого продукта; В = концентрация связанного, меченого тритием гормона в присутствии концентрации Х немеченого продукта;Bmin = концентрация связанного, меченого тритием гормона для инкубации этого меченого тритием гормона в концентрации (Т) в присутствии большого избытка немеченого стандартного гормона (1000 х 10-9 М) для человеческого рецептора. Пересечение прямой I50 и кривых позволяют оценить концентрации немеченого стандартного гормона (СН) и тестируемого немеченого продукта (СХ), которые ингибируют 50% связывания меченого тритием гормона с рецептором. Относительное сродство к связыванию(ARL) тестируемого продукта определяли по уравнению:ARL = 100(СН)/(СХ) Полученные результаты являются следующими: ПримерыEH эстрадиол=100 24 ч 12 28 7 59 9 28 13 42 11 14 Заключение: тестируемые продукты обладают хорошим сродством к человеческому рецептору эстрогена. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I)R1 обозначает атом водорода иди радикал ацил,R2 обозначает радикал (С 1-С 4)алкил,Х обозначает атом галогена или атом водорода,n равно 3, 4 или 5,R3 и R4 обозначает (С 1-С 4)алкил или R3 иR4 образуют вместе с атомом азота, с которым они связаны, группу пирролидинил или пиперидинил,R5 обозначает ОН иR6 обозначает Н, (С 1-С 4)алкил, возможно,замещенный одним или тремя атомами галогена или R5 и R6 вместе с атомом углерода, с которым они связаны, образуют группу фуранил или дигидрофуранил или оба образуют оксогруппу,а также их соли присоединения оснований и кислот. 2. Соединения по п.1 формулы (I')X' обозначает атом хлора, брома или водорода,n' равно 3,R'3, R'4, R'5, и R'6 имеют значения, указанные в п.1 для R3, R4, R5, и R6, а также их соли присоединения оснований и кислот. 27 3. Соединения по п.1 или 2, в которых Х является атомом хлора. 4. Соединения по одному из пп.1-3, в которых Х является атомом водорода. 5. Соединения формулы (I) или (I') по любому из пп.1-4, названия которых приводятся ниже: 3-гидрокси-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 3-гидрокси-11-[4-[3-(1-пирролидинил) пропил]фенил]эстра-1,3,5(10)-триен-17-он; 3-гидрокси-11-[4-[3-(диметиламино)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 4-хлор-3-гидрокси-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 4-хлор-3-гидрокси-11-[4-[3-(1-пирролидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 4-хлор-3-гидрокси-11-[4-[3-(диэтиламино)пропил]фенил]эстра-1,3,5(10)-триен-17-он; 11-[4-[3-(1-пирролидинил)пропил]фенил] эстра-1,3,5(10)-триен-3,17-диол; 11-[4-[3-(диметиламино)пропил]фенил] эстра-1,3,5(10)-триен-3,17-диол; 11-[4-[3-(1-пиперидинил)пропил]фенил] эстра-1,3,5(10)-триен-3,17-диол; 4-хлор-11-[4-[3-(1-пирролидинил)пропил] фенил]эстра-1,3,5(10)-триен-3,17-диол; 4-хлор-11-[4-[3-(1-пиперидинил)пропил] фенил]эстра-1,3,5(10)-триен-3,17-диол; 11-[4-[3-(1-пиперидинил)пропил]фенил]17-(трифторметил)эстра-1,3,5(10)-триен-3,17 диол; 4-хлор-11-[4-[3-(диэтиламино)пропил] фенил]эстра-1,3,5(10)-триен-3,17-диол; 17-метил-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-17-диол; 4-хлор-17-метил-11-[4-[3-(1-пиперидинил)пропил]фенил]эстра-1,3,5(10)-триен-3,17 диол;(17R)-4',5'-дигидро-11-[4-[3-(диметиламино)пропил]фенил]спиро(эстра-1,3,5(10)-триен 17,2'(3'Н)-фуран)-3-ол. 6. Способ получения соединений формулы(I) по п.1, согласно которому соединение формулы (II) в которой R2, R5 и R6 имеют указанные в п.1 значения и К означает защитную группу для функциональной 3-кетогруппы, последовательно подвергают следующим реакциям: а) воздействию соединения формулы (III) 28 в которой P означает защитную группу для функциональной спиртовой группы и n означает целое число, равное 3, 4 или 5, затем, при желании, удалению защитных групп от одной или нескольких защищенных реакционноспособных функциональных групп, чтобы получить соединение формулы (IIIa) где Р' имеет такие же значения, как Р, а также означает водород; б) воздействию, при желании, галогенирующего агента, чтобы получить соединение формулы (IIIb) где Hal означает атом галогена; в) воздействию агента ароматизации цикла(А) на соединения формул (IIIa) и (IIIb), при желании, после защиты и/или активации функциональной группы ОН, затем воздействию основания для получения соединения формулы (IV) где Р" имеет такие же значения, как Р', и может означать, кроме того, активирующую группу; Х имеет указанное в п.1 значение; г) воздействию амина формулы (V) где R3 и R4 имеют указанные в п.1 значения,причем это соединение может находиться в форме соли, чтобы получить некоторые из соединений формулы (I),причем соединения формул (IIIa), (IIIb),(IV) и (I) при необходимости в соответствующем порядке подвергают одной или нескольким следующим реакциям:- введению/удалению защитных групп в случае группы или групп ОН;- алкилированию/ацилированию группы или групп ОН;- воздействию металлоорганического соединения или соединения СF3SiМе 3 на соединения формулы (IV) или (I), где R5 и R6 вместе образуют оксогруппу;- воздействию восстановителя двойной связи, когда R5 и R6 образуют группу фуранил,вместе с атомом углерода, с которым они связаны;- воздействию агента лактонизации на соединения формулы (IV) или (I), где R5 и R6 вместе образуют оксогруппу;- солеобразованию. 7. Применение соединения формулы (I) по п.1, а также их солей присоединения фармацев 30 тически приемлемых кислот или оснований, в качестве лекарственных средств. 8. Применение соединения формулы (I) или (I') по любому из пп.2-5, а также их солей присоединения фармацевтически приемлемых кислот или оснований в качестве лекарственных средств. 9. Применение соединения по п.5, а также их солей присоединения фармацевтически приемлемых кислот в качестве лекарственных средств. 10. Фармацевтические композиции, включающие одно или несколько соединений по любому из пп.1-5. 11. Соединения общих формул (IIIa), (IIIb),(IV) по п.6 в качестве промежуточных продуктов.
МПК / Метки
МПК: C07J 41/00, A61K 31/566, A61P 19/10
Метки: средств, положении, фармацевтические, замещенные, содержащие, лекарственных, композиции, продукты, способ, промежуточные, качестве, получения, 11&beta, 19-норстероиды, новые, применение
Код ссылки
<a href="https://eas.patents.su/16-3133-novye-19-norsteroidy-zameshhennye-v-polozhenii-11beta-sposob-i-promezhutochnye-produkty-dlya-ih-polucheniya-primenenie-v-kachestve-lekarstvennyh-sredstv-i-soderzhashhie-ih-farmacev.html" rel="bookmark" title="База патентов Евразийского Союза">Новые 19-норстероиды, замещенные в положении 11&beta, способ и промежуточные продукты для их получения, применение в качестве лекарственных средств и содержащие их фармацевтические композиции</a>
Предыдущий патент: Способ получения циталопрама
Следующий патент: Противоопухолевая композиция, содержащая синергическую комбинацию производного антрациклина и производного камптотецина
Случайный патент: Способ и устройство для автоматизированных переговоров между сторонами




















