Новые циклические соединения, имеющие циклоалкиленовую цепь, способ их получения и включающие их фармацевтические композиции
Номер патента: 2818
Опубликовано: 31.10.2002
Авторы: Беннежан Каролин, Ренар Пьер, Ланглуа Мишель, Лефа-Ле Галь Мари, Делагранж Филипп, Мат-Алленма Моник
Формула / Реферат
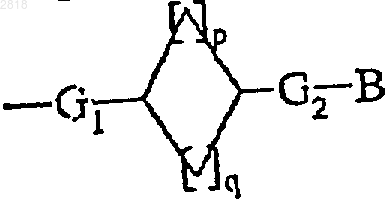
1. Соединение формулы (I)

где А представляет собой
- кольцевую систему формулы (II)
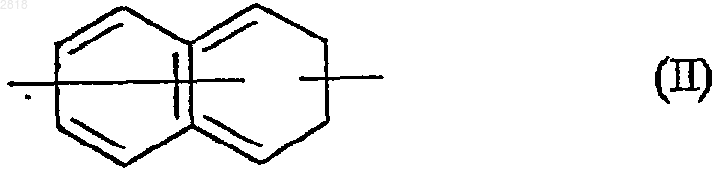
где R может быть заместителем в любом положении кольцевой системы II,
- или А представляет кольцевую систему формулы (III)
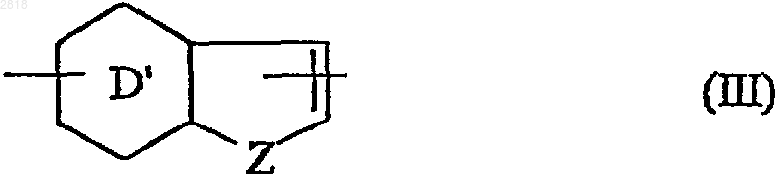
где Z представляет собой атом кислорода, атом серы или группу NR1 (где R1 представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу,
D' представляет бензольное кольцо или пиридиновое кольцо,
где R замещает D' кольцо, a G1 замещает другое кольцо, при этом следует понимать, что кольцевые системы формулы (II) или (III) помимо R и G1 групп могут быть замещены одной-тремя одинаковыми или различными группами, выбранными из линейной или разветвленной (С1-С6)алкоксигруппы, арила и арил-(С1-С6)алкила, где алкильная часть может быть линейной или разветвленной;
R представляет собой Ra, ORa или SRa группу, где Ra представляет собой линейный или разветвленный (С1-С6)алкил,
или образует с несущим его атомом углерода и со смежным атомом углерода кольцо формулы (IV)
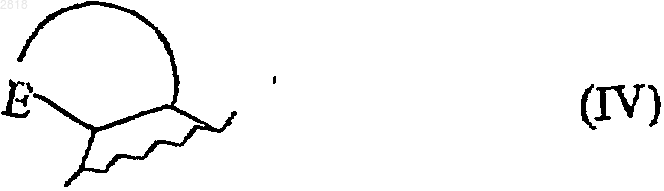
где Е представляет собой атом кислорода или атом серы, где полученное в результате кольцо содержит от 5 до 7 атомов;
G1 и G2, которые могут быть одинаковыми или различными, представляют собой простую связь или алкиленовую цепь -(СН2)t- (где t представляет 1, 2, 3 или 4);
р обозначает 0, 1, 2, 3 или 4,
q обозначает 0, 1, 2, 3 или 4, причем 1=p+q=4;
В представляет собой группу -NR1aC(Q)R2a, -NR1aC(Q)NR2aNR3a или C(Q)NR1aNR2a,
где Q представляет собой атом кислорода или серы,
R1a обозначает водород,
R2a обозначает группу, выбранную из линейного или разветвленного (С2-С6)алкенила, (С3-С8)циклоалкила и линейного или разветвленного (С1-С6)алкила, который может быть необязательно замещен атомом галогена, и
R3a обозначает водород, при этом следует понимать, что
"арил" предусматривает группу, выбранную из фенила, нафтила или бифенила, причем каждая из этих групп может быть замещена одним или большим количеством одинаковых или различных радикалов, выбранных из гидрокси, линейного или разветвленного (С1-С6)алкокси, линейного или разветвленного (С1-С6)алкила, линейного или разветвленного полигалоген-(С1-С6)алкила, циано, карбокси, линейного или разветвленного (С1-С6)алкоксикарбонила, нитро, амино или атомов галогена,
под "гетероарилом" следует понимать любую моно- или полициклическую ароматическую группу, содержащую от 5 до 10 атомов и содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода или серы, причем эти группы могут быть замещены одним или большим количеством радикалов, выбранных из гидрокси, линейного или разветвленного (С1-С6)алкокси, линейного или разветвленного (С1-С6)алкила, линейного или разветвленного полигалоген-(C1-С6)алкила, циано, карбокси, линейного или разветвленного (С1-С6)алкоксикарбонила, нитро, амино или атома галогена,
при условии, что
когда А представляет собой группу нафталина, незамещенную или замещенную одной метокси или одной метильной группой, G1 и G2 одновременно представляют простую связь и В представляет
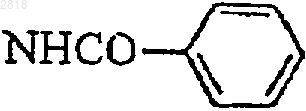
или NHCOMe, исключено, чтобы (q=0 и р=4) или (q=4 и р=0),
когда А представляет собой индольную группу, замещенную в положении 2 группой
В не может представлять собой группу мочевины;
их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, где р представляет 1, 2, 3 или 4 и q представляет 0 (или р представляет 0 и q представляет 1, 2, 3 или 4); их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, где р представляет 1 и q представляет 0 (или р представляет 0 и q представляет 1), их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.3, отличающиеся тем, что R-A-G1 и G2-В группы имеют транс-конфигурацию; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, где R представляет ОRa, SRa или Ra группу; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, где R представляет ORa группу; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, где R образует вместе с несущим его атомом углерода и смежным атомом углерода кольцо формулы (IV), их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, где А представляет кольцевую систему формулы (II), замещенную в 7 положении группой R и в 1 или 2 положении - G1, причем А является незамещенной или замещенной (в том числе заместителями R и G1) в положении 2 или 3; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, где А представляет кольцевую систему формулы (III), замещенную в 5 положении R и в 3 положении G1, причем А является незамещенной или замещенной (помимо заместителями R и G1) во 2 положении; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, где G1 представляет простую связь и G2 представляет простую связь или группу СН2, их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по п.1, где В представляет -NHCOR2a или -CONHRa группу; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по п.1, где А замещен
- группой формулы (V)
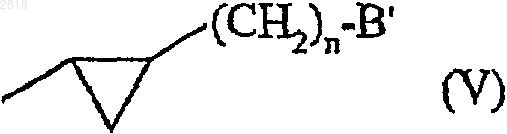
где n представляет 0 или 1 и В' представляет -NHCOR2a или -CONHR2a группу,
- ORa, SRa, или Ra группой и
- необязательно алкокси, арильной или арилалкильной группой;
их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по п.1, где А представляет нафталин, хроман или бензохроман,
- замещенные в 1 и 2 положении (формулы II) группой формулы (V)
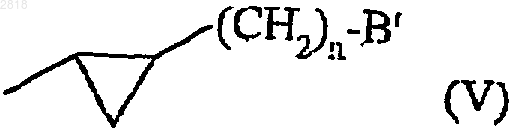
где n представляет 0 или 1 и В' представляет -NHCOR2a или -CONHR2a группу,
- замещенную в 7 положении (формула II) ORa, SRa, или Ra группой и
- необязательно замещенную в 3 положении (формула II) арильной или арилалкильной группой или во 2 положении (формула II) алкокси группой;
их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по п.1, где А представляет бензотиофен, бензофуран, индол или азаиндол,
- замещенные в 3 положении (формула III) группой формулы (V)
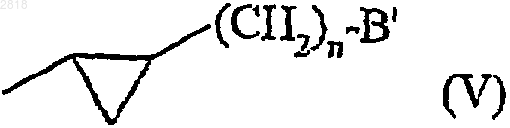
где n представляет 0 или 1 и В' представляет -NHCOR2a или -CONHR2a группу,
- замещенные в 5 положении (формула III) ORa, SRa, или Ra группой и
- необязательно замещенные во 2 положении (формула III) арильной или арилалкильной группой;
их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
15. Соединения формулы (I) по п.1, где А представляет собой нафталин,
- замещенные в 1 положении группой формулы (V)
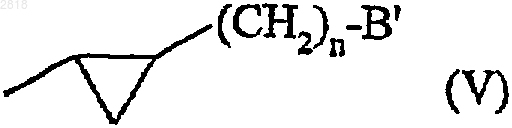
где n представляет 0 или 1 и В' представляет -NHCOR2a или -CONHR2a группу,
- замещенные в 7 положении ORa группой и
- необязательно замещенные в 3 положении арильной или арилалкильной группой или во 2 положении ORa группой;
их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
16. Соединения формулы (I) по п.1, которые представляют собой
N-[2-(7-метокси-1-нафтил)-1-циклопропил]ацетамид,
N-[2-(7-метокси-1-нафтил)-1-циклопропил]пропанамид,
N-[2-(7-метокси-1-нафтил)-1-циклопропил]бутанамид,
N-[2-(7-метокси-1-нафтил)-1-циклопропил]циклопропанкарбоксамид,
N-[2-(2,7-диметокси-1-нафтил)-1-циклопропил]ацетамид,
N-[2-(2,7-диметокси-1-нафтил)-1-циклопропил]пропанамид,
N-[2-(2,7-диметокси-1-нафтил)-1-циклопропил]бутанамид,
N-[2-(2-метокси-1-нафтил)-1-циклопропил]ацетамид,
N-[2-(2-метокси-1-нафтил)-1-циклопропил]пропанамид,
N-[2-(2-метокси-1-нафтил)-1-циклопропил]бутанамид,
N-[2-(2-метокси-1-нафтил)-1-циклопропилметил]ацетамид,
N-[2-(2-метокси-1-нафтил)-1-циклопропилметил]пропанамид,
N-[2-(2-метокси-1-нафтил)-1-циклопропилметил]бутанамид;
их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
17. Соединения формулы (I) по п.15, отличающиеся тем, что -(СН2)n-В и R-A-G1- группы имеют транс-конфигурацию; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием.
18. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (VI)
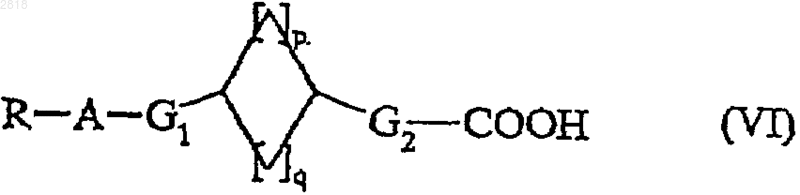
где R, A, G1, G2, р и q такие, как определены выше,
которое подвергают после активации переведением в хлорангидрид кислоты или в присутствии связывающего агента воздействию с амином HNR1aR2a, где R1a и R2a такие, как определено выше, с получением соединения формулы (I/a), частного случая соединения формулы (I)
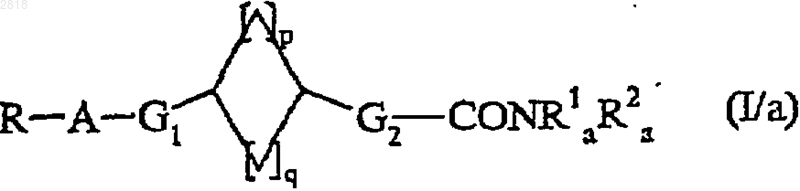
где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше,
которое может быть подвергнуто действию тионирующего агента для получения соединения формулы (I/b), частного случая соединений формулы (I)
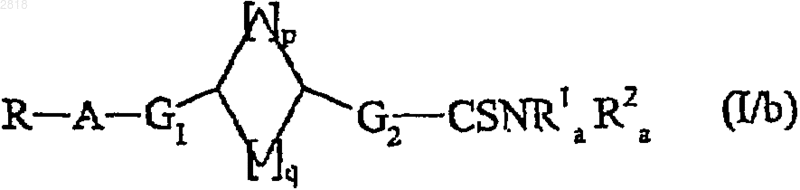
где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше;
или подвергают, после превращения в соответствующий азид, перегруппировке Куртиуса с получением, после гидролиза, амина формулы (VII)
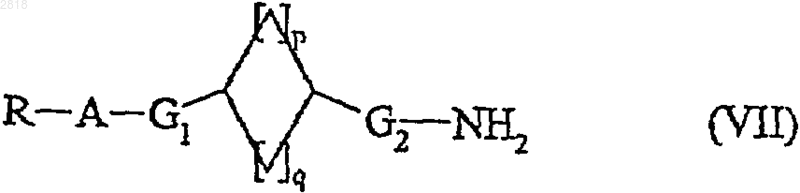
где R, A, G1, G2, p и q такие, как определено выше,
который либо
- подвергают реакции с ацилхлоридом ClCOR2a или соответствующим смешанным или симметричным ангидридом, где R2a такой, как определено выше, для получения соединения формулы (I/с), частного случая соединений формулы (I)
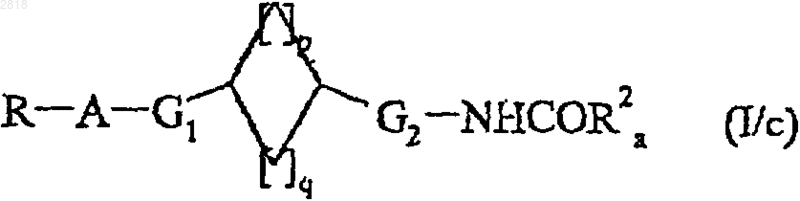
где R, A, G1, G2, R2a, p и q такие, как определено выше,
причем эти соединения формулы (I/с) могут быть подвергнуты воздействию тионирующего агента с получением соединений формулы (I/f), частного случая соединений формулы (I)
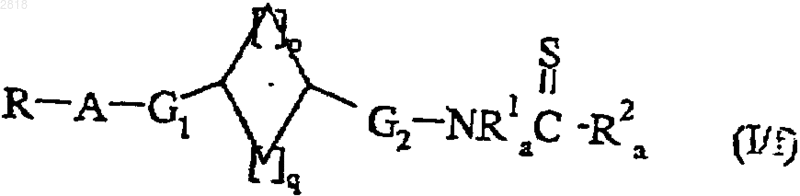
где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше, или
- подвергнуты взаимодействию с соединением формулы (IX)
Q = С = N-R2a (IX)
где Q и R2a такие, как определено выше,
с получением соединения формулы (I/g), частного случая соединений формулы (I)
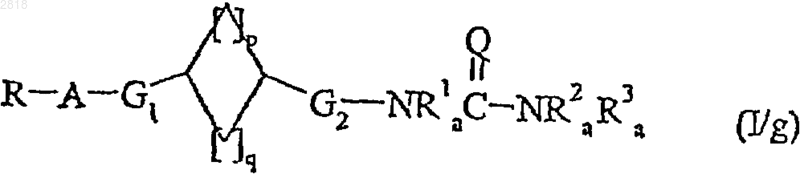
где R, A, G1, G2, R1a, R2a, R3a, Q, p и q такие, как определено выше;
причем соединения с (I/a) по (I/g) представляют всю совокупность соединений формулы (I) и могут быть очищены в соответствии с общепринятыми методиками очистки, превращены при желании в соли присоединения с фармацевтически приемлемыми кислотами и основаниями и необязательно разделены на изомеры в соответствии с общепринятыми методиками разделения.
19. Фармацевтические композиции, включающие продукты формулы (I) по любому из пп.1-17 или их соли присоединения с фармацевтически приемлемой кислотой или основанием в сочетании с одним или большим количеством фармацевтически приемлемых эксципиентов.
20. Применение соединений формулы (I) по любому из пп.1-17 или их фармацевтически приемлемых солей с кислотами или основаниями в комбинации с одним или более фармацевтически приемлемыми эксципиентами в качестве средств для лечения нарушений мелатонинэргической системы.
Текст
1 Настоящее изобретение относится к новым циклическим соединениям, имеющим циклоалкиленовую цепь, к способу их получения и содержащим их фармацевтическим композициям. Гидрокси или алкоксициклопропанамиды(WO 9209566, ЕР 436199, US 5459150) и гидрокси или алкоксициклобутанамиды (US 5187192) известны из данного уровня техники, для использования в качестве ингибиторов 5 липоксигеназы. Другие соединения циклопропанамида или-тиоамида, имеющие ненасыщенную цепь, ранее были описаны как пестициды (ЕР 369762). Также были обнаружены соединения циклопропаниндола для использования в лечении нейродегенеративных заболеваний (ЕР 568136). Наконец, в некоторых публикациях упоминаются амидные соединения, имеющие циклогексановую цепь, как промежуточные продукты или продукты синтеза. (Indian.J. Chem.,1974, 12(7), pp. 664-7; Bull. Chem. Soc. Jap.,1968, 41(12), pp 3008-11). Соединения настоящего изобретения являются новыми и обладают такими фармакологическими характеристиками, которые очень полезны в отношении мелатонинэргических рецепторов. Огромное число исследований проведенных за последние десять лет продемонстрировали ключевую роль мелатонина (N-ацетил-5 метокситриптамина) во многих патофизиологических явлениях и в контроле циркадного ритма. Однако, благодаря быстрому метаболизму его период полужизни довольно короткий. Таким образом огромный интерес представляет возможность проведения клинического лечения аналогами мелатонина, которые метаболически более стабильны, имеют агонистический или антагонистический характер и от которых можно ожидать более сильного терапевтического эффекта, чем от самого гормона. Помимо благоприятного воздействия на нарушения циркадного ритма (J.Neurosurg. 1985, 63, pp. 320-341) и расстройства сна (Psychopharmacology, 1990, 100, pp. 222-226) лиганды мелатонинэргической системы обладают значительными фармакологическими свойствами в отношении центральной нервной системы,в особенности анксиолитическими и антипсихотическими свойствами (Neuropharmacology ofPineal Secretion, 1990, 8 (3-4), pp. 264-272), и анальгезирующими свойствами (Pharmacopsychiat., 1987, 20, pp. 222-223), а также при лечении болезни Паркинсона (J. Neurosurg. 1985, 63,pp. 320-341) и болезни Альцгеймера (Brain Research, 1990, 528, pp. 170-174). Эти соединения также проявляют активность в отношении некоторых раковых заболеваний (Melatonin - Clinical 2 ния (International Journal of Eating Disorders,1996, 20 (4), pp. 443-446). Все эти различные эффекты осуществляются через посредство специфических мелатониновых рецепторов. Молекулярнобиологические исследования показали наличие нескольких подвидов рецепторов, способных к связыванию данного гормона (Trends Pharmacol.Sci., 1995: 16, р.50; WO 97,04094). Существует возможность определения локализации и характера некоторых из этих рецепторов у различных видов, включая млекопитающих. Доступность подходящих специфических лигандов имеет большое значение для лучшего понимания физиологического действия данных рецепторов. Более того, такие соединения путем избирательного связывания с тем или другим из этих рецепторов могут служить отличным лекарственным средством для клинического лечения заболеваний, связанных с мелатонинэргической системой, некоторые из которых упоминались выше. Соединения настоящего изобретения кроме того, что являются новыми, проявляют сильное сродство к мелатониновым рецепторам и/или к одному или другому подвиду мелатониновых рецепторов. Более конкретно настоящее изобретение относится к соединениям формулы (I) где А представляет собой кольцевую систему формулы (II) где Х и Y, которые могут быть одинаковыми или различными, и представляют собой атом кислорода, атом серы или СН 2 группу,D представляет собой бензольное или нафталиновое кольцо, и символ обозначает, что связь может быть простой или двойной, в зависимости от соответствующей валентности атомов,где R замещает или кольцевую систему D или кольцо, содержащее Х и Y, и G1 замещает кольцо, содержащее Х и Y,или А представляет кольцевую систему формулы (III) где Z представляет собой атом кислорода, атом серы, группу СН 2 или группу NR1, где R1 представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу, и арильную группу или арил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, 3D' представляет бензольное кольцо или имеет пиридиновое кольцо, и символ вышеуказанное значение,где R замещает D' кольцо, a G1 замещает другое кольцо, при этом понятно, что кольцевые системы формулы (II) или (III) помимо R и G1 групп могут быть замещены одной-тремя одинаковыми или различными группами, выбранными из Ra, ORa, гидроксила, CORa, формила,COORa, карбоксила и OCORa,где Ra представляет собой замещенную или незамещенную, линейную или разветвленную (C1-С 6)алкильную группу; замещенную или незамещенную, линейную или разветвленную(C1-C6)алкинильную группу; линейную или разветвленную полигалоген-(C1-С 6)алкильную группу; замещенную или незамещенную (С 3 С 8)циклоалкильную группу; замещенную или незамещенную(С 3-C8)циклоалкил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, замещенную или незамещенную (С 3-С 8)циклоалкенильную группу; замещенную или незамещенную (С 3-С 8)циклоалкенил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным; арильную группу; арил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, гетероарильную группу или гетероарил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным.R представляет собой водород или атом галогена, или гидроксил, SH, Ra, ORa илиRa такой, как определено выше,или образует, с несущим его атомом углерода и со смежным атомом углерода, кольцо формулы (IV) где Е представляет собой атом кислорода или группу -S(O)n- , где n такой, как определено выше,где полученное в результате кольцо содержит от 5 до 7 атомов, может содержать одну или большее количество ненасыщенных связей и может быть замещено одной или большим количеством групп, выбранных из линейного или нелинейного (C1-С 6)алкила, линейного или разветвленного (C1-C6)алкокси, карбокси, линейного или разветвленного (C1-C6)алкоксикарбонила, гидрокси и оксо,G1 и G2, которые могут быть одинаковыми или различными, представляют собой простую связь или алкиленовую цепь -(CH2)t (где t представляет 1, 2, 3 или 4), замещенную или незамещенную одним или большим количеством одинаковых или различных радикалов, выбран 002818c1p+q4,В представляет собой группу -NR1aC(Q)R2a, 1R3a, которые могут быть одинаковым или различными, могут иметь любое из значений Ra или могут представлять собой атом водорода, и Q представляет собой атом кислорода или серы,причем-термин замещенный, примененный к терминам алкил, алкенил и алкинил означает, что эти группы замещены одним или большим количеством одинаковых или различных радикалов, выбранных из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, линейного или разветвленного полигалоген-(C1-С 6) алкила, амино или атома галогена,термин замещенный, примененный к терминам циклоалкил, циклоалкилалкил,циклоалкенил и циклоалкенилалкил обозначают, что циклический остаток этой группы является замещенным одним или большим количеством радикалов, выбранных из гидрокси,линейного или разветвленного (C1-С 6)алкокси,линейного или разветвленного (C1-C6)алкила,линейного или разветвленного полигалоген-(C1C6)алкила, амино или атома галогена,под арилом следует понимать группы фенила, нафтила или бифенила, причем эти группы могут быть замещены одним или большим количеством одинаковых или различных радикалов, выбранных из гидрокси, линейного или разветвленного (C1-С 6)алкокси, линейного или разветвленного (C1-C6)алкила, линейного или разветвленного полигалоген-(C1-С 6)алкила,циано, карбокси, линейного или разветвленного(C1-C6)алкоксикарбонила, нитро, амино или атомов галогена,под гетероарилом следует понимать любую моно- или полициклическую ароматическую группу, содержащую от 5 до 10 атомов, и содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода или серы, причем эти группы могут быть замещены одним или большим количеством радикалов, выбранных из гидрокси, линейного или разветвленного (C1 С 6)алкокси, линейного или разветвленного (C1C6)алкила, линейного или разветвленного полигалоген-(C1-С 6)алкила, циано, карбокси, линейного или разветвленного (C1-C6)алкоксикарбонила, нитро, амино или атома галогена,при условии, что когда А представляет собой группу нафталина, незамещенную или замещенную одной метокси или одной метильной группой, G1 и G2 одновременно представляют простую связь, и В представляет или NHCOMe, исключено, чтобы (q=0 и р=4) или (q=4 и p=0),когда G1 представляет собой простую связь и p+q=1, А не может представлять собой группу нафталина, замещенную одним или большим количеством атомов галогена,когда А представляет собой индольную группу, замещенную в положении 2 группой,В не может представлять собой группу мочевины,когда А представляет собой индольную группу, замещенную в положении 2 карбоксильной или алкоксикарбонильной группой, р представляет 1 и q представляет 0 (или q представляет 1 и р представляет 0) и G1 представляет простую связь, В не может представлять собойCONHAr группу, в которой Аr является арильной группой,их энантиомеры и диастереоизомеры и к их солям присоединения с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых солей в качестве не ограничивающих примеров можно отметить хлористо-водородную кислоту,бромисто-водородную кислоту, фосфорную кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пирувиновую, малоновую кислоту, янтарную кислоту, глютаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту,аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту, щавелевую кислоту и т.д. Среди фармацевтически приемлемых оснований в качестве не ограничивающих примеров можно отметить гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями по изобретению являются такие, в которых p+q=1. Предпочтительными R заместителями являются группы Ra, ORa, SRa, особенно Ra, и ORa,где Ra более предпочтительно представляет линейную или разветвленную (C1-С 6)алкильную группу, (С 3-С 8)циклоалкильную группу, (С 3 С 8)циклоалкил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является разветвленным или линейным, арильную группу или арил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, как например метил, этил, пропил,изопропил, бутил, втор-бутил, трет-бутил, пентил, гексил, циклопропил, циклобутил, циклопентил, циклогексил, циклопропилметил, циклопропилэтил, фенил или бензил,или те, в которых R образует с несущим его атомом углерода и со смежным атомом углерода кольцо формулы (IV), где Е представляет, например -Q-(CH2)1-, 002818 где Q представляет атом серы или кислорода. Более предпочтительно изобретение относится к соединениям, в которых R представляет группу ORa. В предпочтительном варианте изобретение относится к соединениям, где А представляет кольцевую систему формулы (II), замещенную в 7 положении группой R или в 1 или 2 положении группой G1, или систему формулы (III), замещенную в 5 положении R и в 3 положении G1. Предпочтительными являются незамещенные или замещенные (в том числе заместителями R и G1) группой во 2 и 3 положении (формула II) или во 2 положении (формула III), причем наиболее предпочтительно, чтобы этой группой была группа алкокси, арильная группа или арилалкильная группа. Предпочтительные G1 и G2 группы представляют простую связь или группу СН 2. Более конкретно изобретение относится к соединениям, где В представляет -NHCORa, или-CONHRa группу. В более предпочтительном варианте изобретение относится к соединениям, где А является замещенным группой формулы (V) где n представляет 0 или 1 и В' представляетNHCORa или -CONHRa группу (где R такой, как определено выше), -алкокси, алкилтио или алкильной группой,необязательно алкокси, арильной или арилалкильной группой. Еще более конкретно данное изобретение относится к соединениям нафталина, хромана или бензохромана, замещенным в 1 или 2 положении (формула II) группой формулы (V), в 7 положении (формула II) Ra, ORa или SRa группой и необязательно замещенной по 3 положению (формула II) арильной арилалкидной группой или в 2 положении (формула II) алкокси группой,или к соединениям бензотиофена, бензофурана, индола или азаиндола, замещенным в 3 положении (формула III) группами формулы(V), в 5 положении (формула III) группами Ra,ORa или SRa и необязательно замещенным в 3 положении (формула III) арильной или арилалкильной группой. В наиболее предпочтительном варианте изобретение относится к соединениям нафталина, замещенным в 1 положении группой формулы (V), в 7 положении ORa группой и необязательно замещенным в 2 положении ORa группой или в 3 положении арильной или арилалкильной группой. 7 Более точно изобретение относится к соединениям формулы (I), которые представляют собойN-[2-[2-метокси-1-нафтил)-1-циклопропилметил]бутанамид Предпочтительной является такая конфигурация соединений формулы (I), в которой -G1A-R группа и -G2-B- группа имеют трансконфигурацию. Энантомеры, диастереоизомеры предпочтительных соединений по изобретению и их соли присоединения с фармацевтически приемлемыми кислотами и основаниями являются частью настоящего изобретения. Изобретение также относится к способу получения соединений формулы (I), характеризующемуся тем, что при этом в качестве исходного вещества используется соединение формулы (VI) где R, A, G1, G2, p и q такие, как определено выше,которое подвергают после активации переведением в хлорангидрид кислоты или в присутствии связывающего агента воздействию с амином HNR1aR2a, где R1a, и R2a такие, как определено выше, с получением соединения формулы (I/а), частного случая соединения формулы где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше,которое может быть подвергнуто действию тионирующего агента, такого как реагент Ла 002818 8 вессона, для получения соединения формулы(I/b),- частного случая соединений формулы (I), где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше, или подвергают, после превращения в соответствующий азид, перегруппировке Куртиуса с получением после гидролиза амина формулы (VII) где R, A, G1, G2, p и q такие, как определено выше,который либо подвергают реакции с ацилхлоридомClCOR1a или соответствующим смешанным или симметричным ангидридом, где R1a такой, как определено выше, для получения соединения формулы (I/с), частного случая соединений формулы (I) где R, A, G1, G2, R1a, p и q такие, как определено выше,с последующим необязательным взаимодействием с соединением формулы (VIII)Ra - J (VIII) где Ra такой, как определено выше, и J представляет отщепляемую группу, такую как атом галогена или тозильная группа,с получением соединения формулы (I/d),частного случая соединений формулы (I) где R, A, G1, G2, Ra, R'a, р и q такие, как определено выше,причем вся совокупность соединений (I/c) и (I/d) составляет соединения формулы (I/е),частный случай соединений формулы (I) где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше,причем эти соединения формулы (I/е) могут быть подвергнуты воздействию тионирующего агента, такого, например, как реагент Лавессона, для получения соединения формулы(I/f), частного случая соединений формулы (I)Q = С = N-R1a (IX) 1 где Q и R a, такие, как определено выше,с последующим необязательным взаимодействием с соединением формулы (VIII) с по 9 лучением соединения формулы (I/g), частного случая соединений формулы (I) где R, A, G1, G2, R1a, R2a, R3a, Q, p и q такие, как определено выше,причем соединения с (I/a) по (I/g) представляют всю совокупность соединений формулы (I) и могут быть очищены в соответствии с общепринятыми методиками, превращены, при желании, в соли присоединения с фармацевтически приемлемыми кислотами и основаниями и необязательно разделены на изомеры в соответствии с общепринятыми методиками разделения. Исходные соединения (VI) являются или коммерческими препаратами, или могут быть легко получены квалифицированными в данной области специалистами путем общепринятых химических реакций, описанных в литературе. Соединения по изобретению и содержащие их фармацевтические композиции предлагаются как пригодные в лечении заболеваний мелатонинэргической системы. Фармакологическое тестирование соединений по изобретению в действительности продемонстрировало, что они являются нетоксичными, обладают очень высокой степенью избирательного сродства к мелатониновым рецепторам, а также существенной активностью по отношению к центральной нервной системе и в частности терапевтическими свойствами в отношении нарушений сна, анксиолитическими,антипсихотическими и анальгезирующими свойствами, кроме того обнаруженные свойства,касающиеся микроциркуляции, позволяют утверждать, что соединения по изобретению пригодны в лечении стрессов, нарушений сна, тревожных состояний, сезонных аффективных состояний, сердечно-сосудистых заболеваний,патологий пищеварительной системы, бессонницы, усталости в результате расстройства нормального циркадного ритма при быстрой смене между часовыми поясами, шизофрении, приступов паники, меланхолии, нарушений аппетита, ожирения, бессонницы, нарушений психики,эпилепсии, диабета, болезни Паркинсона, старческой деменции, различных нарушений, связанных с нормальным и патологическим старением, мигрени, потери памяти, болезни Альцгеймера и некоторых нарушений циркуляции. В другой области активности обнаружено, что соединения по настоящему изобретению могут быть использованы в лечении половых дисфункций, обладают свойствами ингибитора овуляции и иммуномодулятора и могут быть использованы в лечении раковых заболеваний. Предпочтительно использовать соединения в лечении сезонных аффективных состояний, нарушений сна, сердечно-сосудистых патологий, бессонницы и усталости в результате расстройства нормального циркадного ритма 10 при быстром перемещении между часовыми поясами, нарушений аппетита и ожирения. Например, соединения могут быть использованы для лечения сезонного аффективного состояния и нарушения сна. Настоящее изобретение относится также к фармацевтическим композициям, содержащим,по крайней мере, одно соединение формулы (I) само по себе, или в сочетании с одним или большим количеством фармацевтически приемлемых дополнений. Среди фармакологических композиций в соответствии с изобретением можно отметить в особенности те, которые пригодны для орального, парентерального, назального, накожного или подкожного, ректального, подъязычного, внутриглазного или респираторного применения и в особенности препараты в виде таблеток, драже,подъязычных таблеток, саше, пакетиков, желатиновых капсул, glossettes, лепешек, суппозиториев, кремов, мазей, кожных гелей и ампулированных форм для питья или инъекций. Дозы варьируются в зависимости от пола,возраста и веса пациента, пути введения, характера лечебных показаний или какого-либо сопутствующего лечения и колеблются от 0,01 мг до 1 г за 24 ч за 1 или более приемов. Следующие примеры иллюстрируют данное изобретение и никаким образом не ограничивают его. Последующие приготовления показывают синтез промежуточных продуктов, которые используются в получении соединений настоящего изобретения. Приготовление 1. Транс-2-(7-метокси-2 нафтил)-1-циклопропанамин. Этап А: (7-метокси-1-нафтил)метилацетат В двухлитровой колбе 48,6 г (0,225 моль)[7-метокси(нафт-1-ил)] уксусной кислоты растворяют в смеси 700 мл бензола/300 мл уксусной кислоты и кипятят с обратным холодильником в токе аргона для дегазирования смеси. Добавляют 100 г (1 экв) тетраацетата свинца при комнатной температуре. Реакционную смесь нагревают до 60-70 С, при этой температуре происходит сильное выделение газа (высвобождение СO2), с последующим выдерживанием в течение 30 мин при температуре кипения. Реакционную смесь концентрируют в вакууме и переносят горячей в СН 2 Сl2 (200 мл); медленно добавляют при перемешивании 500 мл эфира. Значительное количество образовавшегося жирного белого осадка отфильтровывают через целит и промывают эфиром. Эфирную фазу затем делают щелочной с помощью охлажденного на льду раствора 5% гидрокарбоната натрия,нейтрализуют водой, сушат над Na2SO4 и концентрируют при пониженном давлении, получая масло, которое при охлаждении медленно рекристаллизуется. Этап В: (7-метокси-1-нафтил)метанол. 34,5 г (0,15 моль) соединения, полученного в этапе А, растворяют в 300 мл метанола. 35 г (4 11 экв) гидроксида калия, растворенного в 35 мл воды, добавляют при энергичном перемешивании. Спустя 3 ч при комнатной температуре реакционную смесь гидролизуют над смесью лед/концентрированная хлористо-водородная кислоты. Полученный жирный белый осадок отфильтровывают, промывают несколько раз ледяной водой и сушат над Р 2O2 с использованием дессикатора. Названный в заголовке спирт рекристаллизуют из смеси CH2Cl/циклогексан,получая белые игольчатые кристаллы. Этап С: 7-метокси-1-нафтальдегид. 19,2 г (0,1 моль) соединения, полученного на этапе В, растворяют в 300 мл CH2Cl2. В атмосфере аргона 65 г (7,5 экв) оксида марганца добавляют в три этапа (t=0 : 25 г, t=3 ч: 25 г и t=24 ч: 15 г). По истечении последующих 24 ч спирт полностью окисляется. Затем смесь фильтруют через целит для удаления неорганических соединений, промывают CH2Cl2 и затем фильтруют через силикагель с получением масла, которое отвердевает при охлаждении. Этап D: Этил-3-(7-метокси-1-нафтил)-2 пропеноат. 2 г (10,7 ммоль) соединения, полученного на этапе С в 20 мл безводного ТГФ помещают в присутствии 515 мг (1,2 экв) NaH (60% в масле) в 25 мл безводного ТГФ и 2,5 мл (1,2 экв) триэтилфосфоноацетата. Трехчасовое перемешивание при комнатной температуре и мягкое кипячение с обратным холодильником дает темно окрашенное масло. Этап Е: 3-(7-метокси-1-нафтил)-2 пропеновая кислота. 8,4 г (32,8 ммоль) эфира, полученного на этапе D и растворенного в 150 мл этанола, в присутствии 40 мл Н раствора гидроксида натрия перемешивают в течение 3 ч при комнатной температуре и в течение ночи кипятят с обратным холодильником для получения названной в заголовке кислоты в форме белого твердого вещества. Этап F: N-метокси-N-метил-3-(7-метокси 1-нафтил)-2-пропенамид. Хлорангидрид, полученный, исходя из 6,5 г (28,5 ммоль) кислоты, полученной на этапе Е,и 5 мл оксалилхлорида, добавляют по каплям к суспензии N,O-диметилгидроксиламинхлоридаNа 2 СО 3. Защищенную кислоту получают в форме бледно-желтого твердого вещества. Этап G: Транс-N-метокси-N-метил-2-(7 метокси-1-нафтил)-1-циклопропанкарбоксамид. 5,8 г (21,4 ммоль) соединения, полученного на этапе F, растворенного в 30 мл ДМСО(диметилсульфоксида), добавляют к суспензии илида, полученного, исходя из 10,6 г (2 экв) Ме 3SОI, растворенного в горячем виде в 50 мл ДМСО и 1,25 г NaH. После 15 ч перемешивания при комнатной температуре и 4 ч при 50 С получают названный в заголовке циклопропанамид в виде коричневого масла. 12 Этап Н: Транс-2-[7-метокси-1-нафтил)-1 циклопропанкарбоновая кислота. 6 г (21 ммоль) соединения, полученного на этапе G, в 50 мл безводного эфира и 15,4 г третбутилата калия перемешивают в течение 2 дней при комнатной температуре. 3,2 г легкого коричневого твердого вещества собирают и вводят в последующую реакцию без очищения. Этап I: Транс-2-(7-метокси-1-нафтил)-1 циклопропанамин. 1,5 г (6,2 ммоль) кислоты, полученной на этапе Н, и 770 мкд (1,3 экв) этилхлорформиата в присутствии триэтиламина в ацетоне дают смешанный ангидрид, который затем обрабатывают 550 мг (1,3 экв) азида натрия. Ацилазид затем подвергают перегруппировке в 40 мл безводного толуола при 80 С с получением изоцианата. Изоцианат перемешивают в течение 36 ч при комнатной температуре в водном растворе 20% соляной кислоты, получая названый в заголовке амин. Следующие приготовления проводят таким же способом. Приготовление 2: Транс-2-(2,7-диметокси 1-нафтил)-1-циклопропанамин. Приготовление 3: Транс-2-(2-метокси-1 нафтил)-1-циклопропанамин. Приготовление 4: Транс-2-(5-метоксибензо[b]фуран-3-ил)-1-циклопропанамин. Приготовление 5: Транс-2-(5-метоксибензо[b]тиофен-3-ил)-1-циклопропанамин. Приготовление 6: Транс-2-(5-метокси-1Hпирроло[2,3-b]пиридин-3-ил)-1-циклопропанамин. Приготовление 7: Транс-2-(5-метокси-2 фенилбензо[b]фуран-3-ил)-1-циклопропанамин. Приготовление 8: Транс-2-(5-метокси-2 бензилбензо[b]-фуран-3-ил)-1-циклопропанамин. Приготовление 9: Транс-2-(5-этилбензо[b]тиофен-3-ил)-1-циклопропанамин. Приготовление 10: Транс-2-(5-метокси-2 фенилбензо[b]тиофен-3-ил)-1-циклопропанамин. Приготовление 11: Транс-2-(5-метокси-2 бензилбензо[b]тиофен-3-ил)-1-циклопропанамин. Приготовление 12: Транс-2-(7-метокси-3 фенил-1-нафтил)-1-циклопропанамин. Приготовление 13: Транс-2-7-метокси-3[3-(трифторметил)фенил]-1-нафтил-1-циклопропанамин. Приготовление 14: Транс-2-(5-метокси-2 фенил-1 Н-пирроло[2,3-b]пиридин-3-ил)-1-циклопропанамин. Приготовление 15: Транс-2-(2,3-дигидро 1 Н-бензо[f]xpoмeн-10-ил)-1-циклопропанамин. Приготовление 16: Транс-2-(8,9-дигидро-7 Нфуро[2,3-f]хромен-1-ил)-1-циклопропанамин. Приготовление 17: Транс-2-(2-метокси-1 нафтил-1-циклопропанкарбонитрил. 13 Этап А: 3-(2-метокси-1-нафтил)-2 пропеннитрил. Исходя из 5 г (26,85 ммоль) 2 метоксинафтальдегида в 30 мл безводного ТГФ в присутствии 1,3 г (1,2 экв) NaH (60% в масле) в 15 мл безводного ТГФ и 6,5 мл (1,2 экв) диэтилцианометилфосфоната получают продукт,названный в заголовке в виде белого твердого вещества. Этап В: Транс-2-(2-метокси-1-нафтил)-1 циклопропанкарбонитрил. 5 г (23,9 ммоль) соединения, полученного на этапе А, растворенного в 50 мл ДМСО, добавляют по каплям к илиду, полученному, исходя из 7,9 г (1,5 экв) триметилсульфоксония йодида и 1,15 г (1,2 экв) NaH (60% суспензия в масле) в 20 мл ДМСО. Названное в заголовке соединение получают в виде масла и очищают с помощью хроматографии на силикагеле (элюент: CH2Cl2; CH2Cl2/i - PrOH 98/2). Следующие приготовления проводят таким же способом: Приготовление 18: Транс-2-(2,7-диметокси-1-нафтил)-1-циклопропанкарбонитрил. Приготовление 19: Транс-2-(7-метокси-1 нафтил)-1-циклопропанкарбонитрил. Приготовление 20: Транс-2-(7-метокси-3 фенил-1-нафтил)-1-циклопропанкарбонитрил. Приготовление 21: Транс-2-(5-метокси-2 фенилбензо[b]фуран-3-ил)-1-циклопропанкарбонитрил. Приготовление 22: Транс-2-(5-этилбензо[b]тиофен-3-ил)-1-циклопропанкарбонитрил Приготовление 23: Транс-2-5-метокси-2[3-трифторметил)бензил]бензо[b]тиофен-3-ил 1-циклопропанкарбонитрил. Приготовление 24: Транс-2-(5-метокси-2 фенил-1 Н-пирроло[2,3-b]пиридин-3-ил-1-циклопропанкарбонитрил. Приготовление 25: Транс-2-(2,3-дигидро 1H-бензо-[f]-хромен-10-ил-1-циклопропанкарбонитрил. Приготовление 26: Транс-2-(8,9-дигидро 7 Н-фуро[3,2-f]хромен-1-ил)-1-циклопропанкарбонитрил. Приготовление 27: 3-(2-метокси-1-нафтил)циклобутанамин. Раствор 0,1 моля циклобутенона в 50 мл ТГФ добавляют по каплям к реагенту Гриньяра,полученного, исходя из 1-бром-2-метоксинафталина (0,1 моль) и 2,5 г магния в 200 мл ТГФ. Реакционную смесь перемешивают. В конце реакции смесь гасят 3 н НСl и перемешивают в течение 1 ч после разбавления в 200 мл эфира. После экстракции эфиром и концентрации в вакууме органической фазы получают соответствующий циклобутанон и растворяют его гидроксиламином. После образования оксима смесь подвергают гидрированию над никелем Ренея,получая названный в заголовке амин. 14 Приготовления 28 и 29 проводят способом,описанным для приготовления 27, начиная с соответствующих веществ.Приготовление 28: 3-(2,7-диметокси-1 нафтил)циклогексанамин. Приготовление 29: 3-(2,7-диметокси-1-нафтил)циклопентанамин. Приготовление 30: 2-[(7-метокси-1-нафтил)метил]циклопропанамин. Способ получения такой же, как в приготовлении 1, этапы D-I начинают с 2-(7-метокси 1-нафтил)ацетальдегида. Приготовление 31: 2-[(7-метокси-1-фенил 1-нафтил)метил]циклопропанкарбонитрил. Способ получения такой же, как для приготовления 17, начиная с 2-(7-метокси-3 фенил)-ацетальдегида. Приготовление 32: 2-(8,9-дигидро-7 Нфуро[3,2-f]xpoмeн-1-ил-метил)-циклопропанкарбоновая кислота. Этап А: 2-(8,9-дигидро-7 Н-фуро[3,2-f]хромен-1-ил-метил)-циклопропанкарбонитрил. Способ получения такой же, как для приготовления 17, начиная с 2-(8,9-дигидро-7 Нфуро[3,2-f]хромен-1-ил-ацетальдегида. Этап В: 2-(8,9-дигидро-7 Н-фуро[3,2f]хромен-1-ил-метил)-циклопропанкарбоновая кислота. Соединение, полученное в этапе А, гидролизуют в кислой или щелочной среде. Приготовления 33 и 34 получают способом, описанным для приготовления 32. Приготовление 33: 2-[5-метокси-2-(3 метоксифенил)-1-бензофуран-3-ил]метилциклопентанкарбоновая кислота. Приготовление 34: 2-[5-метоксифуро[2,3b]пиридин-3-ил)метил]-циклобутанкарбоновая кислота. Приготовления 35-38 получают способом,описанным для приготовления 1, заменяя этап G циклоприсоединением соответствующего субстрата. Приготовление 35: 2-(5-этил-1-бензотиофен-3-ил)циклогексиламин. Приготовление 36: 2-(5-этил-1-бензотиофен-3-ил)циклобутиламин. Приготовление 37: 2-(8,9-дигидро-7 Нфуро[3,2-f]хромен-1-ил)циклобутиламин. Приготовление 38: 2-(5-метокси-1 Н-пирроло[3,2-b]пиридин-3-ил)циклопентиламин. Пример 1: N-[транс-2-(7-метокси-1-нафтил)-1-циклопропил]ацетамид. 350 мг соединения, полученного в приготовлении 1, растворяют в смеси СН 2 Сl2/Н 2 О (5:5 мл) в присутствии карбоната натрия. 247 мкл(1,5 экв) уксусного ангидрида добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля (элюент:CH2Cl2/iPrOH 95 : 5), получая белое твердое вещество,которое рекристаллизуют из смеси гексана/ СН 2 Сl2. Пример 2: N[транс-2-(7-метокси-1-нафтил)-1-циклопропил]пропанамид. 400 мг соединения, полученного в приготовлении 1, растворяют в смеси СН 2 Сl2/Н 2 О (5:5 мл) в присутствии карбоната натрия. 1,5 экв пропанового ангидрида добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля (элюент: CH2Cl2/i-РrОН 95 : 5) получая белое твердое вещество, которое рекристаллизуют из смеси гексана/СН 2 Сl2. Точка плавления: 125 С. Элементный микроанализ: Теоретически Экспериментально Пример 3. N-[транс-2-(7-метокси-1-нафтил)-1-циклопропил]бутанамид. 150 мг (0,7 ммоль) соединения, полученного в приготовлении 1, растворяют в 10 мл безводного CH2Cl2 в присутствии 146 мкл (1,5 экв) триэтиламина. При 0 С в аргоне по каплям добавляют 87 мкл (1,2 экв) хлорангидрида масляной кислоты. После перемешивания в течение одного часа реакционную смесь гидролизуют и амид экстрагируют с помощью СН 2 Сl2. После хроматографии на колонке силикагеля(элюент:CH2Cl2/i-PrOH 95:5) полученное в результате белое твердое вещество рекристаллизуют из смеси гексана/CH2Cl2. Точка плавления: 119 С. Элементный микроанализ: Теоретически Экспериментально Пример 4. N-[транс-2-(7-метокси-1-нафтил)-1-циклопропил]циклопропанкарбоксамид. 180 мг (0,7 ммоль) соединения, полученного в приготовлении 1 растворяют в 10 мл безводного CH2Cl2 в присутствии 141 мкл (1,5 экв) триэтиламина. При 0 С в атмосфере аргона добавляют по каплям 84 мкл (1,2 экв) циклопропанкарбонилхлорида. После перемешивания в течение одного часа реакционную смесь гидролизуют и амид экстрагируют СН 2 Сl2. После хроматографии на колонке силикагеля (элюент:СН 2 Сl2/i-РrОН 95:5) полученное в результате белое твердое вещество рекристаллизуют из смеси гексана/СН 2 Сl2. Точка плавления: 165 С. Элементный микроанализ: Теоретически ЭкспериментальноCH2Cl2/H2O (10:10 мл) в присутствии карбоната натрия. 200 мкл (1,5 экв) уксусного ангидрида добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля(элюент: CH2Cl2/i-PrOH 90:10) и получают в результате белое твердое вещество, которое рекристаллизуют из смеси гексана/СН 2 Сl2. Точка плавления: 128 С. Элементный микроанализ: Теоретически ЭкспериментальноCH2Cl2/H2 (10:10 мл) в присутствии карбоната натрия. 215 мкл (1,2 экв) пропионового ангидрида добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля (элюент: CH2Cl2/i-PrOH 98:2) и получают белое твердое вещество, которое рекристаллизуют из смеси гексана/СН 2 Сl2. Точка плавления: 135 С. Элементный микроанализ: Теоретически+1/3 Н 2 О Экспериментально(10:10 мл) в присутствии карбоната натрия. 43 мкл (1,2 экв) ангидрида масляной кислоты добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля(элюент: CH2Cl2/i-PrOH 95:5) с получением масла, которое медленно кристаллизуют при комнатной температуре из гексана/СН 2 Сl2. Пример 8. N-[транс-2-(2-метокси-1-нафтил)-1-циклопропил]ацетамид. 500 мг соединения, полученного в приготовлении 3, растворяют в смеси CH2Cl2/H2(10:10 мл) в присутствии карбоната натрия. 332 мкл (1,5 экв) уксусного ангидрида добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля (элюент:CH2Cl2/i-PrOH 90:10) и получают масло, которое медленно кристаллизуют из смеси гексана/СН 2 Сl2.(10:10 мл) в присутствии карбоната натрия. 400 мкл (1,5 экв) пропионового ангидрида добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля (элюент:CH2Cl2/i-PrOH 95:5) и получают масло, которое медленно кристаллизуют из смеси гексана/СН 2 Сl2. Точка плавления: 144 С. Элементный микроанализ: Теоретически Экспериментально(10:10 мл) в присутствии карбоната натрия. 460 мкл (1,5 экв) ангидрида масляной кислоты добавляют по каплям при 0 С. Полученный в результате неочищенный амид очищают с помощью хроматографии на колонке силикагеля(элюент: CH2Cl2/i-PrOH 95:5) и получают белое твердое вещество, которое рекристаллизуют из смеси гексана/CH2Cl2. Точка плавления: 113 С. Элементный микроанализ: Теоретически ЭкспериментальноN-[транс-2-(2-метокси-1 нафтил)-1-циклопропилметил]ацетамид. 1,6 мл (5 экв) уксусного ангидрида и шпатель никеля Ренея добавляют к 700 мг (3,1 ммоль) соединения, полученного в приготовлении 17, растворенного в ТГФ. После выдерживания в течение 24 ч при комнатной температуре в атмосфере водорода остаток подвергают хроматографии на колонке силикагеля (элюент:CH2Cl2/i-PrOH 95:5). Ожидаемый ацетамид получают в виде масла, которое кристаллизуют,получая белое твердое вещество, которое кристаллизуют из смеси гексана/CH2Cl2. Точка плавления: 96 С. Пример 12. N-[транс-2-(2-метокси-1-нафтил)-1-циклопропилметил]пропанамид. 1 мл (3 экв) пропионового ангидрида и шпатель никеля Ренея добавляют к 600 мг (3,1 ммоль) соединения, полученного в приготовлении 17, растворенного в 20 мл ТГФ. После выдерживания в течение 5 ч при 50 С в атмосфере 18 водорода остаток хроматографируют на колонке силикагеля (элюент: CH2Cl2; CH2Cl2/i-PrOH 98:2). Названное в заголовке соединение получают в виде бесцветного масла. Элементный микроанализ: Теоретически+1/5 Н 2O Экспериментально Пример 13. N-[транс-2-(2-метокси-1-нафтил)-1-циклопропилметил]бутанамид. 1,2 мл (3 экв) ангидрида масляной кислоты и шпатель никеля Ренея добавляют к 550 мг (2,5 ммоль) соединения, полученного в приготовлении 17, растворенного в 20 мл ТГФ. После выдерживания в течение 4 ч при 50 С в атмосфере водорода остаток хроматографируют на колонке силикагеля (элюент: СН 2 Сl2; CH2Cl2/i-PrOH 98:2). Названное в заголовке соединение получают в виде бесцветного масла. Элементный микроанализ: Теоретически+1/4 Н 2O Экспериментально Примеры с 14 по 17 получают таким же способом, как в примере 1, начиная с соответствующих приготовлений. Пример 14. N-[транс-2-(5-метоксибензо[b]фуран-3-ил)циклопропил]ацетамид. Исходное вещество: приготовление 4 Пример 15. N-[транс-2-(5-метокси-2-фенилбензо[b]фуран-3-ил)циклопропил]ацетамид. Исходное вещество: приготовление 7 Пример 16. N-[транс-(7-метокси-3-фенил 1-нафтил)-1-циклопропил]ацетамид. Исходное вещество: приготовление 12 Пример 17. N-[тpaнс-2-(8,9-дигидро-7Hфypo[3,2-f]хромен-1-ил)-1-циклопропил]ацетамид. Исходное вещество: приготовление 16 Примеры с 18 по 20 получают таким же способом, как в примере 2, начиная с соответствующих приготовлений. Пример 18. Н-[транс-2-(5-метокси-1 Н-пирроло[2,3-b]пиридин-3-ил)циклопропил]пропанамид. Исходное вещество: приготовление 6 Пример 19. N-[транс-2-(5-метоксибензо[b]тиофен-3-ил)циклопропил]пропанамид. Исходное вещество: приготовление 9 Пример 20. N-[транс-2-7-метокси-3-[3(трифторметил)фенил]-1-нафтилциклопропил]пропанамид. Исходное вещество: приготовление 13 Примеры с 21 по 23 получают таким же способом, как в примере 3, начиная с соответствующих приготовлений. Пример 21. N-[транс-2-(5-метоксибензо[b]тиофен-3-ил)циклопропил]бутанамид. Исходное вещество: приготовление 5N-[транс-2-(5-метокси-2 фенил-1 Н-пирроло[2,3-b]пиридин-3-ил)циклопропил]бутанамид. Исходное вещество: приготовление 14 Примеры с 24 по 26 получают таким же способом, как в примере 4, начиная в соответствующих приготовлений. Пример 24.N-[транс-2-(5-метокси-2 бензилбензо[b]тиофен-3-ил)циклопропил]-1 циклопропанкарбоксамид. Исходное вещество: приготовление 11 Пример 26. N-[транс-2-(2,5-дигидро-1 Нбензо[fхромен-10-ил)циклопропил]-1-циклопропанкарбоксамид. Исходное вещество: приготовление 16 Примеры с 27 по 30 получают таким же способом, как в примере 11, начиная с соответствующих приготовлений. Пример 27. N-[транс-2-(2-метокси-1-нафтил)-1-циклопропилметил]ацетамид. Исходное вещество: приготовление 17 Пример 28. N-[транс-2-(2-метокси-3-фенилнафтил)-1-циклопропилметил]ацетамид. Исходное вещество: приготовление 20 Пример 29. N-[транс-2-(5-метокси-2-[3(трифторметил)бензил]бензо[b]-тиофен-3 ил)метил]ацетамид. Исходное вещество: приготовление 23 Пример 30. N-транс-2-(2,3-дигидро-1 Нбензо[f]хромен-10-ил)-1-циклопропил]-метилацетамид. Исходное вещество: приготовление 25 Примеры с 31 по 34 получают таким же способом, как в примере 12, начиная с соответствующих приготовлений. Пример 31. N-[транс-2,7-диметокси-1 нафтил)-1-циклопропилметил]пропанамид. Исходное вещество: приготовление 18 Пример 32. N-[транс-2-(5-метокси-2-фенилбензо[b]фуран-3-ил-циклопропилметил]пропанамид. Исходное вещество: приготовление 21 Пример 33.N-транс-2-(5-метокси-1 метил-2-фенил-1 Н-пирроло[2,3-b]-пиридин-3 ил)-циклопропил]метилпропанамид. Исходное вещество: приготовление 24 Пример 34. N-транс-[2-(8,9-дигидро-7 Нфуро[3,2-f]-хромен-1-ил)-циклопропил]метилпропанамид. Исходное вещество: приготовление 26 Примеры с 35 по 36 получают таким же способом, как в примере 13, начиная с соответствующего приготовления. 20 Пример 35. N-[транс-2-(7-метокси-1-нафтил)циклопропилметилбутанамид. Исходное вещество: приготовление 19 Пример 36. N-[транс-2-(5-этилбензо[b] тиофен-3-ил)-циклопропилметил]бутананамид. Исходное вещество: приготовление 22 Пример 37. N-[3-(2-метокси-1-нафтил)циклобутил]ацетамид. Получают таким же способом, как в примере 1, начиная с соединения, полученного в приготовлении 27. Пример 38. N-[3-(2,7-диметокси-1-нафтил)циклогексил]пропанамид. Получают таким же способом, как в примере 2, начиная с соединения, полученного в приготовлении 28. Пример 39. N-[3-(2,7-диметокси-1-нафтил)циклопентил]-N'-метилмочевина. Названный в заголовке продукт получают путем конденсации метилизоцианата с соединением, полученным в приготовлении 29. Пример 40.N-2-[(7-метокси-1-нафтил)метил]циклопропилбутанамид. Получают таким же способом, как в примере 3, начиная с соединения, полученного в приготовлении 30. Пример 41. N-(2-[(7-метокси-3-фенил-1 нафтил)метил]циклопропил-метил)пропанамид. Получают таким же способом, как в примере 12, начиная с соединения, полученного в приготовлении 31. Пример 42. 2-(8,9-дигидро-7 Н-фуро[3,2f]xpoмeн-1-ил-метил)-N-метилциклопропанкарбоксамид. Названный в заголовке продукт получают путем конденсации N-метиламина с соединением, полученным в приготовлении 32 в присутствии связывающего агента. Пример 43. N-аллил-2-[5-метокси-2-(3 метоксифенил)-1-бензофуран-3-ил]метилциклопентанкарбоксамид. Названный в заголовке продукт получают путем конденсации N-аллиламина с соединением, полученным в приготовлении 33 в присутствии связывающего агента. Пример 44. N-(бромэтил)-2-[(5-метоксифуро[2,3-b]пиридин-3-ил)метил]-циклобутанкарбоксамид. Названный в заголовке продукт получают путем конденсации N-(бромметил)амина с соединением, полученным в приготовлении 34 в присутствии связывающего агента. Пример 45. N-2-[(5-этил-1-бензотиофен 3-ил)метил]циклогексил-бутанамид. Получают таким же способом, как в примере 2, начиная с соединения, полученного в приготовлении 35. Пример 46. N-[2-(5-этил-1-бензотиофен-3 ил)циклобутил]циклопропанкарбоксамид. 21 Получают таким же способом, как в примере 4, начиная с соединения, полученного в приготовлении 36. Пример 47.N-[2-(8,9-дигидро-7 Н-фуро[3,2-f]хромен-1-ил)циклобутил]-2-метилпропанамид. Получают, как в примере 4, заменяя циклопропанкарбонилхлорид на хлорид 2 метилпропионовую кислоту. Пример 48. N-[2-(5-метокси-1-Н-пирроло[3,2-b]пиридин-3-ил)циклопентил]-бутанамид. Получают таким же способом, как в примере 2, начиная с соединения, полученного в приготовлении 38. Фармакологическое исследование Пример А. Определение острой токсичности. Острую токсичность оценивали после орального применения в группах, состоящих из 8 мышей (262 г). Животных обследовали с регулярными интервалами в течение первого дня курса и ежедневно в течение двух недель,следующих после обработки. ОпределяласьLD50(доза, вызывающая смерть 50% животных),которая показала низкую токсичность соединений изобретения. Пример В. Анализ связывания с мелатониновым рецептором клеток pars tuberalis (задней доли гипофиза) овцы. Анализ связывания с мелатониновым рецепторами соединений изобретения проводили в соответствии с общепринятой методикой наpars tuberalis клеток овцы. Pars tuberalis аденогипофиза в действительности характеризуется у млекопитающих высокой чувствительностью мелатониновых рецепторов (Journal of Neuroendocrinology, 1, pp. 1-4,1989). Схема: 1) Мембраны pars tuberalis овцы подготавливают и используют в качестве ткани-мишени в экспериментах по поглощению для определения связывающей способности и сродства к 2[125I]-йодмелатонину. 2) Мембраны pars tuberalis овцы используются в качестве ткани-мишени в экспериментах по конкурентному связыванию с использованием различных тестируемых соединений в сравнении с мелатонином. Каждый эксперимент проводили трижды и в различных концентрациях для каждого соединения. Результаты после статистической обработки дают возможность определить сродство к связыванию тестируемых соединений. Результаты Соединения изобретения проявляют сильное сродство по отношению к мелатониновым рецепторам. Пример С: Анализ связывания с мелатониновыми mt1 и MT2 рецепторами Эксперименты по связыванию с рецептором mt1 и MT2 проводились с использованием 2 002818[125I]-мелатонина в качестве сравнительного радиолиганда. Остаточная радиоактивность определяется с использованием жидкого сцинцилляционного счетчика Beckman LS 6000. Эксперименты по конкурентному связыванию выполнялись трижды с использованием различных тестируемых соединений. Каждое соединение тестировалось в различных концентрациях. Результаты дают возможность определить сродство тестируемых соединений к связыванию (IC50). Величина (IC50), определенная для соединений изобретения, показывает, что связывание тестируемых соединений очень сильное как дляmt1, так и для МТ 2 подвидов рецепторов,значения в интервале от 0,1 до 10 нМ. Пример D. Анализ с четырьмя пластинами. Соединения по изобретению вводились через пищевод группам мышей по 10 штук в каждой. Одна группа получала сироп камеди. Подлежащих исследованию после введения продукта тридцать мышей помещали в клетки, пол которых состоял из четырех металлических пластин. Каждый раз, когда животные переходили с одной пластины на другую, они получали легкий электрический шок (0,35 мА). Регистрировали число перемещений в минуту с одной пластины на другую. Применение соединений изобретения значительно снижало число перемещений с одной пластины на другую, что демонстрирует анксиолитическую активность соединений изобретения. Пример Е. Действие соединений изобретения на циркадный ритм и локомоторную активность крыс. Включение мелатонина в воздействие на множество физиологических, биохимических и поведенческих циркадных ритмов, связанных с чередованием дня и ночи, делает возможным создание фармакологической модели для исследований мелатонинэргических лигандов. Влияние соединений изучалось по ряду параметров и, в частности, по циркадному ритму локомоторной активности, которая является достоверным показателем активности эндогенных циркадных часов. В этом исследовании оценивалось влияние каждого соединения на определенную экспериментальную модель, а именно крыс, помещенных во временную изоляцию (постоянную темноту). Экспериментальная схема Одномесячных самцов крыс Long Evans подвергали, как только они поступали в лабораторию светлому циклу в 12 ч за 24 ч (СТ (светтемнота) 12:12). После 2-3 недель адаптации их помещали в клетки, снабженные колесом, соединенным с регистрирующим устройством для определения фаз локомоторной активности и таким образом регистрируя нихтемеральный (СТ) и циркадный После того, как записанные ритмы показали стабильный характер в световом ритме LD 12:12, крыс помещали в постоянную темноту(ТТ). Спустя три недели, при очевидном установлении свободного курса без применения препарата (ритма, отражающего зависимость от эндогенных часов), крысам давали дневную норму тестируемого соединения. Наблюдение проводилось в виде визуального наблюдения за ритмом активности: влияние светового ритма на ритм активности,исчезновение влияния на ритмы в постоянной темноте,влияние ежедневного применения соединений,преходящий и стойкий эффект. Программное обеспечение делает возможным измерить длительность и интенсивность активности, период ритма животных в течение свободного курса и во время лечения препаратом,возможность показать путем спектрального анализа существование циркадного и нециркадного (например ультрадианного) компонентов. Результаты Соединения изобретения проявляют очевидное мощное воздействие на циркадный ритм посредством мелатонинэргической системы. Пример F. Противоаритмическая активность. Схема:Expert., 1968, 160 pp.22-31) Тестируемое вещество вводилось интраперитонеально группе из 3 мышей за 30 мин до введения наркоза с помощью хлороформа. Затем за животными наблюдали в течение 15 мин. Отсутствие регистрации аритмии и частоты сердцебиения выше 200 ударов в минуту (контроль: 400-480 ударов в минуту), по крайней мере, у двух животных указывает на значительную защиту. Пример G. Фармацевтическая композиция: таблетки 1000 таблеток, каждая из которых содержит 5 мгN-[транс-2-(7-метокси-1-нафтил)-1-циклопропил]ацетамида (пример 1) 5 г Пшеничный крахмал Кукурузный крахмал Лактоза Стеарат магния Кремний Гидроксипропилцеллюлоза- кольцевую систему формулы (II) где R может быть заместителем в любом положении кольцевой системы II,- или А представляет кольцевую систему формулы (III) где Z представляет собой атом кислорода, атом серы или группу NR1 (где R1 представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,D' представляет бензольное кольцо или пиридиновое кольцо,где R замещает D' кольцо, a G1 замещает другое кольцо, при этом следует понимать, что кольцевые системы формулы (II) или (III) помимо R и G1 групп могут быть замещены однойтремя одинаковыми или различными группами,выбранными из линейной или разветвленной(С 1-С 6)алкоксигруппы, арила и арил-(С 1 С 6)алкила, где алкильная часть может быть линейной или разветвленной;R представляет собой Ra, ORa или SRa группу, где Ra представляет собой линейный или разветвленный (С 1-С 6)алкил,или образует с несущим его атомом углерода и со смежным атомом углерода кольцо формулы (IV) где Е представляет собой атом кислорода или атом серы, где полученное в результате кольцо содержит от 5 до 7 атомов;G1 и G2, которые могут быть одинаковыми или различными, представляют собой простую связь или алкиленовую цепь -(СН 2)t- (где t представляет 1, 2, 3 или 4); р обозначает 0, 1, 2, 3 или 4,q обозначает 0, 1, 2, 3 или 4, причем 1p+q4; В представляет собой группу -NR1aC(Q)R2a,1-NR aC(Q)NR2aNR3a или C(Q)NR1aNR2a,где Q представляет собой атом кислорода или серы,R1a обозначает водород,R2a обозначает группу, выбранную из линейного или разветвленного (С 2-С 6)алкенила,(С 3-С 8)циклоалкила и линейного или разветвленного (С 1-С 6)алкила, который может быть необязательно замещен атомом галогена, иR3a обозначает водород, при этом следует понимать, что"арил" предусматривает группу, выбранную из фенила, нафтила или бифенила, причем каждая из этих групп может быть замещена од 25 ним или большим количеством одинаковых или различных радикалов, выбранных из гидрокси,линейного или разветвленного (С 1-С 6)алкокси,линейного или разветвленного (С 1-С 6)алкила,линейного или разветвленного полигалоген-(С 1 С 6)алкила, циано, карбокси, линейного или разветвленного (С 1-С 6)алкоксикарбонила, нитро,амино или атомов галогена,под "гетероарилом" следует понимать любую моно- или полициклическую ароматическую группу, содержащую от 5 до 10 атомов и содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода или серы, причем эти группы могут быть замещены одним или большим количеством радикалов, выбранных из гидрокси, линейного или разветвленного (С 1 С 6)алкокси, линейного или разветвленного (С 1 С 6)алкила, линейного или разветвленного полигалоген-(C1-С 6)алкила, циано, карбокси, линейного или разветвленного (С 1-С 6)алкоксикарбонила, нитро, амино или атома галогена,при условии, что- когда А представляет собой группу нафталина, незамещенную или замещенную одной метокси или одной метильной группой, G1 и G2 одновременно представляют простую связь, и В представляет или NHCOMe, исключено, чтобы (q=0 и р=4) или (q=4 и р=0),- когда А представляет собой индольную группу, замещенную в положении 2 группой В не может представлять собой группу мочевины; их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, где р представляет 1, 2, 3 или 4 и q представляет 0(или р представляет 0 и q представляет 1, 2, 3 или 4); их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, где р представляет 1 и q представляет 0 (или р представляет 0 и q представляет 1), их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.3, отличающиеся тем, что R-A-G1 и G2-В группы имеют транс-конфигурацию; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, где R представляет ОRa, SRa или Ra группу; их энантиомеры и диастереоизомеры и соли присоеди 002818 26 нения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, где R представляет ORa группу; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по п.1, где R образует вместе с несущим его атомом углерода и смежным атомом углерода кольцо формулы(IV), их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по п.1, где А представляет кольцевую систему формулы (II),замещенную в 7 положении группой R и в 1 или 2 положении - G1, причем А является незамещенной или замещенной (в том числе заместителями R и G1) в положении 2 или 3; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по п.1, где А представляет кольцевую систему формулы (III),замещенную в 5 положении R и в 3 положенииG1, причем А является незамещенной или замещенной (помимо заместителями R и G1) во 2 положении; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по п.1, где G1 представляет простую связь и G2 представляет простую связь или группу СН 2, их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по п.1, где В представляет -NHCOR2a или -CONHRa группу; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по п.1, где А замещен- необязательно алкокси, арильной или арилалкильной группой; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по п.1, где А представляет нафталин, хроман или бензохроман,- замещенные в 1 и 2 положении (формулы- необязательно замещенную в 3 положении (формула II) арильной или арилалкильной группой, или во 2 положении (формула II) алкоксигруппой; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по п.1, где А представляет бензотиофен, бензофуран, индол или азаиндол,- замещенные в 3 положении (формула III) группой формулы (V) где n представляет 0 или 1, и В' представляет- необязательно замещенные во 2 положении (формула III) арильной или арилалкильной группой; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 15. Соединения формулы (I) по п.1, где А представляет собой нафталин,- замещенные в 1 положении группой формулы (V) где n представляет 0 или 1 и В' представляет- необязательно замещенные в 3 положении арильной или арилалкильной группой или во 2 положении ORa группой; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 16. Соединения формулы (I) по п.1, которые представляют собойN-[2-(2-метокси-1-нафтил)-1-циклопропил]бутанамид,N-[2-(2-метокси-1-нафтил)-1-циклопропилметил]ацетамид,N-[2-(2-метокси-1-нафтил)-1-циклопропилметил]пропанамид,N-[2-(2-метокси-1-нафтил)-1-циклопропилметил]бутанамид; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 17. Соединения формулы (I) по п.15, отличающиеся тем, что -(СН 2)n-В и R-A-G1- группы имеют транс-конфигурацию; их энантиомеры и диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием. 18. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (VI) где R, A, G1, G2, р и q такие, как определены выше,которое подвергают после активации переведением в хлорангидрид кислоты или в присутствии связывающего агента воздействию с амином HNR1aR2a, где R1a и R2a такие, как определено выше, с получением соединения формулы (I/a), частного случая соединения формулы(I) где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше,которое может быть подвергнуто действию тионирующего агента для получения соединения формулы (I/b), частного случая соединений формулы (I) где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше; или подвергают, после превращения в соответствующий азид, перегруппировке Куртиуса с получением, после гидролиза, амина формулы (VII) где R, A, G1, G2, p и q такие, как определено выше,который либоClCOR2a или соответствующим смешанным или симметричным ангидридом, где R2a такой, как определено выше, для получения соединения формулы (I/с), частного случая соединений формулы (I) где R, A, G1, G2, R2a, p и q такие, как определено выше,причем эти соединения формулы (I/с) могут быть подвергнуты воздействию тионирующего агента с получением соединений формулы(I/f), частного случая соединений формулы (I) где R, A, G1, G2, R1a, R2a, p и q такие, как определено выше, илиQ =С = N-R2a (IX) 2 где Q и R a такие, как определено выше,с получением соединения формулы (I/g),частного случая соединений формулы (I) 30 причем соединения с (I/a) по (I/g) представляют всю совокупность соединений формулы (I) и могут быть очищены в соответствии с общепринятыми методиками очистки, превращены при желании в соли присоединения с фармацевтически приемлемыми кислотами и основаниями и необязательно разделены на изомеры в соответствии с общепринятыми методиками разделения. 19. Фармацевтические композиции, включающие продукты формулы (I) по любому из пп.1-17 или их соли присоединения с фармацевтически приемлемой кислотой или основанием в сочетании с одним или большим количеством фармацевтически приемлемых эксципиентов. 20. Применение соединений формулы (I) по любому из пп.1-17 или их фармацевтически приемлемых солей с кислотами или основаниями в комбинации с одним или более фармацевтически приемлемыми эксципиентами в качестве средств для лечения нарушений мелатонинэргической системы.
МПК / Метки
МПК: C07D 307/80, A61K 31/343, C07C 233/06
Метки: циклоалкиленовую, новые, соединения, цепь, фармацевтические, способ, имеющие, композиции, циклические, получения, включающие
Код ссылки
<a href="https://eas.patents.su/16-2818-novye-ciklicheskie-soedineniya-imeyushhie-cikloalkilenovuyu-cep-sposob-ih-polucheniya-i-vklyuchayushhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые циклические соединения, имеющие циклоалкиленовую цепь, способ их получения и включающие их фармацевтические композиции</a>
Предыдущий патент: Соединения сульфоновой кислоты или сульфониламино-n-(гетероаралкил)азагетероциклиламида
Следующий патент: Циклическое пептидное соединение и его применение, бициклопептидное соединение, пептидное соединение и его применение, фармацевтическая композиция
Случайный патент: Система управления проведением азартных игр




















