Способ получения силденафила
Номер патента: 19160
Опубликовано: 30.01.2014
Авторы: Лю Чжэн, Чжу И, Шэнь Цзиншам, Ван Чжэнь, Бомбек Сергея, Тянь Гуанхуй, Стропник Тадей
Формула / Реферат
1. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов
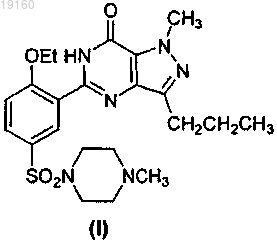
включающий стадии получения соединения формулы (III)
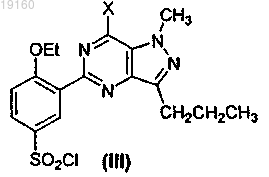
путем циклизации соединения формулы (VII)
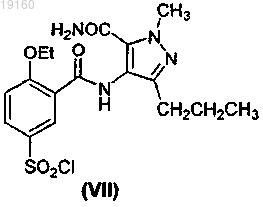
в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (II)
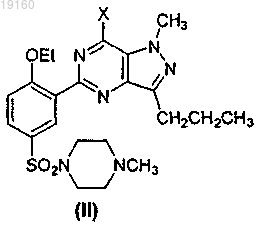
из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты.
2. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадию получения соединения формулы (III) путем галогенирования соединения формулы (VIII)
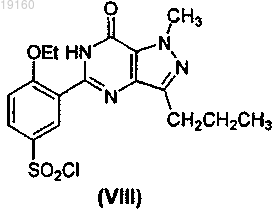
в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты.
3. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадии получения соединения формулы (IV) путем циклизации соединения формулы (V)
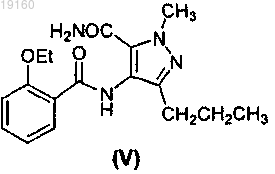
в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (III) хлорсульфонированием соединения формулы (IV) в присутствии хлорсульфоновой кислоты, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты.
4. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадию получения соединения формулы (IV) путем галогенирования соединения формулы (X)
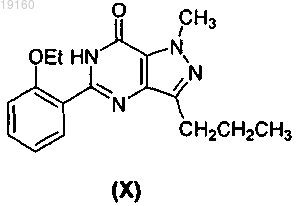
в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (III) хлорсульфонированием соединения формулы (IV)
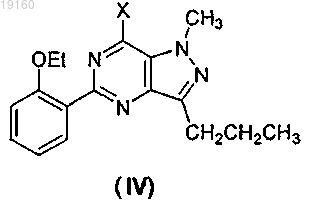
в присутствии хлорсульфоновой кислоты, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты.
5. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадию получения соединения формулы (III) из соединения формулы (V) с применением синтеза в одном и том же сосуде в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, с последующим хлорсульфонированием в присутствии хлорсульфоновой кислоты, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты.
6. Способ по любому из пп.1-5, где X представляет собой Cl или Br.
7. Способ по п.3, где соединение формулы (IV) получают обработкой соединения формулы (V) POX3, или PX3, или PX5, или их смесями при 50-120°C.
8. Способ по п.4, где соединение формулы (IV) получают обработкой соединения формулы (X) POX3, или PX3, или PX5, или их смесями при 50-120°C.
9. Способ по п.7 или 8, где после обработки реакционную смесь выливают в воду, лед или их смеси и отбирают осадок с образованием соединения формулы (IV).
10. Способ по п.2 или 4, где реакцию галогенирования проводят в присутствии бензола, или толуола, или CH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей.
11. Способ по п.1 или 3, где реакцию циклизации проводят в присутствии бензола, или толуола, или CH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей.
12. Способ по п.3 или 4, где соединение формулы (III) получают обработкой соединения формулы (IV) хлорсульфоновой кислотой при 0-50°C.
13. Способ по п.1, где соединение формулы (III) получают нагреванием соединения формулы (VII) в присутствии POX3, или PX3, или PX5, или их смесей при 50-120°C.
14. Способ по п.13, где реакцию циклизации проводят в присутствии бензола, или толуола, или CH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей.
15. Способ по п.2, где соединение формулы (III) получают нагреванием соединения формулы (VIII) в присутствии POX3, или PX3, или PX5, или их смесей при 50-120°C.
16. Способ по п.15, где реакцию галогенирования проводят в присутствии бензола, или толуола, или CH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей.
17. Способ по любому из пп.1-5, где основание выбирают из алкоксидов щелочных металлов, гидридов щелочных металлов, гидридов щелочно-земельных металлов, аминов, металлических производных аминов, гидроксидов, карбонатов, бикарбонатов или их смесей.
18. Способ по любому из пп.1-5, где кислоту выбирают из соляной кислоты, серной кислоты, фосфорной кислоты, лимонной кислоты, винной кислоты, малеиновой кислоты или их смесей.
19. Способ по любому из пп.1-18, дополнительно включающий преобразование соединения формулы (I) в его фармацевтически приемлемую соль или сольват.
20. Способ по п.19, где фармацевтически приемлемая соль представляет собой силденафила цитрат.
21. Способ по п.20, где превращают соединение формулы (I) в силденафила цитрат путем приведения соединения формулы (I) в контакт с лимонной кислотой в подходящем растворителе, предпочтительно метаноле.
22. Способ получения фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль или сольват в комбинации по меньшей мере с одним фармацевтически приемлемым носителем, включающий стадию получения соединения формулы (I) или его фармацевтически приемлемой соли или сольвата по любому из пп.1-21.
23. Соединение формулы (II)
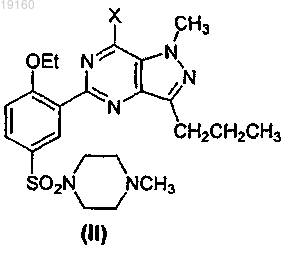
где X представляет собой Cl или Br.
24. Соединение формулы (III)
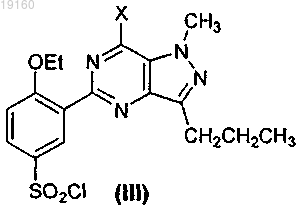
где X представляет собой Cl или Br.
Текст
Изобретение относится к способу получения соединения формулы (I), включающему стадию превращения соединения, которое выбрано из группы, состоящей из соединений формул (II),(III) или (IV), где X представляет собой галоген, в ходе одной или более стадий с образованием соединения формулы (I). Изобретение также относится к способу получения фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль или сольват. Более того, изобретение относится к промежуточным продуктам, пригодным для применения в вышеупомянутых способах, а также к способам их получения. Настоящее изобретение относится к способу получения силденафила и его фармацевтически приемлемых солей и сольватов. Изобретение также направлено на способ получения фармацевтической композиции, включающей силденафил или его фармацевтически приемлемую соль или сольват. Более того, изобретение относится к промежуточным соединениям, пригодным для применения в вышеуказанных способах, а также к способам их получения. Предшествующий уровень техники Соединение формулы (I) имеющее химическое название 5-[2-этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-1-метил-3-нпропил-1,6-дигидро-7 Н-пиразоло[4,3-альфа]пиримидин-7-он, также известно под родовым наименованием силденафил. Первоначально соединение применяли для лечения сердечно-сосудистых заболеваний, таких как стенокардия, гипертензия, сердечная недостаточность, атеросклероз и т.д. Позднее было обнаружено, что это соединение, в частности, применимо для лечения эректильной дисфункции у мужчин. Силденафил является селективным ингибитором фосфодиэстеразы типа 5. Это соединение и его получение были первоначально описаны в ЕР-А-0463756 (соответствует CN1057464A), а также было обнаружено, что соединение применимо при лечении некоторых сердечно-сосудистых заболеваний. Его применение при лечении эректильной дисфункции у мужчин было впервые описано в WO-A-94/28902(соответствует CN1124926A). Улучшенный способ получения силденафила был описан в ЕР-А-О 812845(соответствует CN1168376A). CN1208337C описывает способ получения силденафила при участии неорганического окислителя. CN1176081C и CN1281851A описывают два способа получения силденафила и его промежуточных соединений, Bioorg. Med. Chem. Lett. 2000, 10, 1983-1986 описывает конвергентный способ с применением реагентов на полимерной подложке в многостадийной реакции, приводящий к чистому и эффективному препарату без необходимости применения традиционных способов очистки.US-B-6 204383 описывает способ, при котором используется меньше основного промежуточного соединения при получении силденафила. WO-A-2001/019827 описывает более дешевый способ получения силденафила метилированием. Большинство способов получения силденафила в предшествующем уровне техники сопровождается побочными реакциями. Поэтому выход конечного продукта уменьшается, что ограничивает применимость способов предшествующего уровня техники в фармацевтической промышленности. Описание изобретения Настоящее изобретение предлагает новый способ получения силденафила и его промежуточных соединений, имеющий много преимуществ по сравнению со способами предшествующего уровня техники,таких как уменьшение побочных реакций и увеличение выхода продукта. Настоящее изобретение относится к способу получения соединения формулы (I) который включает стадию превращения соединения, выбранного из группы, состоящей из соединений формул (II), (III) и (IV): где X представляет собой галоген, предпочтительно Cl или Br,с образованием соединения формулы (I) в ходе одной или более стадий. Настоящее изобретение также относится к соединению формулы (IV) где X представляет собой галоген, предпочтительно Cl или Br. Настоящее изобретение также относится к способу получения соединения формулы (IV), включающему циклизацию соединения формулы (V) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении: или галогенирование соединения формулы (X) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении: где X представляет собой галоген, предпочтительно Cl или Br. Согласно предпочтительному варианту воплощения способа получения соединения формулы (IV) соединение формулы (IV) получают обработкой соединения формулы (V) POX3, PX3, PX5 или их смесями в любом соотношении при 50-120C, предпочтительно при 80-120C, необязательно с последующим выливанием реакционной смеси в воду, лед или их смеси и отбором осадка, который представляет собой целевое соединение формулы(IV); или обработкой соединения формулы (X) POX3, PX3, PX5 или их смесями в любом соотношении при 50-120C, предпочтительно при 80-120C, необязательно с последующим выливанием реакционной смеси в воду, лед или их смеси и отбором осадка, который представляет собой целевое соединение формулы(IV),где X представляет собой галоген, предпочтительно Cl или Br. Реакцию можно необязательно проводить в присутствии бензола, толуола, CH2Cl2, CHCl3,ClCH2CH2Cl, THF (тетрагидрофурана), диоксана или их смесей в любом соотношении. Настоящее изобретение также относится к соединению формулы (III) где X представляет собой галоген, предпочтительно Cl или Br. Настоящее изобретение также относится к способу получения соединения формулы (III), включающему хлорсульфонирование соединения формулы (IV) в присутствии хлорсульфоновой кислоты или циклизацию соединения формулы (VII) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении: или галогенирование соединения формулы (VIII) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении: где X представляет собой галоген, предпочтительно Cl или Br. Согласно предпочтительному варианту воплощения способа получения соединения формулы (III) соединение формулы (III) получают обработкой соединения формулы (IV) хлорсульфоновой кислотой, предпочтительно при температуре 0-50C, более предпочтительно при 0-25C, необязательно с последующим выливанием реакционной смеси в воду, лед или их смеси и отбором осадка с получением целевого соединения формулы (III); или нагреванием соединения формулы (VII) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении при 50-120C, предпочтительно 80-120C, необязательно с последующим выливанием реакционной смеси в воду, лед или их смеси и отбором осадка, который представляет собой целевое соединение формулы (III); или нагреванием соединения формулы (VIII) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении при 50-120C, предпочтительно при 80-120C, необязательно с последующим выливанием реакционной смеси в воду, лед или их смеси и отбором осадка, который представляет собой целевое соединение формулы (III),где X представляет собой галоген, предпочтительно Cl или Br. В процессе получения соединения формулы (III) реакция циклизации и реакция галогенирования могут проводиться в присутствии бензола, толуола, CH2Cl2, CHCl3, ClCH2CH2Cl, THF, диоксана или их смесей в любом соотношении. Настоящее изобретение также относится к соединению формулы (II) где X представляет собой Cl или Br. Настоящее изобретение также относится к способу получения соединения формулы (II), включающему обработку соединения формулы (III) 1-метилпиперазином: или циклизацию соединения формулы (VI) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении: где X представляет собой галоген, предпочтительно Cl или Br. Соединение формулы (II) предпочтительно можно получать растворением соединения формулы (III) в растворителе, выбранном из группы, состоящей из алкилгалогенидов, низших алифатических кетонов и простых эфиров, с последующим добавлением основания и 1-метилпиперазина и отбором целевого соединения из реакционной смеси или циклизацией соединения формулы (VI) в присутствии POX3, PX3, PX5 или их смесей в любом соотношении. Вышеупомянутую реакцию циклизации можно необязательно проводить в присутствии бензола,толуола, CH2Cl2, CHCl3, ClCH2CH2Cl, THF, диоксана или их смесей в любом соотношении. Настоящее изобретение также относится к способу получения соединения формулы (I), где соединение формулы (I) можно получать, исходя из соединения формулы (II) где X представляет собой галоген, предпочтительно Cl или Br. Вышеупомянутую реакцию можно необязательно проводить в растворителе, который выбран из группы, состоящей из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля или их смесей. Кроме того, реакцию необязательно проводить путем добавления основания, такого как алкоксид щелочного металла, гидрид щелочного металла, гидрид щелочноземельного металла, амин, металлическое производное амина, гидроксид, карбонат, бикарбонат или их смеси в любом соотношении, или добавления кислоты, такой как соляная кислота, серная кислота, фосфорная кислота, лимонная кислота, винная кислота, малеиновая кислота или их смеси. В процессе получения соединения формулы (I) предпочтительно можно получить промежуточное соединение (II) вышеупомянутым способом. Согласно определенному варианту воплощения настоящего изобретения способ получения соединения (I) является таким, как изображено на схеме 1. Схема 1 где X представляет собой галоген, предпочтительно Cl или Br. По сравнению со способами, известными из предшествующего уровня техники, настоящее изобретение уменьшает вклад побочных реакций, которые обычно обнаруживаются при циклизации, катализируемой щелочами, а также на других стадиях получения силденафила. Улучшения обеспечивают лучший выход и более простой контроль реакций, что особенно применимо при крупномасштабном производстве. Исходя из соединения формулы (V), соединение формулы (III) можно получить через промежуточное соединение (IV) или с применением синтеза в одном и том же сосуде. По последнему способу соединение формулы (V) подвергают циклизации с последующим добавлением хлорсульфонирующего реагента без промежуточной очистки. Подробный и предпочтительный способ представляет собой следующее. Соединение формулы (V) добавляют в POX3 или PX3, при охлаждении ледяной баней. Через 10 мин смесь медленно нагревают до 80C в течение 1-10 ч. После завершения реакции смесь охлаждают до комнатной температуры и медленно добавляют хлорсульфоновую кислоту. Смесь перемешивают при комнатной температуре в течение 1-5 ч и выливают в воду, дробленый лед или их смесь. Осажденное белое твердое вещество фильтруют и промывают ледяной водой с последующей сушкой под вакуумом с образованием соединения формулы (III). Эту реакцию можно необязательно проводить в соответствующем растворителе, который выбран из бензола, толуола, CH2Cl2, CHCl3, ClCH2CH2Cl, THF, диоксана и их смесей. В ранее описанных способах получения силденафила циклизацию проводят в присутствии сильной щелочи, что обычно приводит к побочным реакциям, например изомеризации пиримидинового скелета и отщеплению 5-этоксигруппы в бензольном кольце. Соответственно, выход является низким. Настоящее изобретение преодолевает недостатки традиционного способа. Циклизацию проводят в присутствииPOX3 или PX3. Циклизованный продукт является устойчивым. Не происходит ни побочная реакция изомеризации пиримидинового скелета, ни отщепление этоксигруппы бензольного кольца. Более того, на последующей стадии хлорсульфонирования остаток POX3 может предотвратить гидролиз соединения формулы (III). Соответственно, выход значительно увеличивается. Соединение формулы (II) предпочтительно получают обработкой соединения формулы (III) 1 метилпиперазином в присутствии агента, удаляющего кислоту. Согласно особенно предпочтительному варианту воплощения соединение формулы (III) растворяют в подходящем растворителе и добавляют агент, удаляющий кислоту. Температуру реакции поддерживают ниже 10C и медленно добавляют 1,1 экв. 1-метилпиперазина. Перемешивание продолжают в течение 1-3 ч при комнатной температуре. Затем добавляют дистиллированную воду и смесь экстрагируют органическим растворителем. Органическую фазу промывают насыщенным NH4Cl и концентрированным солевым раствором и сушат Na2SO4. Растворитель упаривают в вакууме с образованием целевого продукта формулы (II) в виде белого порошка. Подходящий растворитель может быть выбран из алкилгалогенидов, таких как CH2Cl2, CHCl3 илиClCH2CH2Cl; низших алифатических кетонов, таких как ацетон; простых эфиров, таких как THF или монометиловый эфир этиленгликоля или их смесей. Агент, удаляющий кислоту, может быть выбран из неорганических оснований, таких как карбонаты, бикарбонаты или гидроксиды, или из органических оснований, таких как триэтиламин. Реакцию получения силденафила из соединения формулы (II) можно проводить в щелочных, нейтральных или кислых условиях. Предпочтительно основание выбирают из алкоксидов щелочных металлов, гидридов щелочных металлов, гидридов щелочно-земельных металлов, аминов, предпочтительно триэтиламина, металлических производных аминов, гидроксидов, карбонатов, бикарбонатов и их смесей. Предпочтительно кислоту выбирают из соляной кислоты, серной кислоты, фосфорной кислоты, органических кислот, таких как лимонная кислота, винная кислота, малеиновая кислота и их смеси. Предпочтительно растворитель выбирают из группы, состоящей из воды и смеси воды с метанолом, этанолом, изопропанолом, трет-C4H9OH, гликолем и/или монометиловым эфиром этиленгликоля. Например, соединение формулы (II) растворяют в смешанном растворителе, состоящем из воды и трет-бутанола, к которому добавляют 1 экв. NaHCO3. Смесь нагревают при 70C в течение 2 ч с образованием соединения формулы (I). Соединение формулы (III) можно также получить путем циклизации соединения формулы (VII) или галогенирования соединения формулы (VIII): где X представляет собой галоген, предпочтительно Cl или Br. Соединение формулы (IV) может также быть получено путем галогенирования соединения формулы (X): где X представляет собой галоген, предпочтительно Cl или Br. Три вышеуказанные реакции можно проводить в присутствии POX3, PX3, PX5 или их смесей. В альтернативном варианте их можно проводить в растворителях, таких как бензол, толуол, CH2Cl2 CHCl3,ClCH2CH2Cl, или других растворителях. Соединение формулы (II) также можно получить из соединения формулы (VI) в присутствии POCl3: Информацию о получении соединений формул (VIII) и (X) можно также найти в ЕР-А-0463756 (соответствует CN1028758C). Информацию о получении соединения формулы (VI) можно также найти в ЕР-А-0812845 (соответствует CN1106399C). Промежуточное соединение (V) по настоящему изобретению можно получить при помощи традиционных способов, известных в литературе. Например, соединение можно получить обработкой 2-этоксибензоилхлорида 1-метил-3-н-пропил-4-аминопиразол-5-карбоксамидом (XI): Соединение формулы (VII) можно получить из соединения формулы (V) традиционными способами, известными в литературе: Соединения, полученные способом по настоящему изобретению, могут находиться в разных кристаллических формах. Кристаллическая форма соединения формулы (I), т.е. свободное основание силденафила, описывается в Melnikov et al., Journal of Pharmaceutical Sciences, 2003, 92, 2140-2143. Способ по настоящему изобретению может дополнительно включать преобразование соединения формулы (I) в его фармацевтически приемлемую соль или сольват. Предпочтительно приемлемой солью соединения формулы (I) является силденафила цитрат. Способы получения фармацевтически приемлемых солей или сольватов соединения формулы (I) в целом известны специалистам в данной области техники. Такие способы, а также различные соли силденафила и их полиморфные формы в основном описаны в Badwan et al., Analytical Profiles of DrugUniversity, 2002, 19, 173-175. Согласно предпочтительному варианту воплощения соединение формулы (I) превращают в силденафила цитрат путем приведения соединения формулы (I) в контакт с лимонной кислотой в подходящем растворителе, предпочтительно метаноле. Особенно предпочтительный способ получения силденафила цитрата включает следующие стадии:(1) суспендирование свободного основания силденафила в метаноле и нагрев суспензии до 45-65C;(2) добавление лимонной кислоты, предпочтительно безводной лимонной кислоты и метанола к суспензии, полученной на стадии (1), предпочтительно при температуре 50-60C и дополнительно нагрева смеси до кипения с образованием раствора;(3) концентрирование раствора с целью уменьшения объема смеси, предпочтительно менее чем на 50%, более предпочтительно менее чем на 35% ее первоначального объема с целью получения суспензии;(4) охлаждение суспензии до комнатной температуры и(5) извлечение полученных кристаллов, предпочтительно фильтрованием. Изобретение также относится к способу получения фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль или его сольват в комбинации по меньшей мере с одним фармацевтически приемлемым носителем, который включает стадию получения соединения формулы (I) или его фармацевтически приемлемой соли или его сольвата согласно способам по настоящему изобретению, как описано выше. Фармацевтические препараты силденофила и силденафила цитрата можно получить способами, которые хорошо известны специалистам в данной области техники. Применимые составы описаны, например, в ЕР-А-0941075, ЕР-А-0960621, JP-A-10298062, WO-A-2004/017976, WO-A-2004/072079 иIPCOM000146068D. Далее изобретение объясняется в приведенных ниже примерах без ограничения изобретения указанными примерами. Примеры Температуры плавления определяли в открытых капиллярах в аппарате BUCHI-510 для определения температуры плавления и были не отрегулированы. EI-MS (масс-спектрометрия электронного удара) спектры измеряли на спектрометре Finnigan MAT-95 при 70 эВ и температуре ионного источника 200; 1 Н ЯМР спектры определяли в растворе CDCl3 на спектрометре Varian Mercury 300. Все результаты по спектрам находились в хорошем соответствии с ожидаемыми результатами. Для обозначения основных пиков применяли традиционные сокращения: например, s, синглет; d, дублет; t, триплет; q, квартет; m,мультиплет. В рамках настоящих примеров комнатная температура означает 20-25C. Пример 1. Пример получения 1. 1-Метил-3-н-пропил-4-(2-этоксибензамидо)пиразол-5-карбоксамид (V). При охлаждении на ледяной бане в трехгорлой колбе вместимостью 250 мл соединение (XI) (20 г,0,11 моль) растворяли в дихлорметане (100 мл) и триэтиламине (22,2 г, 0,22 моль) с получением раствора. К раствору при температуре ниже 5C добавляли 2-этоксибензоил хлорид и смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию останавливали добавлением воды (40 мл) и разделяли слои. Органическую фазу промывали концентрированным солевым раствором (30 мл) и насыщенным водным раствором гидрокарбоната натрия, сушили над безводным сульфатом натрия и затем концентрировали. Образовавшийся остаток очищали перекристаллизацией из смеси этилацетат/петролейный эфир,получая соединение (V) (31,5 г, выход 87%) в виде белого твердого вещества, температура плавления(Т.пл.) 153-154C. 1 Н ЯМР (CDCl3, 300 МГц):0,93 (3H, t), 1,54 (3H, t), 1,65 (2 Н, m), 2,54 (2 Н, t), 4,06 (3H, s), 4,31 (2 Н,q), 5,62 (1H, br s), 7,05 (1 Н, d), 7,13 (1 Н, t), 7,54 (1 Н, t), 7,91 (1 Н, br s), 8,27 (1 Н, dd), 9,47 (1H, s). Пример получения 1 а. 1-Метил-3-н-пропил-4-(2-этоксибензамидо)пиразол-5-карбоксамид (V). При охлаждении на ледяной бане в трехгорлой колбе вместимостью 250 мл соединение (XI) (21,8 г,0,10 моль) растворяли в этилацетате (200 мл) и триэтиламине (32 мл, 0,23 моль) с получением раствора. К раствору при температуре ниже 5C добавляли 2-этоксибензоил хлорид (17 мл, 0,11 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию останавливали добавлением воды(170 мл) и петролейного эфира (100 мл) и смесь перемешивали еще 0,5 ч. Отфильтровывали твердое вещество и помещали в воду (170 мл), перемешивали в течение 0,5 ч, фильтровали и сушили (70C, 12 ч) с образованием соединения (V) в виде белого твердого вещества (32,0 г, выход 95%). Т.пл. 153-154C. Образовавшийся остаток очищали перекристаллизацией из смеси этилацетат/петролейный эфир. 1 Н ЯМР (CDCl3, 300 МГц):0,93 (3H, t), 1,54 (3H, t), 1,65 (2 Н, m), 2,54 (2 Н, t), 4,06 (3H, s), 4,31 (2 Н,q), 5,62 (1H, br s), 7,05 (1 Н, d), 7,13 (1 Н, t), 7,54 (1 Н, t), 7,91 (1 Н, br s), 8,27 (1 Н, dd), 9,47 (1 Н, s) Пример получения 2. 4-[2-Этокси-5-(хлорсульфонил)бензамидо]-1-метил-3-н-пропилпиразол-5-карбоксамид (VII). При охлаждении на ледяной бане соединение формулы (V) (5 г, 0,015 моль) порциями добавляли к хлорсульфоновой кислоте (10 мл). Смесь перемешивали в течение 30 мин и затем убирали ледяную баню. Реакция продолжалась еще 2 ч. Остаток помещали в ледяную воду. Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме с получением (VII) (3,5 г) в виде белого твердого вещества с выходом 54%. 1 Н ЯМР (CDCl3, 300 МГц):0,94 (3H, t), 1,62 (3H, t), 1,66 (2 Н, m), 2,53 (2 Н, t), 4,06 (3H, s), 4,46 (2 Н,q), 5,72 (1 Н, s), 7,25 (1 Н, t), 7,62 (1 Н, s), 8,18 (1 Н, dd), 8,95 (1 Н, d), 9,20 (1 Н, s). Пример получения 3. 7-Хлор-1-метил-5-(2-этоксифенил)-3-н-пропил-1 Н-пиразоло[4,3-альфа]пиримидин (IV) (X=Cl). Способ 1. При охлаждении на ледяной бане в трехгорлую колбу вместимостью 50 мл добавляли соединение(V) (5 г, 0,015 моль). Для получения раствора в колбу по каплям добавляли POCl3 (20 мл). Раствор нагревали при 80C в течение 2 ч, чтобы остановить реакцию смесь выливали в ледяную воду и затем смесь экстрагировали дихлорметаном (330 мл). Органическую фазу промывали концентрированным солевым раствором (210 мл) и сушили над безводным сульфатом натрия (2 г), с последующим концентрированием в вакууме с получением соединения (IV) (X=Cl, 4,1 г, выход 82%). 1 Н ЯМР (CDCl3, 300 МГц):1,03 (3H, t), 1,38 (3H, t), 1,90 (2 Н, m), 3,10 (2 Н, t), 4,15 (2 Н, q), 4,38 (3H,s), 7,03 (1 Н, d), 7,07 (1 Н, t), 7,42 (1 Н, t), 7,79 (1 Н, dd).EI-MS m/z 330 (М+, 76), 332 (25), 315 (52), 317 (15), 294 (100), 296 (32), 279 (60), 261 (28), 159 (20). Способ 2. При охлаждении на водяной бане в трехгорлую колбу вместимостью 50 мл добавляли соединение(X) (5 г, 0,015 моль). Для получения раствора в колбу по каплям добавляли POCl3 (20 мл). Раствор нагревали при 80C в течение 2 ч, для остановки реакции смесь выливали в ледяную воду и затем смесь экстрагировали дихлорметаном (330 мл). Органическую фазу промывали концентрированным солевым раствором (210 мл) и сушили над безводным сульфатом натрия (2 г), далее концентрировали в вакууме,-7 019160 получая соединение (IV) (X=Cl, 4,4 г, выход 83%) в виде белого твердого вещества. Способ 3. Соединение (V) (5 г, 0,015 моль) растворяли в бензоле (20 мл). При охлаждении на ледяной бане в раствор по каплям добавляли раствор POCl3 (2,8 мл) в бензоле и затем убирали ледяную баню. Реакционную смесь нагревали при 80C в течение 3 ч и затем бензол удаляли перегонкой при пониженном давлении. Остаток выливали в ледяную воду (20 мл) и раствор экстрагировали дихлорметаном (330 мл). Органическую фазу промывали концентрированным солевым раствором (210 мл), сушили над безводным сульфатом натрия (2 г), далее концентрировали в вакууме, получая соединение (IV) (X=Cl, 3,6 г, выход 72%) в виде белого твердого вещества. Пример получения 4. 7-Хлор-1-метил-5-[2-этокси-5-(хлирсульфонил)фенил]-3-н-пропил-1H-пиразоло[4,3 альфа]пиримидин (III) (X=Cl). Способ 1. При охлаждении на ледяной бане в трехгорлую колбу вместимостью 50 мл добавляли соединение(V) (5 г, 0,015 моль) и затем добавляли POCl3 (10 мл). Реакционную смесь нагревали при 80C в течение 2 ч и образовавшийся раствор охлаждали до температуры ниже 5C. Через 30 мин к реакционной смеси добавляли хлорсульфоновую кислоту (10 мл), убирали ледяную баню и далее реакционную смесь при комнатной температуре перемешивали в течение 2 ч. Смесь выливали в ледяную воду (20 мл). Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме в течение 3 ч, получая соединение (III) (Х=Cl, 5,7 г) с выходом 88%,Т.пл. 155-156C. 1 Н ЯМР (CDCl3, 300 МГц):1,04 (3H, t), 1,43 (3H, t), 1,89 (2 Н, m), 3,09 (2 Н, t), 4,27 (2 Н, q), 4,42 (3H,s), 7,19 (1 Н, d), 8,10 (1 Н, dd), 8,46 (1 Н, d).EI-MS m/z 430 (31), 428 (М+, 41), 413 (45), 415 (34), 393 (20), 357 (24), 328 (25), 292 (100). Способ 2. При охлаждении на ледяной бане в колбу вместимостью 50 мл добавляли соединение (IV) (X=Cl,3 г) и затем для получения раствора хлорсульфоновую кислоту (6 мл). Через 30 мин убирали ледяную баню. Далее реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем смесь выливали в ледяную воду (15 мл). Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме при 35C в течение 3 ч, получая соединение (III) (X=Cl, 2,8 г, выход 72%). Способ 3. В колбу вместимостью 50 мл добавляли соединение (VII) (5 г, 0,012 моль) и затем для получения раствора медленно добавляли POCl3 (10 мл). Реакционную смесь нагревали при 80C в течение 2 ч и затем выливали в ледяную воду (20 мл), образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме, получая соединение (III) (X=Cl,3,2 г, выход 64%). Способ 4. В колбу вместимостью 50 мл добавляли соединение (VIII) (5 г, 0,012 моль) и затем для получения раствора медленно добавляли POCl3 (10 мл), реакционную смесь нагревали при 80C в течение 2 ч и затем выливали в ледяную воду (20 мл). Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме, получая соединение (III) (X=Cl,4,8, выход 92%) в виде белого твердого вещества. Способ 5. В колбу вместимостью 50 мл добавляли соединение (VIII) (5 г, 0,012 моль) и затем для получения раствора медленно добавляли POCl3 (10 мл), реакционную смесь нагревали при 70C в течение 2 ч и затем выливали в ледяную воду (20 мл). Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме, получая соединение (III) (X=Cl,4,8 г, выход 92%) в виде белого твердого вещества. Способ 6. Соединение (VIII) (5 г, 0,012 моль) растворяли в бензоле (40 мл). При охлаждении на ледяной бане в раствор добавляли PCl5. Через 30 мин ледяную баню убирали, реакционную смесь нагревали при 90C в течение 2 ч и затем выливали в ледяную воду (20 мл). Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме, получая соединение (III) (X=Cl, 3,5 г, выход 67%) в виде белого твердого вещества. Пример получения 5. 7-Хлор-1-метил-5-[2-этокси-5-(4-метилпиперазинилсульфонил)фенил]-3-н-пропил-1 Нпиразоло[4,3-альфа]пиримидин (II) (X=Cl). Способ 1. Соединение (III) (X=Cl, 2 г) растворяли в дихлорметане (20 мл) и триэтиламине (0,94 г, 9,3 ммоль) для получения раствора. Затем, при охлаждении на ледяной бане по каплям добавляли раствор 1-метипиперазина (0,51 г, 5,1 ммоль) в дихлорметане (5 мл). Ледяную баню убирали и смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и разделяли слои. Органическую фазу промывали насыщенным водным раствором хлорида аммония (25 мл) и концентрированным солевым раствором (25 мл) и сушили над безводным Na2SO4 (1 г) в течение 30 мин. Растворитель удаляли путем перегонки при пониженном давлении с образованием неочищенного соединения (II) в виде белого твердого вещества. Неочищенный продукт очищали перекристаллизацией из смеси дихлорметан/петролейный эфир с получением соединения (II) (X=Cl, 1,95 г, выход 85%) в виде белых игольчатых кристаллов, Т.пл. 157-159C. 1 Н ЯМР (CDCl3, 300 МГц):1,03 (3H, t), 1,41 (3H, t), 1,90 (2 Н, m), 2,41 (3H, s), 2,69 (4 Н, s), 3,04 (2 Н,t), 3,23 (4 Н, s), 4,19 (2 Н, q), 4,37 (3H, s), 7,10 (1 Н, d), 7,78 (1 Н, dd), 8,17 (1 Н, s).EI-MS m/z 494 (2), 492 (М+, 6), 424 (2), 422(7), 330 (7), 99 (100). Способ 2. В колбу вместимостью 50 мл добавляли соединение (VI) (2 г, 0,004 моль). Для получения раствора медленно добавляли POCl3 (10 мл). Реакционную смесь нагревали при 80C в течение 2 ч и затем выливали в ледяную воду (8 мл). Образовавшееся белое твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме с образованием соединения (II)(X=Cl, 1,5 г, выход 75%) в виде белого твердого вещества. Способ 3. Соединение (VI) (2 г, 4 ммоль) растворяли в бензоле (10 мл). К раствору медленно добавляли раствор POCl3 (0,65 мл) в бензоле (2 мл), реакционную смесь нагревали при 80C в течение 2 ч и затем выливали в ледяную воду (8 мл). Образовавшееся белое твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили под вакуумом с получением соединения (II)(X=Cl, 1,4 г, выход 70%) в виде белого твердого вещества. Пример получения 6. 1-Метил-5-[2-этокси-5-(4-метилпиперазинилсульфонил)фенил]-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3- альфа]пиримидин-7-он (I). Способ 1. Соединение (II) (X=Cl, 1 г) растворяли в трет-бутиловом спирте (3 мл) и воде (3 мл) для получения раствора. К раствору добавляли NaHCO3 (0,17 г, 2,1 ммоль) и смесь нагревали до образования флегмы в течение 2 ч. Трет-бутиловый спирт удаляли перегонкой при пониженном давлении. При охлаждении на водяной бане рН раствора подгоняли до значений 8,5-9,5 добавлением водного 1 моль/л раствора HCl. Образовавшееся твердое белое вещество отфильтровывали и очищали путем перекристаллизации из этанола, получая соединение (I) (0,87 г, выход 90%) в виде белых игольчатых кристаллов, Т.пл. 186-188C. 1 Н ЯМР (CDCl3, 300 МГц):1,01 (3H, t), 1,63 (3H, t), 1,85 (2 Н, m), 2,27 (3H, s), 2,50 (4 Н, t), 2,92 (2 Н,t), 3,10 (4 Н, t), 4,27 (3H, s), 4,37 (2 Н, q), 7,14 (1 Н, d), 7,83 (1 Н, dd), 8,83 (1 Н, d), 10,81 (1 Н, s).EI-MS m/z 474 (М+, 4), 410 (8), 404 (58), 312 (7), 99 (100). Способ 2. Соединение (II) (X=Cl, 1 г) растворяли в воде (5 мл) и смесь нагревали до образования флегмы в течение 4 ч. К раствору добавляли дихлорметан (15 мл) и слои разделяли. Органическую фазу промывали концентрированным солевым раствором (25 мл) и сушили над безводным Na2SO4 в течение 30 мин. Дихлорметан удаляли перегонкой при пониженном давлении с образованием соединения (I) (0,80 г, выход 83%) в виде белого твердого вещества. Способ 3. Соединение (II) (X=Cl, 1 г) растворяли в 1 моль/л водном растворе HCI (5 мл) и реакционную смесь нагревали при 60C в течение 2 ч. При охлаждении на ледяной бане рН раствора подгоняли до значений 8,5-9,5 добавлением NaHCO3. Образовавшееся белое твердое вещество отфильтровывали и очищали перекристаллизацией из этанола с образованием соединения (I) (0,76 г, выход 79%) в виде белого порошка. Пример получения 7. 7-Бром-1-метил-5-(2-этоксифенил)-3-н-пропил-1H-пиразоло[4,3-альфа]пиримидин (IV) (Х=Br). Соединение, указанное в заголовке, получали, следуя процедуре способа 2 примера получения 3,заменив POCl3 на PBr3 с образованием соединения (IV) (Х=Br, 4,0 г) с выходом 67%. Пример получения 8. 7-Бром-1-метил-5-[2-этокси-5-(хлорсульфонил)фенил]-3-н-пропил-1H-пиразоло[4,3 альфа]пиримидин (III) (X=Br). Способ 1. Соединение, указанное в заголовке, получали, следуя процедуре способа 1 примера получения 4,заменив POCl3 на PBr3 с образованием соединения (III) (Х=Br, 5,0 г) с выходом 70%. 1 Н ЯМР (CDCl3, 300 МГц):1,03 (3H, t), 1,43 (3H, t), 1,88 (2 Н, m), 3,04 (2 Н, t), 4,23 (2 Н, q), 4,40 (3H,s), 7,15 (1 Н, d), 8,07 (1 Н, dd), 8,45 (1 Н, d).EI-MS m/z 475 (8), 473(М 1, 8), 382 (24), 380 (24), 292 (76), 82 (98), 80 (100), 79 (40). Способ 2. Соединение, указанное в заголовке, получали, следуя процедуре способа 3 примера получения 4,заменив POCl3 на POBr3 с образованием соединения (III) (X=Br, 3,4 г) с выходом 59%. Способ 3. Соединение, указанное в заголовке, получали, следуя процедуре способа 6 примера получения 4,заменив PCl5 на PBr5 с образованием соединения (III) (Х=Br, 3,0 г) с выходом 52%. Пример получения 9. 7-Бром-1-метил-5-[2-этокси-5-(4-метилпиперазинилсульфонил)фенил]-3-н-пропил-1 Нпиразоло[4,3-альфа]пиримидин (II) (Х=Br). Соединение,указанное в заголовке,получали из 7-бром-1-метил-5-[2-этокси-5(хлорсульфонил)фенил]-3-н-пропил-1 Н-пиразоло[4,3-альфа]пиримидина III), Х=Br), следуя процедуре по способу 1 примера получения 5 с образованием соединения (II) (Х=Br, 0,8 г) с выходом 72%. 1 Н ЯМР (CDCl3, 300 МГц):1,03 (3H, t), 1,43 (3H, t), 1,87 (2 Н, m), 2,51 (3H, s), 2,83 (4 Н, s), 3,04 (2 Н,t), 3,50 (4 Н, s), 4,21 (2 Н, q), 4,39 (3H, s), 7,14 (1 Н, d), 7,77 (1 Н, dd), 8,20 (1 Н, s).EI-MS m/z 538 (М+, 6), 536 (6), 468 (6), 466 (6), 456 (20), 99 (100). Пример получения 10. 1-Метил-5-[2-этокси-5-(4-метилпиперазинилсульфонил)фенил]-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-альфа]пиримидин-7-он (I). Соединение, указанное в заголовке, было получено из 7-бром-1-метил-5-[2-этокси-5-(4 метилпиперазинилсульфонил)фенил]-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-альфа]пиримидина, следуя процедуре по способу 1 примера получения 6 с образованием соединения (I) (0,85 г) с выходом 75%. Пример 2. Получение соединения формулы (I). Стадия 1. В колбу вместимостью 50 мл добавляли соединение (V) (5 г, 0,015 моль) и для получения раствора медленно добавляли POCl3 (10 мл). Смесь нагревали при 120C в течение 1 ч, далее реакционную смесь выливали в ледяную воду (30 мл) для остановки реакции, после этого смесь экстрагировали дихлорметаном (330 мл). Органическую фазу промывали концентрированным солевым раствором(210 мл) и сушили над безводным сульфатом натрия в течение 30 мин, далее путем концентрирования получали соединение (IV) (Х=Cl, 4,1 г) в виде белого твердого вещества. Стадия 2. При охлаждении на ледяной бане соединение (IV) (X=Cl, 5 г, 0,015 моль) добавляли порциями к хлорсульфоновой кислоте (10 мл). Смесь перемешивали на ледяной бане в течение 30 мин, затем ледяную баню убирали. Реакцию продолжали еще 2 ч. Остаток выливали в воду. Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме, получая соединение (III) (X=Cl) в виде белого твердого вещества. Стадия 3. Соединение (III) (X=Cl, 2 г) растворяли в дихлорметане (20 мл) и триэтиламине (0,94 г,9,3 ммоль) для получения раствора. Затем, при охлаждении на ледяной бане по каплям добавляли раствор 1-метилпиперазина (0,51 г, 5,1 ммоль) в дихлорметане (5 мл). Ледяную баня убирали и смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и разделяли слои. Органическую фазу промывали насыщенным раствором хлорида аммония (210 мл), концентрированным солевым раствором (210 мл) и сушили над безводным Na2SO4 (1 г) в течение 30 мин. Растворитель удаляли путем перегонки при пониженном давлении с образованием неочищенного соединения (II) (X=Cl) в виде белого твердого вещества. Неочищенный продукт очищали перекристаллизацией из смеси дихлорметан/петролейный эфир с получением соединения (II) (X=Cl) в виде белого кристаллического твердого вещества. Стадия 4. Соединение (II) (X=Cl, 1 г) растворяли в трет-бутиловом спирте (3 мл) и в соответствующем количестве воды для получения раствора. К раствору добавляли NaHCO3 (2,1 ммоль) и смесь нагревали при 90C в течение 1,5 ч. трет-Бутиловый спирт удаляли перегонкой при пониженном давлении при 40C. рН раствора подгоняли до значений 8,5-9,5 и образовавшееся твердое вещество отфильтровывали и очищали перекристаллизацией из этанола с получением соединения (I) (0,87 г) в виде белых игольчатых кристаллов. Альтернатива А. Стадия 2 может проводиться непосредственно после стадии 1 без очистки промежуточного продукта, подробная процедура выглядит следующим образом. В трехгорлую колбу вместимостью 50 мл добавляли соединение (V) (5 г, 0,015 моль). При охлаждении на ледяной бане добавляли POCl3 (10 мл) для получения раствора и реакционную смесь нагревали при 120C в течение 1 ч, затем полученный раствор охлаждали до температуры ниже 0C. В реакцион- 10019160 ную смесь добавляли хлорсульфоновую кислоту (10 мл). Через 30 мин ледяную баню убирали и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь выливали в ледяную воду(30 мл), образовавшееся белое твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме в течение 3 ч при 35C с получением соединения (III) При охлаждении на ледяной бане в трехгорлую колбу вместимостью 50 мл добавляли соединение(X) (5 г, 0,016 моль). Для получения раствора в колбу по каплям добавляли POCl3 (10 мл). Раствор нагревали при 50C в течение 4 ч, для остановки реакции смесь выливали на лед и затем смесь экстрагировали дихлорметаном (330 мл). Органическую фазу промывали концентрированным солевым раствором(210 мл) и сушили над безводным сульфатом натрия (2 г) в течение 30 мин с последующим упариванием. получая соединение (IV) (X=Cl, 4,4 г) в виде белого твердого вещества. В колбу вместимостью 50 мл добавляли соединение (VIII) (5 г, 0,012 моль) и для получения раствора медленно добавляли POCl3 (10 мл). Реакционную смесь нагревали при 60C в течение 3 ч и затем выливали в воду (20 мл). Образовавшееся твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме в течение 2 ч при 35C, получая соединение (III)(X=Cl, 4,8 г) в виде белого твердого вещества. В колбу вместимостью 50 мл добавляли соединение (VI) (2 г, 0,004 моль). Для получения раствора медленно добавляли POCl3 (10 мл). Реакционную смесь нагревали при 100C в течение 1,5 ч и затем выливали на дробленый лед. Образовавшееся белое твердое вещество отфильтровывали, промывали ледяной водой до нейтральной реакции фильтрата и сушили в вакууме в течение 2 ч при 35C, получая соединение (II) (X=Cl, 1,5 г) в виде белого твердого вещества. Пример 4. Соединение формулы (III) (X=Br) получали по способу Альтернатива А примера 2, заменяя POCl3 на PBr3, с получением соединения (III) (Х=Br, 5,0 г). Соединение формулы (II) (Х=Br) получали из соединения (III) (X=Br, 1,0 г), следуя стадии 3 в примере 2, получая соединение (II) (Х=Br, 0,8 г). Соединение формулы (I) получали из соединения (II) (Х=Br, 0,5 г), следуя стадии 4 в примере 2, получая соединение (I) (0,36 г) в виде белых игольчатых кристаллов. Пример 5. Получение силденафила цитрата. Пример 5.1. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии добавляли лимонную кислоту, моногидрат (2,10 г, 10 ммоль), при этом получали раствор. Через короткий промежуток времени образовался осадок. Осадок охлаждали, отфильтровывали и промывали метанолом, получая 6,6 г силденафила цитрата. Осадок перекристаллизовали из метанола (160 мл). Получали белые игольчатые кристаллы силденафила цитрата (4,5 г). Пример 5.2. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии добавляли лимонную кислоту, моногидрат (2,10 г, 10 ммолъ), при этом получали раствор. Через короткий промежуток времени образовался осадок. Затем осадок охлаждали и добавляли метанол (150 мл). Образовавшуюся суспензию нагревали до образования флегмы для получения раствора. Раствор охлаждали и происходила кристаллизация. Кристаллы отфильтровывали и промывали метанолом. Получали белые игольчатые кристаллы силденафила цитрата (5,2 г). Пример 5.3. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии добавляли безводную лимонную кислоту (1,90 г, 10 ммоль), при этом получали раствор. Через короткий промежуток времени образовался осадок. Затем осадок охлаждали, отфильтровывали и промывали метанолом, получая 6,4 г силденафила цитрата. Осадок перекристаллизовали из метанола (160 мл). Получали белые игольчатые кристаллы силденафила цитрата (4,6 г). Пример 5.4. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии добавляли безводную лимонную кислоту (1,90 г, 10 ммоль), при этом получали раствор. Через короткий промежуток времени образовался осадок. Затем осадок охлаждали и добавляли метанол (150 мл). Образовавшуюся суспензию нагревали до образования флегмы для получения раствора. Раствор охлаждали и происходила кристаллизация. Кристаллы отфильтровывали и промывали метанолом. Получали белые игольчатые кристаллы силденафила цитрата (5,2 г). Пример 5.5. Суспензию силденафила (4,75 г, 10 ммоль) и лимонной кислоты (2,1 г) в метаноле (20 мл) нагревали до образования флегмы в течение 1 ч и затем охлаждали до 20-25C. Происходило осаждение и осадок отфильтровывали и промывали метанолом. Осадок перекристаллизовали из метанола. Получали белые игольчатые кристаллы силденафила цитрата (5,7 г). Пример 5.6. Способ повышения выхода при кристаллизации упариванием раствора или суспензии. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии при 50-60C добавляли безводную лимонную кислоту (1,90 г, 10 ммоль) и метанол (150 мл), и при кипячении с обратным холодильником происходило растворение. Затем раствор упаривали до объема 50-60 мл. Во время упаривания происходило образование осадка. Суспензию охлаждали до комнатной температуры, кристаллы отфильтровывали и промывали метанолом. Продукт сушили в вакуумной сушильной печи при 60C. Получали белые игольчатые кристаллы силденафила цитрата (6,3 г). Пример 5.7. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии при 50-60C добавляли безводную лимонную кислоту (1,90 г, 10 ммоль), при этом происходило растворение. Через короткий промежуток времени образовался осадок. Добавляли метанол (150 мл) и суспензию нагревали до образования флегмы, получая раствор. Раствор затем упаривали и охлаждали до 20-25C, получая белые игольчатые кристаллы силденафила цитрата (5,8 г). Пример 5.8. Кристаллизация белых игольчатых кристаллов силденафила цитрата с малым размером частиц. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии добавляли безводную лимонную кислоту (1,90 г, 10 ммоль) и метанол (150 ммоль) и получали раствор. Раствор быстро охлаждали до 20-25C и происходила кристаллизация. Кристаллы отфильтровывали и промывали метанолом. Получали белые игольчатые кристаллы силденафила цитрата (5,2 г) малого размера. Пример 5.9. Кристаллизация белых игольчатых кристаллов силденафила цитрата с малым размером частиц. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревали до 45-65C. К суспензии добавляли безводную лимонную кислоту (1,90 г, 10 ммоль) и метанол (150 ммоль) и получали раствор. Раствор упаривали, быстро охлаждали до 20-25C, что приводило к кристаллизации. Кристаллы отфильтровывали и промывали метанолом. Получали белые игольчатые кристаллы силденафила цитрата малого размера (5,8 г). Пример 5.10. Кристаллизация белых игольчатых кристаллов силденафила цитрата с большим размерим частиц. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревают до 45-65C. К суспензии добавляли безводную лимонную кислоту (1,90 г, 10 ммоль) и метанол (150 ммоль) и получали раствор. Раствор упаривали, охлаждали до 20-25C и происходила кристаллизация. По-другому суспензию нагревали до 55C и охлаждали до 20C несколько раз. Полученные кристаллы отфильтровывали и промывали метанолом. Получали белые игольчатые кристаллы силденафила цитрата большого размера (5,2 г). Пример 5.11. Получение силденафила цитрата. Суспензию силденафила (4,75 г, 10 ммоль) в метаноле (20 мл) нагревают до 45-65C в атмосфере азота. К суспензии добавляли лимонную кислоту (1,90 г, 10 ммоль) и метанол (150 мл) и получали раствор. Раствор охлаждали до 20-25C и происходила кристаллизация. Суспензию отфильтровывали под азотом, получая белые игольчатые кристаллы силденафила цитрата (5,2 г). Пример 6. Определение чистоты силденафила. Для определения примесей, относящихся к силденафилу и силденафила цитрату, применяли высокоэффективную жидкостную хроматографию (HPLC). Анализы проводили с применением колонки Hypersil MOS C8, длиной 200 мм и внутренним диаметром 4,6 мм (размер частиц 5 мкм). В качестве подвижной фазы применяли А: 0,1% триэтиламин в 0,025 М KH2PO4 (pH 6,0, подогнанный ортофосфорной кислотой) и В: ацетонитрил. Применяли градиентное элюирование: 30% В (0 мин), 30% В (3 мин), 70% В(20 мин), 70% В (30 мин). Хроматограф был оборудован УФ-детектором. Было определено, что чистота силденафила, полученного по примеру 2, стадия 4, составила 99,95%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов включающий стадии получения соединения формулы (III) путем циклизации соединения формулы (VII) в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, третC4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты. 2. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадию получения соединения формулы (III) путем галогенирования соединения формулы (VIII) в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания,представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты. 3. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадии получения соединения формулы (IV) путем циклизации соединения формулы (V) в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (III) хлорсульфонированием соединения формулы (IV) в присутствии хлорсульфоновой кислоты, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты. 4. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадию получения соединения формулы (IV) путем галогенирования соединения формулы (X) в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, получения соединения формулы (III) хлорсульфонированием соединения формулы (IV) в присутствии хлорсульфоновой кислоты, получения соединения формулы (II) из соединения формулы(III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты. 5. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей или сольватов, включающий стадию получения соединения формулы (III) из соединения формулы (V) с применением синтеза в одном и том же сосуде в присутствии POX3, или PX3, или PX5, или их смесей, где X представляет собой галоген, с последующим хлорсульфонированием в присутствии хлорсульфоновой кислоты, получения соединения формулы (II) из соединения формулы (III) путем обработки соединения формулы (III) 1-метилпиперазином в присутствии агента, удаляющего кислоту, выбранного из неорганических оснований, представляющих собой карбонаты, бикарбонаты или гидроксиды, и из органического основания, представляющего собой триэтиламин, и последующего получения соединения формулы (I) из соединения формулы (II) в ходе реакции, которую проводят в растворителе, выбранном из воды, метанола, этанола, изопропанола, трет-C4H9OH, гликоля, монометилового эфира этиленгликоля и их смесей, в присутствии основания или кислоты. 6. Способ по любому из пп.1-5, где X представляет собой Cl или Br. 7. Способ по п.3, где соединение формулы (IV) получают обработкой соединения формулы (V)POX3, или PX3, или PX5, или их смесями при 50-120C. 8. Способ по п.4, где соединение формулы (IV) получают обработкой соединения формулы (X)POX3, или PX3, или PX5, или их смесями при 50-120C. 9. Способ по п.7 или 8, где после обработки реакционную смесь выливают в воду, лед или их смеси и отбирают осадок с образованием соединения формулы (IV). 10. Способ по п.2 или 4, где реакцию галогенирования проводят в присутствии бензола, или толуола, или CH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей. 11. Способ по п.1 или 3, где реакцию циклизации проводят в присутствии бензола, или толуола, илиCH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей. 12. Способ по п.3 или 4, где соединение формулы (III) получают обработкой соединения формулы(IV) хлорсульфоновой кислотой при 0-50C. 13. Способ по п.1, где соединение формулы (III) получают нагреванием соединения формулы (VII) в присутствии POX3, или PX3, или PX5, или их смесей при 50-120C. 14. Способ по п.13, где реакцию циклизации проводят в присутствии бензола, или толуола, илиCH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей. 15. Способ по п.2, где соединение формулы (III) получают нагреванием соединения формулы (VIII) в присутствии POX3, или PX3, или PX5, или их смесей при 50-120C. 16. Способ по п.15, где реакцию галогенирования проводят в присутствии бензола, или толуола,или CH2Cl2, или CHCl3, или ClCH2CH2Cl, или тетрагидрофурана (THF), или диоксана, или их смесей. 17. Способ по любому из пп.1-5, где основание выбирают из алкоксидов щелочных металлов, гидридов щелочных металлов, гидридов щелочно-земельных металлов, аминов, металлических производных аминов, гидроксидов, карбонатов, бикарбонатов или их смесей. 18. Способ по любому из пп.1-5, где кислоту выбирают из соляной кислоты, серной кислоты, фосфорной кислоты, лимонной кислоты, винной кислоты, малеиновой кислоты или их смесей. 19. Способ по любому из пп.1-18, дополнительно включающий преобразование соединения формулы (I) в его фармацевтически приемлемую соль или сольват. 20. Способ по п.19, где фармацевтически приемлемая соль представляет собой силденафила цитрат. 21. Способ по п.20, где превращают соединение формулы (I) в силденафила цитрат путем приведения соединения формулы (I) в контакт с лимонной кислотой в подходящем растворителе, предпочтительно метаноле. 22. Способ получения фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль или сольват в комбинации по меньшей мере с одним фармацевтически приемлемым носителем, включающий стадию получения соединения формулы (I) или его фармацевтически приемлемой соли или сольвата по любому из пп.1-21. 23. Соединение формулы (II)
МПК / Метки
МПК: C07D 487/04
Метки: получения, способ, силденафила
Код ссылки
<a href="https://eas.patents.su/16-19160-sposob-polucheniya-sildenafila.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения силденафила</a>
Предыдущий патент: Гидротаранный электрогенератор
Следующий патент: Сборные бетонные строительные элементы
Случайный патент: Устройство для непрерывной очистки жидкостей, обезвоживания и высушивания отделённого твердого материала




















