Фармацевтическая композиция, содержащая олигогулуронат или галактуронат, способы лечения с ее использованием, ее применение и содержащий ее спрей-аппликатор
Номер патента: 18776
Опубликовано: 30.10.2013
Авторы: Тэйлор Кэтрин, Драгет Курт Ингар, Смидсрод Олав Осмунд
Формула / Реферат
1. Фармацевтическая композиция, содержащая: (а) физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната или галактуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 20, и (б) макромолекулярное лекарственное вещество, имеющее молекулярную массу выше 2000 Да.
2. Композиция по п.1 для введения на поверхность слизистой оболочки субъекта, являющегося человеком или позвоночным животным.
3. Композиция по п.1 или 2, содержащая физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17.
4. Композиция по любому из пп.1-3, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,92 и долю маннуроната (FM) не более 0,08.
5. Композиция по любому из пп.1-4, где указанный олигогулуронат или олигогалактуронат имеет среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08 и где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17.
6. Композиция по любому из пп.1-5, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05.
7. Композиция по любому из пп.1-6, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации.
8. Композиция по любому из пп.1-7, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза.
9. Способ лечения субъекта, являющегося человеком или позвоночным животным, направленный на снижение вязкости слизи на поверхности слизистой оболочки субъекта, включающий нанесение на поверхность слизистой оболочки эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната или галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 20.
10. Стерильная распыляемая водная композиция, содержащая водный раствор физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната или галактуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 20, где указанный раствор содержит олигогулуронат или олигогалактуронат в концентрации от 40 до 140 мг/мл в пересчете на его натриевую соль.
11. Композиция по п.10, содержащая раствор физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17.
12. Композиция по п.11, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,92 и долю маннуроната (FM) не более 0,08.
13. Композиция по любому из пп.11-12, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05.
14. Композиция по любому из пп.11-13, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации.
15. Композиция по любому из пп.11-14, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза.
16. Спрей-аппликатор, содержащий резервуар и генератор капель, где резервуар содержит стерильную водную композицию по любому из пп.10 или 15.
17. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 17, для усиления всасывания через поверхность слизистой оболочки субъекта макромолекулярного лекарственного вещества.
18. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 17, для усиления всасывания через поверхность слизистой оболочки субъекта макромолекулярного лекарственного вещества.
19. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта.
20. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта путем нанесения средства на указанную поверхность.
21. Применение по любому из пп.17-20, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05.
22. Применение по любому из пп.17-21, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации.
23. Применение по любому из пп.17-22, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза.
24. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства, содержащего олигогулуронат в стерильном водном растворе в концентрации от 40 до 140 мг/мл в пересчете на его натриевую соль, для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта путем нанесения средства на указанную поверхность.
25. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю галактуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства, содержащего олигогалактуронат в стерильном водном растворе в концентрации от 40 до 140 мг/мл в пересчете на его натриевую соль, для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта путем нанесения средства на указанную поверхность.
26. Применение по п.24 или 25, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,92 и долю маннуроната (FM) не более 0,08.
27. Применение по пп.24-26, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05.
28. Применение по любому из пп.24-27, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации.
29. Применение по любому из пп.24-28, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза.
30. Способ лечения субъекта, являющегося человеком или позвоночным животным, направленный на снижение вязкости слизи на поверхности слизистой оболочки субъекта, включающий введение на указанную поверхность эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17.
31. Способ по п.9 или 30, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05.
32. Способ по любому из пп.30 или 31, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации.
33. Применение по любому из пп.9 или 30-32, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза.
34. Способ лечения субъекта, являющегося человеком или позвоночным животным, направленный на снижение вязкости слизи на поверхности слизистой оболочки субъекта, включающий введение на указанную поверхность эффективного количества стерильного водного раствора, содержащего от 40 до 140 мг/мл в пересчете на его натриевую соль физиологически приемлемого олигогулуроната или олигогалактуроната, как он определен в любом из пп.11-15.
35. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 20, для изготовления лекарственного средства, дополнительно содержащего лекарственное вещество, для введения на поверхность слизистой оболочки субъекта и всасывания через нее указанного лекарственного вещества для лечения состояния, реагирующего на указанное лекарственное вещество.
36. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю галактуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 20, для изготовления лекарственного средства, дополнительно содержащего лекарственное вещество, для введения на поверхность слизистой оболочки субъекта и всасывания через нее указанного лекарственного вещества для лечения состояния, реагирующего на указанное лекарственное вещество.
37. Применение по п.35 или 36, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат является таким, как он определен в любом из пп.3-8.
38. Способ лечения субъекта, являющегося человеком или позвоночным животным, путем введения на поверхность слизистой оболочки субъекта эффективного количества лекарственного вещества для лечения состояния, реагирующего на указанное лекарственное вещество, отличающийся тем, что включает введение указанного лекарственного вещества с физиологически приемлемым олигогулуронатом или олигогалактуронатом, как он определен в любом из пп.1 или 3-8.
Текст
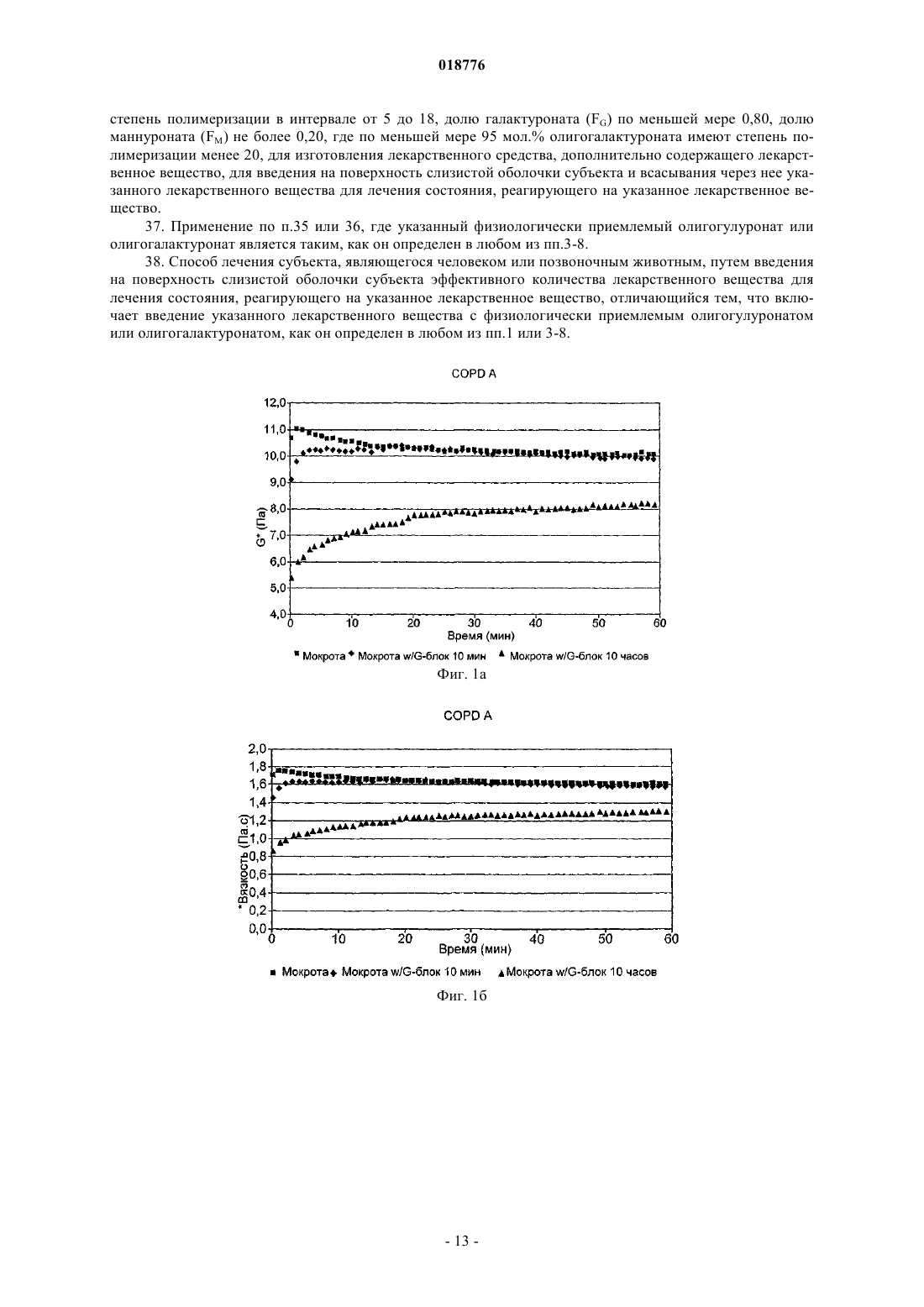
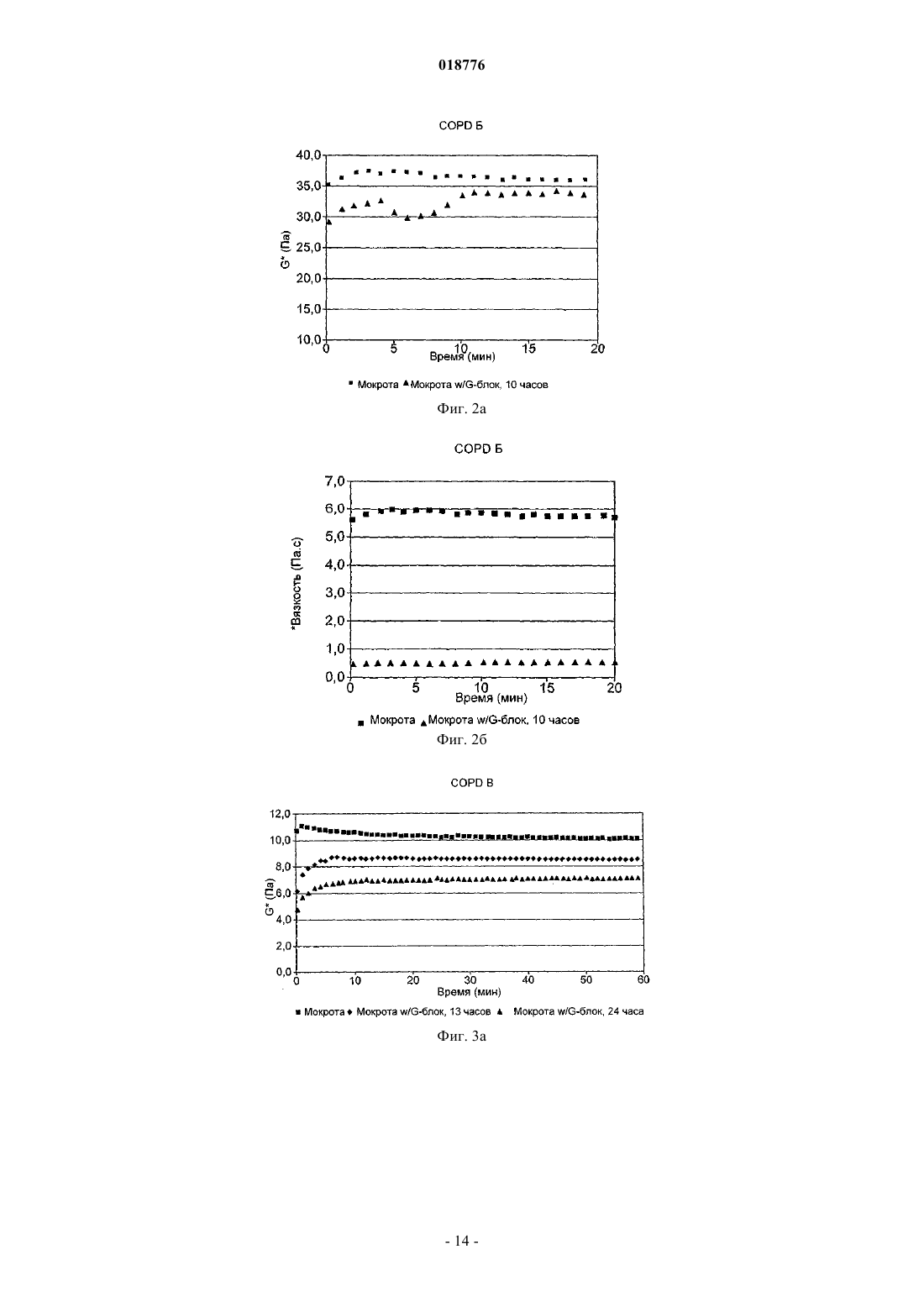
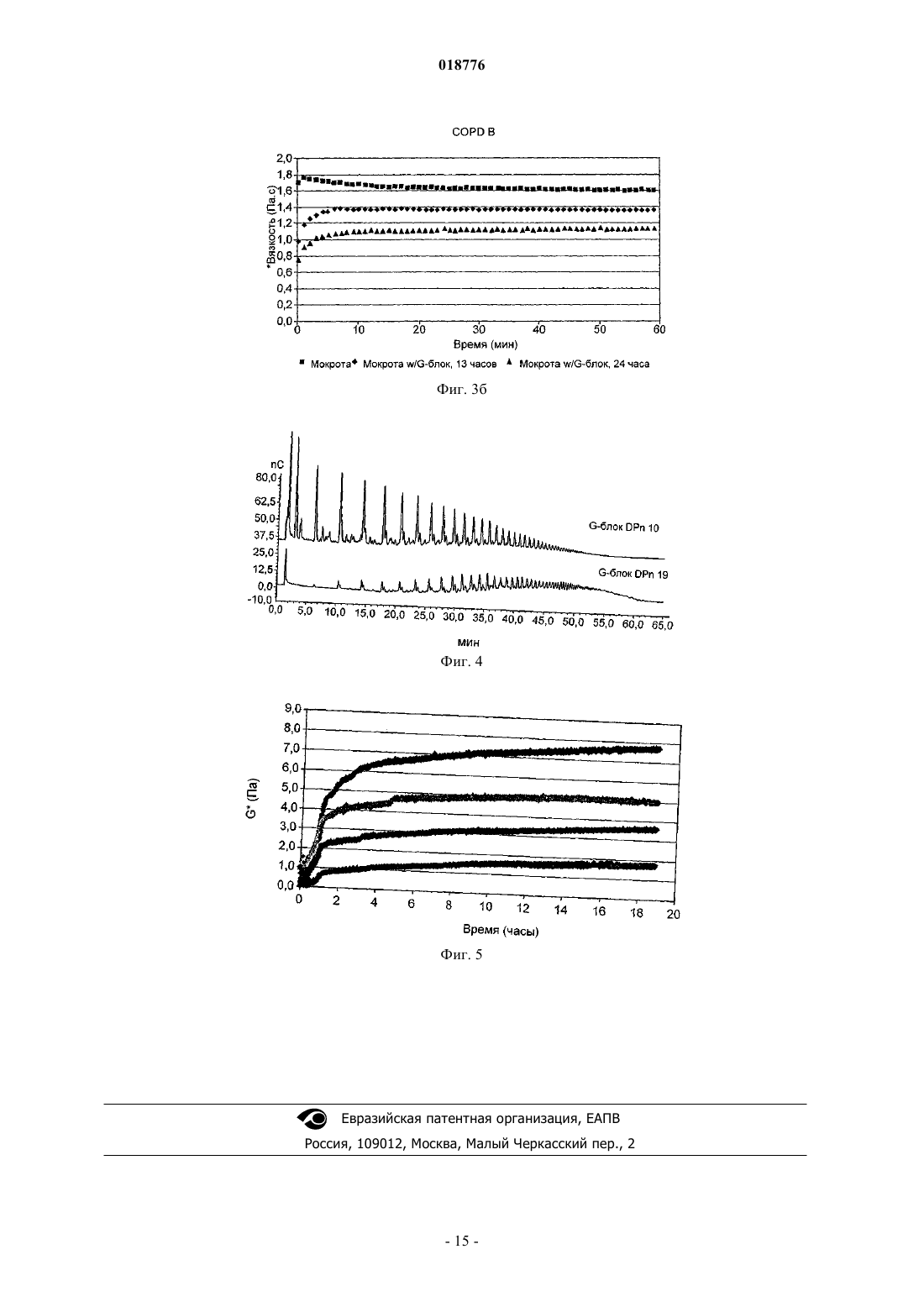
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ОЛИГОГУЛУРОНАТ ИЛИ ГАЛАКТУРОНАТ, СПОСОБЫ ЛЕЧЕНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ, ЕЕ ПРИМЕНЕНИЕ И СОДЕРЖАЩИЙ ЕЕ СПРЕЙ-АППЛИКАТОР В изобретении предложена фармацевтическая композиция, содержащая макромолекулярное лекарственное вещество и олигогулуронат или олигогалактуронат, в частности, имеющие среднечисленную степень полимеризации в интервале от 5 до 18, фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,80, фракцию маннуроната (FM) не более 0,20 и имеющие по меньшей мере 95 мол.% со степенью полимеризации менее 20. Эту композицию можно применять в способе лечения, включающем введение этой композиции на поверхность слизистой оболочки субъекта, являющегося человеком или позвоночным животным.(71)(73) Заявитель и патентовладелец: ЭнТиЭнЮ ТЕКНОЛОДЖИ ТРАНСФЕР АС (NO) Данное изобретение относится к композициям олигогулуроната и олигогалактуроната и к способу лечения человека или животных, отличных от человека, в частности млекопитающих, олигогулуронатами или олигогалактуронатами, например для борьбы с повышенной вязкостью слизи, например для усиления клиренса слизи, особенно из дыхательных путей, в частности из пазух и легких, в частности при лечении муковисцидоза (CF) и синусита. Муковисцидоз является наиболее распространенным летальным генетическим заболеванием в европейских популяциях. Это заболевание вызвано мутацией в гене, который кодирует трансмембранный регулятор муковисцидоза (CFTR), хлоридный канал, который присутствует в секреторных и других клетках в организме. Это заболевание характеризуется присутствием густых, трудноизлечимых слизистых секретов в организме, что может приводить к заболеванию легких, возникновению проблем с пищеварением и бесплодию. Нормальный мукоцилиарный клиренс в легких не удаляет чрезмерно вязкую слизь, которая колонизируется микроорганизмами, которые, в свою очередь, увеличивают вязкость слизи и могут привести к хроническому воспалению легких и обструкции. Заболевание легких является, таким образом, самой большой проблемой здоровья для большинства пациентов CF и является основной причиной смерти. Слизь представляет собой нормальный секрет всех дыхательных путей, включая легкие. Ее основной функцией является участие в системе мукоцилиарного клиренса, который поддерживает легкие чистыми и защищает против инфекции. Система мукоцилиарного клиренса включает три основных компонента: слизь, реснички и поверхностную жидкость дыхательных путей. Поверхность эпителия, таким образом, содержит бокаловидные клетки, секретирующие слизь, и реснитчатые эпителиальные клетки с вышележащим слоем поверхностной жидкости дыхательных путей и выше него слоем слизи, в который выдаются кончики ресничек. Слизь представляет собой клейкое гелеобразное вещество, состоящее главным образом из воды (примерно 95% мас./мас.) и муцинов, гелеобразующих молекул, ответственных за физические свойства слизи. Реснички представляют собой мелкие волосоподобные выросты из поверхности эпителиальных клеток, которые ритмично колеблются в водянистой, невязкой поверхностной жидкости дыхательных путей, а их кончики погружены в слой слизи. Слой слизи образует клейкий покров на поверхности легких, который улавливает бактерии, вирусы, вдыхаемые частицы, загрязняющие вещества окружающей среды и клеточные обломки. Колебание ресничек служит для проталкивания этого слизистого покрова и всего, что он улавливает, в направлении рта и из легких. В нормальных условиях система мукоцилиарного клиренса функционирует эффективно, и легкие сохраняются чистыми и свободными от инфекции. Если система перегружена, существует вторая линия защиты - кашель. Таким образом,когда секретируются повышенные уровни слизи в ответ на раздражение или воспаление, например из-за вдыхаемых частиц или инфекции, слизь выбрасывается из легких путем кашлевого рефлекса. У пациентов CF слизь в легких является более густой и более вязкой, чем нормальная, и эта более густая слизь не так легко переносится ресничками. В результате система мукоцилиарного клиренса подвергается повышенной нагрузке, и легкие становятся более восприимчивыми к инфекции. Кроме того,легкие пациентов CF находятся, по-видимому, в гипервоспалительном состоянии при постоянном низком уровне воспаления и усиленной реакции на агенты, которые обычно вызывают воспаление. Это составляет серьезную проблему, поскольку составной частью ответа на воспаление является усиленное продуцирование слизи. Повышенное количество слизи накапливается, если она является слишком густой для выведения системой мукоцилиарного клиренса или посредством кашля, емкость легких уменьшается, и обмен кислорода через слизистую оболочку снижается. Это обеспечивает идеальную окружающую среду для бактериальной колонизации, серьезную проблему для пациентов CF, поскольку она также вызывает воспаление и активирует иммунный ответ. Это приводит не только к повышенной секреции слизи, но также к повышенному присутствию клеток и агентов иммунного ответа, таких как макрофаги и лизоцимы. Поскольку бактерии и макрофаги погибают, их клеточное содержимое высвобождается в слизь, а оно включает вязкие молекулы, такие как ДНК. Кроме того, некоторые из бактерий, напримерBurkholdia sp. и Pseudomonas aeruginosa, также секретируют полисахариды высокой вязкости, в последнем случае альгинаты. Эти молекулы дополнительно увеличивают вязкость слизи, в случае альгинатов,по-видимому, за счет взаимодействия с муциновым матриксом слизи, но в случае ДНК, по-видимому, за счет увеличения вязкости зольной фазы внутри муцинового матрикса. Поддержание слизи в форме, способной к переносу ресничками, составляет, таким образом, ключевую цель лечения CF. В результате действия агентов, которые просто разрушают ее гелеобразную структуру, образовалась бы жидкость, которая была бы также неспособна к переносу, как и гипервязкая слизь пациента CF. Следовательно, важно, чтобы терапевтический агент не разрушал гелевый матрикс, образованный гликопротеиновыми муцинами. Авторы изобретения обнаружили, что этого можно достичь с применением олигогулуронатов или олигогалактуронатов (предпочтительно олигогулуронатов), имеющих среднечисленную степень полимеризации (DPn) в интервале от 5 до 30, предпочтительно от 5 до 18. В других областях организма, например в ушах, шейке матки и особенно в дыхательных путях, в частности в пазухах, особенно в придаточных пазухах носа, избыточно вязкая слизь может создавать проблемы. Олигогулуронаты и олигогалактуронаты можно также адресно применять для решения этих проблем. Слизь шейки матки, продуцируемая железами шейки матки, представляет собой гетерогенную структуру, содержащую различные типы секретов в различных соотношениях на протяжении менструального цикла. Природа этого секрета такова, что она обеспечивает барьер для миграции спермы через шейку матки во все моменты времени за исключением "фертильного окна", когда происходит овуляция,и возможно оплодотворение яйцеклетки. Этот механизм действует для защиты матки, фаллопиевых труб и яичников от ненужного воздействия патогенов. С целью поддержания миграции спермы во время фертильного окна слизь шейки матки должна обладать соответствующими биохимическими и биофизическими характеристиками. Биохимические свойства, такие как рН и осмомолярность, важны для обеспечения подходящих условий для выживания спермы (см. Marriott et al., "Mucus physiology and pathology" in Bioadhesive Drug Delivery Systems, CRCPress, 1990), тогда как биофизические свойства, такие как реология и морфология макромолекулярной сети, влияют на подвижность спермы в слизи (см. Rutllant et al., Reprod. Dom. Anim. 40: 79-86 (2005. Клинически фертильное окно можно идентифицировать путем обнаружения вспышки лютенизирующего гормона перед овуляцией и подъема базальной температуры тела после овуляции, а также путем исследования биофизических свойств слизи шейки матки, в частности кристаллизации (кристаллизуемости) слизи, которая, по существу, является мерой того, насколько эластичной является слизь, и как таковая относится к реологии слизи. Также показано, что феномен арборизации слизи шейки матки, то есть паттерны кристаллизации, которые образуются, когда слизи из овуляторного периода дают возможность высохнуть на воздухе, связан с морфологией макромолекулярной сети внутри этой слизи (см.Menarguez et al., Human Reproduction 18: 1782-1789 (2003. Показано, что паттерны арборизации слизи (и, следовательно, морфология макромолекулярной сети) являются значимыми факторами в вероятности достижения беременности при применении искусственного осеменения, и для субпопуляции женщин "проблемная слизь" является, по-видимому, основным барьером для достижения беременности (см. Boyers et al., Human Reproduction 6: 1108-1114 (1991. Следовательно, существует необходимость в способе модулирования биофизических свойств слизи шейки матки для оптимальной подвижности спермы, не только для женщин с "проблемной слизью", но для любой женщины, которая желает максимально увеличить свои шансы на зачатие, а также для животноводов, которые желают максимально увеличить шансы беременности у своих животных. Авторы изобретения обнаружили, что этого можно достичь с применением олигогулуронатов или олигогалактуронатов (предпочтительно олигогулуронатов), имеющих среднечисленную степень полимеризации (DPn) в интервале от 5 до 30, предпочтительно от 5 до 18. Такое применение олигогулуронатов и олигогалактуронатов описано, например, в WO 2007/039754 и WO 2007/039760, содержания которых полностью включены здесь путем ссылки. Олигогулуронаты и олигогалактуронаты (здесь далее "G-блоки") могут быть получены из природных полисахаридов, как описано ниже, и содержат смесь соединений различных степеней полимеризации (DP). В настоящее время авторы изобретения обнаружили, что путем удаления высокомолекулярного "хвоста" смеси G-блоков получают вещество с улучшенными характеристиками в отношении его способности к модификации структуры слизи. В формуле изобретения к данному документу, таким образом, изложены особенно предпочтительные значения для среднечисленных степеней полимеризации (DPn), фракции гулуроната/галактуроната(FG), фракции маннуроната (FM) и распределения молекулярных масс. Авторы изобретения также неожиданно обнаружили, что G-блоки (особенно олигогулуронаты) можно успешно использовать для облегчения всасывания из поверхностей слизистой оболочки макромолекулярных лекарственных веществ, то есть лекарственных веществ, имеющих молекулярную массу выше 2000 Да (предпочтительно выше 4000 Да, например 5-2000 кДа), при их совместном введении. Этот эффект явно продемонстрирован с использованием модели клеток почки собак Мадин-Дарби(MDCK). Таким образом, в одном аспекте изобретения предложена фармацевтическая композиция, содержащая олигогулуронат или олигогалактуронат и макромолекулярное лекарственное вещество. В следующем аспекте изобретения предложен способ лечения субъекта, являющегося человеком или позвоночным животным (например млекопитающего, птицы или рептилии, в частности млекопитающего), включающий введение указанному субъекту фармацевтической композиции, содержащей эффективное количество макромолекулярного лекарственного вещества, отличающийся тем, что он включает совместное введение на поверхность слизистой оболочки указанного субъекта указанного лекарственного вещества с эффективным количеством олигогулуроната или олигогалактуроната. В следующем аспекте изобретения предложено применение олигогулуроната или олигогалактуроната в изготовлении лекарственного средства, дополнительно содержащего макромолекулярное лекарственное вещество, для использования в способе лечения, который включает введение указанного лекарственного средства на поверхность слизистой оболочки субъекта, являющегося человеком или позвоночным животным. Под слизистой оболочкой понимают, например, внутреннюю часть носа, влагалища, легких, вы-2 018776 стилку полости рта (например, под языком) или ануса. Введение в полость рта, как правило, осуществляют либо путем ингаляции спрея, либо путем введения под язык, либо путем удерживания во рту. Введение перорально в желудочно-кишечный тракт для всасывания лекарственного вещества в желудке или кишечнике является одной из дополнительных возможностей, но менее предпочтительной, поскольку макромолекулярные лекарственные вещества при таком введении часто склонны к разрушению. Примеры пригодных макромолекулярных лекарственных веществ включают нуклеиновые кислоты(например, этанерцепт, инфликсимаб, адалинумаб и т.д.), интерферон (например, интерферонили ),фактор VII, фактор VIIa, фактор VIII, фактор IX, фолликулостимулирующий гормон, эритропоэтин, трастузумаб, ритуксимаб, гранулоцитарный колониестимулирующий фактор (и его ПЭГилированные эквиваленты), гормоны роста, такие как соматотропин, апотрансферрин (применяемый при лечении атрансферринемии) и -глюкоцереброзидаза. Большинство из них характеризуются таким слабым биологическим всасыванием с поверхностей слизистых оболочек, что их обычно вводят путем инъекции, которая представляет собой путь введения, менее удобный для пациента, чем введение через поверхность слизистой оболочки. В способе по изобретению такие лекарственные вещества можно, конечно, применять по их обычным показаниям. Соответствующая дозировка может быть легко определена на животных моделях, работающих на той основе, что принимаемое количество должно быть сравнимо с общепринятой инъекционной дозой. Если желательно, композиции по изобретению можно вводить подкожно или внутримышечно; однако это менее предпочтительно, а внутривенная инъекция, как правило, нежелательна. Примеры пригодных макромолекулярных лекарственных веществ, подходящих для включения в композиции по изобретению, включают анти-TNF лекарственные средства, продаваемые под торговыми марками энбрель (Enbrel) и ремикад (Remicade); анти-CD20, продаваемое под торговой маркой ритуксан(Rituxan); эритропоэтины, продаваемые под торговыми марками прокрит (Procrit), эпрекс (Eprex), аранесп (Aranesp), эпоген (Epogen), НеоРекормон (NeoRecormon) и эпогин (Epogin); G-CSF, продаваемый под торговой маркой Неуласта (Neulasta); анти-EGFR, продаваемое под торговой маркой герцептин (Herceptin); интерфероны, продаваемые под торговой маркой авонекс (Avonex), ребиф (Rebif), бетасерон (Betaseron), нейпоген (Neupogen) и пегасис (Pegasys); фактор VIII, продаваемый под торговой маркой когенат (Kogenate); фактор VII, продаваемый под торговой маркой НовоСэвен (NovoSeven); фактор IX, продаваемый под торговой маркой бенефикс (Benefix); гормоны роста, продаваемые под торговыми марками генотропин (Genotropin) и нутропин (Nutropin); tPA, продаваемый под торговой маркой активаза (Activase); FSH (фолликулостимулирующий гормон), продаваемый под торговой маркой фоллистим (Follistim); и глюкоцереброзидаза, продаваемая под торговой маркой церезим (Cerezyme). На web-сайтах изготовителей приведены показания и дозировки. Макромолекулярное лекарственное вещество, конечно, может представлять собой нуклеиновую кислоту для применения в генотерапии. Макромолекулярное лекарственное вещество предпочтительно представляет собой вещество с желаемым физиологическим эффектом, кроме просто какого-либо эффекта уменьшения инфекции, воспаления, вязкости слизи или других легочных проблем. В частности, оно предпочтительно не представляет собой фермент, расщепляющий нуклеиновые кислоты, гельзолин, декстран, полиASP или полиGLU. Макромолекулярные лекарственные вещества иногда имеют тенденцию к образованию агрегатов в водном растворе, и без связи с какой-либо теорией считают, что улучшенное всасывание, достигаемое посредством совместного введения G-блоков, частично является результатом эффекта G-блоков в плане уменьшении образования агрегатов. Изобретение, таким образом, особенно пригодно для применения с макромолекулами, подобными инсулину, которые имеют такую тенденцию к агрегации. Считают также,что в основе улучшенного всасывания, достигаемого посредством совместного введения G-блоков, также лежит способность G-блоков к стимуляции прохождения через структуры гликокаликса на клеточных поверхностях, которая может быть обусловлена облегченным G-блоками доступом макромолекулярного лекарственного вещества к соответствующим рецепторам клеточной поверхности. Применяемый G-блок предпочтительно представляет собой физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий среднечисленную степень полимеризации в интервале от 5 до 18 (в частности, от 7 до 15), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,80 (предпочтительно по меньшей мере 0,85, в частности по меньшей мере 0,92), фракцию маннуроната (FM) не более 0,20 (предпочтительно не более 0,15, в частности не более 0,08), и имеющий по меньшей мере 95 мол.% со степенью полимеризации менее 20 (предпочтительно менее чем 17). G-блок предпочтительно присутствует в композициях в концентрации 0,1-50 мг/мл, в частности 0,5-25 мг/мл, особенно 1-10 мг/мл в водном растворе, готовом к употреблению. Выражаясь альтернативно, G-блок и макромолекулярное лекарственное вещество предпочтительно присутствуют в относительном массовом отношении примерно от 0,5:1 до 10:1, в частности примерно 1:1. В другом аспекте изобретения предложен способ лечения субъекта, являющегося человеком или позвоночным животным (например, млекопитающего, птицы или рептилии, в частности млекопитающего) для снижения вязкости слизи на поверхности слизистой оболочки у указанного субъекта и, в частно-3 018776 сти, для борьбы с гипервязкостью слизи (например, для лечения экссудативного отита, синусита или муковисцидоза, для усиления вероятности оплодотворения после осеменения или полового акта, для усиления доставки лекарственного средства через поверхности слизистой оболочки), включающий нанесение на указанную поверхность слизистой оболочки эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, фракцию гулуроната (или галактуроната) (FG) ПО меньшей мере 0,92, фракцию маннуроната (FM) не более 0,08 и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 20. Если олигогулуронат или олигогалактуронат предназначен для нанесения на поверхность слизистой оболочки в дыхательных путях (то есть носа, пазух и легких) или в ушах, тогда его предпочтительно готовят в виде препарата в водном растворе в концентрации от 40 до 140 мг/мл (вычисленной на основе массы олигогулуроната или олигогалактуроната в форме натриевой соли, здесь далее "в пересчете на натриевую соль"). Если его вводят в легкие, суточная дозировка для человека должна составлять от 100 до 2000 мг/сутки для взрослого (в пересчете на натриевую соль), предпочтительно от 120 до 1000 мг/сутки, в частности от 150 до 500 мг/сутки. Для ребенка дозировка может быть пропорциональна массе тела ребенка, принимая массу тела взрослого за 70 кг для вышеуказанных диапазонов дозы. Эту суточную дозировку предпочтительно следует давать в 2, 3 или 4 приема, разделенных интервалами времени. Если олигогулуронат или олигогалактуронат предназначен для нанесения на поверхность слизистой оболочки во влагалище или для введения ректально, он может быть также представлен в форме иной,нежели водный раствор. Так, например, он может находиться в форме таблетки, таблетки с покрытием (в частности, таблетки с покрытием для замедленного или отсроченного высвобождения), капсулы, суппозитория, пессария, геля, эмульсии, сиропа, дисперсии, суспензии, эмульсии, порошка, крема, пасты и т.д. Для этой цели его препарат можно готовить с общепринятыми фармацевтическими носителями и эксципиентами, и лекарственную форму можно готовить общепринятым способом. Для вагинального применения олигоуронат (то есть олигогулуронат или олигогалактуронат) предпочтительно наносят в форме стерильной водной композиции, например раствора, геля, эмульсии, крема или пасты, либо в виде таблетки, капсулы или вагинального суппозитория. Однако предпочтительны гелевые формы, в частности водные смазывающие гели. Такие композиции, которые должны быть свободны от спермицидов, могут, если желательно, содержать дополнительные агенты для усиления функции спермы, например регуляторы pH и антиоксиданты, или способствующие оплодотворению, например мышечные релаксанты, смазывающие агенты и т.д. Ясно, что композиции могут также содержать дополнительные физиологически приемлемые фармацевтические или косметические компоненты, которые обычно присутствуют в композициях для вагинального применения, например связующие агенты,разбавители, растворимые оболочки капсул, ароматические вещества, антибиотики, витамины, масла,эмульгаторы, основы суппозиториев и т.д. Олигоуронат предпочтительно должен присутствовать в количестве примерно от 0,1 до 2,5 г на стандартную дозу, более предпочтительно от 0,5 до 2 г/стандартную дозу для взрослой женщины. Дозировки для других видов могут быть рассчитаны аналогично по отношению к среднему размеру тела, например [(0,1-2,5)/60] г/стандартная доза/кг массы тела и т.д. Композицию предпочтительно наносят перед осеменением, например за 1-60 ч до него, предпочтительно за 2-48 ч до него, в частности за 4-36, например за 20-52 ч до него. Это может быть осуществлено,например, с помощью влагалищного душа, путем вагинального введения разрушающейся в воде таблетки или капсулы или путем инъекции геля или пасты. Периодичность нанесения может быть выбрана путем мониторинга параметров, свидетельствующих об овуляции или близости овуляции, например температуры. Если желательно, композицию можно наносить два или более чем два раза, например задолго до осеменения и непосредственно перед (например, в пределах 1 ч) осеменением. Если в композицию включен регулятор рН, он предпочтительно является таким, чтобы сделать вагинальный pH слегка основным, например pH от 7,1 до 7,6, в частности примерно pH 7,4. Для этого можно использовать обычные физиологически приемлемые буферы. Особь женского пола, которую лечат в соответствии со способом по изобретению, предпочтительно представляет собой женщину, в частности диагностированную как имеющую проблемы с фертильностью вследствие проблемной слизи. Способ, однако, может применяться другими женщинами в возрасте,возможном для беременности, с целью повышения вероятности наступления беременности. Его также могут применять ветеринары и животноводы, например фермеры, для таких животных, как коровы, лошади, собаки, кошки, овцы, козы, свиньи и т.д. Композиции по изобретению для вагинального применения предпочтительно упаковывают вместе с инструкциями по применению в способе по изобретению, особенно предпочтительно в форме стандартной дозы, и особенно предпочтительно вместе с аппликатором, например шприцом. Применение предварительно заполненных шприцов особенно предпочтительно. Альтернативно аппликатор может принимать форму цервикальной диафрагмы, на вогнутую сторону которой нанесена композиция, которую удаляют перед осеменением, если мембрана диафрагмы непроницаема для спермы или водорастворимых веществ. Такие шприцы и диафрагмы образуют следующие аспекты настоящего изобретения. Для введения в желудочно-кишечный тракт ректально суточная дозировка обычно составляет от 0,1 до 100 мг/кг массы тела, более предпочтительно от 1 до 50 мг/кг, в частности от 1,5 до 25 мг/кг (на основе натриевой соли). Введение предпочтительно осуществляют от одного до четырех раз в сутки. Для введения в уши суточная дозировка обычно составляет от 0,05 до 4 мг/кг массы тела (в пересчете на натриевую соль), более предпочтительно от 0,1 до 2 мг/кг. Введение предпочтительно осуществляют от одного до четырех раз в сутки. Оптимальная доза может быть легко определена с помощью обычных экспериментов по выбору диапазона дозы, возможно после первоначального исследования на животной модели, например на модели собак. Композиции по изобретению могут быть изготовлены с использованием общепринятых фармацевтических носителей и эксципиентов, например стерильных растворителей (таких как вода, в частности вода для инъекций), модификаторов осмомолярности, корригентов, регуляторов pH и т.д. Они могут содержать дополнительные активные компоненты, например агенты, которые служат для разрушения биополимеров, не включенных в муциновый матрикс слизи (например, ДНКазу, в частности, рекомбинантную человеческую ДНКазу), антибактериальные агенты, анестетики и противовоспалительные агенты. Комбинированная терапия с применением такого дополнительного агента и олигогулуроната или олигогалактуроната, вводимых по отдельности или вместе, составляет особенно предпочтительное воплощение способа по изобретению. Такие дополнительные агенты можно применять в их обычных дозах или даже в более низких дозах, например 50% от обычной дозы. Олигогулуронат или олигогалактуронат, применяемый согласно изобретению, предпочтительно имеет среднечисленную степень полимеризации (DPn) от 7 до 15, более предпочтительно от 8 до 12, в частности примерно 10. Молекулярно-массовое распределение предпочтительно является таким, что не более чем 5 мол.% имеет степень полимеризации (DP) выше 17, более предпочтительно не более чем 5 мол.% имеет DP выше 14, еще более предпочтительно не более чем 5 мол.% имеет DP выше 12 (например, в каждом вышеуказанном случае DP в два раза выше, чем релевантный верхний предел для DPn). Подобным же образом предпочтительно, чтобы не более чем 5 мол.% имели DP ниже числа, в два раза более низкого, чем релевантный нижний предел для DPn. Противоионом для олигогулуроната или олигогалактуроната может быть любой физиологически приемлемый катион, например любой из физиологически приемлемых ионов, обычно используемых для заряженных лекарственных веществ, например натрия, калия, меглумина и т.д. Однако предпочтительно не следует использовать ионы, которые способствуют желированию альгината, например металлов второй группы. Натрий, как правило, предпочтителен. Таким образом, в следующем аспекте изобретения предложена стерильная распыляемая водная жидкая композиция, содержащая водный раствор физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18 (предпочтительно от 7 до 15, более предпочтительно от 8 до 12, в частности примерно 10), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,80 (предпочтительно по меньшей мере 0,85, более предпочтительно по меньшей мере 0,90, в частности по меньшей мере 0,92, наиболее предпочтительно по меньшей мере 0,95), фракцию маннуроната (FM) не более 0,20 (предпочтительно не более 0,15, более предпочтительно не более 0,10, в частности не более 0,08, наиболее предпочтительно не более 0,05), и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 20 (предпочтительно менее 17,более предпочтительно менее 14), который содержит указанный олигогулуронат в концентрации от 40 до 140 мг/мл, предпочтительно от 50 до 100 мг/мл, в частности от 55 до 75 мг/мл (в пересчете на натриевую соль). В следующем аспекте изобретения предложен спрей-аппликатор, содержащий резервуар и генератор капель, где указанный резервуар содержит стерильный водный раствор или композицию согласно изобретению. Такие спрей-аппликаторы, а именно олигогулуронатов или олигогалактуронатов, можно применять в лечении муковисцидоза, закупорки пазух или заложенности носа, либо гиперемии, являющихся результатом насморка или других причин. Композиции, предназначенные для ингаляции в легкие, желательно содержат дополнительный физиологически приемлемый агент, снижающий вязкость слизи, например фермент, расщепляющий нуклеиновую кислоту (например ДНКазу, такую как ДНКаза I), гельзолин, агент, восстанавливающий тиол,ацетилцистеин, хлорид натрия, незаряженный низкомолекулярный полисахарид (например декстран),аргинин (или другие предшественники или стимуляторы синтеза оксида азота) или апротонная полиаминокислота (например полиASP или полиGLU). Применение ДНКазы особенно предпочтительно. Для введения в легкие олигоуронаты могут находиться в форме порошков, например со средним размером частиц примерно от нанометров до микрометров (например от 10 до 50000 нм). В еще одном следующем аспекте изобретения предложены физиологически приемлемые олигогулуронаты или олигогалактуронаты, имеющие средне-численную степень полимеризации в интервале от 7 до 15 (предпочтительно от 8 до 12), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,92 (предпочтительно по меньшей мере 0,95), фракцию маннуроната (FM) не более 0,08 (предпочтительно не более 0,05), и имеющие по меньшей мере 95 мол.% со степенью полимеризации менее 17 (пред-5 018776 почтительно менее 14), для применения в медицине. В еще одном следующем аспекте изобретения предложено применение физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего средне-численную степень полимеризации в интервале от 7 до 15 (предпочтительно от 8 до 12), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,92 (предпочтительно по меньшей мере 0,95), фракцию маннуроната (FM) не более 0,08(предпочтительно не более 0,05), и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 17 (предпочтительно менее 14), в изготовлении лекарственного средства для использования в способе лечения для снижения вязкости слизи на поверхности слизистой оболочки путем нанесения на указанную поверхность, например при лечении муковисцидоза, экссудативного отита, синусита, хронической обструктивной болезни легких (COPD, в частности в ее влажных формах), бронхита, эмфиземы,нарушенной фертильности, либо для усиления доставки лекарственного вещества через поверхность слизистой оболочки. В еще одном следующем аспекте изобретения предложено применение физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего средне-численную степень полимеризации в интервале от 7 до 15 (предпочтительно от 8 до 12), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,85 (предпочтительно по меньшей мере 0,92), фракцию маннуроната (FM) не более 0,15(предпочтительно не более 0,08), и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 17 (предпочтительно менее 14), в изготовлении лекарственного средства, содержащего указанный олигогулуронат или олигогалактуронат в стерильном водном растворе в концентрации от 40 до 140 мг/мл (в пересчете на натриевую соль), для использования в способе лечения для снижения вязкости слизи на поверхности слизистой оболочки путем нанесения на указанную поверхность, например, при лечении муковисцидоза, экссудативного отита, синусита, хронической обструктивной болезни легких(COPD, в частности в ее влажных формах), бронхита, эмфиземы, нарушенной фертильности, либо для усиления доставки лекарственного вещества через поверхность слизистой оболочки. В еще одном следующем аспекте изобретения предложен способ лечения субъекта, являющегося человеком или позвоночным животным (например млекопитающего, птицы или рептилии, предпочтительно млекопитающего) для снижения вязкости слизи на поверхности слизистой оболочки, включающий введение на указанную поверхность эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего средне-численную степень полимеризации в интервале от 7 до 15 (предпочтительно от 8 до 12), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,92 (предпочтительно по меньшей мере 0,95), фракцию маннуроната (FM) не более 0,08 (предпочтительно не более 0,05), и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 17 (предпочтительно менее 14). В еще одном следующем аспекте в изобретении предложен способ лечения субъекта, являющегося человеком или позвоночным животным (например млекопитающего, птицы или рептилии, предпочтительно млекопитающего) для снижения вязкости слизи на поверхности слизистой оболочки, включающий введение на указанную поверхность эффективного количества стерильного водного раствора, содержащего в концентрации от 40 до 140 мг/мл (в пересчете на натриевую соль) физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий средне-численную степень полимеризации в интервале от 7 до 15 (предпочтительно от 8 до 12), фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,85 (предпочтительно по меньшей мере 0,92), фракцию маннуроната (FM) не более 0,15(предпочтительно не более 0,08), и имеющий по меньшей мере 95 мол.% со степенью полимеризации менее 17 (предпочтительно менее 14). В способах по изобретению введение на поверхность слизистой оболочки может быть непосредственным, например путем введения пессария, путем впрыскивания вагинального геля, путем впрыскивания или введения капель в ухо или нос или путем ингаляции капель спрея в нос или легкие, либо непрямым, например, путем введения суппозитория или клизмы для достижения дистального конца желудочно-кишечного тракта. В другом аспекте изобретения предложен способ лечения субъекта, являющегося человеком или позвоночным животным (например млекопитающего, птицы или рептилии, предпочтительно млекопитающего), для борьбы с гипервязкостью слизи в ушах, пазухе или легких указанного субъекта, включающий введение в уши, нос или легкие указанного субъекта эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего средне-численную степень полимеризации в интервале от 5 до 18, фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,92, фракцию маннуроната (FM) не более 0,08, и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 20, предпочтительно в стерильном водном растворе в концентрации от 40 до 140 мг/мл (в пересчете на натриевую соль). Нанесение олигоуроната в этом способе можно осуществлять с помощью любых средств, которые доставляют его на поверхность, секретирующую слизь или несущую слизь, в уши или дыхательные пути пациента, например в придаточные пазухи носа или более предпочтительно в легкие. Введение типично осуществляют путем ингаляции, например, капель жидкости (например аэрозоля) или порошка, либо путем введения капель в нос или уши. Авторы изобретения также обнаружили, что олигогулуронаты и олигогалактуронаты можно применять для усиления всасывания через поверхность слизистой оболочки физиологически активного агента(здесь далее "лекарственного вещества"). Таким образом, в следующем аспекте изобретения предложена фармацевтическая композиция, содержащая лекарственное вещество и физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий средне-численную степень полимеризации в интервале от 5 до 18, фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,80, фракцию маннуроната(FM) не более 0,20, и имеющий по меньшей мере 95 мол.% со степенью полимеризации менее 20, предпочтительно один из олигоуронатов, описанных выше как предпочтительные. Такие композиции могут принимать любую общепринятую форму, например порошков, таблеток, капсул, растворов, суппозиториев, дисперсий и т.д., и могут быть получены общепринятым способом, используя общепринятые фармацевтические носители и эксципиенты. Лекарственное вещество предпочтительно представляет собой заряженную молекулу, в частности макромолекулу (например имеющую молекулярную массу выше 2 кДа), например полиэлектролит или амфолит, в частности отрицательно заряженную молекулу. Так, например, лекарственное вещество может представлять собой сложную макромолекулу, такую как гликопротеин, например трансферрин. В следующем аспекте изобретения предложено применение физиологически переносимого олигогулуроната или олигогалактуроната, имеющего средне-численную степень полимеризации в интервале от 5 до 18, фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,80, фракцию маннуроната (FM) не более 0,20, и имеющего по меньшей мере 95 мол.% со степенью полимеризации менее 20, предпочтительно одного из олигоуронатов, описанного выше как предпочтительный, в изготовлении лекарственного средства, дополнительно содержащего лекарственное вещество, для введения на поверхность слизистой оболочки для всасывания через нее указанного лекарственного вещества. В еще одном следующем аспекте изобретения предложен способ лечения субъекта, являющегося человеком или позвоночным животным, включающий введение на поверхность слизистой оболочки эффективного количества лекарственного вещества для борьбы с состоянием, реагирующим на указанное лекарственное вещество, отличающийся тем, что он включает введение указанного лекарственного вещества с физиологически приемлемым олигогулуронатом или олигогалактуронатом, имеющим среднечисленную степень полимеризации в интервале от 5 до 18, фракцию гулуроната (или галактуроната) (FG) по меньшей мере 0,80, фракцию маннуроната (FM) не более 0,20, и имеющим по меньшей мере 95 мол.% со степенью полимеризации менее 20, предпочтительно одного из олигоуронатов, описанного выше как предпочтительный. Введение типично является назальным, путем ингаляции, ректальным или вагинальным. Лекарственное вещество типично используют в количестве от 50 до 110% его обычной дозы. Хотя олигоуронат может представлять собой синтетическое вещество, предпочтительно он представляет собой производное природного полисахарида. Он может представлять собой отдельное соединение, либо может представлять собой смесь соединений олигоуроната, например в интервале степеней полимеризации. Олигоуронаты легко доступны из природных источников, поскольку многие натуральные полисахариды находятся в форме блоксополимера, содержащего звенья остатков гулуроновой кислоты (так называемые G-блоки), часто вместе со звеньями остатков маннуроновой кислоты (так называемые Mблоки). M-блоки или M/G-блоки можно использовать вместо G-блоков в соответствии с изобретением; однако, это не является предпочтительным. Расщепление полисахаридов до олигосахаридов с получением олигоуронатов, применимых в соответствии с настоящим изобретением, можно осуществить, используя общепринятые методики лизиса полисахаридов, такие как ферментативное расщепление и кислотный гидролиз. Однако предпочтительно использование кислотного гидролиза. Затем олигоуронаты с желаемой DPn и желаемым распределением по молекулярной массе можно отделить от продуктов распада полисахаридов хроматографическим путем, используя ионообменную смолу, путем фракционированного осаждения или солюбилизации, либо путем диализа. Пригодные полисахариды обсуждаются, например, в "Handbook of Hydrocolloids", Ed. Phillips и Williams, CRC, Boca Raton, Florida, USA, 2000. Использование альгинатов, однако, особенно предпочтительно, поскольку они встречаются в природе в виде блоксополимеров маннуроновой (М) и гулуроновой (G) кислот, и олигомеры G-блоков могут быть легко получены из источников альгинатов. Если альгинаты используют в качестве исходного вещества для получения олигоуроната, содержание гулуроновой кислоты можно при желании повысить путем эпимеризации посредством маннуронанС-5-эпимеразами из А. vinelandii. Олигогулуронаты, пригодные для применения в соответствии с изобретением, могут быть удобным образом получены путем кислотного гидролиза альгиновой кислоты из Laminaria hyperborea, растворения при нейтральном рН, добавления минеральной кислоты для снижения pH до 3,4 для осаждения олигогулуроната, промывания слабой кислотой, ресуспендирования при нейтральном pH и лиофилизации. Далее изобретение описано дополнительно со ссылкой на приведенные ниже не ограничивающие примеры и сопроводительные графические материалы, в которых на фиг. 1 а и 1 б, 2 а и 2 б и 3 а и 3 б показаны изменения в G (сверху) и(снизу) в мокроте от пациента с COPD с течением времени и в зависимости от добавленного олигоуроната. Фиг. 4 представляет собой хроматограмму Dionex материала G-блоков с DPn 10, используемого в примере 7, и для сравнения материала предшественника с DPn 19, из которого не удален высокомолекулярный хвост; и на фиг. 5 показано развитие с течением времени механических свойств модельной слизи в присутствии материала Gблоков с фиг. 4. Пример 1. Получение натрия олигогулуроната DPn 5-18. 1. Богатую гулуронатом альгиновую кислоту (pH 2-3; 15-40% сухой массы) из стволов-черешков листа Laminaria hyperborea подвергают интенсивному гидролизу минеральной или органической кислотой, предпочтительно HCl, при 70-100 С в течение 2-12 ч. 2. После гидролиза pH смеси олигосахаридов повышают до 3-4 и промывают ее водой низкой ионной силы для удаления М-богатых фрагментов и низкомолекулярных компонентов. 3. При необходимости очищенную смесь олигосахаридов подвергают гидролизу и далее очищают,как на стадиях 1 и 2. 4. Затем очищенную смесь олигосахаридов нейтрализуют щелочью, предпочтительно NaOH илиNa2CO3, с получением растворимых G-блоков и содержание сухого вещества доводят до 2,5-20%. 5. Для получения продукта с приемлемой величиной средней степени полимеризации, а также распределением молекулярных масс, раствор G-блоков дважды фильтруют. Сначала через фильтр с примерной отсекаемой фракцией 1000 Да для удаления олигомеров ниже DP 5. Затем удержанную фракцию фильтруют через фильтр с примерной отсекаемой фракцией 4000 Да для удаления фрагментов G-блоков выше примерно DP 20. 6. При необходимости доводят содержание сухого вещества полученной удержанной фракции и раствор высушивают распылением. Полученный в результате порошок от грязно-белого до светложелтого цвета (продукт) имеет содержание влаги менее чем 15%. Пример 2. Получение натрия олигогулуроната с DPn 7-15. Стадии получения являются следующими: 1) как в примере 1 выше; 2) как в примере 1 выше; 3) как в примере 1 выше. 4. Для оптимизации выхода и чистоты содержание сухого вещества смеси олигосахаридов доводят до 5-15%, смесь олигосахаридов солюбилизируют в ацетатном буфере (50-250 мМ) до достижения конечного pH раствора 3,8-5,0. 5. Солюбилизированный олигосахарид в ацетатном буфере подвергают дальнейшему гомогенному гидролизу при 70-100C в течение 1-15 ч для снижения содержания высокомолекулярных фрагментов и повышения содержания физиологически активных фрагментов G-блоков. 6. Фильтрование (также включая обессоливание) и распылительную сушку осуществляют, как описано на стадиях 5 и 6 примера 1 выше. Олигогулуронаты могут быть также получены, как описано в патенте США 6121441 и в патенте США 6407226, содержание которых включено здесь путем ссылки. Действительно, продукты примеров 1 и 2 здесь могут быть с успехом получены с использованием олигогулуроната, полученного в соответствии с патентом США 6121441, в качестве исходного вещества. Пример 3. Характеристика и контроль качества. Для примеров 1 и 2, включая проверку промежуточных продуктов, используют приведенные ниже методики. Чистоту (содержание остатков гулуроновой кислоты) и величину средней степени полимеризации определяют с помощью 1 Н-ЯМР спектроскопии, как описано Grasdalen et al. in Carbohydr. Res. 68(1):2331 (1979). Высокоэффективную анионообменную хроматографию с импульсным амперометрическим детектированием (HPAEC-PAD) (от Dionex), также используют для определения характеристик олигомерного вещества. Для определения характеристик G-блоков используют следующий способ. 1. Образцы G-блоков солюбилизируют в MQ воде, 1-2 мг/мл. 2. 0,1 М раствор NaOH (без карбоната) используют в качестве подвижной фазы, а в качестве элюента используют 1,0 М ацетат натрия. Все растворы дегазируют гелием и фильтруют через фильтр 0,22 мкм. 3. Впрыскивают образцы 20 мкл и используют предварительную колонку AG4A и основную колонку lonPac 4250 AS4A. 4. Колонки элюируют линейным градиентом от 0 до 87,5% Na-ацетата в 0,1M NaOH в течение 90 мин. Скорость элюирования составляет 1 мл/мин при режиме давления 650-750 фунт/кв.дюйм (4481,5925171,067 кПа). 5. После определения коэффициента чувствительности детектора как функции длины цепи можно вычислить концентрацию каждого олигомера, подразумевая, что можно определить как числовую, так и средневзвешенную молекулярную массу, а также распределение по молекулярной массе. Возможная дополнительная обработка олигосахарида: это соображение, т.е. если релевантные параметры находятся вне желаемых интервалов, связано с выходом изготовления продукта. Не составляет проблемы получить какой-либо продукт гидролизата альгината с высоким содержанием G, который со-8 018776 ответствовал бы требуемым интервалам параметров, но выход может быть низким. Можно предложить следующую рекомендацию для оптимизации выхода так, чтобы не выходить за рамки требуемых интервалов параметров. а) FG слишком низкая: дополнительный гидролиз (GG-связи более устойчивы к кислотному гидролизу) или/и дополнительная отмывка при несколько более высоких значениях pH (M-богатые фрагменты более растворимы в кислоте, чем G-богатые фрагменты). б) "Неправильная" DPn: если средняя DPn слишком низкая, выход будет снижен вследствие повышенной потери при фильтровании через фильтр 1 кДа. Выход, однако, можно повысить, когда средняяDPn слишком высока; здесь усиленный кислотный гидролиз приведет в результате к большему количеству молекул, находящихся в пределах желаемых интервалов параметров. Пример 4. Растворы для введения. Ингаляционные растворы готовят путем растворения натрия олигогулуронатов с DPn 5-18 или 7-15,полученных в соответствии с примерами 1 и 2 соответственно, в стерильной воде для инъекций в концентрациях 6, 8 и 10 мас.%. Затем аликвоты этих растворов загружают в спрей-аппликатор для введения в легкие в дозах от 1 до 5 мл, предпочтительно 2-3 мл. Дополнительные аликвоты загружают в бутылки с крышками, снабженными пипетками. Капли можно вводить в нос или в уши, например по 2-4 капли в ухо или ноздрю. Пример 5. Вагинальный гель. Натрия олигогулуронаты, полученные в соответствии с примерами 1 и 2, смешивают с имеющимся в продаже вагинальным смазывающим гелем (например K-Y Jelly (от JohnsonJohnson) или Astroglide(от BioFilm Inc. в концентрациях 5 и 15 мас.%. Гель наносят свободно, предпочтительно за 2-4 ч до осеменения или полового акта. Пример 7. Эффект в отношении муцина. Образцы мокроты собирали у пациентов с хронической обструктивной болезнью легких (COPD). Образцы аккуратно перемешивали, делили на части, замораживали и хранили при -40C. Контроль и смешанные образцы (мокрота и G-блок) аккуратно перемешивали в течение 1 мин, дегазировали примерно при 10 мБар (1 КПа) 2 раза в течение 1 мин, а затем помещали в холодильник на 5 мин, после чего их переносили в реометр для тестирования. Реологические измерения чистой и смешанной мокроты COPD проводили на пластине/конусе (40 мм/1 или 25 мм/1 в зависимости от количества образца), используя реометр общего назначенияRheologica Stress-Tech, при 10C для минимизации эффекта каких-либо присутствующих протеолитических ферментов. Реологическую характеристику чистой мокроты COPD и мокроты, смешанной с G-блоками, проводили за четыре различные стадии: 1) контроль осциллирующего напряжения в течение 2 мин при постоянном напряжении 0,03 и частоте 1 Гц; 2) контроль осциллирующего напряжения после предварительного сдвига (1 мин при скорости сдвига 20 с-1) в течение 60 мин при постоянном напряжении 0,03 и частоте 1 Гц; 3) колебание частоты с диапазоном 0,01-5 Гц при постоянном напряжении 0,03; 4) колебание давления с диапазоном 0,02-20 Па при 1 Гц. Обработка 2 (предварительный сдвиг и измерение в течение 1 ч) представляет собой основу для представленных экспериментальных результатов. Данную обработку повторяли 2-3 раза в пределах 0-24 ч. Здесь представлены результаты, полученные для трех образцов ex vivo мокроты COPD. Они протестированы реологическим способом "как таковые" (контроль), а также с добавлением G-блоков чистая мокрота (контроль); мокрота + 75 мкл 150 мг/мл (на 0,5 г образец мокроты) олигомеров натрия гулуроната с DP 10. Олигомер натрия гулуроната с DP 10 имел приведенные ниже характеристики:FG 0,79, FM 0,11, FGG 0,76, FGM = FMG 0,03, FMM 0,07, FMGG = FGGM 0,02, FMGM 0,01, FCGG 0,74, FG(red) 0,10, FG(tot) 0,89, DPn 10. На фиг. 1a, 2a и 3 а показано развитие комплексного модуля (G) для образцов мокроты COPD (с олигоуронатом и без олигоуроната) после окончания обработки предварительным сдвигом и в данные интервалы времени после введения олигоуроната. На фиг. 1 б, 2 б и 3 б показано развитие комплексной вязкости того же образца мокроты, что и на фиг. 1 а, 2 а и 3 а. Добавление олигоуроната явно и зависимым от времени образом снижает механические свойства мокроты COPD ex vivo. Как комплексный динамический модуль, так и комплексная динамическая вязкость значительно снижаются. Воздействие на изменение угла сдвига, однако, не было таким сильным,как в случае G и эта(данные не включены). Это наиболее важно, поскольку ясно показывает, что механические свойства муциновой сети сохранены. Пример 8. Феномен арборизации. Муциновые композиции готовили следующим образом: а) 18 мг муцина на 1 мл 0,05 М водного NaCl; б) 18 мг муцина и 1 мг альгината на 1 мл 0,05 М водного NaCl и в) 18 мг муцина и 0,5 мг олигомера гулуроната (DPn = 10, как в примере 7) на 1 мл 0,05 М NaCl. Композиции высушивали на воздухе и делали микрофотографии. Эти фотографии (не представлены) ясно показывают, что олигомер гулуроната способствует феномену арборизации. Пример 9. Механические свойства слизи. Готовили два модельных материала слизи: первый - 18 мг/мл муцина и 0,6 мг/мл альгината в воде; второй - только 18 мг/мл муцина. 4 мг/мл G-блока с DPn = 10 (как в примере 7) или с DPn = 19 добавляли к каждому материалу и регистрировали развитие динамического комплексного модуля G с течением времени для каждого образца. G является показателем механических свойств слизи. Результаты представлены на фиг. 5, в направлении сверху вниз: муцин/альгинат; муцин; муцин/альгинат плюс DPn 19 и муцин/альгинат плюс DPn 10. Как видно, G-блок с DPn 10, в котором отсутствует высокомолекулярный хвост, уменьшает свойства слизи, сходные с твердым веществом, в большей степени, чем G-блок с DPn 19. Фиг. 4 представляет собой хроматограмму Dionex для двух используемых G-блоков. Как видно, образец с DPn 19 имеет плечо, продленное вправо, что указывает на присутствие высокомолекулярного хвоста. Пример 10. Композиция этанерсепта.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 40 мг/мл в водном растворе этанерцепта 50 мг/мл для инъекций (имеющемся в продаже от Registered Trade Mark Enbrel из Amgen, CA,USA). Пример 11. Композиция инфликсимаба.Centocor, PA, USA под зарегистрированным товарным знаком Ремикад (Remicade растворяют в стерильной воде. Пример 12. Композиция ритуксимаба.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 10 мг/мл в водном растворе ритуксимаба 10 мг/мл для инъекций (имеющемся в продаже под зарегистрированным товарным знаком Ритуксан (Rituxan) от Genentech, CA, USA). Пример 13. Композиция эритропоэтина.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 8 мг/мл в водном растворе эритропоэтина 4000 ед./мл для инъекций (имеющемся в продаже под зарегистрированным товарным знаком Эпоген (Epogen) от Amgen, CA, USA). Пример 14. Композиция G-CSF.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 9 мг/мл в водном растворе пэгфилграстима 10 мг/мл для инъекций (имеющемся в продаже под зарегистрированным товарным знаком Неуласта (Neulasta) от Amgen, CA, USA). Пример 15. Композиция трастузумаба.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 15 мг/мл, а трастузумаб (имеющемся в продаже под зарегистрированным товарным знаком Герцептин (Herceptin) от Genentech, CA,USA) при 22 мг/мл в бактериостатической воде для инъекций. Пример 16. Композиция интерферона.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 1 мг/мл в водном растворе 30 мкг/мл интерферона -1 а для инъекций (имеющемся в продаже под зарегистрированным товарным знаком Авонекс (Avonex) от Biogen Idee, Hoofddorp, NL). Пример 17. Композиция инсулина.G-блок с DPn = 10 (как в примере 7) растворяют в концентрации 10 мг/мл в водном растворе 100 ед./мл инсулина для инъекций (имеющемся в продаже под зарегистрированным товарным знаком Хумулин (Humulin) от Ely Lilly, IN, USA). Композиции примеров 10-17 можно типично вводить назально, вагинально или под язык, как правило, в дозировках порядка величины, рекомендованной поставщиками имеющихся в продаже лекарственных соединений, на которые ссылаются в данных примерах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая: (а) физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната или галактуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 20, и (б) макромолекулярное лекарственное вещество, имеющее молекулярную массу выше 2000 Да. 2. Композиция по п.1 для введения на поверхность слизистой оболочки субъекта, являющегося человеком или позвоночным животным. 3. Композиция по п.1 или 2, содержащая физиологически приемлемый олигогулуронат или олигогалактуронат, имеющий среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуро- 10018776 ната или галактуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17. 4. Композиция по любому из пп.1-3, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,92 и долю маннуроната (FM) не более 0,08. 5. Композиция по любому из пп.1-4, где указанный олигогулуронат или олигогалактуронат имеет среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната(FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08 и где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17. 6. Композиция по любому из пп.1-5, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05. 7. Композиция по любому из пп.1-6, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации. 8. Композиция по любому из пп.1-7, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза. 9. Способ лечения субъекта, являющегося человеком или позвоночным животным, направленный на снижение вязкости слизи на поверхности слизистой оболочки субъекта, включающий нанесение на поверхность слизистой оболочки эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната или галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08,где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 20. 10. Стерильная распыляемая водная композиция, содержащая водный раствор физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната или галактуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 20, где указанный раствор содержит олигогулуронат или олигогалактуронат в концентрации от 40 до 140 мг/мл в пересчете на его натриевую соль. 11. Композиция по п.10, содержащая раствор физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17. 12. Композиция по п.11, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,92 и долю маннуроната(FM) не более 0,08. 13. Композиция по любому из пп.11-12, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05. 14. Композиция по любому из пп.11-13, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации. 15. Композиция по любому из пп.11-14, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза. 16. Спрей-аппликатор, содержащий резервуар и генератор капель, где резервуар содержит стерильную водную композицию по любому из пп.10 или 15. 17. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 17, для усиления всасывания через поверхность слизистой оболочки субъекта макромолекулярного лекарственного вещества. 18. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 17, для усиления всасывания через поверхность слизистой оболочки субъекта макромолекулярного лекарственного вещества. 19. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта. 20. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта путем нанесения средства на указанную поверхность. 21. Применение по любому из пп.17-20, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05. 22. Применение по любому из пп.17-21, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации. 23. Применение по любому из пп.17-22, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза. 24. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства, содержащего олигогулуронат в стерильном водном растворе в концентрации от 40 до 140 мг/мл в пересчете на его натриевую соль, для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта путем нанесения средства на указанную поверхность. 25. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю галактуроната (FG) по меньшей мере 0,85, долю маннуроната (FM) не более 0,15, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 17, для изготовления лекарственного средства, содержащего олигогалактуронат в стерильном водном растворе в концентрации от 40 до 140 мг/мл в пересчете на его натриевую соль, для лечения, направленного на снижение вязкости слизи на поверхности слизистой оболочки субъекта путем нанесения средства на указанную поверхность. 26. Применение по п.24 или 25, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,92 и долю маннуроната (FM) не более 0,08. 27. Применение по пп.24-26, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната (FM) не более 0,05. 28. Применение по любому из пп.24-27, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации. 29. Применение по любому из пп.24-28, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза. 30. Способ лечения субъекта, являющегося человеком или позвоночным животным, направленный на снижение вязкости слизи на поверхности слизистой оболочки субъекта, включающий введение на указанную поверхность эффективного количества физиологически приемлемого олигогулуроната или олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 7 до 15, долю гулуроната или галактуроната (FG) по меньшей мере 0,92, долю маннуроната (FM) не более 0,08, где по меньшей мере 95 мол.% олигогулуроната или олигогалактуроната имеют степень полимеризации менее 17. 31. Способ по п.9 или 30, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет долю гулуроната или галактуроната (FG) по меньшей мере 0,95 и долю маннуроната(FM) не более 0,05. 32. Способ по любому из пп.30 или 31, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат имеет интервал степеней полимеризации. 33. Применение по любому из пп.9 или 30-32, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат получен посредством кислотного гидролиза. 34. Способ лечения субъекта, являющегося человеком или позвоночным животным, направленный на снижение вязкости слизи на поверхности слизистой оболочки субъекта, включающий введение на указанную поверхность эффективного количества стерильного водного раствора, содержащего от 40 до 140 мг/мл в пересчете на его натриевую соль физиологически приемлемого олигогулуроната или олигогалактуроната, как он определен в любом из пп.11-15. 35. Применение физиологически приемлемого олигогулуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю гулуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогулуроната имеют степень полимеризации менее 20, для изготовления лекарственного средства, дополнительно содержащего лекарственное вещество, для введения на поверхность слизистой оболочки субъекта и всасывания через нее указанного лекарственного вещества для лечения состояния, реагирующего на указанное лекарственное вещество. 36. Применение физиологически приемлемого олигогалактуроната, имеющего среднечисленную степень полимеризации в интервале от 5 до 18, долю галактуроната (FG) по меньшей мере 0,80, долю маннуроната (FM) не более 0,20, где по меньшей мере 95 мол.% олигогалактуроната имеют степень полимеризации менее 20, для изготовления лекарственного средства, дополнительно содержащего лекарственное вещество, для введения на поверхность слизистой оболочки субъекта и всасывания через нее указанного лекарственного вещества для лечения состояния, реагирующего на указанное лекарственное вещество. 37. Применение по п.35 или 36, где указанный физиологически приемлемый олигогулуронат или олигогалактуронат является таким, как он определен в любом из пп.3-8. 38. Способ лечения субъекта, являющегося человеком или позвоночным животным, путем введения на поверхность слизистой оболочки субъекта эффективного количества лекарственного вещества для лечения состояния, реагирующего на указанное лекарственное вещество, отличающийся тем, что включает введение указанного лекарственного вещества с физиологически приемлемым олигогулуронатом или олигогалактуронатом, как он определен в любом из пп.1 или 3-8.
МПК / Метки
МПК: A61K 31/715
Метки: применение, композиция, способы, содержащий, олигогулуронат, содержащая, фармацевтическая, галактуронат, спрей-аппликатор, использованием, лечения
Код ссылки
<a href="https://eas.patents.su/16-18776-farmacevticheskaya-kompoziciya-soderzhashhaya-oligoguluronat-ili-galakturonat-sposoby-lecheniya-s-ee-ispolzovaniem-ee-primenenie-i-soderzhashhijj-ee-sprejj-applikator.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция, содержащая олигогулуронат или галактуронат, способы лечения с ее использованием, ее применение и содержащий ее спрей-аппликатор</a>
Предыдущий патент: Применение тестостерона в форме водно-спиртового геля для лечения детского гипогонадизма
Следующий патент: Способ газификации отходов
Случайный патент: Малатная соль n-(4-{[6,7-бис-(метилокси)хинолин-4-ил]окси}фенил)-n'-(4-фторфенил)циклопропан-1,1-дикарбоксамида и ее кристаллические формы для лечения рака