Способ получения дифторметилпиразолилкарбоксилатов
Номер патента: 17900
Опубликовано: 30.04.2013
Авторы: Дитц Йохен, Райнхаймер Йоахим, Лёр Зандра, Зукопп Мартин, Цирке Томас, Кайл Михаэль, Ломанн Ян Клаас, Гроте Томас, Ракк Михаель, Шмидт Зебастиан Пеер
Формула / Реферат
1. Способ получения дифторметилзамещенных пиразол-4-илкарбоксилатов общей формулы (I)
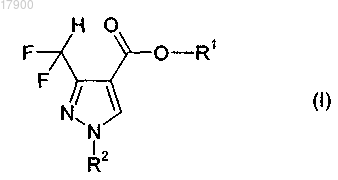
в которой R1 означает C1-C6-алкил, C3-C8-циклоалкил, C1-C4-алкокси-C1-C4-алкил, C3-C8-циклоалкокси-C1-C4-алкил, C2-C8-алкенил или бензил, при необходимости замещенный посредством 1, 2 или 3 заместителей Ry1, независимо друг от друга выбранных из C1-C4-алкила, C1-C4-алкокси или нитро;
R2 означает водород, C1-C4-алкил, бензил или фенил, причем оба названных последними заместителя могут быть незамещенными или при необходимости замещенными посредством 1, 2 или 3 заместителей Ry2, выбранных независимо друг от друга из галогена, CN, нитро, C1-C4-алкила, C1-C4-галоалкила, C1-C4-алкокси или C1-C4-галоалкокси;
причем
а) соединение общей формулы (II)

в которой X означает фтор, хлор или бром;
R1 имеет одно из приведенных ранее значений и
R4 означает C1-C8-алкил, C3-C8-циклоалкил, C2-C8-алкенил, бензил или фенил,
взаимодействует с силановым соединением общей формулы
R3nSiCl(4-n),
в которой n означает 1, 2 или 3 и
заместители R3 независимо друг от друга выбраны из C1-C8-алкила или фенила,
и металлом, который выбран из металлов групп 1, 2, 3, 4 и 12 Периодической системы элементов и имеет окислительно-восстановительный потенциал менее чем -0,7 V, в пересчете на нормальный водородный электрод (при 25°C и 101,325 кПа); и
б) реакционная смесь из стадии а) взаимодействует с соединением общей формулы (III)
R2HN-NH2 (III),
в которой R2 имеет одно из приведенных ранее значений.
2. Способ по п.1, в котором металл представляет собой магний.
3. Способ по одному из предыдущих пунктов, включающий использование силанового соединения общей формулы
R3nSiCl(4-n),
в которой n означает 2 или 3.
4. Способ по одному из предыдущих пунктов, где в силановом соединении заместители R3 независимо друг от друга выбраны из C1-C4-алкила.
5. Способ по п.3 или 4, где силановое соединение выбрано из группы, включающей триметилсилилхлорид, этилдиметилсилилхлорид, диметилпропилсилилхлорид, диметилизопропилсилилхлорид, n-бутилдиметилсилилхлорид, 2-бутилдиметилсилилхлорид, (2-метилпропил)диметилсилилхлорид, диметилдихлорсилан, диэтилдихлорсилан и трет-бутилдиметилсилилхлорид.
6. Способ по одному из предыдущих пунктов, где R4 в соединении формулы (II) выбран из C1-C4-алкила или бензила.
7. Способ по одному из предыдущих пунктов, в котором взаимодействие на стадии а) осуществляют в безводной среде.
8. Способ по п.7, в котором взаимодействие на стадии а) проводят в растворителе, выбранном из N-C1-C4-алкиллактамов, N-ди(C1-C4-алкил)амидов алифатических C1-C4-карбоновых кислот, N,N,N',N'-тетра(C1-C4-алкил)алкилмочевин, 1,3-ди(C1-C4-алкил)гексагидропиримидин-2-она и 1,3-ди(C1-C4-алкил)имидазолин-2-она.
9. Способ по одному из предыдущих пунктов, в котором взаимодействие на стадии б) осуществляют в присутствии воды.
10. Способ по п.9, где взаимодействие на стадии б) осуществляют в смеси из C1-C4-алканола и воды.
11. Способ по одному из предыдущих пунктов, в котором в соединениях формул (I) и (II) R1 означает C1-C4-алкил или бензил.
12. Способ по одному из предыдущих пунктов, где соединение общей формулы (III) выбрано из C1-C4-алкилгидразинов и гидразингидрата.
13. Способ получения пиразол-4-карбоновой кислоты общей формулы (IV)
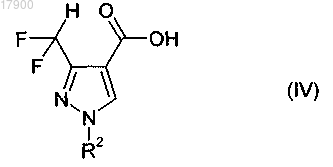
в которой R2 имеет одно из приведенных ранее значений,
включающий:
i) получение соединения формулы (I) способом по одному из пп.1-10 и
ii) гидролиз соединения (I) до получения карбоновой кислоты (IV).
14. Способ по п.13, в котором основный гидролиз происходит в присутствии водного раствора гидроксида щелочного металла или раствора гидроксида щелочно-земельного металла.
15. Способ получения анилидов пиразол-4-карбоновой кислоты общей формулы (V)

в которой R2 имеет указанное ранее значение;
R5 выбран из галогена, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкилтио, C1-C6-галоалкила, C1-C6-галоалкокси или C1-C6-галоалкилтио;
m означает 0, 1, 2, 3 или 4;
R6 выбран из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, причем 6 указанных выше остатков являются незамещенными или могут быть частично или полностью галогенированы и/или могут иметь 1, 2, 3, 4 или 5 заместителей Ray, причем Ray независимо друг от друга выбраны из циано, нитро, гидрокси, меркапто, амино, карбоксил, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, C1-C6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(С1-С6-алкил)амино, C1-C6-алкилсульфонила, С1-С6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси; С3-С14-циклоалкила или фенила, которые являются незамещенными или могут иметь 1, 2, 3, 4 или 5 заместителей Rax, причем Rax независимо друг от друга выбраны из галогена, циано, нитро, гидрокси, меркапто, амино, карбоксила, C1-C6-алкила, C1-C6-галоалкила, C3-С6-циклоалкила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, C1-C6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(С1-С6-алкил)амино, C1-C6-алкилсульфонила, C1-C6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси;
включающий получение пиразолкарбоксилата формулы (I) способом по одному из пп.1-10 и взаимодействие пиразолкарбоксилата формулы (I) с аминосоединением формулы (VI)
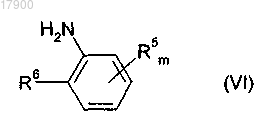
в которой m, R5 и R6 имеют указанные ранее значения.
16. Способ получения анилидов пиразол-4-карбоновой кислоты общей формулы (V)
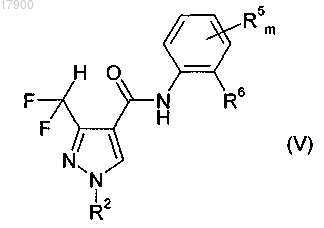
в которой R2 имеет указанное ранее значение;
R5 выбран из галогена, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкилтио, C1-C6-галоалкила, C1-C6-галоалкокси или C1-C6-галоалкилтио;
m означает 0, 1, 2, 3 или 4;
R6 выбран из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, причем 6 указанных выше заместителей являются незамещенными или могут быть частично или полностью галогенированы и/или могут иметь 1, 2, 3, 4 или 5 заместителей Ray, причем Ray независимо друг от друга выбраны из циано, нитро, гидрокси, меркапто, амино, карбоксила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, С1-С6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(C1-C6-алкил)амино, C1-C6-алкилсульфонила, C1-C6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси; C3-С14-циклоалкила или фенила, которые являются незамещенными или могут иметь 1, 2, 3, 4 или 5 заместителей Rax, причем Rax независимо друг от друга выбраны из галогена, циано, нитро, гидрокси, меркапто, амино, карбоксила, C1-C6-алкила, C1-C6-галоалкила, C3-C6-циклоалкила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, C1-C6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(C1-C6-алкил)амино, C1-C6-алкилсульфонила, C1-C6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси;
включающий получение пиразол-4-карбоновой кислоты формулы (IV) способом по п.11, при необходимости переведение пиразол-4-карбоновой кислоты (IV) в ее галогенид карбоновой кислоты и последующее взаимодействие пиразол-4-карбоновой кислоты формулы (IV) или ее галогенида карбоновой кислоты с аминосоединением формулы (VI).
17. Соединение формулы (А)
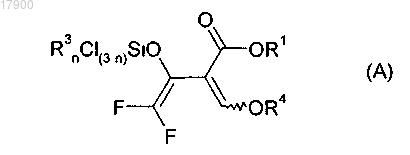
в которой R1 и R4 имеют одно из приведенных для формулы (II) значений и
R3 независимо друг от друга выбраны из С1-С8-алкила или фенила.
Текст
Настоящее изобретение относится к способу получения дифторметилзамещенных пиразол-4 илкарбоксилатов формулы (I) в которой R1 означает C1-C8-алкил, C3-C8-циклоалкил, C1-C4-алкокси-C1-C4-алкил и т.д.; R2 означает водород, C1-C4-алкил, бензил или фенил, причем а) соединение общей формулы (II) в которой X означает фтор, хлор или бром; R1 имеет одно из приведенных ранее значений иR4 означает C1-C8-алкил, C3-C8-циклоалкил, C2-C8-алкенил, бензил или фенил, взаимодействует с силановым соединением общей формулы R3nSiCl(4-n), в которой n означает 1, 2 или 3 и заместителиR3 независимо друг от друга выбраны из C1-C6-алкила или фенила, и с металлом, который выбран из металлов 1, 2, 3, 4 и 12 группы Периодической системы элементов и имеет окислительновосстановительный потенциал менее чем -0,7 V, в пересчете на нормальный водородный электрод(при 25C и 101,325 кПа); и б) реакционная связь из стадии а) взаимодействует с соединением общей формулы (III) в которой R2 имеет одно из приведенных ранее значений. Настоящее изобретение относится к способу получения дифторметилзамещенных пиразол-4 илкарбоксилатов. Заявка WO 92/12970 описывает (3-дифторметил-1-метилпиразол-4-ил)карбоксамиды и их применение в качестве фунгицидов. Получение осуществляется исходя из сложного 2,2-дифторацетоуксусного эфира, который постепенно подвергают взаимодействию с триэтилортоформиатом и с метилгидразином,причем получают сложный эфир 3-дифторметил-1-метилпиразол-4-карбоновой кислоты, который затем омыляется до карбоновой кислоты, которую после превращения в хлорангидрид кислоты подвергают взаимодействию с пригодным амином до получения соответствующего амида. Однако выработка необходимого в качестве исходного продукта 4,4-дифторированного ацетоуксусного эфира является сравнительно дорогостоящей и тяжелой и для этого способа представляет собой затруднение. Заявка WO 2005/044804 описывает сложные алкиловые эфиры фторметилзамещенных гетероциклических карбоновых кислот, а также их получение посредством галогенного обмена в соответствующих хлорметилзамещенных гетероциклических эфиров карбоновых кислот и их дальнейшей переработки до получения анилидов фторметилзамещенных гетероциклических карбоновых кислот. Тем не менее, применение фторирующих агентов является дорогостоящим и предъявляет особые требования к мерам предосторожности и к применяемому оборудованию. Таким образом, в основе настоящего изобретения лежит задача предоставить альтернативные способы получения (3-дифторметилпиразол-4-ил)карбоксилатов и их производных, которые исходят из продуктов, выработка которых является менее дорогостоящей, чем, например, получение 4,4 дифторацетоуксусного эфира. Неожиданно было обнаружено, что эта задача решается путем взаимодействия 4,4,4-тригалогензамещенных производных ацетоуксусного эфира, который в дальнейшем определен формулой (II) с хлорсиланами в присутствии магния или других металлов 1, 2, 3, 4 или 12 группы Периодической системы элементов и последующего взаимодействия продукта реакции с гидразином или производным гидразина. Итак, объектом настоящего изобретения является способ получения дифторметилзамещенных пиразол-4-илкарбоксилатов общей формулы (I) в которой R1 означает C1-C8-алкил, C3-C8-циклоалкил, C1-C4-алкокси-C1-C4-алкил, C3-C8 циклоалкокси-C1-C4-алкил, C2-C8-алкенил или означает при необходимости замещенный бензил посредством 1, 2 или 3 заместителей Ry1, независимо друг от друга выбранных из C1-C4-алкила, C1-C4-алкокси или нитро;R2 означает водород, C1-C4-алкил, бензил или фенил, причем оба приведенных последними заместителя могут быть незамещенными или при необходимости замещенными посредством 1, 2 или 3 заместителей Ry2, независимо друг от друга выбранных из галогена, CN, нитро, C1-C4-алкила, C1-C4 галоалкила, C1-C4-алкокси или C1-C4-галоалкокси; причем подвергают взаимодействиюa) соединение общей формулы (II)R1 имеет одно из приведенных ранее значений иR4 означает C1-C8-алкил, C3-C8-циклоалкил, C2-C8-алкенил, бензил или фенил,с соединением силана общей формулыR3nSiCl(4-n),в которой n означает 1, 2 или 3 и заместители R3 независимо друг от друга выбраны из C1-C8-алкила или фенила,и металлом, который выбран из металлов 1, 2, 3, 4 и 12 группы Периодической системы элементов и имеет окислительно-восстановительный потенциал менее чем -0,7 V, в пересчете на нормальный водородный электрод (при 25C и 101,325 кПа); иb) реакционную смесь из стадии a) подвергают взаимодействию с соединением общей формулы(III) в которой R2 имеет одно из приведенных ранее значений. Способ согласно изобретению имеет целый ряд преимуществ. Он обеспечивает пиразоловое соединение формулы (II) с высоким выходом и, в случае взаимодействия с замещенными гидразинами (III)(R2H), с высокой региоселективностью. К тому же можно отказаться от дорогих исходных веществ, дифторметилкарбонильных соединений, таких как 2,2-дифторацетоуксусный эфир, и вместо него использовать гораздо более дешевые трифторметилкарбонильные соединения и галодифторметильные соединения, такие как 2,2,2-трифторацетоуксусный эфир или 2-хлор-2,2-дифторацетоуксусный эфир. Применяемыми при определении переменных понятиями для органических групп являются, как,например, выражение "галоген", собирательные понятия, которые заместительно означают отдельные члены этих групп органических единиц. Префикс Cx-Cy в соответствующем случае обозначает число возможных атомов углерода. Понятие "галоген" в каждом случае обозначает фтор, бром, хлор или йод, особенно фтор, хлор или бром. Примерами других значений являются следующие. Понятие "C1-C6-алкил", применяемое как здесь и в понятиях C1-C6-алкокси, C1-C6-алкиламино,ди(C1-C6-алкил)амино, C1-C6-алкилтио, C1-C6-алкилсульфонил, C1-C6-алкилсульфоксил, C1-C6 алкилкарбонил, C1-C6-алкоксикарбонил и C1-C6-алкилкарбонилокси, обозначает насыщенную, неразветвленную или разветвленную углеводородную группу, включающую от 1 до 6 атомов углерода, особенно от 1 до 4 атомов углерода, например метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2 метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил,1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3 метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил,2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2 триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил и их изомеры. C1-C4-алкил включает,например, метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил или 1,1-диметилэтил. Понятие "C1-C6-галоалкил", применяемое как здесь и в галоалкильных единицах C1-C6-галоалкокси,описывает неразветвленные или разветвленные алкильные группы с 1-6 атомами углерода, причем атомы водорода этих групп частично или полностью замещены атомами галогена, например C1-C4 галоалкилом, таким как хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил,трифторметил, хлорофторметил, дихлорфторметил, хлордифторметил, 1-хлорэтил, 1-бромэтил, 1 фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил,2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил и т.д. Понятие "C1-C6-алкокси" описывает неразветвленные или разветвленные насыщенные алкильные группы, включающие от 1 до 6 атомов углерода, которые связаны через атом кислорода. Примеры включают C1-C6-алкокси, как, например, метокси, этокси, OCH2-С 2 Н 5, OCH(CH3)2, n-бутокси, OCH(CH3)-С 2 Н 5,OCH2-СН(CH3)2, OC(CH3)3, n-пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1 диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1-этилпропокси, n-гексокси, 1 метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2 диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1 этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси,1-этил-2-метилпропокси и т.д. Понятие "C1-C4-алкокси-C1-C4-алкил", применяемое как здесь, описывает C1-С 4-алкильные радикалы, причем атом углерода привязан к C1-C4-алкоксирадикалу. Примерами таковых являются СН 2-OCH3,СН 2-ОС 2 Н 5, n-пропоксиметил, СН 2-OCH(CH3)2, n-бутоксиметил, (1-метилпропокси)метил, (2 метилпропокси)метил, СН 2-OC(CH3)3, 2-(метокси)этил, 2-(этокси)этил, 2-(n-пропокси)этил, 2-(1 метилэтокси)этил, 2-(n-бутокси)этил, 2-(1-метилпропокси)этил, 2-(2-метилпропокси)этил, 2-(1,1 диметилэтокси)этил,2-(метокси)пропил,2-(этокси)пропил,2-(n-пропокси)пропил,2-(1 метилэтокси)пропил, 2-(n-бутокси)пропил, 2-(1-метилпропокси)пропил, 2-(2-метилпропокси)пропил, 2(1,1-диметилэтокси)пропил, 3-(метокси)пропил, 3-(этокси)пропил, 3-(n-пропокси)пропил, 3-(1 метилэтокси)пропил, 3-(n-бутокси)пропил, 3-(1-метилпропокси)пропил, 3-(2-метилпропокси)пропил, 3(1,1-диметилэтокси)пропил,2-(метокси)бутил,2-(этокси)бутил,2-(n-пропокси)бутил,2-(1 метилэтокси)бутил, 2-(n-бутокси)бутил, 2-(1-метилпропокси)бутил, 2-(2-метилпропокси)бутил, 2-(1,1 диметилэтокси)бутил, 3-(метокси)бутил, 3-(этокси)бутил, 3-(n-пропокси)бутил, 3-(1-метилэтокси)бутил,3-(n-бутокси)бутил, 3-(1-метилпропокси)бутил, 3-(2-метилпропокси)бутил, 3-(1,1-диметилэтокси)бутил,4-(метокси)бутил, 4-(этокси)бутил, 4-(n-пропокси)бутил, 4-(1-метилэтокси)бутил, 4-(n-бутокси)бутил, 4(1-метилпропокси)бутил, 4-(2-метилпропокси)бутил, 4-(1,1-диметилэтокси)бутил и т.д. Понятие "C1-C6-алкилкарбонил", применяемое как здесь, описывает неразветвленную или разветвленную насыщенную алкильную группу, включающую от 1 до 6 атомов углерода, которая конечно или внутренне связана через атом углерода карбонильной единицы. Понятие "C1-C6-алкоксикарбонил", применяемое как здесь, описывает неразветвленную или разветвленную алкоксигруппу, включающую от 1 до 6 атомов углерода, которая связана через атом углерода карбонильной единицы. Понятие "C1-C6-алкилкарбонилокси", применяемое как здесь, описывает неразветвленные или раз-2 017900 ветвленные насыщенные алкильные группы, включающие от 1 до 6 атомов углерода, которые конечно или внутренне связаны через атом углерода карбонильной единицы. Понятие "C2-C6-алкенил", применяемое как здесь и для алкенильных единиц C2-C6-алкенилокси,описывает неразветвленные и разветвленные ненасыщенные углеводородные радикалы, включающие от 2 до 6 атомов углерода и по меньшей мере одну углерод-углеродную двойную связь, как, например, этенил, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2 метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4 пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2 бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2 пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1 гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3 метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4 метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1 метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил,1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3 диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил 1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2 бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2 этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил и 1 этил-2-метил-2-пропенил. Понятие "C3-C14-циклоалкил", применяемое как здесь, описывает моноциклические, бициклические или полициклические углеводородные радикалы, включающие от 3 до 8 атомов углерода, особенно от 3 до 6 атомов углерода. Примеры моноциклических радикалов включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. Примеры бициклических радикалов включают бицикло[2.2.1]гептил, бицикло[3.1.1]гептил, бицикло[2.2.2]октил и бицикло[3.2.1]октил. Примерами трициклических радикалов являются адамантил и гомоадамантил. Двойная связь в соединении (II) и равным образом в дальнейшем определенных формулах (А) и (В) может иметь Е- или Z-конфигурацию (соответственно цис- или транс-конфигурацию, в пересчете на относительное расположение группы OR4 и трифторацетилового остатка). В предпочтительной форме осуществления способа согласно изобретению R1 в формулах (I) и (II) означает C1-C4-алкил или бензил, в особенности метил, этил или изопропил; особенно R1 означает этил. Далее для способа согласно изобретению является преимуществом, если R4 в формуле (II) выбран из C1-C4-алкила или бензила и в особенности из метила, этила, изопропила или бензила; особенно R4 означает этил. В формуле (II) X в особенности означает фтор или хлор. В особенно предпочтительной форме осуществления изобретения X означает фтор.R2 преимущественно означает водород или C1-C4-алкил; особенно R2 означает метил. Вследствие этого соединение общей формулы (III) предпочтительно выбрано из C1-C4-алкилгидразина или гидразина; особенно соединение общей формулы (III) представляет собой метилгидразин или гидразингидрат. Все описанные здесь взаимодействия проводят в стандартных для подобного рода реакций реакционных сосудах, причем проведение реакции может быть выполнено как непрерывно, так и дискретно. Как правило, данные реакции осуществляют без давления. В низкокипящих растворителях соответствующая реакция может быть проведена также и под давлением. Стадия а). Для осуществления стадии а) способа согласно изобретению подвергают взаимодействию соединение формулы (II) с силановым соединением и с металлом 1, 2, 3, 4 и 12 группы Периодической системы элементов, который имеет окислительно-восстановительный потенциал менее чем -0,7 V, в пересчете на нормальный водородный электрод (при 25C и 101,325 кПа), преимущественно с металлом 1, 2 или 3 главной группы Периодической системы элементов, или цинком, или особенно с магнием. Не будучи привязанным к теории, предполагают, что при этом первостепенно получают силилированный енол формулы (А), который, возможно, в зависимости от выбранных условий реакции или при переработке реакции или в ходе другого взаимодействия в стадии б) промежуточно гидролизуют до получения соединения (В). Соединения (А) являются обнаруживаемыми в реакционном растворе и в некоторых случаях могут быть выделены. А поэтому соединения (А) и их растворы равным образом являются объектом настояще-3 017900 го изобретения. Относительно предпочтительных значений R1, R3 и R4 в соединениях (А) сказанное ранее и в дальнейшем относится аналогичным образом. В принципе, взаимодействие может быть осуществлено по аналогии с реакцией, описанной в Organic Letters, 2001, 3(20), 3103-3105, которая описывает получение 1-этокси-3-триметилсилилокси-4,4 дифторбутадиена. Если X означает хлор или фтор, то взаимодействие может быть проведено в особенности по аналогии с методами, описанными в Tetrahedron Letters, 1983, т. 24, No.5, 507-510. J. Chem. Soc.Perkin Trans. I, 1988, 1149-1153, J. Org. Chem. 1995, 60, 5570-5578, J. Org. Chem. 2006, 71,15, 5468-5473 и US 5618951. Примерами металлов 1, 2, 3, 4 и 12 группы Периодической системы элементов, которые имеют окислительно-восстановительный потенциал менее чем -0,7 V, например-0,7 до -3,0 V, в пересчете на нормальный водородный электрод (при 25C и 101,325 кПа), являются щелочные металлы, в особенности литий, натрий или калий, щелочно-земельные металлы, в особенности магний или кальций, далее алюминий, титан, циркон и цинк. Предпочтительными металлами являются натрий, магний и цинк, причем магний особенно предпочтителен, в особенности, если X означает фтор. Равным образом особенно предпочтителен цинк, в особенности, если X означает хлор или бром. Оказалось выгодным, если на стадии а) используют силановое соединение R3nSiCl(4-n), где n означает 2 или 3. Особенно предпочтительно заместители R3 в этих силановых соединениях независимо друг от друга означают C1-C4-алкил, в особенности метил, этил, изопропил, трет-бутил. В особенности речь идет о силановом соединении, в котором n означает 3. В этом случае 3 остатка R3 могут быть одинаковыми или различными, причем предпочтительны те силановые соединения, в которых 2 из остатков R3 означают метил и оставшийся остаток R3 означает C1-C4-алкил. В этом случае силановое соединение преимущественно представляет собой триметилсилилхлорид, этилдиметилсилилхлорид, диметилпропилсилилхлорид, диметилизопропилсилилхлорид, n-бутилдиметилсилилхлорид, 2-бутилдиметилсилилхлорид,(2-метилпропил)диметилсилилхлорид или трет-бутилдиметилсилилхлорид и совершенно особенно предпочтительно триметилсилилхлорид. Примерами предпочтительных силановых соединений, где n означает 2, являются диметилдихлорсилан и диэтилдихлорсилан. В совершенно особенно предпочтительной форме осуществления силановое соединение R3nSiCl(4-n) представляет собой триметилсилилхлорид. Предпочтительно силановое соединение используют, по меньшей мере, в эквимолярных количествах или в избытке в пересчете на соединение (II), причем количество силанового соединения, как правило, не превышает 5 моль, в особенности 3,5 моль на 1 моль соединения (II). Преимущественно используют от 1,1 до 3,5 моль, в особенности около от 1,2 до 2,5 моль соединений силанового соединения на каждый моль соединения (II). Как правило, силановое соединение используют в количестве от по меньшей мере 0,8 моль на 1 моль металла. Преимущественно силановое соединение используют, по меньшей мере, в эквимолярных количествах или в избытке, в пересчете на металл, причем больший избыток, например более чем 200 мол.%, в пересчете на количество металла, как правило, не требуется. Преимущественно используют от 0,8 до 3 моль, в особенности около от 0,9 до 3 моль и особенно от 1 до 2 моль силанового соединения на каждый моль металла. В пересчете на соединение (II) металл используют, как правило, по меньшей мере, в эквимолярном количестве, например в количестве от 1 до 5 моль, часто от 1,1 до 4 моль и особенно от 1,5 до 3 моль на моль соединения (II). Преимущественно стадию а) осуществляют при существенном отсутствии воды, т.е. в сухом органическом растворителе. Здесь и в дальнейшем сухой означает, что растворитель имеет содержание воды менее чем 500 част./млн и в особенности не более чем 100 част./млн. Примерами пригодных органических растворителей являются апротонные полярные растворители, например циклические или ациклические простые эфиры, такие как диэтиловый эфир, трет-бутилметиловый эфир (МТБЭ), диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан, циклические или ациклические амиды, например N-C1-C4 алкиллактамы, такие как N-метилпирролидон или N-ди(C1-C4-алкил)амиды алифатических C1-C4 карбоновых кислот, такие как диметилформамид или диметилацетамид, или апротонные производные мочевины, т.е. N,N,N'N'-тетраалкилмочевины или N,N'-диалкилированные циклические мочевины, такие как N,N,N'N'-тетра(C1-C4-алкил)алкилмочевины, 1,3-ди(C1-C4-алкил)гексагидропиримидин-2-он или 1,3 ди(C1-C4-алкил)имидазолин-2-он, например тетраметилмочевина, 1,3-диметилгексагидропиримидин-2-он(диметилпропиленмочевина) или 1,3-диметилимидазолин-2-он (ДМИ), а также смеси указанных выше растворителей. Пригодны также смеси указанных ранее апротонных полярных органических растворителей с неполярными апротонными растворителями, например, с ароматическими или (цикло)алифатическими углеводородами, такими как толуол, ксилолы, гексан, циклогексан и т.п., причем в этих смесях преимущественно апротонно полярный растворитель предпочтительно составляет по меньшей мере 50 об.%, в особенности по меньшей мере 70 об.% общего количества растворителя. Преимущественно взаимодействие осуществляют в апротонно полярном растворителе, который выбран из циклических или ациклических амидов, в особенности N-C1-C4-алкиллактамов, таких как N-метилпирролидон,N-ди(C1-C4-алкил)амидов алифатической C1-C4-карбоновой кислоты, такой как диметилформамид или диметилацетамид, и апротонных производных мочевины, таких как N,N,N',N'-тетра(C1-C4-4 017900 алкил)алкилмочевины,1,3-ди(C1-C4-алкил)гексагидропиримидин-2-он или 1,3-ди(C1-C4 алкил)имидазолин-2-он, например тетраметилмочевина, 1,3-диметилгексагидропиримидин-2-он (диметилпропиленмочевина) или 1,3-диметилимидазолин-2-он (ДМИ) и смесях этих растворителей. Особенно предпочтительными растворителями являются апротонные мочевинные соединения и особенно ДМИ. Преимущественно взаимодействие на стадии а) проводят при температурах от -10 до 60C. Преимущественно заботятся о том, чтобы температура реакции не превышала 50C, в особенности 30C. Взаимодействие осуществляется обычным образом, при котором в реакционном сосуде друг с другом приводят в контакт реагенты, т.е. соединение (II), силановое соединение и металл, преимущественно в пригодном растворителе, причем, как правило, помещают металл в реакционный сосуд и при необходимости силановое соединение. Является выгодным, если по меньшей мере одна часть силанового соединения, например, по меньшей мере 20%, в особенности по меньшей мере 50% и металл находятся в реакционном сосуде в пригодном для взаимодействия, преимущественно сухом органическом растворителе, прежде чем добавляют соединение (II). В предпочтительном способе действия металл и силановое соединение помещают в пригодном для взаимодействия, преимущественно сухом органическом растворителе. Металл при этом типично используют в отдельном виде, например в виде стружки, порошка или гранул. Последовательность, в которой помещают компоненты, при этом имеет второстепенное значение. При необходимости проводят активацию металла. Затем, при необходимости при охлаждении для отвода теплоты реакции вносят соединение формулы (II) в чистом виде или как раствор, причем скорость внесения преимущественно выбирают таким образом, что указанные выше температуры по возможности удерживаются и в особенности не превышаются. Если применяют раствор соединения формулы (II), то концентрация соединения (II) типично находится в пределах от 10 до 90 мас.% в пересчете на общий вес раствора. Применяемый для раствора растворитель типично представляет собой растворитель, применяемый для реакции. В другом, равным образом предпочтительном способе действия металл помещают в пригодный для взаимодействия, преимущественно сухой органический растворитель, при необходимости проводят активацию и затем постепенно добавляют сначала силановое соединение и потом соединение (II) в реакционный сосуд, причем силановое соединение и соединение (II) могут быть добавлены в чистом виде или как раствор в желаемом для реакции растворителе. В другом, равным образом предпочтительном способе действия металл помещают в пригодный для взаимодействия, преимущественно сухой органический растворитель, при необходимости проводят активацию и потом при необходимости часть силанового соединения, например от 1 до 30%, и потом в реакционный сосуд добавляют силановое соединение, соответственно оставшееся количество силанового соединения и соединение (II), вместе или через отдельные притоки, причем силановое соединение и соединение (II) могут быть добавлены в чистом виде или как раствор в желаемом для реакции растворителе. Альтернативно также можно поместить соединение (II) и металл в пригодном для реакции растворителе и к нему добавить силановое соединение в чистом виде или как раствор в пригодном для реакции растворителе. В зависимости от реакционной способности соединений (II) силанового соединения, металла и температуры реакции время добавления соединения (II) соответственно силанового соединения, как правило, находится в пределах от 5 до 240 мин, часто в пределах от 10 до 120 мин, предпочтительно в пределах от 20 до 60 мин. При необходимости вслед за этим можно присоединить последующую фазу реакции, которая, как правило, находится в пределах от 10 до 360 мин, часто в пределах от 15 до 240 мин и в особенности в пределах от 20 до 180 мин. Необходимая для полного взаимодействия общая продолжительность реакции (длительность добавления + возможная последующая фаза реакции) составляет, как правило, в пределах от 20 мин до 10 ч, часто в пределах от 30 мин до 6 ч и преимущественно в пределах от 1 до 5 ч. Взаимодействие соединения (II), как правило, является количественным или почти количественным (95% превращения). Оказалось пригодным активирование помещенного в реакционном сосуде металла перед добавлением соединения (II) соответственно силанового соединения, например, путем обработки ультразвуком или химическим путем, например, путем обработки бромом, йодом, трихлорметаном или дибромметаном. Для дальнейшего взаимодействия может быть проведена переработка реакционной смеси и выделение продукта реакции из стадии а). Для количественного выделения соединений формулы А действия,как правило, проводят при слабо основных или безводных условиях, чтобы избежать преждевременного гидролиза. Если перерабатывают при добавлении воды, то, по меньшей мере, частично происходит гидролиз до соединения В и получают соединение В, при необходимости в смеси с соединением А. Преимущественно избегают преждевременного гидролиза соединения А. Выделение образовавшихся соединений для взаимодействия в стадии б) не требуется. Более того,оказалось благоприятным, отказаться от выделения продуктов реакции. И поэтому в предпочтительной форме осуществления способа согласно изобретению дальнейшее взаимодействие в стадии б) происхо-5 017900 дит без предыдущего выделения продукта реакции А. Преимущественно перед последующим взаимодействием избыточное силановое соединение удаляют частично или в особенности значительно, т.е., по меньшей мере, до оставшегося количества менее чем 10 мол.%, в пересчете на используемое соединение(II), или полностью, например, путем дистилляции. При необходимости также удаляют другие летучие компоненты реакционной смеси, например растворитель частично или в особенности полностью. Используемые в стадии а) соединения общей формулы (II) имеются в продаже или могут быть получены, например, по аналогии с реакцией для (2-этоксиметилен-4,4,4-трифтор)ацетоуксусного эфира,описанной в Journal of Medicinal Chemistry, 2000, объемн. 43,21, из трис-(галоген)ацетоуксусного эфира (VII) и пригодного ортоформиата (VIII), как правило, три(C1-C4-алкил)ортоформиата. Реакция представлена на нижеследующей схеме: В этой схеме X, R1 и R4 имеют указанные ранее значения. Пригодным для этого ортоформиатом в особенности является триэтилортоформиат (R4=этил). Как правило, взаимодействие (VII) с (VIII) проводят таким образом, что образующийся при взаимодействии C1-C4-алканол удаляют из реакционного равновесия, например, тем, что его отгоняют или химически связывают, например, тем, что взаимодействие проводят в присутствии ангидрида карбоновой кислоты, например С 2-С 4-алканкарбоновой кислоты, такой как уксусный ангидрид. Как правило, для взаимодействия соединение (VIII) используют в избытке в пересчете на стехиометрию реакции. В частности, используют от 1,1 до 5 моль и особенно от 1,2 до 2 моль ортоформиата(VIII) в пересчете на 1 моль соединения (VII). Взаимодействие (VII) с (VIII) происходит обычно при повышенной температуре, часто в пределах от 80 до 180C, в особенности в пределах от 100 до 150C. При необходимости можно прибавить кислоту, например органическую сульфокислоту, такую как p-толуолсульфокислота, в качестве катализатора. В предпочтительной форме выполнения взаимодействие (VII) с ортоформиатом (VIII) происходит в уксусном ангидриде. Как правило, соединение (II) перед его использованием в способе согласно изобретению очищают,в особенности от не взаимодействующих исходных веществ (VII) и/или (VIII) отделяют. Это можно осуществлять обычным образом, например, путем фракционной перегонки. Стадия б). Получение дифторметилзамещенных пиразол-4-илкарбоксилатов общей формулы (I) на стадии б) способа согласно изобретению происходит путем взаимодействия продукта реакции из стадии а), при необходимости после выделения или очистки полученных при этом соединений, или в особенности путем взаимодействия полученного в стадии а) реакционного раствора, преимущественно после отделения избыточного силанового соединения, с соединением гидразина формулы (IV). Взаимодействие в стадии б), в принципе, может быть осуществлено по аналогии с описанным вWO 92/12970 взаимодействием 3-(дифторметил-1-метилпиразол-4-ил)этилкарбоксилата с метилгидразином. Преимущественно используют гидразин или производное гидразина общей формулы (III), по меньшей мере, в эквимолярных количествах или в избытке, причем больший избыток соединения (III), например более чем 20 мол.%, в пересчете на один моль используемого в стадии а) соединения (II), как правило, не требуется. Преимущественно используют от 1,0 до 1,2 моль, в особенности около от 1,01 до 1,1 моль соединения гидразина (III) на каждый моль соединения (II). Предпочтительно соединение гидразина формулы (III) представляет собой C1-C4-алкилгидразин или гидразин, соответственно гидразингидрат; особенно соединение общей формулы (III) представляет собой метилгидразин или гидразингидрат. Для взаимодействия продукта реакции из стадии а) с соединением гидразина (III), как правило, действуют так, что смешивают продукт реакции из стадии а), преимущественно тем, что продукт реакции,при необходимости в виде раствора в органическом растворителе, например, в виде реакционного раствора, при необходимости после отделения избыточного силанового соединения, вводят к соединению гидразина формулы (III). Преимущественно помещают соединение гидразина формулы (III) в качестве раствора в органическом растворителе или смеси растворитель/вода. Альтернативно также можно сделать так, что соединение гидразина формулы (III), преимущественно как раствор в органическом растворителе или смеси растворитель/вода, добавляют к продукту реакции из стадии а) или к раствору из него в органическом растворителе или смеси растворитель/вода. Для взаимодействия в стадии б) пригодными органическими растворителями являются, например протонно полярные растворители, например алифатические спирты с преимущественно от 1 до 4 атомами углерода, такие как метанол, этанол, n-пропанол, изопропанол, n-бутанол, изобутанол или трет-6 017900 бутанол; ароматические углеводороды, такие как бензол, толуол, ксилолы, кумол, хлорбензол, нитробензол или трет-бутилбензол; апротонные полярные растворители, например циклические или ациклические простые эфиры, такие как диэтиловый эфир, трет-бутилметиловый эфир (МТБЭ), тетрагидрофуран (ТГФ) или диоксан,циклические или ациклические амиды, такие как диметилформамид, диметилацетамид, Nметилпирролидон или тетраметилмочевина, или алифатические нитрилы, такие как ацетонитрил или пропионитрил,а также смеси указанных выше растворителей. Преимущественно взаимодействие происходит в протонно полярном растворителе, в особенности вC1-C4-спирте и особенно предпочтительно в метаноле, этаноле, или в ацетонитриле, или в смеси протонно полярного растворителя с апротонно полярным растворителем либо в смеси этих растворителей с водой. Преимущественно взаимодействие в стадии б) происходит в присутствии воды. При этом уже достаточными являются небольшие количества воды в 0,1 об.% в пересчете на общее количество растворителя (органический растворитель + вода). Как правило, количество воды не превышает 50 об.%, часто 30 об.%, в особенности 15 об.%, в пересчете на общее количество органического растворителя + вода и часто находится в пределах от 0,1 до 50 об.%, преимущественно в пределах от 0,5 до 30 об.%, в особенности в пределах от 1 до 15 об.%, в пересчете на общее количество органического растворителя + вода. В особенно предпочтительной форме осуществления изобретения взаимодействие в стадии б) осуществляют в смеси из C1-C4-алканола и воды и особенно в смеси метанол-вода. Прежде сказанное относится к объемному соотношению алканола к воде. Преимущественно взаимодействие проводят при температурах от -80 до 100C. Как правило, верхняя граница температур является точкой кипения соответствующего растворителя при проведении реакции без давления. Преимущественно температура реакции не превышает 60C и в особенности 40C. Часто по практическим причинам реакцию проводят при комнатной температуре. В особой форме осуществления перед началом взаимодействия сначала устанавливают температуру от -60 до 0C, в особенности от -60 до -20C и в ходе реакции нагревают до температуры от 0 до 60C, в особенности от 10 до 40C. В зависимости от температуры реакции необходимая для полного взаимодействия продолжительность реакции типично находится в пределах от 1 до 48 ч и преимущественно в пределах от 4 до 24 ч. Переработка реакционной смеси и получение пиразолового соединения общей формулы (I) происходит обычным способом, например, путем удаления растворителя, например, путем дистилляции или путем водной экстрактивной переработки или путем комбинирования этих мероприятий. Последующая очистка может осуществляться, например, путем кристаллизации или посредством хроматографии. Однако часто продукт получают уже чистым, что делает ненужным последующий способ очистки. Стадия б) способа согласно изобретению предоставляет соединения общей формулы (I) с выходом от хорошего до очень хорошего, как правило, по меньшей мере в 70%. Другой объект настоящего изобретения относится к способу получения соединения общей формулы (IV) в которой R2 имеет одно из приведенных ранее значений. Способ получения соединения (IV) включает:i) получение соединения формулы (I) в соответствии со способом согласно изобретению, как описано, иii) гидролиз соединения (I). Гидролиз может быть проведен при кислотном катализе или основно, или другим образом. Соединение (I) может использоваться как таковое, т.е. после выделения. Однако также является возможным полученную в стадии б) реакционную смесь, при необходимости после отделения летучих компонентов,таких как растворитель, использовать для гидролиза без дальнейшей очистки. Для основного гидролиза соединения (I) типично обрабатывают соединение формулы (I) гидроксидом щелочного металла, такого как гидроксид натрия, гидроксид калия или гидроксид лития, предпочтительно водным раствором гидроксида щелочного металла, особенно водным раствором NaOH или водным раствором KOH, до полного гидролиза сложного эфира, преимущественно при нагревании. При основном гидролизе молярное соотношение соединения формулы (I) к основанию типично находится в пределах от 0,8:1 до 1:10 и является в особенности приблизительно эквимолярным (т.е. оно находится в пределах от 0,9:1 до 1,2:1), однако также может быть выгодным больший избыток основа-7 017900 ния, например, до 5 моль на каждый моль соединения (I). Обычно основный гидролиз происходит в разбавителе, соответственно растворителе. Пригодными разбавителями, соответственно растворителями наряду с водой также являются органические растворители, которые являются стабильными в отношении щелочи, а также их смеси с водой. Примерами щелочно-стабильных органических растворителей в особенности являются указанные выше C1-C4 алканолы, а также указанные выше ациклические и циклические простые эфиры. Преимущественно гидролиз проводят в водной фазе, т.е. в воде или смеси из воды с одним из указанных выше органических растворителей, причем содержание органического растворителя в водной фазе, как правило, типично не превышает 30 об.%, в пересчете на общее количество воды и органического растворителя. Преимущественно основный гидролиз проводят при температурах от 20 до 100C. Как правило,верхняя граница температур является точкой кипения применяемого растворителя при проведении реакции без давления. Преимущественно температура реакции не превышает 100C и в особенности 90C. Как особенно выгодным оказалось осуществлять работу при температуре выше точки кипения спиртового компонента сложного эфира. К примеру, исходя из соединения общей формулы (I), в которой R1 означает этил, гидролиз проводят предпочтительно при температуре по меньшей мере в 80C, например, в пределах от 80 до 100C. При этом продолжительность реакции зависит от температуры реакции, концентрации и стабильности соответствующей сложноэфирной связи. В общем, условия реакции выбирают таким образом, что продолжительность реакции находится в пределах от 1 до 12 ч, в особенности в пределах от 2 до 8 ч. Кислотный гидролиз соединения (I) может быть проведен по аналогии с известными кислотными гидролизами сложного эфира, т.е. в присутствии каталитических или стехиометрических количеств кислоты и воды (см., например, J. March, Advanced Organic Chemistry, 2nd Ed., 334-338, McGraw-Hill, 1977,и процитированные там литературные источники). Часто взаимодействие проводят в смеси из воды и апротонного органического растворителя, например простого эфира, такого как указаны выше. Примерами кислот являются галогеноводородные кислоты, серная кислота, органические сульфокислоты, такие как р-толуолсульфокислота, метансульфокислота, фосфорная кислота, а также кислотные смолы ионного обмена и т.п. Пригодными катализаторами гидролиза далее являются йодиды щелочных металлов, такие как йодид лития, триметилйодсилан или смеси триметилхлорсилана с йодидами щелочных металлов, такими как йодид лития, йодид натрия или йодид калия. Выделение кислоты (IV) затем происходит путем обычного способа разделения, такого как, например, осаждение путем регулирования значения pH или экстракция. Согласно изобретению соединения общей формулы (I) выгодно пригодны для синтеза целого ряда соединений, привлекательных в качестве действующего вещества, таких как, например, для получения 3 дифторметилпиразол-4-карбоксамидов определенной в дальнейшем формулы (V) в которой R2 имеет приведенное ранее значение;R6 выбран из C1-C8-алкила, C2-C6-алкенила, С 2-С 6-алкинила, C1-C6-алкокси, C2-C6-алкенилокси, С 2 С 6-алкинилокси, причем 6 указанных выше остатков являются незамещенными или частично или полностью могут быть галогенированы и/или могут иметь 1, 2, 3, 4 или 5 заместителей Ray, причем Ray независимо друг от друга выбраны из циано, нитро, гидрокси, меркапто, амино, карбоксил, C1-C6-алкокси, C2C6-алкенилокси, С 2-С 6-алкинилокси, C1-C6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(C1-C6 алкил)амино, C1-C6-алкилсульфонила, C1-C6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6 алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси; С 3-С 14-циклоалкила или фенила, которые являются незамещенными, или 1, 2, 3, 4 или 5 остатков Rax могут быть замещены, причем Rax независимо друг от друга выбраны из галогена, циано, нитро, гидрокси, меркапто, амино, карбоксила, C1-C6-алкила,C1-C6-галоалкила, C3-C6-циклоалкила, C1-C6-алкокси, С 2-С 6-алкенилокси, С 2-С 6-алкинилокси, C1-C6 галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(C1-C6-алкил)амино, C1-C6-алкилсульфонила, C1-C6 алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6 алкилкарбонилокси. В формуле (V) R6 преимущественно выбран из C1-C8-алкила, C1-C8-галоалкила, C1-C6-алкокси, C1C6-галоалкокси, фенила и циклопропила, причем фенил и циклопропил могут быть замещены указанным выше способом. В соответствии с особенно предпочтительной формой осуществления R6 означает фенил, который при необходимости может быть замещен посредством 1, 2, 3, 4 или 5 остатков Rax. Rax в особенности выбран из галогена, C1-C6-алкокси, C1-C6-алкилтио, C1-C6-алкилсульфонила, C1-C6 алкилсульфоксила, C1-C6-галоалкилтио, C1-C6-галоалкилсульфонила и С 1-С 6-галоалкилсульфоксила. R5 в особенности означает галоген. Способ включает получение пиразолкарбоксилата формулы (I) в соответствии с описанным здесь способом и его взаимодействие с аминосоединением формулы (VI) в которой m, R5 и R6 имеют приведенные ранее значения; или получение пиразол-4-карбоновой кислоты формулы (IV) согласно описанным здесь способам,при необходимости переведение пиразол-4-карбоновой кислоты (IV) в ее галогенид карбоновой кислоты где R2 имеет указанное прежде значение и Hal означает галоген, в особенности хлор,и последующее взаимодействие пиразол-4-карбоновой кислоты формулы (IV) или ее галогенида карбоновой кислоты (IVa) с аминосоединением формулы (VI). Пригодные методы получения анилидов путем взаимодействия карбоновых кислот или сложных эфиров карбоновых кислот с ароматическими аминами являются известными для специалиста в данной области техники, например, из процитированного вначале уровня техники, а также из J. March, AdvancedOrganic Chemistry, 2nd Ed., 382 f, McGraw-Hill, 1977 и Organikum, 21. изд-е Wiley-VCH, Weinheim 2001, c. 481-484 и процитированные там литературные источники, и могут аналогичным образом распространяться на получение соединений (V) согласно изобретению. К примеру, можно подвергать взаимодействию пиразолкарбоксилаты формулы (I), в особенности у которых R1=метил или этил, непосредственно с соединением анилина (VI) в смысле аминолиза сложного эфира карбоновой кислоты. Альтернативно можно подвергать взаимодействию пиразолкарбоновую кислоту формулы (IV) непосредственно с соединением анилина (VI) в смысле аминолиза карбоновой кислоты. Однако часто поступают таким образом, что пиразолкарбоновую кислоту формулы (IV) сначала переводят в ее галоидангидрид кислоты, например ее хлорангидрид кислоты, и затем галоидангидрид кислоты (IVa) взаимодействует с соединением анилина (VI). В зависимости от выбранного пути синтеза реакция сочетания карбоновой кислоты (IV) соответственно производного карбоновой кислоты (I) или (IVa) и производного анилина (VI) при необходимости может быть проведена в присутствии катализаторов, конденсационных средств, связывающих кислоту средств и/или при отделении воды, например, путем азеотропной дистилляции. В общем, взаимодействие галогенида карбоновой кислоты (IVa) с соединением анилина (VI) происходит в инертном растворителе. Пригодными растворителями являются алифатические углеводороды,такие как пентан, гексан, циклогексан и петролейный эфир, ароматические углеводороды, такие как толуол, о-, m- и p-ксилол, галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир,диоксан, анизол и тетрагидрофуран, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и трет-бутилметилкетон, спирты, такие как метанол, этанол, nпропанол, изопропанол, n-бутанол и трет-бутанол, а также метиленхлорид, диметилсульфоксид и диметилформамид, особенно предпочтительно толуол, метиленхлорид и тетрагидрофуран. Также могут применяться смеси указанных растворителей. Взаимодействие (IVa) с (VI) происходит обычно в присутствии основания. В качестве оснований, в общем, пригодны неорганические соединения, такие как гидроксиды щелочных и щелочно-земельных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид кальция, оксиды щелочных и щелочно-земельных металлов, такие как оксид лития, оксид натрия, оксид кальция и оксид магния, гидриды щелочных и щелочно-земельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция, амиды щелочных металлов, такие как амид лития, амид натрия и амид калия, карбонаты щелочных и щелочно-земельных металлов, такие как карбонат лития и карбонат кальция,а также гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, кроме того, органические основания, например третичные амины, такие как триметиламин, триэтиламин, диизопропилэтиламин и диметиламинопиридин, а также бициклические амины. Особенно предпочтительно применяют триэтиламин и пиридин. Основания, в общем, используют в эквимолярных количествах, в пересчете на соединение (IVa). Однако они могут также применяться в избытке от 5 до 30 мол.%, преимущественно от 5 до 10 мол.%,или - в случае применения третичных аминов - при необходимости в качестве растворителей. Исходные продукты (IVa) и (VI), в общем, взаимодействуют друг с другом в эквимолярных количествах. Может быть выгодным для выхода использование (IVa) в избытке от 1 до 20 мол.%, преимущественно от 1 до 10 мол.% в пересчете на (VI). Это взаимодействие галогенидов пиразолкарбоновой кислоты (IVa) с соединениями анилина (VI) происходит обычно при температурах от -20 до 100C, преимущественно от 0 до 50C. Взаимодействие пиразолкарбоновых кислот (IV) с соединениями анилина (VI) происходит обычно в присутствии дегидрирующего средства. В качестве дегидрирующих средств пригодны 1,1'карбонилдиимидазол, бис-(2-оксо-3-оксазолидинил)фосфорилхлорид, карбодиимиды, такие как N,N'дициклогексилкарбодиимид и N-(3-диметиламинопропил)-N'-этилкарбодиимид, соли фосфония, такие как гексафторфосфат (бензотриазол-1-илокси)-трис-(диметиламино)фосфония, гексафторфосфат бромтрипирролидинофосфония, гексафторфосфат бром-трис-(диметиламино)фосфония и гексафторфосфат хлортрипирролидинофосфония, соли урония и тиурония, такие как гексафторфосфат О-(бензотриазол-1 ил)-N,N,N'N'-тетраметилурония,гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N'N'тетраметилурония, тетрафторборат S-(1-оксидо-2-пиридил)-N,N,N'N'-тетраметилтиурония, тетрафторборат О-(2-оксо-1(2H)пиридил)-N,N,N'N'-тетраметилурония,тетрафторборат О[(этоксикарбонил)цианометиленамино]-N,N,N'N'-тетраметилурония, соли карбения, такие как гексафторфосфат(бензотриазол-1 илокси)дипиперидинокарбения,тетрафторборат О-(3,4-дигидро-4-оксо-1,2,3-бензотриазин-3-ил)N,N,N'N'-тетраметилурония, хлор-N,N'-бис-(тетраметилен)формамидинийтетрафторборат, гексафторфосфат хлордипирролидинокарбения, тетрафторборат хлор-N,N,N',N'-бис-(пентаметилен)формамидиния,соли имидазолия, такие как тетрафторборат 2-хлор-1,3-диметилимидазолия, предпочтительно 1,1'карбонилдиимидазол, бис-(2-оксо-3-оксазолидинил)фосфорилхлорид, N,N'-дициклогексилкарбодиимид и N-(3-диметиламинопропил)-N'-этилкарбодиимид. Поскольку взаимодействие пиразолкарбоновых кислот (IV) с соединениями анилина (VI) проводят в присутствии дегидрирующего средства, то преимущественно применяют органическое основание. В качестве органических оснований пригодны, например, третичные амины, такие как триметиламин, триэтиламин, диизопропилэтиламин и N-метилпиперидин, пиридин, замещенные пиридины, такие как коллидин, лутидин и 4-диметиламинопиридин, а также бициклические амины. Особенно предпочтительно применяют триэтиламин и пиридин. Основания, в общем, используют в избытке от 10 до 200 мол.%,преимущественно от 50 до 150 мол.% в пересчете на соединение (IV). Исходные продукты (IV) и (VI), в общем, взаимодействуют друг с другом приблизительно в эквимолярных количествах. Может быть выгодным для выхода использовать одно из соединений в избытке от 1 до 20 мол.%, преимущественно от 1 до 10 мол.%. Дегидратирующее средство используют, в общем,в избытке от 5 до 100 мол.%, преимущественно от 5 до 60 мол.% в пересчете на соединение (IV). Взаимодействие (IV) с (VI) происходит обычно в растворителе. Пригодными растворителями являются алифатические углеводороды, такие как пентан, гексан, циклогексан и петролейный эфир, ароматические углеводороды, такие как толуол, o-, m- и p-ксилол, галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и трет-бутилметилкетон, а также диметилсульфоксид и диметилформамид, особенно предпочтительны метиленхлорид, толуол и тетрагидрофуран. Также могут применяться смеси указанных растворителей. В дальнейшем получение дифторметилзамещенных сложных эфиров пиразол-4-илкарбоновой кислоты и их дальнейшая переработка поясняются при помощи примеров. Пример получения 1. Получение сложного этилового эфира 2-этоксиметилен-4,4,4-трифтор-3 оксомасляной кислоты. В 500-мл четырехгорлой колбе с мешалкой смешивали 78,3 г (0,425 моль) трифторацетоацетата(этиловый эфир 4,4,4-трифтор-3-оксомасляной кислоты), 103,3 г (0,638 моль) триэтилортоформиата и 130,0 г (1,275 моль) уксусного ангидрида и нагревали 6 ч до 120C. Затем при нормальном давлении отделяли сначала низкокипящие компоненты и по окончании продукт дистиллировали в вакууме через колонку. Таким образом, получали 91,8 г (выход 90%) указанного в заголовке соединения в виде бесцветной жидкости с чистотой 98%. Пример получения 2. Получение сложного изопропилового эфира 2-изопропоксиметилен-4,4,4 трифтор-3-оксомасляной кислоты. Получение осуществляли аналогично примеру получения 1 с применением изопропилового эфира 4,4,4-трифтор-3-оксомасляной кислоты и триизопропилортоформиата. Пример 1. Получение сложного этилового эфира 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. В 500-мл трехгорлой колбе, оснащенной магнитной мешалкой и термометром, помещали стружку магния (4,9 г, 0,20 моль), триметилсилилхлорид (TMC-Cl: 21,8 г, 0,20 ммоль) и безводный диметилформамид (ДМФ, 240 мл). После активирования магния посредством ультразвука в ледяной ванне добавляли этиловый эфир 2-этоксиметилен-4,4,4-трифтор-3-оксомасляной кислоты (25,3 г, 0,10 моль) в течение промежутка времени в 30 мин, причем температуру реакции удерживали в пределах от 0 до 10C. Через последующие 60 мин при сниженном давлении удаляли избыточный триметилсилилхлорид. Во второй 500-мл трехгорлой колбе при -50C помещали водный раствор метилгидразина (37%, 20,8 г, 0,12 моль) и этанол (320 мл). Сюда же в течение промежутка времени в 60 мин добавляли охлажденный реакционный раствор первого взаимодействия, причем охлаждение сохраняли. Спустя еще 2 ч при -50C реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали последующие 10 ч. Реакционная смесь согласно анализу ГХ содержала сложный этиловый эфир 3-дифторметил-1-метилпиразол-4 карбоновой кислоты (изомер а) в смеси со сложным этиловым эфиром 2-дифторметил-1-метилпиразол-3 карбоновой кислоты (изомер б) с соотношением изомеров а:б в 82:18. Затем реакционную смесь концентрируют при сниженном давлении. Остаток ресуспендировали в 100 мл этилацетата и три раза промывали насыщенным водным раствором поваренной соли, значение pH которых было установлено путем добавления конц. соляной кислоты до pH 2. Органическую фазу при сниженном давлении освобождали от растворителя. Твердый остаток перекристаллизовывали из гексана. Сложный этиловый эфир 3-дифторметил-1-метилпиразол-4-карбоновой кислоты получали в виде бесцветного кристаллического порошка (15,3 г, 70% выход, 95% чистота, чистота изомеров а:b=94:6). 1 Н-ЯМР (d6-ДМСО, 400 МГц): =1,27 (t, 3 Н, J=7,1 Hz), 3,92 (s, Н), 4,23 (q, 2 Н, J=7,1 Hz), 7,21 (t, 1H,J=53 Hz), 8,41 част./млн (s, 1 Н). Пример 1a-1e. Эксперименты получения сложного этилового эфира 3-дифторметил-1 метилпиразол-4-карбоновой кислоты в различных растворителях при взаимодействии промежуточного соединения А с метилгидразином. Аналогично примеру 1 подвергали взаимодействию сложный эфир 2-этоксиметилен-4,4,4-трифтор 3-оксомасляной кислоты, Mg и TMC-Cl в ДМФ и избыток TMC-Cl удаляли при сниженном давлении. Затем состав подвергали взаимодействию с водным раствором метилгидразина (37%) в различных растворителях до получения сложного этилового эфира 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. Нижеследующая табл. 1 показывает полученные смеси изомеров в зависимости от растворителя и количественное соотношение реагентов. Таблица 1 Пример 2. Получение 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. Получение осуществлялось аналогично примеру 1, причем в отличие от примера 1 вместо перекристаллизации из гексана полученный после водной экстрактивной переработки и удаления этилацетата твердый остаток обрабатывали следующим образом. Твердый остаток смешивали с 16 г 50 мас.% водным раствором едкого натра и 100 мл этанола и смесь при помешивании 4 ч кипятили с обратным холодильником. Затем растворитель удаляли при сниженном давлении и полученный водный остаток доводили посредством 10%-ной соляной кислоты до pH 1. При этом получали дикарбоновую кислоту в виде твердого вещества, которое выделяли с помощью фильтрации. Таким образом, получили 3-дифторметил-1-метилпиразол-4-карбоновую кислоту в виде светло-коричневого порошка. 1 Н-ЯМР (d6-ДМСО, 400 МГц): =3,92 (s, 3 Н), 7,21 (t, 1 Н, J=53 Hz), 8,34 част./млн (s, 1 Н). Пример 3. Получение сложного этилового эфира 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. В 500-мл трехгорлой колбе, оснащенной магнитной мешалкой и термометром, помещали стружку магния (4,9 г, 0,20 моль). После активирования магния путем поверхностного травления йодом и последующего добавления безводного N-метилпирролидона (НМП, 240 мл) и триметилсилилхлорида (21,8 г,0,20 ммоль) добавляли сложный этиловый эфир 2-этоксиметилен-4,4,4-трифтор-3-оксомасляной кислоты(25,3 г, 0,10 моль) в течение промежутка времени в 30 мин при температуре в пределах от 30 до 40C. Через последующие 120 мин избыточный триметилсилилхлорид удаляли под сниженным давлением. Во второй 500-мл трехгорлой колбе при -50C помещали водный раствор метилгидразина (37%, 20,8 г, 0,12 моль) и этанола (320 мл). Сюда же в течение промежутка времени в 60 мин добавляли охлажденный реакционный раствор первого взаимодействия, причем охлаждение сохраняли. Спустя последующие 2 ч при -50C реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали последующие 10 ч. Реакционная смесь содержала согласно ГХ анализу сложный этиловый эфир 3 дифторметил-1-метилпиразол-4-карбоновой кислоты (изомер а) в смеси со сложным этиловым эфиром 2 дифторметил-1-метилпиразол-3-карбоновой кислоты (изомер б) с соотношением изомеров а:б в 84:16. Затем реакционную смесь концентрировали под сниженным давлением. В качестве продукта получали раствор сложного этилового эфира 3-дифторметил-1-метилпиразол 4-карбоновой кислоты в НМП, который может быть очищен путем экстракции или кристаллизации аналогично примеру 1 или аналогично примеру 2 посредством кипячения с раствором едкого натра омылен до кислоты. Пример 4. Получение 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. В 500-мл трехгорлой колбе, оснащенной магнитной мешалкой и термометром, помещали стружку магния (4,9 г, 0,20 моль), триметилсилилхлорид (32,6 г, 0,30 ммоль) и безводный 1,3-диметил-2 имидазолидинон (ДМИ, 160 мл). После активирования магния посредством йода в ледяной ванне добавляли сложный метиловый эфир 2-метоксиметилен-4,4,4-трифтор-3-оксомасляной кислоты (21,3 г,0,10 моль) в течение промежутка времени в 30 мин, причем реакционную температуру удерживали в пределах от 20 до 30C. Спустя последующие 60 мин при комнатной температуре удаляли избыточный триметилсилилхлорид под сниженным давлением. Во второй 500-мл трехгорлой колбе при -50C помещали водный раствор метилгидразина (37%, 14,8 г, 0,12 моль) и метанол (320 мл). Сюда же в течение промежутка времени в 60 мин добавляли охлажденный реакционный раствор первого взаимодействия,причем охлаждение сохраняли. Через последующие 2 ч при -50C реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали последующие 10 ч. Реакционная смесь содержала согласно анализу ГХ сложный метиловый эфир 3-дифторметил-1-метилпиразол-4-карбоновой кислоты(изомер а) в смеси со сложным метиловым эфиром 2-дифторметил-1-метилпиразол-3-карбоновой кислоты (изомер б) с соотношением изомеров а:б в 90:10. Затем реакционную смесь концентрируют под сниженным давлением. Остаток смешивали с 120 г 10%-ного раствора едкого натра и перемешивали 4 ч при 100C. После подкисления водного раствора соляной кислотой до pH 1 и многократной экстракции с помощью МТБЭ получали органический раствор, который содержал 13,4 г указанного в заголовке соединения (выход изомер а: 71%). Указанное в заголовке соединение выделяли путем кристаллизации в виде светло-коричневого твердого вещества. Пример 5. Получение сложного изопропилового эфира 3-дифторметил-1-метилпиразол-4 карбоновой кислоты. В 500-мл трехгорлой колбе, оснащенной магнитной мешалкой и термометром, помещали магнитную стружку (4,9 г, 0,20 моль), триметилсилилхлорид (21,8 г, 0,20 ммоль) и безводный диметилформамид (ДМФ, 250 мл). После активирования магния посредством ультразвука в ледяной ванне добавляли сложный изопропиловый эфир 2-изопропоксиметилен-4,4,4-трифтор-3-оксомасляной кислоты (26,8 г,0,10 моль) в течение промежутка времени в 30 мин, причем реакционную температуру удерживали в пределах от 0 до 10C. Спустя последующие 60 мин удаляли избыточный триметилсилилхлорид под сниженным давлением. Во второй 500-мл трехгорлой колбе при -50C помещали водный раствор метилгидразина (37%, 20,8 г, 0,12 моль) и этанол (320 мл). Сюда же в течение промежутка времени в 60 мин добавляли охлажденный реакционный раствор первого взаимодействия, причем охлаждение сохраняли. Спустя последующие 2 ч при -50C реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали последующие 10 ч. Реакционная смесь содержала согласно анализу ГХ сложный изопропиловый эфир 3-дифторметил-1-метилпиразол-4-карбоновой кислоты (изомер а) в смеси со сложным изопропиловым эфиром 2-дифторметил-1-метилпиразол-3-карбоновой кислоты (изомер б) с соотношением изомеров а:б в 83:17. Пример 6. Хлорид 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. Нагревали раствор 293 г 3-дифторметил-1-метилпиразол-4-карбоновой кислоты, полученный аналогично примеру 2, в 700 г толуола до 90C и туда добавляли в течение 3,5 ч 260 г тионилхлорида. Оставляли охлаждаться и смесь концентрировали в вакууме, остаток смешивали с 100 мл толуола и снова концентрировали в вакууме. Остаток дистиллировали через насадочную колонну при давлении в 0,8 мбар и температуре верха в 109C, причем получали 298,4 г хлорангидрида кислоты с чистотой в 99%(выход 92,1%). Пример 7. N-(3,4'-Дихлор-5-фторбифенил-2-ил)амид 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. В 2-л четырехгорлой колбе с мешалкой и капельной воронкой растворяли 208 г (0,788 моль) 2 амино-3',4'-дихлор-5-фторбифенила (чистота 97%) и 82,1 г (1,04 моль) пиридина в 1100 мл сухого толуола, нагревали до 45C и туда же в течение 30 мин через капельную воронку добавляли 155 г (0,788 моль) полученного согласно примеру 6 хлорида 3-дифторметил-1-метилпиразол-4-карбоновой кислоты. Капельную воронку промывали небольшим количеством толуола и перемешивали 1 ч при 75C. Затем экстрагировали в тепле по очереди посредством 270 мл 5 мас.%-ной водной соляной кислоты, 270 мл 10 мас.%-ного водного раствора гидрокарбоната натрия и 270 мл деионизованной воды. Органическую фазу охлаждали при помешивании до комнатной температуры. При этом получали продукт в виде твердого вещества, которое отсасывали через стеклянный фильтр и проводили повторную промывку холодным толуолом (0C). Твердое вещество затем высушивали в вакууме. Таким образом, получали 264 г указанного в заголовке соединения в виде белого твердого вещества с чистотой 99%. Аналогично примеру 7 получали указанные в табл. 2 анилиды пиразол-4-карбоновой кислоты общей формулы (V) (R2=СН 3) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения дифторметилзамещенных пиразол-4-илкарбоксилатов общей формулы (I) в которой R1 означает C1-C6-алкил, C3-C8-циклоалкил, C1-C4-алкокси-C1-C4-алкил, C3-C8 циклоалкокси-C1-C4-алкил, C2-C8-алкенил или бензил, при необходимости замещенный посредством 1, 2 или 3 заместителей Ry1, независимо друг от друга выбранных из C1-C4-алкила, C1-C4-алкокси или нитро;R2 означает водород, C1-C4-алкил, бензил или фенил, причем оба названных последними заместителя могут быть незамещенными или при необходимости замещенными посредством 1, 2 или 3 заместителей Ry2, выбранных независимо друг от друга из галогена, CN, нитро, C1-C4-алкила, C1-C4-галоалкила, C1C4-алкокси или C1-C4-галоалкокси; причем а) соединение общей формулы (II)R1 имеет одно из приведенных ранее значений иR4 означает C1-C8-алкил, C3-C8-циклоалкил, C2-C8-алкенил, бензил или фенил,взаимодействует с силановым соединением общей формулы в которой n означает 1, 2 или 3 и заместители R3 независимо друг от друга выбраны из C1-C8-алкила или фенила,и металлом, который выбран из металлов групп 1, 2, 3, 4 и 12 Периодической системы элементов и имеет окислительно-восстановительный потенциал менее чем -0,7 V, в пересчете на нормальный водородный электрод (при 25C и 101,325 кПа); и б) реакционная смесь из стадии а) взаимодействует с соединением общей формулы (III)R2HN-NH2 (III),2 в которой R имеет одно из приведенных ранее значений. 2. Способ по п.1, в котором металл представляет собой магний. 3. Способ по одному из предыдущих пунктов, включающий использование силанового соединения общей формулыR3nSiCl(4-n),в которой n означает 2 или 3. 4. Способ по одному из предыдущих пунктов, где в силановом соединении заместители R3 независимо друг от друга выбраны из C1-C4-алкила. 5. Способ по п.3 или 4, где силановое соединение выбрано из группы, включающей триметилсилилхлорид, этилдиметилсилилхлорид, диметилпропилсилилхлорид, диметилизопропилсилилхлорид, nбутилдиметилсилилхлорид, 2-бутилдиметилсилилхлорид, (2-метилпропил)диметилсилилхлорид, диметилдихлорсилан, диэтилдихлорсилан и трет-бутилдиметилсилилхлорид. 6. Способ по одному из предыдущих пунктов, где R4 в соединении формулы (II) выбран из C1-C4 алкила или бензила. 7. Способ по одному из предыдущих пунктов, в котором взаимодействие на стадии а) осуществляют в безводной среде. 8. Способ по п.7, в котором взаимодействие на стадии а) проводят в растворителе, выбранном из NC1-C4-алкиллактамов, N-ди(C1-C4-алкил)амидов алифатических C1-C4-карбоновых кислот, N,N,N',N'тетра(C1-C4-алкил)алкилмочевин, 1,3-ди(C1-C4-алкил)гексагидропиримидин-2-она и 1,3-ди(C1-C4 алкил)имидазолин-2-она. 9. Способ по одному из предыдущих пунктов, в котором взаимодействие на стадии б) осуществляют в присутствии воды. 10. Способ по п.9, где взаимодействие на стадии б) осуществляют в смеси из C1-C4-алканола и воды. 11. Способ по одному из предыдущих пунктов, в котором в соединениях формул (I) и (II) R1 означает C1-C4-алкил или бензил. 12. Способ по одному из предыдущих пунктов, где соединение общей формулы (III) выбрано из C1C4-алкилгидразинов и гидразингидрата. 13. Способ получения пиразол-4-карбоновой кислоты общей формулы (IV) в которой R2 имеет одно из приведенных ранее значений,включающий:i) получение соединения формулы (I) способом по одному из пп.1-10 иii) гидролиз соединения (I) до получения карбоновой кислоты (IV). 14. Способ по п.13, в котором основный гидролиз происходит в присутствии водного раствора гидроксида щелочного металла или раствора гидроксида щелочно-земельного металла. 15. Способ получения анилидов пиразол-4-карбоновой кислоты общей формулы (V) в которой R2 имеет указанное ранее значение;R6 выбран из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-алкокси, C2-C6-алкенилокси, C2C6-алкинилокси, причем 6 указанных выше остатков являются незамещенными или могут быть частично или полностью галогенированы и/или могут иметь 1, 2, 3, 4 или 5 заместителей Ray, причем Ray независимо друг от друга выбраны из циано, нитро, гидрокси, меркапто, амино, карбоксил, C1-C6-алкокси, C2C6-алкенилокси, C2-C6-алкинилокси, C1-C6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(С 1-С 6 алкил)амино, C1-C6-алкилсульфонила, С 1-С 6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6 алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси; С 3-С 14-циклоалкила или фенила, которые являются незамещенными или могут иметь 1, 2, 3, 4 или 5 заместителей Rax, причем Rax независимо друг от друга выбраны из галогена, циано, нитро, гидрокси, меркапто, амино, карбоксила, C1-C6-алкила, C1C6-галоалкила, C3-С 6-циклоалкила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, C1-C6 галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(С 1-С 6-алкил)амино, C1-C6-алкилсульфонила, C1-C6 алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6 алкилкарбонилокси; включающий получение пиразолкарбоксилата формулы (I) способом по одному из пп.1-10 и взаимодействие пиразолкарбоксилата формулы (I) с аминосоединением формулы (VI) в которой m, R5 и R6 имеют указанные ранее значения. 16. Способ получения анилидов пиразол-4-карбоновой кислоты общей формулы (V) в которой R2 имеет указанное ранее значение;R6 выбран из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-алкокси, C2-C6-алкенилокси, C2C6-алкинилокси, причем 6 указанных выше заместителей являются незамещенными или могут быть частично или полностью галогенированы и/или могут иметь 1, 2, 3, 4 или 5 заместителей Ray, причем Ray независимо друг от друга выбраны из циано, нитро, гидрокси, меркапто, амино, карбоксила, C1-C6 алкокси, C2-C6-алкенилокси, C2-C6-алкинилокси, С 1-С 6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино,ди(C1-C6-алкил)амино,C1-C6-алкилсульфонила,C1-C6-алкилсульфоксила,формила,C1-C6 алкилкарбонила, C1-C6-алкоксикарбонила, формилокси и C1-C6-алкилкарбонилокси; C3-С 14-циклоалкила или фенила, которые являются незамещенными или могут иметь 1, 2, 3, 4 или 5 заместителей Rax, причемRax независимо друг от друга выбраны из галогена, циано, нитро, гидрокси, меркапто, амино, карбоксила,C1-C6-алкила, C1-C6-галоалкила, C3-C6-циклоалкила, C1-C6-алкокси, C2-C6-алкенилокси, C2-C6 алкинилокси, C1-C6-галоалкокси, C1-C6-алкилтио, C1-C6-алкиламино, ди(C1-C6-алкил)амино, C1-C6 алкилсульфонила, C1-C6-алкилсульфоксила, формила, C1-C6-алкилкарбонила, C1-C6-алкоксикарбонила,формилокси и C1-C6-алкилкарбонилокси; включающий получение пиразол-4-карбоновой кислоты формулы (IV) способом по п.11, при необходимости переведение пиразол-4-карбоновой кислоты (IV) в ее галогенид карбоновой кислоты и последующее взаимодействие пиразол-4-карбоновой кислоты формулы (IV) или ее галогенида карбоновой кислоты с аминосоединением формулы (VI). 17. Соединение формулы (А) в которой R1 и R4 имеют одно из приведенных для формулы (II) значений иR3 независимо друг от друга выбраны из С 1-С 8-алкила или фенила. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 237/04, C07F 7/04
Метки: способ, дифторметилпиразолилкарбоксилатов, получения
Код ссылки
<a href="https://eas.patents.su/16-17900-sposob-polucheniya-diftormetilpirazolilkarboksilatov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения дифторметилпиразолилкарбоксилатов</a>
Предыдущий патент: Устройство для аспирационного способа определения вариантов внутривенозного положения устья крупных лимфатических коллекторов
Следующий патент: Подъемное устройство, устройство для выработки электроэнергии и устройство для обратного осмоса морской воды
Случайный патент: Способ и устройство переработки бытовых и промышленных органических отходов




















