Кальцилитические соединения
Номер патента: 9603
Опубликовано: 28.02.2008
Авторы: Каллахан Джеймс Фрэнсис, Раманджулу Джоши М., Марквис Роберт В., Касиллас Линда Н.
Формула / Реферат
1. Соединение, имеющее химическую формулу

или его фармацевтически приемлемые соли.
2. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый разбавитель или наполнитель.
3. Способ лечения заболевания или расстройства, характеризующегося аномальным гомеостазом костей или минерального состава, который включает введение нуждающемуся в таком лечении пациенту эффективного количества соединения по п.1.
4. Способ по п.3, в котором расстройство костей или минерального состава выбрано из группы, включающей остеосаркому, периодонтальное заболевание, срастание переломов, остеоартрит, ревматоидный артрит, болезнь Педжета, злокачественное заболевание, связанное с гуморальной гиперкальциемией, и остеопороз.
5. Способ по п.3, в котором заболевание или расстройство костей или минерального состава является остеопорозом.
6. Способ повышения уровней паратиреоидного гормона у млекопитающих, который включает введение нуждающемуся в таком лечении пациенту эффективного количества соединения по п.1.
Текст
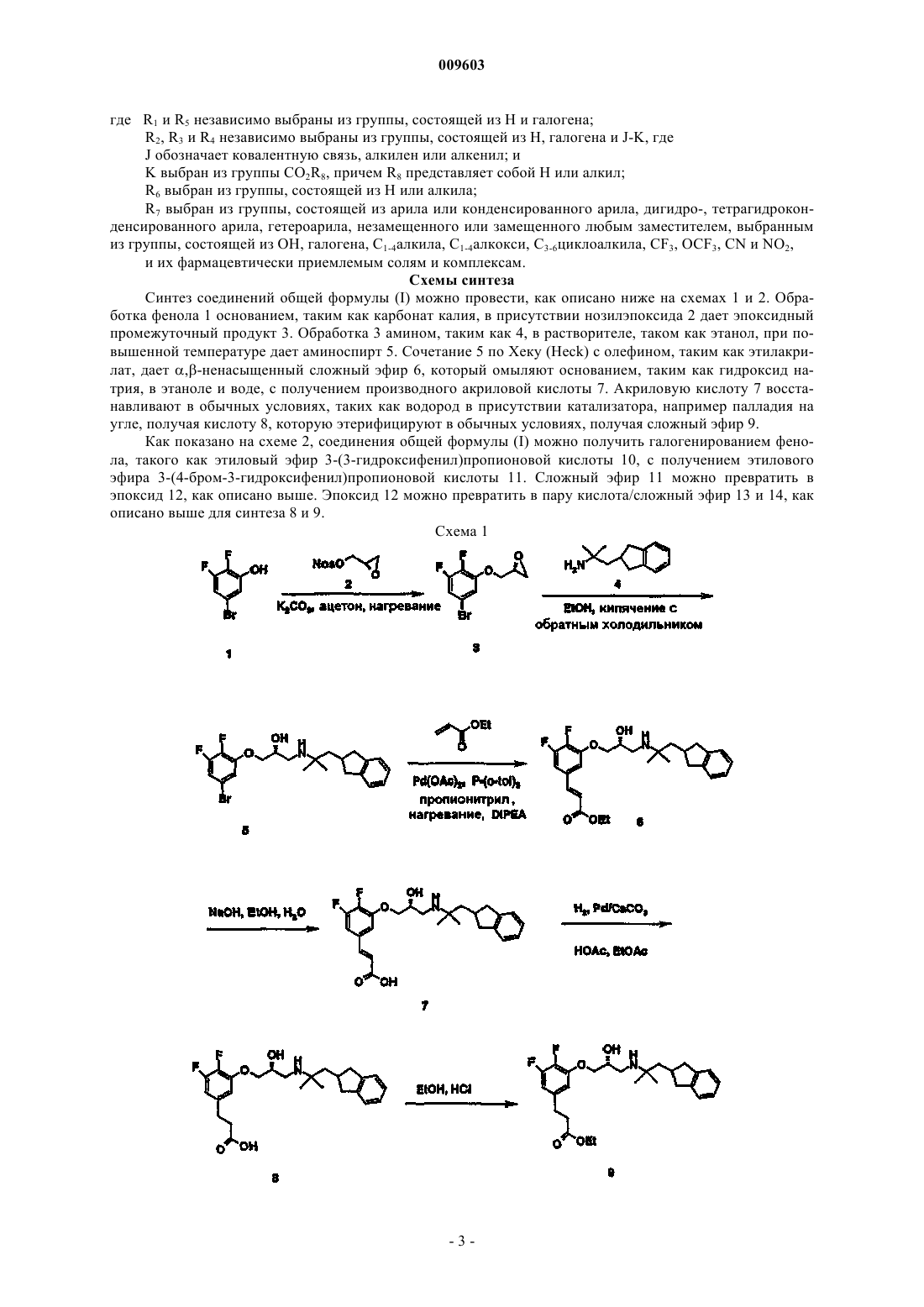
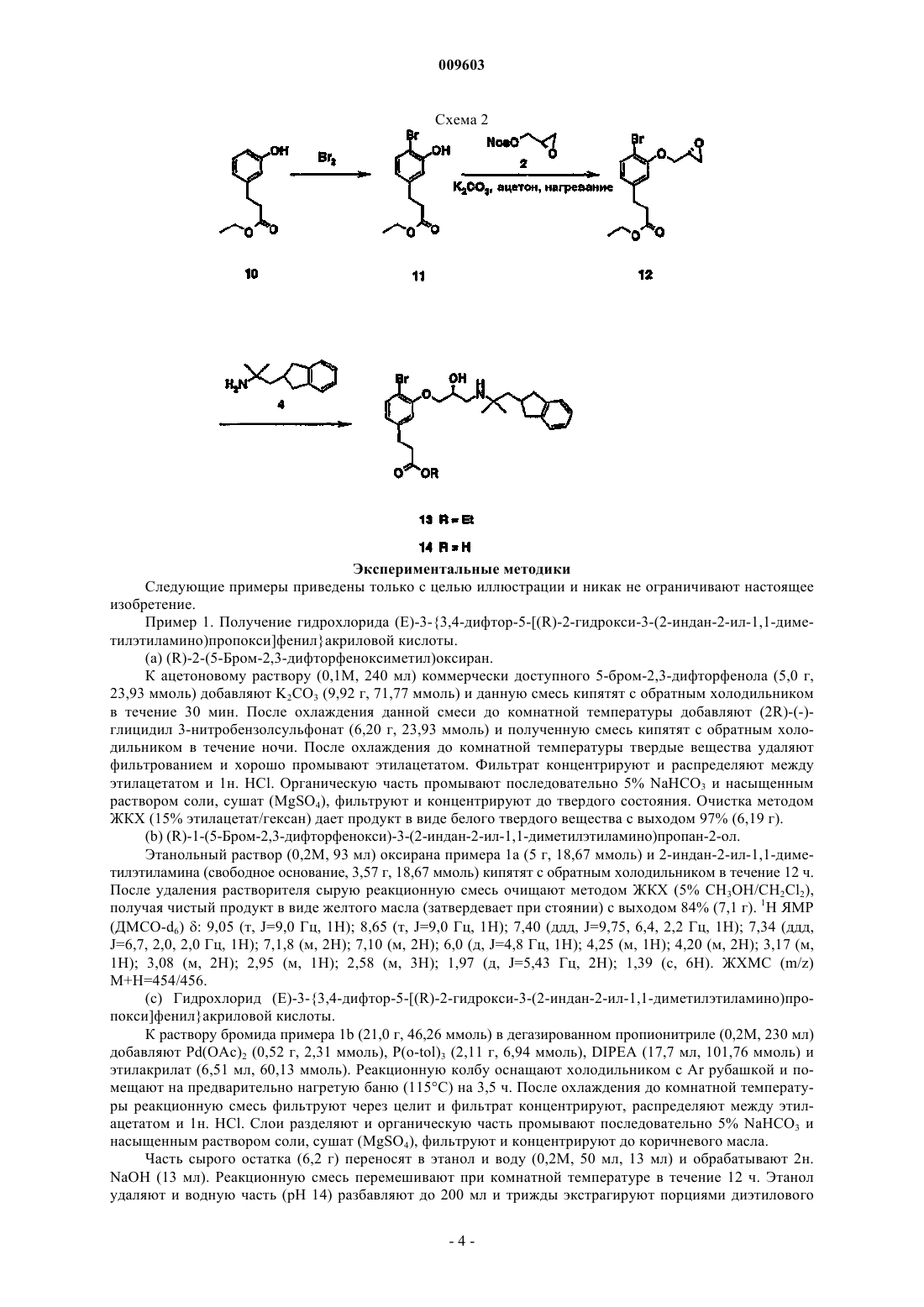
009603 Область техники Настоящее изобретение касается новых соединений, способных ингибировать активность кальциевых рецепторов, и применения таких соединений. Предпочтительно описанные здесь соединения вводят для обеспечения терапевтического эффекта. Уровень техники Настоящее изобретение касается новых кальцилитических соединений, фармацевтических композиций, содержащих данные соединения, и их применения в качестве антагонистов кальциевых рецепторов. У млекопитающих внеклеточный Са 2+ находится под жестким гомеостатическим контролем и регулирует различные процессы, такие как свертываемость крови, нервная и мышечная возбудимость и правильное формирование костей. Внеклеточный Са 2+ ингибирует секрецию паратиреоидного гормона(ПТГ) из паратиреоидных клеток, ингибирует резорбцию костей посредством остеокластов и стимулирует секрецию кальцитонина из С-клеток. Кальций-рецепторные белки обеспечивают возможность реагирования определенных специализированных клеток на изменения концентрации внеклеточного Са 2+. ПТГ представляет собой основной эндокринный фактор, регулирующий гомеостаз Са 2+ в крови и внеклеточных жидкостях. ПТГ при действии на клетки костей и почек повышает уровень Са 2+ в крови. Это повышение внеклеточного Са 2+ действует как отрицательный сигнал обратной связи, подавляя секрецию ПТГ. Взаимосвязь между внеклеточным Са 2+ и секрецией ПТГ образует важный механизм, поддерживающий гомеостаз Са 2+ в организме. Внеклеточный Са 2+ действует непосредственно на паратиреоидные клетки, регулируя секрецию ПТГ. Подтверждено наличие поверхностного белка паратиреоидных клеток, который детектирует изменения внеклеточного Са 2+. См. работу Brown и др., Nature 366: 574, 1993. В паратиреоидных клетках данный белок, кальциевый рецептор, действует как рецептор для внеклеточного Са 2+, детектирует изменения концентрации внеклеточного Са 2+ и инициирует функциональный клеточный ответ, секрецию ПТГ. Внеклеточный Са 2+ влияет на различные клеточные функции, рассмотренные в работе Nemeth и др.,Cell Calcium 11: 319, 1990. Например, внеклеточный Са 2+ играет определенную роль в парафолликулярных (С-клетках) и паратиреоидных клетках. См. работу Nemeth, Cell Calcium 11: 323, 1990. Также исследована роль внеклеточного Са 2+ в остеокластах костей. См. работу Zaidi, Bioscience Reports 10: 493, 1990. Известны различные соединения, имитирующие воздействие внеклеточного Са 2+ на кальций-рецепторную молекулу. Кальцилитики представляют собой соединения, способные ингибировать кальций-рецепторную активность, вызывая тем самым снижение одной или более кальций-рецепторных активностей, обусловленных внеклеточным Са 2+. Кальцилитики полезны в качестве ключевых молекул при открытии, разработке, моделировании, модификации и/или конструировании полезных кальциевых модуляторов, которые активны в отношении Са 2+-рецепторов. Такие кальцилитики полезны при лечении различных болезненных состояний, характеризующихся аномальными уровнями одного или более компонентов, например полипептидов, таких как гормоны, ферменты или факторы роста, экспрессия и/или секреция которых регулируется или находится под воздействием активности одного или нескольких рецепторов Са 2+. Целевые заболевания или расстройства для кальцилитических соединений включают заболевания, затрагивающие аномальный гомеостаз костей и минерального состава. Аномальный кальциевый гомеостаз характеризуется одним или несколькими из следующих явлений: аномальное повышение или снижение кальция в сыворотке; аномальное повышение или снижение мочевыделения кальция; аномальное повышение или снижение уровней кальция в костях (например, по оценке посредством определений минеральной плотности костей); аномальная абсорбция пищевого кальция; аномальное повышение или снижение продукции и/или высвобождения мессенджеров, которые воздействуют на уровни кальция в сыворотке, таких как ПТГ и кальцитонин; и аномальное изменение ответа, вызванного мессенджерами, которые воздействуют на уровни кальция в сыворотке. Таким образом, антагонисты кальциевых рецепторов обеспечивают уникальный подход к фармакотерапии заболеваний, связанных с аномальным гомеостазом костей или минерального состава, таких как гипопаратиреоз, остеосаркома, периодонтальное заболевание, срастание переломов, остеоартрит, ревматоидный артрит, болезнь Педжета, гуморальная гиперкальциемия, связанная со злокачественным заболеванием и срастанием переломов, и остеопороз. Сущность изобретения Настоящее изобретение относится к соединению, имеющему химическую формулу и его фармацевтически приемлемым солям. Кроме этого, предлагаются фармацевтическая композиция, включающая соединение по изобретению и фармацевтически приемлемый разбавитель или наполнитель, а также способ лечения заболевания-1 009603 или расстройства, характеризующегося аномальным гомеостазом костей или минерального состава, и способ повышения уровней паратиреоидного гормона у млекопитающих, которые включают введение нуждающемуся в таком лечении пациенту эффективного количества соединения по изобретению. Расстройство костей или минерального состава выбирают из группы, включающей остеосаркому,периодонтальное заболевание, срастание переломов, остеоартрит, ревматоидный артрит, болезнь Педжета, злокачественное заболевание, связанное с гуморальной гиперкальциемией, и остеопороз. Также описаны другие кальцилитические соединения. Термин "кальцилитические соединения" относится к соединениям, способным ингибировать кальций-рецепторную активность. Способность соединения "ингибировать кальций-рецепторную активность" означает, что данное соединение вызывает снижение одной или более кальций-рецепторных активностей, вызванных внеклеточным Са 2+. Ниже описано применение кальцилитических соединений для ингибирования кальций-рецепторной активности и/или для обеспечения благотворного воздействия на пациента. Кроме того, ниже описаны методики, которые можно применять для получения дополнительных кальцилитических соединений. Примером характерных кальцилитических соединений являются соединения структуры I, имеющие химическую формулу где R1 и R5 независимо выбраны из группы, состоящей из Н и галогена;R2, R3 и R4 независимо выбраны из группы, состоящей из Н, галогена и J-K, гдеK выбран из группы CO2R8, причем R8 представляет собой Н или алкил;R7 выбран из группы, состоящей из арила или конденсированного арила, дигидро-, тетрагидроконденсированного арила, гетероарила, незамещенного или замещенного любым заместителем, выбранным из группы, состоящей из ОН, галогена, С 1-4 алкила, С 1-4 алкокси, С 3-6 циклоалкила, CF3, OCF3, CN и NO2,и их фармацевтически приемлемые соли и комплексы."Alk" обозначает алкил или алкенил. "Низший alk" обозначает низший алкил или низший алкенил,предпочтительно низший алкил. Термин "алкенил" обозначает необязательно замещенную углеводородную группу, содержащую по меньшей мере одну двойную связь углерод-углерод и 2-6 соединенных вместе атомов углерода. Алкенильная углеводородная группа может быть линейной. Линейный алкенил предпочтительно содержит от 2 до 4 атомов углерода. Термин "алкил" обозначает необязательно замещенную углеводородную группу, соединенную простыми связями углерод-углерод и содержащую от 1 до 6 соединенных вместе атомов углерода. Алкильная углеводородная группа может быть линейной или содержать одно или более разветвлений. Разветвленный и линейный алкил предпочтительно содержит от 1 до 4 атомов углерода, каждый из которых необязательно может быть замещенным. Каждый из алкильных заместителей независимо выбран из группы, состоящей из низшего алкила, незамещенного арила, ОН, NH2, NH-низшего алкила и N(низшего алкила)2. Предпочтительно присутствуют не более двух заместителей. Еще более предпочтительно алкил представляет собой низший алкил, который является незамещенным разветвленным или линейным алкилом, содержащим от 2 до 4 атомов углерода. Термин "арил" обозначает необязательно замещенную ароматическую группу по меньшей мере с одним кольцом, имеющую сопряженную или конденсированную циклическую систему. Арил включает карбоциклические арильные, гетероциклические арильные и диарильные группы, каждая из которых необязательно может быть замещенной. Предпочтительно арил представляет собой необязательно замещенный фенил или необязательно замещенный пиридил. Термин "алкокси" обозначает атом кислорода, соединенный с незамещенным алкилом длиной от 1 до 4 атомов углерода, предпочтительно длиной от 1 до 2 атомов углерода. Более предпочтительным алкокси является метокси. Подробное описание изобретения В настоящей заявке продемонстрирована способность кальцилитических соединений оказывать физиологически важное воздействие на клетку путем иллюстрации способности таких соединений повышать секрецию ПТГ и также идентифицирована мишень для кальцилитических соединений. Изобретение относится к соединениям, имеющим формулу-2 009603 где R1 и R5 независимо выбраны из группы, состоящей из Н и галогена;R2, R3 и R4 независимо выбраны из группы, состоящей из Н, галогена и J-K, гдеK выбран из группы CO2R8, причем R8 представляет собой Н или алкил;R7 выбран из группы, состоящей из арила или конденсированного арила, дигидро-, тетрагидроконденсированного арила, гетероарила, незамещенного или замещенного любым заместителем, выбранным из группы, состоящей из ОН, галогена, С 1-4 алкила, C1-4 алкокси, С 3-6 циклоалкила, CF3, OCF3, CN и NO2,и их фармацевтически приемлемым солям и комплексам. Схемы синтеза Синтез соединений общей формулы (I) можно провести, как описано ниже на схемах 1 и 2. Обработка фенола 1 основанием, таким как карбонат калия, в присутствии нозилэпоксида 2 дает эпоксидный промежуточный продукт 3. Обработка 3 амином, таким как 4, в растворителе, таком как этанол, при повышенной температуре дает аминоспирт 5. Сочетание 5 по Хеку (Heck) с олефином, таким как этилакрилат, дает ,-ненасыщенный сложный эфир 6, который омыляют основанием, таким как гидроксид натрия, в этаноле и воде, с получением производного акриловой кислоты 7. Акриловую кислоту 7 восстанавливают в обычных условиях, таких как водород в присутствии катализатора, например палладия на угле, получая кислоту 8, которую этерифицируют в обычных условиях, получая сложный эфир 9. Как показано на схеме 2, соединения общей формулы (I) можно получить галогенированием фенола, такого как этиловый эфир 3-(3-гидроксифенил)пропионовой кислоты 10, с получением этилового эфира 3-(4-бром-3-гидроксифенил)пропионовой кислоты 11. Сложный эфир 11 можно превратить в эпоксид 12, как описано выше. Эпоксид 12 можно превратить в пару кислота/сложный эфир 13 и 14, как описано выше для синтеза 8 и 9. Схема 1 Экспериментальные методики Следующие примеры приведены только с целью иллюстрации и никак не ограничивают настоящее изобретение. Пример 1. Получение гидрохлорида (Е)-3-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилакриловой кислоты.(a) (R)-2-(5-Бром-2,3-дифторфеноксиметил)оксиран. К ацетоновому раствору (0,1 М, 240 мл) коммерчески доступного 5-бром-2,3-дифторфенола (5,0 г,23,93 ммоль) добавляют K2CO3 (9,92 г, 71,77 ммоль) и данную смесь кипятят с обратным холодильником в течение 30 мин. После охлаждения данной смеси до комнатной температуры добавляют (2R)-(-)глицидил 3-нитробензолсульфонат (6,20 г, 23,93 ммоль) и полученную смесь кипятят с обратным холодильником в течение ночи. После охлаждения до комнатной температуры твердые вещества удаляют фильтрованием и хорошо промывают этилацетатом. Фильтрат концентрируют и распределяют между этилацетатом и 1 н. HCl. Органическую часть промывают последовательно 5% NaHCO3 и насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют до твердого состояния. Очистка методом ЖКХ (15% этилацетат/гексан) дает продукт в виде белого твердого вещества с выходом 97% (6,19 г).(b) (R)-1-(5-Бром-2,3-дифторфенокси)-3-(2-индан-2-ил-1,1-диметилэтиламино)пропан-2-ол. Этанольный раствор (0,2 М, 93 мл) оксирана примера 1 а (5 г, 18,67 ммоль) и 2-индан-2-ил-1,1-диметилэтиламина (свободное основание, 3,57 г, 18,67 ммоль) кипятят с обратным холодильником в течение 12 ч. После удаления растворителя сырую реакционную смесь очищают методом ЖКХ (5% СН 3 ОН/CH2Cl2),получая чистый продукт в виде желтого масла (затвердевает при стоянии) с выходом 84% (7,1 г). 1 Н ЯМР(c) Гидрохлорид (Е)-3-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилакриловой кислоты. К раствору бромида примера 1b (21,0 г, 46,26 ммоль) в дегазированном пропионитриле (0,2 М, 230 мл) добавляют Pd(OAc)2 (0,52 г, 2,31 ммоль), P(o-tol)3 (2,11 г, 6,94 ммоль), DIPEA (17,7 мл, 101,76 ммоль) и этилакрилат (6,51 мл, 60,13 ммоль). Реакционную колбу оснащают холодильником с Ar рубашкой и помещают на предварительно нагретую баню (115 С) на 3,5 ч. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и фильтрат концентрируют, распределяют между этилацетатом и 1 н. HCl. Слои разделяют и органическую часть промывают последовательно 5% NaHCO3 и насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют до коричневого масла. Часть сырого остатка (6,2 г) переносят в этанол и воду (0,2 М, 50 мл, 13 мл) и обрабатывают 2 н.NaOH (13 мл). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Этанол удаляют и водную часть (рН 14) разбавляют до 200 мл и трижды экстрагируют порциями диэтилового-4 009603 эфира по 30 мл. Добавляют при перемешивании водную HCl, доводя рН до 5, что вызывает выделение продукта из раствора в виде смолы. Добавляют CH2Cl2 и двухфазную смесь тщательно перемешивают в течение 5-30 мин. Данным способом продукт переводят в белое твердое вещество и выделяют фильтрованием в виде цвиттериона (3,3 г, 70% для 2 стадий). К ацетонитрильной суспензии цвиттерионного продукта добавляют 2 М HCl в диэтиловом эфире. Данный материал быстро переходит в раствор и затем осаждается в виде белого кристаллического твердого вещества, давая (Е)-3-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилакриловую кислоту в виде чистой соли с HCl. 1 Н ЯМР (ДМСО-d6) : 12,53 (с, 1 Н); 8,91 (м,1 Н); 8,58 (м, 1 Н); 7,54 (д, J=16,0 Гц, 1 Н); 7,49 (м, 2 Н); 7,18 (м, 2 Н); 7,11 (м, 2 Н); 6,67 (д, J=16,0 Гц, 1 Н); 6,0 (д, J=4,4 Гц, 1 Н); 4,27 (м, 1 Н); 4,23 (м, 2 Н); 3,17 (м, 1 Н); 3,09 (дд, J=13,4, 7,05 Гц, 2 Н); 2,96 (м, 1 Н); 2,56 (м, 3H); 1,96 (д, J=5,4 Гц, 2 Н); 1,39 (с, 6 Н). Пример 2. Получение гидрохлорида 3-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. К раствору акриловой кислоты примера 1 (2,5 г, 5,62 ммоль) в уксусной кислоте (30 мл) и этилацетате (20 мл) добавляют 5% Pd/СаСО 3 (0,50 г). Реакционную колбу продувают Н 2 и изолируют в Н 2-камере на 15 ч. Данную смесь фильтруют через целит и фильтрат концентрируют до объема примерно 5 мл. Добавляют толуол (100 мл) и 2 М HCl в диэтиловом эфире (10 мл) и раствор концентрируют до белого твердого вещества. Данное твердое вещество суспендируют в ацетонитриле и обрабатывают 2 М HCl в диэтиловом эфире. Данный раствор концентрируют досуха, получая указанное в заголовке соединение как соль HCl в виде белого твердого вещества. 1 Н ЯМР (ДМСО-d6) : 9,0 (м, 1 Н); 8,6 (м, 1 Н); 7,19 (м, 2 Н); 7,11 (м, 2 Н); 6,98 (кажущийся д, J=7,1 Гц, 1 Н); 6,91 (м, 1 Н); 6,0 (широкий с, 1 Н); 4,27 (м, 1 Н); 4,14 (д, J=5,1 Гц, 2 Н); 3,20 (м, 1 Н); 3,10 (м, 2 Н); 2,98 (м, 1 Н); 2,79 (т, J=7,7 Гц, 2 Н); 2,58 (м, 5 Н); 1,97 (д, J=5,4 Гц, 2 Н); 1,39 (с,6 Н). ЖХМС (m/z) M+H=448. Пример 3. Получение гидрохлорида этилового эфира 3-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2 ил-1,1-диметилэтиламино)пропокси]фенил)пропионовой кислоты. К суспензии пропионовой кислоты примера 2 (2 г) в этаноле (20 мл) добавляют 2 М HCl в диэтиловом эфире (2 мл). Данную смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры полученный раствор концентрируют до желтого масла и сушат в вакууме. Содержимое колбы отверждается, давая указанное в заголовке соединение в виде соли HCl (2 г). 1 Н ЯМР(м, 1 Н); 6,0 (широкий с, 1 Н); 4,27 (м, 1 Н); 4,14 (д, J=5,2 Гц, 2 Н); 4,06 (квартет, J=7,1 Гц, 2 Н); 3,18 (м, 1 Н); 3,09 (м, 2 Н); 2,98 (м, 1 Н); 2,82 (т, J=7,5 Гц, 2 Н); 2,61 (м, 5 Н); 1,97 (д, J=5,4 Гц, 2 Н); 1,39 (с, 6 Н); 1,17 (т,J=7,1 Гц, 3H). ЖХМС (m/z) M+H=476. Пример 4. Получение гидрохлорида 5-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенил)пентеновой кислоты. Указанное в заголовке соединение получают в две стадии способами, описанными выше для получения соединения примера 1, за исключением того, что используют этил-4-пентеноат вместо этилакрилата в реакции сочетания Хека, получая этиловый зфир 5-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил 1,1-диметилэтиламино)пропокси]фенилпент-4-еновой кислоты. Продукт реакции Хека, этиловый эфир,гидролизуют до карбоновой кислоты способом, аналогичным описанному выше. Получение соли HCl проводят описанным выше способом. 1 Н ЯМР (ДМСО-d6) : 8,9 (широкий, 1 Н); 8,55 (широкий, 1 Н); 7,18(м, 2 Н); 7,07 (м, 5 Н); 6,38 (с, 1 Н); 5,99 (широкий с, 1 Н); 4,25 (м, 1 Н); 4,15 (м, 2 Н); 3,36 (м, 2 Н); 3,19 (м,1 Н); 3,08 (дд, J=13,3, 7,05 Гц, 2 Н); 2,95 (м, 1 Н); 2,55 (м, 3H); 2,40 (с, 2 Н); 1,95 (д, J=5,3 Гц, 2 Н); 1,39 (с,6 Н). ЖХМС (m/z) M+H=474,6. Пример 5. Получение 5-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпентановой кислоты. Указанную в заголовке кислоту получают гидрированием продукта примера 4 в присутствии каталитического Pd/СаСО 3 в уксусной кислоте и этилацетате способом, аналогичным описанному выше в примере 2. 1 Н ЯМР (ДМСО-d6) : 8,75 (м, 1 Н); 8,50 (м, 1 Н); 7,19 (м, 2 Н); 7,10 (м, 2 Н); 6,90 (м, 2 Н); 5,95(д, J=4,3 Гц, 1 Н); 4,22 (м, 1 Н); 4,15 (м, 2 Н); 3,4 (м, 2 Н); 3,20 (м, 1 Н); 3,10 (дд, J=13,8, 7,2 Гц, 2 Н); 2,98 (м,1 Н); 2,60 (м, 3H); 2,24 (т, J=7,2 Гц, 2 Н); 1,95 (д, J=5,7 Гц, 2 Н); 1,56 (м, 2 Н); 1,51 (м, 2 Н), 1,38 (с, 6 Н). ЖХМС (m/z) M+H=476. Пример 6. Получение этилового эфира 5-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпентановой кислоты. К раствору этилового эфира 5-3,4-дифтор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпент-4-еновой кислоты примера 4 (12,0 г, 23,95 ммоль) в этаноле (250 мл) добавляют 5% Pd/СаСО 3 (2,4 г). Реакционную колбу продувают Н 2 и изолируют в Н 2-камере на 15 ч. Данную смесь фильтруют через целит и фильтрат концентрируют. Колоночная хроматография остатка (SiO2, 5%CH3OH/CH2Cl2) обеспечивает чистый продукт - эфир, который превращают в соль HCl, применяя описанный выше способ.-5 009603 Пример 7. Получение гидрохлорида этилового эфира 3-4-бром-3-[(R)-2-гидрокси-3-(2-индан-2-ил 1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты.(а) Этиловый эфир 3-(3-гидроксифенил)пропионовой кислоты. К раствору коммерчески доступной 3-(3-гидроксифенил)пропионовой кислоты (25 г, 150,4 ммоль) в этаноле (250 мл) добавляют концентрированную серную кислоту (3,0 мл). Раствор кипятят с обратным холодильником в течение ночи. Растворитель удаляют в вакууме и полученное масло разбавляют этилацетатом и помещают в делительную воронку. Органическую часть экстрагируют дважды 5% NaHCO3 и 1 раз насыщенным раствором соли. Данный раствор сушат (MgSO4), фильтруют и концентрируют до темного желтовато-коричневого масла (30 г). Данное вещество переносят на следующую стадию без дополнительной очистки.(b) Этиловый эфир 3-(4-бром-3-гидроксифенил)пропионовой кислоты. К раствору этилового эфира 3-(3-гидроксифенил)пропионовой кислоты (2,0 г, 10,31 ммоль) в хлороформе (0,2 М, 51 мл) при -10 С добавляют N-бромсукцинимид (1,93 г, 10,83 ммоль). После перемешивания при комнатной температуре в течение ночи раствор концентрируют в вакууме и очищают методом колоночной флэш-хроматографии (SiO2, от 5 до 15% этилацетат/гексан), получая продукт в виде бесцветного масла (0,45 г, 16%).(c) (R)-2-(5-Бром-2,3-дифторфеноксиметил)оксиран. Суспензию этилового эфира 3-(4-бром-3-гидроксифенил)пропионовой кислоты (0,6 г, 2,20 ммоль) иK2CO3 (0,91 г, 6,59 ммоль) в ацетоне (0,1 М, 22 мл) кипятят с обратным холодильником в течение 30 мин. После охлаждения данной смеси до комнатной температуры добавляют (2R)-(-)-глицидил 3-нитробензолсульфонат (0,57 г, 2,20 ммоль) и полученную смесь кипятят с обратным холодильником в течение ночи. Твердые вещества удаляют фильтрованием и промывают этилацетатом. Фильтрат концентрируют и распределяют между этилацетатом и 1 н. HCl. Органическую часть промывают последовательно 5%NaHCO3 и насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют до желтого масла.(d) Гидрохлорид этилового эфира 3-4-бром-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Раствор сырого оксирана (0,7 г) и 2-индан-2-ил-1,1-диметилэтиламина (0,42 г, 2,2 ммоль) в этаноле(0,2 М, 11 мл) кипятят с обратным холодильником в течение ночи. После удаления растворителя сырую реакционную смесь очищают методом ЖКХ (5% CH3OH/CH2Cl2), получая чистый продукт в виде желтого масла. Данное вещество растворяют в ацетонитриле и CH2Cl2 и обрабатывают 2 М HCl в диэтиловом эфире. Удаление растворителей и сушка в вакууме дают указанное в заголовке соединение как соль HCl в виде не совсем белого твердого вещества (0,5 г, 44% для 2 стадий). 1 Н ЯМР (ДМСО-d6) : 8,70 (м, 1 Н); 8,52 (м, 1H); 7,47 (д, J=8,1 Гц, 1 Н); 7,18 (м, 2 Н); 7,11 (м, 2 Н); 7,05 (д, J=1,7 Гц, 1 Н); 6,79 (дд, J=8,1, 1,6 Гц,1 Н); 5,92 (д, J=4,7 Гц, 1 Н); 4,15 (м, 1 Н); 4,05 (квартет, J=7,1 Гц, 3H); 3,25 (м, 1 Н); 3,09 (м, 3H); 2,83 (т,J=7,4 Гц, 2 Н); 2,64 (т, J=7,4 Гц, 2 Н); 2,56 (м, 3H); 1,96 (д, J=5,5 Гц, 2 Н); 1,39 (с, 6 Н); 1,17 (т, J=7,1 Гц, 3H). ЖХМС (m/z) M+H=518/520. Пример 8. Получение гидрохлорида 3-4-бром-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. К раствору этилового эфира 3-4-бром-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино) пропокси]фенилпропионовой кислоты примера 7 (0,25 г, 0,48 ммоль) в этаноле (4 мл) и воде (0,8 мл) добавляют 2 н. NaOH (0,36 мл, 0,72 ммоль). Раствор перемешивают при комнатной температуре в течение ночи. Этанол удаляют и остаток разбавляют водой, доводят рН до 6 и экстрагируют трижды CH2Cl2. Органическую часть сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая чистый цвиттерион в виде белого твердого вещества. К ацетонитрильной суспензии цвиттерионного продукта добавляют 2 М HCl в диэтиловом эфире. Данный материал быстро переходит в раствор и затем осаждается в виде белого кристаллического вещества, давая чистую соль HCl, которую выделяют фильтрованием и сушат в вакууме (0,18 г, 76%). 1 Н ЯМР(a) 4-Бром-2,3-дифтороксиранилметоксибензол. Раствор сырого 4-бром-2,3-дифторфенола (0,40 г) [полученный с применением опубликованной методики WO 0121606] и (2R)-глицидил 3-нитробензолсульфоната (0,49 г) в сухом ацетоне (19 мл) обрабатывают карбонатом калия (0,79 г) и кипятят с обратным холодильником под азотом в течение 12 ч. Реакционную смесь охлаждают, фильтруют, фильтрат концентрируют в вакууме и остаток подвергают флэшхроматографии (20% этилацетат/гексан), получая требуемый продукт (0,33 г) с выходом 71%. 1 Н ЯМР(b) (R)-1-(4-Бром-2,3-дифторфенокси)-3-(2-индан-2-ил-1,1-диметилэтиламино)пропан-2-ол. Смесь 2-(5-бром-2,3-дифторфеноксиметил)оксирана примера 8 а (2,12 г, 8 ммоль) и 2-индан-2-ил 1,1-диметилэтиламина (1 Г 51 г, 8 ммоль) помещают в абсолютный этанол (32 мл) и кипятят с обратным холодильником в течение ночи. После расходования всего эпоксида реакционную смесь охлаждают,концентрируют и подвергают флэш-хроматографии (10% метанол/дихлорметан), получая требуемый продукт (3,06 г, 84%). MC (ES) m/z 454 (М+Н)+.(c) Этиловый эфир (Е)-3-2,3-дифтор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино) пропокси]фенилакриловой кислоты. В герметичную пробирку на 150 мл загружают при помощи перемешивающего стержня (R)-1-(4 бром-2,3-дифторфенокси)-3-(2-индан-2-ил-1,1-диметилэтиламино)пропан-2-ол (3,06 г) 1 и пропионитрил(70 мл). К смеси добавляют последовательно Pd(OAc)2 (0,151 г), P(O-tol)3 (0,82 г), этилакрилат (1,35 г),триэтиламин (2,73 г) и обескислороживают реакционную смесь, барботируя азот в течение 15 мин. Герметичную пробирку плотно закрывают и погружают в предварительно нагретую (120 С) масляную баню. Реакционную смесь нагревают при данной температуре в течение 12 ч. Охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Сырой остаток очищают методом колоночной флэш-хроматографии, элюируя сначала 50% EtOAc в гексане и 100% EtOAc. В это время смеси элюирующих растворителей меняют на 100% дихлорметан, 5% МеОН в дихлорметане, а затем 8% МеОН в дихлорметане. Продукт собирают и концентрируют, получая требуемый продукт (2,40 г, 75%) в виде светло-желтой пены. MC (ES) m/z 474 [М+Н]+.(d) Этиловый эфир 3-2,3-дифтор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, вносят соединение примера 8(Pd/СаСО 3) и помещают в атмосферу водорода. Через 16 ч перемешивания все исходные материалы расходуются. Реакционную смесь фильтруют через слой из целита, промывают дополнительным количеством этанола и концентрируют, получая сырой продукт (2,35 г, 98%). MC (ES) m/z 476 [М+Н]+.(e) Гидрохлорид 3-2,3-дифтор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси] фенилпропионовой кислоты. Раствор сложного эфира (1,6 г) в этаноле (30 мл) обрабатывают 2,5 н. NaOH (6 мл) и перемешивают при комнатной температуре под аргоном в течение ночи. Этанол удаляют в вакууме и водный слой разбавляют водой (10 мл) и затем экстрагируют эфиром (3x20 мл). Водный слой собирают и доводят рН до 5 при помощи концентрированной HCl при перемешивании. Осадившееся белое твердое вещество отфильтровывают и сушат на воздухе, получая 1,3 г (86%) белого твердого вещества. MC (ES) m/z 448[М+Н]+. Данную кислоту (0,65 г) суспендируют в сухом ацетонитриле (15 мл) и обрабатывают 2,0 М HCl (4 мл) в эфире. Через несколько минут реакционная смесь становится гомогенной, после чего выпадает белое твердое вещество. Реакционную смесь перемешивают еще 10 мин, после чего осадок фильтруют и сушат,получая указанное в заголовке соединение (0,52 г, 74%). MC (ES) m/z 448 [М+Н]+. 1 Н ЯМР (400 МГц,ДМСО-d6) : 8,63 (с, 1 Н); 8,39 (с, 1 Н); 7,13-6,90 (м, 6 Н); 5,86 (д, 1 Н); 4,14 (широкий с, 1 Н); 4,05 (д, 2 Н); 3,133,09 (м, 1 Н); 3,04 и 3,00 (дд, 2 Н); 2,93-2,89 (м, 1 Н); 2,75 (т, 2 Н); 2,55-2,44 (м, 5 Н); 1,89 (д,2 Н); 1,31 (с, 6 Н). Пример 10. Получение гидрохлорида 3-2,3-дифтор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Кислоту примера 9 (0,65 г) растворяют в абсолютном этаноле (10 мл) и добавляют каталитическое количество концентрированной серной кислоты. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Реакционную смесь концентрируют, затем разбавляют этилацетатом и промывают 2,5 н NaOH (2x10 мл), насыщенным раствором соли (10 мл), сушат над сульфатом натрия. Фильтрат концентрируют, очищают методом ВЭЖХ и превращают в соль HCl, применяя стандартный протокол. MC (ES) m/z 476 [М+Н]+. 1H ЯМР (400 МГц, ДМСО-d6) : 8,72 (с, 1 Н); 8,48 (с, 1 Н); 7,206,99 (м, 6 Н); 5,93 (д, 1 Н); 4,20 (широкий с, 1 Н); 4,12 (д, 2 Н); 4,04 (квартет, 2 Н); 3,20-3,16 (м, 1 Н); 3,11 и 3,07 (дд, 2 Н); 3,00-2,96 (м, 1 Н); 2,85 (т, 2 Н); 2,62-2,51 (м, 5 Н); 1,95 (д, 2 Н); 1,37 (с, 6 Н); 1,15 (т, 3H). Пример 11. Получение гидрохлорида (Е)-3-2,3-дихлор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилакриловой кислоты.(а) 4-Бром-2,3-дихлорфенол. В круглодонной колбе на 250 мл растворяют 10 г 2,3-дихлорфенола в смеси растворителей (ледяная уксусная кислота (16 мл) и хлороформ (4 мл и охлаждают до 10 С. К данной смеси добавляют по каплям бром (3,45 мл) в 15 мл ледяной уксусной кислоты, поддерживая температуру. Реакционную смесь энергично перемешивают при добавлении брома и продолжают энергичное перемешивание в течение 0,5 ч после окончания добавления. В данный момент реакционную смесь выливают в колбу, содержащую 60 мл воды и 30 мл дихлорметана. Органический слой отделяют и водный слой экстрагируют дихлорметаном(3x50 мл). Органические слои объединяют, промывают насыщенным бикарбонатом натрия (3 х 100 мл) и насыщенным раствором соли (100 мл) и сушат над сульфатом натрия. Сырой продукт (9,65 г) переносят-7 009603 на следующую стадию без какой-либо очистки. 1 Н ЯМР (400 МГц, CDCl3) : 7,47 и 6,89 (АВ квартет,2 Н); 5,69 (широкий, 1 Н).(b) 4-Бром-2,3-дихлороксиранилметоксибензол. Раствор сырого 4-бром-2,3-дихлорфенола (7,96 г) и (2R)-глицидил 3-нитробензолсульфоната (8,52 г) в сухом ацетоне (250 мл) обрабатывают карбонатом калия (13,61 г) и кипятят с обратным холодильником под азотом в течение 12 ч. Реакционную смесь охлаждают, фильтруют и фильтрат концентрируют в вакууме, остаток подвергают флэш-хроматографии (20% этилацетат/гексан), получая требуемый продукт(c) (R)-1-(4-Бром-2,3-дихлорфенокси)-3-(2-индан-2-ил-1,1-диметилэтиламино)пропан-2-ол. Смесь эпоксида (0,5 г) и инданиламина (0,32 г) вносят в абсолютный этанол (16 мл) и кипятят с обратным холодильником в течение ночи. После расходования всего эпоксида реакционную смесь охлаждают, концентрируют и очищают методом флэш-хроматографии (10% метанол/дихлорметан), получая 86% требуемого продукта (0,71 г). MC (ES) m/e 488 [М+Н]+.(d) Этиловый эфир (Е)-3-2,3-дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино) пропокси]фенилакриловой кислоты. В герметичную пробирку на 75 мл загружают при помощи перемешивающего стержня бромид (0,9 г) и пропионитрил (10 мл). К данной смеси добавляют последовательно Pd(OAc)2 (0,042 г), P(O-tol)3 (0,23 г) и этилакрилат (0,40 мл) и обескислороживают реакционную смесь, барботируя азот в течение 15 мин. Герметичную трубку плотно закрывают и погружают в предварительно нагретую (120 С) масляную баню. Реакционную смесь нагревают при данной температуре в течение 12 ч. Охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Сырой остаток очищают методом колоночной флэш-хроматографии, элюируя сначала 50% EtOAc в гексане и 100% EtOAc. В это время смеси элюирующих растворителей меняют на 100% ДХМ, 5% МеОН в дихлорметане, а затем 8% МеОН в ДХМ. Продукт собирают и концентрируют, получая требуемый продукт (0,95 г) с выходом 98% в виде светло-желтой пены. MC (ES) m/e 506 [М+Н]+.(е) Гидрохлорид (Е)-3-2,3-дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилакриловой кислоты. Раствор сложного эфира (5,0 г) в этаноле (49 мл) обрабатывают 2,5 н. NaOH (4,5 мл) и перемешивают под аргоном в течение ночи. Этанол удаляют в вакууме и водный слой разбавляют водой (10 мл) и затем экстрагируют эфиром (3x100 мл). Водный слой собирают и доводят рН до 4 при помощи концентрированной HCl при перемешивании. Осадившееся белое твердое вещество собирают фильтрованием и сушат на воздухе, получая указанное в заголовке соединение (3,92 г, 83%). MC (ES) m/e 478 [М+Н]+. 1 Н ЯМР (400 МГц, ДМСО-d6) : 7,76 и 7,15 (АВ квартет, 2 Н); 7,66 (д, 1 Н); 7,06-6,97 (м, 4 Н); 6,41 (д, 1 Н); 4,12-3,92 (м, 3H); 3,20 (широкий с, 1 Н); 2,95 и 2,92 (дд, 2 Н); 2,84 и 2,81 (дд, 2 Н); 2,70 и 2,67 (дд, 2 Н); 2,502,43 (м, 2 Н); 1,67 (д, 2 Н); 1,10 (с, 6 Н). Пример 12. Получение гидрохлорида 3-2,3-дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, помещают акриловую кислоту примера 11 (2,0 г), 100 мл абсолютного этанола и 50 мл метанола. К данной смеси добавляют 0,2 г(10% мас./мас.) катализатора (5% родий/Al2O3) и помещают в атмосферу водорода. Через 16 ч перемешивания все исходные материалы расходуются. Реакционную смесь фильтруют через слой целита, промывают дополнительным количеством метанола и концентрируют, получая требуемый продукт (1,96 г) с выходом 98%. MC (ES) m/e 480,2 [М+Н]+. Кислоту (0,5 г) суспендируют в сухом ацетонитриле (10 мл) и обрабатывают 1,0 М HCl (5,2 мл) в эфире. Реакционную смесь перемешивают в течение 15 мин, затем концентрируют, получая светложелтую пену с количественным выходом. MC (ES) m/e 480,2 [М+Н]+. 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,64 (т, 1 Н); 8,45 (т, 1 Н); 7,27 (д, 1 Н); 7,15-7,04 (м, 4 Н); 5,86 (д, 1 Н); 4,20-4,03 (м, 3H); 3,37-2,82 (м, 10 Н); 2,55-2,45 (м, 2 Н); 1,93 (д, 2 Н); 1,35 (с, 6 Н). Пример 13. Получение трифторацетата этилового эфира 3-2,3-дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Кислоту примера 12 (2,0 г) растворяют в абсолютном этаноле (50 мл) и добавляют каталитическое количество концентрированной серной кислоты. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. На следующий день реакционную смесь концентрируют, разбавляют этилацетатом и промывают 2,5 н. NaOH (2x20 мл), насыщенным раствором соли (20 мл) и сушат над сульфатом натрия. MC (ES) m/e 508 [М+Н]+. Этиловый эфир (33,7 г) растворяют в сухом ацетонитриле и помещают в инертную атмосферу. К данной смеси добавляют 6 мл трифторуксусной кислоты, перемешивают в течение 15 мин и концентрируют, получая густой светло-желтый сироп с количественным выходом (41,2 г). MC (ES) m/e 508-8 009603 кий с, 1 Н); 4,20-4,02 (м, 5 Н); 3,27-3,20 (м, 1 Н); 3,09, 3,05 (дд, 1 Н); 2,95 (т, 1 Н); 2,61-2,47 (м, 5 Н); 1,93 (д,2 Н); 1,35 (с, 6 Н); 1,28 (д, 3H); 1,16 (т, 3H). Пример 14. Получение гидрохлорида этилового эфира 3-4-фтор-3-[(R)-2-гидрокси-3-(2-индан-2 ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты.[ЕР 0238272], и (2R)-глицидил 3-нитробензолсульфоната (5,37 г) в сухом ацетоне (175 мл) обрабатывают карбонатом калия (8,58 г) и кипятят с обратным холодильником под азотом в течение 12 ч. Реакционную смесь охлаждают, фильтруют и фильтрат концентрируют в вакууме, остаток подвергают флэш-хроматографии (20% этилацетат/гексан), получая требуемый продукт (4,25 г) с выходом 82%. 1 Н ЯМР (400 МГц,CDCl3) : 7,15-6,96 (м, 3H); 4,33 и 4,30 (дд, 1 Н); 4,02 и 4,00 (дд, 1 Н); 3,41-3,37 (м, 1 Н); 2,97 (м, 1 Н); 2,78(b) (R)-1-(5-Бром-2-фторфенокси)-3-(2-индан-2-ил-1,1-диметилэтиламино)пропан-2-ол. Смесь эпоксида (3,0 г) и инданиламина (2,24 г) помещают в абсолютный этанол (60 мл) и кипятят с обратным холодильником в течение ночи. После расходования всего эпоксида реакционную смесь охлаждают, концентрируют и очищают методом флэш-хроматографии (10% метанол/дихлорметан), получая 87% требуемого продукт (4,55 г). MC (ES) m/e 437 [М+Н]+.(c) Этиловый эфир (Е)-3-4-фтор-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилакриловой кислоты. В герметичную пробирку загружают при помощи перемешивающего стержня бромид (5,20 г) и пропионитрил (60 мл). К данной смеси добавляют последовательно Pd(OAc)2 (0,54 г), P(O-tol)3 (2,91 г) и этилакрилат (1,95 мл) и обескислороживают реакционную смесь, барботируя азот в течение 15 мин. Герметичную пробирку плотно закрывают и погружают в предварительно нагретую (120 С) масляную баню. Реакционную смесь нагревают при данной температуре в течение 12 ч. Охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Сырой остаток очищают методом колоночной флэш-хроматографии, элюируя сначала 50% EtOAc в гексане и 100% EtOAc. В это время смеси элюирующих растворителей меняют на 100% ДХМ, 5% МеОН в дихлорметане, а затем 8% МеОН в ДХМ. Продукт собирают и концентрируют, получая требуемый продукт (4,81 г) с выходом 88% в виде светло-желтой пены. MC (ES) m/е 556 [М+Н]+.(d) Гидрохлорид этилового эфира 3-4-фтор-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпент-4-еновой кислоты. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, загружают этилакрилат (3,2 г,7 ммоль), 100 мл абсолютного этанола. К данной смеси добавляют 0,32 г (10% мас./мас.) катализатора(Pd/CaCO3) и помещают в атмосферу водорода. Через 16 ч перемешивания все исходные материалы расходуются. Реакционную смесь фильтруют через слой целита, промывают дополнительным количеством этанола и концентрируют, получая требуемый продукт 7 (3,12 г, 97%). MC (ES) m/z 458 [М+Н]+. Сложный эфир 7 (0,5 г, 1 ммоль) суспендируют в сухом ацетонитриле (10 мл) и обрабатывают 2,0 МHCl (3 мл, 5 экв.) в эфире. Через несколько минут реакционная смесь становится гомогенной, после чего выпадает белое твердое вещество. Реакционную смесь перемешивают еще 10 мин, после чего осадок фильтруют и сушат, получая требуемую соль (0,43 г, 80%). MC (ES) m/z 458 [М+Н]+. 1 Н ЯМР (400 МГц,ДМСО-d6) : 8,56 (с, 1 Н); 8,45 (с, 1 Н); 7,28-7,15 (м, 6 Н); 6,91-6,88 (м, 1 Н); 5,98 (д, 1 Н); 4,26 (широкий с,1 Н); 4,19-4,14 (м, 2 Н); 4,13 (квартет, 2 Н); 3,30-3,24 (м, 1 Н); 3,18 и 3,14 (дд, 2 Н); 3,09-3,02 (м, 1 Н); 2,90 (т,2 Н); 2,71-2,57 (м, 5 Н); 2,02 (д, 2 Н); 1,45 (с, 6 Н); 1,28 (т, 3H). Пример 15. Получение гидрохлорида 3-4-фтор-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Раствор сложного эфира примера 14 (2,58 г, 5,6 ммоль) в этаноле (250 мл) обрабатывают 2,5 н.NaOH (10 мл, 4,5 экв.) и перемешивают при комнатной температуре под аргоном в течение ночи. Этанол удаляют в вакууме и водный слой разбавляют водой (30 мл) и затем экстрагируют эфиром (3x100 мл). Водный слой собирают и доводят рН до 5 концентрированной HCl при перемешивании. Осадившееся белое твердое вещество отфильтровывают и сушат на воздухе, получая указанное в заголовке соединение 8 (1,98 г, 81%). MC (ES) m/z 430 [М+Н]+. Кислоту 8 (0,10 г, 0,23 ммоль) суспендируют в сухом ацетонитриле (5 мл) и обрабатывают 2,0 МHCl (1 мл, 5 экв.) в эфире. Через несколько минут реакционная смесь становится гомогенной, после чего выпадает белое твердое вещество. Реакционную смесь перемешивают еще 10 мин, после чего ее фильтруют и сушат, получая требуемую соль (96 мг, 89%). MC (ES) m/z 430 [М+Н]+. 1 Н ЯМР (400 МГц,ДМСО-d6) : 8,61 (т, 1 Н); 8,43 (т, 1 Н); 7,20-7,07 (м, 6 Н); 6,84-6,81 (м, 1 Н); 5,91 (с, 1 Н); 4,20 (широкий с,1 Н); 4,12-4,07 (м, 2 Н); 3,22-3,17 (м, 1 Н); 3,11 и 3,07 (дд, 2 Н); 3,01-2,97 (м, 1 Н); 2,79 (т, 2 Н); 2,62-2,49 (м,5 Н); 1,95 (д, 2 Н); 1,38 (с, 6 Н). Пример 16. Получение гидрохлорида этилового эфира 3-2-хлор-5-[(R)-2-гидрокси-3-(2-индан-2-ил 1,1-диметилэтиламино)пропокси]фенил)пропионовой кислоты.-9 009603 К раствору этилового эфира 3-(3-гидроксифенил)пропионовой кислоты (1,0 г, 5,15 ммоль) в диэтиловом эфире (50 мл) при 0 С добавляют сульфурилхлорид (0,493 мл, 6,18 ммоль). Через 2,5 ч при 0 С реакцию гасят насыщенным карбонатом натрия (50 мл). Водный слой экстрагируют этилацетатом. Органические части объединяют и сушат сульфатом магния. Растворитель удаляют в вакууме, получая сырой продукт, который очищают методом колоночной хроматографии (10% этилацетат/гексан). Указанное в заголовке соединение получают в виде бесцветного масла (0,73 г, выход 62%). 1 Н ЯМР (CDC13) : 6,96(b) Гидрохлорид этилового эфира 3-2-хлор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Применяя описанные выше в примерах 1a-b методики, превращают этиловый эфир 3-(2-хлор-5 гидроксифенил)пропионовой кислоты в указанное в заголовке соединение. ЖХМС (m/z) M+H=474,4. Пример 17. Получение гидрохлорида 3-2-хлор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Этиловый эфир примера 16 омыляют, получая указанное в заголовке соединение. 1 Н ЯМР (ДМСОd6) : 8,78 (с, 1 Н); 8,46 (с, 1 Н); 7,36 (д, 7=8,7 Гц, 2 Н); 7,20-7,18 (м, 2 Н); 7,12-7,16 (м, 2 Н); 6,90 (с, 1 Н); 6,86(д, J=3,0 Гц, 1 Н); 4,02-3,98 (м, 2 Н); 3,36-3,32 (м, 2 Н); 3,12-3,04 (м, 2 Н); 2,90-2,84 (м, 2 Н); 2,62-2,44 (м,6 Н); 1,38 (с, 6 Н). ЖХМС (m/z) M+H=446/448. Пример 18. Получение этилового эфира 3-2,4-дихлор-5-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. К раствору этилового эфира 3-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси] фенилпропионовой кислоты (0,35 г, 0,683 ммоль, полученной из этилового эфира 3-(3-гидроксифенил) пропионовой кислоты описанными здесь способами) в хлороформе (6,8 мл) добавляют N-хлорсукцинимид (0,27 г, 2,05 ммоль) при комнатной температуре. Реакционную смесь кипятят с обратным холодильником в течение ночи. Растворитель удаляют в вакууме и сырой продукт очищают методом ВЭЖХ с обращенной фазой (65% CH3CN/H2O с 0,1% TFA). Чистый продукт получают в виде белого твердого вещества (0,12 г, выход 30%). 1H ЯМР (CDCl3) : 7,2 (с, 1 Н); 7,26 (с, 1 Н); 7,18-7,12 (м, 4 Н); 6,86 (c, 1 Н); 4,51(a) Этиловый эфир (Е)-3-2,3-дихлор-4-[(R)-2-гидрохси-3-(2-индан-2-ил-1,1-диметилэтиламино) пропокси]фенилпент-4-еновой кислоты. В герметичную пробирку на 75 мл загружают при помощи перемешивающего стержня (R)-1-(4 бром-2,3-дихлорфенокси)-3-(2-индан-2-ил-1,1-диметилэтиламино)пропан-2-ол примера 11 с (2,0 г) и пропионитрил (50 мл). К данной смеси добавляют последовательно Pd(OAc)2 (0,09 г), P(O-tol)3 (0,5 г), этил 4-пентеноат (1,05 г) и диизопропилэтиламин (2,08 мл) и обескислороживают реакционную смесь, барботируя азот в течение 15 мин. Герметичную пробирку плотно закрывают и погружают в предварительно нагретую (120 С) масляную баню. Реакционную смесь нагревают при данной температуре в течение 12 ч. Охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Сырой остаток очищают методом колоночной флэш-хроматографии, элюируя сначала 50% EtOAc в гексане и 100% EtOAc. В это время смеси элюирующих растворителей меняют на 100% дихлорметан, 5% МеОН в дихлорметане, а затем 8% МеОН в дихлорметане. Продукт собирают и концентрируют, получая указанное в заголовке соединение (2,0 г) с выходом 92% в виде светло-желтой пены. MC (ES) m/e 534 [М+Н]+.(b) (E)-3-2,3-Дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпент 4-еновая кислота. Раствор сложного эфира примера 19 а (2,0 г) в этаноле (25 мл) обрабатывают 2,5 н. NaOH (6 мл) и перемешивают под азотом в течение ночи. Этанол выпаривают, водный слой разбавляют водой (10 мл) и затем экстрагируют эфиром (3x100 мл). Доводят рН водного слоя до 5 концентрированной HCl, экстрагируют дихлорметаном, сушат и концентрируют, получая светло-желтую пену с выходом 81% (1,53 г).(с) Трифторацетат 3-2,3-дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпент-4-еновой кислоты. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, загружают кислоту примера 19b (1,0 г), 100 мл абсолютного этанола и 50 мл метанола. К данной смеси добавляют 0,2 г (10% мас./мас.) катализатора (5% родий/Al2O3) и помещают в атмосферу водорода. Через 16 ч перемешивания все исходные материалы расходуются. Реакционную смесь фильтруют через слой целита, промывают дополнительным количеством метанола и концентрируют. Полученный светло-желтый сироп очищают методом ВЭЖХ (элюируют смесью CH3CN/H2O, содержащей 0,1% TFA), получая требуемый продукт с выходом 72% (0,88 г). MC (ES) m/e 508 [М+Н]+. 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,19 (широкий с, 2 Н);- 10009603 7,14 (д, 1 Н); 7,03-6,92 (м, 5 Н); 5,77 (широкий с, 1 Н); 4,05-3,91 (м, 2 Н); 3,13-3,05 (м, 2 Н); 2,97-2,88 (м, 4 Н); 2,55-2,35 (м, 4 Н); 2,08 (т, 2 Н); 1,77 (д, 2 Н); 1,63-1,58 (м, 2 Н); 1,37-1,35 (м, 2 Н); 1,20 (д, 6 Н). Пример 20. Получение трифторацетата этилового эфира 3-2,3-дихлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпент-4-еновой кислоты. Кислоту примера 19 (0,5 г) растворяют в абсолютном этаноле (10 мл) и добавляют каталитическое количество концентрированной серной кислоты. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. На следующий день реакционную смесь концентрируют и разбавляют этилацетатом, промывают 2,5 н. NaOH (2x20 мл), насыщенным раствором соли (20 мл) и сушат над сульфатом натрия. Сырую смесь очищают методом ВЭЖХ (элюируют смесью CH3CN/H2O, содержащей 0,1% TFA), получая требуемый продукт с выходом 81% (0,43 г). MC (ES) m/e 536 [М+Н]+. 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,35-8,48 (широкий с, 2 Н); 7,31-7,10 (м, 6 Н); 4,17-4,01 (м, 5 Н); 3,26-3,05 (м, 4 Н); 2,692,50 (м, 7 Н); 2,32 (т, 2 Н); 1,94 (д, 2 Н); 1,58-1,54 (т, 2 Н); 1,33 (с, 3H); 1,35 (с, 3H); 1,18 (т, 3H). Пример 21. Получение гидрохлорида этилового эфира 3-2,3-дихлор-4-[2-(R)-гидрокси-3-(2-индан 2-ил-1,1-диметилэтиламино)-1(R)-метилпропокси]фенилпропионовой кислоты, гидрохлорида этилового эфира 3-2,3-дихлор-4-[2-(S)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(S)-метилпропокси]фенилпропионовой кислоты, гидрохлорида этилового эфира 3-2,3-дихлор-4-[2-(R)-гидрокси-3-(2-индан 2-ил-1,1-диметилэтиламино)-1(S)-метилпропокси]фенилпропионовой кислоты, гидрохлорида этилового эфира 3-2,3-дихлор-4-[2-(S)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(R)-метилпропокси]фенилпропионовой кислоты.(a) 1-Бром-2,3-дихлор-4-(1-метилаллилокси)бензол. К холодной смеси бут-3-ен-1-ола (1,29 г) и 4-бром-2,3-дихлорфенола (4,35 г) добавляют последовательно трифенилфосфин (5,65 г) и DEAD (3,69 г). Реакционную смесь медленно нагревают до комнатной температуры при перемешивании. Через 12 ч реакционную смесь концентрируют и сырой остаток очищают методом колоночной флэш-хроматографии, элюируя EtOAc в гексане и получая требуемый продукт (3,83 г) с выходом 72% в виде светло-желтой пены. 1 Н ЯМР (400 МГц, CDCl3) : 7,44 и 6,77 (АВ квартет, 2 Н); 5,95-5,87 (м, 1 Н); 5,31-5,20 (м, 2 Н); 4,81-4,78 (м, 1 Н); 1,52 (д, 3H).(b) 2-[1-(4-Бром-2,3-дихлорфенокси)этил]оксиран. 1-Бром-2,3-дихлор-4-(1-метилаллилокси)бензол (2,5 г), 1,1,1-трифторацетон (6,05 мл) и бикарбонат натрия (2,12 г) помещают в смесь растворителей ацетонитрила и воды (2:1, 45 мл) и охлаждают до 0 С. Добавляют тремя порциями оксон (5,19 г) и реакционную смесь медленно нагревают до комнатной температуры. По окончании реакционную смесь фильтруют, концентрируют и повторно растворяют в этилацетате. Данный раствор промывают насыщенным NH4Cl, насыщенным раствором соли и сушат над сульфатом натрия. После фильтрования его концентрируют и очищают методом колоночной флэш-хроматографии, элюируя EtOAc в гексане и получая требуемый продукт (2,39 г) с выходом 91% в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDC13) : 7,48 (д, 2 Н); 6,97 (д, 1 Н); 6,83 (д, 1 Н); 4,40-4,38 (м,1 Н); 4,15-4,08 (м, 1 Н); 3,25-3,21 (м, 1 Н); 3,18-3,16 (м, 1 Н); 2,89 (т, 1 Н); 2,85-2,68 (м, 3H); 1,49-1,44 (м, 6 Н).(c) 3-(4-Бром-2,3-дихлорфенокси)-1-(2-индан-2-ил-1,1-диметилэтиламино)бутан-2-ол. Смесь эпоксида (4,44 г) и инданиламина (2,69 г) помещают в абсолютный этанол (16 мл) и кипятят с обратным холодильником в течение ночи. После расходования всего эпоксида реакционную смесь охлаждают, концентрируют и подвергают флэш-хроматографии (10% метанол/дихлорметан), получая 93% требуемого продукта (6,61 г). MC (ES) m/e 502,4 [М+Н]+.(d) Этиловый эфир (Е)-3-2,3-дихлор-4-[2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1-метилпропокси]фенилакриловой кислоты. В герметичную пробирку на 75 мл загружают при помощи перемешивающего стержня бромид примера 21 с (5,0 г) и пропионитрил (100 мл). К данной смеси добавляют последовательно Pd(OAc)2 (0,22 г),P(O-tol)3 (1,22 г), этилакрилат (2,17 мл) и N,N-диизопропилэтиламин (7,10 мл) и обескислороживают реакционную смесь, барботируя азот в течение 15 мин. Герметичную трубку плотно закрывают и погружают в предварительно нагретую (120 С) масляную баню. Реакционную смесь нагревают при данной температуре в течение 12 ч. Охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Сырой остаток очищают методом колоночной флэш-хроматографии, элюируя сначала 50% EtOAc в гексане и 100% EtOAc. В это время смеси элюирующих растворителей меняют на 100% дихлорметан, 5% МеОН в дихлорметане, а затем 8% МеОН в дихлорметане. Продукт собирают и концентрируют, получая требуемый продукт (5,10 г) с выходом 98% в виде светло-желтой пены. MC(e) (Е)-3-2,3-Дихлор-4-[2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1-метилпропокси]фенилакриловая кислота. Раствор сложного эфира примера 21d (5,0 г) в этаноле (100 мл) обрабатывают 2,5 н. NaOH (16 мл) и перемешивают при комнатной температуре под аргоном в течение ночи. Этанол удаляют при пониженном давлении, водный слой разбавляют водой (10 мл) и затем экстрагируют эфиром (3x100 мл). Водный слой собирают и доводят рН до 4 концентрированной HCl. Осадившееся белое твердое вещество соби- 11009603 рают фильтрованием и сушат на воздухе, получая диастереомерные смеси с выходом 77% (3,64 г). MC(f) 3-2,3-Дихлор-4-[2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1-метилпропокси]фенилпропионовая кислота. В круглодонную колбу на 250 мл, снабженную магнитной мешалкой, загружают акриловую кислоту примера 21 е (0,58 г) и 20 мл абсолютного этанола. К данной смеси добавляют 0,2 г (10% мас./мас.) катализатора (5% родий/Al2O3) и помещают в атмосферу водорода. Через 48 ч перемешивания все исходные материалы расходуются. Реакционную смесь фильтруют через слой целита, промывают дополнительным количеством метанола и концентрируют, получая требуемый продукт в виде смеси диастереомеров (0,58 г). MC (ES) m/e 494 [М+Н]+.(g) Гидрохлорид этилового эфира 3-2,3-дихлор-4-[2-(R)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(R)-метилпропокси]фенилпропионовой кислоты. Гидрохлорид этилового эфира 3-2,3-дихлор-4-[2-(S)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(S)-метилпропокси]фенилпропионовой кислоты. Гидрохлорид этилового эфира 3-2,3-дихлор-4-[2-(R)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(S)-метилпропокси]фенилпропионовой кислоты. Гидрохлорид этилового эфира 3-2,3-дихлор-4-[2-(S)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(R)-метилпропокси]фенилпропионовой кислоты. Кислоту примера 20f (2,50 г) растворяют в абсолютном этаноле и добавляют каталитическое количество концентрированной серной кислоты. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. На следующий день реакционную смесь концентрируют, разбавляют этилацетатом и промывают 2,5 н. NaOH, насыщенным раствором соли и сушат (Na2SO4). Сырой остаток очищают методом колоночной флэш-хроматографии, элюируя сначала 50% EtOAc в гексане и 100%EtOAc. В это время смеси элюирующих растворителей меняют на 100% дихлорметан, 5% МеОН в дихлорметане, а затем 8% МеОН в ДХМ. Продукт собирают и концентрируют, получая требуемый продукт: 0,8 г чистого продукта (продуктов) и еще 0,7 г продукта с 10% примесей. Чистый продукт, содержащий все четыре диастереомера, разделяют методом ВЭЖХ, получая 100-250 мг каждого индивидуального диастереомера со степенью чистоты более 99%. MC (ES) m/e 522 [М+Н]+. Каждый чистый стереомер суспендируют в сухом ацетонитриле и обрабатывают 1,0 М HCl в эфире. Через 15 мин реакционную смесь концентрируют, получая указанные в заголовке соединения в виде чистых диастереомеров: каждый индивидуальный диастереомер имеет молекулярную массу (по данным масс-спектрального анализа), которая согласуется с молекулярной формулой.MC (ES) m/e 522 [М+Н]+. Пример 22. Получение гидрохлорида 3-2,3-дихлор-4-[2-(R)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(R)-метилпропокси]фенилпропионовой кислоты, гидрохлорида 3-2,3-дихлор-4-[2-(S)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(S)-метилпропокси]фенилпропионовой кислоты, гидрохлорида 3-2,3-дихлор-4-[2-(R)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино-1(S)-метилпропокси]фенилпропионовой кислоты, гидрохлорида 3-2,3-дихлор-4-[2-(S)-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)-1(R)-метилпропокси]фенилпропионовой кислоты. Каждый из индивидуальных диастереомерных сложных эфиров примера 21 омыляют воднымNaOH и затем превращают в соль соляной кислоты, обрабатывая соляной кислотой в сухом ацетонитриле и получая указанные в заголовке соединения. Каждая индивидуальная диастереомерная кислота имеет молекулярную массу (по данным массспектрального анализа), которая согласуется с молекулярной формулой. MC (ES) m/e 494 [М+Н]+. Пример 23. Получение этилового эфира 3-3-хлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Указанное в заголовке соединение получают, следуя общей методике примера 1a-b, за исключением того, что заменяют бром-2,3-дифторфенол на этиловый эфир 3-(3-хлор-4-гидроксифенил)пропионовой кислоты. Пример 24. Получение 3-3-хлор-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Указанное в заголовке соединение получают, следуя общей методике примера 1 с, за исключением того, что заменяют бром-2,3-дифторфенол на сложный эфир примера 23. Пример 25. Получение этилового эфира 3-3-бром-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Указанное в заголовке соединение получают, следуя общей методике примера 1a-b, за исключением того, что заменяют бром-2,3-дифторфенол на этиловый эфир 3-(3-бром-4-гидроксифенил)пропионовой кислоты. Пример 26. Получение 3-3-хлор-4-[(R)-2-гидрокси-3-[2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. Указанное в заголовке соединение получают, следуя общей методике примера 1 с, за исключением того, что заменяют бром-2,3-дифторфенол на сложный эфир примера 25.- 12009603 Пример 27. Получение этилового эфира 3-(3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты.(a) Этиловый эфир 3-(3-гидроксифенил)пропионовой кислоты. Этанольный раствор (250 мл) 3-(3-гидроксифенил)пропионовой кислоты (25 г, 100,4 моль) и концентрированную серную кислоту (3,0 мл) кипятят с обратным холодильником в течение 2 ч и затем при комнатной температуре в течение ночи. Растворитель удаляют, выпаривая на роторном испарителе, и остаток переносят в этилацетат. Органическую часть промывают последовательно 5% NaHCO3 (2 х) и насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют до коричневого масла (30 г,количественно), данный материал используют без дополнительной очистки.(b) Этиловый эфир 3-[3-R)-1-оксиранилметокси)фенил]пропионовой кислоты. К ацетоновому раствору (0,15 М, 170 мл) этилового эфира 3-(3-гидроксифенил)пропионовой кислоты (5,0 г, 25,77 ммоль) добавляют K2CO3 (10,69 г, 77,32 ммоль) и данную смесь кипятят с обратным холодильником в течение 30 мин. После охлаждения смеси до комнатной температуры добавляют (2R)-(-)глицидил 3-нитробензолсульфонат (6,68 г, 25,77 ммоль) и полученную смесь кипятят с обратным холодильником в течение ночи. После охлаждения до комнатной температуры удаляют твердые вещества фильтрованием и хорошо промывают этилацетатом. Фильтрат концентрируют и распределяют между этилацетатом и 1 н. HCl. Органическую часть промывают последовательно 5% NaHCO3 и насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют до твердого состояния. Очистка методом ЖКХ (30% этилацетат/гексан) дает продукт в виде белого твердого вещества с выходом 93% (6,0 г). ЖХМС (m/z) M+H: 187.(с) Этиловый эфир 3-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенил пропионовой кислоты. Этанольный раствор (0,2 М, 100 мл) указанного выше оксирана (5 г, 20,0 ммоль) и 2-индан-2-ил-1,1 диметилэтиламина (свободное основание, 3,78 г, 20,0 ммоль) кипятят с обратным холодильником в течение 15 ч. После удаления растворителя сырую реакционную смесь очищают методом ЖКХ (от 2 до 5%CH3OH/CH2Cl2), получая указанное в заголовке соединение в виде желтого масла с выходом 85% (7,5 г). ЖХМС (m/z) M+H: 440. Пример 28. Получение 3-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. К раствору этилового эфира 3-3-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси] фенилпропионовой кислоты (1,3 г, 3,0 ммоль) примера 27 в этаноле (12 мл) и воде (3 мл) добавляют 2 н.NaOH (3 мл, 6,0 ммоль). Раствор перемешивают при комнатной температуре в течение ночи. Этанол удаляют и остаток распределяют между диэтиловым эфиром и водой. Водную часть промывают 3 раза диэтиловым эфиром и затем доводят рН до 5. Твердое вещество, которое осаждается из водного слоя, выделяют фильтрованием, получая чистый цвиттерион в виде белого твердого вещества. К ацетонитрильной суспензии цвиттерионого продукта добавляют 2 М HCl в диэтиловом эфире. Вещество быстро переходит в раствор и затем осаждается в виде белого твердого вещества, давая указанное в заголовке соединение в виде соли HCl, которую выделяют фильтрованием и сушат в вакууме(0,85 г, 63%). ЖХМС (m/z) M+H: 412. Пример 29. Получение 3-4-[(R)-2-гидрокси-3-(2-индан-2-ил-1,1-диметилэтиламино)пропокси]фенилпропионовой кислоты. В круглодонную колбу на 25 мл, снабженную магнитной мешалкой, загружают дихлорпропионовую кислоту (0,12 г, 0,25 ммоль) и 3 мл абсолютного этанола. К данной смеси добавляют 0,012 г (10% мас./мас.) катализатора (Pd/C) и помещают в атмосферу водорода. Перемешивают при комнатной температуре до завершения дехлорирования. Реакционную смесь фильтруют через слой целита, промывают дополнительным количеством этанола, концентрируют и очищают методом ВЭЖХ, получая соль TFA(36 мг). MC (ES) m/z 412 [М+Н]+. Все цитированные в данном описании публикации, включая (но не ограничиваясь) патенты и патентные заявки, включены здесь в виде ссылок, как будто для каждой индивидуальной публикации конкретно и индивидуально указано, что она включена здесь в виде ссылки, хотя они достаточно полно изложены. Приведенное выше описание полностью раскрывает данное изобретение, включая его предпочтительные варианты. Модификации и улучшения вариантов, подробно здесь раскрытых, включены в объем приведенной далее формулы изобретения. Предполагается, что специалист в данной области может без дополнительной доработки, используя предшествующее описание, применять настоящее изобретение в полной мере. Таким образом, приведенные здесь примеры составлены только как иллюстративные и никоим образом не ограничивают область настоящего изобретения. Варианты данного изобретения, в которых заявлено особое свойство или преимущество, определены далее в формуле изобретения. или его фармацевтически приемлемые соли. 2. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый разбавитель или наполнитель. 3. Способ лечения заболевания или расстройства, характеризующегося аномальным гомеостазом костей или минерального состава, который включает введение нуждающемуся в таком лечении пациенту эффективного количества соединения по п.1. 4. Способ по п.3, в котором расстройство костей или минерального состава выбрано из группы,включающей остеосаркому, периодонтальное заболевание, срастание переломов, остеоартрит, ревматоидный артрит, болезнь Педжета, злокачественное заболевание, связанное с гуморальной гиперкальциемией, и остеопороз. 5. Способ по п.3, в котором заболевание или расстройство костей или минерального состава является остеопорозом. 6. Способ повышения уровней паратиреоидного гормона у млекопитающих, который включает введение нуждающемуся в таком лечении пациенту эффективного количества соединения по п.1.
МПК / Метки
МПК: C07C 229/00
Метки: соединения, кальцилитические
Код ссылки
<a href="https://eas.patents.su/15-9603-kalciliticheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Кальцилитические соединения</a>
Предыдущий патент: Антипаразитарная композиция
Случайный патент: Каталитические композиции, включающие молекулярные сита, их приготовление и применение в процессах превращения