Замещенные [2-(1-пиперазинил)этокси]метильные соединения, способ их получения и их применение
Номер патента: 831
Опубликовано: 24.04.2000
Авторы: Дюшене Ги, Люркин Франсуаз, Делирс Мишель, Мотте Женевьев, Бодсон Ги
Формула / Реферат
1. Замещенные [2-(1-пиперазинил)этокси]метильные соединения формулы
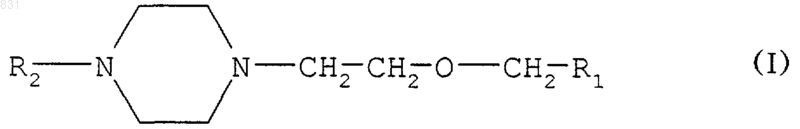
где R1 обозначает -CONH2, -CN, -СООН, -СООМ или -СООR3, причем М обозначает щелочной металл и R3 обозначает С1-4алкил; и
R2 обозначает атом водорода или группу -COR4 или R5, причем R4 выбран из групп -OR5 или R7, в которых
R5 обозначает аллил или алкиларил,
R6 обозначает линейный или разветвленный С1-4алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и
R7 обозначает галоидалкил.
2. Замещенное [2-(1-пиперазинил)этокси]метильное соединение по п.1, отличающееся тем, что оно выбрано из
2-(1-пиперазинил)этоксиуксусной кислоты,
2-[2-(1-пиперазинил)этокси]ацетамида,
2-(1-пиперазинил)этоксиацетонитрила,
метил-2-(1-пиперазинил)этоксиацетата,
этил-2-(1-пиперазинил)этоксиацетата,
2-(4-бензил-1-пиперазинил)этоксиацетамида,
2-(4-бензил-1-пиперазинил)этоксиацетонитрила,
метил-2-(4-бензил-1-пиперазинил)этоксиацетата,
бензил-4-(2-карбамоилметоксиэтил)пиперазин-1-карбоксилата,
бензил-4-(2-цианметоксиэтил)пиперазин-1-карбоксилата,
трет.бутил-4-(2-карбамоилметоксиэтил)пиперазин-1-карбоксилата,
трет.бутил-4-(2-цианметоксиэтил)пиперазин-1-карбоксилата,
трет.бутил-4-(2-метоксикарбонилметоксиэтил)пиперазин-1-карбоксилата,
этил-4-(2-карбамоилметоксиэтил)пиперазин-1-карбоксилата и
2-(4-карбоксиэтил-1-пиперазинил)этоксиацетата калия.
3. Замещенные [2-(1-пиперазинил)этокси]метильные соединения по п.1, отличающиеся тем, что группа, защищающая аминную функцию R2, представляет собой линейную или разветвленную алкилкарбоксилатную группу, содержащую 1-4 атома углерода, или алкиларильную группу.
4. Способ получения замещенных [2-(1-пиперазинил)этокси]-метильных соединений по любому из пп.1-3, отличающийся тем, что пиперазин формулы
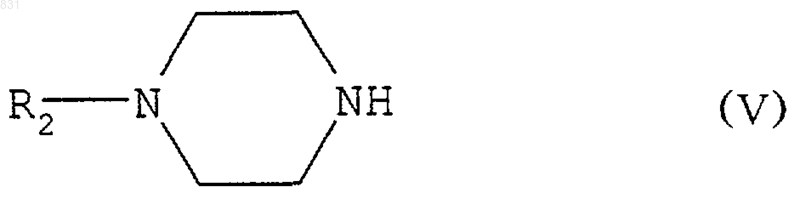
где R2 обозначает атом водорода или группу -COR4 или R5, где R4 выбран из групп -OR6 или R7, в которых
R5 обозначает аллил или алкиларил,
R6 обозначает линейный или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и
R7 обозначает галоидалкил,
подвергают взаимодействию с замещенным [2-галоэтокси]метильным соединением формулы
Х-СН2-СН2-О-СН2-R1 (VI)
где R1 обозначает -CONH2, -CN, -COOH, -СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С1-4алкил и Х обозначает галоген.
5. Способ по п.4, отличающийся тем, что атом галогена, обозначенный X, представляет собой хлор или йод.
6. Способ по п.4 или 5, отличающийся тем, что защитная группа для аминной функции R2 представляет собой линейную или разветвленную алкилкарбоксилатную группу, содержащую 1-4 атома углерода, или алкиларильную группу.
7. Применение замещенных [2-(1-пиперазинил)этокси]метильных соединений формулы
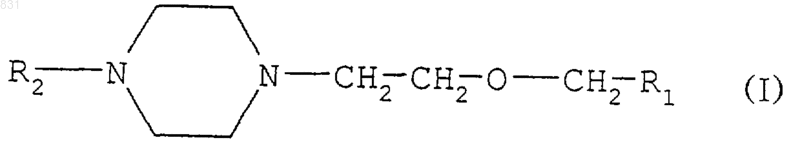
где R1 обозначает -СОNН2, -CN, -COOH, -СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает C1-4алкил; и
R2 обозначает атом водорода, в качестве промежуточных продуктов для получения соединений формулы
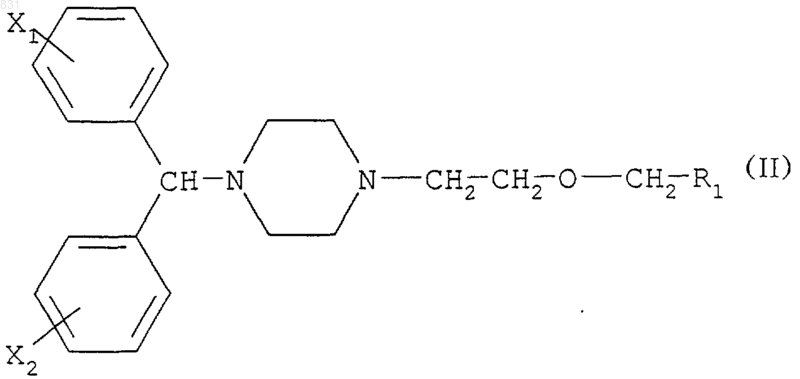
где R1 имеет то же значение, что и в формуле (I) выше и X1 и Х2 независимо обозначают водород, фтор, хлор и/или бром.
8. Способ получения соединений формулы
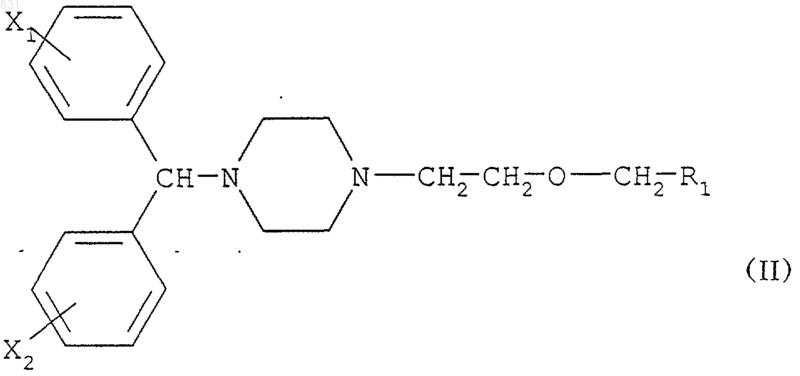
где R1 обозначает -CONH2, -CN, -СООН, -СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает C1-4алкил, и Х1 и Х2 независимо обозначают водород, фтор, хлор и/или бром, отличающийся тем, что замещенное [2-(1-пиперазинил)этокси]-метильное соединение формулы
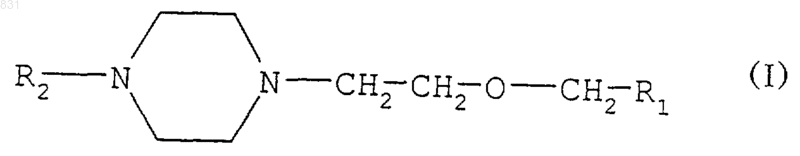
где R1 обозначает -CONH2, -CN, -СООН, -СООМ или -COOR3, M обозначает щелочной металл, R3 обозначает С1-4 алкил; и
R2 обозначает атом водорода,
подвергают взаимодействию с дифенилметангалогенидом формулы
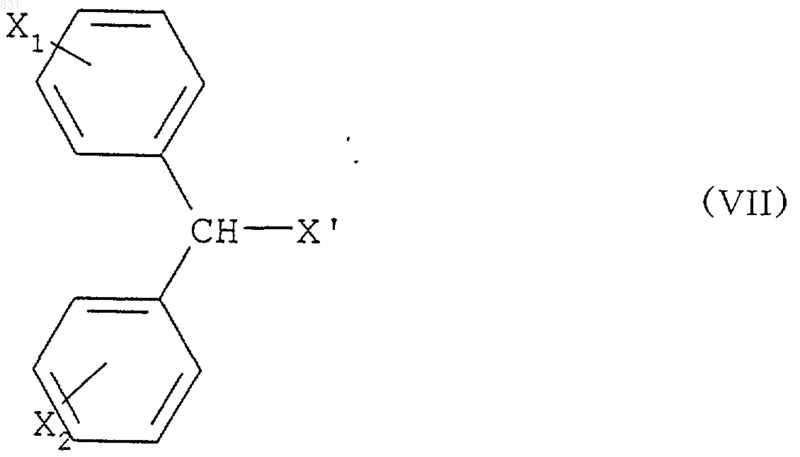
где X обозначает галоген, выбранный из хлора, брома или йода, и X1 и Х2 независимо обозначают водород, фтор, хлор и/или бром.
9. Способ по п.8, отличающийся тем, что замещенное [2-(1-пиперазинил)этокси]метильное соединение формулы (I), где R2 обозначает атом водорода, представляет собой продукт реакции отщепления группы R2 замещенного [2-(1-пиперазинил)этокси]метильного соединения формулы (I), где R2 обозначает атом водорода или группу -COR4 или -R5, где R4 выбран из групп OR6 или R7,
где R5 обозначает аллил или алкиларил,
R6 обозначает линейный или разветвленный С1-4алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и
R7 обозначает галоидалкил.
10. Применение соединений формулы
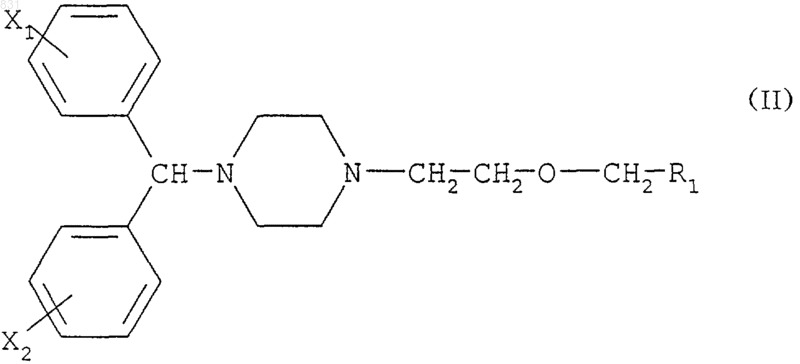
где R1 обозначает -CONH2, -CN, -COOH, -СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С1-4алкил, и Х1 обозначает атом хлора в положении 4, и Х2 обозначает атом водорода, полученных способом по п.8, в качестве промежуточных соединений для получения 2-[2-[4-[(4-хлорфенил)-фенилметил]-1-пиперазинил]этокси]уксусной кислоты и/или её фармацевтически приемлемых солей.
11. Применение соединений формулы
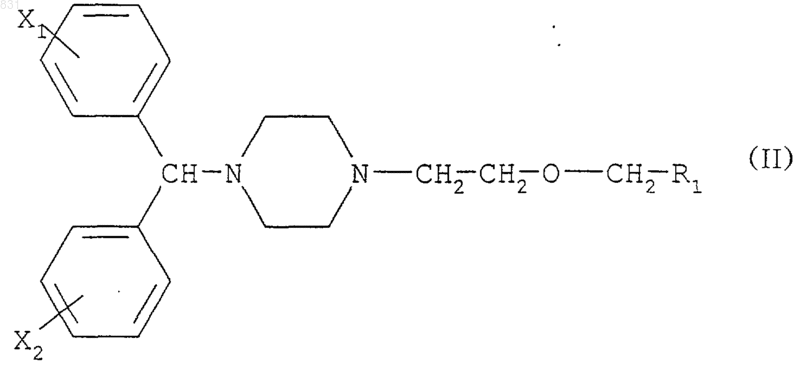
где R1 обозначает -CONH2, -CN, -COOH, -СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С1-4алкил, и X1 и Х2 каждый обозначает атом фтора в положении 4, полученных способом по п.8, в качестве промежуточных соединений для получения 2-[2-[4-[бис(4-фторфенил)фенилметил]-1-пиперазинил]этокси]уксусной кислоты и/или её фармацевтически приемлемых солей.
Текст
1 Данное изобретение относится к новымсоединениям, замещенным [2-(1-пиперазинил) этокси]метильным соединениям формулыR1 обозначает -СОNН 2, -CN, -СООН,-СООМ или -СООR3, причем М обозначает щелочной металл и R3 обозначает С 1-4 алкил иR2 обозначает атом водорода или группу COR4 или R5, причем R4 выбран из групп -OR6 или R7, в которыхR5 обозначает аллил или алкиларил,R6 обозначает линейный или разветвленный C1-4 алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, иR7 обозначает галоидалкил,к способу получения этих соединений и к их применению для получения соединений формулы где R1 имеет то же значение, что и в формуле I и-СООН и X1 обозначает атом хлора в положении 4, а Х 2 обозначает атом водорода, соединение формулы II представляет собой 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси] уксусную кислоту формулы В случае, когда R1 обозначает -СОNН 2,-CN, -СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С 1-4 алкил и Х 1 обозначает атом хлора в положении 4, а Х 2 обозначает атом водорода, соединения формулы II являются ценными промежуточными продуктами при получении 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]-этокси]уксусной кислоты формулы III, а также е фармацевтически приемлемых солей. 2-[2-[4-[(4-Хлорфенил)фенилметил]-1-пиперазинил]-этокси]уксусной кислоты дигидрохлорид, продукт, хорошо известный под международным наименованием цетиризин, описан в патенте Канады 1199918 и был предложен в качестве лекарственного средства для лечения аллергических синдромов, например, хронических и острых аллергических ринитов, аллергического конъюктивита, зуда, крапивницы и т.п. При терапевтическом применении этот продукт 2 оказался не вызывающим побочных эффектов при действии на центральную нервную систему,например, сонливости, ухудшения умственных способностей и т.д. (см. D.P. TASHKIN et al.,Annals of Allergy, Part II, 59, (1987), 49-52, а также F.M. GENGO et al., Annals of Allergy, PartII, 59, (1987), 53-57). В случае, когда R1 обозначает -СООН, a X1 и Х 2 каждый обозначает атом фтора в положении 4, соединение формулы II представляет собой 2-[2-[4-[бис-(4-фторфенил)метил]-1-пиперазинил]-этокси]уксусную кислоту формулы В случае, когда R1 обозначает -CONH2,-CN, -СООМ или -COOR3, M обозначает щелочной металл, R3 обозначает С 1-4 алкил и X1 и Х 2 каждый обозначает атом фтора в положении 4, соединения формулы II являются ценными промежуточными продуктами при получении 2[2-[4-[бис-(4-[фторфенил)метил]-1-пиперазинил]этокси]-уксусной кислоты формулы IV, а также е фармацевтически приемлемых солей. 2-[2-[4-[Бис-(4-фторфенил)метил]-1-пиперазинил]этокси]-уксусной кислоты дигидрохлорид также известен под международным наименованием эфлетиризин. Применение эфлетиризина при лечении ринита или риноконъюктивита аллергического происхождения было предложено в нескольких последних сообщенияхImmunology, reproduced in. Allergy and Clin. Immunol. News, (1994) suppl. No. 2, abstracts 428,1136 and 1864). Эти сообщения свидетельствуют, что интраназальное введение эфлетиризина может оказаться эффективным при терапевтическом лечении ринита или риноконъюктивита аллергического происхождения. В патенте Канады 1199918 на имя заявителя описан синтез 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]уксусной кислоты и е дигидрохлорида. В случае этого процесса исходным соединением является 1-[(4-хлорфенил)фенилметил]пиперазин, который может реагировать с метил-(2-хлорэтокси)ацетатом или 2-(2-хлорэтокси)ацетамидом с образованием соответственно метил 2-[2-[4-[(4-хлорфенил) фенилметил]-1-пиперазинил]этоксиацетата (соединение формулы II при R1 = -СООСН 3, X1 = 3 метиловый эфир, как и этот ацетамид, может быть подвергнут гидролизу неорганическим основанием (гидроокисью калия или натрия) с получением натриевой или калиевой соли, которую легко превратить в цетиризин и его дигидрохлорид. В патенте Канады 1320732, также на имя заявителя, описан альтернативный способ синтеза 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]уксусной кислоты и е дигидрохлорида. Согласно этому патенту 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси] уксусную кислоту и е дигидрохлорид получают способом, который характеризуется тем, что 2-[4-[(4-хлорфенил)-фенилметил]-1-пиперазинил]этанол реагирует с галоидацетатом щелочного металла в присутствии алкоксида щелочного металла и тем, что полученная соль щелочного металла превращается в соответствующую кислоту и, соответственно, в е дигидрохлорид. В патенте Канады 1317300, также на имя Заявителя, предложен другой способ, который дает возможность получить 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси] уксусную кислоту и е дигидрохлорид. Согласно этому патенту 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси] уксусную кислоту и е дигидрохлорид получают способом, характеризующимся тем, что 2-[2[4-[(4-хлорфенил)-фенилметил]-1-пиперазинил] этокси]ацетонитрил (соединение формулы II при R1 = -CN, X1 = -Сl (положение 4) и Х 2 = Н) гидролизуется в водной, спиртовой или водноспиртовой среде при помощи основания или кислоты, и тем, что полученная таким образом кислота превращается, когда это нужно, в дигидрохлорид. 2-[2-[4-[(4-Хлорфенил)фенилметил]-1-пиперазинил]этокси]-ацетонитрил, используемый в качестве исходного соединения, получают взаимодействием 1-[(4-хлорфенил)фенилметил] пиперазина с 2-галоэтоксиацетонитрилом. Реакцию проводят в присутствии акцептора кислоты, например, карбоната щелочного металла и, возможно, в присутствии небольшого количества иодида щелочного металла для ускорения реакции, в инертном органическом растворителе, таком как спирт (например, в нбутаноле), предпочтительно при температуре,близкой к температуре отгонки растворителя. Имея в виду возрастающее терапевтическое значение цетиризина и соединений похожей структуры, Заявитель поставил перед собой цель и исследовал возможность создания нового способа синтеза 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусной кислоты и е фармацевтически приемлемых солей,который даст возможность получить это соединение из известных и/или легко доступных реагентов и который позволит получить это соеди 000831 4 нение с достаточной степенью чистоты и приемлемым с экономической точки зрения выходом. Более того, с целью упрощения способа,Заявитель поставил цель создать способ, который включает меньшее число стадий, чем известные способы. Кроме того, зная о терапевтическом значении других соединений формулы II, таких как,например, эфлетиризин, было бы предпочтительно иметь возможность получать эти другие соединения практически тем же способом. Соответственно необходимо найти предшественников, которые, с одной стороны, могут быть сами получены легко и экономичным способом и, с другой стороны, могут легко превращаться с высокими выходами в соединения формулы II. Заявитель изучил группу соединений, а именно замещенных [2-(1-пиперазинил)этокси] метильных соединений формулыR1 обозначает -CONH2, -CN, -COOH,-СООМ или -СООR3, причем М обозначает щелочной металл и R3 обозначает С 1-4 алкил; иR2 обозначает атом водорода или группу-COR4 или R5, причем R4 выбран из групп -OR6 или R7, в которыхR5 обозначает аллил или алкиларил,R6 обозначает линейный или разветвленный С 1-4 алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, иR7 обозначает галоидалкил. Эти соединения легко могут быть получены взаимодействием пиперазина формулы где R2 обозначает атом водорода или группу COR4 или R5, где R4 выбран из групп -OR6 илиR7, R5 обозначает аллил или алкиларил, R6 обозначает линейный или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и R7 обозначает галоидалкил, с замещенным [2-галоидэтокси]метильным соединением формулы в которой R1 обозначает -CONH2, -CN, -COOH,-СООМ или -СООR3, М обозначает щелочной металл и R3 обозначает алкил, содержащий 1-4 атома углерода и Х обозначает атом галогена. Обычно используют соединение формулы VI,где Х обозначает хлор и иод, но эту реакцию можно проводить с соответствующим бромидом. Отмечено, что когда Х обозначает иод,преимущественно надо работать при сравнительно низких температурах (ниже 40 С) и в течение сравнительно небольшого промежутка времени (например, в течение 2 ч). 5 Эту реакцию обычно осуществляют при нагревании между 30 и 180 С в течение нескольких часов в растворителе, выбранном из алифатических спиртов, алифатических кетонов(например, метилэтилкетона), ароматических углеводородов (например, толуола или ксилола), или в воде в присутствии неорганического основания (например, карбоната натрия). Когда используют большой избыток пиперазина (более трех эквивалентов по отношению к [2 галоидэтокси]метальному соединению), сам пиперазин действует как акцептор кислоты и не имеет значения введение дополнительного акцептора кислоты. Преимущественно также использовать пиперазин и его дигидрохлорид в эквивалентных количествах. В общем для того, чтобы получить замещенные[2-(1-пиперазинил)этокси]метильные соединения по изобретению, предпочтительно по соображениям упрощения использовать пиперазин формулы V, где R2 обозначает водород. Тем не менее может оказаться выгодным защитить одну из аминогрупп пиперазина в процессе этой реакции обычной защитной группой, пригодной для защиты аминогрупп, чтобы пиперазин не реагировал дважды с соединением формулы VI. В качестве защищающей аминную функцию группы можно использовать любую защищающую группу, известную специалистам. Можно выбрать защитную группу, которая после образования соединения формулы I может быть селективно отщеплена согласно уравнению: Среди способов защиты, особенно подходящих в данном случае, можно использовать способы с применением галоидалкил, алкилгалоидарил, алкиларил, алкилнитроарил и алкилгалоидарилкарбаматов, амидов, например, трифторацетамида или же третичных аминов, таких как N-алкиламины и N-алкилариламины. При наличии указанных групп реакция снятия защиты аминных функций пиперазина может осуществляться простым нагревом, каталитическим гидрированием или гидролизом при помощи основания или кислоты в соответствии с хорошо известными методиками. Согласно одному варианту в качестве защитной группы можно также выбрать группу, которая может быть отщеплена в таких условиях, что в случае,когда R1 обозначает -СОNН 2, -CN, -СООН,-СООМ или -СООR3, М обозначает щелочной металл, и R3 обозначает C1-4 алкил, одновременно со снятием защиты аминной функции, группаR1 превращается в СООН и, в случае когда R1 обозначает -СООН, эта группа -СООН остается во время реакции снятия защиты аминной функции. Эта реакция протекает по уравнению: Среди методов защиты, особенно подходящих для этого случая, можно использовать,например, способ с применением алкилкарбаматных групп. В случае таких карбоксилированных групп снять защиту аминной функции пиперазина можно путем нагрева в течение нескольких часов в спиртовой или водной среде в присутствии неорганического основания или любым другим известным специалисту методом. В двух предыдущих уравнениях R1 обозначает -CONH2, -CN, -СООН, -СООМ или-СООR3, причем М обозначает щелочной металл и R3 обозначает С 1-4 алкил; иR2 обозначает атом водорода или группу COR4 или R5, причем R4 выбран из групп -OR6 или R7, в которыхR5 обозначает аллил или алкиларил,R6 обозначает линейный или разветвленный С 1-4 алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и R7 обозначает галоидалкил. Замещенные[2-(1-пиперазинил)этокси] метильные соединения формулы I, полученные таким образом, в основном имеют значение как предшественники для получения соединений формулы II (или соединений формулы III и IV,когда R1 представляет собой СООН), которые могут быть получены с достаточной степенью чистоты, с приемлемым с экономической точки зрения выходом, при меньшем числе стадий процесса и из тех же самых предшественников,что представляет значительное преимущество в отношении упрощения промышленного способа и уменьшения стоимости процесса. Соответственно, данное изобретение относится также к получению соединений формулыII (или соединений формулы III и IV в случае,когда R1 обозначает СООН) взаимодействием соединения формулы I, в которой R2 обозначает водород, с дифенилметилгалогенидом формулы-СООR3, М обозначает щелочной металл и R3 обозначает С 1-4 алкил, и Х обозначает атом галоида, выбранный из хлора, брома и иода,X1 и Х 2 независимо обозначают водород,фтор, хлор или бром. Эту реакцию проводят при взаимодействии дифенилметилгалогенида формулы VII с соединением формулы I, взятых в молярных соотношениях между 4:1 и 1:4 в течение промежутка времени от нескольких минут до нескольких часов при температуре между примерно 60 С и примерно 160 С в инертном растворителе, выбранном из алифатических спиртов,алифатических кетонов (например, метилэтилкетона), ароматических углеводородов (например, толуола или ксилола), алифатических нитрилов (например, ацетонитрила). Можно осуществлять реакцию в присутствии акцептора кислоты, такого как третичное органическое основание (например, триэтиламин) или неорганическое основание (например, карбоната натрия). Эту реакцию также можно проводить в присутствии иодида щелочного металла. Как указано выше, соединения формулы II(где R1 обозначает -СОNН 2, -CN, -СООН,-СООМ или -СООR3, М обозначает щелочной металл, и R3 обозначает С 1-4 алкил, X1 обозначает хлор в положении 4 и Х 2 обозначает водород),уже известны, и их превращение в 2-[2-[4-[(4 хлорфенил)фенилметил]-1-пиперазинил]этокси] уксусную кислоту формулы III уже описано как протекающее в водной или водно-спиртовой среде в присутствии основания или кислоты. Более того, соединение формулы II, в которойR1 обозначает СООН, X1 обозначает хлор в положении 4 и Х 2 обозначает водород, представляет собой 2-[2-[4-[(4-хлорфенил)фенилметил]-1 пиперазинил]этокси]-уксусную кислоту формулы III. Последующее превращение алкил 2-[2-[4[(4-хлорфенил)фенилметил]-1-пиперазинил] этокси]ацетата (соединение формулы II, где R1 =-СООR3, X1 = -Сl в положении 4 и Х 2 = Н) или 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]ацетамида (соединение формулы II,где R1 = -СОNН 2, X1 = -Сl в положении 4 и Х 2 = Н) в 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-уксусную кислоту формулы III описано в патенте Канады 1199918 и конверсия 2-[2-[4-[(4-хлорфенил)фенилметил]-1-пиперазинил]этокси]-ацетонитрила описано в патенте Канады 1317300. Конверсия других соединений формулы II протекает аналогично. Нижеследующие примеры иллюстрируют изобретение, не ограничивая его. В этих примерах температуры плавления определяют методом дифференциальной сканирующей калориметрии (ДСК) при температурном градиенте 20 С/мин. Масс-спектры снима 000831 8 лись на приборе Finnigan MAT TSQ 700. Ядерный магнитный резонанс (ЯМР) изучали при помощи прибора Bruker при 250 МГц в диметилсульфоксиде с использованием в качестве внутреннего стандарта тетраметилсилана. Химические сдвиги указаны в (частей на миллион). Буквы s, d, dd, t, q, b и m обозначают соответственно синглет, дублет, двойной дублет, триплет,квартет, широкий пик и мультиплет. Пример I. Получение замещенного [2-(1 пиперазинил)этокси]метильного соединения формулы I.I.1. Получение соединений формулы I, где(0,5 мол) в 250 мл толуола вводят в круглодонную колбу, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают при температуре флегмы в течение 4 ч. Образовавшийся осадок отфильтровывают,пока он горячий, и выпаривают из фильтрата растворитель при пониженном давлении досуха. Остаток очищают хроматографией на силикагеле (элюент 14/5/1 (об/об/об) смесь дихлорметан/метанол/28% водный раствор аммиака). Получают 7,4 г 2-[2-(1-пиперазинил)этокси]ацетамида в виде желтого масла. Выход: 39%. Масс-спектр: 188 (МН+), 99 (NН(C4 Н 8)N+= СН 2), 44 (CONH2)I.1.1.2 (вариант). 8,6 г (0,1 мол) пиперазина, 15,9 г (0,1 мол) пиперазина дигидрохлорида, 10,8 мл (0,6 мол) воды и 86 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 250 мл,снабженную охлаждаемым водой конденсатором и механической мешалкой. Температуру смеси доводят до 65 С. Затем добавляют одной порцией 13,8 г (0,1 мол) (2-хлорэтокси)ацетамида. Смесь выдерживают при температуре 65 С в течение 16 ч. Дают смеси охладиться до комнатной температуры и затем происходит разделение двух фаз. Нижнюю фазу (масляная фаза, несмешивающаяся с метилэтилкетоном) промывают метилэтилкетоном 225 мл. Это масло собирают в 50 мл этанола и премешивают в течение 15 мин. Образовавшийся осадок (пиперазина дигидрохлорид) отфильтровывают и концентрируют фильтрат при пониженном давлении при 50 С в ротационном испарителе. Получают 27 г желтого масла, которое очищают методом препаративной хроматографии на силикагеле (элюент: 82/15/1/2 (об/об/об/об) смесь дихлорметан/метанол/28 вес.% водного раствора аммиака/вода). Получают 10,7 г 2-[2-(1 пиперазинил)этокси]ацетамида в виде бесцветного масла, которое кристаллизуется. Выход: 57,1%.I.1.2. 2-(1-Пиперазинил)этоксиацетонитрил. 8,6 г (0,1 мол) пиперазина, 15,9 г (0,1 мол) пиперазина дигидрохлорида, 0,6 мл воды и 40 мл этанола вводят в трехгорлую круглодонную колбу объемом 250 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Температуру смеси доводят до температуры 70 С. 11,3 г (0,1 мол) (2-хлорэтокси) ацетонитрила растворяют в 48 мл этанола и добавляют по каплям в течение 15 мин. Смесь выдерживают при 70 С в течение 16 ч. Затем дают смеси охладиться до комнатной температуры и охлаждают на ледяной бане. Образовавшийся осадок отфильтровывают. Фильтрат концентрируют при пониженном давлении в ротационном испарителе и остаток (масло твердое вещество) извлекают 50 мл этанола. Смесь оставляют при перемешивании в течение 15 мин. Образовавшийся осадок (пиперазина дигидрохлорид) отфильтровывают и концентрируют под вакуумом при 50 С фильтрат в ротационном испарителе. Остаток очищают методом препаративной хроматографии на силикагеле (элюент: 94,5/5/0,5(об/об/об) смесь дихлорметана/метанола/28 вес.%) водного раствора аммиака, постепенно вытесняют 89/10/1 (об/об/об) смеси такого же состава). Получают 4,7 г 2-(1-пиперазинил) этоксиацетонирила в виде масла оранжевого цвета. Выход: 27,8%. ЯМР: 2,36 (4 Н, m); 2,47 (2 Н, t, 5,6 Гц); 2,71I.1.3. Метил-2-(1-пиперазинил)этоксиацетат. 8,6 г (0,1 мол) пиперазина, 17,7 г (0,1 мол) пиперазина дигидрохлорида, 10,8 мл (0,6 мол) воды и 40 мл метанола вводят в трехгорлую круглодонную колбу объемом 250 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Температуру смеси доводят до 39 С. 13,8 г (0,1 мол) метилового эфира(2-хлорэтокси)уксусной кислоты растворяют в 17 мл метанола и затем добавляют по каплям в течение 35 мин. Смесь выдерживают при 65 С в течение 48 ч. Смеси дают охладиться до комнатной температуры и осадившиеся соли пиперазина отфильтровывают. Фильтрат концентрируют при пониженном давлении в ротационном испарителе при 50 С. Получают 31,6 г желтого масла, которое очищают методом препаративной хроматографии на силикагеле (элюент: 94,5/5/0,5 (об/об/об) смесь дихлорметан/метанол/28 вес.% водного раствора аммиака, постепенно вытесняют 73,5/25/2,5 (об/об/об) смеси того же состава). Получают 9,83 г метил-2-(1 000831I.1.4. 2-(1-Пиперазинил)этоксиуксусная кислота. 8,6 г (0,1 мол) пиперазина, 17,7 г (0,1 мол) пиперазина дигидрохлорида и 50 мл воды вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Температуру смеси доводят до 70 С. Затем по каплям в течение 15 мин добавляют 15,2 г (2 хлорэтокси)уксусной кислоты. Температуру смеси доводят до 80 С при перемешивании и выдерживают при этой температуре в течение 27 ч. Дают смеси охладиться до комнатной температуры и выпаривают воду при пониженном давлении в ротационном испарителе. Остаток извлекают 50 мл этанола и выдерживают при 50 С при перемешивании в течение 45 мин. Затем его помещают на ледяную баню и перемешивают в течение 1 ч. Образовавшийся осадок(пиперазина дигидрохлорид) затем отфильтровывают и выпаривают при пониженном давлении в ротационном испарителе при 50 С растворитель. Получают 22,4 г желтого масла. 10 г этой смеси очищают на 130 г смолы AmberlyteIRA-400. Элюирование вначале проводят 600 мл воды и затем 0,5 М водным раствором ацетата аммония. Фракции,содержащие 2-(1 пиперазинил)этоксиуксусную кислоту или е соли, соединяются и из них удаляют воду при пониженном давлении при 60 С в ротационном испарителе. Выделяют 18,2 г смеси, содержащей белые кристаллы и масло. Эту смесь извлекают 75 мл изопропанола и отфильтровывают нерастворимые кристаллы. Фильтрат подкисляют 20 мл 9N раствора соляной кислоты в этаноле. Образовавшийся осадок быстро отфильтровывают, промывают изопропанолом и сушат в ротационном испарителе при пониженном давлении при 50 С. Получают 7,1 г белого твердого вещества, которое очищают сублимацией хлорида аммония (4 ч при 135 С, давление 0,1 мбар и затем 8 ч при 150 С при давлении 0,1 мбар). Получают 1,4 г 2-(1-пиперазинил)этоксиуксусной кислоты дигидрохлорида. Выход: 12%. ЯМР: 2,36 (2 Н, t, 4,8 Гц); 3,45 (4 Н, m); 3,53I.2 Получение соединений формулы I, гдеI.2.1.1. 8,8 г (0,05 мол) 1-бензилпиперазина, 7,6 г (0,055 мол) (2-хлорэтокси)ацетамида,11,7 г (0,11 мол) карбоната натрия, 0,050 г иодида калия и 44 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают до температуры флегмы и выдерживают при этой температуре в течение 20 ч. Смеси дают охладиться до комнатной температуры и добавляют 50 мл воды. Затем при пониженном давлении в ротационном испарителе удаляют метилэтилкетон. Затем экстрагируют водную фазу дихлорметаном 250 мл. Органические фазы соединяют и промывают 25 мл насыщенного раствора хлорида аммония. Раствор сушат над сульфатом натрия и затем фильтруют и концентрируют при пониженном давлении в ротационном испарителе. Получают 14,15 г коричневого масла, которое кристаллизуется, это масло очищают методом препаративной хроматографии на силикагеле (элюент: 97/3/0,3 (об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака). Получают 11,5 г желтого твердого вещества. Выход: 82,9%. После перекристаллизации из этилацетата получают белый твердый 2-(4-бензил-1 пиперазинил)этоксиацетамид. Выход после перекристаллизации: 81,5%. ЯМР: 2,40 (8 Н, т); 2,47 (2 Н, t, 5,58 Гц); 3,44(0,055 мол) (2-иодэтокси)ацетамида, 11,7 г (0,11 мол) карбоната натрия и 44 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь доводят до температуры флегмы и выдерживают при этой температуре в течение 4 ч. Дают смеси охладиться до комнатной температуры и добавляют 75 мл воды. Затем при пониженном давлении в ротационном испарителе удаляют метилэтилкетон. Водную фазу экстрагируют 75 мл и затем 50 мл дихлорметана. Органические фазы соединяют и сушат над сульфатом натрия и затем фильтруют и концентрируют при пониженном давлении в ротационном испарителе. Получают 14,5 г масла оранжевого 12 цвета, которое кристаллизуется и этот продукт очищают методом препаративной хроматографии на силикагеле (элюент: 95,6/4/0,4 (об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака и затем 93,6/6/0,4 (об/об/об) смеси того же состава). Получают 12,7 г (91,6%) желтого твердого вещества. После перекристаллизации из этилацетата получают 2-(4-бензил-1-пиперазинил)этоксиацетамид в виде твердого вещества белого цвета(0,055 мол) (2-хлорэтокси)ацетонитрила, 11,5 г 0,11 мол) карбоната натрия, 0,5 г иодида калия и 50 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Температуру смеси доводят до 80 С и выдерживают е при этой температуре 24 ч. Затем дают смеси охладиться до комнатной температуры и разбавляют 50 мл воды, затем при пониженном давлении в ротационном испарителе удаляют метилэтилкетон. Водную фазу экстрагируют 250 мл дихлорметана, органические фазы соединяют. Высушивают органическую фазу над сульфатом натрия и затем отфильтровывают. Фильтрат концентрируют при пониженном давлении в ротационном испарителе. Получают 14,6 г масла коричневого цвета, которое очищают методом препаративной хроматографии на силикагеле (элюент: 97,8/2/0,2(об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака). Получают 8,4 г (64,9%) 2-(4-бензил-1-пиперазинил)этоксиацетонитрила в виде масла оранжевого цвета. ЯМР: в дейтерированном хлороформе, : 2,40 (8 Н, m); 2,50 (2 Н, t, 5,68 Гц); 3,44 (2 Н, s); 3,61 (2 Н, t, 5,67 Гц); 4,44 (2 Н, s); 7,28 (5 Н, m). Масс-спектр: 259 (М+).(2,2 экв) карбоната натрия, 0,4 г иодида калия и 100 мл толуола вводят в трехгорлую круглодонную колбу объемом 250 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают при 100 С в течение 36 ч. Затем смеси дают охладиться до комнатной температуры, добавляют 100 мл воды и отделяют органическую фазу при осаждении. Затем промывают органическую фазу 100 мл воды и 100 мл насыщенного раствора хлористого натрия. Сушат над сульфатом натрия, фильтруют и концентрируют в ротационном испарителе при пониженном давлении. Получают 18,8 г коричневого масла, которое очищают методом 13 препаративной хроматографии на силикагеле(элюент: 98,9/1/0,1 (об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака, которая постепенно замещается 91,2/8/0,8(об/об/об) смесью того же состава). Получают 10,8 г метил-2-(4-бензил-1-пиперазинил)этоксиацетата в виде масла оранжевого цвета. Выход: 65%. ЯМР: 2,38 (8 Н, m); 2,47 (2 Н, t, 5,87 Гц); 3,44 (2 Н, s); 3,56 (2 Н, t, 5,84 Гц); 3,64 (3 Н, s); 4,09 (2 Н, s); 7,28 (5 Н, m). Масс-спектр: 292 (М+).I.3. Получение соединений формулы I, гдеI.3.1. Бензил-4-(2-карбамоилметоксиэтил)пиперазин-1-карбоксилат. 6,6 г (0,03 мол) бензилпиперазин-1-карбоксилата, 7,6 г (0,033 мол) (2-иодэтокси)ацетамида, 7 г (0,066 мол) карбоната натрия и 33 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают до температуры флегмы и выдерживают при этой температуре 5 ч. Смеси дают охладиться до комнатной температуры, затем добавляют 75 мл воды и в ротационном испарителе при пониженном давлении удаляют метилэтилкетон. Водную фазу экстрагируют дихлорметаном 75 мл и затем 50 мл дихлорметана и соединяют органические фазы. Их сушат над сульфатом натрия, фильтруют и фильтрат концентрируют при пониженном давлении в ротационном испарителе. Получают 9,4 г твердого вещества бежевого цвета,которое очищают методом препаративной хроматографии на силикагеле (элюент: 95,4/4/0,4(79,9%) твердого вещества белого цвета, 7,5 г которого перекристализовывают из 34 мл ацетона. Выделяют 6,6 г бензил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилата в виде белых кристаллов (выход после перекристаллизации 88%). ЯМР: 2,41 (4 Н, m); 2,51 (2 Н, t); 3,39 (4 Н,m); 3,56 (2 Н, t, 5,48 Гц); 3,79 (2 Н, s); 5,08 (2 Н, s); 7,15 (1 Н, s el.); 7,31-7,22 (5H, m); 7,35 (6 Н, m). Масс-спектр: 321 (М+). ДСК: Начало 115,09 С, макс. 125,46 С. Элементный анализ: Атом С НI.3.2. Бензил-4-(2-цианметоксиэтил)-пиперазин-1-карбоксилат. 6,4 г (0,29 мол) бензилпиперазин-1-карбоксилата, 3,8 г (0,0319 мол) (2-хлорэтокси)ацетонитрила, 6,8 г (0,0638 мол) карбоната натрия,20 мг иодида калия и 32 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой 14 конденсатором и механической мешалкой. Эту смесь выдерживают при температуре флегмы(0,0145 мол) (2-хлорэтокси)ацетонитрила и эту смесь выдерживают при температуре флегмы еще 24 ч. Затем дают смеси охладиться до комнатной температуры, добавляют 75 мл воды и удаляют при пониженном давлении в ротационном испарителе метилэтилкетон. Водную фазу обрабатывают дихлорметаном 75 мл и затем 50 мл дихлорметана. Органические фазы соединяют и сушат над сульфатом натрия. Смесь фильтруют и концентрируют фильтрат в ротационном испарителе при пониженном давлении. Получают 10,5 г темно-коричневой жидкости,которую очищают методом препаративной хроматографии на силикагеле (элюент: 99/1/0,1(об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака, постепенно вытесняемая 98/2/0,1 (об/об/об) смесью тех же компонентов). Получают 7,3 г (83%) бензил-4-(2 цианметоксиэтил)-пиперазин-1-карбоксилата в виде жидкости желтого цвета. ЯМР: 2,39 (4 Н, m); 2,54 (2 Н, t, 5,5 Гц); 3,39I.4. Получение соединений формулы I, гдеI.4.1. Трет.бутил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилат. 5,6 г (0,03 мол) трет.бутилпиперазин-1 карбоксилата, 7,6 г (0,033 мол) (2-иодэтокси) ацетамида, 7 г (0,066 мол) карбоната натрия и 28 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 100 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь выдерживают при температуре флегмы в течение 2 ч. Дают смеси охладиться до комнатной температуры, добавляют 75 мл воды и удаляют метилэтилкетон при пониженном давлении в ротационном испарителе. Водную фазу обрабатывают 2 50 мл дихлорметана. Органические фазы соединяют,промывают 40 мл насыщенного водного раствора хлористого аммония, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении в ротационном испарителе. Получают 9,7 г бледно-желтой жидкости, которую очищают методом препаративной хроматографии на силикагеле(90,5%) белого твердого вещества, 7,7 г которого перекристализовывают из 15,4 мл ацетона. Получают 6,35 г трет.бутил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилата в виде кристаллов белого цвета (выход после перекристаллизации 82,5%). ЯМР: 1,39 (9H, s); 2,38 (4 Н, m); 2,49 (2 Н, t); 3,49 (4 Н, m); 3,55 (2 Н, t, 5,5 Гц); 3,75 (2 Н, s); 7,14 (1 Н, bs); 7,38 (1H, bs).I.4.2. Трет.бутил-4-(2-цианметоксиэтил)пиперазин-1-карбоксилат. 20 г (0,107 мол) бензилпиперазин-1 карбоксилата, 14,12 г (0,117 мол) (2-хлорэтокси) ацетонитрила, 25,04 г (0,235 мол) карбоната натрия, 0,075 г иодида калия и 100 мл метилэтилкетона вводят в трехгорлую круглодонную колбу объемом 250 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают до температуры флегмы и выдерживают 78 ч. Смеси дают охладиться до 50 С и отфильтровывают соли. Остаток отбирают в 150 мл воды и обрабатывают 200 и затем 100 мл дихлорметана. Органические фазы соединяют, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении в ротационном испарителе. Получают 30,5 г масла коричневого цвета, которое очищают методом препаративной хроматографии на силикагеле (элюент: 98,9/1/0,1 (об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака, постепенно вытесняемая 97,8/2/0,2 (об/об/об) смесью тех же компонентов). Получают 25,8 г трет.бутил-4-(2 цианметоксиэтил)-пиперазин-1-карбоксилата в виде желтого масла. Выход: 89,2%. ЯМР в дейтерированном хлороформе: 1,44I.4.3. Трет. бутил-4-(2-метоксикарбонилметоксиэтил)-пиперазин-1-карбоксилат. 7,06 г (0,0379 мол) бензилпиперазин-1 карбоксилата, 6,35 г (0,0417 мол) метил-(2 хлорэтокси)ацетата, 8,83 г (0,083 мол) карбоната натрия, 0,025 г иодида калия и 80 мл толуола вводят в трехгорлую круглодонную колбу объемом 250 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают до температуры флегмы и выдерживают 78 ч. Смеси дают охладиться до комнатной температуры и отфильтровывают соли. Фильтрат промывают 250 мл воды. Водную фазу обрабатывают 50 мл дихлорметана. Органические фазы соединяют и сушат над сульфатом натрия. Смесь фильтруют и концентрируют при пониженном давлении в ротационном испарителе фильтрат. Получают 12,72 г масла коричневого цвета, которое очищают методом препаративной хроматографии на силикагеле (элюент:98,9/1/0,1 (об/об/об) смеси дихлорметан/метанол/28% водный раствор аммиака и 97,2/2/0,2 (об/об/об) смесь тех же компонентов). Получают 7,2 г трет.бутил-4-(2 000831 16 метоксикарбонилметоксиэтил)-пиперазин-1 карбоксилата в виде масла желтого цвета. Выход: 62,8%. ЯМР (в дейтерированном хлороформе): 1,45 (9 Н, s); 2,45 (4 Н, m); 2,63 (2 Н, t, 5,6 Гц); 3,43 (4 Н, m); 3,68 (2 Н, t, 5,6 Гц); 3,74 (ЗН, s); 4,10 (2 Н, s). Масс-спектр: 302 (M+).I.5. Получение соединений формулы I, гдеI.5.1.1. 164 г (1,04 мол) этилпиперазин-1 карбоксилата, 156,9 г (1,14 мол) (2-хлорэтокси) ацетамида, 241,7 г (2,28 мол) карбоната натрия,1 г иодида калия и 200 мл толуола вводят в трехгорлую круглодонную колбу объемом 2 л,снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают до температуры флегмы и выдерживают 3 ч 30 мин. Дают смеси охладиться до 50 С и добавляют 200 мл изопропанола. Реакционную смесь фильтруют и осадок промывают 150 мл изопропанола. Фильтрат концентрируют при пониженном давлении в ротационном испарителе. Получают 277,2 г технического продукта,который перекристализовывают из 500 мл этилацетата. Получают 219,2 г (81,6%) этил-4-(2 карбамоилметоксиэтил)-пиперазин-1-карбоксилата в виде твердого вещества белого цвета. ЯМР: 1,24 (ЗН, t, 7,05 Гц); 2,46 (4 Н, m); 2,57 (2 Н, t, 5,2 Гц); 3,44 (4 Н, m); 3,62 (2 Н, t, 5,2 Гц); 3,95 (2 Н, s); 4,1 (2 Н, 9, 7,1 Гц); 5,72 (1 Н, bs); 7,34 (1H, bs). Масс-спектр: 260 (МН+). ДСК: Начало 106,5 С, макс. 109,7 С. Элементный анализ: Атом С Н(0,1 мол), 23,3 г карбоната натрия (0,22 мол) и 1,0 г иодида калия в 25 мл толуола вводят в трехгорлую круглодонную колбу, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь нагревают при температуре флегмы в течение 4 ч и дают охладиться до комнатной температуры. Реакция продолжается, все еще при перемешивании, в течение 16 ч. Добавляют 100 мл изопропанола и отфильтровывают твердые вещества. Растворитель выпаривают из фильтрата досуха при пониженном давлении. Продукт, полученный после испарения растворителей, перекристализовывается из толуола. Получают 21,35 г этил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилата. Выход: 82%. 17 Масс-спектр: 260 (МН+), 214 (М+-ОЕt). 1.5.2. 2-(4-карбоксиэтил-1-пиперазинил)-1 этоксиацетат калия. 200 г (0,77 мол) этил-4-(2 карбамоилметоксиэтил)-пиперазин-1-карбоксилата, полученного в примере I.5.1., 216,4 г (3,86 мол) гидроокиси калия и 800 мл этанола вводят в трехгорлую круглодонную колбу объемом 2 л,снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь доводят до температуры флегмы и выдерживают 24 ч. Дают смеси охладиться до комнатной температуры и отфильтровывают соли. Фильтрат концентрируют при пониженном давлении в ротационном испарителе и масло извлекают 300 мл изопропанола. Соли отфильтровывают на дикалите и раствор вновь концентрируют при пониженном давлении в ротационном испарителе. Масло извлекают 1,25 л этилацетата при перемешивании. Появляется осадок. Смесь охлаждают на ледяной бане в течение 2 ч и затем отфильтровывают. Твердое вещество белого цвета сушат в печке. Получают 231,8 г продукта, содержащего неорганические соли. Пример II. Снятие защиты у замещенных[2-(1-пиперазинил)этокси]метильных соединений формулы I, где R2 не является атомом водорода.II.2.1. 13,9 г (0,05 мол) 2-(4-бензил-1 пиперазинил)-этоксиацетамида, полученного в примере I.2.1. и 139 мл этанола вводят в трехгорлую круглодонную колбу объемом 250 мл,снабженную охлаждаемым водой конденсатором и механической мешалкой. Затем добавляют 1,4 г палладия на угле (10% по весу) и 15,8 г формиата аммония. Смесь нагревают при 30 С в течение 30 мин и затем при 40 С в течение 1 ч и при 60 С в течение 30 мин. Дают смеси охладиться до 40 С и фильтруют через диатомовую землю (дикалит). Палладий промывают этанолом. Фильтрат концентрируют при пониженном давлении в ротационном испарителе. Получают 9,5 г (100%) 2-(-1-пиперазинил)этоксиацетамида в виде кристаллизующегося бесцветного масла. Результаты анализов совпадают с данными, полученными для соединения, полученного в Примере I.1.1.II.3. Из соединений формулы I, где R = СООСН 2-С 6 Н 5.II.3.1. 2-(-1-Пиперазинил)этоксиацетамид. 6,45 г (0,02 мол) бензил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилата, полученного в примере I.3.1., 0,654 г палладия на угле и 65 мл этанола вводят в трубку Парра. Смесь перемешивают при комнатной температуре под давлением 310,26 кПа в течение 4 ч. Е подвергают фильтрованию через дикалит, промывают этанолом и концентрируют при пониженном давлении в ротационном испарителе. Выделяют 3,75 г (100%) 2-(-1-пиперазинил) этоксиацетамида в виде кристаллизующегося бесцветного масла. 18 Результаты анализов совпадают с данными, полученными для соединения, полученного в примере I.1.1.II.4. Из соединений формулы I, где R = СООтрет.Вu.II.4.1. 2-(-1-Пиперазинил)этоксиацетамид. 1,4 г (0,005 мол) трет.бутил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилата,полученного в примере I.4.1., и 14 мл 3 М раствора соляной кислоты в этилацетате вводят в трехгорлую круглодонную колбу объемом 50 мл, снабженную охлаждаемым водой конденсатором и механической мешалкой. Смесь перемешивают при комнатной температуре в течение 2 ч. Осадок отфильтровывают и промывают этилацетатом. Получают 1,3 г (100%) 2-(-1 пиперазинил)-этоксиацетамида дигидрохлорида. ЯМР: 3,4 (2 Н, t, 4,7 Гц); 3,49-3,66 (8 Н, m); 3,81 (2 Н, t, 4,7 Гц); 3,87 (2 Н, s); 6,2 (5 Н, обмениваемые, bm); 7,2-7,7; 10,2. Масс-спектр: 188 (МН+).II.4.2. 2-(-1-Пиперазинил)этоксиацетонитрил. 2,7 г (0,010 мол) трет.бутил-4-(2-цианметоксиэтил)-пиперазин-1-карбоксилата, полученного в примере I.4.2, растворяют в 70 мл дихлорметана в трехгорлой круглодонной колбе объемом 250 мл, снабженной охлаждаемым водой конденсатором и механической мешалкой. В течение 30 мин добавляют 1,7 мл (1,2 экв) триметилсилилиодида, растворенного в 15 мл дихлорметана. В конце добавления наблюдается образование осадка. В реакционную смесь добавляют 15 мл дихлорметана. После выдержки в течение 20 мин при комнатной температуре добавляют 1 мл триметилсилилиодида, растворенного в 10 мл дихлорметана в течение 10 мин. Смесь перемешивают при комнатной температуре еще 1 ч и оставляют стоять 16 ч при комнатной температуре. Затем добавляют 20 мл метанола и перемешивают смесь 10 мин. Растворитель выпаривают при пониженном давлении в ротационном испарителе при 50 С с получением 3,5 г коричневого твердого остатка,который извлекают 40 мл дихлорметана. Смесь перемешивают 10 мин при 35 С. Образовавшийся осадок отфильтровывают, промывают 2 5 мл дихлорметана и сушат. Получают 1,6 г(94,6%) 2-(-1-пиперазинил)этоксиацетонитрила дигидроиодида в виде твердого вещества желтого цвета. ЯМР: 3,88 (10 Н, т); 3,87 (2 Н, t, 4,9 Гц); 4,57 Метил-2-(-1-пиперазинил)этокси 19 2 г (0,0066 мол) трет.бутил-4-(2 метоксикарбонилметоксиэтил)-плиперазин-1 карбоксилата, полученного в примере I.4.3, растворяют в 5 мл этилацетата в трехгорлой круглодонной колбе объемом 50 мл, снабженной охлаждаемым водой конденсатором и механической мешалкой. При перемешивании одной порцией добавляют 20 мл 3 М раствора соляной кислоты в этилацетате. Смесь перемешивают при комнатной температуре 30 мин. Затем добавляют 5 мл 3 М раствора соляной кислоты в этилацетате и перемешивание продолжают в течение 30 мин. Осадок отфильтровывают и промывают 25 мл этилацетата. Получают 1,68 г(92%) метил-2-(-1-пиперазинил)-этоксиацетата дигидрохлорида в виде твердого вещества белого цвета. ЯМР: 3,4 (2 Н, t, 4,8 Гц); 3,47-3,65 (8 Н, m); 3,67 (ЗН, s); 3,92 (2 Н, t, 4,8 Гц); 4,21 (2 Н, s); 10,1II.4.4. Этил-2-(-1-пиперазинил)этоксиацетат. 2 г (0,0066 мол) трет.бутил-4-(2-метоксикарбонилметоксиэтил)-пиперазин-1-карбоксилата, полученного в примере I.4.3, растворяют в 10 мл этанола в трехгорлой крутлодонной колбе объемом 50 мл, снабженной охлаждаемым водой конденсатором и механической мешалкой. При перемешивании одной порцией добавляют 11 мл 3,8 М раствора соляной кислоты в этаноле. Смесь перемешивают 30 мин при комнатной температуре и затем добавляют 11 мл 3,8 М раствора соляной кислоты в этаноле. Смесь доводят до температуры флегмы и выдерживают 4 ч. Растворитель удаляют при пониженном давлении в ротационном испарителе. Получают 1,86 г(97,3%) этил-2-(-1-пиперазинил)этоксиацетата дигидрохлорида в виде кристаллизующегося масла бледно-желтого цвета. ЯМР: 1,21 (3 Н, t, 7,1 Гц); 3,37 (2 Н, t, 4,8 Гц); 3,46 (4 Н, m); 3,55 (4 Н, m); 3,91 (2 Н, t, 4,8 Гц); 4,14 (2 Н, q, 7,1 Гц); 4,18 (2 Н, s); 10,1 (1 Н,bs); 12 (1H, bs). Масс-спектр: 216 (М+).II.5. Из соединений формулы I, где R =II.5.1. 2-(-1-Пиперазинил)этоксиуксусная кислота. 20 г (0,077 мол) этил-4-(2-карбамоилметоксиэтил)-пиперазин-1-карбоксилата, полученного в примере I.2. суспендируют в смеси 20 мл водного раствора, содержащего 37 вес.% соляной кислоты и 20 мл воды, в круглодонной колбе, снабженной механической мешалкой и водоохлаждаемым конденсатором и температуру смеси при перемешивании доводят до 50 С. Смесь оставляют реагировать при этой температуре в течение 5 ч. Реакционную смесь охлаждают до 0 С и доводят рН смеси до 6, используя 50%-ный водный раствор гидроокиси натрия. Воду испаряют из реакционной смеси сначала 20 просто при пониженном давлении и затем, вс еще при пониженном давлении, после добавления толуола. Затем толуол испаряют в ротационном испарителе и остаток извлекают 100 мл изопропанола. Образовавшиеся соли отфильтровывают и подкисляют фильтрат добавлением 28 мл 6N водного раствора соляной кислоты. Из смеси выпаривают воду, сначала просто при пониженном давлении и затем, вс еще при пониженном давлении, после добавления 50 мл толуола. Затем выпаривают толуол в ротационном испарителе и остаток извлекают 50 мл ацетона. Образовавшиеся белые кристаллы отфильтровывают и выпаривают из фильтрата при пониженном давлении ацетон. Получают масло,которое используют без очистки на следующей стадии. Полученное таким образом масло растворяют в 75 мл 5,5N раствора гидроокиси калия в этаноле и смесь выдерживают в течение 28 ч при температуре флегмы. Добавляют 10 мл воды и выпаривают при пониженном давлении этанол, после чего рН смеси доводят до 7 при помощи 36 мл 6N водного раствора соляной кислоты. После удаления выпариванием при пониженном давлении воды остаток извлекают изопропанолом и отфильтровывают твердые вещества. Из фильтрата выпаривают растворитель и полученный масляный остаток растворяют в 30 мл 6N водного раствора соляной кислоты. Воду удаляют выпариванием при пониженном давлении и твердое вещество извлекают 100 мл толуола. Смесь фильтруют и промывают толуолом. Получают 9,4 г 2-(1-пиперазинил)этоксиуксусной кислоты дигидрохлорида. Выход 65%. Масс-спектр: 189 (MH+), 171 (М-ОН), 99III.1.А. 13,9 г (0,05 мол) 2-(4-бензил-1 пиперазинил)-этоксиацетамида растворяют в 15 мл воды в трехгорлой круглодонной колбе объемом 100 мл, снабженной водоохлаждаемым конденсатором и механической мешалкой. Добавляют 31 мл (0,375 мол) водного раствора 37% соляной кислоты. Воду удаляют в ротационном испарителе при пониженном давлении при 60 С. Полученное белое твердое вещество извлекают 75 мл ацетона и перемешивают 1 ч при комнатной температуре. Смесь фильтруют и получают 19,7 г 2-(4-бензил-1-пиперазинил)этоксиуксусной кислоты дигидрохлорида в виде белых кристаллов. Очистка: 1) Перекристаллизация: 5 г белых кристаллов растворяют при повышенной температуре в 55 мл 9/1 (об/об) смеси изопропанол/вода. Вы 21 деляют 2 г 2-(4-бензил-1-пиперазинил)этоксиуксусного продукта, т.е. выход 44,8%. 2) Возгонка: 2 г измельченных белых кристаллов помещают в сублиматор Bbchi. Устройство подключают к вакууму (0,2 мм Hg) и нагревают при 150 С в течение 11 ч. Выделяют 1,65 г чистого 2-(4-бензил-1-пиперазинил)этоксиуксусного продукта, т.е. выход 92,8%. ЯМР: 3,39 (6 Н, m); 3,65 (4 Н, m); 3,88 (2 Н, t,4,6 Гц); 4,09 (2 Н, s); 4,34 (2 Н, s, d); 7, 44 (3 Н, m); 7,64 (2 Н, m). Масс-спектр: 278 (M+). Получение свободного основания: 5 г белых кристаллов растворяют в 25 мл воды. рН раствора доводят до 7 добавлением 25 мл водного раствора 1N раствора гидроокиси натрия. Воду удаляют в ротационном испарителе при пониженном давлении при 60 С и остаток извлекают изопропанолом. Смесь перемешивают в ротационном испарителе под вакуумом при 50 С в течение 2 ч. Соли отфильтровывают и концентрируют фильтрат в ротационном испарителе под вакуумом при 50 С. Получают 4 г оранжевого масла. Это масло извлекают 40 мл ацетона и раствор перемешивают при 50 С. Соли отфильтровывают и после концентрирования фильтрата получают 3,4 г (96,3%) 2-(4-бензил-1 пиперазинил)-этоксиуксусной кислоты в виде коричневого масла. ЯМР: 2,51 (4 Н, m); 2,78 (6 Н, m); 3,54 (2 Н,s); 3,66 (2 Н, t, 5,4 Гц); 3,92 (2 Н, s); 7,28 (5 Н, m). Масс-спектр: 279 (МН+). ДСК: Начало 234,05 С, макс. 237,7 С. Элементный анализ: Атом С НIII.1.B. 2-(1-Пиперазинил)-этоксиуксусная кислота. 2 г (0,0057 мол) 2-(4-бензил-1-пиперазинил)-этоксиуксусной кислоты дигидрохлорида, 0,2 г палладия на угле и 50 мл 8/2 (об/об) раствора этанол/вода помещают в трубку Parr'a. Смесь перемешивают при комнатной температуре и под давлением 310,26 кПа в течение 5 ч. Смесь фильтруют через дикалит, промывают 25 мл раствора этанол/вода 8/2 (об/об) и концентрируют фильтрат в ротационном испарителе при пониженном давлении. Выделяют 1,6 г твердого вещества, окрашенного в оранжевый цвет. Это вещество извлекают 10 мл этанола и перемешивают в течение 1 ч. После фильтрации и сушки выделяют 1,2 г 2-(1-пиперазинил)этоксиуксусной кислоты дигидрохлорида в виде желтых кристаллов (80,6%). Результаты анализов соответствуют данным, полученным для соединения, полученного в примере I.1.4. 22 мл воды помещают в коническую колбу объемом 10 мл. Добавляют 2 мл 37%-ного раствора соляной кислоты и нагревают смесь на масляной бане при 60 С в течение 1 ч. Воду удаляют при пониженном давлении в ротационном испарителе. Остаток извлекают толуолом. После выпаривания получают 1,1 г бледно-желтого твердого вещества. Это мелкоизмельченное вещество помещают в сублиматор Bbchi. Устройство присоединяют к вакууму (0,3 мм Hg) и нагревают при 150 С в течение 8 ч. Получают 800 мг (88%) 2-(1-пиперазинил)-этоксиуксусной кислоты дигидрохлорида в виде белых кристаллов. Данные анализов соответствуют данным,полученным для соединения, полученного в примере I.1.4. Пример IV. Получение соединений формулы II.IV.1.1. 2-[(4-[(4-Хлорфенил)фенилметил)1-пиперазинил]этоксиацетамид. 2,4 г (0,01 мол) (4-хлорфенил)фенилметанхлорида, 4,1 г (0,022 мол) 2-(1-пиперазинил) этоксиацетамида, полученного в примере I.1.1. и 10 мл ацетонитрила помещают в трехгорлую круглодонную колбу объемом 100 мл, снабженную водоохлаждаемым конденсатором и механической мешалкой. Смесь выдерживают при температуре флегмы в течение 3 ч. Смеси дают охладиться до комнатной температуры и концентрируют при пониженном давлении в ротационном испарителе. Остаток извлекают 25 мл воды. рН раствора доводят до 14 1N растворомNaOH. Затем смесь обрабатывают 225 мл дихлорметана. Органические фазы соединяют,промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении в ротационном испарителе при 50 С. Получают 4,1 г коричневого масла, которое очищают методом препаративной хроматографии на силикагеле (элюент: 98/2/0,2 (об/об/об) смесь дихлорметан/метанол/28% водный раствор аммиака, затем 97/3 (об/об) смесь дихлорметан/метанол). Получают 3,2 г (82,5%) 2-[(4-[(4 хлорфенил)фенилметил)-1-пиперазинил]этокси]-ацетамида в виде кристаллизующегося бесцветного масла.IV.1.2. 2-[2-[(4-[(4-Хлорфенил)фенилметил]-1-пиперазинил]этокси]уксусная кислота. 5,9 г (0,025 мол) (4-хлорфенил)фенилметанхлорида, 11,3 г (0,05 мол) 2-(1-пиперазинил) этоксиацетата калия и 50 мл ацетонитрила вводят в трехгорлую круглодонную колбу объемом 50 мл, снабженную водоохлаждаемым конденсатором и механической мешалкой. Смесь выдерживают при температуре флегмы в течение 16 ч. Смеси дают охладиться до комнатной температуры, отделяют ацетонитрил после отстаивания и коричневый остаток извлекают 50 мл воды. Водную фазу и ацетонитрильную фазу 23 соединяют и концентрируют в ротационном испарителе при пониженном давлении. Остаток(коричневое твердое вещество) извлекают 50 мл воды и доводят рН раствора до 4-5 8 мл 6N водного раствора соляной кислоты. Затем смесь обрабатывают 250 мл дихлорметана. Органические фазы соединяют, сушат над сульфатом натрия, фильтруют и концентрируют при 50 С под вакуумом. Получают 9,5 г коричневого масла. Это масло растворяют в 100 мл ацетона. Добавляют 2 г Norit и перемешивают смесь 15 мин при 50 С. После фильтрации получают раствор оранжевого цвета. Добавляют 4,6 мл концентрированной (37%) НС 1. Ацетон выпаривают в ротационном испарителе при пониженном давлении и коричневый маслянистый остаток извлекают 100 мл ацетона. Наблюдается образование осадка. Суспензию перемешивают 30 мин при 50 С и затем 2 ч при комнатной температуре. После фильтрации и сушки при 50 С получают 5,6 г (48,5%) 2-[(2-[(4-хлорфенил)фенилметил)-1-пиперазинил]этокси]уксусной кислоты в виде твердого вещества белого цвета.IV.2.1. (2-[4-[Бис(4-фторфенил)метил]-1 пиперазинил]этокси)ацетамид. 2,43 г (0,0102 мол) бис(4-хлорфенил) метанхлорида, 3,84 г (0,022 мол) 2-(1 пиперазинил)этоксиацетамида и 10 мл ацетонитрила вводят в трехгорлую круглодонную колбу объемом 50 мл, снабженную водоохлаждаемым конденсатором и магнитной мешалкой. Смесь выдерживают при температуре флегмы 3 ч. Смеси дают охладиться до комнатной температуры. Концентрируют смесь под вакуумом и остаток извлекают 100 мл воды и 100 мл дихлорметана. рН водной фазы доводят до 14 1N раствором NaOH. Органическую фазу отделяют после отстаивания и затем осуществляют повторную экстракцию 50 мл дихлорметана. Соединяют органические фазы, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют при 50 С в ротационном испарителе. Получают 4,02 г желтого масла, которое очищают методом препаративной хроматографии на силикагеле(элюент: 98,9/1/0,1 (об/об/об) смесь дихлорметан/метанол/28% водный раствор аммиака, постепенно вытесняемая 95,6/4/0,4 (об/об/об) смесью тех же компонентов). Получают 2,5 г(63,1%) (2-[4-[бис(4-фторфенил)метил)-1-пиперазинил]этоксиацетамида в виде масла оранжевого цвета.IV.2.2. (2-[4-[Бис(4-фторфенил)метил]-1 пиперазинил]этокси]уксусная кислота. 6 г (0,025 мол) бис(4-фторфенил)метанхлорида, 17 г (0,075 мол) 2-(1-пиперазинил) этоксиацетата калия и 100 мл ацетонитрила помещают в трехгорлую круглодонную колбу объемом 250 мл, снабженную водоохлаждаемым конденсатором и механической мешалкой. Смесь выдерживают при температуре флегмы 24 10 ч и затем дают охладиться до комнатной температуры. Концентрируют смесь при пониженном давлении в ротационном испарителе и извлекают осадок 100 мл воды. Водную фазу и ацетонитрильную фазу соединяют и концентрируют в ротационном испарителе при пониженном давлении. Остаток (коричневое твердое вещество) извлекают 50 мл воды и доводят рН водной фазы до 4-5 5 мл 6N водного раствора НСl. Смесь обрабатывают 250 мл дихлорметана. Органические фазы соединяют и концентрируют под вакуумом при 50 С. Полученное масло извлекают 50 мл ацетона и перемешивают 30 мин при комнатной температуре. Нерастворимую часть отфильтровывают, фильтрат концентрируют при пониженном давлении в ротационном испарителе. Получают 8,5 г коричневого масла, которое очищают методом препаративной хроматографии на силикагеле (элюент: 89/10/1 (об/об/об) смесь дихлорметан/метанол/ 28% водный раствор аммиака, вытесняемая постепенно 78/20/2 (об/об/об) смесью тех же компонентов). Получают 3,4 г (34,8%) 2-[4-[бис(4 фторфенил)метил)-1-пиперазинил]этокси]уксусной кислоты в виде бесцветного масла.IV.3.1. (2-[4-[Бис(4-фторфенил)метил)-1 пиперазинил]этоксиацетамид. 2,85 г (0,01 мол) (4-хлорфенил)фенилметанбромида, 4,1 г (0,022 мол) 2-(1-пиперазинил) этоксиацетамида и 10 мл ацетонитрила помещают в трехгорлую круглодонную колбу объемом 50 мл, снабженную водоохлаждаемым конденсатором и магнитной мешалкой. Смесь выдерживают 2 ч при температуре флегмы. Смеси дают охладиться до комнатной температуры. Концентрируют смесь при пониженном давлении в ротационном испарителе и остаток извлекают 25 мл воды и 50 мл дихлорметана. рН водной фазы доводят до 14 1N раствором NaOH. Органическую фазу после отстаивания отделяют и осуществляют повторную экстракцию 50 мл дихлорметана. Органические фазы соединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют при 50 С в ротационном испарителе. Получают 4,14 г желтого масла,которое очищают методом препаративной хроматографии на силикагеле (элюент: 98,9/1/0,1(об/об/об) смесь дихлорметан/метанол/28% водный раствор аммиака, постепенно вытесняемая 95,6/4/0,4 (об/об/об) смесью тех же компонентов). Получают 3,4 г (86,5%) (2-[4-[бис(4 фторфенил)метил)-1-пиперазинил]этоксиацетамида в виде кристаллизующегося бесцветного масла. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенные [2-(1-пиперазинил)этокси] метильные соединения формулы где R1 обозначает -CONH2, -CN, -СООН,-СООМ или -СООR3, причем М обозначает щелочной металл и R3 обозначает С 1-4 алкил; иR2 обозначает атом водорода или группу COR4 или R5, причем R4 выбран из групп -OR5 или R7, в которыхR5 обозначает аллил или алкиларил,R6 обозначает линейный или разветвленный С 1-4 алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, иR7 обозначает галоидалкил. 2. Замещенное [2-(1-пиперазинил)этокси] метильное соединение по п.1, отличающееся тем, что оно выбрано из 2-(1-пиперазинил)этоксиуксусной кислоты,2-[2-(1-пиперазинил)этокси]ацетамида,2-(1-пиперазинил)этоксиацетонитрила,метил-2-(1-пиперазинил)этоксиацетата,этил-2-(1-пиперазинил)этоксиацетата,2-(4-бензил-1-пиперазинил)этоксиацетамида,2-(4-бензил-1-пиперазинил)этоксиацетонитрила,метил-2-(4-бензил-1-пиперазинил)этоксиацетата,бензил-4-(2-карбамоилметоксиэтил)пиперазин 1-карбоксилата,бензил-4-(2-цианметоксиэтил)пиперазин-1-карбоксилата,трет.бутил-4-(2-карбамоилметоксиэтил)пиперазин-1-карбоксилата,трет.бутил-4-(2-цианметоксиэтил)пиперазин-1 карбоксилата,трет.бутил-4-(2-метоксикарбонилметоксиэтил) пиперазин-1-карбоксилата,этил-4-(2-карбамоилметоксиэтил)пиперазин-1 карбоксилата и 2-(4-карбоксиэтил-1-пиперазинил)этоксиацетата калия. 3. Замещенные [2-(1-пиперазинил)этокси] метильные соединения по п.1, отличающиеся тем, что группа, защищающая аминную функцию R2, представляет собой линейную или разветвленную алкилкарбоксилатную группу, содержащую 1-4 атома углерода, или алкиларильную группу. 4. Способ получения замещенных [2-(1 пиперазинил)этокси]-метильных соединений по любому из пп.1-3, отличающийся тем, что пиперазин формулы где R2 обозначает атом водорода или группу COR4 или R5, где R4 выбран из групп -OR6 илиR5 обозначает аллил или алкиларил,R6 обозначает линейный или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и(VI) где R1 обозначает -CONH2, -CN, -COOH,-СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С 1-4 алкил и Х обозначает галоген. 5. Способ по п.4, отличающийся тем, что атом галогена, обозначенный X, представляет собой хлор или йод. 6. Способ по п.4 или 5, отличающийся тем,что защитная группа для аминной функции R2 представляет собой линейную или разветвленную алкилкарбоксилатную группу, содержащую 1-4 атома углерода, или алкиларильную группу. 7. Применение замещенныхR2 обозначает атом водорода, в качестве промежуточных продуктов для получения соединений формулы где R1 имеет то же значение, что и в формуле (I) выше и X1 и Х 2 независимо обозначают водород, фтор, хлор и/или бром. 8. Способ получения соединений формулы где X обозначает галоген, выбранный из хлора,брома или йода, и X1 и Х 2 независимо обозначают водород, фтор, хлор и/или бром. 9. Способ по п.8, отличающийся тем, что замещенное [2-(1-пиперазинил)этокси]метильное соединение формулы (I), где R2 обозначает атом водорода, представляет собой продукт реакции отщепления группы R2 замещенного [2(1-пиперазинил)этокси]метильного соединения формулы (I), где R2 обозначает атом водорода или группу -COR4 или -R5, где R4 выбран из групп OR6 или R7,где R5 обозначает аллил или алкиларил,R6 обозначает линейный или разветвленный С 1-4 алкил, галоидалкил, алкиларил, алкилнитроарил или алкилгалоидарил, и 28 где R1 обозначает -CONH2, -CN, -COOH,-СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С 1-4 алкил, и Х 1 обозначает атом хлора в положении 4, и Х 2 обозначает атом водорода, полученных способом по п.8, в качестве промежуточных соединений для получения 2-[2-[4-[(4-хлорфенил)-фенилметил]-1 пиперазинил]этокси]уксусной кислоты и/или е фармацевтически приемлемых солей. 11. Применение соединений формулы где R1 обозначает -CONH2, -CN, -COOH,-СООМ или -СООR3, М обозначает щелочной металл, R3 обозначает С 1-4 алкил, и X1 и Х 2 каждый обозначает атом фтора в положении 4, полученных способом по п.8, в качестве промежуточных соединений для получения 2-[2-[4[бис(4-фторфенил)фенилметил]-1-пиперазинил] этокси]уксусной кислоты и/или е фармацевтически приемлемых солей.
МПК / Метки
МПК: C07D 295/08
Метки: соединения, способ, применение, получения, 2-(1-пиперазинил)этокси]метильные, замещенные
Код ссылки
<a href="https://eas.patents.su/15-831-zameshhennye-2-1-piperaziniletoksimetilnye-soedineniya-sposob-ih-polucheniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные [2-(1-пиперазинил)этокси]метильные соединения, способ их получения и их применение</a>
Предыдущий патент: Наружное зеркало с шаговым и контролируемым поворотом
Следующий патент: Термопластичный композитный материал и способ получения декоративного изделия на его основе
Случайный патент: βd - кристаллическая форма гидрохлорида ивабрадина, способ её получения и фармацевтические композиции, которые её содержат



















