Винилсульфоксиды и способ их синтеза
Номер патента: 405
Опубликовано: 24.06.1999
Авторы: Айкинс Джеймс А., Занг Тони Й., Миллер Рэндэл С.
Формула / Реферат
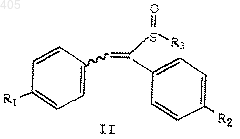
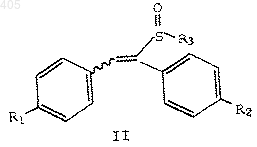
1. Соединение формулы
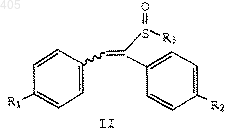
где R1 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино;
R2 представляет водород, C1-C4 алкокси, арилалкокси, галоген или амино; и
R3 представляет термически или кислотонеустойчивую С2-С10 алкильную, С4-С10 алкенильную или арил (С1-С10 алкильную) группу, при условии, что R1 и R2 не являются оба водородом, когда R3 представляет С2-С10 алкил или арил (С1-С10алкил), и R1 не является С1-С4 алкокси, когда R2 представляет водород и R3 представляет С2-С10 алкил.
2. Соединение по п.1, в котором R1 представляет водород, С1-С4 алкокси или арилалкокси и R2 представляет водород, С1-С4 алкокси или арилалкокси.
3. Соединение по п.2, в котором R3 представляет термически или кислотонеустойчивую С2-С10 алкильную или арил(С1-С10 алкильную) группу.
4. Соединение по п.3, в котором R3 представляет термически или кислотонеустойчивую С2-С10 алкильную группу.
5. Соединение по п.4, в котором R1 представляет водород или С1-С4 алкокси и R2 представляет водород или С1-С4 алкокси.
6. Соединение по п.5, в котором R1 и R2 представляют С1-С4 алкокси.
7. Соединение по п.6, в котором R3 представляет трет-бутил.
8. Соединение по п.5, в котором R1 и R2 представляют метокси.
9. Соединение по п.1 формулы
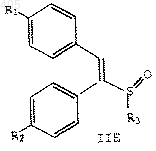
где R1 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино;
R2 представляет водород, C1-С4 алкокси, арилалкокси, галоген или амино; и
R3 представляет термически или кислотонеустойчивую С2-С10 алкильную, С4-С10 алкенильную или арил(С1-С10алкильную) группу, при условии, что R1 и R2 не являются оба водородом, когда R3 представляет С2-С10 алкил или арил (С1-С10 алкил), и R1 не является С1-С4 алкокси, когда R2 представляет водород и R3 представляет С2-С10 алкил.
10. Соединение по п.9, в котором R1 и R2 представляют метокси и R3 представляет трет-бутил.
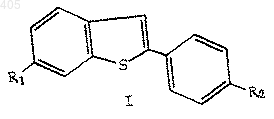
11. Соединение по п.1 формулы
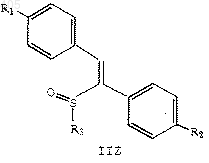
где R1 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино;
R2 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино; и
R3 представляет термически или кислотонеустойчивую С2-С10 алкильную, С4-С10 алкенильную или арил(С1-С10 алкильную) группу, при условии, что R1 и R2 не являются оба водородом, когда R3 представляет С2-С10 алкил или арил(С1-С10 алкил), и R1 не является С1-С4 алкокси, когда R2 представляет водород и R3 представляет C2-C10 алкил.
12. Соединение по п.11, в котором R1 и R2 представляют метокси и R3 представляет трет-бутил.
13. Способ получения соединения формулы
где R1 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино;
R2 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино; и
R3 представляет термически или кислотонеустойчивую С4-С10 алкильную, С4-С10 алкенильную или арил (С1-С10 алкильную) группу, каждая из которых имеет третичный углеродный атом, соседний с атомом серы;
включающий стадии:
1) окисление бензилсульфида формулы
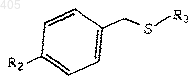
где R2 и R3 принимают значения, определенные выше;
окисляющим агентом с получением бензилсульфоксида формулы
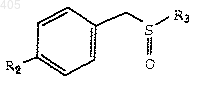
где R2 и R3 принимают значения, определенные выше;
2) взаимодействие указанного бензилсульфоксида с первым сильным основанием с образованием бензильного аниона;
3) конденсация указанного бензильного аниона с бензальдегидом формулы
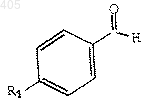
где R1 принимает значения определенные выше;
4) взаимодействие продукта конденсации со стадии 3 с хлорангидридом кислоты с получением сложного эфира формулы
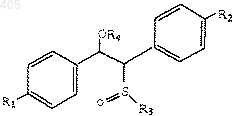
где R1, R2 и R3 принимают значения, определенные выше, и
R4 представляет CO(C1-C6 алкил), СО(арил), СО(арилалкил), SO2 (C1-C6 алкил), SO2 (арил), SO2 (арилалкил), СО2 (C1-C6 алкил), СО2(арил), СО2(арилалкил) или CON(C1-C6 алкил)2; и
5) обработка указанного сложного эфира вторым сильным основанием.
14. Способ по п.13, в котором R1 представляет водород, С1-С4 алкокси или арилалкокси; и
R2 представляет водород, С1-С4 алкокси или арилалкокси.
15. Способ по п.14, в котором R3 представляет термически или кислотонеустойчивую С4-С10 алкильную или арил (C1-C10 алкильную) группу, каждая из которых имеет третичный углеродный атом, соседний с атомом серы.
16. Способ по п.15, отличающийся тем, что окисляющим агентом является перуксусная кислота.
17. Способ по п.16, отличающийся тем, что первым сильным основанием является алкиллитий.
18. Способ по п.17, отличающийся тем, что первым сильным основанием является н-бутиллитий.
19. Способ по п.17, отличающийся тем, что хлорангидридом кислоты является сульфонилхлорид и R4 представляет SO2(C1-C6 алкил), SO2(арил) или SO2(арилалкил).
20. Способ по п.19, отличающийся тем, что сульфонилхлоридом является метансульфонилхлорид.
21. Способ по п.17, отличающийся тем, что вторым сильным основанием является алкоксид металла.
22. Способ по п.21, отличающийся тем, что алкоксидом металла является трет-бутоксид калия.
23. Способ по п.22, в котором R3 представляет термически или кислотонеустойчивую С4-С10 алкильную группу, имеющую третичный углеродный атом, соседний с атомом серы.
24. Способ по п.17, в котором R1 и R2 представляют метокси и R3 представляет трет-бутил.
25. Способ получения соединения формулы

где R1 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино;
R2 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино; и
R3 представляет термически шыш кислотонеустойчивую С4-С10 алкильную, С4-С10 алкенильную или арил(С1-С10 алкильную) группу, каждая из которых имеет третичный углеродный атом, соседний с атомом серы;
включающий стадии:
1) взаимодействие бензилсульфида формулы

где R2 и R3 принимают значения, определенные выше;
с первым сильным основанием с образованием бензильного аниона;
2) конденсирование указанного бензильного аниона с бензальдегидом формулы
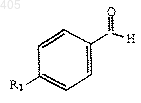
где R1 принимает значения, определенные выше;
3) взаимодействие продукта конденсации со стадии 2 с хлорангидридом кислоты с получением сложного эфира формулы
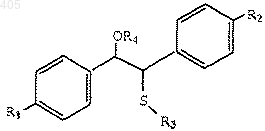
где R1, R2 и R3 принимают значения, определенные выше; и
R4 представляет CO(C1-C6 алкил), СО(арил), СO(арилалкил), SO2(C1-C6 алкил), SO2(арил), SO2(арилалкил), СО2(C1-C6 алкил), СО2 (арил), СО2(арилалкил) или CON(C1-С6алкил)2;
4) обработка указанного сложного эфира вторым сильным основанием с получением стирилсульфида формулы
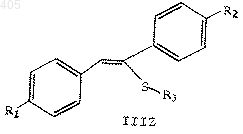
где R1, R2 и R3 принимают значения, определенные выше; и
5) окисление указанного стирилсульфида окисляющим агентом.
26. Способ по п.25, в котором R1 представляет водород, С1-С4 алкокси или арилалкокси и R2 представляет водород, С1-С4 алкокси или арилалкокси.
27. Способ по п.26, в котором R3 представляет термически или кислотонеустойчивую С4-С10 алкильную или арил(С1-С10 алкильную) группу, каждая из которых имеет третичный углеродный атом, соседний с атомом серы.
28. Способ по п.26, отличающийся тем, что окислителем является перуксусная кислота.
29. Способ по п.28, отличающийся тем, что первым сильным основанием является алкиллитий.
30. Способ по п.29, отличающийся тем, что первым сильным основанием является н-бутиллитий.
31. Способ по п.29, отличающийся тем, что хлорангидридом кислоты является сульфонилхлорид и R4 представляет SO2 (C1-C6 алкил), SO2(арил) или SO2(арилалкил).
32. Способ по п.31, отличающийся тем, что сульфонилхлоридом является метансульфонилхлорид.
33. Способ по п.29, отличающийся тем, что вторым сильным основанием является алкоксид металла.
34. Способ по п.33, отличающийся тем, что алкоксидом металла является трет-бутоксид калия.
35. Способ по п.34, в котором R3 представляет термически или кислотонеустойчивую С2-С10 алкильную группу, имеющую третичный углеродный атом, соседний с атомом серы.
36. Способ по п.29, в котором R1 и R2 представляют метокси и R3 представляет трет-бутил.
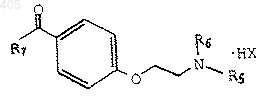
37. Способ получения соединения формулы
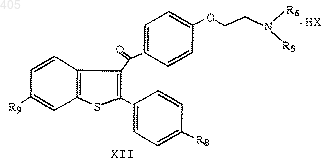
где R8 представляет водород, галоген, амино или гидроксил;
R9 представляет водород, галоген, амино или гидроксил;
R5 и R6 независимо представляют С1-С4 алкил или R5 и R6 вместе с соседним атомом азота образуют гетероциклическое кольцо, выбранное из группы, состоящей из пирролидино, пиперидино, гексаметиленимино и морфолино; и
НХ представляет НСl или НВr;
включающий стадии:
а) циклизация в присутствии кислотного катализатора соединения формулы
где R1 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино;
R2 представляет водород, С1-С4 алкокси, арилалкокси, галоген или амино; и
R3 представляет термически или кислотонеустойчивую С2-С10 алкильную, С4-С10 алкенильную или арил(С1-С10 алкильную) группу, с получением бензотиофена формулы
где R1 и R2 - такие, как определены выше;
b) ацилирование указанного бензотиофена ацилирующим агентом формулы
где R5, R6 и НХ принимают значения, определенные выше; и
R7 представляет хлор, бром или гидроксил;
в присутствии ВХ'3, где Х' представляет хлор или бром;
с) когда R1 и/или R2 представляют (ет) С1-С4 алкокси или арилалкокси, деалкилирование одной или нескольких фенольных групп продукта ацилирования со стадии (b) взаимодействием с дополнительным ВХ'3, где Х' принимает значения, определенные выше; и
d ) необязательное выделение соединения формулы XII.
Текст
1 Настоящее изобретение относится к новым винилсульфоксидам, в частности диарилвинилсульфоксидам, и к новому способу их синтеза. Эти соединения используются для синтеза бензо[b] тиофенов. Бензо[b]тиофены получают различными способами синтеза. Одним из наиболее широко используемых способов является окислительная циклизация омеркаптокоричных кислот. Этот способ ограничивается получением бензо[b]тиофен-2-карбоксилатов. 2-Фенилбензо[b]тиофены получают катализируемой кислотой циклизацией диалкилацеталей 2-фенилтиоацетальдегидов. Незамещенные бензо[b]тиофены получают каталитической конденсацией стирола и серы. 3 Замещенные бензо[b]тиофены получают катализируемой кислотой циклизацией арилтиометилкетонов,но этот способ ограничивается получением 3 алкилбензо[b]тиофенов,см.Rees), том IV, часть III, 863-934 (1984). 3-Хлор 2-фенилбензо[b] тиофен получают взаимодействием дифенилацетилена с дихлоридом серы.(1970). Бензо[b] тиофены получают также пиролизом стирилсульфоксидов. Однако низкие выходы и очень высокие температуры делают этот способ непригодным для промышленного синтеза. См. Ando, J. Chem. Soc., Chem. Comm.,704-705 (1975). Получение 6-гидрокси-2-(4-гидроксифенил)бензо[b]тиофенов описано в патентах США 4133814 и 4380635. Одним из способов,описанных в этих патентах, является катализируемая кислотой внутримолекулярная циклизация с перегруппировкой -(3-метоксифенилтио)-4-метоксиацетофенона. Реакция этого исходного соединения в неразбавленной полифосфорной кислоте при температуре от примерно 85 С до примерно 90 С дает смесь (приблизительно 3:1) двух региоизомерных продуктов: 6-метокси-2-(4-метоксифенил)бензо[b]тиофена и 4-метокси-2-(4-метоксифенил)бензо[b] тиофена. Эти изомерные бензо[b]тиофены соосаждаются из реакционной смеси, в результате чего получают смесь, содержащую оба соединения. Для получения отдельного региоизомера необходимо разделить региоизомеры, например,путем хроматографии или фракционной кристаллизации. Поэтому в настоящее время существует потребность в эффективном региоспецифическом синтезе 2-арилбензо[b]тиофенов из легкодоступных исходных материалов. Соединения по настоящему изобретению полезны для эффективного и региоспецифического синтеза 2-арилбензо[b] тиофенов из легкодоступных исходных материалов. Настоящее изобретение относится к новым винилсульфоксидам, в частности диарилвинил 000405 2 сульфоксидам и новому способу их синтеза. В частности, настоящее изобретение относится к соединению формулы:R3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил (С 1-С 10 алкильную) группу. Таким образом, настоящее изобретение включает индивидуальные Е- и Z -изомеры или их смеси соединений формулы II. Указанные Е- и Z региоизомеры имеют следующие структуры: Другим объектом настоящего изобретения является способ получения соединения формулыR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу,имеющую третичный углеродный атом, соседний с атомом серы; включающий стадии: 1) окисление бензилсульфида формулы где R2 и R3 - такие, как определенные выше; 2) взаимодействие указанного бензилсульфоксида с сильным основанием с образованием бензильного аниона; 3) конденсацию указанного бензильного аниона с бензальдегидом формулы где R1 - такой, как определенный выше; 4) взаимодействие продукта конденсации со стадии 3 с хлорангидридом кислоты с получением сложного эфира формулы 4 с сильным основанием с образованием бензильного аниона; 2) конденсацию указанного бензильного аниона с бензальдегидом формулы где R1 принимает значения, определенные выше; 3) взаимодействие продукта конденсации со стадии 2 с хлорангидридом кислоты с получением сложного эфира формулы где R1, R2 и R3 принимают значения, определенные выше; иCO(C1-C6) алкил),СО(арил), СO(арилалкил), SO2 (C1-C6) алкил),SO2 (арил), SO2 (арилалкил), СО 2 (C1-C6 алкил),СО 2 (арил), СО 2 (арилалкил) или CON(C1-C6 алкил)2; и 5) обработка указанного сложного эфира вторым сильным основанием. Е- и Z -региоизомеры соединений формулы II имеют следующие структуры:R4 представляет CO(C1-C6 алкил) ,СО(арил), СO(арилалкил) , SO2(C1-C6 алкил),SO2 (арил) , SO2 (арилалкил) , CO2(C1-C6 алкил),СО 2(арил), СО 2 (арилалкил) или CON(C1-C6 алкил)2; 4) обработка указанного сложного эфира вторым сильным основанием с получением стирилсульфида формулы Следующим объектом настоящего изобретения является способ региоселективного синтеза Z -изомера соединений формулы II. В частности, настоящее изобретение относится к способу получения соединения формулы где R1, R2 и R3 принимают значения, определенные выше; и 5) окисление указанного стирилсульфида окисляющим агентом. Еще одним объектом настоящего изобретения является способ синтеза соединения формулы где R1 представляет водород, С 1-С 4 алкокси,арилалкокси, галоген или амино;R3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил (С 1-С 10 алкильную) группу,имеющую третичный углеродный атом, соседний с атомом серы; включающий стадии: 1) взаимодействие бензилсульфида формулыR5 и R6 независимо представляют С 1-С 4 алкил или R5 и R6 вместе со смежным атомом азота образуют гетероциклическое кольцо, выбранное из группы, состоящей из пирролидино,пиперидино, гексаметиленимино и морфолино; и НХ представляет НСl или НВr; 5 включающий стадии: а) циклизация в присутствии кислотного катализатора соединения формулыR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил (С 1-С 10 алкильную) группу, с получением бензотиофена формулыb) ацилирование указанного бензотиофена ацилирующим агентом формулыR7 представляет хлор, бром или гидроксил; в присутствии ВХ'3, где X' представляет хлор или бром; с) когда R1 и/или R2 представляют(ет) С 1 С 4 алкокси или арилалкокси, деалкилирование одной или нескольких фенольных групп продукта ацилирования со стадии (b) взаимодействием с дополнительным ВХ'3, где X' принимает значения, определенные выше; иd) выделение соединения формулы XII. Термин "С 1-С 6 алкил" представляет прямую или разветвленную алкильную цепь,имеющую от одного до шести углеродных атомов. Типичные C1-C6 алкильные группы включают метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, нпентил, изопентил, н-гексил, 2-метилпентил и тому подобное. Термин "С 1-С 4 алкил" включает прямую или разветвленную алкильную цепь,имеющую от одного до четырех углеродных атомов, и включает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил и третбутил. Термин "С 1-С 4 алкокси" представляет группы, такие как метокси, этокси, н-пропокси,изопропокси, н-бутокси, трет-бутокси и тому подобные группы. Термин "галоген" относится к фтору, хлору, брому или иоду. 6 Термин "арил" представляет группы, такие как фенил и замещенный фенил. Термин "замещенный фенил" представляет фенильную группу, замещенную одним или несколькими группами, выбранными из галогена, гидрокси, нитро, С 1-С 4 алкила, С 1-С 4 алкокси, трихлорметила и трифторметила. Примеры замещенной фенильной группы включают 4-хлорфенил, 2,6 дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 3-хлорфенил, 3-бромфенил, 4-бромфенил,3,4-дибромфенил, 3-хлор-4-фторфенил, 2-фторфенил, 4-гидроксифенил, 3-гидроксифенил, 2,4 дигидроксифенил,3-нитрофенил,4 нитрофенил, 2,4-динитрофенил, 4-метилфенил,4-этилфенил, 4-метоксифенил, 4-пропилфенил,4-н-бутилфенил, 4-трет-бутилфенил, 3-фтор-2-метилфенил, 2,3-дифторфенил, 2,6-дифторфенил, 2,6 диметилфенил, 2-фтор-5-метилфенил, 2,4,6 трифторфенил, 2-трифторметилфенил, 2-хлор-5 трифторметилфенил,3,5-бис(трифторметил) фенил, 2-метоксифенил, 3-метоксифенил, 3,5 диметоксифенил,4-гидрокси-3-метилфенил,3,5-диметил-4-гидроксифенил, 2-метил-4-нитрофенил, 4-метокси-2-нитрофенил и тому подобное. Термин "арилалкил" представляет С 1-С 4 алкильную группу, замещенную одной или несколькими арильными группами. Представители этой группы включают бензил, онитробензил, п-нитробензил, п-галогенбензил(такой как п-хлорбензил, п-бромбензил, пиодбензил), 1-фенилэтил, 2-фенилэтил, 3 фенилпропил,4-фенилбутил,2-метил-2 фенилпропил, (2,6-дихлорфенил)метил, бис(2,6 дихлорфенил)метил, (4-гидроксифенил)метил, (2,4-динитрофенил)метил, дифенилметил, трифенилметил,(п-метоксифенил)дифенил метил, бис(п-метоксифенил)метил, бис(2-нитрофенил)метил и тому подобное. Термин "арилалкокси" представляет C1-C4 алкоксигруппу, замещенную одной или несколькими арильными группами. Представители этой группы включают бензилокси, онитробензилокси,п-нитробензилокси,пгалогенбензилокси (такой, как п-хлорбензилокси, п-бромбензилокси, п-иодбензилокси),1-фенилэтокси, 2-фенилэтокси, 3-фенилпропокси, 4-фенилбутокси, 2-метил-2-фенилпропокси,(2,6-дихлорфенил)метокси, бис(2,6-дихлорфенил)метокси, (4-гидроксифенил)метокси, (2,4 динитрофенил)метокси, дифенилметокси, трифенилметокси,(п-метоксифенил)дифенилметокси, бис(п-метоксифенил)метокси, бис (2 нитрофенил) метокси и тому подобное. Термин "термически или кислотонеустойчивая С 2-С 10 алкильная, С 4-С 10 алкенильная или арил(С 1-С 10 алкильная) группа" представляет группу, которая легко удаляется из сульфоксидной (SO) группы при нагревании или при обработке кислотным катализатором. Термиче 7 ски или кислотонеустойчивые С 2-С 10 алкильные группы представляют собой прямые или разветвленные алкильные цепи, имеющие от двух до десяти углеродных атомов и, по крайней мере, один бета-водородный атом. Типичные термически или кислотонеустойчивые С 2-С 10 алкильные группы включают этил, н-пропил, изопропил, 1,1-диметилпропил, н-бутил, вторбутил, трет-бутил, 1,1-диметилбутил, 2-метилбутил,3-метилбутил,1-метилбутил,1,2 диметилбутил,1,3-диметилбутил,2,4 диметилбутил, 3,3-диметилбутил, н-пентил, 1 метилпентил, 2-метилпентил, 3-метилпентил, 4 метилпентил, н-гексил и тому подобное. Термически или кислотонеустойчивые С 4-С 10 алкенильные группы представляют собой прямые или разветвленные алкенильные цепи, имеющие от четырех до десяти углеродных атомов, по крайней мере, одно место ненасыщенности и либо бета-водородный, либо дельта-водородный атом. Типичные термически или кислотонеустойчивые С 4-С 10 алкенильные группы включают 2-бутенил, 3-бутенил, 2-метил-2-бутенил,3-метил-2-бутенил,2-метил-3-бутенил,2 пентенил, 3-пентенил, 4-пентенил, 2-метил-2 пентенил,3-метил-2-пентенил,4-метил-2 пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 2-метил-4-пентенил,3-метил-4-пентенил, 4-метил-4-пентенил, 2 гексенил, 3-гексенил, 4-гексенил, 5-гексенил и тому подобное. Термин "термически или кислотонеустойчивый арил(С 1-С 10 алкил)" представляет термически или кислотонеустойчивые С 2 С 10 алкильные группы, дополнительно содержащие одну или несколько арильных групп и арилзамещенные метильные группы. Типичные арил(С 1-C10 алкильные) группы включают бензил,дифенилметил,трифенилметил,пметоксибензил, 2-фенилэтил, 2-фенилпропил, 3 фенилпропил и тому подобное. Термин "термически или кислотонеустойчивая С 2-С 10 алкильная, С 4-С 10 алкенильная или арил(С 1-С 10 алкильная) группа, имеющая третичный углеродный атом, соседний с атомом серы" включает(но не ограничивается ими) такие группы, как трет-бутил,1,1-диметилпропил,1,1 диметилбутил,1-этил-1-метилпропил,1,1 диметилпентил,1-этил-1-метилбутил,1,1 диэтилпропил, 1,1-диметилгексил, трифенилметил и тому подобное. Термин "хлорангидрид кислоты" включает хлорангидриды карбоновой кислоты, такие как ацетилхлорид и бензоилхлорид; сульфонилхлориды, такие как метансульфонилхлорид, бензолсульфонилхлорид, 1-бутансульфонилхлорид,этансульфонилхлорид,изопропилсульфонилхлорид и п-толуолсульфонилхлорид; алкоксикарбонилхлориды, такие как метоксикарбонилхлорид и бензилоксикарбонилхлорид; и диалкиламинокарбонилхлориды, такие как N, Nдиметиламинокарбонилхлорид. Предпочтительно хлорангидрид кислоты является сульфонил 000405 8 хлоридом. Более предпочтительно хлорангидрид кислоты является метансульфонилхлоридом. Соединения по настоящему изобретению могут быть получены многими способами. Один способ получения соединений формулы II показан на схеме 1. Схема 1 В общем, соединение формулы IX превращают в стирилсульфид взаимодействием с меркаптаном формулы НSR3 в присутствии кислоты Льюиса. Затем соединение формулы III окисляют до стирилсульфоксида - соединения формулы II. Более конкретно, соединение формулы IX,где R1 и R2 определены выше, обрабатывают кислотой Льюиса, такой как хлорид титана (IV). Эту реакцию осуществляют в безводном органическом растворителе, таком как сухой тетрагидрофуран, при температуре от примерно 0 С до примерно 35 С. Через промежуток времени от примерно пятнадцати минут до примерно одного часа реакционную смесь обрабатывают аминооснованием и меркаптаном формулыHSR3, где R3 определен выше. Предпочтительно меркаптан и аминооснование добавляют в виде раствора в растворителе для реакции. Типичным аминооснованием является триэтиламин. После добавления меркаптана и аминооснования реакционную смесь обычно нагревают до температуры в пределах от примерно 35 С до примерно 65 С, предпочтительно до примерно 50 С. Продукты этой реакции могут быть очищены с использованием методов, известных в области химии, например кристаллизацией или хроматографией. Далее соединение формулы III, где R1, R2 иR3 определены выше, окисляют с получением соединений формулы II. Подходящими окислителями для этой реакции являются перкислоты,такие, как перуксусная кислота и мхлорпероксибензойная кислота, и пероксид водорода. Эту реакцию окисления обычно проводят в органическом растворителе, таком как толуол, метиленхлорид, хлороформ или тетрахлорид углерода. Когда в качестве окислителя используют перкислоту, реакцию обычно осуществляют при температуре от примерно -30 С до примерно 15 С, предпочтительно при примерно -20 С. Продукты реакции можно легко очистить перекристаллизацией. Когда R3 представляет трет-бутил, кристаллический продукт 9 этой последовательности реакций представляет собой Е-региоизомер формулы II. Когда R3 имеет третичный атом углерода,соседний с атомом серы, Z-региоизомер соединений формулы II может быть избирательно получен способом, показанным на схеме 2. Схема 2 В общем, бензиловый спирт формулы V подвергают взаимодействию с меркаптаном формулы R3SН с получением бензилсульфида,формулы VI. Этот бензилсульфид реагирует с сильным основанием, с образованием бензильного аниона, который конденсируют с бензальдегидом. Продукт конденсации подвергают взаимодействию с хлорангидридом кислоты и полученный промежуточный сложный эфир обрабатывают вторым сильным основанием с получением стирилсульфида формулы IIIZ. Затем этот стирилсульфид окисляют окисляющим агентом с получением соединения формулы IIZ. Первой стадией синтеза Z-стирилсульфоксидов является превращение бензилового спирта в бензилсульфид формулы VI. Взаимодействие соединения формулы V, где R2 определен выше, с меркаптаном формулы R3SH, гдеR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу,имеющую третичный атом углерода, соседний с атомом серы, в присутствии кислоты Льюиса дает бензилсульфид формулы VI. Подходящими кислотами Льюиса для этого превращения являются бромид цинка, хлорид цинка, иодид цинка, хлорид железа (III), хлорид титана (IV),трихлорид алюминия и трибромид алюминия,предпочтительно иодид цинка. Реакцию обычно проводят в органическом растворителе, таком,как 1,2-дихлорэтан или метиленхлорид. Когда реакцию проводят при комнатной температуре,она заканчивается спустя примерно 18 ч. Бензилсульфид реагирует с сильным основанием с получением бензильного аниона. Подходящие сильные основания для этой реакции включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, этоксид лития,трет-бутоксид лития и трет-бутоксид калия; гидрид натрия и алкиллитий, такой как нбутиллитий, трет-бутиллитий, втор-бутиллитий и метиллитий. Предпочтительным сильным основанием для этой реакции является нбутиллитий. Предпочтительным растворителем 10 для этой реакции является сухой тетрагидрофуран. Когда в качестве сильного основания используют н-бутиллитий, реакцию проводят при температуре в пределах от примерно -35 С до примерно -15 С. Бензильный анион конденсируют с бензальдегидом с получением промежуточного продукта конденсанции. Бензальдегид имеет общую формулу R1(C6H4)CHO, где R1 представляет водород, С 1-С 4 алкокси, арилалкокси, галоген или амино. Предпочтительно получают бензильный анион и продукт конденсации образуют in situ добавлением бензальдегида к холодному раствору бензильного аниона. Продукт конденсации обрабатывают хлорангидридом кислоты с получением промежуточного сложного эфира. Типичные хлорангидриды включают ацилхлориды, такие как ацетилхлорид и бензоилхлорид; сульфонилхлориды, такие, как метансульфонилхлорид, бензолсульфонилхлорид,1-бутансульфонилхлорид,этансульфонилхлорид,изопропилсульфонилхлорид и п-толуолсульфонил-хлорид; алкоксикарбонилхлориды, такие как метоксикарбонилхлорид и бензилоксикарбонилхлорид; и диалкиламинокарбонилхлориды, такие как N,Nдиметиламинокарбонилхлорид; предпочтительно сульфонилхлорид. Предпочтительно метансульфонилхлорид вводят в реакционную смесь вскоре после образования продукта конденсации. Указанный промежуточный сложный эфир подвергают взаимодействию со вторым сильным основанием, с получением стирилсульфида формулы IIIZ , где R1, R2 и R3 определены выше. Подходящие сильные основания для этой реакции включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия,этоксид лития, трет-бутоксид лития и третбутоксид калия; гидрид натрия; алкиллитий,такой как н-бутиллитий, трет-бутиллитий, вторбутиллитий и метиллитий; и амиды металлов,такие как амид натрия, диизопропиламид магния и диизопропиламид лития. Предпочтительным сильным основанием для этой реакции является трет-бутоксид калия. Обычно эту реакцию проводят при температуре в пределах от примерно 15 С до примерно комнатной температуры, предпочтительно при комнатной температуре. Стирилсульфид окисляют с получением соответствующего стирилсульфоксида. Подходящими окислителями для этой реакции являются перкислоты, такие как перуксусная кислота и м-хлорпероксибензойная кислота; органические пероксиды,такие как третбутилпероксид; и пероксид водорода. Предпочтительно окислителем является перуксусная кислота. Эту реакцию окисления обычно проводят в органическом растворителе, таком как толуол, бензол, ксилол, метанол, этанол, метилацетат,этилацетат,метиленхлорид,1,2 11 дихлорэтан или хлороформ; предпочтительно метиленхлорид. Окисление может быть проведено при температуре от примерно -40 С до примерно 0 С. Альтернативно, когда R имеет третичный углерод, соседний с атомом серы, можно использовать промежуточный продукт бензилсульфид формулы VI с получением смеси Е- иZ-изомеров стирилсульфоксидов формулы II. Этот синтез показан на схеме 3. Схема 3 Бензилсульфид, полученный так, как описано выше, окисляют с получением соответствующего бензилсульфоксида. Бензилсульфоксид подвергают взаимодействию с сильным основанием и полученный анион конденсируют с бензальдегидом. Продукт конденсации подвергают взаимодействию с хлорангидридом кислоты и полученный промежуточный сложный эфир подвергают взаимодействию с вторым сильным основанием, с получением стирилсульфоксида. Бензилсульфид формулы VI, где R2 определен и R3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу,имеющую третичный атом углерода, соседний с атомом серы, окисляют с получением соответствующего бензилсульфоксида формулы X. Подходящими окислителями для этой реакции являются перкислоты, такие как перуксусная кислота и м-хлорпероксибензойная кислота; органические пероксиды, такие как третбутилпероксид; и пероксид водорода. Предпочтительно окислителем является перуксусная кислота. Окисление обычно проводят в органическом растворителе, таком как толуол, бензол,ксилол, метанол, этанол, метилацетат, этилацетат, метиленхлорид, 1,2-дихлорэтан или хлороформ; предпочтительно при температуре от примерно -30 С до примерно 5 С. Бензилсульфид формулы X, где R2 и R3 определены выше, подвергают взаимодействию с сильным основанием, с получением бензильного аниона. Подходящие сильные основания для этой реакции включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия,этоксид лития, трет-бутоксид лития и третбутоксид калия; гидрид натрия; алкиллитий,такой, как н-бутиллитий, трет-бутиллитий, вторбутиллитий и метиллитий; и амиды металлов,такие, как амид натрия, диизопропиламид магния и диизопропиламид лития. Предпочтитель 000405 12 ным основанием для этого превращения является н-бутиллитий. Эту реакцию депротонирования проводят в сухом органическом растворителе, таком, как сухой тетрагидрофуран или 1,2 диметоксиэтан, при температуре около -25 С. Бензильный анион конденсируют, без выделения, с бензальдегидом формулы пR1(C6H4)CHO, где R1 определен выше. Предпочтительно примерно один эквивалент бензальдегида добавляют в холодный раствор, полученный так, как описано в предшествующем абзаце. Полученная диастереометрическая смесь продуктов конденсации может быть выделена или, что является предпочтительным, использована на следующей стадии без выделения. Продукт конденсации необязательно обрабатывают основанием, таким как н-бутиллитий,и подвергают взаимодействию с хлорангидридом кислоты. Типичные хлорангидриды включают ацилхлориды, такие как ацетилхлорид и бензоилхлорид; сульфонилхлориды, такие как метансульфонилхлорид, бензолсульфонилхлорид, 1-бутансульфонилхлорид, этансульфонилхлорид, изопропилсульфонилхлорид и птолуолсульфонилхлорид; алкоксикарбонилхлориды, такие как метоксикарбонилхлорид и бензилоксикарбонилхлорид; и диалкиламинокарбонилхлориды, такие как N,N-диметиламинокарбонилхлорид; предпочтительно сульфонилхлорид. Хлорангидрид добавляют в холодную реакционную смесь и затем полученной смеси дают нагреться до комнатной температуры. Предпочтительно в реакционную смесь добавляют метансульфонилхлорид вскоре после образования продукта конденсации, что исключает необходимость введения дополнительного основания. Полученный промежуточный сложный эфир подвергают взаимодействию со вторым сильным основанием, с получением Е-и Zстирилсульфоксидов формулы II, где R1, R2 и R3 определены выше. Типичные вторые сильные основания для этой реакции включают алкоксиды металлов, такие как метоксид натрия, этоксид натрия, этоксид лития, трет-бутоксид лития и трет-бутоксид калия; гидрид натрия; алкиллитий, такой как н-бутиллитий, трет-бутиллитий,втор-бутиллитий и метиллитий; и амиды металлов, такие, как амид натрия, диизопропиламид магния и диизопропиламид лития. Предпочтительным основанием для этого превращения является трет-бутоксид калия. Предпочтительно добавляют 20% избыток, 1,2 эквивалента, второго основания. Обычно реакцию проводят при температуре в пределах от примерно 15 С до примерно комнатной температуры, предпочтительно при комнатной температуре. Промежуточные стирилсульфоксиды полезны для синтеза 2-арилбензо[b]тиофенов, как показано на схеме 4. В общем, промежуточные стирилсульфоксиды нагревают и обрабатывают кислотными катализаторами с получением соединений формулы I. Подходящие кислотные катализаторы для этой реакции включают кислоты Льюиса или кислоты Брэнстеда. Примеры кислот Льюиса включают хлорид цинка, иодид цинка, хлорид алюминия и бромид алюминия. Примеры кислот Брэнстеда включают неорганические кислоты, такие как серная и фосфорная кислоты; карбоновые кислоты, такие как уксусная и трифторуксусная кислоты; сульфоновые кислоты, такие как метансульфоновая, бензолсульфоновая, 1-нафталинсульфоновая, 1-бутансульфоновая, этансульфоновая, 4-этилбензолсульфоновая, 1-гексансульфоновая, 1,5-нафталиндисульфоновая, 1-октансульфоновая, камфорсульфоновая, трифторметансульфоновая и птолуолсульфоновая кислоты; и полимерные арилсульфоновые кислоты, такие как Нафион(Amberlite ). Более предпочтительными кислотными катализаторами являются сульфоновые кислоты, такие как метансульфоновая кислота,бензолсульфоновая кислота, камфорсульфоновая кислота и п-толуолсульфоновая кислота. Наиболее предпочтительным кислотным катализатором является п-толуолсульфоновая кислота. Обычно раствор кислотного катализатора в органическом растворителе, таком как толуол,бензол, ксилол или высококипящие галогенированные углеводородные растворители, такие как 1,1,2-трихлорэтан, нагревают до примерно 80140 С и обрабатывают раствором стирилсульфоксида в том же растворителе. Используют избыточное количество кислотного катализатора, предпочтительно два эквивалента кислоты. Для получения наилучших результатов конечная концентрация исходного соединения должна быть в пределах от примерно 0,01 М до примерно 0,2 М, предпочтительно 0,05 М. Кроме того, самые высокие выходы получают тогда,когда стирилсульфоксид медленно добавляют к нагретому раствору кислоты в течение от примерно 20 мин до примерно трех часов. Для получения наилучших результатов остаточную воду удаляют из реакционного раствора с помощью ловушки Дина-Старка или экстрактора Сокслета (Soxhiet) и продувают реакционную смесь очищенным азотом. Соединения формулы I полезны в качестве промежуточных продуктов в синтезе ряда 3 ароил-2-арилбензо[b]тиофенов. В патентах США 4133814 и 4418068, которые включены 14 в данное описание в качестве ссылки, описаны эти 3-ароил-2-арилбензо[b]тиофены, а также способы их получения из соединений формулыI. Усовершенствованный синтез ряда 3-ароил-2 арилбензо[b]тиофенов из соединений формулыI, где R1 и R2 представляет водород, С 1-С 4 алкокси или арилалкокси, показан на схеме 5. Схема 5 Бензотиофен формулы I , где R1 и R2 представляют водород, С 1-С 4 алкокси или арилалкокси, ацилируют соединением формулы XI, гдеR7 представляет хлор или гидрокси, в присутствии трихлорида бора или трибромида бора,предпочтительным является трихлорид бора. Реакция может быть проведена в различных органических растворителях, таких как хлороформ, метиленхлорид, 1,2-дихлорэтан, 1,2,3 трихлорпропан,1,1,2,2-тетрахлорэтан,1,2 дихлорбензол, хлорбензол и фторбензол. Предпочтительным растворителем для этого синтеза является 1,2-дихлорэтан. Реакцию проводят при температуре от примерно -10 С до примерно 25 С, предпочтительно при 0 С. Предпочтительно проводить реакцию при концентрации бензотиофена формулы I от примерно 0,2 М до примерно 1,0 М. Реакция ацилирования обычно заканчивается через примерно два-восемь часов. Когда R1 и/или R2 представляют С 1-С 4 алкокси- или арилалкоксигруппу, ацилированный бензотиофен превращают в соединение формулы XI, где R8 и/или R9 представляют гидрокси,без выделения продукта из реакционной смеси для ацилирования. Это превращение осуществляют добавлением дополнительного трихлорида бора или трибромида бора и нагреванием реакционной смеси. В реакционную смесь предпочтительно добавляют два-пять молярных эквивалентов тригалогенида бора, более предпочтительно три молярных эквивалента. Реакцию проводят при температуре от примерно 25 С до примерно 40 С, предпочтительно при 35 С. Реакция обычно заканчивается через примерно 448 ч. Реакцию ацилирования или реакцию ацилирования/деалкилирования останавливают добавлением спирта или смеси спиртов. Подходящие спирты для остановки реакции включают метанол, этанол и изопропанол. Реакционную смесь для ацилирования/деалкилирования предпочтительно добавляют к смеси (95:5) этанола и метанола (этанол 3 А). Этанол 3 А может находиться при комнатной температуре или может 15 быть нагрет до кипения, предпочтительно до температуры кипения. Когда реакцию останавливают указанным образом, соединение формулы XII легко кристаллизуется из полученной спиртовой смеси. Обычно используют 1,25-3,75 мл спирта на миллимоль исходного бензотиофена. Следующие далее примеры дополнительно иллюстрируют настоящее изобретение. Примеры ни в коей мере не предназначены для ограничения объема изобретения и не должны быть так истолкованы. Все примеры были выполнены в атмосфере сухого давлении азота при повышенном давлении. Все растворители и реагенты были использованы в таком виде, в каком были получены. Процентные содержания, как правило, вычисляли по массе (мас./мас.), за исключением растворителей для высокоэффективной жидкостной хроматографии (ВЭЖХ), процентные отношения которых вычисляли по объему(об./об.). Спектры протонного ядерного магнитного резонанса (1 Н ЯМР) и спектры 13 Сядерного магнитного резонанса (13 С ЯМР) получали на спектрометре AC-300 FTNMR при 300,135 МГц или спектрометре GE QE-300 при 300,15 МГц. Флэш-хроматографию на силикагеле проводили так, как описано в Still et al. с использованием Силикагеля 60 (230-400 меш, E.Merck). Still et al., J. Org. Chem., 43, 2923 (1978). Элементный анализ на углерод, водород и азот проводили на элементном анализаторе 440 фирмы Control Equipment Corporation. Элементный анализ на серу проводили на колориметрическом элементном анализаторе Brinkman. Температуру плавления определяли в открытых стеклянных капиллярах на устройстве MelTemp II для определения температуры плавления или автоматическом приборе Mettler FP62 и коррекцию не производили. Масс-спектры с полевой десорбцией (FDMS, ПДМС) получали на масс-спектрометре Varian Instruments VG 70SE или VG ZAB-3F. Масс-спектры высокого разрешения с бомбардировкой свободными атомами (FABMS, БСАМС) получали с использованием масс-спектрометра фирмы Varian Instruments VG ZAB-2SE. Выход in situ 6-метокси-2-(4-метоксифенил)бензо[b]тиофена определяли высокоэффективной жидкостной хроматографией (ВЭЖХ) в сравнении с аутентичным образцом этого соединения, полученного известными способами синтеза. См. патент США 4133814. Как правило, образцы реакционной смеси разбавляли ацетонитрилом и разбавленные пробы анализировали ВЭЖХ, используя колонку Zorbax RXC8 (4,6 х 25 см) с УФ-де-тектированием (280 нм). Для этого анализа использовали следующую линейно-градиентную систему растворителей: Градиентная система растворителей Время (мин) А(%) В(%) 0 50 50 2 50 50 20 20 80 35 20 80 37 50 50 45 50 50 А: 0,01 М водный раствор фосфата натрия(рН 2,0); В: ацетонитрил. Количество (процентное содержание) 6 гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофенгидрохлорида в кристаллическом материале (содержание) определяли следующим способом. Образец кристаллического твердого вещества (5 мг) загружали в колбу емкостью 100 мл и растворяли в смеси 70/30 (об/об) мМ калийфосфатного буфера (рН 2,0) и ацетонитрила. Аликвоту этого раствора (10 мкл) анализировали высокоэффективной жидкостной хроматографией, используя колонку Zorbax Rx-C8 (25 см х 4,6 мм внут. диаметр, размер частиц 5 мкм) и УФдетектирования (280 нм). Использовали следующую градиентную систему растворителей: Градициентная система растворителей (содержание) Время (мин) А(%) В(%) 0 70 30 12 70 30 14 25 75 16 70 30 25 70 30 А: 75 мМ КР 2 РO4 буфер (рН 2,0); В: ацетонитрил. Процентное содержание 6-гидрокси-2-(4 гидроксифенил)-3-[4-(2-пиперидиноэтокси) бензоил]бензо[b]тиофенгидрохлорида в образце вычисляли, используя площадь пика, наклон (m) и отсекаемый отрезок (b) калибровочной кривой, по следующему уравнению: площадь пика -b объем образца (мл) Содержание (%) =х Количество (процентное содержание) растворителя, такого как 1,2-дихлорэтан, в кристаллическом материале определяли газовой хроматографией. Образец кристаллического твердого вещества (50 мг) взвешивали в мерной колбе емкостью 10 мл и растворяли в растворе 2-бутанола(0,025 мг/мл) в диметилсульфоксиде. Образец этого раствора анализировали на газовом хроматографе, используя колонку DВ Wax (30 м х 0,53 мм внут. диаметр,размер частиц 1 мкм) при расходе через колонку 17 10 мл/мин и пламенно-ионизационном детектировании. Температуру колонки повышали от 35 до 230 С в течение 12 мин. Количество растворителя определяли путем сравнения с внутренним стандартом (2-бутанол). Пример 1. Е-трет-Бутил 4,4'-диметоксистильбенилсульфоксид. А. Получение Е-трет-бутил 4,4'диметоксистильбенилсульфида. Раствор дезоксианизоина (12,82 г) в тетрагидрофуране (100 мл) обрабатывали хлоридом титана (IV) (10,43 г). В течение добавления по каплям хлорида титана (IV) реакционную смесь охлаждали, поддерживая температуру ниже 35 С. По окончании добавления полученную смесь перемешивали при 30 С. Спустя еще 30 мин эту смесь обрабатывали раствором 2-метил 2-пропантиола (6,76 мл) и триэтиламина (16,70 мл) в тетрагидрофуране (15 мл). Полученную смесь перемешивали при 50 С. Через два часа смесь выливали в 10% раствор карбоната натрия(500 мл). Полученную смесь экстрагировали метиленхлоридом. Объединенные метиленхлоридные экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме,получив в результате 17,2 г масла, которое кристаллизовали при температурах в диапазоне от охлаждения до комнатной температуры. Кристаллический материал перекристаллизовывали из горячего этанола с получением 12,3 г указанного в заголовке соединения. Температура плавления 71-73 С. Вычислено для С 20 Н 24O2S : С 73,13; Н 7,36;S 9,76. Найдено: С, 73,37; Н, 7,51; S, 9,87. В. Получение Е-трет-бутил 4,4'диметоксистильбенилсульфоксида. Кристаллическое соединение, полученное по методике примера 1 А, растворяли в толуоле(150 мл) и полученный раствор охлаждали до примерно -20 С. Холодный раствор обрабатывали перуксусной кислотой (32% м/м в разбавленной уксусной кислоте, 1,24 г) в течение десяти минут. Полученную смесь экстрагировали насыщенным раствором сульфита натрия и рассолом. Органическую фазу концентрировали в вакууме. Остаток перекристаллизовывали из смеси этилацетат-гептан с получением 14,11 г указанного в заголовке соединения. Температура плавления 104 С (разл.). Вычислено для С 24H24O3S: С 69,74; Н 7,02;(9,92 мл) одной порцией. Полученную смесь перемешивали при комнатной температуре. Че 000405 18 рез примерно 18 ч реакционную смесь разбавляли водой (100 мл) и метиленхлоридом (100 мл). Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме, получив в результате 14,4 г масла. 1C ЯМР (СDСl3):130, 114, 56, 35, 32. Вычислено для C12H18OS: С 68,52; Н 8,63; Найдено: С 68,8; Н 8,67. В. Получение Z-трет-бутил 4,4'-диметоксистильбенилсульфида. Раствор соединения, полученного по методике примера 2 А (2, 51 г), в тетрагидрофуране(50 мл) охлаждали до примерно -20 С. Охлажденный раствор обрабатывали раствором нбутиллития в гексане (1,6 М, 7,47 мл) в течение десяти минут. Полученному раствору давали нагреться до примерно 0 С в течение 35 мин. Холодный раствор обрабатывали п-анисовым альдегидом(1,46 мл). Спустя еще 15 мин реакционный раствор обрабатывали метансульфонилхлоридом(0,95 мл). Полученному реакционному раствору давали согреться до комнатной температуры. Спустя еще 45 мин реакционную смесь обрабатывали раствором трет-бутоксида в тетрагидрофуране (1,0 М, 12,0 мл). Еще через 45 мин реакцию останавливали добавлением 1 н. хлороводородной кислоты (12,0 мл). Органическую фазу отделяли, сушили над сульфатом магния,фильтровали и концентрировали до масла (4,4 г). 1H ЯМР (CDCl3):7,95 (д, Н), 7,05 (с, Н),6,9 (д,Н), 6,8 (дд, 2 Н), 3,75 (с, ЗН), 0,95 (с, 9 Н). 13 С ЯМР (CDCl3):153, 139, 137, 114, 56,32. С. Получение Z-трет-бутил 4,4'-диметоксистильбенилсульфоксида. Соединение примера 2 В превращали в указанное в заголовке соединение по методике примера 1 В. 1(9,92 мл) одной порцией. Полученную смесь перемешивали при комнатной температуре. Через примерно 18 ч реакционную смесь разбавляли водой (100 мл) и метиленхлоридом (100 мл). Органическую фазу отделяли, сушили надC ЯМР (CDCl3):130, 114, 56, 35, 32. Вычислено для С 12 Н 18OS: С 68,52; Н 8,63; Найдено: С 68,8; Н 8,67. В. Получение трет-бутил 4-метоксибензилсульфоксида. Раствор соединения, полученного по методике примера 3 А (14,4 г), в 1,2-дихлорэтане (50 мл) охлаждали до примерно 5 С и холодный раствор обрабатывали перуксусной кислотой(32% мас./мас. в разбавленной уксусной кислоте, 14,2 мл) в течение 30 мин. По окончании добавления перуксусной кислоты реакционную смесь обрабатывали рассолом и бикарбонатом натрия. Органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали в вакууме до получения желтого осадка. Этот остаток обрабатывали гексаном(100 мл) и полученную смесь перемешивали при комнатной температуре. Спустя примерно 18 ч смесь фильтровали и твердые частицы промывали гексаном (100 мл). Твердый материал высушивали в вакууме с получением 14,07 г указанного в заголовке соединения. Температура плавления 124-126 С. 1C ЯМР (CDCl3):132, 114, 56, 53, 23. Вычислено для С 12H18O2S: С 63,68; Н 8,02. Найдено: С 63,72; Н 7,93. С. Получение Е- и Z-трет-бутил 4,4'диметоксистильбенилсульфоксида. Раствор соединения, полученного по методике примера 3 В (10,0 г), в тетрагидрофуране(140 мл) охлаждали до температуры от примерно -30 С до -25 С (баня с сухим льдом и ацетоном). Холодный раствор обрабатывали нбутиллитием в циклогексане (1,6 М, 27,65 мл) в течение 25 мин. После перемешивания в течение 35 мин реакционную смесь обрабатывали панисовым альдегидом (5,4 мл). Баню с сухим льдом и ацетоном убирали и давали реакционной смеси нагреться до примерно 20 С. Смесь обрабатывали метансульфонилхлоридом (3,5 мл). После добавления метансульфонилхлорида температура реакционной смеси повышалась от примерно 20 С до примерно 35 С. Смесь охлаждали до примерно 25 С, после чего обрабатывали трет-бутоксидом калия в тетрагидрофуране(1 М, 50,9 мл). После перемешивания в течение еще 35 мин реакционную смесь обрабатывали 1 н. хлороводородной кислотой (51,0 мл). Разделяли фазы и органический слой сушили над сульфатом магния, фильтровали и концентрировали до масла (16,67 г). Этот материал использовали на следующей стадии без дополнитель 000405 20 ной очистки. Углеродный и протонный ЯМРспектры были такими же, как у соединения, полученного по методикам примеров 1 и 2. Пример 4 Z-трет-Бутил 4,4-диметоксистильбенилсульфоксид. Раствор соединения, полученного по методике примера 3 В (3,0 г), в тетрагидрофуране (40 мл) охлаждали до примерно -15 С. Холодный раствор обрабатывали н-бутиллитием в циклогексане (1,6 М, 8,3 мл) в течение 15 мин. После перемешивания в течение десяти минут реакционную смесь нагревали до 0 С и обрабатывали п-анисовым альдегидом (1,61 мл). Ледяную баню убирали и давали реакционной смеси нагреться до примерно комнатной температуры. Смесь обрабатывали ацетил-хлоридом (0,95 мл). Через примерно один час реакционную смесь обрабатывали трет-бутоксидом калия в тетрагидрофуране (1 М, 16,0 мл). После перемешивания в течение еще 1,5 ч реакционную смесь обрабатывали 1 н. хлороводородной кислотой (17,0 мл). Разделяли фазы и органический слой сушили над сульфатом магния, фильтровали и концентрировали до масла (5,26 г). Этот материал использовали без дополнительной очистки. Углеродный и протонный ЯМР-спектры были такими же, как у соединения, полученного по методике примера 2. Пример 5. 6-Метокси-2-(4-метоксифенил) бензо[b]тиофен. Раствор моногидрата п-толуолсульфоновой кислоты (2,25 г) в толуоле (60 мл) нагревали с обратным холодильником и удаляли воду путем улавливания в ловушке Дина-Старка. При продувке газообразного азота через верхнюю часть холодильника к кипящему раствору кислоты добавляли в течение 1,5 ч раствор соединения, полученного по методике примера 1(2,04 г), в толуоле (33 мл). Полученную смесь охлаждали до примерно 5 С при продувке азотом, после чего обрабатывали водой (8 мл). Полученную суспензию перемешивали три часа,после чего фильтровали и кристаллический продукт промывали водой (8 мл) и ацетоном (8 мл). Высушивали кристаллический продукт в вакууме при 40 С в течение примерно 18 ч, получив в результате 1,30 г указанного в заголовке соединения в виде светло-рыжевато-коричневого твердого вещества. Это соединение было идентично соединению, полученному известным способом. Температура плавления 196199 С. Пример 6. 6-Метокси-2-(4-метоксифенил) бензо[b]тиофен. Раствор моногидрата п-толуолсульфоновой кислоты (2,49 г) в толуоле (108 мл) нагревали с обратным холодильником и удаляли воду путем улавливания в ловушке ДинаСтарка. К кипящему раствору кислоты добавляли в течение шести часов раствор соединения,полученного по методике примера 1 (9,00 г), в толуоле (32 мл). По окончании добавления к 21 реакционному раствору добавляли абсолютный этанол (35 мл) и полученной смеси давали остыть до комнатной температуры. Примерно через 18 часов осадок отделяли фильтрованием. Осадок промывали смесью толуолабсолютный этанол (4:1, 29 мл) и сушили в вакууме при 40 С в течение примерно 18 ч, получив в результате 4,86 г твердого вещества. Это соединение было идентично соединению, полученному известным способом. Температура плавления 199200 С. Пример 7. 1,2-Дихлорэтановый сольват 6 гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил] бензо[b] тиофенгидрохлорида. А. Получение этил 4-(2 пиперидиноэтокси) бензоата. Смесь этил 4-гидроксибензоата (8, 31 г), 1(2-хлорэтил)-пиперидинмоногидрохлорида(10,13 г), карбоната калия (16, 59 г) и метилэтилкетона (60 мл) нагревали до 80 С. Через 1 ч смесь охлаждали до примерно 55 С и обрабатывали дополнительным 1-(2-хлорэтил) пиперидинмоногидрохлоридом (0,92 г). Полученную смесь нагревали до 80 С. Реакцию контролировали тонкослойной хроматографией (ТСХ) с использованием пластин силикагеля и смеси растворителей этилацетат-ацетонитфилтриэтиламин (10:6:1, об./об.). Добавляли дополнительные порции 1-(2-хлорэтил) пиперидингидрохлорида до тех пор, пока не был израсходован исходный сложный эфир 4-гидроксибензоат. По окончании реакции реакционную смесь обрабатывали водой (60 мл) и давали ей остыть до комнатной температуры. Водный слой выливали, а органический слой концентрировали в вакууме при 40 С и 40 мм рт. ст. Полученное масло использовали на следующей стадии без дополнительной очистки. В. Получение гидрохлорида 4-(2 пиперидиноэтокси) бензойной кислоты. Раствор соединения, полученного по методике примера 7 А (примерно 13,87 г), в метаноле(30 мл) обрабатывали 5 н. раствором гидроксида натрия (15 мл) и нагревали до 40 С. Через 4 1/2 ч добавляли воду (40 мл). Полученную смесь охлаждали до 5-10 С и медленно добавляли к ней концентрированную хлороводородную кислоту (18 мл). Во время подкисления образовались кристаллы указанного в заголовке соединения. Кристаллический продукт собирали фильтрованием и высушивали в вакууме при 4050 С с получением 83%-ного выхода указанного в заголовке соединения. Температура плавления 270-271 С. С. Получение гидрохлорида 4-(2 пиперидиноэтокси)бензоилхлорида. Раствор соединения, полученного по методике примера 7 В (30,01 г), и диметилформамида 22 анализировали реакционную смесь на окончание реакции путем ВЭЖХ. В случае присутствия исходной карбоновой кислоты в реакционную смесь может быть добавлен дополнительный оксалилхлорид. По окончании реакции реакционный раствор выпаривали досуха в вакууме. Остаток растворяли в метиленхлориде (200 мл) и полученный раствор выпаривали досуха. Повторяли эту процедуру растворения и выпаривания с получением указанного в заголовке соединения в виде твердого вещества. Указанное в заголовке соединение можно хранить в виде твердого вещества или в виде 0,2 М раствора в метиленхлориде (500 мл).D. Получение 1,2-дихлорэтанового сольвата 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофенгидрохлорида. Смесь соединения, полученного по методике примера 5 или 6 (2,92 г), соединения, полученного по методике примера 7 С (3,45 г ), и 1,2-дихлорэтана (52 мл) охлаждали до примерно 0 С. Газообразный трихлорид бора (2,8 мл) конденсировали в холодный градуированный цилиндр и добавляли к описанной выше холодной смеси. Спустя 8 ч выдерживания при 0 С реакционную смесь обрабатывали дополнительным трихлоридом бора (2,8 мл). Полученный раствор нагревали до 35 С. Через 16 ч реакция завершалась. Полученной реакционной смесью обрабатывали в течение 20 мин метанол (30 мл), нагреваемый с обратным холодильником. Полученную суспензию перемешивали при 25 С. Через час кристаллический продукт отфильтровывали, промывали холодным метанолом (8 мл) и высушивали при 40 С в вакууме, получив в результате 5,14 г указанного в заголовке соединения. Температура плавления 225 С. Выход: 86,8% 1,2-Дихлорэтан: 6,5% (газовая хроматография). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил (С 1-С 10 алкильную) группу,при условии, что R1 и R2 не являются оба водородом, когда R3 представляет С 2-С 10 алкил или арил (С 1-С 10 алкил), и R1 не является С 1-С 4 ал 23 кокси, когда R2 представляет водород и R3 представляет С 2-С 10 алкил. 2. Соединение по п.1, в котором R1 представляет водород, С 1-С 4 алкокси или арилалкокси и R2 представляет водород, С 1-С 4 алкокси или арилалкокси. 3. Соединение по п.2, в котором R3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную или арил(С 1-С 10 алкильную) группу. 4. Соединение по п.3, в котором R3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную группу. 5. Соединение по п.4, в котором R1 представляет водород или С 1-С 4 алкокси и R2 представляет водород или С 1-С 4 алкокси. 6. Соединение по п.5, в котором R1 и R2 представляют С 1-С 4 алкокси. 7. Соединение по п.6, в котором R3 представляет трет-бутил. 8. Соединение по п.5, в котором R1 и R2 представляют метокси. 9. Соединение по п.1 формулыR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу,при условии, что R1 и R2 не являются оба водородом, когда R3 представляет С 2-С 10 алкил или арил (С 1-С 10 алкил), и R1 не является С 1-С 4 алкокси, когда R2 представляет водород и R3 представляет С 2-С 10 алкил. 10. Соединение по п.9, в котором R1 и R2 представляют метокси и R3 представляет третбутил. 11. Соединение по п.1 формулыR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу, 000405 24 при условии, что R1 и R2 не являются оба водородом, когда R3 представляет С 2-С 10 алкил или арил(С 1-С 10 алкил), и R1 не является С 1-С 4 алкокси, когда R2 представляет водород и R3 представляет C2-C10 алкил. 12. Соединение по п.11, в котором R1 и R2 представляют метокси и R3 представляет третбутил. 13. Способ получения соединения формулыR3 представляет термически или кислотонеустойчивую С 4-С 10 алкильную, С 4-С 10 алкенильную или арил (С 1-С 10 алкильную) группу,каждая из которых имеет третичный углеродный атом, соседний с атомом серы; включающий стадии: 1) окисление бензилсульфида формулы где R2 и R3 принимают значения, определенные выше; 2) взаимодействие указанного бензилсульфоксида с первым сильным основанием с образованием бензильного аниона; 3) конденсация указанного бензильного аниона с бензальдегидом формулы где R1 принимает значения, определенные выше; 4) взаимодействие продукта конденсации со стадии 3 с хлорангидридом кислоты с получением сложного эфира формулыCO(C1-C6 алкил),СО(арил), СО(арилалкил), SO2 (C1-C6 алкил),SO2 (арил), SO2 (арилалкил), СО 2 (C1-C6 алкил),СО 2(арил), СО 2(арилалкил) или CON(C1-C6 алкил)2; и 5) обработка указанного сложного эфира вторым сильным основанием. 14. Способ по п.13, в котором R1 представляет водород, С 1-С 4 алкокси или арилалкокси; иR2 представляет водород, С 1-С 4 алкокси или арилалкокси. 15. Способ по п.14, в котором R3 представляет термически или кислотонеустойчивую С 4 С 10 алкильную или арил (C1-C10 алкильную) группу, каждая из которых имеет третичный углеродный атом, соседний с атомом серы. 16. Способ по п.15, отличающийся тем, что окисляющим агентом является перуксусная кислота. 17. Способ по п.16, отличающийся тем, что первым сильным основанием является алкиллитий. 18. Способ по п.17, отличающийся тем, что первым сильным основанием является нбутиллитий. 19. Способ по п.17, отличающийся тем, что хлорангидридом кислоты является сульфонилхлорид и R4 представляет SO2(C1-C6 алкил),SO2(арил) или SO2(арилалкил). 20. Способ по п.19, отличающийся тем, что сульфонилхлоридом является метансульфонилхлорид. 21. Способ по п.17, отличающийся тем, что вторым сильным основанием является алкоксид металла. 22. Способ по п.21, отличающийся тем, что алкоксидом металла является трет-бутоксид калия. 23. Способ по п.22, в котором R3 представляет термически или кислотонеустойчивую С 4 С 10 алкильную группу, имеющую третичный углеродный атом, соседний с атомом серы. 24. Способ по п.17, в котором R1 и R2 представляют метокси и R3 представляет третбутил. 25. Способ получения соединения формулыR3 представляет термически или кислотонеустойчивую С 4-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу,каждая из которых имеет третичный углеродный атом, соседний с атомом серы; включающий стадии: 1) взаимодействие бензилсульфида формулы где R2 и R3 принимают значения, определенные выше; с первым сильным основанием с образованием бензильного аниона; 2) конденсирование указанного бензильного аниона с бензальдегидом формулы где R1 принимает значения, определенные выше; 3) взаимодействие продукта конденсации со стадии 2 с хлорангидридом кислоты с получением сложного эфира формулыCO(C1-C6 алкил),СО(арил), СO(арилалкил), SO2(C1-C6 алкил),SO2(арил), SO2(арилалкил), СО 2(C1-C6 алкил),СО 2 (арил), СО 2(арилалкил) или CON(C1 С 6 алкил)2; 4) обработка указанного сложного эфира вторым сильным основанием с получением стирилсульфида формулы где R1, R2 и R3 принимают значения, определенные выше; и 5) окисление указанного стирилсульфида окисляющим агентом. 26. Способ по п.25, в котором R1 представляет водород, С 1-С 4 алкокси или арилалкокси иR2 представляет водород, С 1-С 4 алкокси или арилалкокси. 27. Способ по п.26, в котором R3 представляет термически или кислотонеустойчивую С 4 С 10 алкильную или арил(С 1-С 10 алкильную) группу, каждая из которых имеет третичный углеродный атом, соседний с атомом серы. 28. Способ по п.26, отличающийся тем, что окислителем является перуксусная кислота. 29. Способ по п.28, отличающийся тем, что первым сильным основанием является алкиллитий. 30. Способ по п.29, отличающийся тем, что первым сильным основанием является нбутиллитий. 31. Способ по п.29, отличающийся тем, что хлорангидридом кислоты является сульфонилхлорид и R4 представляет SO2 (C1-C6 алкил),SO2(арил) или SO2(арилалкил). 32. Способ по п.31, отличающийся тем, что сульфонилхлоридом является метансульфонилхлорид. 33. Способ по п.29, отличающийся тем, что вторым сильным основанием является алкоксид металла. 34. Способ по п.33, отличающийся тем, что алкоксидом металла является трет-бутоксид калия. 35. Способ по п.34, в котором R3 представляет термически или кислотонеустойчивую С 2 С 10 алкильную группу, имеющую третичный углеродный атом, соседний с атомом серы. 36. Способ по п.29, в котором R1 и R2 представляют метокси и R3 представляет третбутил. 37. Способ получения соединения формулыR5 и R6 независимо представляют С 1-С 4 алкил или R5 и R6 вместе с соседним атомом азота образуют гетероциклическое кольцо, выбранное из группы, состоящей из пирролидино,пиперидино, гексаметиленимино и морфолино; и 28 НХ представляет НСl или НВr; включающий стадии: а) циклизация в присутствии кислотного катализатора соединения формулыR3 представляет термически или кислотонеустойчивую С 2-С 10 алкильную, С 4-С 10 алкенильную или арил(С 1-С 10 алкильную) группу, с получением бензотиофена формулыb) ацилирование указанного бензотиофена ацилирующим агентом формулыR7 представляет хлор, бром или гидроксил; в присутствии ВХ'3, где Х' представляет хлор или бром; с) когда R1 и/или R2 представляют (ет) С 1 С 4 алкокси или арилалкокси, деалкилирование одной или нескольких фенольных групп продукта ацилирования со стадии (b) взаимодействием с дополнительным ВХ'3, где Х' принимает значения, определенные выше; иd ) необязательное выделение соединения формулы XII.
МПК / Метки
МПК: C07F 7/08
Метки: синтеза, способ, винилсульфоксиды
Код ссылки
<a href="https://eas.patents.su/15-405-vinilsulfoksidy-i-sposob-ih-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Винилсульфоксиды и способ их синтеза</a>
Предыдущий патент: Способ получения практически чистых изомеров альфа-бисоксимов
Следующий патент: Кормовые добавки для животных и корм, содержащий указанные добавки
Случайный патент: Композиция пропиленового полимера, способ ее получения и ее применение

















