Способ для лечения и/или предотвращения мигрени
Номер патента: 23267
Опубликовано: 31.05.2016
Авторы: Икеда Дзунити, Курокава Масако, Итикава Сундзи, Канда Томоюки
Формула / Реферат
1. Способ для лечения и/или предотвращения мигрени, который включает введение эффективного количества соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленное следующей формулой (II):
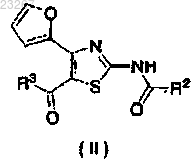
где R2 представляет собой фенил, пиридил, пиримидинил, 5,6-дигидро-2H-пиридилметил или тетрагидропиранилокси, или любую из этих групп, замещенную 1-3 заместителями, выбранными из атома фтора, атома хлора, атома брома, метила, этила, метокси и этокси;
R3 представляет собой пиридил или тетрагидропиранил,
или его фармацевтически приемлемой соли в качестве единственного активного ингредиента.
2. Способ по п.1, в котором R3 представляет собой пиридил.
3. Способ по п.1, в котором R3 представляет собой тетрагидропиранил.
4. Применение соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленного следующей формулой (II):
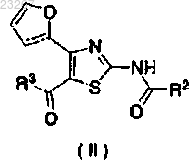
где R2 и R3 имеют соответственно те же самые значения, как указано выше,
или его фармацевтически приемлемой соли в качестве единственного активного ингредиента для изготовления терапевтического и/или профилактического средства от мигрени.
5. Применение по п.4, в котором R3 представляет собой пиридил.
6. Применение по п.4, в котором R3 представляет собой тетрагидропиранил.
Текст
СПОСОБ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ МИГРЕНИ Изобретение относится к способу для лечения и/или предотвращения мигрени, который включает введение эффективного количества соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленное следующей формулой где определения радикалов даны в формуле изобретения, в качестве единственного активного ингредиента. Данное соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, имеет сродство к аденозиновому рецептору A2A,большее в 10 раз или более, чем к аденозиновому рецептору A1. Также настоящее изобретение относится к применению соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленного следующей формулой (II) для изготовления терапевтического и/или профилактического средства от мигрени.(71)(73) Заявитель и патентовладелец: КИОВА ХАККО КИРИН КО., ЛТД. Область техники Настоящее изобретение относится к лечению и/или профилактики мигрени. Уровень техники Мигрень представляет собой пароксизмальную головную боль, которая продолжается 4-72 ч, сопровождающуюся тошнотой, рвотой, чувствительностью к свету, чувствительностью к звуку и т.п. [TheInternational Classification of Headache Disorders-II: ICHD-II, 2004]. Вазодилация во вне- или внутричерепных кровеносных сосудах, включая поверхностную височную артерию, предполагалась в качестве одной из патофизиологии мигрени и ее патогенеза. [Arch. Neurol. Psychiatr., Vol.39, p.737-763(1938);Cephalagia, Vol.1, p.143-147 (1981); Internal medicine, Vol.81, p.601-609 (1998); Internal Medicine, Vol.81,p.639 (1998)]. Также было известно, что алкалоид спорыньи и суматриптан, гидрофильные агонисты серотонинового рецептора 5-HT1 (5-гидрокситриптамин 1), которые не пересекают гематоэнцефалический барьер, являются эффективными для лечения мигрени, так как эти агонисты действуют на серотониновый рецептор 5-НТ 1 в черепно-мозговой гладкой мускулатуре сосудов для сужения расширенных кровеносных сосудов [Ann. N.Y. Acad. Sci., Vol. 600, p. 587-600 (1990); Neurology, Vol. 43, p. S43-S47 (1993)]. Таким образом, считается, что мигрень можно лечить путем подавления вазодилации во вне- или внутричерепных кровеносных сосудах. Касательно причины начала мигрени также имелись сообщения,в которых выдвигались теории, основанные на нейрогенном воспалении вокруг тройничного нерва или мозгового кровеносного сосуда, или вокруг кровеносного сосуда твердой мозговой оболочки, или основанные на активации центрального нерва, также как и в кортикально распространяющейся депрессии[Lancet, Vol. 363, p. 381-391 (2004)]. Существуют дополнительные сообщения касательно мигрени (см. непатентные документы 1-3). Некоторые примеры терапевтических средств от мигрени, используемых в настоящее время в клинической практике, включают нестероидные противовоспалительные анальгетики, такие как триптаны(например, суматриптан) и ибупрофены. Что касается профилактических средств, в настоящее время в клинической практике используются, например, противоэпилептические средства, такие как топирамат и средства - антагонисты кальция, такие как флунаризин. Известно, что концентрация аденозина в плазме крови страдающего мигренью пациента через час после приступа мигрени увеличивается в среднем на 68% от таковой во время нормального периода, и что активация аденозинового рецептора A2A аденозином подавляет обратный захват серотонина тромбоцитами способом, который зависит от концентрации аденозина, и вызывает вазолидацию в качестве результата быстрого выброса серотонина [Can. J. Neurol. Sci., Vol. 2, p. 55-58 (1998)]. Далее известно, что внутривенное введение усилителя аденозина страдающему мигренью пациенту вызывает приступ мигрени [Med. J. Aust., Vol. 162, p. 389-390 (1995)]. Также известно, что аденозин обладает сильным сосудорасширяющим действием, и что аденозиновый рецептор A2A и аденозиновый рецептор A2B вовлечены в вазолидацию во время мигрени и в вызванную аденозином вазолидацию [Am. J. Physiol. Heart Circ. Physiol., Vol. 280, p. 2329-2335 (2000)]. Таким образом, считается, что мигрень можно лечить путем подавления вызванной аденозином вазолидации. Известно, что кофеин, который имеет неселективную антагонистическую активность к аденозину,облегчает мигрень; однако кофеин имеет побочные эффекты, а именно, психиатрическую зависимость и вызывает головную боль отмены кофеина [см. Pain, 1991, Vol. 44, p. 151-155; Drugs, 1998, Vol. 49, p. 3750]. Далее известно, что производные ксантина являются пригодными в качестве терапевтических лекарств от мигрени (см. патентный документ 1). Известно, что аденозин в большом количестве распределен по всему телу и оказывает ряд физиологических воздействий на центральную нервную систему, сердечную мышцу, почки, гладкую мышцу и т.п. через свои рецепторы (см. непатентный документ 4). Например, известно, что антагонисты аденозина-A1 способствуют дефекации (Jpn. J. Pharmacol.,1995, Vol. 68, p. 119). Далее известна вовлеченность аденозинового рецептора A2A, в особенности, в центральную нервную систему. Известно, что антагонисты аденозинового рецептора A2A являются пригодными в качестве, например, терапевтических лекарств от болезни Паркинсона (см. непатентный документ 5) или терапевтических лекарств от нарушения сна (см. Nature Neuroscience, 2005, p. 1; патентный документ 2). Существует ряд сообщений касательно связи между аденозиновыми рецепторами и мигренью (см. непатентные документы 6-13). Например, соединения, представленные следующими формулами (I), (II), (III), (IV), (V), (VI) и(VII), известны в качестве соединений, имеющих селективную антагонистическую активность по отношению к аденозиновому рецептору A2A (см. патентные документы 3-9 и непатентные документы 14 и 15).(где R1 представляет собой метил, этил, пропил, бутил или 3-метилбутил, или любую из этих групп,замещенную гидрокси; R2 представляет собой фенил, пиридил, пиримидинил, 5,6-дигидро-2Hпиридилметил или тетрагидропиранилокси, или любую из этих групп, замещенную 1-3 заместителями,выбранными из атома фтора, атома хлора, атома брома, метила, этила, метокси и этокси; R3 представляет собой пиридил или тетрагидропиранил; R4 и R5 могут быть одними и теми же, или различными, и каждый представляет собой атом водорода, атом фтора или 2-метоксиэтокси; и R6 представляет собой метил,этил, пропил или бутил). Документы из известного уровня техники Патентные документы: патентный документ 1: WO 2005/072739,патентный документ 2: WO 2007/015528,патентный документ 3: WO 98/42711,патентный документ 4: WO 00/17201,патентный документ 5: WO 2005/063743,патентный документ 6: WO 2002/055524,патентный документ 7: WO 2003/011864,патентный документ 8: WO 2006/032273,патентный документ 9: WO 2002/055083. Непатентные документы: непатентный документ 1: Proceedings of the National Academy of Sciences of the United States ofAmerica, 2001, Vol. 98, p. 4687; непатентный документ 2: Nature Neuroscience, 2007, Vol. 10, p. 754 непатентный документ 3: Neurological Research, 2005, Vol. 27, p. 175 непатентный документ 4: Nature Reviews Drug Discovery, 2006, Vol. 5, p. 247 непатентный документ 5: Progress in Neurobiology, 2007, Vol. 83, p. 332 непатентный документ 6: Can. J. Neurol. Sci., 1998, Vol. 253, p. 55 непатентный документ 7: Cephalalgia, 2006, Vol. 26, p. 925 непатентный документ 8: Cephalalgia, 2007, Vol. 27, p. 177 непатентный документ 9: Brain, 2002, Vol. 125, p. 1392 непатентный документ 10: Am. J. Physiol., 2001, Vol. 281, Н 2018-Н 2027 непатентный документ 11: J. Pharmacol. Sci., 2004, Vol. 94, p. 100 непатентный документ 12: Pharmacological Reviews, 1999, Vol. 51, p. 83 непатентный документ 13: PharmacologyTherapeutics, 2006, Vol. 112, p. 199 непатентный документ 14: European Journal of Pharmacology, 1994, Vol. 267, p. 335 непатентный документ 15: BioorganicMedicinal Chemistry Letters, 2007, Vol. 17, p. 1376. Цель изобретения и краткое описание Задачи, которые изобретение должно решить Задачей изобретения является создание способа лечения и/или профилактики мигрени, который включает введение соединения, обладающего антагонистической активностью по отношению к аденозиновому рецептору A2A, или его фармацевтически приемлемой соли и т.п. Способы решения задач Изобретение относится:(1) к способу для лечения и/или профилактики мигрени, который включает введение эффективного количества соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленного следующей формулой (II)-2 023267 где R2 представляет собой фенил, пиридил, пиримидинил, 5,6-дигидро-2H-пиридилметил или тетрагидропиранилокси, или любую из этих групп, замещенную 1-3 заместителями, выбранными из атома фтора, атома хлора, атома брома, метила, этила, метокси и этокси;R3 представляет собой пиридил или тетрагидропиранил,или его фармацевтически приемлемой соли в качестве единственного активного ингредиента. Причем соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, имеет сродство к аденозиновому рецептору A2A, большее в 10 раз или более, чем к аденозиновому рецептору А 1.(4) Применению соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, или его фармацевтически приемлемой соли для изготовления терапевтического и/или профилактического средства от мигрени. Причем соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, имеет сродство к аденозиновому рецептору A2A, большее в 10 раз или более, чем к аденозиновому рецептору A1.(6) Применению по (4), в котором R3 представляет собой тетрагидропиранил. Способ по изобретению предназначен для лечения мигрени, в котором мигрень представляет собой мигрень с аурой или мигрень без ауры. Эффекты от изобретения Настоящее изобретение может обеспечить применение терапевтического и/или профилактического средства, включающего в качестве активного ингредиента соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A или его фармацевтически приемлемую соль для лечения мигрени. Способы осуществления изобретения Соединение, применяемое в настоящем изобретении, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A предпочтительно представляет собой соединение, которое имеет сильную антагонистическую активность по отношению к аденозиновому рецептору A2A среди различных подтипов (например, аденозиновых рецепторов A1, A2A, A2B и А 3) аденозиновых рецепторов. Соответственно, соединение, имеющее сильную антагонистическую активность по отношению к аденозиновому рецептору A2A, является предпочтительным в качестве соединения, имеющего селективную антагонистическую активность по отношению к аденозиновому рецептору A2A. Например, соединение предпочтительно представляет собой соединение, которое имеет 50% или более ингибирующий эффект при концентрации исследуемого соединения 310-8 моль/л, более предпочтительно, соединение,имеющее 50% или более ингибирующий эффект при концентрации исследуемого соединения 110-8 моль/л, далее предпочтительно соединение, имеющее 50% или более ингибирующий эффект при концентрации исследуемого соединения 310-9 моль/л, еще более предпочтительно соединение, имеющее 50% или более ингибирующий эффект при концентрации исследуемого соединения 110-9 моль/л, как определено испытанием на связывание с аденозиновым рецептором A2A, описанным в пробном примере 1 ниже. Далее соединение предпочтительно представляет собой соединение, имеющее ингибирующий эффект с константой ингибирования (значение Ki; получено в том же испытании), составляющий 30 нмоль/л или меньше, более предпочтительно соединение, имеющее ингибирующий эффект с константой ингибирования, составляющий 10 нмоль/л или меньше, далее предпочтительно соединение, имеющее ингибирующий эффект с константой ингибирования, составляющий 3 нмоль/л или меньше, даже более предпочтительно соединение, имеющее ингибирующий эффект с константой ингибирования, составляющий 1 нмоль/л или меньше. Далее соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, используемое в настоящем изобретении, предпочтительно представляет собой соединение, обладающее селективным сродством к аденозиновому рецептору A2A среди различных подтипов аденозиновых рецепторов. Например, соединение, имеющее более высокое сродство к аденозиновому рецептору A2A, чем к аденозиновому рецептору A1, является предпочтительным. Конкретно,соединение предпочтительно представляет собой, например, соединение, имеющее сродство в 5 раз или более, более предпочтительно сродство в 10 раз или более, даже более предпочтительно сродство в 100 раз или более, наиболее предпочтительно сродство в 500 раз или более высокое к аденозиновому рецептору A2A, чем таковое к аденозиновому рецептору A1. Сродство может быть определено в соответствии с обычным способом, например в соответствии со способом из примера 1 испытаний ниже, или со способами, описанными, например, в Naunyn Schmiedebergs Arch Pharmacol., 1987, 355(1), p. 59-63; Naunyn Schmiedebergs Arch Pharmacol., 1987, 355(2), p.204210; или Br. J. Pharmacol. 1996, 117(8), p.1645-1652. Фармацевтически приемлемые соли соединения, обладающего селективной антагонистической ак-3 023267 тивностью по отношению к аденозиновому рецептору A2A, используемого в настоящем изобретении,включают, например, фармацевтически приемлемые соли присоединения кислоты, соли металлов, аммонийные соли, соли присоединения органического амина, соли присоединения аминокислоты и т.п. Фармацевтически приемлемые соли присоединения кислоты соединения, имеющего селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, используемому в настоящем изобретении, включают, например, соли неорганических кислот, такие как гидрохлорид, гидробромат, нитрат, сульфат и фосфат; соли органических кислот, такие как ацетат, оксалат, малеат, фумарат,цитрат, бензоат и метансульфонат и т.п. Примеры фармацевтически приемлемых солей металлов включают соли щелочных металлов, такие как соль натрия и соль калия; соли щелочно-земельных металлов,такие как соль магния и соль кальция; соль алюминия; соль цинка и т.п. Примеры фармацевтически приемлемых аммонийных солей включают соли аммония, тетраметиламмония и т.п. Примеры фармацевтически приемлемых солей присоединения органического амина включают соли присоединения морфолина, пиперидина и т.п. Примеры фармацевтически приемлемых солей присоединения аминокислот включают соли присоединения лизина, глицина, фенилаланина, аспарагиновой кислоты, глутаминовой кислоты и т.п. Соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, или фармацевтически приемлемая соль, используемые в способе настоящего изобретения, могут быть изготовлены в соответствии с обычно известными способами, соответственно. Например, соединение (II) может быть изготовлено в соответствии со способами, описанными, например, вWO 2005/063743 и т.п. Соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, используемые в способе лечения по настоящему изобретению, могут существовать в виде стереоизомеров, таких как геометрические изомеры или оптические изомеры,или таутомеры. Эти и все другие возможные изомеры и смеси таковых также могут использоваться для,например, терапевтических и/или профилактических средств от мигрени из настоящего изобретения. Для получения соли соединения, имеющего селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, используемого в настоящем изобретении, когда соединение получают в форме соли, его можно очистить в том виде, как оно есть. Далее, когда соединение получают в свободной форме, соединение можно растворить или суспендировать в подходящем растворителе с последующим прибавлением кислоты или основания для образования соли. Затем полученную соль можно выделить и очистить. Соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A или фармацевтически приемлемые соли таковых, используемые в способе лечения и/или предотвращения мигрени по настоящему изобретению, могут существовать в виде аддукта с водой или различными растворителями. Такие аддукты также можно использовать, например, для терапевтических и/или профилактических средств от мигрени и способов лечения и/или профилактики мигрени из настоящего изобретения. Примеры расстройств, которые можно лечить и/или предотвращать при помощи, например, терапевтических и/или профилактических средств от мигрени, и способов для лечения и/или профилактики мигрени из настоящего изобретения, включают различные типы мигреней, представленные, например, вThe International Classification of Headache Disorders, 2nd edition (ICHC-II) (The International Headache society (IHS) 2003). Конкретные примеры включают мигрень без ауры, мигрень с аурой, детские периодические синдромы (с частым переходом в мигрень), ретинальную мигрень, осложнения мигрени, вероятную мигрень и т.п. Таковые включают мигрени у женщин во время менструации, такие как менструальную мигрень, мигрени, происходящие у молодых, такие как детская мигрень и т.п. В ниже описана биологическая активность типичных соединений, имеющих селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, на основании примеров испытания, которые используют в настоящем способе. Пример испытания 1. Активность связывания с аденозиновым рецептором.(1) Испытание на связывание с аденозиновым рецептором A2A. Испытание проводят в соответствии с методом Bruns и др. (Molecular Pharmacology, Vol. 29, p. 331,1986). Стриатум крысы (крыса SD, Japan SLC, Inc.) суспендируют в 50 мл охлажденного льдом буферного раствора гидрохлорида трис(гидроксиметил)аминометана (Tris HCl) (50 ммоль/л, рН 7,7) с использованием гомогенизатора Polytron (Kinematica, Inc.). Суспензию центрифугируют (48000g, 20 мин) и получившийся осадок снова суспендируют путем добавления к нему того же самого количества буферного раствора Tris HCl (50 ммоль/л) с последующим центрифугированием при тех же условиях. Получившийся конечный осадок суспендируют в буферном растворе Tris HCl (50 ммоль/л) [содержащем хлорид магния (10 ммоль/л) и аденозиндеаминазу (0,02 ед/мг ткани)(Sigma)] для приготовления суспензии при концентрации ткани, составляющей 5 мг (масса во влажном состоянии)/мл. К 100 мкл очищенной клеточной суспензии добавляют 80 мкл меченого тритием CGS-21680 3 Н-2[п-(2-карбоксиэтил)фенетиламино]-5'-(N-этилкарбоксамидо)аденозина: 40 ки/моль; New England Nuclear[The Journal of Pharmacology and Experimental Therapeutics, Vol. 251, p. 888, 1989] (конечная концентрация в 6,0 ммоль/л), и 20 мкл раствора испытываемого соединения (раствор испытываемого соединения в диметилсульфоксиде, разбавленный буферным раствором Tris HCl). Смесь оставляют стоять при 25 С в течение 120 мин с последующим быстрым фильтрованием с отсасыванием с использованием фильтровальной бумаги из стекловолокна (CF/C; Whatman), и затем немедленно промывают три раза 200 мкл охлажденного льдом буферного раствора Tris HCl (50 ммоль/л). Фильтровальную бумагу из стекловолокна затем помещают во флакон, и добавляют жидкость MicroScinti (PKI). Затем измеряют радиоактивность при помощи TopCount (Perkin-Elmer). Процентная доля ингибирования связывания с аденозиновым рецептором A2A (связывание с 3HCGS21680) испытываемого соединения может быть подсчитана при помощи следующего уравнения: В уравнении общая степень относится к связанной радиоактивности 3H-CGS21680 в отсутствие испытываемого соединения. Степень неспецифического связывания относится к связанной радиоактивности 3H-CGS21680 в присутствии 100 мкмоль/л циклопентиладенозина (СРА; Sigma). Степень связывания в присутствии лекарственного средства относится к связанной радиоактивности 3H-CGS21680 в присутствии испытываемого соединения. В вышеприведенном испытании процентную долю ингибирования для аденозинового рецептораA2A при различных концентрациях испытываемого соединения или его фармацевтически приемлемой соли, и концентрацию испытываемого соединения, при которой испытываемое соединение ингибирует связывание на 50% (IC50) можно подсчитать путем соответствующей корректировки концентрации испытываемого соединения. Константу ингибирования (значение Ki) испытываемого соединения для связывания с аденозиновым рецептором можно подсчитать в соответствии со следующим уравнением. В уравнении L обозначает концентрацию 3H-CGS21680, используемого в испытании, и Kd представляет собой константу диссоциации 3H-CGS21680, используемого в испытании. Вместо 3H-CGS21680 можно использовать, например, 3H-SCH58261 [3 Н-5-амино-7-(2-фенилэтил)-2(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (синтезированный GE healthcare bio-sciences)]. Сродство испытываемого соединения к аденозиновому рецептору A2A может быть подтверждено при помощи вышеуказанного испытания.(2) Испытание на связывание с аденозиновым рецептором A1. Константу ингибирования (значение Ki) испытываемого соединения для аденозинового рецептораA1 можно подсчитать таким же способом, как в (1), с использованием нижеприведенных материалов. Конкретно используют, например, клеточную мембрану крысы, экспрессирующую рецептор А 1(PerkinElmer), и в качестве меченого соединения используют, например, меченый тритием СНА [N6 циклогесиладенозин (PerkinElmer)]. Для измерения степени неспецифического связывания измеряют связанную радиоактивность 3 Н-СНА в присутствии, например, 10 мкмоль/л DPCPX [1,3-дипропил-8 циклопентилксантина (Sigma)]. Сродство испытываемого соединения к аденозиновому рецептору A1 может быть подтверждено при помощи вышеуказанного испытания. При помощи вышеуказанных испытаний (1) и (2) может быть подтверждено селективное сродство соединений (I)-(VII) и им подобных к аденозиновому рецептору A2A. Некоторые примеры сродства к аденозиновому рецептору A2A, в том виде, как они установлены при помощи вышеуказанного испытания с соединениями, имеющими селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, или их фармацевтически приемлемыми солями,используемыми в настоящем изобретении, представлены ниже. К настоящему изобретению относятся только соединения II и их конкретные представители IIA, IIC и т.д. Испытания других соединений формул I, III и т.д. представлены только для общей информации. Таблица 1: Процентная доля ингибирования при 100 нмоль/л соединения (IA).: Процентная доля ингибирования при 1000 нмоль/л соединения (IB). Пример испытания 2. Активность связывания с аденозиновым рецептором (2).(1) Испытание на связывание с аденозиновым рецептором A2A человека. Испытание проводят в соответствии с методом, например, Varani и др. [British Journal of Pharmacol-5 023267ogy, Vol. 117, p. 1693 (1996)]. Конкретно, например, рекомбинантные аденозиновые рецепторы A2A человека экспрессируются в клетках НЕК-293. Клеточные мембраны экспрессирующих рецепторы клеток собирают и приготавливают суспензию клеточных мембран. После разбавления буферным растворомTris HCl, к суспензии клеточных мембран добавляют меченый тритием CGS-21680 (50 ммоль/л) и раствор испытываемого соединения (раствор испытываемого соединения в диметилсульфоксиде) для связывания с рецепторами. После реакции смесь подвергают быстрому фильтрованию с отсасыванием с использованием фильтровальной бумаги из стекловолокна и измеряют радиоактивность фильтровальной бумаги из стекловолокна. Таким образом может быть определена процентная доля ингибирования связывания с аденозиновым рецептором A2A (связывания с 3H-CGS21680) для испытываемого соединения. Процентная доля ингибирования может быть подсчитана при помощи следующего уравнения: В уравнении общая степень связывания относится к связанной радиоактивности 3H-CGS21680 в отсутствие испытываемого соединения. Степень неспецифического связывания относится к связанной радиоактивности 3H-CGS21680 в присутствии 50 мкмоль/л 5'-N-этиладенозинкарбоксамида (NECA) или 100 мкмоль/л СРА. Степень связывания в присутствии лекарственного средства относится к связанной радиоактивности 3H-CGS21680 в присутствии испытываемого соединения. В вышеприведенном испытании процентную долю ингибирования для аденозинового рецептораA2A человека при различных концентрациях испытываемого соединения или фармацевтически приемлемой соли, и концентрации испытываемого соединения, при которой испытываемое соединение ингибирует связывание на 50% (IC50) можно подсчитать путем соответствующей корректировки концентрации испытываемого соединения. Константу ингибирования (значение Ki) испытываемого соединения для связывания с аденозиновым рецептором можно подсчитать в соответствии со следующим уравнением. В уравнении L обозначает концентрацию 3H-CGS21680, используемого в испытании, и Kd представляет собой константу диссоциации 3H-CGS21680, используемого в испытании. Вместо 3H-CGS21680 можно использовать, например, 3 Н-SCH58261.(2) Испытание на связывание с аденозиновым рецептором A1 человека. Константу ингибирования (значение Ki) испытываемого соединения для аденозинового рецептораA1 человека можно подсчитать таким же способом, как в (1), с использованием нижеприведенных материалов. Конкретно используют, например, экспрессирующие рецептор А 1 человека клеточные мембраны СНО, и в качестве меченого соединения используют, например, меченый тритием DPCPX. Степень неспецифического связывания можно определить путем измерения связанной радиоактивности 3H-DPCPX в присутствии, например, 100 мкмоль/л R(-)-PIA-)-N6-2-фенилизопропиладенозина). Сродство испытываемого соединения к аденозиновому рецептору А 1 человека может быть подтверждено этим способом. При помощи вышеуказанных испытаний (1) и (2) может быть подтверждено селективное сродство соединений (I)-(VII) и им подобных к аденозиновому рецептору A2A человека.(3) Сродство соединения или фармацевтически приемлемой соли, используемых в настоящем изобретении, к аденозиновому рецептору человека. Некоторые примеры сродства соединений (IIA)-(IID) к аденозиновому рецептору А 1 человека и к аденозиновому рецептору A2A человека представлены ниже. Результаты испытаний ниже представляют собой результаты измерений, проведенных MDS Pharma Services Inc. в соответствии с вышеуказанными методами. Таблица 2. Сродство к аденозиновым рецепторам Процентная доля ингибирования при 100 нмоль/л соединения Селективное сродство соединений (IIA)-(IID) к аденозиновому рецептору A2A человека было подтверждено вышеуказанными испытаниями. Пример испытания 3. Эффект церебрального сужения сосудов. Собак анестезировали путем внутривенного введения пентобарбитала натрия, обескровили путем обезглавливания и подвергли краниотомии. Базилярные артерии удалили, и приготовили кольцевидные препараты церебральной гладкой мускулатуры сосудов, имеющие размер примерно 2 мм в ширину. Каждый кольцевидный препарат закрепили на инъекционной игле (разрезанной на 2-мм кусочки) при помощи шелковой нити. Инъекционную иглу закрепили в держателе, установленном в Easy Magnus Device (модель: UC-2; Kishimoto Medical Instruments), и оставили препарат стабилизироваться в течение 60 мин или более при напряжении покоя в 0,2 г (1,96 мН) в питательном растворе при 37 С. Церебральную гладкую мышцу сосудов расслабили при помощи 2 мкл 10 ммоль/л водного раствора аденозина, добавленного в баню (2 мл) Easy Magnus Device,и совокупно добавили испытываемое соединение в виде 1-мкл раствора 0,2 ммоль/л диметилсульфоксида, 1-мкл раствора 0,4 ммоль/л диметилсульфоксида и 0,7-мкл раствора 2 ммоль/л диметилсульфоксида в таком порядке (группа с прибавленным испытываемым соединением). Отдельно тем же способом, что и в группе с введенным испытываемым соединением, совокупно добавили диметилсульфоксид вместо испытываемого соединения (группа с прибавленным растворителем). Сокращение церебральной гладкой мышцы сосудов затем записали на регистрирующем устройстве (Yokogawa Electric Corporation) с передатчика (Ninon Kohden Corporation), присоединенного к держателю, в котором был закреплен препарат,через деформационный усилитель давления (Nihon Kohden Corporation) (n=6). Расслабление удаленной церебральной гладкой мышцы сосудов путем прибавления аденозина было подтверждено. Эффект церебрального сужения сосудов установили в качестве процентной доли ингибирования (%) вызванного аденозином расслабления церебральной гладкой мускулатуры сосудов, и провели сравнение между группой с прибавленным испытываемым соединением и группой с прибавленным растворителем. Испытание показывает, что соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, или фармацевтически приемлемая соль из настоящего изобретения могут подавлять вызванное аденозином церебрально-васкулярное расслабление. Результат вышеприведенного испытания подтвердил, что группа с прибавленным соединением(IIC; 10 нмоль/л) имела значительный подавляющий эффект (процентная доля ингибирования: 97,4%1,8%) по сравнению с группой с прибавленным растворителем (процентная доля ингибирования: 0,67,6%). Результат, таким образом, дает понять, что соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, являются пригодными в качестве терапевтических и/или профилактических средств от мигрени. Пример испытания 4. Воздействие на увеличение церебрального кровотока путем электростимуляции анестезированного тройничного нерва крысы. Испытание проводили в соответствии с методом Tsukahara и др. [Cerebral Blood Flow and Metabolism, Vol. 14, p. 8 (2002)]. Крыс SD (самцов, Charles River) анестезировали путем интраперитонеального введения пентобарбитала натрия (60 мг/кг; Tokyo Chemical Industry Co., Ltd.). Шейный участок каждой крысы вскрыли и ввели трахеальный зонд. Измеряющий кровяное давление зонд ввели в правую феморальную артерию. Крысу закрепили в стереотаксическом инструменте (стереотаксический инструмент для крыс; SummitMedical), и поддерживали температуру тела при 37 С на поддерживающей температуру тела обогревающей грелке (модель: СМА/150; Carnegie Medicine). Для создания черепного окна с диаметром 5 мм (центральная координата черепного окна АР: - 1,5; L: -1; Н: -1,5) использовали электрическую дрель (модель: С-201; Urawa Kogyo), и замерили церебральный кровоток. Для измерения церебрального кровотока использовали лазерный допплеровский расходомер (модель: ALF-2100; Advance). Каждое среднее значение кровяного давления записали на регистрирующем устройстве (модель: РЕ 3066; Yokogawa Electric Corporation) при помощи измерения с датчика давления (модель: DX-312, Nihon Kohden Corporation) через деформационный усилитель давления (модель: AP-612GA; Nihon Kohden Corporation) с использованием многоканальной системы (модель: RM6000; Nihon Kohden Corporation). Парциальное давление газа артериальной крови (рН, РаО 2, РаСО 2) измерили с использованием портативной системы анализа крови (модель: AVL-OPTI-CCA; Sysmex). Дистальную часть тройничного нерва отсоединили и закрепили на стимуляционном двухполюсном электроде (вольфрамовая нить, 5 мм шириной). Для электростимуляции через тройничный нерв подавали прямоугольную волну (30 Гц, 2-8 В), которая показывала максимальное увеличение кровотока, с использованием биоэлектростимулятора (модель: SEN-3301; Nihon Kohden Corporation) и изолятора (модель:SS-210J; Nihon Kohden Corporation). Электростимуляцию тройничного нерва поддерживали в течение 30 секунд с 5-минутными интервалами, и испытываемое соединение или растворитель вводили после того,как стимулированный кровоток становился стабильным. Измерили изменения в церебральном кровотоке от электростимуляции после 10, 20 и 30 мин с момента введения и сравнили эффекты от испытываемого соединения и растворителя. Когда соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A из настоящего изобретения, использовали в качестве испытываемого соединения, увеличение во внутричерепном церебральном кровотоке путем активации тройничного нерва подавлялось в группе с введенным испытываемым соединением. Исходя из этих результатов считается, что соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, являются эффективными в качестве терапевтических и/или профилактических средств от мигрени. Пример испытания 5. Воздействие на кровоизлияние в твердую мозговую оболочку, вызванное электростимуляцией тройничного нерва анестезированной крысы. Крыс SD (самцов, Charles River) анестезировали путем интраперитонеального введения пентобарбитала натрия (60 мг/кг, Tokyo Chemical Industry Co., Ltd.). Дистальную часть тройничного нерва отсоединили и закрепили на стимуляционном двухполюсном электроде (вольфрамовая нить, 5 мм шириной). По истечении 5 мин от внутривенного введения синего Эванса (10% мас.ч./об., 30 мл/кг; Sigma) тройничный нерв подвергали электростимуляции в течение 30 с таким же способом, как в испытательном примере 3. После немедленной транскардиальной перфузии физиологическим солевым раствором в течение 5 мин твердую мозговую оболочку удалили и взвесили для нахождения мокрой массы. Синий Эванса из твердой мозговой оболочки экстрагировали формамидом (Wako Pure Chemical Industries, Ltd.) при 60 С в течение 24 ч, и измерили поглощение при 625 нм с использованием абсорбционного спектрометра (модель: Power Wave X; Bio-Tec-instruments). Концентрацию синего Эванса в экстракте рассчитали от калибровочной кривой, построенной с помощью стандартного образца синего Эванса, и ввели поправку на массу твердой мозговой оболочки. Испытываемое соединение или растворитель вводили за 30 мин до электростимуляции. Утечку синего Эванса в твердую мозговую оболочку сравнили между группой с введенным испытываемым соединением и группой с введенным растворителем. Было показано, что кровоизлияние в твердую мозговую оболочку, обусловленное активацией тройничного нерва, можно подавить в группе с введенным испытываемым соединением, когда соединение,обладающее селективной антагонистической активностью по отношению к аденозиновому рецепторуA2A из настоящего изобретения, используют в качестве испытываемого соединения. По результату испытаний считается, что соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, являются эффективными в качестве терапевтических и/или профилактических средств от мигрени. Пример испытания 6. Действие на кортикально распространяющуюся депрессию у анестезированной крысы. Испытание проводили с использованием в качестве показателя повторяющегося увеличения вторичного церебрального кровотока при помощи кортикально распространяющейся депрессии [NeuroReport, Vol. 17, p. 1709 (2006)]. Существует сообщение о том, что профилактирующие средства от мигрени имеют подавляющее воздействие на кортикально распространяющуюся депрессию [Annals of Neurology,Vol. 59, p. 652 (2006)]. Крыс SD (самцов, Charles River) анестезировали путем интраперитонеального введения пентобарбитала натрия (60 мг/кг; Tokyo Chemical Industry Co., Ltd.). Шейный участок каждой крысы вскрыли и ввели трахеальный зонд. Измеряющий кровяное давление зонд ввели в правую феморальную артерию. Крысу закрепили в стереотаксическом инструменте (стереотаксический инструмент для крыс; SummitMedical), и поддерживали температуру тела при 37 С на поддерживающей температуру тела обогревающей грелке (модель: СМА/150; Carnegie Medicine). Вокруг мозговой коры сделали два черепных окна с диаметром 5 мм (черепное окно для измерения кровотока; АР: -1,5; L: -1; Н: -1,5; и черепное окно, использованное для ввода раствора хлорида калия; АР: -4,5; L: -1; Н: -4,5). Для измерения церебрального кровотока использовали лазерный допплеровский расходомер (модель: ALF-2100; Advance). Среднее значение кровяного давления записали на регистрирующем устройстве (модель: Тип 3066; YokogawaElectric Corporation) при помощи измерения с датчика давления (модель: DX-312, Nihon Kohden Corporation) через деформационный усилитель давления (модель: AP-612GA; Ninon Kohden Corporation) с использованием многоканальной системы (модель: RM6000; Nihon Kohden Corporation). Парциальное давление газа артериальной крови (рН, РаО 2, РаСО 2) измерили с использованием портативной системы анализа крови (модель: AVL-OPTI-CCA; Sysmex). После ввода раствора хлорида калия (2 моль/л, 0,01 мл) через черепное окно измерили изменения в церебральном кровотоке после 30-минутного периода времени для оценки кортикально распространяющейся депрессии. Испытываемое соединение или растворитель вводили за 30 мин до ввода хлорида калия. Влияние на повторяющееся увеличение церебрального кровотока сравнили между группой с введенным испытываемым соединением и группой с растворителем. Было показано, что повторяющееся увеличение церебрального кровотока можно подавить в группе с введенным испытываемым соединением, когда соединение, имеющее селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, или фармацевтически приемлемая соль из настоящего соединения используют в качестве испытываемого соединения. По результату испытаний считается, что соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A являются эффективными в качестве профилактических средств от мигрени. Также по результату испытаний считается, что путем многократного ввода соединений, имеющих селективную антагонистическую активность по отношению к аденозиновому рецептору A2A не развивается устойчивость к лекарственному средству. Соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, или его фармацевтически приемлемая соль из настоящего изобретения могут быть введены отдельно. Однако обычно соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, или его фармацевтически приемлемая соль из настоящего изобретения, предпочтительно создается в виде различных фармацевтических препаратов. Такие фармацевтические препараты могут быть использованы для животных и людей. Фармацевтический препарат может содержать в качестве активного ингредиента соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A,или фармацевтически приемлемая соль либо отдельно, либо в качестве смеси с любым другим терапевтически активным ингредиентом. При этом эти фармацевтические препараты изготовляют путем смешивания активного ингредиента с одним или более фармацевтически приемлемым носителем (например,разбавителями, растворителями, вспомогательными веществами или им подобными), и затем подвергания смеси воздействию любого способа, хорошо известного в области техники - фармацевтики. Что касается пути введения, то предпочтительным является выбрать наиболее эффективный путь введения для лечения. Примеры пути введения включают пероральное введение и парентеральное введение, например, такое как внутривенное, назальное и ингаляционное введение. Примеры лекарственных форм включают таблетки, инъекции, назальные препараты, ингаляции и т.п. Подходящие лекарственные формы для перорального введения, например, таблетки, можно изготовить путем использования вспомогательных веществ, таких как лактоза, размельчителей, таких как крахмал, скользящих веществ, таких как стеарат магния, или связующих веществ, таких как гидроксипропилцеллюлоза или им подобных. Подходящие лекарственные формы для парентерального введения, например инъекции, можно изготовить путем использования разбавителей или растворителей, таких как физиологический раствор,раствор глюкозы или смеси соляного раствора и раствора глюкозы, или им подобных. Назальный препарат можно изготовить в виде препарата-раствора, например, путем добавления активного ингредиента к стерильной очищенной воде с необязательным(и) компонентом(ами), включающими, например, вещества, регулирующие тоничность, такие как хлорид натрия, антисептики, такие как сложный эфир п-гидроксибензойной кислоты, буферные вещества, такие как фосфатный буфер или т.п. Альтернативным образом назальный препарат можно приготовить в виде препарата-суспензии путем смешивания активного ингредиента с диспергатором(ами), таким(и) как полиэтиленгликоль 400 или ему подобные, или в виде порошкового препарата путем смешивания активного ингредиента с носителем(ями), таким(и) как гидроксипропилцеллюлоза с необязательным(и) компонентом(ами), включающим(и), например, прилипающее(ие) к слизистым оболочкам основание(ия), такие как карбопол или им подобные. Ингаляции можно изготовить путем примешивания активного ингредиента, либо в порошковой,либо в жидкой форме, к ингаляционному(ым) аэрозолю(ям) или носителю(ям), и путем заряжания смеси в ингалятор(ы) или в ингалятор(ы) сухого порошка. Можно использовать широкий ряд обычно известных ингаляционных аэрозолей, включающих, например, хлорфторуглеродный газ, такой как CFC-11; альтернативный CFC-газ, такой как HFA-227; углеводородный газ, такой как пропан, изобутан и н-бутан; диэтиловый эфир; газ азот; газ диоксид углерода и т.п. Можно использовать широкий ряд обычно известных носителей, включающий, например, сахара, сахарные спирты, аминокислоты и т.п. Предпочтительные примеры включают лактозу, D-маннит и т.п. Дозировки и частоты введения соединения, имеющего селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, или фармацевтически приемлемой соли из настоящего изобретения, могут варьироваться в зависимости от лекарственной формы, возраста и массы тела пациента, природы или серьезности излечиваемого симптома или тому подобного. В пероральном введении, в общем, дозу в 0,001-1000 мг, предпочтительно, 0,05-100 мг вводят взрослому пациенту один или несколько раз в день. В парентеральном введении, таком как внутривенное введение, назальное введение и ингаляция, в общем дозу в 0,001-1000 мг, предпочтительно 0,01-100 мг один или несколько раз в день. Однако эти дозировки и частоты введения могут варьироваться в зависимости от различных условий,описанных выше. Настоящее изобретение, включающее применение соединения формулы II для изготовления терапевтического и/или профилактического средства от мигрени и способы лечения и/или предотвращения мигрени оказывает превосходное терапевтическое и/или профилактическое воздействие на головную боль, такую как мигрень. Далее, как описано выше, соединения, имеющие селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, включающие, например, соединения(I)-(VII) и т.п., или фармацевтически приемлемые соли таковых можно использовать в комбинации с одним или более из других фармацевтических компонентов. Примеры других фармацевтических компонентов, использованных в комбинации, включают известные медикаменты, пригодные в качестве, например, терапевтических и/или профилактических средств от головной боли, например, такой как мигрень (PharmacologyTherapeutics, 2006, 112, p. 199212). Конкретные примеры включают агонисты 5-HT1 [например, триптаны, такие как алмотриптан, элетриптан, фроватриптан, наратриптан, ризатриптан, суматриптан и золмитриптан; агонисты 5-HT1D, такие,как PNU-109291 и PNU-142633; агонисты 5-HT1F, такие, как LY334370 и т.п.], агонисты -аминомасляной кислоты [например, такие, как вальпроат и дивальпроекс], антагонисты дофамина [например, такие, как дроперидол и локсапин], модуляторы глутамата [например, неселективные антагонисты -амино-3 гидрокси-5-метил-4-изоксазолпропионовой кислоты(АМРА)/каиновой кислоты (КА) (неселективные антагонисты АМРА/КА), такие, как LY293558 и Е 2007; метаботропные модуляторы глутаматного рецептора, такие, как ADX-10059; антагонисты NR2B, такие, как СР-101,606; антагонисты глицинового участка, такие, как ZD9379; и т.п.], агонисты аденозинового рецептора A1 [например, такие, как GR79236],антагонисты связанного с кальцитониновым геном пептида (CGRP) [например, такие, как BIBN4096BS иMK-0974], ингибиторы синтазы оксида азота (NO) [например, такие как гидрохлорид N3-метил-Lаргинина (546C88) и GW-274150], модуляторы ваниллоидного рецептора [например, такие как капсаицин, цивамид и зукапсаицин], агонисты соматостатинового рецептора, ангиотензиновые модуляторы[например, ингибиторы рецептора ангиотензина-II (AT)-1, такие как кандесартан; ингибиторы ангиотензин-конвертирующего фермента (АСЕ), такие, как лизиноприл; и т.п.], антидепрессанты [например, такие, как амитриптилин, венлафаксин, миртазапин, милнаципран и дулоксетин], противоэпилептические лекарства [например, габапентиноиды, такие как габапентин и прегабалин; топирамат; Srx-502; зонисамид; локозамид; и т.п.], блокаторы кальциевых каналов [например, такие как верапамил, флюнаризин,ломеризин и нимодипин], ацетаминофены, изометептаны, вещества спорыньи [например, такие как эрготамин и дигидроэрготамин], нестероидные противовоспалительные лекарства (NSAID) [например, такие как аспирин, диклофенак, флурбипрофен, ибупрофен, кетопрофен, мефенамовая кислота, напроксен, рофекоксиб, толфенамовая кислота и нимесулид], модуляторы адренергического рецептора [например, 2 адренергические агонисты, такие как клонидин и тизанидин; b-адренергические блокаторы, такие, как атенолол, метопролол, надолол, пропранолол, тимолол; и т.п.], антагонисты 5-НТ 2 [например, такие как метисергид и пизотифен], агонисты сигма-рецепторов (R1) [например, такие как декстрометорфан, карбетапентан и 4-IBP], модуляторы К-потока, усилители каналов-переносчиков для ионов хлора [например,такие, как BTS72664], модуляторы коннескиновых геми-каналов [например, такие, как фенаматныеNSAID], магний, рибофлавин, кофермент Q10, токсин ботулизма, тонабераст, стероидные противовоспалительные лекарства [например, такие как дексаметазон], модуляторы ацетилхолинового рецептора [например, такие как донепезил] и т.п. Лекарственная форма соединения, имеющего селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, использующегося в настоящем изобретении, при использовании в комбинации с любым(и) другим(и) фармацевтическим(и) компонентом(ами) не является конкретно ограниченной, до тех пор, пока (а) соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A и (b) другой(-ие) фармацевтический(ие) компонент(ы) комбинируют во время введения. Например, компоненты (а) и (b) можно использовать или вводить в виде одиночного средства (средство комбинации) или в виде комбинации более чем одного препарата, при условии, что эти средства изготовлены с содержанием этих компонентов. При введении в виде комбинации более чем одного препарата, препараты могут быть введены в одно и то же время, или по отдельности с временным промежутком. Предпочтительно эти препараты используют в форме, например, таблеток, инъекций, назальных препаратов, ингаляций или им подобных. Далее эти препараты изготавливают с использованием любого способа, хорошо известного в области техники - фармацевтики,как и выше. При введении в виде комбинации более чем одного препарата, например (а) первый компонент, который содержит соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A и (b) второй компонент, который содержит другой(ие) фармацевтический(ие) компонент(ы), могут быть по отдельности собраны в набор и могут быть введены тому же самому лицу одним и тем же путем или различными путями одновременно или с временным промежутком с использованием набора. Набор изготавливают в форме двух или более контейнеров (например, пузырьков, пакетиков или им подобным) с содержимым так, что первый и второй компонент можно ввести различными путями(например, тубы или им подобные) или одним и тем же путем. Материал, форма или другие параметры контейнеров не являются конкретно ограниченными до тех пор, пока, например, компоненты содержимого контейнеров не подвергаются изменениям в результате воздействия внешней температуры или све- 10023267 та или химические компоненты не выделяются из контейнеров во время хранения. Конкретно, набор может быть для таблеток, инъекций, назальных препаратов, ингаляций или им подобных. Когда соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A используют в комбинации с другим(и) фармацевтическим(и) компонентом(ами), (а) компонент, имеющий селективную антагонистическую активность по отношению к аденозиновому рецептору A2A, такой и (b) другой(ие) фармацевтический(ие) компонент(ы) можно вводить в одно и то же время или с временным промежутком. Дозировки варьируются в зависимости от комбинаций различных факторов, таких как пациент, которому вводят препарат, путь введения, расстройство и фармацевтический компонент и им подобные, и должны быть установлены в соответствии с дозировками, использующимися в клинической практике. Например, в пероральном введении в форме, например, таблеток, в общем, (а) соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A и(b) другой(ие) фармацевтический(ие) компонент(ы) дают в дозировках в 0,001-1000 мг и 0,01-3000 мг,предпочтительно 0,05-1000 мг и 0,1-3000 мг, далее предпочтительно 0,05-100 мг и 0,1-3000 мг, даже более предпочтительно 0,5-100 мг и 0,1-3000 мг, соответственно, взрослому пациенту один или несколько раз в день, либо в одно и то же время, либо с временным промежутком. Далее, например, в парентеральном введении в форме, например инъекций, в общем, (а) соединение, обладающее селективной антагонистической активностью по отношению к аденозиновому рецептору A2A и (b) другой(ие) фармацевтический(ие) компонент(ы) дают в дозировках в 0,001-1000 мг и 0,0013000 мг, предпочтительно 0,001-500 мг и 0,01-3000 мг, далее предпочтительно 0,01-300 мг и 0,01-3000 мг, даже более предпочтительно 0,01-100 мг и 0,1-3000 мг, соответственно, взрослому пациенту один или несколько раз в день, либо в одно и то же время, либо с временным промежутком. Дозировки и частоты введения (а) соединения, имеющего селективную антагонистическую активность по отношению к аденозиновому рецептору A2A и (b) другого(их) фармацевтического(их) компонента(ов) не являются ограниченными вышеуказанными примерами, потому что дозировки и частоты введения являются должным образом установленными в зависимости от эффективности активных ингредиентов, лекарственной формы, возраста и массы тела пациента, симптома и т.п. В нижеследующем при помощи примеров более конкретно описано настоящее изобретение. Стоит,однако, отметить, что объем изобретения не ограничивается нижеследующими примерами. Пример 1. Таблетка (соединение IB). Таблетки, содержащие следующие ингредиенты, изготавливают в соответствии с обычным способом. Смешивают соединение IB (40 г), лактозу (286,8 г) и картофельный крахмал (60 г), и затем в смесь добавляют 10% водный раствор гидроксипропилцеллюлозы (120 г). Получившуюся смесь замешивают в соответствии с обычным способом, гранулируют и сушат с образованием гранул для таблетирования. После добавления в смесь 1,2 г стеарата магния с последующим смешиванием смесь таблетируют в машине для получения таблеток, имеющей размер штампа в 8 мм в диаметре (модель: RT-15; Kikusui) с получением таблеток (содержащих 20 мг активного ингредиента на таблетку). Таблица 3 Пример 2. Таблетка (соединение IIC по изобретению). Таблетки, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 1. Таблица 4 Пример 3. Таблетка (соединение IIIA). Таблетки, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 1. Пример 4. Таблетка (соединение VA). Таблетки, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 1. Таблица 6 Пример 5. Инъекция (соединение IA). Инъекции, содержащие следующие ингредиенты, приготавливают в соответствии с обычным способом. Соединение IA (1 г) добавляют к дистиллированной воде для инъекции с последующим смешиванием. После доведения рН смеси до 7 путем прибавления туда хлороводородной кислоты и водного раствора гидроксида натрия, общий объем доводят до 1000 мл дистиллированной водой для инъекции. Получившуюся смесь асептически заливают в стеклянные пузырьки 2-мл порциями для получения инъекций (содержащих 2 мг активного ингредиента на пузырек). Таблица 7 Пример 6. Инъекция (соединение IIA по изобретению). Инъекции, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 5. Таблица 8 Пример 7. Инъекция (соединение IV). Инъекции, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 5. Пример 8. Инъекция (соединение VI). Инъекции, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 5. Таблица 10 Пример 9. Назальный препарат (соединение IB). Назальные препараты, содержащие следующие ингредиенты, приготавливают в соответствии с обычным способом. Соединение IB (10 мг) и хлорид натрия (0,9 г) добавляют к примерно 80 мл стерильной очищенной воды и растворяют там путем тщательного перемешивания. Затем туда добавляют стерильную очищенную воду для получения общего объема в 100 мл и для получения назальных препаратов. Полученную смесь заливают в назальные емкости порциями по 1 мл для получения назальных препаратов (содержащих 0,1 мг активного ингредиента на емкость). Таблица 11 Пример 10. Назальный препарат (соединение IIC по изобретению) Назальные препараты, содержащие следующие ингредиенты, приготавливают тем же способом, что и в примере 9. Таблица 12 Пример 11. Назальный препарат (соединение VII). Назальные препараты, содержащие следующие ингредиенты, приготавливают в соответствии с обычным способом. Гидроксипропилцеллюлозу (49 г) и карбоксиметилцеллюлозу (49 г) добавляют к соединению VII (2 г), и смесь тщательно перемешивают. Получившуюся порошковую смесь засыпают в назальные емкости порциями по 1 г для получения назальных препаратов (содержащих 0,1 г активного ингредиента на емкость). Таблица 13 Пример 12. Сухая порошкообразная ингаляция (соединение IB). Соединение IB (10 г) растирают под давлением воздуха, составляющим 5 кг/см 2 при скорости подачи в 1,5 г/мин с использованием вихревой мельницы (A-OJET; Seishin Enterprise Co., Ltd.). Измельченное соединение (I) и лактозу (Pharmatose 325M; DMV) смешивают в массовом соотношении в 1:5 для получения сухих порошкообразных препаратов. Таблица 14 Промышленная применимость Настоящее изобретение может предоставить способ лечения и/или профилактики мигрени, которые включают введение эффективного количества соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленное следующей формулой (II),которое имеет сродство к аденозиновому рецептору A2A, большее в 10 раз или более, чем таковое к аденозиновому рецептору. А также применение соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленного следующей формулой (II) для изготовления терапевтического и/или профилактического средства от мигрени. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ для лечения и/или предотвращения мигрени, который включает введение эффективного количества соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленное следующей формулой (II): где R2 представляет собой фенил, пиридил, пиримидинил, 5,6-дигидро-2H-пиридилметил или тетрагидропиранилокси, или любую из этих групп, замещенную 1-3 заместителями, выбранными из атома фтора, атома хлора, атома брома, метила, этила, метокси и этокси;R3 представляет собой пиридил или тетрагидропиранил,или его фармацевтически приемлемой соли в качестве единственного активного ингредиента. 2. Способ по п.1, в котором R3 представляет собой пиридил. 3. Способ по п.1, в котором R3 представляет собой тетрагидропиранил. 4. Применение соединения, обладающего селективной антагонистической активностью по отношению к аденозиновому рецептору A2A, представленного следующей формулой (II): где R2 и R3 имеют соответственно те же самые значения, как указано выше,или его фармацевтически приемлемой соли в качестве единственного активного ингредиента для изготовления терапевтического и/или профилактического средства от мигрени. 5. Применение по п.4, в котором R3 представляет собой пиридил. 6. Применение по п.4, в котором R3 представляет собой тетрагидропиранил.
МПК / Метки
МПК: A61P 25/06, A61K 45/00, A61K 31/52, A61K 31/427, A61K 31/519
Метки: лечения, мигрени, предотвращения, способ
Код ссылки
<a href="https://eas.patents.su/15-23267-sposob-dlya-lecheniya-i-ili-predotvrashheniya-migreni.html" rel="bookmark" title="База патентов Евразийского Союза">Способ для лечения и/или предотвращения мигрени</a>
Предыдущий патент: Способы синтеза 2(s),4(s),5(s),7(s)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов
Следующий патент: Комплект для имплантации зубов
Случайный патент: Аппарат для закрытой репозиции и наружной фиксации отломков костей таза млекопитающих



















