Солевые формы ингибитора mtor
Номер патента: 18144
Опубликовано: 30.05.2013
Авторы: Кастелано Арлиндо Л., Речка Йозеф А., Малвихилл Кристен Мишель, Вайзор Гари К.
Формула / Реферат
1. Фармацевтически приемлемая соль транс-4-[4-амино-5-(7-метокси-1Н-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты, в которой соль выбирают из L-аргининовой или трометаминовой соли.
2. Соль по п.1, в которой солевая форма представляет собой L-аргининовую соль.
3. Соль по п.1, в которой солевой формой является трометаминовая соль.
4. Соль по п.1, которая представляет собой гидратированную или сольватированную форму трометаминовой соли.
5. Соль по п.3, которая находится, по существу, в аморфной форме.
6. Соль по п.3, которая находится, по существу, в кристаллической форме.
7. Соль по п.3, которая присутствует в количестве, которое является по меньшей мере на 95 вес.% кристаллическим.
8. Соль по п.3, которая присутствует в количестве, которое является, по существу, единой кристаллической формой.
9. Соль по п.3, которая разлагается на 1 вес.% или меньше в течение 30 дней при 40°С и относительной влажности 75%.
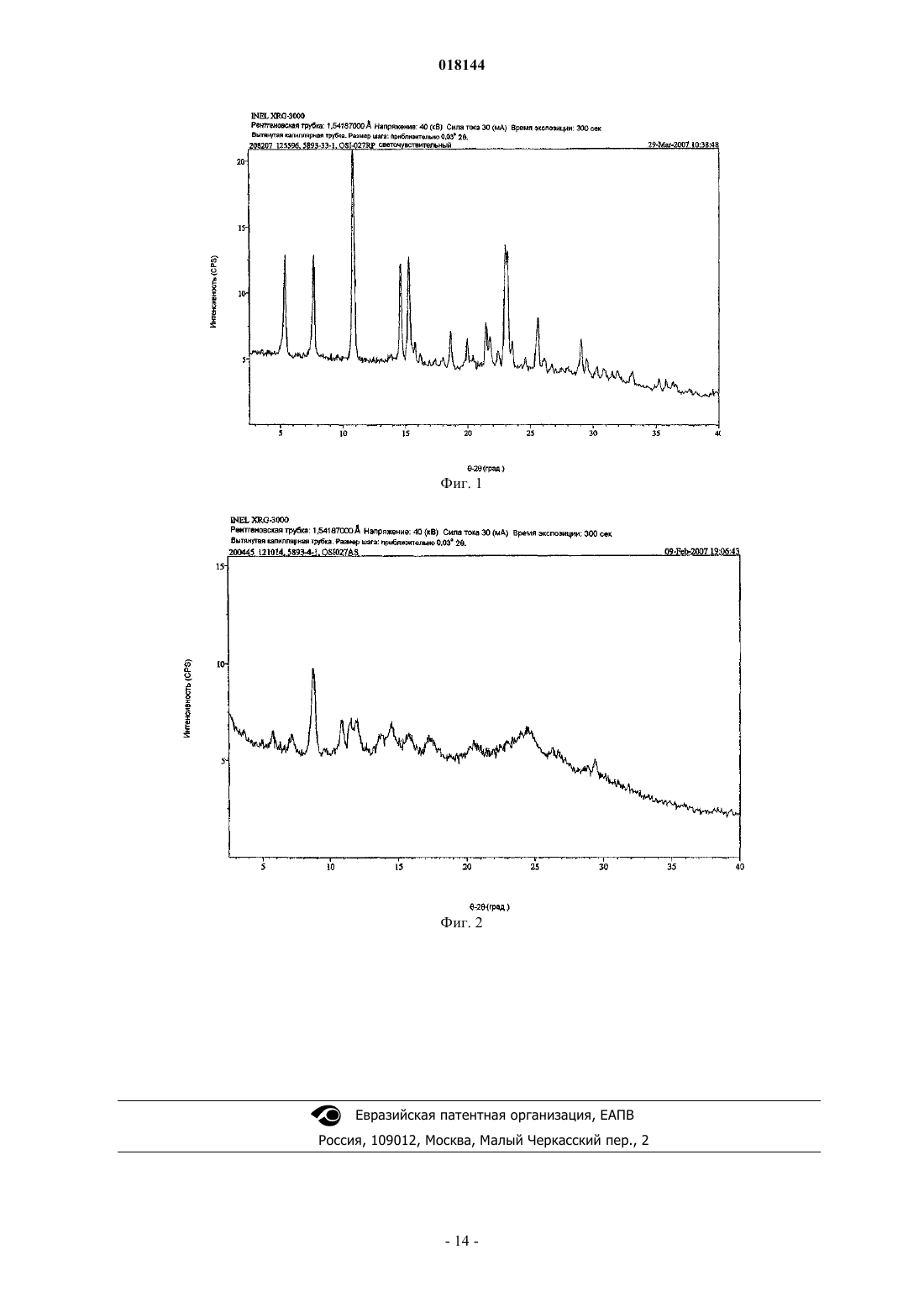
10. Соль по п.1, которая является трометаминовой солью и характеризуется порошковой рентгенограммой, по существу, соответствующей рентгенограмме, представленной на фиг. 1.
11. Соль по п.6, которая характеризуется следующим 13С ЯМР спектром (100 МГц, ДМСО): 29.1, 29.6, 34.3, 43.9, 55.3, 59.0, 61.3, 102.3, 102.5, 110.9, 113.1, 120.1, 126.8, 127.2, 130.0, 132.1, 146.3, 146.7 и 178.6.
12. Соль по п.6, которая обладает гигроскопичностью 2-4% при относительной влажности 90-95%.
13. Соль по п.6, которая характеризуется острым эндотермическим пиком при 202-211°С в ДСК анализе.
14. Соль по п.6, которая обладает растворимостью в воде по меньшей мере 6 мг/мл.
15. Фармацевтическая композиция, содержащая соль по любому из пп.1-14, составленная по меньшей мере с одним фармацевтически приемлемым наполнителем или без него.
16. Способ лечения опухоли, включающий введение нуждающемуся в этом пациенту эффективного количества соли по любому из пп.1-14.
17. Способ лечения лимфомы или рака яичников, включающий введение нуждающемуся в этом пациенту эффективного количества соли по любому из пп.1-14.
Текст
СОЛЕВЫЕ ФОРМЫ ИНГИБИТОРА mTOR Солевые формы ингибиторов mTOR формулы (I), способы получения, составление рецептуры и применение для лечения заболевания Предшествующий уровень техники По настоящей заявке испрашивается приоритет на основании заявки США 61/070062 (от 19 марта 2008 г.), содержание которой введено в данное описание в качестве ссылки. Настоящее изобретение направлено на бициклические соединения, которые являются ингибиторами киназы, мишени рапамицина млекопитающих (mTOR) (также известной как FRAP, RAFT, RAPT,SEP). В частности, настоящее изобретение направлено на конденсированные бициклические соединения,которые являются ингибиторами mTOR, полезными для лечения рака. Было показано, что высокие уровни неуправляемой активности mTOR связаны с разнообразными формами рака у человека и различными синдромами гамартомы, включая комплекс туберозного склероза, PTEN-зависимые синдромы гамартомы и синдром Пейтса-Йегерса. Хотя в стадии клинической разработки против рака находятся аналоги рапамицина, как ингибиторы mTOR киназы, исход болезни у пациентов с раком груди и почек с применением CCI-779 является достаточно скромным. Это, вероятно, происходит из-за того, что рапамицин не полностью ингибирует функцию mTOR через raptor-mTOR комплекс (mTORC1). Также было обнаружено, что 2/3 случаев рака груди и 1/2 пациентов с почечноклеточным раком оказались резистивными к терапии рапамицином. С недавним открытием rictor-mTOR комплекса (mTORC2), который вовлечен в фосфорилирование протеинкиназы K (AKT) (S473), что является важным в регуляции клеточного выживания, и модуляцию протеинкиназы С (PKC), что играет основную роль в регуляции структуры актинового цитоскелета, независимым от рапамицина способом, ингибирование этих активностей mTOR, вероятно, является важным для более широкой противоопухолевой активности и лучшей эффективности. Таким образом, желательно обнаружить новые соединения, которые представляют собой прямые ингибиторы mTOR киназы, которые ингибировали бы mTORC1 иmTORC2. С недавним открытием независимой от рапамицина функции mTOR (через mTOR2) фосфорилирования протеинкиназы K (AKT) (в позиции S473), что является важным в регуляции клеточного выживания, и модуляции протеинкиназы С (PKC), что играет основную роль в регуляции структуры актинового цитоскелета, полагают, что ингибирование функции mTOR рапамицином является частичным. Таким образом, для более широкой противоопухолевой активности и лучшей эффективности требуется обнаружение прямого ингибитора mTOR киназы, который мог бы полностью ингибировать функцию какmTORC1, так и mTORC2. Здесь авторы описывают изобретение прямых ингибиторов mTOR киназы,которые можно применять для лечения различных форм рака - включая рак груди, легкого, почек, простаты, крови, печени, яичников, щитовидной железы, желудочно-кишечного тракта и лимфомы - и других проявлений, таких как ревматоидный артрит, синдромы гамартомы, отторжения трансплантатов,воспалительное заболевание кишечника, множественные склерозы и подавление иммунитета. Недавний успех применения препарата Тарцева, ингибитора EGFR киназы для лечения NSCLC, и предыдущий успех применения препарата Глевек для лечения CML показал, что возможно разрабатывать селективные ингибиторы киназы для эффективного лечения злокачественных опухолей. Хотя существуют несколько противоопухолевых средств, включающих ингибиторы киназы, все еще существует потребность в улучшенных противоопухолевых лекарственных средствах, и было бы желательно разработать новые соединения с лучшей селективностью, эффективностью или с пониженной токсичностью или побочными эффектами. Таким образом, требуется разработать соединения, которые проявляют mTOR ингибирование для того, чтобы лечить онкологических пациентов. Кроме того, такие соединения могут быть активны в отношении других киназ, таких как, например, PI3K, Src, KDR, для дополнительной эффективности против рака груди, немелкоклеточного рака легкого (NSCLC), почечноклеточной карциномы, лимфомы из клеток мантии, злокачественных опухолей эндометрия или других синдромов гамартомы. В отношении новых солевых форм желательно, чтобы они обеспечивали подходящий профиль в отношении фармацевтического производства, составления рецептуры, хранения и применения. Например, желательно, чтобы соль среди прочих известных критериев обладала подходящей растворимостью,гигроскопичностью, стабильностью, однородностью, воспроизводимостью получения, чистотой.US 2007/0112005 раскрывает в числе прочего mTOR ингибирующие соединения. Настоящее изобретение относится к отдельным солям и формам соединений ингибиторов mTOR, их получению, составлению рецептуры и применению. Сущность изобретения В некоторых аспектах настоящее изобретение обеспечивает соли и полиморфные формы соединений, представленных формулой (I) как описано и подробно изложено далее ниже. Соли можно получить из соединений, описанных в US 2007/0112005, который также описывает их получение, биологическую активность и применение. US 2007/0112005 введен в данное описание по ссылке, как на единое целое. Изобретение включает соли,полиморфные формы, их получение, составление рецептуры и применение для лечения заболевания. Краткое описание фигур Фиг. 1 - порошковая рентгеновская дифрактограмма трометаминовой солевой формы по примеру 1; фиг. 2 - порошковая рентгеновская дифрактограмма кальциевой солевой формы по примеру 2. Подробное описание изобретения В некоторых аспектах изобретение обеспечивает фармацевтически приемлемые соли соединения,представленного формулой (I)X1 и Х 2, каждый независимо, является N или С-(Е 1)аа; Х 5 представляет собой N, С-(Е 1)аа или N-(E1)aa; Х 3, Х 4, Х 6 и X7, каждый независимо, является N или С; где по меньшей мере один из Х 3, Х 4, Х 5, Х 6 и Х 7 является независимо N или N-(E1)aa;R3 представляет собой С 0-10 алкил, циклоС 3-10 алкил, аминометилциклоС 3-10 алкил, бициклоС 5-10 алкил,арил, гетероарил, аралкил, гетероаралкил, гетероциклил или гетеробициклоС 5-10 алкил, каждый из которых необязательно замещен одним или несколькими независимыми G11 заместителями;Q1 представляет собой -A(R1)mB(W)n или -В(G11)nA(Y)m; А и В являются, соответственно, 5- и 6-членными ароматическими или гетероароматическими кольцами, конденсированными друг с другом с образованием 9-членной гетероароматической системы, за исключением 5-бензо[b]фурила и 3-индолила и за исключением 2-индолил, 2-бензоксазол, 2 бензотиазол, 2-бензимидазолил, 4-аминопирролопиримидин-5-ил, 4-аминопирролопиримидин-6-ил и 7 деаза-7-аденозинилпроизводных, когда Х 1 и Х 5 являются СН, Х 3, Х 6 и Х 7 являются С и Х 2 и Х 4 являютсяN; или Q1 представляет собой -A(R1)mA(Y)m, в котором каждое А является одинаковым или отличающимся 5-членным ароматическим или гетероароматическим кольцом, и они оба конденсированы друг с другом с образованием 8-членной гетероароматической системы;R1 представляет собой независимо водород, -N(С 0-8 алкил)(С 0-8 алкил), гидроксил, галоген, оксо, арилW представляет собой независимо водород, -N(С 0-8 алкил)(С 0-8 алкил), гидроксил, галоген, оксо, арилY представляет собой независимо водород, -N(С 0-8 алкил)(С 0-8 алкил), гидроксил, галоген, оксо, арилG11 представляет собой галоген, оксо, -CF3, -OCF3, -OR312, -NR312R322, -C(O)R312, -С(O)С 3-8 циклоалкил, -CO2C3-8 циклоалкил, -CO2R312, -C(=O)NR312R322, -NO2, -CN, -S(O)0-2R312, -SO2NR312R322,NR312(C=O)R322, NR312C(=O)OR322, NR312C(=O)NR322R332, NR312S(O)0-2R322, -C(=S)OR312, -C(O)SR312,-NR312C(=NR322)NR332R341, NR312C(=NR322)OR332, -NR312C(=NR322)SR332, -ОС(=O)OR312, OC(=O)NR312R322,-OC(=O)SR312, -SC(=O)OR312, -SC(=O)NR312R322, -P(O)OR312OR322, C1-10 алкилиден, С 0-10 алкил, С 2-10 алкенил, С 2-10 алкинил, -C1-10 алкоксиС 1-10 алкил, -С 1-10 алкоксиС 2-10 алкенил, -C1-10 алкоксиС 2-10 алкинил, -С 1-10 алкилтиоС 1-10 алкил, -С 1-10 алкилтиоС 2-10 алкенил, -С 1-10 алкилтиоС 2-10 алкинил, циклоС 3-8 алкил, циклоС 3-8 алкенил, -циклоС 3-8 алкилС 1-10 алкил, -циклоС 3-8 алкенилС 1-10 алкил, -циклоС 3-8 алкилС 2-10 алкенил, -цикло С 3-8 алкенилС 2-10 алкенил, -циклоС 3-8 алкилС 2-10 алкинил, -циклоС 3-8 алкенилС 2-10 алкинил, -гетероциклил-С 0-10 алкил, -гетероциклил-С 2-10 алкенил или -гетероциклил-С 2-10 алкинил, каждый из которых необязательно замещен одним или несколькими независимыми галоген, оксо, -CF3, -OCF3, -OR313, -NR313R323, -C(O)R313,-CO2R313, -C(=O)NR313R323, -NO2, -CN, -S(O)0-2R313, -SO2NR313R323, -NR313C(=O)R323, -NR313C(=O)OR323,-NR313C(=O)NR323R333,-NR313S(O)0-2R323,-C(=S)OR313,-C(=O)SR313,-NR313C(=NR323)NR333R342,313 323 333 313 323 333 333 313 323OR313, -P(O)OR313OR323 или -SC(=O)NR313R323 заместителями; или G11 представляет собой арил-С 0-10 алкил, арил-С 2-10 алкенил, арил-С 2-10 алкинил, гетарил-С 0-10 алкил, гетарил-С 2-10 алкенил или гетарил-С 2-10 алкинил, где местом присоединения является место либо слева, либо справа, как написано, где любой из которых является необязательно замещенным одним или несколькими независимыми галоген, -CF3, -OCF3, -OR313, -NR313R323, -C(O)R313, -CO2R313,-C(=O)NR313R323, -NO2, -CN, -S(O)0-2R313, -SO2NR313R323, -NR313C(=O)R323, -NR313C(=O)OR323,-NR313C(=O)NR323R333,-NR313S(O)0-2R323,-C(=S)OR313,-C(=O)SR313,-NR323C(=NR313)NR333R342,313 323 333 313 323 333 313R31, R32, R33, R311, R321, R331, R312, R322, R332, R341, R313, R323, R333 и R342 в каждом примере представляют собой независимо С 0-8 алкил, необязательно замещенный арильным, гетероциклильным или гетарильным заместителем, или С 0-8 алкил, необязательно замещенный 1-6 независимыми галогенами, -CON(С 0-8 алкил)(С 0-8 алкилом), -СО(С 0-8 алкилом), -ОС 0-8 алкилом, -Оарилом, -Огетарилом, -Огетероциклилом,-S(О)0-2 арилом, -S(О)0-2 гетарилом, -S(О)0-2 гетероциклилом, -S(О)0-2 С 0-8 алкилом, -N(С 0-8 алкил)(С 0-8 алкилом), -N(С 0-8 алкил)CON(С 0-8 алкил)(С 0-8 алкилом), -N(C0-8 алкил)СО(С 1-8 алкилом), -N(С 0-8 алкил)СО(С 3-8 циклоалкилом), -N(С 0-8 алкил)CO2(С 1-8 алкилом), S(О)1-2N(С 0-8 алкилС 0-8 алкилом), -NR11S(О)1-2(С 0-8 алкилом),-CON(С 3-8 циклоалкил)(С 3-8 циклоалкилом), -CON(С 0-8 алкил)(С 3-8 циклоалкилом), -N(С 3-8 циклоалкил)CON(С 0-8 алкил)(С 0-8 алкилом), -N(С 3-8 циклоалкил)CON(С 3-8 циклоалкил)(С 0-8 алкилом), -N(С 0-8 алкил)CON(С 3-8 циклоалкил)(С 0-8 алкилом),-N(С 0-8 алкил)СО 2(С 3-8 циклоалкилом),-N(С 3-8 циклоалкил)СО 2(С 3-8 циклоалкилом), S(О)1-2N(С 0-8 алкил)(С 3-8 циклоалкилом), -NR11S(О)1-2(С 3-8 циклоалкилом), С 2-8 алкенилом, С 2-8 алкинилом, CN, CF3, ОН, или необязательно замещенный арильными заместителями, так что каждая из вышеупомянутых арильной, гетероциклильной, гетарильной, алкильной или циклоалкильной групп может необязательно независимо замещаться -N(С 0-8 алкил)(С 0-8 алкилом), гидроксилом, галогеном, оксо,арилом, гетарилом, С 0-6 алкилом, -С 0-8 алкилциклилом, -С 0-8 алкил-N(С 0-8 алкил)-S(О)0-2-(С 0-8 алкилом), -С 0-8 алкил-S(О)0-2-N(С 0-8 алкил)(С 0-8 алкилом), -С 0-8 алкил-N(С 0-8 алкил)СО(С 0-8 алкилом), -С 0-8 алкил-N(С 0-8 алкил)CO-N(С 0-8 алкил)(С 0-8 алкилом),-С 0-8 алкил-CO-N(С 0-8 алкил)(С 0-8 алкилом), -С 1-8 алкил-СО 2(С 0-8 ал-3 018144 килом), -С 0-8 алкил-S(O)0-2(С 0-8 алкилом), -С 0-8 алкил-O-С 0-8 алкилом, -С 0-8 алкил-O-С 0-8 алкилдиклилом, -С 0-8 алкил-O-С 0-8 алкилгетероциклилом, -С 0-8 алкил-O-С 0-8 алкиларилом, -С 0-8 алкил-O-С 0-8 алкилгетарилом, -С 0-8 алкил-S-С 0-8 алкилом, -С 0-8 алкил-S-С 0-8 алкилциклилом, -С 0-8 алкил-S-С 0-8 алкилгетероциклилом, -С 0-8 алкилS-С 0-8 алкиларилом, -С 0-8 алкил-S-С 0-8 алкилгетарилом, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкилом, -C0-8 алкилN(С 0-8 алкил)-С 0-8 алкилциклилом, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкилгетероциклилом, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкиларилом, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкилгетарилом, -С 2-8 алкенилом, -С 2-8 алкинилом,NO2, CN, CF3, OCF3, OCHF2, -С 0-8 алкил-С 3-8 циклоалкилом, -С 0-8 алкил-O-С 0-8 алкилом, -С 0-8 алкил-N(С 0-8 алкил)(С 0-8 алкилом), -С 0-8 алкил-S(О)0-2-С 0-8 алкилом или гетероциклилом, необязательно замещенным 1-4 независимыми С 0-8 алкил, циклил или замещенный циклил заместителями; Е 1 в каждом примере представляет собой независимо галоген, -CF3, -OCF3, -OR2, -NR31R32,-C(=O)R31, -CO2R31, -CONR31R32, -NO2, -CN, -S(O)0-2R31, -S(O)0-2NR31R32, -NR31C(=O)R32, -NR31C(=O)OR32,-NR31C(=O)NR32R33, -NR31S(O)0-2R32, -C(=S)OR31, -C(=O)SR31, -NR31C(=NR32)NR33R31, -NR31C(=NR32)OR33, -NR31C(=NR31)SR31, -OC(=O)OR31, -OC(=O)NR31R32, -OC(=O)SR31, -SC(=O)OR31, -SC(=O)NR31R32,С 0-10 алкил, С 2-10 алкенил, С 2-10 алкинил, -C1-10 алкоксиС 1-10 алкил, -С 1-10 алкоксиС 2-10 алкенил, -С 1-10 алкоксиС 2-10 алкинил, -С 1-10 алкилтиоС 1-10 алкил, -С 1-10 алкилтиоС 2-10 алкенил, -C1-10 алкилтиоС 2-10 алкинил, циклоС 3-8 алкил, циклоС 3-8 алкенил, -циклоС 3-8 алкилС 1-10 алкил, -циклоС 3-8 алкенилС 1-10 алкил, -циклоС 3-8 алкилС 2-10 алкенил, -циклоС 3-8 алкенилС 2-10 алкенил, -циклоС 3-8 алкилС 2-10 алкинил, -циклоС 3-8 алкенилС 2-10 алкинил,-гетероциклил-С 0-10 алкил, -гетероциклил-С 2-10 алкенил или -гетероциклил-С 2-10 алкинил, любой из которых необязательно замещен одним или несколькими независимыми галоген, оксо, -CF3, -OCF3, -OR31,-NR31R32, -C(=O)R31, -CO2R31, -C(=O)NR31R32, -NO2, -CN, -S(=O)0-2R31, -SO2NR31, -NR31C(=O)R32,-NR31C(=O)OR31, -NR31C(=O)NR32R33, -NR31S(O)0-2R31, -C(=S)OR31, -C(=O)SR31, -NR31C(=NR32)NR33R31,-NR31C(=NR32)OR33, -NR31C(=NR32)SR33, -OC(=O)OR31, -ОС(=O)NR31R32, -ОС(=O)SR31, -SC(=O)OR31 или-SC(=O)NR31R32 заместителями; или Е 1 в каждом примере представляет собой независимо арил-С 0-10 алкил, арил-С 2-10 алкенил, арилС 2-10 алкинил, гетарил-С 0-10 алкил, гетарил-С 2-10 алкенил или гетарил-С 2-10 алкинил, где местом присоединения является место либо слева, либо справа, как написано, где любой из которых является необязательно замещенным одним или несколькими независимыми галоген, -CF3, -OCF3, -OR31, -NR31R32, -C(O)R31,-CO2R31, -С(=O)NR31R32, -NO2, -CN, -S(O)0-2R31, -S(O)0-2NR31R32, -NR31C(=O)R32, -NR31C(=O)OR32,-NR31C(=O)NR32R33, -NR31S(O)0-2R32, -C(=S)OR31, -C(=O)SR31, -NR31C(=NR32)NR33R31, -NR31C(=NR32)OR33, -NR31C(=NR32) SR33, -OC(=O)OR31, -OC(=O)NR31R32, -OC(=O)SR31, -SC(=O)OR31 или -SC(O)NR31R32 заместителями; в случаях -NR31R32, -NR311R321, -NR312R322, -NR332R341, -NR313R323 и -NR323R333, соответствующие R31 32 и R , R311 и R321, R312 и R322, R331 и R341, R313 и R323, а также R323 и R333 необязательно взятые вместе с атомом азота, к которому они присоединены, формируют 3-10-членное насыщенное или ненасыщенное кольцо; где вышеупомянутое кольцо в каждом примере независимо необязательно замещено одним или несколькими независимыми -N(С 0-8 алкил)(С 0-8 алкил), гидроксил, галоген, оксо, арил, гетарил, С 0-6 алкил,-С 0-8 алкилС 3-8 циклоалкил, -С 0-8 алкил-N(С 0-8 алкил)S(О)0-2 С 0-8 алкил, -С 0-8 алкил-N(С 0-8 алкил)S(О)0-2N(С 0-8 алкил)(С 0-8 алкил), -С 0-8 алкил-N(С 0-8 алкил)СО 2(С 0-8 алкил), -С 0-8 алкил-CONС 0-8 алкилS(О)0-2(С 0-8 алкил),-С 0-8 алкил-S(О)0-2N(С 0-8 алкил)(С 0-8 алкил), -С 0-8 алкил-N(С 0-8 алкил)СО(С 0-8 алкил), -С 0-8 алкил-N(С 0-8 алкил)CON(С 0-8 алкил)(С 0-8 алкил), -С 0-8 алкил-CON(С 0-8 алкил)(С 0-8 алкил), -С 0-8 алкил-СО 2(С 0-8 алкил), -С 0-8 алкилS(O)0-2(С 0-8 алкил),-С 0-8 алкил-O-С 0-8 алкил,-С 0-8 алкил-O-С 0-8 алкилциклил,-С 0-8 алкил-O-С 0-8 алкилгетероциклоалкил, -С 0-8 алкил-О-С 0-8 алкиларил, Оарил, -С 0-8 алкил-O-С 0-8 алкилгетарил, -С 0-8 алкил-S-С 0-8 алкил, -С 0-8 алкил-S-С 0-8 алкилС 3-8 циклоалкил, -С 0-8 алкил-S-С 0-8 алкилгетероциклоалкил, -С 0-8 алкил-S-С 0-8 алкиларил, -С 0-8 алкил-S-С 0-8 алкилгетарил, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкил, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкилС 3-8 циклоалкил, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкилгетероциклоалкил, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкиларил, -С 0-8 алкил-N(С 0-8 алкил)-С 0-8 алкилгетарил, -С 0-8 алкил-N(С 0-8 алкил)(С 0-8 алкил), С 2-8 алкенил, С 2-8 алкинил, NO2, CN, CF3, OCF3 или OCHF2 заместителями; где вышеупомянутое кольцо в каждом примере независимо необязательно включает один или несколько гетероатомов, отличающихся от азота; иn равно 0, 1, 2, 3 или 4 и аа равно 0 или 1. В некоторых вариантах осуществления соединение не является транс-4-[8-амино-1-(7-хлор-4 гидрокси-1 Н-индол-2-ил)имидазо[1,5-]пиразин-3-ил]циклогексанкарбоновой кислотой, цис-3-[8-амино 1-(7-хлор-1 Н-индол-2-ил)имидазо[1,5-]пиразин-3-ил]циклобутанкарбоновой кислотой, транс-4-8 амино-1-[7-(3-изопропил)фенил-1 Н-индол-2-ил]имидазо[1,5-]пиразин-3-илциклогексанкарбоновой кислотой или транс-4-8-амино-1-[7-(2,5-дихлор)фенил-1 Н-индол-2-ил]имидазо[1,5-]пиразин-3 илциклогексанкарбоновой кислотой. В некоторых вариантах осуществления обеспечивается фармацевтически приемлемая соль, выбранная из группы, состоящей из трометаминовой, натриевой, кальциевой и L-аргининовой соли соединения, выбираемого из следующего: Соединения можно получить согласно обычным известным из уровня техники методикам, таким как описано в US 2007/0112005. В некоторых вариантах осуществления соли выбирают из трометаминовой, натриевой, кальциевой или L-аргининовой. В некоторых вариантах осуществления соли выбирают из магниевой, калиевой, N,Nдиэтилэтаноламиновой, N-метил-D-глюкаминовой или пиперазиновой. В некоторых вариантах осуществления обеспечивается фармацевтически приемлемая соль транс-4[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты, где соль выбирают из натриевой, кальциевой, L-аргининовой, магниевой, калиевой, N,Nдиэтилэтаноламиновой, N-метил-D-глюкаминовой или трометаминовой. В некоторых вариантах осуществления солевую форму выбирают из натриевой, кальциевой или Lаргининовой. В некоторых вариантах осуществления солевую форму выбирают из магниевой, калиевой,N,N-диэтилэтаноламиновой или N-метил-D-глюкаминовой. В некоторых вариантах осуществления солевой формой является трометаминовая. В некоторых вариантах осуществления солевая форма является гидратированной или сольватиро-7 018144 ванной солевой формой. В некоторых вариантах осуществления солевая форма является, по существу,аморфной. В некоторых вариантах осуществления солевая форма является в основном кристаллической. В некоторых вариантах осуществления солевая форма является по меньшей мере примерно на 95 вес.% кристаллической. В некоторых вариантах осуществления солевая форма представляет собой в основном единую кристаллическую форму. В некоторых вариантах осуществления солевая форма разлагается примерно на 1 вес.% или меньше в течение 30 дней при 40 С и относительной влажности 75%. В некоторых вариантах осуществления солевая форма является трометаминовой солью, которая дает порошковую рентгенограмму, в значительной степени схожую с той, что на фиг. 1. В некоторых вариантах осуществления солевая форма является трометаминовой формой, которая обладает эндотермическим пиком при температуре примерно 202-211 С в ДСК анализе. В некоторых вариантах осуществления солевая форма является трометаминовой формой, которая обладает растворимостью в воде примерно 6 мг/мл. В некоторых вариантах осуществления солевая форма является трометаминовой формой, имеющей 13 С ЯМР спектр, в значительной степени такой, как в примере 1. В некоторых вариантах осуществления солевая форма является трометаминовой формой, обладающей гигроскопичностью 2-4% при относительной влажности 90-95%. В некоторых вариантах осуществления солевую форму получают по реакции (трометамина) 1,3 пропандиола, 2-амино-2-(гидроксиметила) (примерно 1-2 экв.) в МеОН при кипячении с обратным холодильником примерно в течение 1 ч, охлаждении, фильтровании, промывании и сушке. В некоторых вариантах осуществления исходное соединение первоначально свободно от неорганических солей. Кристаллизация свободного соединения из EtOH или EtOH/воды может быть особенно полезна для удаленияPd, если он присутствует. В некоторых вариантах осуществления трометаминовую соль образуют по реакции примерно 3 экв. трометамина в EtOH или EtOH:вода 1:1. В некоторых вариантах осуществления трометаминовую соль получают в МеОН:ТГФ и медленно охлаждают. В некоторых вариантах осуществления солевая форма является кальциевой солью, которая дает порошковую рентгенограмму, в значительной степени схожую с той, что на фиг. 2. Биологическая активность: ингибирование mTOR активности Способность соединений ингибировать mTOR киназную активность определяли in vitro иммунопреципитационным (IP) методом анализа киназной активности, используя рекомбинантный 4 Е-ВР 1 в качестве субстрата. Анализ определяет способность соединений ингибировать фосфорилирование 4 ЕВР 1, общеизвестного физиологического субстрата mTOR. Комплекс иммунозахвата mTOR из клетокHeLa инкубировали с различными концентрациями соединений и His-tag 4E-BP1 в буфере для анализа активности киназы, перед добавлением АТФ для начала реакции при комнатной температуре. Реакцию останавливали через 30 мин, и фосфорилированный His-tag 4E-BP1 захватывался планшетом, модифицированным хелатным соединением на основе никеля в течение ночи при 4 С. Затем измеряли содержание фосфотреонина 4 Е-ВР 1, используя первичные антитела к фосфо-4 Е-ВР 1 (Т 37/46) и соответствующие вторичные антитела, антикроличий IgG, конъюгированный с пероксидазой хрена. Вторичное антитело содержит ковалентно присоединенный репортерный фермент (например, пероксидазу хрена (HRP, так что связывание первичного антитела с фосфорилированным 4 Е-ВР 1 можно определить количественно,что равно количеству связанного с ним вторичного антитела. Количество вторичного антитела можно определить путем инкубации с соответствующим субстратом HRP. Используемыми исходным реагентами были следующие: буфер для лизиса клеток: 40 мМ HEPES,рН 7,5, содержащий 120 мМ NaCl, 1 мМ ЭДТА, 10 мМ пирофосфата натрия, 10 мМ -глицерофосфата,50 мМ фторида натрия, 1,5 мМ ванадата натрия и 0,3% CHAPS. Миникомплект ингибиторов протеаз, не содержащий ЭДТА (Roche, кат.11836170001). Клеточная масса HeLa (Paragon Bioservices). Планшеты,покрытые белком G для иммунопреципитации (Pierce, кат.15131). mTOR (aka FRAP) N-19 антитела(Santa Cruz Biotechnology, кат.sc-1549). IP промывочный буфер: 50 мМ HEPES, pH 7,5, содержащий 150 мМ NaCl. Буфер для анализа активности киназ: 20 мМ HEPES, рН 7,5, содержащий 10 мМ MgCl2, 4 мМ MnCl2, 10 мМ b-меркаптоэтанол и 200 мкМ ванадата натрия. Для анализа использовать свежеприготовленным. Рекомбинантный 4 Е-ВР 1 (aka PHAS I) (Calbiochem, кат.516675. Разбавить исходный 4 ЕВР 1 (1 мг/мл) в 120 раз буфером для анализа активности киназ до получения концентрации 0,25 мкг/лунка в 30 мкл. Раствор АТФ: приготовить запасный 330 мкМ раствор АТФ в буфере для анализа активности киназ. Планшет, модифицированный хелатным соединением на основе никеля (Pierce, кат.15242). Буфер для разбавления антител: TBST, содержащий 5% обезжиренного молока. Фосфо-4 Е-ВР 1(Т 37/46) антитела: фосфо-4 Е-ВР 1 (Т 37/46) антитела (Cell Signaling Technology, кат.9459) разведенные 1:1000 в буфере для разбавления антител. Конъюгат антител осла к антикроличьим IgG с пероксидазой хрена, 1:10000 разведение конъюгата антикроличьего IgG с пероксидазой хрена (GE Healthcare, кат.NA934) в буфере для разбавления антител. Субстрат пероксидазы хрена: хемилюминесцентные реагенты(Pierce, кат.37074). Протокол анализа: лизат клеток HeLa готовили в большом количестве путем гомогенизации 25 г клеточной массы в 60 мл буфера для лизиса клеток и затем центрифугировали при 12000 об./мин в течение 30 мин. Прозрачный супернатант переносили в чистую пробирку, аликвотировали, быстро замора-8 018144 живали и хранили при -80 С до использования. 96-луночные планшеты, покрытые белком G, промывали буфером для лизиса клеток и в каждую лунку добавляли по 50 мкл разведенных mTOR антител и инкубировали при комнатной температуре в течение 30-60 мин. Затем в каждую лунку добавляли по 50 мкг лизата клеток HeLa в 50 мкл лизирующего буфера и инкубировали при 4 С в холодной комнате на шейкере в течение 2-3 ч. Лизат удаляли и планшеты промывали 100 мкл буфера для полного лизиса клеток (3 раза). Планшеты дополнительно промывали 2 раза 100 мкл промывочного буфера с высокой концентрацией соли. Разбавленный 4 Е-ВР 1 (субстрат) добавляли к каждой лунке по 30 мкл. Соединения добавляли в различных концентрациях по 5 мкл на каждую лунку. Концентрации лекарственных средств варьировали от 30 мкМ до 0,1 мкМ. Конечная концентрация DMSO составляла 1%. В лунки с положительным контролем добавляли только DMSO. В лунки с отрицательным контролем не добавляли раствор АТФ, но вместо этого добавляли 15 мкл буфера для анализа активности киназы, реакцию начинали добавлением в оставшиеся лунки по 15 мкл АТФ до конечной концентрации 100 мкМ, за исключением лунок с отрицательным контролем. Реакцию проводили в течение 30 мин при комнатной температуре. Затем по 45 мкл реакционной смеси переносили в планшет, модифицированный хелатным соединением на основе никеля,и инкубировали в течение ночи при 4 С. Планшет однократно промывали буфером для разбавления антител и в каждую лунку добавляли по 50 мкл разведенных фосфо-4 Е-ВР 1 антител, и инкубировали при комнатной температуре в течение 1 ч. Затем планшет промывали TBST (4 раза) и добавляли в каждую лунку по 50 мкл разведенных вторичных антикроличьих антител и инкубировали при комнатной температуре в течение 1 ч. Планшет промывали 100 мкл TBST (4 раза). В каждую лунку добавляли по 50 мклvictor. Сравнение аналитических сигналов, полученных в присутствии соединения, с аналитическими сигналами положительных и отрицательных контролей позволило определить степень ингибирования фосфорилирования фосфо-4 Е-ВР 1 в диапазоне концентраций соединения. Эти величины ингибирования строили в виде сигмоидальной дозозависимой кривой ингибирования для того, чтобы определить величины IC50 (т.е. концентрацию соединения, которая ингибирует фосфорилирование 4 Е-ВР 1 на 50%). Анализ механизма действия клеточной mTOR для измерения ингибирования фосфорилирования 4 Е-ВР 1 (Т 37/46) MDA-MB-231 клетки помещали в лунки 96-луночного планшета в концентрации 2104 клеток/лунка в 90 мкл полной питательной среды и инкубировали при 37 С в течение ночи в СО 2 инкубаторе. Клетки обрабатывали различными соединениями дозозависимым способом в течение 3 ч при 37 С в СО 2 инкубаторе перед получением клеточных лизатов для измерения ингибирования фосфорилирования 4 Е-ВР 1 при Т 37/46. Клеточные лизаты переносили в 96-луночный планшет с адсорбированными антителами к 4 Е-ВР 1 для захвата фосфо-4 Е-ВР 1 (Т 37/46) и инкубировали в течение ночи при 4 С. Количество фосфо-4 Е-ВР 1 в каждой лунке далее определяли путем инкубации лунок с антикроличьими фосфо-4 Е-ВР 1 (Т 37/46) антителами и соответствующим конъюгатом антител козы к антикроличьим IgG с пероксидазой хрена. Количество пероксидазы хрена, присутствующее в каждой лунке, измеряли хемилюминесцентным методом, что соответствовало количеству фосфо-4 Е-ВР 1 в каждой лунке. ВеличиныIC50 определяли, используя 6-точечные кривые дозозависимости. Соединения по этому изобретению демонстрировали по меньшей мере одно из следующего: I) ингибированное фосфорилирование 4 Е-ВР 1 иммунозахваченной mTOR человека, определенное в биохимическом анализе по ингибированию mTOR активности с величинами IC50 в диапазоне между 0,001 мкМ и 11,00 мкМ. Предпочтительно, чтобы величины IC50 были меньше чем 1,00 мкМ и более предпочтительно, чтобы величины IC50 были меньше чем 0,1 мкМ. Даже более предпочтительно, чтобы величиныIC50 были меньше чем 0,01 мкМ; II) ингибированное фосфорилирование 4 Е-ВР 1 (Т 37/46) в анализе механизма действия клеточной mTOR с величинами IC50 ниже 40 мкМ. Например, транс-4-[4-амино-5-(7 метокси-1 Н-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновая кислота ингибировала фосфорилирование 4 Е-ВР 1 (Т 37/46) в анализе механизма действия клеточной mTOR с величиной IC50 примерно 1 мкМ. Фармацевтические композиции Настоящее изобретение включает композиции, содержащие соль соединения по изобретению,включенную в состав рецептуры для требуемого способа применения с одним или несколькими фармацевтически приемлемыми носителями или наполнителями или без них. Фармацевтические композиции по настоящему изобретению включают по меньшей мере одно соединение в качестве активного ингредиента, необязательно фармацевтически приемлемый носитель и необязательно другие вспомогательные средства. Композиции включают композиции, пригодные для орального, ректального, местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя наиболее пригодный путь в любом заданном случае будет зависеть от индивидуальных особенностей пациента, природы и тяжести состояний, для лечения которых применяют активный ингредиент. Фармацевтические композиции обычно можно удобным образом представить в виде стандартной лекарственной формы и изготовить любым из способов, хорошо известных в области фармацевтики. Используемые фармацевтические носители могут представлять собой, например, твердое вещество, жидкость или газ. Примеры твердых носителей включают лактозу, каолин, сахарозу, тальк,-9 018144 желатин, агар, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Примерами жидких носителей являются сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают диоксид углерода и азот. При изготовлении композиций для оральных лекарственных форм можно использовать любую подходящую фармацевтическую среду. Например, воду, гликоли,масла, спирты, ароматизаторы, консерванты, красящие добавки и т.п. можно использовать для формирования жидких оральных препаратов, таких как суспензии, эликсиры и растворы; в то время как носители,такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранилирующие агенты,смазочные средства, связующие, дезинтеграторы и т.п. можно использовать для формирования твердых оральных препаратов, таких как порошки, капсулы и таблетки. Благодаря своей легкости применения таблетки и капсулы являются предпочтительными оральными стандартными лекарственными формами,в соответствии с чем используются твердые фармацевтические носители. Необязательно таблетки можно покрыть, используя стандартные водные или неводные методики. Таблетку, содержащую композицию по этому изобретению, можно изготовить путем прессования или формовки необязательно с одним или несколькими дополнительными ингредиентами или вспомогательными средствами. Прессованные таблетки можно изготовить путем прессования в подходящей машине активного ингредиента в сыпучей форме, такого как порошок или гранулы, необязательно смешанного со связующим, смазочным материалом, инертным разбавителем, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно изготовить путем формования в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от примерно 0,05 мг до примерно 5 г активного ингредиента и каждое саше или капсула предпочтительно содержит от примерно 0,05 мг до примерно 5 г активного ингредиента. Например, рецептура, предназначенная для перорального применения человеком, может содержать от примерно 0,5 мг до примерно 5 г активного ингредиента, компаундированного с соответствующим и подходящим количеством вещества-носителя, которое может варьироваться от примерно 5 до примерно 95% от всей композиции. Стандартная лекарственная форма может содержать между примерно 1 мг и примерно 2 г активного ингредиента, обычно 25, 50, 100, 200, 300, 400, 500, 600, 800 или 1000 мг. Фармацевтические композиции по настоящему изобретению, пригодные для парентерального введения, можно приготовить в виде растворов или суспензий активных соединений в воде. Можно включить подходящее поверхностно-активное вещество, такое, например, как гидроксипропилцеллюлозу. Также можно приготовить дисперсии в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Кроме того, можно включить консерванты для предотвращения неблагоприятного роста микроорганизмов. Фармацевтические композиции, пригодные для применения в виде инъекций, включают стерильные водные растворы или дисперсии. Кроме того, композиции могут быть в виде стерильных порошков для приготовления для немедленного применения таких стерильных инъецируемых растворов или суспензий. Во всех случаях конечная инъецируемая форма должна быть стерильной и должна эффективно течь для легкого засасывания в шприц. Фармацевтические композиции должны быть стабильными в условиях производства и хранения; таким образом, предпочтительно должны быть защищены от загрязнения микроорганизмами, такими как бактерии и грибы. Носитель должен быть растворителем или дисперсионной средой, содержащей, например, воду, EtOH, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), растительные масла и подходящие смеси из них. В дополнение к вышеупомянутым носителям описанные выше фармацевтические рецептуры могут включать, при необходимости, один или несколько дополнительных ингредиентов, таких как разбавители, буферы, ароматизаторы, связующие, поверхностно-активные агенты, загустители, смазывающие средства, консерванты (включая антиоксиданты) и т.п. Кроме того, можно включить другие вспомогательные средства для того, чтобы довести рецептуру для состояния, изотоничного крови получателя, для которого она предназначена. Композиции, содержащие соль по изобретению, можно также получить в виде порошка или жидкого концентрата. Настоящее изобретение включает композицию, содержащую соль соединения по изобретению и по меньшей мере одно дополнительное активное средство, такое как дополнительное антинеопластическое,противоопухолевое, антиангиогенное или химиотерапевтическое средство(а). Способы лечения Настоящее изобретение относится к способу лечения гиперпролиферативных нарушений, в том числе рака, включающему введение нуждающемуся в этом пациенту эффективного количества соли соединения по изобретению. Нарушение может представлять собой рак яичников, лимфому, рак груди, рак легкого, немелкоклеточный рак легкого, рак почки, почечноклеточную карциному, рак простаты, рак крови, рак печени, рак яичников, рак щитовидной железы, рак эндометрия, рак желудочно-кишечного тракта, почечноклеточную карциному, лимфому из клеток зоны мантии или рак эндометрия. Таким образом, обеспечивается способ лечения опухоли, включающий введение нуждающемуся в этом пациенту эффективного количества соли соединения по настоящему изобретению. В некоторых вариантах его осуществления рак представляет собой лимфому или рак яичников. Вообще уровни дозировок от примерно 0,01 до примерно 150 мг/кг массы тела в день могут быть полезны при лечении вышеуказанных состояний или, альтернативно, от примерно 0,5 мг до примерно 7 г- 10018144 на пациента в день. Например, рак груди, легкого, почки, простаты, крови, печени, яичников, щитовидной железы, желудочно-кишечного тракта и лимфому можно эффективно лечить путем введения примерно от 0,01 до 50 мг соединения на 1 кг массы тела в день или, альтернативно, от примерно 0,5 мг до примерно 3,5 г на пациента в день. В некоторых вариантах осуществления можно вводить от примерно 0,05 до примерно 2 мг на пациента в день или от примерно 0,1 до примерно 1 мг/кг. Оптимальная дозировка для любого конкретного пациента будет зависеть от множества факторов, включая возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, способ введения, скорость выведения, комбинацию с другими лекарственными средствами и тяжесть конкретного заболевания, которое подвергается лечению. Примеры Соединение транс-4-[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоновая кислота известно и может быть получено согласно US 2007/0112005 (по примеру 258 из него). Были получены соли транс-4-[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты, включая его кальциевую, магниевую, калиевую,натриевую, L-аргининовую, N-метил-D-глюкаминовую, пиперазиновую и трометаминовую соли. Пример 1. Трометаминовая соль транс-4-[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты(75,0 мл) и нагревали с обратным холодильником. Добавляли 1,3-пропандиол, 2-амино-2(гидроксиметил) (1,79 г, 14,8 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 1 ч. Суспензии давали возможность остыть до комнатной температуры, затем фильтровали. Твердое вещество промывали МеОН и затем сушили под вакуумом в течение ночи при 50 С до получения названного соединения в виде твердого вещества коричневого цвета (4,57 г, выход 70,2%). 1 Н ЯМР (400 МГц, CD3OD):1,67 (дддд, J=12,8, 12,8, 12,8, 2,8 Гц, 2 Н), 1,87 (дддд, J=13,2, 13,2, 13,2,3,2 Гц, 2 Н), 2,14-2,17 (м, 4 Н), 2,34 (тт, J=12,4, 2,8 Гц, 1 Н), 3,40 (тт, J=12,4, 3,2 Гц, 1 Н), 3,65 (с, 6 Н), 4,01 (с,3 Н), 6,75 (д, J=7,2 Гц, 1 Н), 6,75 (с, 1 Н), 7,04 (дд, J=7,6, 7,6 Гц, 1 Н), 7,23 (д, J=7,6 Гц, 1 Н), 7,88 (с, 1 Н). 13 С ЯМР (100 МГц, ДМСО):29,1, 29,6, 34,3, 43,9, 55,3, 59,0, 61,3, 102,3, 102,5, 110,9, 113,1, 120,1,126,8, 127,2, 130,0, 132,1, 146,3, 146,7, 178,6.LCMS (ESI+): m/z 407 (МН+). Элементарный анализ для C25H33N7O6: С, 56,92%; Н, 6,30%; N,18,58%; О, 18,20%. Найдено: С, 56,23%; Н, 6,31%; N, 18,33%; О, 18,63%. Данные, характеризующие трометаминовую соль, суммированы в следующем виде:(a) рентгеновский порошковый дифрактометрический анализ (XRPD) [Inel XRG-3000 w/CPS детектор w/2 диапазон 120] показал, что соль находится в кристаллической форме (см. фиг. 1);(b) дифференциальный сканирующий калориметрический анализ (ДСК) [ТА Instruments 2920 или(c) термогравиметрический (TG) анализ [ТА Instruments 2050 или 2950] показал 0,3-1% потерю массы соли при 150 С;(d) термогравиметрический спектроскопический анализ с преобразованием Фурье (TGIR) показал слабую потерю массы (1%), соответствующей воде;(e) паросорбционный анализ (DVS) [VTI SGA-100 анализатор] показал, что соль проявляет низкую гигроскопичность в 2-4% при относительной влажности 90-95%;(f) оптическая микроскопия (ОМ) [Leica DM LP] показала, что соль, по-видимому, представляет собой по большей части очень маленькие палочки, и в поляризационном микроскопе видно двойное лучепреломление; и(g) растворимость соли в воде составляет приблизительно 6 мг/мл;(h) данные по стабильности: после 30 дней при 40 С и относительной влажности 75% не наблюдается существенного разрушения. Проверка полиморфного состояния трометаминовой соли показала, что после семи дней суспендирования в присутствии десяти различных растворителей при температуре окружающей среды порошковая рентгеновская дифрактограмма образцов трометаминовой соли совпадала с порошковой рентгенов- 11018144 ской дифрактограммой исходного вещества (таблица) и была в основном аналогична той, что представлена на фиг. 1. Кроме того, трометаминовая солевая форма оставалась стабильной после кипячения с обратным холодильником исходной трометаминовой соли в изопропаноле в течение 24 ч. Пример 2. Кальциевая соль транс-4-[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты. Натрий транс-4-[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1-f][1,2,4]триазин-7-ил]циклогексанкарбоксилат (201 мг, 0,469 ммоль) растворяли в воде (2,00 мл) и нагревали с обратным холодильником. Добавляли дихлорид кальция (51,8 мг, 0,467 ммоль), и твердое вещество сразу выпадало в осадок. Реакцию охлаждали до комнатной температуры и фильтровали. Твердое вещество промывали водой и сушили под вакуумом при 60 С до получения названного соединения в виде твердого вещества коричневого цвета (180 мг, выход 90%). 1 Н ЯМР (400 МГц, ДМСО):1,67 (дддд, J=12,8, 12,8, 12,8, 2,8 Гц, 2 Н), 1,87 (дддд, J=13,2, 13,2, 13,2,3,2 Гц, 2 Н), 2,14-2,17 (м, 4 Н), 2,34 (тт, J=12,4, 2,8 Гц, 1 Н), 3,40 (тт, J=12,4, 3,2 Гц, 1 Н), 3,65 (с, 6 Н), 4,01 (с,3 Н), 6,75 (д, J=7,2 Гц, 1 Н), 6,75 (с, 1 Н), 7,04 (дд, J=7,6, 7,6 Гц, 1 Н), 7,23 (д, J=7,6 Гц, 1 Н), 7,88 (с, 1 Н). Данные, характеризующие кальциевую соль, суммированы в следующем виде:(а) рентгеновский порошковый дифрактометрический анализ (XRPD) показал, что соль находится в кристаллической форме (см. фиг. 2);(b) дифференциальный сканирующий калориметрический анализ (ДСК) показал широкие эндотермы при 145,5 С и 178,2 С;(с) паросорбционный анализ (DVS) показал, что соль проявляет гигроскопичность в размере 35% прироста массы при относительной влажности 0-95%; иNaOH (приготовленный из 50% NaOH (1,97 г, 24,6 ммоль) и деионизованную воду (20 мл загружали в течение 10 мин при перемешивании в токе азота. При рН 8,0 формировался прозрачный коричневый раствор. Загружали сажу (0,5 г, 5 вес.%). Смесь перемешивали в течение 5 мин и фильтровали через стекловолоконный фильтр и бумажный фильтр (через двойной слой) под слабым вакуумом. Колбу и воронку промывали небольшим количеством деионизированной воды. Коричневый фильтрат концентрировали при пониженном давлении при 30-35 С. Получившееся в результате клейкое твердое вещество держали под вакуумом при 40-45 С (на водяной бане) в течение 30 мин до получения практически сухого остатка, который переносили на поднос для сушки. Твердое вещество сушили в вакуумной печи при 50 С в течение 5 ч до получения названного соединения в виде твердого вещества коричневого цвета(10,1 г, выход 96%). 1 Н ЯМР (400 МГц, ДМСО):1,43 (дддд, J=12,6, 12,8, 12,8, 2,4 Гц, 2 Н), 1,68 (дддд, J=12,4, 12,4, 12,4,2,8 Гц, 2 Н), 1,99-2,02 (м, 5 Н), 3,12 (тт, J=12,0, 2,8 Гц, 1 Н), 3,92 (с, 3 Н), 6,61 (д, J=7,6 Гц, 1 Н), 6,67 (с, 1 Н),6,88 (дд, J=7,6, 7,6 Гц, 1 Н), 7,12 (д, J=8,0 Гц, 1 Н), 7,72 (с, 1 Н). Элементарный анализ для C21H21N6O3NaH2O: С, 56,50%; Н, 5,19%; N, 18,82%; Na, 5,15%. Найдено: С, 56,44%; Н, 4,76%; N, 18,51%; Na, 4,55%. Данные, характеризующие натриевую соль, суммированы в следующем виде:(а) рентгеновский порошковый дифрактометрический анализ (XRPD) показал, что соль, в основном, является аморфной;(b) дифференциальный сканирующий калориметрический анализ (ДСК) показал широкий эндотерм при 98,3 С и экзотермы при 224,1 С и 256,8 С;(с) термогравиметрический (TG) анализ показал 3,8% потерю массы соли при 250 С;(d) паросорбционный анализ (DVS) показал, что соль проявляет гигроскопичность в размере 37% прироста массы при относительной влажности 0-95%; иEtOH (78,0 мл). Суспензию нагревали с обратным холодильником до получения прозрачного раствора и затем медленно охлаждали до комнатной температуры. Спустя 16 ч суспензию охлаждали на бане со льдом в течение 30 мин и затем фильтровали. Не совсем белое твердое вещество сушили под вакуумом при 80 С в течение 2 дней до получения названного соединения (12,9 г, выход 81%). 1 Н ЯМР (400 МГц, CD3OD):1,59-1,78 (м, 3 Н), 1,79-1,90 (м, 3 Н), 2,13 (ушир.д, J=10,8 Гц, 4 Н), 2,35(д, J=7,6 Гц, 1 Н), 6,72 (с, 1 Н), 7,01 (дд, J=8,0, 8,0 Гц, 1 Н), 7,22 (д, J=8,4 Гц, 1 Н), 7,84 (с, 1 Н). Рентгеновский порошковый дифрактометрический анализ (XRPD) показал, что соль находится в аморфной форме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтически приемлемая соль транс-4-[4-амино-5-(7-метокси-1 Н-индол-2-ил)имидазо[5,1f][1,2,4]триазин-7-ил]циклогексанкарбоновой кислоты, в которой соль выбирают из L-аргининовой или трометаминовой соли. 2. Соль по п.1, в которой солевая форма представляет собой L-аргининовую соль. 3. Соль по п.1, в которой солевой формой является трометаминовая соль. 4. Соль по п.1, которая представляет собой гидратированную или сольватированную форму трометаминовой соли. 5. Соль по п.3, которая находится, по существу, в аморфной форме. 6. Соль по п.3, которая находится, по существу, в кристаллической форме. 7. Соль по п.3, которая присутствует в количестве, которое является по меньшей мере на 95 вес.% кристаллическим. 8. Соль по п.3, которая присутствует в количестве, которое является, по существу, единой кристаллической формой. 9. Соль по п.3, которая разлагается на 1 вес.% или меньше в течение 30 дней при 40 С и относительной влажности 75%. 10. Соль по п.1, которая является трометаминовой солью и характеризуется порошковой рентгенограммой, по существу, соответствующей рентгенограмме, представленной на фиг. 1. 11. Соль по п.6, которая характеризуется следующим 13 С ЯМР спектром (100 МГц, ДМСО): 29.1,29.6, 34.3, 43.9, 55.3, 59.0, 61.3, 102.3, 102.5, 110.9, 113.1, 120.1, 126.8, 127.2, 130.0, 132.1, 146.3, 146.7 и 178.6. 12. Соль по п.6, которая обладает гигроскопичностью 2-4% при относительной влажности 90-95%. 13. Соль по п.6, которая характеризуется острым эндотермическим пиком при 202-211 С в ДСК анализе. 14. Соль по п.6, которая обладает растворимостью в воде по меньшей мере 6 мг/мл. 15. Фармацевтическая композиция, содержащая соль по любому из пп.1-14, составленная по меньшей мере с одним фармацевтически приемлемым наполнителем или без него. 16. Способ лечения опухоли, включающий введение нуждающемуся в этом пациенту эффективного количества соли по любому из пп.1-14. 17. Способ лечения лимфомы или рака яичников, включающий введение нуждающемуся в этом пациенту эффективного количества соли по любому из пп.1-14.
МПК / Метки
МПК: A61K 45/06, C07D 487/04
Метки: формы, ингибитора, солевые
Код ссылки
<a href="https://eas.patents.su/15-18144-solevye-formy-ingibitora-mtor.html" rel="bookmark" title="База патентов Евразийского Союза">Солевые формы ингибитора mtor</a>
Предыдущий патент: Устройство отображения на лобовом стекле
Следующий патент: Способ определения ориентации датчика для электромагнитной разведки
Случайный патент: Аналоги глюкагона