Пиперидиновые агонисты gpcr
Номер патента: 16507
Опубликовано: 30.05.2012
Авторы: Дживаратнам Ревати Перпетуа, Суэйн Саймон Эндрю, Кейли Джон, Файф Мэттью Колин Тор
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
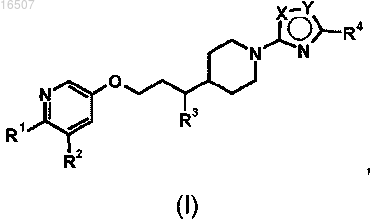
где один из X и Y представляет собой О, а другой представляет собой N;
R1 представляет собой SO2R5 или -CONR6R7;
R2 представляет собой водород или метил;
R3 представляет собой водород или метил;
R4 представляет собой С2-5алкил;
R5 представляет собой С1-3алкил;
R6 и R7 независимо представляют собой водород, С1-4алкил, который, возможно, может быть замещен галогеном, гидрокси, С1-4алкокси-, С1-4алкил-S(O)m-, N(R8)2 или -C(O)OR9; или может представлять собой С3-7циклоалкил, где циклические группы могут быть замещены одним или более заместителями, выбранными из галогена, С1-4алкила, С1-4фторалкила, OR6, CN, SO2CH3 и N(R8)2; или R6 и R7, взятые вместе, могут образовывать 5- или 6-членное гетероциклическое кольцо, возможно замещенное гидрокси, С1-4алкилом или С1-4гидроксиалкилом и возможно содержащее дополнительный гетероатом, выбранный из О и NR8;
R8 независимо представляет собой водород или С1-4алкил; или группа N(R8)2 может образовать 4-7-членное гетероциклическое кольцо, возможно содержащее дополнительный гетероатом, выбранный из О и NR8;
R9 представляет собой водород или С1-4алкил и
m равно 0, 1 или 2.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где X представляет собой О.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где R1 представляет собой SO2R5.
4. Соединение по п.3 или его фармацевтически приемлемая соль, где R1 представляет собой SO2CH3.
5. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где R1 представляет собой
-CONR6R7.
6. Соединение по п.5 или его фармацевтически приемлемая соль, где R6 представляет собой водород, С1-3алкил или С2-3алкил, замещенный гидрокси, и R7 представляет собой водород.
7. Соединение по п.6 или его фармацевтически приемлемая соль, где R6 представляет собой С1-3алкил или С2-3алкил, замещенный гидрокси.
8. Соединение по п.7 или его фармацевтически приемлемая соль, где R6 представляет собой С2-3алкил, замещенный гидрокси.
9. Соединение по п.8 или его фармацевтически приемлемая соль, где R6 представляет собой 2-гидроксиэтил или 2-гидрокси-1-метилэтил.
10. Соединение по любому из пп.1-9 или его фармацевтически приемлемая соль, где R3 представляет собой водород.
11. Соединение по любому из пп.1-9 или его фармацевтически приемлемая соль, где R3 представляет собой метил и образовавшийся стереоцентр имеет (R)-конфигурацию.
12. Соединение по любому из пп.1-11 или его фармацевтически приемлемая соль, где R4 представляет собой С3-4алкил.
13. Соединение по п.12 или его фармацевтически приемлемая соль, где R4 представляет собой изопропил.
14. Соединение формулы (I), выбранное из
((R)-2-гидрокси-1-метилэтил)амида 5-{3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси} пиридин-2-карбоновой кислоты;
амида 5-{3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси}-3-метилпиридин-2-карбоновой кислоты;
5-{3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси}-2-метансульфонилпиридина,
или его фармацевтически приемлемая соль.
15. Соединение формулы (I) по п.1, представляющее собой ((R)-2-гидрокси-1-метилэтил)амид 5-{3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси}-3-метилпиридин-2-карбоновой кислоты, или его фармацевтически приемлемая соль.
16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-15 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
17. Способ лечения заболевания или состояния, в котором играет роль GPR119 (G-белок-сопряженный рецептор 119), включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли.
18. Способ лечения ожирения, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли.
19. Способ лечения диабета, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли.
20. Способ лечения метаболического синдрома (синдром X), нарушенной толерантности к глюкозе, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, низких уровней HDL (липопротеинов высокой плотности) или гипертензии, включающий стадию введения пациенту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли.
Текст
Соединения формулы (I) или их фармацевтически приемлемые соли являются агонистами GPCR(G-белок-сопряженных рецепторов) и полезны для лечения ожирения и диабета. Файф Мэттью Колин Тор,Дживаратнам Ревати Перпетуа, Кейли Джон, Суэйн Саймон Эндрю (GB) Поликарпов А.В., Борисова Е.Н. (RU) 016507 Изобретение относится к агонистам G-белок-сопряженных рецепторов (GPCR). В частности, настоящее изобретение относится к агонистам GPCR, которые полезны для лечения ожирения, например в качестве регуляторов насыщения, метаболического синдрома и для лечения диабета. Ожирение характеризуется избыточной массой жировой ткани по сравнению с размером тела. С клинической точки зрения жировую массу тела оценивают по индексу массы тела (BMI; масса(кг)/рост(м)2) или окружности талии. Субъекты считаются тучными, когда BMI составляет более 30, и установлены медицинские последствия избыточного веса. С некоторого времени в медицинском мире существует точка зрения, что повышенная масса тела, в особенности как результат абдоминального жира тела, ассоциирована с повышенным риском диабета, гипертензии, болезни сердца и другими многочисленными осложнениями состояния здоровья, такими как артрит, инсульт, заболевание желчного пузыря,мышечные и респираторные проблемы, боль в спине и даже некоторые виды рака. Фармакологические подходы к лечению ожирения главным образом касаются уменьшения жировой массы путем изменения баланса между потреблением и расходом энергии. Во многих исследованиях установлена четкая связь между ожирением и мозговым кровообращением (brain circuitry), вовлеченным в регуляцию энергетического гомеостаза. Прямые и опосредованные данные позволяют предположить,что серотонинергический, дофаминергический, адренергический, холинергический, эндоканнобиноидный, опиоидный и гистаминергический проводящие пути в дополнение ко многим нейропептидным проводящим путям (например, нейропептид Y и меланокортины) вовлечены в центральный контроль потребления и расхода энергии. Гипоталамические центры также обладают способностью распознавать периферические гормоны, вовлеченные в поддержание массы тела и степени ожирения, такие как инсулин и лептин, и пептиды, происходящие из жировой ткани. Лекарственные средства, нацеленные на патофизиологию, ассоциированную с инсулинзависимым диабетом I типа и инсулиннезависимым диабетом II типа, имеют многочисленные возможные побочные эффекты и действуют неадекватно в отношении дислипидемии и гипергликемии у значительной части пациентов. Лечение зачастую сфокусировано на индивидуальных потребностях пациента с использованием диеты, физических упражнений, гипогликемических агентов и инсулина, однако существует потребность в новых антидиабетических агентах, в частности таких, которые могут лучше переноситься пациентом и с меньшими неблагоприятными эффектами. Аналогично, метаболический синдром (синдром X) определяет людей в группу с высоким риском ишемической болезни сердца и характеризуется набором факторов риска, включая центральное ожирение (избыток жировой ткани в абдоминальной области), непереносимость глюкозы, высокое содержание триглицеридов и низкое содержание холестерина HDL (липопротеинов высокой плотности) и высокое кровяное давление. Миокардиальная ишемия и микрососудистое заболевание являются установленным заболеванием, ассоциированным с нелеченным или плохо контролируемым метаболическим синдромом. Существует постоянная потребность в новых агентах против ожирения и антидиабетических агентах, в частности агентах с лучшей переносимостью и с меньшими неблагоприятными эффектами.SNORF25 в WO 00/50562, где описаны рецепторы как человека, так и крыс, в US 6468756 также описан рецептор мышей (инвентарные номера: AAN95194 (человек), AAN95195 (крыса) и ANN95196 (мышь. У людей GPR119 экспрессируется в поджелудочной железе, тонком кишечнике, толстой кишке и жировой ткани. Профиль экспрессии человеческого рецептора GPR119 показывает его потенциальную полезность в качестве мишени для лечения ожирения и диабета. В международных заявках на патент WO 2005/061489, WO 2006/070208, WO 2006/067531 и WO 2006/067532 описаны гетероциклические производные в качестве агонистов рецептора GPR119. В международных заявках на патент PCT/GB 2006/050176, PCT/GB 2006/050177, PCT/GB 2006/050178 иPCT/GB 2006/050182 (опубликованных после даты приоритета настоящей заявки) описаны другие агонисты рецептора GPR119. Настоящее изобретение относится к агонистам GPR119, которые полезны для лечения ожирения,например в качестве периферических регуляторов насыщения, метаболического синдрома и для лечения диабета. Краткое изложение сущности изобретения Соединения формулы (I) или их фармацевтически приемлемые соли являются агонистами GPR119 и полезны для профилактического или терапевтического лечения ожирения и диабета.-1 016507 Подробное описание изобретения Настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли: где один из X и Y представляет собой О, а другой представляет собой N;R2 представляет собой водород или метил;R3 представляет собой водород или метил;R6 и R7 независимо представляют собой водород, С 1-4 алкил, который возможно может быть замещен галогеном, гидрокси, С 1-4 алкокси-, С 1-4 алкил-S(O)m-, N(R8)2 или -C(O)OR9; или может представлять собой С 3-7 циклоалкил, где данные циклические группы могут быть замещены одним или более заместителями, выбранными из галогена, С 1-4 алкила, С 1-4 фторалкила, OR6, CN, SO2CH3 и N(R8)2; или R6 и R7,взятые вместе, могут образовать 5- или 6-членное гетероциклическое кольцо, возможно замещенное гидрокси, С 1-4 алкилом или С 1-4 гидроксиалкилом и возможно содержащее дополнительный гетероатом, выбранный из О и NR8;R8 независимо представляет собой водород или С 1-4 алкил; или группа N(R8)2 может образовать 4-7 членное гетероциклическое кольцо, возможно содержащее дополнительный гетероатом, выбранный из О и NR8;R9 представляет собой водород или С 1-4 алкил; иm равно 0, 1 или 2. В одном воплощении изобретения X представляет собой О, а в другом Y представляет собой О.X предпочтительно представляет собой О.Y предпочтительно представляет собой N. Когда R1 представляет собой CONHR6, то R2 предпочтительно представляет собой метил. В одном воплощении изобретения R3 представляет собой водород, а в другом R3 представляет собой метил. Когда R3 представляет собой метил, то образовавшийся стереоцентр предпочтительно имеетR4 предпочтительно представляет собой С 3-4 алкил, в частности н-пропил, изопропил или третбутил, еще более предпочтительно С 3 алкил, особенно изопропил.R5 предпочтительно представляет собой метил.R6 предпочтительно представляет собой водород, С 1-3 алкил или С 2-3 алкил, замещенный гидрокси, a 7R предпочтительно представляет собой водород. Когда R6 представляет собой С 2-3 алкил, замещенный гидрокси, тогда он может быть замещен одной или более чем одной, например 1 или 2, предпочтительно 1, гидроксигруппой.R6 более предпочтительно представляет собой C1-3 алкил или C2-3 алкил, замещенный гидрокси, более предпочтительно С 2-3 алкил, замещенный гидрокси, например 2-гидроксиэтил, 2-гидрокси-1 метилэтил, 2,3-дигидроксипропил или 2-гидрокси-1-гидроксиметилэтил, предпочтительно 2-гидроксиэтил или 2-гидрокси-1-метилэтил, еще более предпочтительно 2-гидрокси-1-метилэтил, особенно (R)-2 гидрокси-1-метилэтил. Поскольку предпочтительные группы для каждой переменной в общем случае приведены выше отдельно для каждой переменной, предпочтительные соединения по этому изобретению включают соединения, в которых несколько переменных или каждая переменная в формуле (I) выбрана из предпочтительных, более предпочтительных или конкретно перечисленных групп для каждой переменной. Следовательно, предполагается, что это изобретение включает все комбинации предпочтительных, более предпочтительных и конкретно перечисленных групп. Особыми соединениями по изобретению, которые могут быть упомянуты, являются соединения,включенные в примеры, и их фармацевтически приемлемые соли. Как использовано в данном описании и если не указано иное, "алкил" означает углеродные цепи,которые могут быть линейными или разветвленными или их комбинациями. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил и пентил. Термин "галоген" включает атомы фтора, хлора, брома и йода, в частности фтора или хлора, особенно фтора. Соединения, описанные в данном изобретении, могут содержать один или более асимметрических центров и поэтому могут давать диастереомеры и оптические изомеры. Настоящее изобретение включает-2 016507 все такие возможные диастереомеры, а также их рацемические смеси, их по существу чистые разрешенные энантиомеры, все возможные геометрические изомеры и их фармацевтически приемлемые соли. Вышеупомянутая формула (I) показана без определенной стереохимии по некоторым положениям. Настоящее изобретение включает все стереоизомеры формулы (I) и их фармацевтически приемлемые соли. Кроме того, также включены смеси стереоизомеров, а также выделенные конкретные стереоизомеры. В ходе выполнения методик синтеза, используемых для получения таких соединений, или при применении методик рацемизации или эпимеризации, известных специалистам в данной области техники, продукты таких методик могут представлять собой смесь стереоизомеров. В том случае, когда соединение формулы (I) и его фармацевтически приемлемые соли существуют в форме сольватов или полиморфных форм, настоящее изобретение включает все возможные сольваты и полиморфные формы. Тип растворителя, в котором образуется сольват, особо не ограничивается при условии, что растворитель является фармакологически приемлемым. Например, можно использовать воду, этанол, пропанол, ацетон или тому подобное. Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают, например, соляную, метансульфоновую, серную, пара-толуолсульфоновую кислоту и тому подобное. Поскольку соединения формулы (I) предназначены для фармацевтического применения, они предпочтительно предложены по существу в чистой форме, например по меньшей мере 60% чистоты, более предпочтительно по меньшей мере 75% чистоты, в особенности по меньшей мере 98% чистоты (% по массе от навески). Соединения формулы (I) могут быть получены, как описано ниже. PG представляет собой защитную группу, G представляет собой замещенный оксадиазол, как описано выше, и R1, R2, R3 и R4 являются такими, как описано выше. Соединения формулы (II), где PG представляет собой подходящую защитную группу, легко могут быть получены из известных соединений (схема 1). Например, сложный этиловый эфир соединения (II),где PG представляет собой Вос, описан ранее (патент США 6518423). В результате гидрирования в стандартных условиях будет получено рацемическое соединение формулы (III). В результате "хирального восстановления" алкена в подходящих условиях, таких как гидрирование в присутствии хирального катализатора, получают соединения формулы (III) в значительном энантиомерном избытке. Примером подходящего катализатора является [Rh(норборнадиен)2]BF4 и (S)-1-[(R)-2-(ди-трет-бутилфосфино)ферроценил]этилбис(2-метилфенил)фосфин. Затем могут быть получены соединения формулы (IV) путем восстановления карбоновых кислот формулы (III) в стандартных условиях, например с использованием борана в подходящем растворителе, таком как THF. Удаления защитной группы далее достигают в условиях, хорошо известных специалистам в данной области техники. Схема 1 Соединение формулы (V), где R3 представляет собой Н, является известным соединением (схема 2,Siegel, M. G. et al. Tetrahedron 1999, 55, 11619-11639). Соединения формулы (VII) могут быть получены из соединений формулы (V) в стандартных условиях. Например, в результате обработки соединений формулы (V) цианогенбромидом с последующей конденсацией полученного цианамида (VI) с соединением формулы (IX) в стандартных условиях получают соединения формулы (VII), где X представляет собой О. Соединения формулы (IX) либо имеются в продаже, либо их легко получают из соответствующих карбоновых кислот, используя общеизвестные методики. Альтернативно, синтез региоизомерного оксадиазола, где Y представляет собой О, может быть успешно выполнен путем нагревания соединений формулы (VI) с гидроксиламином с получением N-гидроксигуанидинов формулы (VIII), которые могут быть подвергнуты реакции конденсации с карбоновой кислотой формулы (X) в подходящих условиях. Кислоты формулы (X) имеются в продаже. Схема 2 Соединения формулы (VII) также могут быть получены путем конденсации амина (V) с оксадиа-3 016507 золхлоридом формулы (XI), как проиллюстрировано на Схеме 3 (Buscemi, S. et al. JCS Perkin I: Org. and Соединения формулы (I), где R1 представляет собой либо сульфон, либо амид, могут быть образованы, как изображено на схеме 4. Соединение, где R1 представляет собой метилсульфонил, a R2 представляет собой водород, описано ранее (WO 2005/063738). В результате объединения соединений формулы (VIII) и формулы (VII) с использованием условий Мицунобу, например в подходящем растворителе, таком как THF, при температуре от0 С до комнатной температуры, с последующим добавлением трифенилфосфина и диизопропилазодикарбоксилата получают соединения формулы (I). Соединения формулы (I), где R1 представляет собой амид, могут быть синтезированы, начиная с имеющегося в продаже соединения формулы (VIII), где R1 представляет собой циано, a R2 представляет собой метил, с использованием химии, хорошо известной специалистам данной области техники. Например, в результате конденсации по Мицунобу этого соединения со спиртом формулы (VII) будет получен цианопиридин,который может быть превращен в соответствующую кислоту посредством гидролиза, затем в желаемые амиды посредством стандартных методик образования амидной связи. Аминопиридины формулы (I) могут быть получены из соответствующих сульфонов формулы (I) путем замещения алкансульфината соответствующим амином в результате нагревания при повышенной температуре. Схема 4 Другие соединения формулы (I) могут быть получены способами, аналогичными описанным выше,или по существу известными способами. Соединения формулы (I) могут быть получены по отдельности или в виде библиотек соединений,содержащих по меньшей мере 2 соединения, например 5-1000 соединений и более предпочтительно 10100 соединений формулы (I). Библиотеки соединений могут быть получены с применением комбинаторного подхода "расщепляй и смешивай" ("split and mix") или в результате многократных параллельных процедур синтеза с использованием либо химии в растворе, либо твердофазной химии с применением методик, известных специалистам в данной области техники. В процессе синтеза соединений формулы (I) активные функциональные группы в промежуточных соединениях, например группы гидрокси, карбокси и амино, могут быть защищены. Защитные группы можно удалить на любой стадии синтеза соединений формулы (I), или они могут присутствовать в конечном соединении формулы (I). Всестороннее обсуждение способов возможной защиты различных активных функциональных групп и методов расщепления полученных защищенных производных приведено, например, в Protective Groups in Organic Chemistry, T.W. Greene and P.G.M. Wuts, (1991) Wileylnterscience, New York, 2-е издание. Любые новые промежуточные соединения, такие как соединения, определенные выше, могут быть использованы в синтезе соединений формулы (I) и поэтому также включены в объем изобретения, а также их соли или защищенные производные. Как указано выше, соединения формулы (I) полезны в качестве агонистов GPR119, например, для лечения и/или профилактики ожирения и диабета. Для такого применения соединения формулы (I) обычно будут вводить в форме фармацевтической композиции. В изобретении также предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в качестве фармацевтического средства. В изобретении также предложена фармацевтическая композиция, содержащая соединение формулы(I) в комбинации с фармацевтически приемлемым носителем. Предпочтительно такая композиция состоит из фармацевтически приемлемого носителя и нетоксичного терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Кроме того, в изобретении также предложена фармацевтическая композиция для лечения заболевания посредством модулирования GPR119, результатом чего является профилактическое или терапевтическое лечение ожирения, например путем регуляции насыщения, или для лечения диабета, содержащая фармацевтически приемлемый носитель и нетоксичное терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли.-4 016507 Фармацевтические композиции возможно могут содержать другие терапевтические ингредиенты или адъюванты. Такие композиции включают композиции, подходящие для перорального, ректального,местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя наиболее подходящий путь в любом заданном случае будет зависеть от конкретного пациента и природы и тяжести состояний, для которых вводят данный активный ингредиент. Для удобства фармацевтические композиции могут быть представлены в стандартной лекарственной форме и изготовлены любым из способов, общеизвестных в фармацевтике. На практике соединения формулы (I) или их фармацевтически приемлемые соли можно комбинировать в виде активного ингредиента в тонкоизмельченной смеси с фармацевтическим носителем в соответствии с традиционными методиками приготовления фармацевтических смесей. Носитель может быть представлен широким разнообразием форм в зависимости от формы композиции, необходимой для введения, например перорального или парентерального (включая внутривенное). Так, фармацевтические композиции могут быть представлены в виде дискретных единиц, подходящих для перорального введения, таких как капсулы, облатки или таблетки, каждая из которых содержит заданное количество активного ингредиента. Кроме того, композиции могут быть представлены в виде порошка, в виде гранул, в виде раствора, в виде суспензии в водной жидкости, в виде неводной жидкости, в виде эмульсии типа масло-в-воде или в виде эмульсии типа вода-в-масляной жидкости. В дополнение к общепринятым лекарственным формам, приведенным выше, соединение формулы (I) или его фармацевтически приемлемую соль также можно вводить, используя средства и/или устройства доставки с регулируемым высвобождением. Такие композиции можно изготовить любым из способов фармацевтики. В общем случае такие способы включают стадию объединения активного ингредиента с носителем,состоящим из одного или более необходимых ингредиентов. В общем случае такие композиции изготавливают путем однородного и тщательного смешивания активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или и теми и другими. Затем продукт может быть сформован в желаемую форму. Соединения формулы (I) или их фармацевтически приемлемые соли также могут быть включены в фармацевтические композиции в комбинации с одним или более чем одним другим терапевтически активным соединением. Используемый фармацевтический носитель может быть, например твердым, жидким или газообразным. Примеры твердых носителей включают лактозу, магнезию (terra alba), сахарозу, тальк, желатин,агар, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Примерами жидких носителей являются сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают двуокись углерода и азот. При изготовлении композиций для пероральной лекарственной формы можно использовать любые удобные фармацевтические среды. Например, воду, гликоли, масла, спирты, корригенты, консерванты,окрашивающие агенты и тому подобное можно использовать для создания пероральных жидких препаратов, таких как суспензии, эликсиры и растворы; тогда как для образования пероральных твердых препаратов, таких как порошки, капсулы и таблетки, можно использовать такие носители, как крахмалы,сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие вещества,связующие, разрыхлители и тому подобное. Из-за легкости их введения таблетки и капсулы являются предпочтительными пероральными стандартными лекарственными формами, поэтому применяют твердые фармацевтические носители. Возможно, что таблетки могут иметь покрытие, наносимое с использованием стандартных методик в водных или неводных условиях. Таблетка, содержащая композицию по данному изобретению, может быть изготовлена прессованием или формованием, возможно с использованием одного или более вспомогательных ингредиентов или адъювантов. Прессованные таблетки могут быть изготовлены путем прессования в подходящей машине активного ингредиента в свободно текучей форме, такой как порошок или гранулы, возможно смешанного со связующим, смазывающим веществом, инертным разбавителем, поверхностно-активным веществом или диспергирующим агентом. Формованные таблетки могут быть изготовлены формованием в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от примерно 0,05 мг до примерно 5 г активного ингредиента, и каждая облатка или капсула предпочтительно содержит от примерно 0,05 мг до примерно 5 г активного ингредиента. Например, композиция, предназначенная для перорального введения людям, может содержать от примерно 0,5 мг до примерно 5 г активного агента, смешанного с подходящим и приемлемым количеством вещества-носителя, которое может варьировать от примерно 5 до примерно 95 процентов от общей композиции. Стандартные лекарственные формы в общем случае будут содержать от примерно 1 мг до примерно 2 г активного ингредиента, обычно 25, 50, 100, 200, 300, 400, 500, 600, 800 или 1000 мг. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, могут быть изготовлены в виде растворов или суспензий активных соединений в воде. Туда может быть включено подходящее поверхностно-активное вещество, такое как, например, гидроксипропилцеллюлоза. Также могут быть изготовлены дисперсии в глицерине, жидких полиэтиленгликолях и их-5 016507 смесях в маслах. Кроме того, может быть включен консервант для предотвращения нежелательного роста микроорганизмов. Фармацевтические композиции по настоящему изобретению, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии. Кроме того, композиции могут быть в форме стерильных порошков для экстемпорального приготовления таких стерильных инъекционных растворов или дисперсий. Во всех случаях конечная инъекционная форма должна быть стерильна и должна представлять собой эффективно текучую среду, чтобы ее можно было легко ввести посредством шприца. Фармацевтические композиции должны быть стабильны в условиях их изготовления и хранения; следовательно, предпочтительно должны быть защищены от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например глицерин, пропиленгликоль и жидкий полиэтиленгликоль), растительные масла и их подходящие смеси. Фармацевтические композиции по настоящему изобретению могут быть в форме, подходящей для местного применения, такой как, например аэрозоль, крем, мазь, лосьон, присыпка или тому подобное. Кроме того, композиции могут быть в форме, подходящей для применения в трансдермальных устройствах. Такие композиции могут быть изготовлены с использованием соединения формулы (I) или его фармацевтически приемлемой соли посредством традиционных методов обработки. Например, крем или мазь готовят путем смешивания гидрофильного вещества и воды вместе с соединением в количестве от примерно 5 мас.% до примерно 10 мас.% для получения крема или мази желаемой консистенции. Фармацевтические композиции по данному изобретению могут быть в форме, подходящей для ректального введения, где носитель представляет собой твердое вещество. Предпочтительно, чтобы из смеси можно было сформировать суппозитории, содержащие стандартную дозу. Подходящие носители включают масло какао и другие вещества, обычно используемые в данной области техники. Для удобства суппозитории можно создавать сначала путем смешивания композиции с размягченным(и) или расплавленным(и) носителем(ями), а затем охлаждения и придания формы в пресс-формах. В дополнение к вышеупомянутым ингредиентам носителя фармацевтические композиции, описанные выше, могут включать, при необходимости, один или более дополнительных ингредиентов носителя,таких как разбавители, буферы, корригенты, связующие, поверхностно-активные агенты, загустители,смазывающие вещества, консерванты (включая антиоксиданты) и тому подобное. Кроме того, можно включать и другие адъюванты для того, чтобы сделать композицию изотоничной крови предполагаемого реципиента. Композиции, содержащие соединение формулы (I) или его фармацевтически приемлемые соли, также могут быть получены в концентрированной порошковой или жидкой форме. В общем случае, в лечении вышеуказанных состояний полезны уровни дозировок порядка от 0,01 мг/кг до примерно 150 мг/кг массы тела в сутки или, альтернативно, от примерно 0,5 мг до примерно 7 г на одного пациента в сутки. Например, ожирение можно эффективно лечить путем введения от примерно 0,01 до 50 мг соединения на килограмм массы тела в сутки или, альтернативно, от примерно 0,5 мг до примерно 3,5 г на одного пациента в сутки. Однако понятно, что определенный уровень доз для любого конкретного пациента будет зависеть от ряда факторов, включая возраст, массу тела, общее состояние здоровья, пол, питание, время введения,путь введения, скорость выведения, лекарственную комбинацию и тяжесть конкретного заболевания,которое лечат. Соединения формулы (I) могут быть использованы в лечении заболеваний или состояний, в которых играет роль GPR119. Таким образом, в изобретении также предложен способ лечения заболевания или состояния, в котором играет роль GPR119, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Заболевания или состояния, в которых играет роль GPR119, включают ожирение и диабет. В контексте настоящей заявки предполагается, что лечение ожирения охватывает лечение таких заболеваний или состояний, как ожирение и другие расстройства приема пищи, ассоциированные с избыточным потреблением пищи, например путем снижения аппетита и массы тела, поддержания снижения массы и предупреждения обратного эффекта и диабета (включая диабет 1 типа и 2 типа, нарушенную толерантность к глюкозе, инсулинорезистентность и диабетические осложнения, такие как невропатия, нефропатия, ретинопатия, катаракты,сердечно-сосудистые осложнения и дислипидемия), и лечение пациентов с аномальной чувствительностью к всасываемым жирам, приводящей к функциональной диспепсии. Соединения по изобретению также можно применять для лечения метаболических заболеваний, таких как метаболический синдром(синдром X), нарушенная толерантность к глюкозе, гиперлипидемия, гипертриглицеридемия, гиперхолестеринемия, низкие уровни HDL и гипертензия. Соединения по изобретению могут давать преимущества по сравнению с соединениями, действующими посредством других механизмов для лечения вышеупомянутых расстройств, в том, что они могут обеспечивать бета-клеточную защиту, увеличение уровня цАМФ и секреции инсулина, а также медленное опорожнение желудка. Соединения по изобретению также могут быть использованы для лечения состояний, характери-6 016507 зующихся низкой костной массой, таких как остеопения, остеопороз, ревматоидный артрит, остеоартрит,периодонтальное заболевание, потеря альвеолярной кости, потеря костной ткани вследствие остеотомии,идиопатический остеопороз у детей, болезнь Педжета, потеря костной ткани вследствие метастатического рака, остеолитические поражения, искривление позвоночника и уменьшение роста. В изобретении также предложен способ регуляции насыщения, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ лечения ожирения, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ лечения диабета, включая диабет 1 типа и 2 типа, в частности диабет 2 типа, включающий стадию введения пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ лечения метаболического синдрома (синдрома X), нарушенной толерантности к глюкозе, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, низких уровней HDL или гипертензии, включающий стадию введения пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложены соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении состояния, которое определено выше. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения состояния, которое определено выше. В способах по изобретению термин "лечение" включает как терапевтическое, так и профилактическое лечение. Соединения формулы (I) могут демонстрировать преимущественные свойства по сравнению с известными агонистами GPR119, например соединения могут демонстрировать улучшенную эффективность или стабильность или улучшенную растворимость, что приводит таким образом к улучшению абсорбционных свойств и биодоступности, или другие преимущественные свойства, характеризующие соединения, используемые в качестве фармацевтических средств. Соединения формулы (I) или их фармацевтически приемлемые соли можно вводить сами по себе или в комбинации с одним или более чем одним другим терапевтически активным соединением. Другие терапевтически активные соединения могут быть полезны для лечения того же заболевания или состояния, что и соединения формулы (I), либо другого заболевания или состояния. Терапевтически активные соединения можно вводить одновременно, последовательно или по отдельности. Соединения формулы (I) можно вводить с другими активными соединениями, полезными для лечения ожирения и/или диабета, например с инсулином и аналогами инсулина, ингибиторами липазы желудка, ингибиторами панкреатической липазы, сульфонилмочевинами и их аналогами, бигуанидами, 2 агонистами, глитазонами, агонистами PPAR- (рецептор-, активируемый пролифератором пероксисом),смешанными агонистами PPAR-/, агонистами RXR (ретиноидный Х-рецептор), ингибиторами окисления жирных кислот, ингибиторами -глюкозидазы, ингибиторами дипептидилпептидазы IV, агонистамиGLP-1 (глюкагоноподобный пептид-1), например аналогами и миметиками GLP-1,-агонистами, ингибиторами фосфодиэстеразы, снижающими содержание липидов агентами, ингибиторами гликогенфосфорилазы, агентами против ожирения, например ингибиторами панкреатической липазы, антагонистами МСН-1 (меланин-концентрирующий гормон) и антагонистами (или обратными агонистами) СВ-1 (каннабиноидный рецептор-1), антагонистами амилина, ингибиторами липоксигеназы, аналогами сомастатина, активаторами глюкокиназы, антагонистами глюкагона, агонистами инсулинового сигнального пути,ингибиторами РТР 1 В (протеинтирозинфосфатаза 1 В), ингибиторами глюконеогенеза, антилиполитическими агентами, ингибиторами GSK (киназа гликогенсинтазы), агонистами рецептора галанина, аноректическими агентами, агонистами рецепторов ССК (холецистокинин), лептином, серотонинергическими/дофаминергическими лекарственными средствами против ожирения, ингибиторами обратного захвата, например сибутрамином, антагонистами CRF (кортикотропин-рилизинг-фактор), CRF-связывающими белками, тиреомиметическими соединениями, ингибиторами альдозоредуктазы, антагонистами глюкокортикоидных рецепторов, ингибиторами NHE-1 (натрий-водородный обмен типа 1) или ингибиторами сорбитолдегидрогеназы. Комбинированная терапия, включающая введение соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одного другого агента против ожирения, представляет собой следующий аспект изобретения. В настоящем изобретении также предложен способ лечения ожирения у млекопитающего, такого как человек, включающий введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и другого агента против ожирения млекопитающему, нуждающемуся в этом.-7 016507 В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли и другого агента против ожирения для лечения ожирения. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для применения в комбинации с другим агентом против ожирения, полезным для лечения ожирения. Соединение формулы (I) или его фармацевтически приемлемую роль и другой агент(ы) против ожирения можно вводить совместно или вводить последовательно либо по отдельности. Совместное введение включает введение композиции, содержащей как соединение формулы (I) или его фармацевтически приемлемую соль, так и другой(ие) агент(ы) против ожирения, или одновременное либо раздельное введение разных композиций каждого агента. Если фармакологические профили соединения формулы (I) или его фармацевтически приемлемой соли и другого агента(ов) против ожирения позволяют осуществить совместное введение двух агентов, то это может быть предпочтительным. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли и другого агента против ожирения в изготовлении лекарственного средства для лечения ожирения. В изобретении также предложена фармацевтическая композиция, содержащая соединение формулы(I) или его фармацевтически приемлемую соль и другой агент против ожирения и фармацевтически приемлемый носитель. Изобретение также охватывает применение таких композиций в способах, описанных выше. Агонисты GPR119 находят конкретное применение в комбинации с центрально действующими агентами против ожирения. Другим агентом против ожирения для применения в комбинированных терапиях в соответствии с этим аспектом изобретения предпочтительно является модулятор СВ-1, например антагонист или обратный агонист СВ-1. Примеры модуляторов СВ-1 включают SR141716 (римонабант) и SLV-319 4S)-(-)-3(4-хлорфенил)-N-метил-N-[(4-хлорфенил)сульфонил]-4-фенил-4,5-дигидро-1 Н-пиразол-1-карбоксамид); а также соединения, раскрытые в ЕР 576357, ЕР 656354, WO 03/018060, WO 03/020217, WO 03/020314,WO 03/026647, WO 03/026648, WO 03/027076, WO 03/040105, WO 03/051850, WO 03/051851, WO 03/053431, WO 03/063781, WO 03/075660, WO 03/077847, WO 03/078413, WO 03/082190, WO 03/082191,WO 03/082833, WO 03/084930, WO 03/084943, WO 03/086288, WO 03/087037, WO 03/088968, WO 04/012671, WO 04/013120, WO 04/026301, WO 04/029204, WO 04/034968, WO 04/035566, WO 04/037823,WO 04/052864, WO 04/058145, WO 04/058255, WO 04/060870, WO 04/060888, WO 04/069837, WO 04/072076, WO 04/072077, WO 04/078261 и WO 04/108728 и в описанных там ссылках. Другие заболевания или состояния, в которых, как полагают, играет роль GPR119, включают заболевания или состояния, описанные в WO 00/50562 и US 6468756, например сердечно-сосудистые расстройства, гипертензию, респираторные расстройства, гестационные нарушения, желудочно-кишечные расстройства, иммунные расстройства, скелетно-мышечные расстройства, депрессию, фобии, тревогу,расстройства настроения и болезнь Альцгеймера. Все публикации, включая, но не ограничиваясь этим, патенты и заявки на патент, приведенные в данном описании, включены в данное описание посредством ссылки, как если бы каждая отдельная публикация конкретно и отдельно была включена в данное описание посредством ссылки в полном объеме. Теперь изобретение будет описано со ссылкой на следующие ниже примеры, которые приведены для иллюстративных целей и не должны истолковываться как ограничивающие объем настоящего изобретения. Примеры Материалы и методы Колоночную хроматографию проводили на SiO2 (40-63 меш), если не указано иное. Данные LCMS(жидкостная хроматография с масс-спектроскопией) получали следующим образом: колонка Atlantis, 3 мкм С 18 (3,020,0 мм, скорость потока = 0,85 мл/мин) с элюированием раствором Н 2 О-CH3CN, содержащим 0,1% НСО 2 Н, в течение 6 мин с УФ-детекцией при 220 нм. Информация о градиенте: 0,0-0,3 мин: 100% Н 2 О; 0,3-4,25 мин: линейное возрастание до 10% Н 2 О-90% CH3CN; 4,25-4,4 мин: линейное возрастание до 100% CH3CN; 4,4-4,9 мин: выдерживание при 100% CH3CN; 4,9-6,0 мин: возвращение к 100% Н 2 О. Масс-спектры получали, используя источник ионизации электрораспылением как в режиме положительно заряженных ионов (ES+), так и в режиме отрицательно заряженных ионов (ES-). Сокращения и акронимы. Ас: ацетил; DIPEA: N,N-диизопропилэтиламин; DMF: диметилформамид;EDCI: 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид; Et: этил; ч: час(ы); HOBt: 1 гидроксибензотриазол; IH: изогексан; iPr: изопропил; Me: метил; RT: время удерживания; THF: тетрагидрофуран; TMEDA: N',N',N,N-тетраметилэтилендиамин. Синтезы следующих соединений описаны в других работах: N-гидроксиизобутирамидин: J. Org.Chem. 2003, 68, 7316-7321; 3-пиперидин-4-илпропан-1-ол: Tetrahedron 1999, 55, 11619-11639. Все остальные соединения доступны из коммерческих источников. Подготовительный пример 1. 4-(3-Гидроксипропил)пиперидин-1-карбонитрилCH2Cl2 (19 мл) добавляли к реакционной смеси в течение 1 мин, затем перемешивание продолжали при 0 С в течение 0,5 ч. Затем реакционную смесь перемешивали при 20 С в течение 2 ч, после чего промывали насыщенным водным NaHCO3 и рассолом. Раствор в CH2Cl2 сушили (MgSO4), фильтровали и концентрировали в вакууме, получая масло, которое растворяли в небольшом количестве CH2Cl2, после чего фильтровали через слой SiO2, элюируя EtOAc. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения: m/z (ES+) = 169,1 [М+Н]+. Подготовительный пример 2. 3-[1-(3-Изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропан-1 олZnCl2 (1 M В Et2O, 145 мл, 145 ммоль) добавляли в течение 20 мин к перемешиваемому раствору 4(3-гидроксипропил)пиперидин-1-карбонитрила (подготовительный пример 1; 20,3 г; 121 ммоль) и Nгидроксиизобутирамидина (14,8 г; 145 ммоль) в ЕЮАс (290 мл) и THF (270 мл). Через 2 ч белый осадок,который образовался, собирали и промывали THF-EtOAc (1:1, 50 мл). Этот осадок растворяли в EtOH(550 мл) и 12 М HCl (70 мл), затем раствор перемешивали с нагреванием до 70 С в течение 16 ч. EtOH удаляли в вакууме, остаток разбавляли Н 2 О, затем рН подводили до 7, используя твердый NaHCO3. Смесь экстрагировали EtOAc (3 х), затем объединенные экстракты промывали рассолом, затем сушили(MgSO4). После фильтрации и удаления растворителей получали указанное в заголовке соединение: m/z Перемешиваемый раствор метил-5-гидроксипиридин-2-карбоксилата (726 мг; 4,7 ммоль), 3-[1-(3 изопропил[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропан-1-ола (подготовительный пример 2; 1,00 г; 4,0 ммоль) и трифенилфосфина (1,24 г; 4,7 ммоль) в THF обрабатывали по каплям диизопропилазодикарбоксилатом (1,1 мл; 4,7 ммоль). Через 16 ч реакционную смесь концентрировали, затем остаток растворяли в ЕЮАс. Раствор промывали 2 М NaOH (2) и рассолом, затем сушили (MgSO4), фильтровали и концентрировали. Затем остаток перемешивали с небольшим количеством Et2O при 0 С. Через 40 мин смесь фильтровали, затем фильтрат концентрировали и остаток очищали колоночной хроматографией(EtOAc-CH2Cl2, 3:7), получая метил-5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропоксипиридин-2-карбоксилат: m/z (ES+) = 389,00 [М + Н]+. Смесь этого сложного эфира (1,34 г; 3,5 ммоль), LiOHH2O (1,45 г; 34,6 ммоль), МеОН (26 мл) и Н 2 О (7 мл) перемешивали при 20 С в течение 16 ч. МеОН удаляли в вакууме, затем еще раз добавляли Н 2 О. Раствор промывали ЕЮАс (2), после чего подкисляли до рН 5, используя 2 М HCl. Образовавшийся осадок собирали и сушили под вакуумом с получением указанного в заголовке соединения: m/z (ES+) = 374,96 [М + Н]+. Подготовительный пример 4. 5-3-[1-(3-Изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-3-метилпиридин-2-карбоновая кислота После конденсации по Мицунобу 5-гидрокси-3-метилпиридин-2-карбонитрила (1,00 г; 7,5 ммоль) с 3-[1-(3-изопропил[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропан-1-олом (подготовительный пример 2; 1,57 г; 6,2 ммоль) по методике, аналогичной изложенной в подготовительном примере 3, получали 5-3[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-3-метилпиридин-2-карбонитрил: m/z(ES+) = 370,01 [М+Н]+. Раствор этого нитрила (500 мг; 1,4 ммоль) в EtOH (8 мл) и 2 М NaOH (4 мл; 8,0 ммоль) нагревали при 70 С в течение 7 ч, после чего перемешивали при температуре окружающей среды в течение 16 ч. EtOH удаляли при пониженном давлении, затем остаток разбавляли Н 2 О. Раствор промывали EtOAc (2), после чего подкисляли до рН 5, используя 2 М HCl. Смесь экстрагировали EtOAc (2),затем объединенные экстракты сушили (MgSO4), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (MeOH-CH2Cl2 (1:9, получая указанное в заголовке соединение: RT = 3,31 мин; m/z (ES+) = 389,02 [М + Н]+. После конденсации по Мицунобу 2-бром-5-гидроксипиридина с 3-[1-(3-изопропил[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропан-1-олом (подготовительный пример 2) по методике, аналогичной изложенной в Подготовительном примере 3, получали указанное в заголовке соединение: RT = 4,01 мин; m/z Раствор 5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-3-метилпиридин 2-карбоновой кислоты (подготовительный пример 4; 178 мг, 459 мкмоль), EDCl (176 мг, 917 мкмоль),HOBt (141 мг, 917 мкмоль) и DIPEA (160 мкл; 917 мкмоль) в безводном THF (8 мл) перемешивали в течение 30 мин. Добавляли (R)-2-аминопропан-1-ол (108 мкл; 1376 мкмоль), затем перемешивание продолжали в течение 16 ч. Растворители удаляли при пониженном давлении, затем добавляли CH2Cl2. Раствор промывали Н 2 О, 2 М NaOH, H2O и рассолом, затем сушили (MgSO4). После фильтрации, выпаривания растворителей и колоночной хроматографии (EtOAc) получали указанное в заголовке соединение: H н-BuLi (322 мкл 2,5 М раствора в гексанах; 0,81 ммоль) добавляли по каплям к перемешиваемому раствору 2-бром-5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропоксипиридина (подготовительный пример 5; 300 мг; 0,73 ммоль) в безводном THF (4 мл) при -78 С. Через 15 мин реакционную смесь обрабатывали (MeS)2 (132 мкл; 1,47 ммоль), затем перемешивание продолжали при -78 С в течение дополнительных 15 мин. Затем реакционную смесь оставляли нагреваться до -50 С в течение 1 ч, затем окончательно нагреваться до комнатной температуры. Смесь распределяли между 1 М HCl иEtOAc, затем органическую фазу промывали 1 М NaOH и рассолом, затем сушили (MgSO4). Фильтрование, выпаривание растворителей и колоночная хроматография (EtOAc-IH, от 15% до 30%) позволили получить 5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-2-метилсульфанилпиридин. Перемешиваемый раствор этого простого тиоэфира (75 мг; 0,2 ммоль) в CH2Cl2 (10 мл) обрабатывали 3-хлорпербензойной кислотой (99 мг чистотой 70%; 0,4 ммоль). Через 40 мин реакционную смесь гасили водным Na2CO3, затем органическую фазу отделяли и концентрировали. Остаток очищали коло- 10016507 ночной хроматографией (EtOAc-IH, от 20 до 50%), получая указанное в заголовке соединение: RT = 3,55 мин; m/z (ES+) = 409,18 [М + Н]+. Следующее соединение также может быть получено способами, описанными выше: 5-(R)-3-[1-(3 изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]бутокси-2-метансульфонилпиридин. Биологическую активность соединений по изобретению можно протестировать в следующих аналитических системах. Репортерный анализ на дрожжах Репортерные анализы на дрожжевых клетках ранее описаны в литературе (например, см. Miret J. J.et al., 2002, J. Biol. Chem., 277: 6881-6887; Campbell R.M. et al., 1999, Bioorg. Med. Chem. Lett, 9: 24132418; King K. et al., 1990, Science, 250: 121-123; WO 99/14344; WO 00/12704; и US 6100042). Кратко,дрожжевые клетки конструировали таким образом, чтобы эндогенный дрожжевой G-альфа (GPA1 (Gбелок-альфа, 1 субъединица был делетирован и заменен G-белковыми химерными конструкциями, созданными с использованием разнообразных методик. Кроме того, был делетирован эндогенный дрожжевой GPCR, Ste3 для того, чтобы позволить осуществление гетерологичной экспрессии выбранного GPCR млекопитающих. В дрожжах элементы пути трансдукции сигналов феромонов, которые являются консервативными в эукариотических клетках (например митоген-активируемый протеинкиназный путь),управляют экспрессией Fus1. В результате помещения -галактозидазы (LacZ) под контроль промотораFus1 (Fus1p) была разработана система, посредством которой активация рецептора приводит к ферментативному считыванию. Дрожжевые клетки трансформировали путем адаптации метода с использованием ацетата лития,описанного Agatep и др. (Agatep, R. et al., 1998, Transformation of Saccharomyces cerevisiae by the lithiumacetate/single-stranded carrier DNA/polyethylene glycol (LiAc/ss-DNA/PEG) protocol. Technical Tips Online,Trends Journals, Elsevier). Кратко, дрожжевые клетки растили в течение ночи на планшетах с дрожжевым триптоном (YT). Однонитевую ДНК-носитель (10 мкг), по 2 мкг каждой из двух репортерных плазмидFus1p-LacZ (одну с селектируемым маркером URA и одну с TRP), 2 мкг GPR119 (человеческого или мышиного рецептора) в дрожжевом экспрессирующем векторе (2 мкг ориджина репликации) и ацетат лития/полиэтиленгликоль/ТЕ-буфер добавляли с помощью пипетки в пробирку Эппендорф. Дрожжевая экспрессирующая плазмида, содержащая рецептор/контроль без рецептора, имеет маркер LEU. Дрожжевые клетки инокулировали в эту смесь и реакцию проводили при 30 С в течение 60 мин. Затем дрожжевые клетки подвергали тепловому шоку при 42 С в течение 15 мин. Затем клетки промывали и рассевали на планшеты для селекции. Планшеты для селекции содержат определенные синтетические среды для дрожжей без LEU, URA и TRP (SD-LUT). После инкубации при 30 С в течение 2-3 суток колонии, растущие на планшетах для селекции, затем тестировали в LacZ-анализе. С целью проведения флуорометрических ферментативных анализов в отношении -галактозидазы дрожжевые клетки, несущие человеческий или мышиный рецептор GPR119, растили в течение ночи в жидкой среде SD-LUT до ненасыщающей концентрации (т.е. клетки все еще продолжали делиться и еще не достигали стационарной фазы). Их разбавляли в свежей среде до оптимальной для анализа концентрации и по 90 мкл дрожжевых клеток добавляли в 96-луночные черные планшеты из полистирола (Costar). Соединения, растворенные в ДМСО (диметилсульфоксид) и разведенные в 10%-ном растворе ДМСО до 10 Х концентрации, добавляли в планшеты и планшеты помещали при 30 С на 4 ч. Через 4 ч в каждую лунку добавляли субстрат для -галактозидазы. В этих экспериментах использовали флуоресцеин-ди-(-D-галактопиранозид) (FDG), субстрат для фермента, который высвобождает флуоресцеин, что позволяет производить флуорометрическое считывание. В каждую лунку добавляли по 20 мкл смеси 500 мкМ FDG/2,5% Тритон-Х 100 (детергент был необходим для того, чтобы сделать клетки проницаемыми). После инкубации клеток с субстратом в течение 60 мин в каждую лунку добавляли по 20 мкл 1 М карбоната натрия для остановки реакции и усиления сигнала флуоресценции. Затем планшеты считывали на флуориметре при 485/535 нм. Соединения по изобретению демонстрируют увеличение флуоресцентного сигнала по меньшей мере примерно в 1,5 раза по сравнению с фоновым сигналом (т.е. сигналом, полученным в присутствии 1% ДМСО без соединения). Соединения по изобретению, которые демонстрируют увеличение по меньшей мере в 5 раз, могут быть предпочтительными. Анализ цАМФ Была создана стабильная клеточная линия, экспрессирующая рекомбинантный человеческийGPR119, и эту клеточную линию можно использовать для изучения влияния соединений по изобретению на внутриклеточные уровни циклического АМФ (цАМФ). Клеточные монослои промывают забуференным фосфатом физиологическим раствором и стимулируют при 37 С в течение 30 мин различными концентрациями соединения в буфере для стимуляции, содержащем 1% ДМСО. Затем клетки лизируют и содержание цАМФ определяют, используя набор для определения цАМФ Perkin Elmer AlphaScreen- 11016507 Исследование процесса питания in vivo Влияние соединений по изобретению на массу тела и всасывание пищи и воды можно исследовать на самцах крыс Sprague-Dawley, которых кормили без ограничений и содержали в условиях чередования фаз освещения. Тестируемые соединения и эталонные соединения вводили с помощью соответствующих путей введения (например, внутрибрюшинно или перорально) и измерения производят в течение следующих 24 ч. Крыс размещают по отдельности в полипропиленовые клетки с решетчатым металлическим настилом при температуре 214 С и влажности 5520%. Под каждую клетку помещают полипропиленовые поддоны с подстилками под клетки (cage pads) для детекции потери корма. Животных содержат в условиях чередования фаз цикла свет-темнота (освещение отключают на 8 ч в интервале 09:3017:30 ч), в течение этого времени комнату освещают красным светом. Животные имеют свободный доступ к стандартному порошковому корму для крыс и водопроводной воде в течение двухнедельного периода акклиматизации. Корм держат в стеклянных банках для корма с алюминиевыми крышками. В каждой крышке имеется отверстие 3-4 см для облегчения доступа к корму. Животных, банки с кормом и бутылки с водой взвешивают (с точностью до 0,1 г) в начале темного периода. Потом банки с кормом и бутылки с водой измеряют через 1, 2, 4, 6 и 24 ч после того, как животным вводят соединение по изобретению, и все существенные различия между группами обработки относительно исходного уровня сравнивают с обработанными носителем контролями. Антидиабетические эффекты соединений по изобретению в модели панкреатических бета-клетокin vitro (HIT-T15) Клеточная культура Клетки HIT-T15 (60-й пассаж) получали из АТСС (Американская коллекция типовых культур) и культивировали в среде RPMI 1640, дополненной 10% фетальной сыворотки теленка и 30 нМ селенита натрия. Все эксперименты проводили с клетками не более 70-ого пассажа согласно литературе, в которой описано изменение свойств этой клеточной линии в пассаже с номерами выше 81 (Zhang HJ, Walseth TF,Robertson RP. Insulin secretion and cAMP metabolism in HIT cells. Reciprocal and serial passage-dependentrelationships. Diabetes. 1989 Jan; 38(1): 44-8). Анализ цАМФ Клетки HIT-Т 15 сеяли в стандартной культуральной среде в 96-луночные планшеты в количестве 100000 клеток/0,1 мл/лунку и культивировали в течение 24 ч, затем среду отбрасывали. Клетки инкубировали в течение 15 мин при комнатной температуре с 100 мкл буфера для стимуляции (забуференный солевой раствор Хенкса, 5 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота), 0,5 мМ IBMX (изобутилметилксантин), 0,1% БСА (бычий сывороточный альбумин), рН 7,4). Его отбрасывали и заменяли на разведения соединения в диапазоне 0,001; 0,003; 0,01; 0,03; 0,1; 0,3; 1; 3; 10; 30 мкМ в буфере для стимуляции в присутствии 0,5% ДМСО. Клетки инкубировали при комнатной температуре в течение 30 мин. Затем в каждую лунку добавляли по 75 мкл лизирующего буфера (5 мМ HEPES, 0,3% Твин-20, 0,1% БСА, рН 7,4) и планшет встряхивали при 900 об./мин в течение 20 мин. Твердые частицы удаляли центрифугированием при 3000 об/мин в течение 5 мин, затем образцы переносили в двух повторностях в 384-луночные планшеты и обрабатывали согласно инструкциям к набору для анализа цАМФ Perkin Elmer AlphaScreen. Кратко, составляли реакционные смеси объемом 25 мкл, содержащие 8 мкл образца, 5 мкл смеси акцепторных гранул и 12 мкл смеси для детекции, так что концентрация компонентов в конечной реакционной смеси точно соответствовала установленной в инструкциях к данному набору. Реакционные смеси инкубировали при комнатной температуре в течение 150 мин и планшеты считывали, используя прибор Packard Fusion. Данные измерений цАМФ сравнивали со стандартной кривой для известных количеств цАМФ (0,01; 0,03; 0,1; 0,3; 1; 3; 10; 30; 100; 300; 1000 нМ) с целью преобразования показаний прибора к абсолютным количествам цАМФ. Данные анализировали, используя программное обеспечение XLfit 3. Было обнаружено, что репрезентативные соединения по изобретению увеличивают цАМФ при ЕС 50 менее 10 мкМ. Соединения с EC50 менее 1 мкМ в анализе цАМФ могут быть предпочтительными. Анализ секреции инсулина Клетки HIT-T15 сеют в стандартной культуральной среде в 12-луночные планшеты в количестве 106 клеток/1 мл/лунку, культивируют в течение 3 суток и затем среду отбрасывают. Клетки промывают х 2 дополненным буфером Кребса-Рингера (KRB), содержащим 119 мМ NaCl, 4,74 мМ KCl, 2,54 мМ CaCl2,1,19 мМ MgSO4, 1,19 мМ KH2PO4, 25 мМ NaHCO3, 10 мМ HEPES при рН 7,4 и 0,1% бычьего сывороточного альбумина. Клетки инкубируют с 1 мл KRB при 37 С в течение 30 мин, который затем отбрасывают. За этим следует вторая инкубация с KRB в течение 30 мин, который собирают и используют для измерения базальных уровней секреции инсулина для каждой лунки. Затем разведения соединений (0; 0,1; 0,3; 1; 3; 10 мкМ) добавляют в двух повторностях в лунки в 1 мл KRB, дополненного 5,6 мМ глюкозой. Через 30 мин инкубации при 37 С отбирают образцы для определения уровней инсулина. Измерение инсулина проводят с использованием ELISA(иммуноферментный анализ)-набора для определения инсулина (Rat) фирмы Mercodia в соответствии с инструкциями производителей с использованием стандартной кривой для известных концентраций инсулина. Для каждой лунки уровни инсулина корректируют путем вычитания базального уровня секреции из предварительно инкубированных в отсутствие глюкозы.- 12016507 Данные анализируют, используя программное обеспечение XLfit 3. Тесты на толерантность к глюкозе при пероральном приеме Влияние соединений по изобретению на толерантность к глюкозе (Glc) при пероральном приеме оценивали на самцах крыс Sprague-Dawley. Корм убирали за 16 ч до введения Glc и не возвращали на протяжении всего исследования. Крысам предоставляли свободный доступ к воде в течение исследования. Делали надрез на хвостах животных, затем отбирали кровь (1 каплю) для измерения базальных уровней Glc за 60 мин до введения Glc нагрузки. После этого крыс взвешивали и перорально (п/о) вводили тестируемое соединение или носитель (20%-ный водный гидроксипропилциклодекстрин) за 45 мин до отбора дополнительного образца крови и обработки Glc нагрузкой (2 гкг-1 п/о). Затем отбирали образцы крови из надрезанного кончика хвоста через 5, 15, 30, 60, 120 и 180 мин после введения Glc. Уровни глюкозы в крови измеряли сразу после отбора, используя имеющийся в продаже глюкометр (OneTouch Ultra от Lifescan). Репрезентативные соединения по изобретению статистически снижали уровень Glc в дозах менее 10 мгкг-1. Влияние соединений по изобретению на толерантность к глюкозе (Glc) при пероральном приеме также можно оценить на мышах - самцах C57BI/6 или самках ob/ob. Корм убирают за 5 ч до введения Glc и не возвращают на протяжении всего исследования. Мышам предоставляют свободный доступ к воде в течение исследования. Делают надрез на хвостах животных, затем отбирают кровь (20 мкл) для измерения базальных уровней Glc за 45 мин до введения Glc нагрузки. После этого мышей взвешивают и перорально вводят тестируемое соединение или носитель (20%-ный водный гидроксипропил-циклодекстрин или 25%-ный водный Gelucire 44/14) за 30 мин до отбора дополнительного образца крови(20 мкл) и обработки Glc нагрузкой (2-5 гкг-1 п/о). Затем отбирают образцы крови (20 мкл) через 25, 50,80, 120 и 180 мин после введения Glc. Образцы крови по 20 мкл для измерения уровней Glc отбирают из надрезанного кончика хвоста в одноразовые микропипетки (Dade Diagnostics Inc., Puerto Rico) и образец добавляют к 480 мкл гемолитического реагента. Аликвоты по 20 мкл разбавленной гемолизированной крови в двух повторностях затем добавляют к 180 мкл реагента глюкозы Триндера (ферментативный(Триндера) колориметрический метод (Sigma в 96-луночном аналитическом планшете. После смешивания образцы оставляют при кт (комнатная температура) на 30 мин, после чего считывают против стандартов Glc (объединенный набор стандартов глюкозы/азота мочевины от Sigma). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль где один из X и Y представляет собой О, а другой представляет собой N;R2 представляет собой водород или метил;R3 представляет собой водород или метил;R6 и R7 независимо представляют собой водород, С 1-4 алкил, который, возможно, может быть замещен галогеном, гидрокси, С 1-4 алкокси-, С 1-4 алкил-S(O)m-, N(R8)2 или -C(O)OR9; или может представлять собой С 3-7 циклоалкил, где циклические группы могут быть замещены одним или более заместителями,выбранными из галогена, С 1-4 алкила, С 1-4 фторалкила, OR6, CN, SO2CH3 и N(R8)2; или R6 и R7, взятые вместе, могут образовывать 5- или 6-членное гетероциклическое кольцо, возможно замещенное гидрокси,С 1-4 алкилом или С 1-4 гидроксиалкилом и возможно содержащее дополнительный гетероатом, выбранный из О и NR8;R8 независимо представляет собой водород или С 1-4 алкил; или группа N(R8)2 может образовать 4-7 членное гетероциклическое кольцо, возможно содержащее дополнительный гетероатом, выбранный из О и NR8;R9 представляет собой водород или С 1-4 алкил иm равно 0, 1 или 2. 2. Соединение по п.1 или его фармацевтически приемлемая соль, где X представляет собой О. 3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где R1 представляет собойSO2R5. 4. Соединение по п.3 или его фармацевтически приемлемая соль, где R1 представляет собой- 13016507 5. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где R1 представляет собой CONR6R7. 6. Соединение по п.5 или его фармацевтически приемлемая соль, где R6 представляет собой водород, С 1-3 алкил или С 2-3 алкил, замещенный гидрокси, и R7 представляет собой водород. 7. Соединение по п.6 или его фармацевтически приемлемая соль, где R6 представляет собой С 1-3 алкил или С 2-3 алкил, замещенный гидрокси. 8. Соединение по п.7 или его фармацевтически приемлемая соль, где R6 представляет собой С 2-3 алкил, замещенный гидрокси. 9. Соединение по п.8 или его фармацевтически приемлемая соль, где R6 представляет собой 2 гидроксиэтил или 2-гидрокси-1-метилэтил. 10. Соединение по любому из пп.1-9 или его фармацевтически приемлемая соль, где R3 представляет собой водород. 11. Соединение по любому из пп.1-9 или его фармацевтически приемлемая соль, где R3 представляет собой метил и образовавшийся стереоцентр имеет (R)-конфигурацию. 12. Соединение по любому из пп.1-11 или его фармацевтически приемлемая соль, где R4 представляет собой С 3-4 алкил. 13. Соединение по п.12 или его фармацевтически приемлемая соль, где R4 представляет собой изопропил. 14. Соединение формулы (I), выбранное изR)-2-гидрокси-1-метилэтил)амида 5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил] пропоксипиридин-2-карбоновой кислоты; амида 5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-3-метилпиридин-2 карбоновой кислоты; 5-3-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-2-метансульфонилпиридина,или его фармацевтически приемлемая соль. 15. Соединение формулы (I) по п.1, представляющее собой R)-2-гидрокси-1-метилэтил)амид 5-3[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-ил]пропокси-3-метилпиридин-2-карбоновой кислоты, или его фармацевтически приемлемая соль. 16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-15 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. 17. Способ лечения заболевания или состояния, в котором играет роль GPR119 (G-белоксопряженный рецептор 119), включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли. 18. Способ лечения ожирения, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли. 19. Способ лечения диабета, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли. 20. Способ лечения метаболического синдрома (синдром X), нарушенной толерантности к глюкозе,гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, низких уровней HDL (липопротеинов высокой плотности) или гипертензии, включающий стадию введения пациенту, нуждающемуся в этом,эффективного количества соединения по любому из пп.1-15 или его фармацевтически приемлемой соли.
МПК / Метки
МПК: A61K 31/454, C07D 413/14, A61P 3/04, A61P 3/10
Метки: пиперидиновые, агонисты
Код ссылки
<a href="https://eas.patents.su/15-16507-piperidinovye-agonisty-gpcr.html" rel="bookmark" title="База патентов Евразийского Союза">Пиперидиновые агонисты gpcr</a>
Предыдущий патент: Способ защиты растений после прорастания от поражения листовыми фитопатогенными грибами путем применения бифениламидов арилкарбоновых кислот
Следующий патент: Пачка для курительных изделий
Случайный патент: Карбоксамидные соединения и способы их применения












