Аналог тиофена для лечения вирусной инфекции гепатита с
Номер патента: 16457
Опубликовано: 30.05.2012
Авторы: Фалардо Ги, Яннопулос Константин Г., Вайанкур Луи, Пуассон Карл, Дени Реал, Кумар Дас Санджой, Чань Чунь Кун Лаваль
Формула / Реферат
1. Соединение, представляющее собой
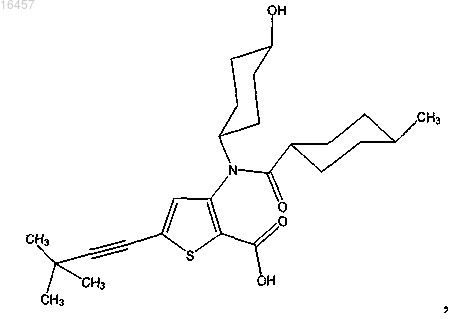
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, содержащая соединение по п.1 и по меньшей мере один фармацевтически приемлемый носитель или эксципиент.
3. Фармацевтическая комбинация, содержащая соединение по п.1 и по меньшей мере один дополнительный агент.
4. Фармацевтическая комбинация по п.3, где указанный по меньшей мере один дополнительный агент выбирают из ингибиторов вирусной сериновой протеазы, ингибиторов вирусной полимеразы, ингибиторов вирусной геликазы, иммуномодулирующих агентов, антиоксидантов, антибактериальных агентов, терапевтических вакцин, гепатопротекторов, антисмысловых агентов, ингибиторов протеазы NS2/3 вируса HCV и ингибиторов участка внутренней посадки рибосомы (IRES).
5. Фармацевтическая комбинация по п.4, где указанный по меньшей мере один дополнительный агент выбирают из рибавирина и интерферона-α.
6. Фармацевтическая комбинация по п.4, где указанный по меньшей мере один дополнительный агент выбирают из рибавирина и пегилированного интерферона-α.
7. Применение соединения по п.1 для лечения вирусной инфекции гепатита C у носителя вируса.
8. Применение по п.7, где упомянутым носителем вируса является человек.
9. Фармацевтически приемлемая соль соединения
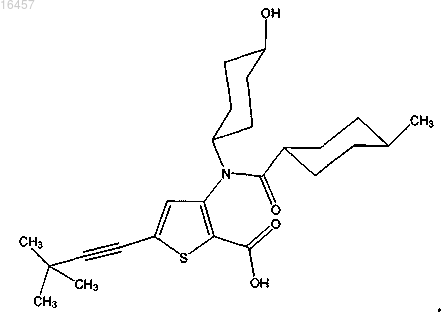
10. Соединение
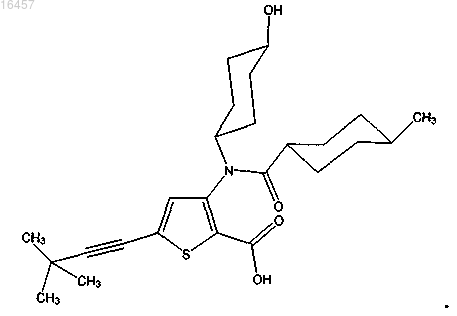
11. Фармацевтическая комбинация, включающая:
a) соединение

b) пегилированный интерферон-α и
c) рибавирин.
12. Применение терапевтически эффективного количества фармацевтической комбинации, включающей:
a) соединение
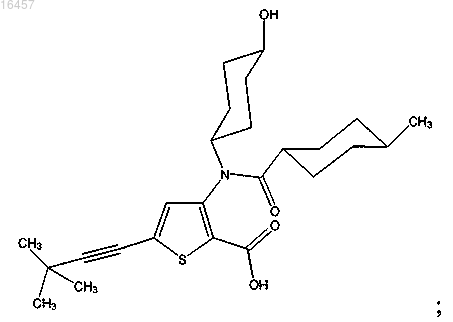
b) пегилированный интерферон-α и
c) рибавирин,
для лечения вирусной инфекции гепатита C у носителя вируса.
Текст
АНАЛОГ ТИОФЕНА ДЛЯ ЛЕЧЕНИЯ ВИРУСНОЙ ИНФЕКЦИИ ГЕПАТИТА С Чань Чунь Кун Лаваль, Кумар Дас Санджой, Пуассон Карл, Яннопулос Константин Г., Фалардо Ги, Вайанкур Луи, Дени Реал (CA) и его фармацевтически приемлемым солям, и их применению для лечения вирусной инфекции гепатита C. Также изобретение относится к фармацевтическим композициям на основе указанного соединения, а также его фармацевтическим комбинациям с дополнительными агентами, в частности с рибавирином и интерфероном-. 016457 Изобретение относится к новому соединению и содержащим его фармацевтическим композициям для лечения вирусной инфекции гепатита C. Гепатит представляет собой заболевание, имеющее распространение по всему миру. Он, как правило, имеет вирусную природу, хотя известны другие факторы. Вирусный гепатит представляет собой наиболее распространенную форму гепатита. Приблизительно 750000 американцев заражаются гепатитом каждый год и из них более чем 150000 заражаются вирусом гепатита C ("HCV"). Вирус HCV представляет собой вирус, содержащий РНК с цепью позитивной полярности, который принадлежит к семейству флавивирусов (Flaviviridae) и имеет самую тесную взаимосвязь с чумными вирусами, которые включают вирус холеры свиней и вирус вирусной диареи крупного рогатого скота(BVDV). Вирус HCV, как полагают, реплицируется через продуцирование матрицы комплементарной РНК с цепью негативной полярности. Вследствие отсутствия эффективной системы репликации культуры для вируса частицы вируса HCV были выделены из смешанной плазмы крови человека и, как показано посредством электронного микроскопа, имеют диаметр приблизительно 50-60 нм. Геном вируса HCV представляет собой одноцепочечную РНК позитивной полярности, состоящей из приблизительно 9600 комплементарных пар оснований нуклеиновых кислот (bp), кодирующую полипротеин, состоящий из 3009-3030 аминокислот, который гидролизуется котрансляционно и посттрансляционно на зрелые вирусные белки (core-белок, E1, E2, p7, NS2, NS3, NS4A, NS4B, NS5A, NS5B). Полагают, что структурные гликопротеины E1 и E2 являются внедренными в вирусную липидную оболочку и образуют стабильные гетеродимеры. Также полагают, что структурный core-белок взаимодействует с вирусным геномом РНК с образованием нуклеокапсида. Неструктурные белки, обозначенные как NS2-NS5, включают протеины с ферментативными функциями, участвующие в репликации вируса и в процессинге белка, включая полимеразу, протеазу и геликазу. Основным источником заражения вирусом гепатита C (HCV) является кровь. Интенсивность проявления инфекции вируса HCV как проблема со здоровьем проиллюстрирована посредством уровня распространения среди групп повышенного риска. Например, 60-90% больных гемофилией и более чем 80% наркоманов, принимающих наркотики внутривенно, в западных странах являются хронически инфицированными вирусом гепатита C. В случае наркоманов, принимающих наркотики внутривенно, уровень распространения варьируется от приблизительно 28 до 70% в зависимости от изучаемой группы населения. Доля новых инфекций вируса HCV, сопутствующих посттрансфузии, значительно снижена в последнее время вследствие усовершенствований диагностических средств, используемых для отбора доноров крови. Комбинирование пегилированных интерферонов плюс рибавирин представляет собой лечение, выбираемое в случае хронической инфекции вируса HCV. Такое лечение не обеспечивает продолжительный вирусный ответ (SVR) у большинства пациентов, инфицированных наиболее распространенным генотипом вируса (1a и 1b). Кроме того, значительные побочные эффекты мешают соблюдению текущего режима терапии и могут вызывать у некоторых пациентов необходимость снижения дозировки/дозы или прекращения приема лекарства. Следовательно существует потребность в разработке противовирусных средств для применения в лечении или предупреждении флавивирусных инфекций. В одном аспекте настоящее изобретение обеспечивает соединение, представляющее собой или его фармацевтически приемлемую соль. Соединение настоящего изобретения представляет собой ингибитор полимеразы вируса HCV. Неожиданно было обнаружено, что данное соединение проявляет улучшенные свойства относительно других тиофеновых ингибиторов полимеразы вируса HCV. Следовательно, соединение настоящего изобретения имеет превосходный потенциал для лечения и предупреждения инфекций гепатита C. В другом аспекте изобретение относится к фармацевтической композиции, содержащей указанное выше соединение и по меньшей мере один фармацевтически приемлемый носитель или эксципиент. В следующем аспекте изобретение относится к фармацевтической комбинации, содержащей указанное выше соединение по и по меньшей мере один дополнительный агент. Дополнительные агенты выбирают из ингибиторов вирусной сериновой протеазы, ингибиторов вирусной полимеразы, ингибиторов вирусной геликазы, иммуномодулирующих агентов, антиоксидантов, антибактериальных агентов,терапевтических вакцин, гепатопротекторов, антисмысловых агентов, ингибиторов протеазы NS2/3 вируса HCV и ингибиторов участка внутренней посадки рибосомы (IRES). В предпочтительном варианте указанный по меньшей мере один дополнительный агент в фарма-1 016457 цевтической комбинации выбирают из рибавирина и интерферона-. В еще одном предпочтительном варианте указанный по меньшей мере один дополнительный агент в фармацевтической комбинации выбирают из рибавирина и пегилированного интерферона-. В следующем аспекте изобретение относится к применению указанного выше соединения для лечения вирусной инфекции гепатита C у носителя вируса. Предпочтительно носителем вируса является человек. В предпочтительных вариантах изобретение относится к фармацевтически приемлемой соли соединения или его свободной форме. В следующем аспекте изобретение относится к фармацевтическая комбинации, включающейc) рибавирин. Далее, изобретение относится к применению терапевтически эффективных количествc) рибавирина для лечения вирусной инфекции гепатита C у носителя вируса. Термин "ингибитор вирусной сериновой протеазы", используемый в этом документе, означает средство, которое является эффективным в ингибировании функции вирусной сериновой протеазы, включающей сериновую протеазу вируса HCV, у млекопитающего. Ингибиторы сериновой протеазы вирусаHCV включают, например, те соединения, которые описаны в международных публикациях: WO 99/07733 (Boehringer Ingelheim), WO 99/07734 (Boehringer Ingelheim), WO 00/09558 (Boehringer Ingelheim), WO 00/09543 (Boehringer Ingelheim), WO 00/59929 (Boehringer Ingelheim), WO 02/060926 (BMS),WO 2006039488 (Vertex), WO 2005077969 (Vertex), WO 2005035525 (Vertex), WO 2005028502 (Vertex),WO 2005007681 (Vertex), WO 2004092162 (Vertex), WO 2004092161 (Vertex), WO 2003035060 (Vertex),WO 03/087092 (Vertex), WO 02/18369 (Vertex) или WO 98/17679 (Vertex). Термин "ингибиторы вирусной полимеразы", используемый в этом документе, означает средство,которое является эффективным в ингибировании функции вирусной полимеразы, включающей полимеразу вируса HCV, у млекопитающего. Ингибиторы полимеразы вируса HCV включают ненуклеозиды,например, те соединения, которые описаны в международных публикациях:(Merck), WO 01/47883 (Japan Tobacco), WO 03/000254 (Japan Tobacco), и в европейском патенте EP 1256628 A2 (Agouron). Кроме того, другие ингибиторы полимеразы вируса HCV также включают аналоги нуклеозидов,например, те соединения, которые описаны в международных публикациях: WO 01/90121 А 2 (Idenix),WO 02/069903 A2 (Biocryst Pharmaceuticals Inc.), и WO 02/057287 A2 (Merck/Isis) и WO 02/057425 A2(Merck/Isis). Конкретные примеры нуклеозидных ингибиторов полимеразы вируса HCV включают R1626/R1479(Idenix). Конкретные примеры ингибиторов полимеразы вируса HCV включают JTK-002/003 и JTK-109 (Japan Tobacco), HCV-796 (Viropharma), GS-9190 (Gilead), и PF-868554 (Pfizer). Термин "ингибиторы вирусной геликазы", используемый в этом документе, означает средство, которое является эффективным в ингибировании функции вирусной геликазы, включающей геликазу семейства флавивирусов (Flaviviridae), у млекопитающего."Иммуномодулирующий агент", так как используют в этом документе, означает те агенты, которые являются эффективными в улучшении/усилении или в потенцировании реакции иммунной системы у млекопитающего. Иммуномодулирующие агенты включают, например, интерфероны класса I (такие как-, -, - и -интерфероны, -интерфероны, консенсусные интерфероны и асиало-интерфероны), интерфероны класса II ( такие как -интерфероны) и пегилированные интерфероны. Термин "интерферон класса I", используемый в этом документе, означает интерферон, выбранный из группы интерферонов, которые все связываются с первым (I) типом рецепторов. Он включает интерфероны класса I как природного, так и синтетического происхождения. Примеры интерферонов класса I включают -, -, - и -интерфероны, -интерфероны, консенсусные интерфероны и асиалоинтерфероны. Термин "интерфероны класса II", используемый в этом документе, означает интерферон,выбранный из группы интерферонов, которые все связываются со вторым (II) типом рецепторов. Примеры интерферонов класса II включают -интерфероны. Антисмысловые препараты включают, например,ISIS-14803. Конкретные примеры ингибиторов протеазы NS3 вируса HCV включают BILN-2061 (Boehringer(InterMune), GS9132 (Gilead), TMC-435350 (Tibotec/Medivir), ITMN-191 (InterMune), MK-7009 (Merck). Ингибитор сайта внутренней посадки рибосомы (IRES) включает ISIS-14803 (ISIS Pharmaceuticals) и те соединения, которые описаны в международной публикации WO 2006019831 (PTC therapeutics). В одном варианте осуществления дополнительный агент представляет собой интерферон 1A, интерферон 1B, интерферон 2A или интерферон 2B. Интерферон доступен в пегилированной и непегилированной формах. Пегилированные интерфероны включают PEGASYStm и Ред-introntm. Рекомендованная доза в монотерапии с применением PEGASYStm в случае хронического гепатита C составляет 180 мг (ампула на 1,0 мл или предварительно заполненный шприц на 0,5 мл) один раз в неделю в течение 48 недель путем подкожного введения в живот или в бедро. Рекомендованная доза PEGASYStm при использовании в комбинации с рибавирином в случае хронического гепатита C составляет 180 мг (ампула на 1,0 мл или предварительно заполненный шприц на 0,5 мл) один раз в неделю. Ежедневная доза рибавирина составляет 800-1200 мг, вводимых перорально двумя поделенными дозами. Доза должна быть подобрана для пациента индивидуально в зависимости от характеристики заболевания исходного уровня (например, генотип), реакции на терапию, и приемлемости/переносимости режима приема лекарства. Режим приема рекомендованной дозы PEG-Introntm составляет 1,0 мг на килограмм в неделю(мг/кг/неделя) подкожно в течение одного года. Дозу следует вводить в один и тот же день недели. При введении в комбинации с рибавирином, рекомендованная доза PEG-Intron составляет 1,5 мкг на килограмм в неделю (мкг/кг/неделя). В дополнительных вариантах осуществления ингибитор вирусной сериновой протеазы представляет собой ингибитор сериновой протеазы вирусаHCV; ингибитор вирусной полимеразы представляет собой ингибитор полимеразы вируса HCV; ингибитор вирусной геликазы представляет собой ингибитор геликазы вируса HCV. В одном варианте осуществления вирусная полимераза представляет собой РНК-зависимую РНКполимеразу. В одном варианте осуществления вирусная полимераза представляет собой полимеразу вирусаHCV. Индивидуальные компоненты для применения в способе настоящего изобретения или комбинации настоящего изобретения могут быть введены либо последовательно либо одновременно отдельно взятыми или скомбинированными фармацевтическими составами. Под термином "фармацевтически приемлемые соли" подразумевают фармацевтически приемлемые соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают хлороводородную, бромоводородную, серную, азотную, перхлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-р-сульфоновую, винную, уксусную, трифторуксусную, лимонную, метансульфоновую, муравьиную,бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, та-3 016457 кие как щавелевая, хотя сами по себе фармацевтически неприемлемые, могут быть полезными в качестве промежуточных соединений в получении соединения изобретения и его фармацевтически приемлемых солей присоединения кислот. Соли, полученные из аминокислот также являются включенными (например, L-аргинин, L-лизин). Соли, полученные из соответственных оснований, включают соли щелочных металлов (например,натрия, лития, калия), соли щелочноземельных металлов (например, кальция, магния), соли аммония,соли NR4+ (где R представляет собой C1-4 алкил), холин и трометамин. В дальнейшем в этом документе упоминание соединения в соответствии с изобретением включает это соединение и его фармацевтически приемлемые соли. Специалистам в данной области будет ясно, что соединение в соответствии с настоящим изобретением может существовать в различных полиморфных формах. Как известно в данной области, полиморфизм представляет собой способность соединения кристаллизоваться в виде более чем одной отличающейся кристаллической или "полиморфной" форме. Полиморф представляет собой твердую кристаллическую фазу соединения по меньшей мере с двумя различными компоновками/расположениями или полиморфными формами молекулы этого соединения в твердом состоянии. Полиморфные формы данного соединения определяются одной и той же химической формулой или композицией и отличаются по химической структуре также как кристаллические структуры двух различных химических соединений. Кроме того, специалистам в данной области будет ясно, что соединение в соответствии с настоящим изобретением может существовать в различных сольватных формах, например в гидратной форме. Сольваты соединения изобретения также могут образовываться при внедрении молекул растворителя в структуру кристаллической решетки молекулы соединения во время кристаллизационного процесса. Если не определено иначе, то все используемые в этом документе технические и научные термины имеют значение, аналогичное общепринятому и понятному значению для среднего специалиста в области, в которой находится это изобретение. Все публикации, заявки на патент, патенты и другие ссылки,упоминаемые в этом документе, включены путем ссылки со всей полнотой. В случае конфликта/противоречия, настоящее описание изобретения, включая определения, будет проверяться. Кроме того, материалы, способы, и примеры являются только иллюстративными и не предназначены для ограничения. Термин "носитель вируса" или "пациент" означает человека мужского пола или женского пола, например ребенка, подростка или взрослого. Будет ясно, что количество соединения изобретения, необходимое для применения в лечении, будет варьироваться в зависимости от пути введения, от природы состояния/заболевания, для которого необходимо лечение, и от возраста и состояния пациента, и, в конечном счете, будет на усмотрении штатного врача больницы или ветеринара. Однако, как правило, подходящая доза будет находиться в диапазоне от приблизительно 0,1 до приблизительно 750 мг/кг массы тела в день, например, в диапазоне 0,5-60 мг/кг/день или, например, в диапазоне 1-20 мг/кг/день. Желательная доза может быть легко/удобно представлена разовой дозой или в виде поделенной дозы, вводимой через надлежащие интервалы времени, например, в виде двух, трех, четырех или более доз в день. Соединение удобно вводится в стандартной лекарственной форме; например, содержащей 10-1500 мг, предпочтительно 20-1000 мг, наиболее предпочтительно 50-700 мг активного ингредиента на дозированную лекарственную форму. Идеально активный ингредиент следует вводить с достижением максимальных концентраций активного соединения в плазме от приблизительно 1 - приблизительно 75 мкМ, приблизительно 2-50 мкМ,приблизительно 3 - приблизительно 30 мкМ. Этого можно добиться, например, внутривенной инъекцией 0,1-5%-ного раствора активного ингредиента, необязательно в солевом растворе или при пероральном введении в виде болюса, содержащего приблизительно 1 - приблизительно 500 мг активного ингредиента. Желательные уровни в крови могут поддерживаться непрерывным вливанием с обеспечением приблизительно 0,01 - приблизительно 5,0 мг/кг/ч или дробными вливаниями растворов, содержащих приблизительно 0,4 - приблизительно 15 мг активного ингредиента на килограмм (мг/кг). В том случае, когда соединение настоящего изобретения или его фармацевтически приемлемые соли применяют в комбинации со вторым терапевтическим средством, активным в отношении того же самого вируса, доза каждого соединения либо может быть аналогична дозе, используемой при применении соединения как такового, либо может отличаться от дозы, используемой при применении соединения как такового. Специалистам в данной области будет легко оценить надлежащие дозы. Хотя для применения в терапии является возможным, что соединение изобретения может быть введено в виде исходного химического вещества, предпочтительно предоставлять активный ингредиент в виде фармацевтической композиции. Таким образом, изобретение дополнительно обеспечивает фармацевтическую композицию, содержащую соединения настоящего изобретения или их фармацевтически приемлемые производные вместе с одним или более фармацевтически приемлемыми носителями для них и, необязательно, с другими терапевтическими и/или профилактическими ингредиентами. Носитель(и) долж(е)н(ы) быть "приемлемым(и)" в смысле совместимости с другими ингредиентами состава и без-4 016457 вредным(и) для его/их рецепиента. Фармацевтические композиции включают фармацевтические композиции, подходящие для перорального, ректального, назального, местного (включая буккальное и сублингвальное), трансдермального,вагинального или парентерального (включая внутримышечное, подкожное и внутривенное) введения или фармацевтические композиции в форме, подходящей для введения путем ингаляции или путем инсуффляции. Там, где это подходит, составы могут быть легко/удобно представлены отдельными дозированными единицами/порциями и могут быть приготовлены любым из способов, общеизвестных в области фармации. Все способы включают стадию приведения в контакт активного соединения с жидкими носителями или тонкоизмельченными твердыми носителями или с тем и другим и затем, при необходимости,стадию придания продукту желательной формы. Фармацевтические композиции, подходящие для перорального введения, могут быть удобным образом представлены в виде отдельных форм, таких как капсулы, крахмальные капсулы или таблетки,каждая из которых содержит заданное количество активного ингредиента; в виде порошка или гранул; в виде раствора, суспензии или эмульсии. Активный ингредиент также может быть представлен в виде болюса, электуария или пасты. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие вещества, наполнители, скользящие вещества, разрыхлители или смачивающие вещества. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта, предназначенного для разведения водой или другой подходящей средой (индифферентное вещество, вводимое в лекарственную форму для придания массы) перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие вещества, эмульгирующие вещества, неводные среды (которые могут включать пищевые масла) или консерванты. Соединение в соответствии с изобретением также может быть составлено в форме смесей для парентерального введения (например, посредством инъекции, например, болюсной инъекции или путем непрерывного вливания) и могут быть представлены в форме для однократного приема лекарственных средств: в ампулах, предварительно-заполненных шприцах, в упаковках лекарственных средств для вливания небольших объемов или в упаковках лекарственных средств для многократного приема с добавленным консервантом. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных средах, и могут содержать вещества, способствующие составлению смеси, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может находиться в порошковой форме, полученной асептическим выделением стерильного твердого вещества или лиофилизацией из раствора, для разведения подходящей средой, например, стерильной, апирогенной водой, перед применением. Для местного нанесения на эпидермис, соединения в соответствии с изобретением могут быть составлены в виде мазей, кремов или лосьонов или в виде пластыря для трансдермального введения лекарственного средства. Такие пластыри для трансдермального введения могут содержать промоторы всасывания, такие как линалоол, карвакрол, тимол, цитраль, ментол и t-анетол. Мази и крема могут быть составлены, например, с водной или масляной основой с добавлением подходящих загущающих и/или гелеобразующих веществ. Лосьоны могут быть составлены с водной или масляной основой и, как правило,будут также содержать одно или более эмульгирующих веществ, стабилизирующих веществ, диспергирующих веществ, суспендирующих веществ, загущающих веществ или окрашивающих веществ. Композиции, подходящие для местного введения в ротовую полость, включают лепешки/леденцы,содержащие активный ингредиент в ароматизированной основе, обычно в сахарозе и гуммиарабике или в трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик; и растворы для полоскания ротовой полости, содержащие активный ингредиент в подходящем жидком носителе. Фармацевтические композиции, подходящие для ректального введения, где носитель представляет собой твердое вещество, являются представленными, например, в виде суппозиториев с разовой дозой. Подходящие носители включают кокосовое масло и другие вещества, обычно применяемые в данной области, и суппозитории могут быть легко образованы посредством смешивания активного соединения с размягченным(и) или расплавленным(и) носителем(ями) с последующим охлаждением и формованием в прессформах. Композиции, подходящие для вагинального введения, могут быть представлены в виде вагинальных суппозиториев, тампонов, кремов, гелей, паст, пен или спреев, содержащих в дополнение к активному ингредиенту такие носители, которые известны в данной области как приемлемые. Для внутриназального введения соединения изобретения могут быть применены в виде жидкого спрея или в виде диспергируемого порошка или в виде капель. Капли могут быть составлены посредством водной или неводной основы, также содержащей одно или более диспергирующих веществ, солюбилизирующих веществ или суспендирующих веществ. Доставка жидких спреев из упаковок, находящихся под повышенным давлением, является удобной.-5 016457 Для введения ингаляцией, соединения в соответствии с изобретением удобно доставляются из инсуффлятора, распылителя (аэрозольный аппарат) или упаковки, находящейся под повышенным давлением или из другого удобного средства доставления аэрозольного спрея. Упаковки, находящиеся под повышенным давлением, могут содержать подходящий газ-вытеснитель, такой как дихлордифторметан,трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае аэрозоля, находящегося под повышенным давлением, дозированная единица может быть определена посредством обеспечения клапана для доставки дозированного количества. Альтернативно, для введения посредством ингаляции или инсуффляции, соединения в соответствии с изобретением могут находиться в форме сухой порошковой композиции, например порошковой смеси соединения и подходящей порошковой основы, такой как лактоза или крахмал. Порошковая композиция может быть представлена в дозированной лекарственной форме, например в капсулах или ампулах или,например, желатиновых или блистерных упаковках, из которых порошок может быть введен посредством ингалятора или инсуффлятора. При желании могут быть применены вышеописанные составы, приспособленные к тому, чтобы давать замедленное высвобождение активного ингредиента. Следующие общие схемы и примеры обеспечивают для иллюстрации различных вариантов осуществления настоящего изобретения и их не следует рассматривать как ограничение объема изобретения. Способы синтеза для получения тиофеновых соединений также описаны в заявках на патент: patent applications US Patent6881741, USSN 10/730272, поданной 9 декабря 2003 г., USSN 11/042442, поданной 26 января 2005 г., USSN 11/433749, поданной 15 мая 2006 г., в международной публикации WO 02/100851, в патенте US 2004-0116509, в международной публикации WO 2004/052885, в патенте US 2005-0009804, в международной публикации WO 2004/052879 и в патенте US 2004-0192707. Тиофеналкинильные соединения также раскрыты в международных публикациях WO 2006/072347 и WO 2006/072348. В примерах все температуры даны в грудусах по Цельсию без поправок; и, если не указано иное,все части и процентные содержания приведены по массе. Могут быть использованы следующие сокращения, которые даны ниже:RBF - круглодонная колба. Все процедуры очистки методом высокоэффективной жидкостной хроматографии (HPLC) проводят с использованием колонки с обращенной фазой C18, заполненной частицами размером 5 мкм. Диаметр колонки составляет 19 мм, и длина составляет 100 мм. Элюент представляет собой смесь ацетонитрила и воды с соответствующим градиентом концентрации ацетонитрила и с концентрацией HCl 3 мМ. Пример 1. Получение 5-(3,3-диметил-бут-1-инил)-3-[(транс-4-гидроксициклогексил)-(транс-4 метилциклогексанкарбонил)амино]тиофен-2-карбоновой кислоты-6 016457 Стадия I. Метиловый эфир 3-[(1,4-диоксаспиро[4.5]дец-8-ил)-(транс-4-метилциклогексанкарбонил)амино]-5-иодтиофен-2-карбоновой кислоты (из примера 3) растворяют в тетрагидрофуране и обрабатывают посредством 3 н раствора HCl. Реакционную смесь перемешивают при 40C в течение 3 ч. Реакционную смесь упаривают при пониженном давлении. Смесь растворяют в этилацетате и промывают водным насыщенным раствором NaHCO3. Отделяют органический слой, сушат над Na2SO4, фильтруют и концентрируют с получением соединения, указанного в заглавии. Стадия II. К холодному (0C) раствору метилового эфира 5-иод-3-[(транс-4-метилциклогексанкарбонил)-(4-оксоциклогексил)амино]тиофен-2-карбоновой кислоты в MeOH в атмосфере N2, добавляют порциями NaBH4 и перемешивают. После завершения реакции, добавляют 2%-ный раствор HCl и перемешивают в течение 15 мин. Реакционную смесь концентрируют в вакууме досуха. Остаток распределяется между водой и этилацетатом. Отделяют органический слой, сушат над MgSO4 и концентрируют досуха. Остаток очищают посредством колоночной хроматографии на силикагеле с использованием смесиEtOAc:гексан в качестве элюента с получением соединения, указанного в заглавии. Стадия III. К раствору метилового эфира 3[(транс-4-гидроксициклогексил)-(транс-4-метилциклогексанкарбонил)амино]-5-иодтиофен-2-карбоновой кислоты и этинилтриметилсилана в диметилформамиде, добавляют триэтиламин и трис(дибензилиденацетон)дипалладий (0), и реакционную смесь перемешивают при 60C в течение 16 ч в атмосфере N2. Диметилформамид и триэтиламин удаляют при пониженном давлении, и остаток распределяется между водой и этилацетатом. Отделяют органический слой, сушат (Na2SO4), концентрируют и остаток очищают посредством колоночной хроматографии с использованием смеси этилацетата и гексана (1:2) в качестве элюента с получением соединения, указанного в заглавии. Стадия IV. Метиловый эфир 3-[(транс-4-гидроксициклогексил)-(транс-4-метилциклогексанкарбонил)амино]-5-триметилсиланилэтинилтиофен-2-карбоновой кислоты и 2-хлор-2-метилпропан собирают в дихлорметане и добавляют свежесублимированный хлорид алюминия при -78C. Реакционную смесь перемешивают при той же температуре в течение 6 ч. Реакционную смесь выливают в воду, разбавляют дихлорметаном. Органический слой отделяют, сушат (Na2SO4) и концентрируют. Остаток очищают колоночной хроматографией с использованием этилацетата и гексана с получением соединения,указанного в заглавии. Ссылка: J. Chem. Soc, Chem. Commun., 1982, 959-960. Стадия V. Метиловый эфир-5-(3,3-диметил-бут-1-инил)-3-[(транс-4-гидроксициклогексил)-(транс 4-метилциклогексанкарбонил)амино]тиофен-2-карбоновой кислоты растворяют в смеси THF:метанол:H2O в соотношении 3:2:1 и обрабатывают посредством 1 н раствора LiOHH2O. После 2 ч перемешивания при 60C, реакционную смесь концентрируют при пониженном давлении на роторном испарителе. Смесь распределяется между этилацетатом и водой. Водный слой подкисляют с использованием 0,1 н. раствораHCl. Этилацетатный слой отделяют и сушат над Na2SO4. Растворитель удаляют и остаток очищают посредством колоночной хроматографии с использованием смеси метанола и дихлорметана (1:9) в качестве злюента с получением соединения, указанного в заглавии. Таблица 1. Соединение в соответствии с настоящим изобретением Данные масс-спектрального анализа записаны с использованием масс-спектрометрии с ионизацией электрораспылением. Пример 2. Оценка соединений в анализе пробы РНК HCV-зависимой РНК-полимеразы. Следующие ссылки все включены путем ссылки: 1. Behrens, S., Tomei, L., De Francesco, R. (1996) EMBO 15, 12-22. 2. Harlow, E., and Lane, D. (1988) Antibodies: A Laboratory Manual. Cold Spring Harbord Laboratory.Cold Spring Harbord. NY. 3. Lohmann, V., Korner, F., Herian, U., and Bartenschlager, R. (1997) J. Virol. 71, 8416-8428. 4. Tomei, L., Failla, C, Santolini, E., De Francesco, R., and La Monica, N. (1993) J. Virol. 67, 4017-4026. Соединения оценивают с использованием анализа пробы полимеразы in vitro, содержащей очищенную рекомбинантную РНК HCV-зависимую РНК-полимеразу (NS5B-белок). NS5B HCV является экспрессированным в клетках насекомых с использованием рекомбинантного бакуловируса в качестве вектора. Экспериментальные методики, использованные для клонирования, экспрессии и очистки NS5Bбелка вируса HCV описаны ниже. Далее следуют подробности методов анализа пробы РНК-зависимой РНК-полимеразы для тестирования соединений.NS5B-белок штамма HCV-Bk, генотип 1b, является амплифицированной посредством полимеразной цепной и реакции (ПЦР), с использованием праймеров NS5Nhe5' и плазмиды pCD 3,8-9,4 в качестве матрицы(Tomei et al, 1993). NS5Nhe5' и XhoNS53' содержат два участка NheI и XhoI (подчеркнутые последовательности),соответственно, на своем 5'-конце. Амплифицированный ДНК-фрагмент клонируют в бактериальной плазмиде экспрессии pET-21b (Novagen) между сайтами рестрикции NheI и XhoI, для продуцирования плазмидыpET/NS5B. Эту плазмиду позднее используют в качестве матрицы для ПЦР-амплификации NS5B-кодирующего участка, с использованием праймеров NS5B-H9 иNS5B-H9 охватывает участок из 15 нуклеотидов вNS5B-R4 (5'плазмиде рЕТ-21b, за которым следуют инициирующий трансляцию кодон (ATG) и 8 нуклеотидов, соответствующих 5'-концу NS5B-кодирующего участка (nt. 7590-7607 в последовательности HCV с номером изолята М 58335). NS5B-R4 содержит два сайта BamHI (подчеркнутые), за которыми следуют 18 нуклеотидов, соответствующие участку около терминирующего трансляцию кодона в геноме HCV (nt. 9365-9347). Амплифицированная последовательность, размером в 1,8 kb (тысяча пар нуклеотидов), была переварена посредством NheI и BamHI и лигирована в предварительно переваренную плазмиду pBlueBacII(Invitrogen). Получающуюся в результате рекомбинантную плазмиду обозначают как pBac/NS5B. КлеткиSf9 совместно трансфицируют 3 мкг pBac/NS5B, вместе с 1 мкг линеаризованной ДНК бакуловируса (Invitrogen) так, как описано в протоколе производителя. После двух раундов очистки от бляшек выделяютNS5B-рекомбинантный бакуловирус, BacNS5B. Присутствие рекомбинантного NS5B-белка определяют посредством вестерн-блоттинг-анализа (Harlow and Lane, 1988) BacNS5B-инфицированных клеток Sf9, с использованием поликлональной антисыворотки кролика (анти-NS5B), индуцированной против вариантаNS5B-белка с гистидиновой меткой, экспрессированного в E. coli. Инфицирование клеток Sf9 посредством такого очищенного от бляшек вируса проводят в однолитровых вращающихся колбах с плотностью клеток 1,2106 клеток на миллилитр (клетки/мл) и с множественностью инфицирования, равной 5. Получение растворимого рекомбинантного NS5B-белка.Sf9-клетки инфицируют так, как описано выше. Через шестьдесят часов после инфицирования,клетки собирают, затем промывают дважды забуференным фосфатом физиологическим раствором (PBS). Тотальные белки солюбилизируют так, как описано в публикации Lohmann et al. (1997), с некоторыми модификациями. Кратко, белки экстрагируют в три стадии, S1, S2, S3, с использованием лизирующих буферных растворов (LB) I, LB II, и LB III (Lohmann et al, 1997). Композицию LBII модифицируют таким образом, чтобы она содержала 0,1% тритона X-100 и 150 мМ NaCl, для снижения количества солюбилизированного NS5B-белка на этой стадии. Кроме того, на всем протяжении протокола избегают разрушения ультразвуком клеточных экстрактов для сохранения целостности структуры белка. Очистка рекомбинантного NS5B-белка с использованием жидкостной экспресс-хроматографии белков (FPLC). Растворимый NS5B-белок в фракции S3 разбавляют с понижением концентрации NaCl до 300 мМ,затем его инкубируют порционно с гранулами ДЭАЭ-сефарозы (Amersham-Pharmacia) в течение 2 ч при 4C так, как описано в публикации Behrens et al. (1996). Несвязанное вещество устраняют посредством центрифугирования в течение 15 мин при 4C, при 25000 оборотах в минуту (rpm) с использованием ротора SW41 (Beckman). Надосадочную жидкость дополнительно разбавляют с понижением концентрацииNaCl до 200 мМ и впоследствии наносят со скоростью потока 1 мл/мин на колонку с гепарином HiTrap объемом 5 мл (Amersham-Pharmacia), соединенную с системой жидкостной экспресс-хроматографии белков (FPLC) (Amersham-Pharmacia). Связанные белки элюируют фракциями по 1-мл, с использованием раствора NaCl с непрерывным градиентом 0,2-1 М, в пределах объема 25 мл. NS5B-белки-содержащие фракции идентифицируют посредством электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), с последующим вестерн-блоттингом с использованием антисыворотки против NS5B-белка при разбавлении 1:2000. Фракции с позитивной полярностью объединяют, и буферный раствор для элюирования заменяют на 50 мМ-ный раствор по NaPO4 (pH 7,0), 20%-ный раствор по глицерину, 0,5%-ный раствор по тритону X-100 и 10 мМ-ный раствор по DTT, с использованием колонкиPD-10 (Amersham-Pharmacia). Затем наносят пробу на колонку HiTrap SP объемом 1 мл (AmershamPharmacia), со скоростью потока 0,1 мл/мин. Связанные белки элюируют с использованием раствораNaCl с непрерывным градиентом NaCl 0-1M в пределах объема 15 мл. Элюированные фракции анализируют посредством электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия(SDS-PAGE) и вестерн-блоттинга. Альтернативно, белки визуализируют, после SDS-PAGE, посредством окрашивания серебром с использованием набора Silver Stain Plus (BioRad), который описан производителем. Фракции с позитивной полярностью тестируют на активность RdRp (pHK-зависимой РНКполимеразы) (смотри ниже), и объединяют наиболее активные фракции с позитивной полярностью, и хранят в виде 40%-ного раствора глицерина при -70C. Флэш-планшетный сцинтилляционный анализ сближения (STREP-FLASH ASSAY) для РНКзависимой РНК-полимеразы (RdRp) вируса HCV in vitro, использованный для оценивания аналогов.-8 016457 Суть этого анализа состоит в измерении внедрения меченного радиоактивным изотопом [3H] UTP(уридинтрифосфата) в матрицу-праймер PolyrA/биотинилированный олиго dT, регистрируемого на поверхности покрытых стрептавидином титрационных флэш-микропланшетах с введенной сцинтилляционной жидкостью Flashplates (NEN Life Science Products Inc., MA, USA, SMP 103A). Кратко, 400 нг/мкл раствора polyrA (Amersham Pharmacia Biotech) смешивают объем-на-объем с раствором 5'-биотин-олигоdT15 с концентрацией 20 пикомоль/мкл. Матрицу и праймеры денатурируют при 95C в течение 5 мин,затем инкубируют при 37C в течение 10 мин. Ренатурированные матрица-праймеры потом разбавляют вTris-HCl-содержащем буферном растворе и дают соединиться с покрытыми стрептавидином флэшпланшетами в течение ночи. Несвязанное вещество отбрасывают; соединения добавляют в 10 мкл раствора с последующим добавлением 10 мкл раствора, с концентрацией 50 мМ по MgCl2, с концентрацией 100 мМ по Tris-HCl (pH 7,5), с концентрацией 250 мМ по NaCl и с концентрацией 5 мМ по DTT. Ферментативную реакцию инициируют добавлением 30 мкл раствора, содержащего фермент и субстрат, с получением следующих концентраций: 25 мкМ по уридинтрифосфату (UTP), 1 мкКи по [3H] UTP и 100 нМ по рекомбинантному NS5B-белку вируса HCV. Реакциям RdRp (pHK-зависимой РНК-полимеразы) дают протекать в течение 2 ч при комнатной температуре, после чего лунки промывают три раза 250 микролитрами 0,15 М раствора NaCl, высушивают на воздухе при 37C, и подсчитывают с использованием жидкостного сцинтилляционного счетчика (Wallac Microbeta Trilex, Perkin-Elmer, MA, USA). Пример 3. Клеточная культура для анализа репликации РНК вируса HCV с использованием клеточного люциферазного репортера. Соединения настоящего изобретения представляют собой ингибиторы полимеразы вируса HCV. Неожиданно было обнаружено, что соединения, соответствующие настоящему изобретению и имеющие особый тип замещения, проявляют улучшенный терапевтический индекс относительно других тиофеновых аналогов. Репликонные клеточные линии Huh-7, 5,2 и ЕТ, которые получены из Huh-7-клеточной линии гепатокарциномы, поддерживают в культуре так, как это описано в публикации Krieger, N; Lohmann, V;Bartenschlager, R. Enhancement of hepatitis C Virus RNA replicaton by cell culture-adaptive mutations. J. Virol. 2001, 75, 4614-4624. Клетки Huh-7, 5,2 содержат сильно адаптированную в клеточной культуре репликонную конструкцию I389luc-ubi-neo/NS3-3'/5.1, которая несет, в дополнение к гену неомицина, интегрированную копию гена люциферазы светляков (Krieger, N; Lohmann, V; Bartenschlager, R. Enhancementof hepatitis C Virus RNA replicaton by cell culture-adaptive mutations. J. Virol. 2001, 75, 4614-4624). Такая клеточная линия позволяет измерять репликацию РНК вируса HCV и трансляцию путем измерения активности люциферазы. Ранее было показано, что активность люциферазы тесно связана с уровнем РНК репликона в таких клетках (Krieger, N; Lohmann, V; Bartenschlager, R. Enhancement of hepatitis C VirusRNA replicaton by cell culture-adaptive mutations. J. Virol. 2001, 75, 4614-4624). Клеточная линия Huh-7, ET имеет те же признаки, которые указаны для клеточной линии Huh-7, 5,2, за исключением того, что клетки ЕТ являются более здоровыми и содержат адаптационную мутацию NS4B-гена HCV вместо NS5A. Обе клеточные линии поддерживают в культурах на суб-конфлюэнтном уровне (85%), так как уровень РНК репликона является наиболее высоким в активно пролиферирующих клетках. Культуральная среда,использованная для пассирования клеток состоит из модифицированной по способу Дульбекко среды Игла (DMEM) (Gibco BRL Laboratories, Mississauga, ON, Canada), дополненной фетальной бычьей сывороткой с конечной концентрацией 10%, пенициллином/стрептомицином с конечной концентрацией 1%,глутамином с конечной концентрацией 1%, пируватом натрия с конечной концентрацией 1%, заменяемыми аминокислотами с конечной концентрацией 1%, и G418 с конечной концентрацией 350 мкг/мл. Клетки инкубируют при 37C, в атмосфере 5%-ного CO2 и для поддержания суб-конфлюэнтности подвергают пассированию дважды в неделю. Приблизительно 3000 жизнеспособных клеток Huh-7, 5,2 или ЕТ (100 мкл) на лунку высевают на белый непрозрачный (матово-белый) 96-луночный титрационный микропланшет. Культуральная среда,использованная для анализа аналогична культуральной среде, описанной выше, за исключением того,что она не содержит G418 и феноловый красный. По истечении периода инкубирования 3-4 ч при 37C в инкубаторе с 5%-ным CO2, добавляют соединения (100 мкл) в различных концентрациях. Затем клетки дополнительно инкубируют в течение 4 дней при 37C в инкубаторе с 5%-ным CO2. После этого культуральную среду удаляют и клетки лизируют путем добавления 95 мкл буферного раствора люциферазы(субстрат люциферина в забуференном детергенте). Клеточные лизаты инкубируют при комнатной температуре и защищают от прямого света в течение по меньшей мере 10 мин. Планшеты подвергают считыванию для определения количества люцифераз с использованием люминометра (Wallac MicroBetaTrilux, Perkin Elmer, MA, USA). 50%-Ингибирующие концентрации (IC50s) в отношении ингибирующего действия определяют по кривой зависимости "доза-эффект" с использованием одиннадцати концентраций на каждое соединение в двух экземплярах. Кривые строят по экспериментальным точкам с использованием нелинейного регрессионного анализа, и концентрации IC50s получают интерполяцией из получающейся в результате кривой с использованием программного обеспечения GraphPad Prism, версия 2,0 (GraphPad Software Inc., SanDiego, CA, USA). Пример 4. Оценивание соединений в ферментативном анализе с использованием укороченного с Cконца на 21 остаток аминокислоты NS5B-белка вируса HCV штамма ВК с генотипом 1b. Следующие ссылки все включены путем ссылки:in Escherichia coli. J. Virol. 73, 1649-1654 (1999). Соединения оценивают с использованием анализа пробы полимеразы in vitro, содержащей рекомбинантную РНК-зависимую РНК-полимеразу HCV (NS5B-белок), экспрессированную в бактериальных клетках. Экспериментальные методики, использованные для клонирования, экспрессии и очистки NS5Bбелка HCV, описаны ниже. Ниже подробно описано проведение анализа проб РНК-зависимой РНКполимеразы для тестирования соединений. Экспрессия NS5B-белка вируса HCV в клетках насекомых. Экспрессия и очистка NS5B-белка HCV. Рекомбинантную растворимую форму, представляющую собой фермент на основе укороченного сBL21 (DE3). Укороченный фермент очищают так, как описано в публикациях Lesburg et al. (1999) и Ferrari et al. (1999) с минимальными модификациями. Кратко, растворимые бактериальные лизаты вводят наNi-хелатирующую аффинную колонку HiTrap (GE Healthcare, Baie d'Urfe, QC, Canada). Связанный фермент элюируют с использованием раствора с градиентом имидазола. Затем имидазол удаляют из буферного раствора смешанных активных фракций с использованием обессоливающих колонок PD-10 (GEHealthcare, Baie d'Urfe, QC, Canada). Дополнительной очистки добиваются путем пропускания препарата белковых веществ через катионообменную колонку на сефарозе HiTrap SP (GE Healthcare, Baie d'Urfe,QC, Canada) с использованием для элюирования градиентного раствора NaCl. После этого буферный раствор заменяют раствором с концентрацией 10 мМ по Tris (pH 7,5), 10% по глицерину, 5 мМ по DTT,600 мМ по NaCl с использованием колонки PD-10. Фракции с позитивной полярностью тестируют на активность РНК-зависимой полимеразы и наиболее активные фракции смешивают и хранят при -70C. Анализ пробы NS5B-белка in vitro. Измерение ингибирующего действия соединений в отношении полимеризационной активностиNS5B-белка вируса HCV осуществляют путем оценивания количества меченного радиоактивным изотопом уридинтрифосфата (UTP), внедренного посредством фермента в новосинтезированную РНК с использованием матрицы/праймера гомополимерной РНК. Кратко, праймер на основе 15-мерного 5'биотинилированного олигонуклеотида ДНК (oligo dT), ренатурированный до гомополимерной матрицы РНК polyrA, улавливается на поверхности покрытого стрептавидином шарика (GE Healthcare, Baie d'Urfe,QC, Canada). По существу, соединения тестируют при различных концентрациях (0,005-200 мкМ) в конечном объеме 50 мкл реакционной смеси, состоящей из Tris-HCl с концентрацией 20 мМ (pH 7,5),MgCl2 с концентрацией 5 мМ, DTT с концентрацией 1 мМ, NaCl с концентрацией 50 мМ, очищенного фермента NS5B с концентрацией 50 нМ, polyrA/oligodT15 с концентрацией 250 нг (Invitrogen, Burlington,Ontario, Canada), нерадиоактивного UTP с концентрацией 15 мкМ, и [3H]UTP с концентрацией 1 мкКиNS5B HCV оценивают количественно путем измерения внедрения субстрата с меченным радиоактивным изотопом [3H]UTP на 3'конец растущего праймера, и детектирование выполняют путем считывания сигнала с использованием жидкостного сцинтилляционного счетчика (Wallac MicroBeta Trilux, PerkinElmer, MA, USA). Анализ внедрения [3H]Тимидина. Клетки общим количеством 1,000-2,000 на лунку высевают в 96-луночные агглютинационные планшеты в объеме 150 мкл модифицированной по способу Дульбекко среды Игла (DMEM) (Life Technologies, Inc., Gaithersburg, Md.), дополненной фетальной бычьей сывороткой (FBS) (HyClone Laboratories, Inc., Logan, Utah) с концентрацией 10% и глутамином (Life Technologies, Inc.) с концентрацией 2 мМ. Пенициллин и стрептомицин (Life Technology, Inc.) добавляют с получением конечных концентраций до 500 ед./мл и 50 мкг/мл соответственно. После инкубирования в течение 18 ч при 37C в атмосфере 5%-ного CO2, среду удаляют и заменяют соединениями, разбавленными в культуральной среде. Шесть серийных двукратных разбавлений лекарственных средств испытывают трижды. После дополнительного 72-часового инкубирования добавляют 50 мкл раствора [3H]метилтимидина (Amersham Life Science, Inc.,Arlington Heights, 111.; 2 Ки/ммоль) в культуральной среде с концентрацией 10 мкКи/мл, и планшеты инкубируют в течение дополнительных 18 ч при 37C. Затем клетки промывают забуференным фосфатом физиологическим раствором (PBS), трипсинизируют в течение 2 мин и собирают на стекловолоконный фильтр с использованием харвестера клеток Tomtec (Tomtec, Orange, Conn.). Фильтры сушат при 37- 10016457 в течение 1 ч и помещают в мешок с 4,5 мл жидкого коктейля для сцинтилляционного счета (Wallac Oy,Turku, Finland). Кумуляция [3H]метилтимидина, представляющего собой жизнеспособные реплицирующиеся клетки, измеряют с использованием жидкостного сцинтилляционного счетчика (1450-Microbeta;Wallac Oy). Ссылка по SOP (стандартизированные технологические операции): 265-162-03. Для этого эксперимента использованные клеточные линии представляют собой следующее: клетки Huh-7 ET (клетки, полученные из клеточной линии Huh-7 (гепатоцеллюлярная карцинома, человек) и содержащие субгеномный репликон HCV), клетки Molt-4 (периферическая кровь, острый лимфобластный лейкоз, человек), клетки DU-145 (рак предстательной железы, метастаз в головной мозг, человек), клетки Hep-G2(гепатоцеллюлярная карцинома, человек), и клетки SH-SY5Y (нейробластома, человек). Анализ полученных данных 50%-ные цитотоксические концентрации (CC50s) в отношении клеточной токсичности определяют из кривых зависимости "доза-эффект" с использованием шести - восьми концентраций на каждое соединение в трех экземплярах. Кривые строят по экспериментальным точкам с использованием нелинейного регрессионного анализа, и значения IC50 получают интерполяцией из получающейся в результате кривой с использованием программного обеспечения GraphPad Prism, версия 2,0 (GraphPad Software Inc., SanTI (терапевтический индекс): Соотношение СС 50/IC50 в клетках репликона вируса HCV (КлеткиHuh-7 ET) из примера 12. В том случае, когда соединения тестируют более, чем один раз, проверяют среднее значение TI. В табл. 2 приведен перечень терапевтических индексов (TIs) соединения по изобретению относительно других тиофеновых ингибиторов полимеразы вируса HCV. Таблица 2 Соединения A-I могут быть синтезированы так, как описано в патенте US Patent6881741, в международных публикациях: WO 02/100851, WO 2004/052885 или WO 2006/072347. Пример 5. Стабильность в человеческих и крысиных микросомах и индукция в культивируемых человеческих гепатоцитах. Некоторые соединения, соответствующие настоящему изобретению и имеющие особый тип замещения, проявляют улучшенные микросомальную стабильность и/или индукцию в человеческих гепатоцитах относительно других тиофеновых аналогов. Например, соединения 1 и 2 показывают лучшие профиль микросомальной стабильности и профиль индукции относительно соединения E. Стабильность в человеческих и крысиных микросомах. Каждое соединение инкубируют в микросомах печени (1,6 мг/мл) при 37C в условиях окисления и глюкоронизации (NADPH с концентрацией 1,5 мМ и UDPGA с концентрацией 1,5 мМ в фосфатном буферном растворе, pH 7,4). Растворы для инкубирования, не содержащие NADPH и UDPGA, используют в качестве контрольных растворов. Соединения инкубируют при концентрации 50 мкМ в течение 0 и 60 мин. Реакцию останавливают путем введения равного объема ацетонитрила. Смесь центрифугируют и надосадочную жидкость анализируют посредством HPLC/UV (высокоэффективная жидкостная хроматография с использованием детектора ультрафиолета) или MS/MS (тандемная масс-спектрометрия). Процентное содержание остатков родительской молекулы соответствует площади родоначального соединения через 60 мин инкубировании относительно площади родоначального соединения в нулевой момент инкубирования 100. Индукция в культивируемых человеческих гепатоцитах Индукцию осуществляют в криоконсервированных или в свежекультивированных человеческих гепатоцитах. Клетки культивируют на коллагене в течение 48 ч. После этого периода клетки дозируют со свежеприготовленной с добавлением известного количества тестового вещества инкубационной средой,содержащей тестовое соединение или индуктор в качестве позитивного контроля, рифампицин. Конечные концентрации тестовых соединений в инкубационных средах составляют 1, 10 и 100 мМ, тогда как позитивный контроль тестируют при концентрации 10 мМ. Негативный контроль (NC) состоит из инкубирования клеток с DMSO с конечным содержанием 0,1%. В течение всех 48 ч выполняют обработку клеток посредством свежеприготовленной инкубационной среды с добавлением известного количества тестового соединения или индуктора в качестве контроля, заменяемой ежедневно. В конце индуктивного периода, среду содержащую индуктор, удаляют, и клетки промывают дважды 200 мкл буферного раствора Krebs-Henseleit, содержащего HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфокислота) с концентрацией 12 мМ, рН 7,4 (КН-буферный раствор). Затем измеряют индукцию CYP3A4 по активности с использованием тестостерона в качестве субстрата и по уровням мРНК. Для измерения активностиCYP3A4, добавляют свежеприготовленный КН-буферный раствор с добавлением тестостерона в концентрации 200 мМ и клетки инкубируют в течение 30 мин при 37C. В конце периода инкубации среду удаляют и анализируют посредством HPLC/MS (высокоэффективная жидкостная хроматография/Массспектрометрия) с целью определения 6-бета-гидрокси-тестостерона. Максимальную индукцию (100% индукцию) определяют при обработке Рифампицином с концентрацией 10 мМ. Потенциал тестовых соединений, вызывающий индукцию CYP3A, описывают в виде процента максимальной индукции, полученной с классическим индуктором. Для определения уровня мРНК собирают гепатоциты и получают тотальную РНК с использованием набора Qiagen Rneasy Purification Kit (Mississauga, ON) в соответствии с инструкциями производителя. Комплементарные ДНК гепатоцитов синтезируют из тотальной РНК с- 12016457 использованием обратной транскриптазы M-MLV (обратная транскриптаза вируса лейкоза мышей Молони) (Invitrogen, Carlbad, CA) с универсальным праймером (Roche Diagnostic, Germany). Анализ экспрессии определенной мРНК в образцах тотальной РНК осуществляют посредством количественной полимеразной цепной реакции (ПЦР) в реальном времени с использованием тест-системы для определения нуклеотидных последовательностей ABI PRISM 7700 Sequence Detection System. Использованные праймеры для CYP3A4 представляют собой 5'-ТСА GCC TGG TGC ТСС ТСТ АТС ТАТ-3' в качестве прямого праймера и 5'-AAG CCC TTA TGG TAG GAC ААА ATA TTT-3' в качестве обратного праймера. Использованная проба представляет собой 5'-/56-FAM/TCC AGG GCC САС АСС TCT GCC T/36-TAMSp/-3'. Данные нормализуют по рибосомной 18S мРНК (VIC) с определением в реальном времени. Анализ данных и статистические тесты выполняют с использованием программного обеспечения Microsoft Excel. Результаты могут быть представлены в виде экспрессии гена изменения фолдинга (способа укладки) молекулы белка в сравнении с контрольной группой в соответствии со следующей формулой:Ct = Ct FAM - Ct VIC,Ct = Ct (потенциальное лекарство) - Ct (контрольная группа). Индукция фолдинга: 2 - Ct. Вышеупомянутые примеры могут быть повторены с подобным успехом при замене реагентов и/или условий эксперимента, использованных в вышеупомянутых примерах, описанными в общем или описанными конкретно реагентами и/или условиями эксперимента этого изобретения. Исходя из предшествующего описания, специалист в данной области может легко выявить существенные характеристики этого изобретения и, не выходя за рамки его сущности и объема, может сделать различные изменения и модификации изобретения с тем, чтобы адаптировать его к различным применениям и условиям/состояниям. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция, содержащая соединение по п.1 и по меньшей мере один фармацевтически приемлемый носитель или эксципиент. 3. Фармацевтическая комбинация, содержащая соединение по п.1 и по меньшей мере один дополнительный агент. 4. Фармацевтическая комбинация по п.3, где указанный по меньшей мере один дополнительный агент выбирают из ингибиторов вирусной сериновой протеазы, ингибиторов вирусной полимеразы, ингибиторов вирусной геликазы, иммуномодулирующих агентов, антиоксидантов, антибактериальных агентов, терапевтических вакцин, гепатопротекторов, антисмысловых агентов, ингибиторов протеазыNS2/3 вируса HCV и ингибиторов участка внутренней посадки рибосомы (IRES). 5. Фармацевтическая комбинация по п.4, где указанный по меньшей мере один дополнительный агент выбирают из рибавирина и интерферона-. 6. Фармацевтическая комбинация по п.4, где указанный по меньшей мере один дополнительный агент выбирают из рибавирина и пегилированного интерферона-. 7. Применение соединения по п.1 для лечения вирусной инфекции гепатита C у носителя вируса. 8. Применение по п.7, где упомянутым носителем вируса является человек. 9. Фармацевтически приемлемая соль соединенияc) рибавирин. 12. Применение терапевтически эффективного количества фармацевтической комбинации, включающей:c) рибавирин,для лечения вирусной инфекции гепатита C у носителя вируса.
МПК / Метки
МПК: A61K 31/4196, A61K 31/7056, A61P 31/14, A61K 38/21, C07D 333/40, A61K 31/381, C07F 7/10, C07D 409/12, A61K 31/4535
Метки: инфекции, лечения, тиофена, аналог, вирусной, гепатита
Код ссылки
<a href="https://eas.patents.su/15-16457-analog-tiofena-dlya-lecheniya-virusnojj-infekcii-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Аналог тиофена для лечения вирусной инфекции гепатита с</a>
Предыдущий патент: 8-сульфонил-1,3,4,8-тетрагидро-2н-[1,4]оксазепино[6,7-e]индольные производные и их использование в качестве 5-нт6 рецепторных лигандов
Следующий патент: Заготовка для пайки, способ изготовления заготовок для пайки, способ пайки и конструктивные элементы, изготовленные из упомянутой заготовки для пайки
Случайный патент: Поршневая машина












