Способ синтеза замещенных гидроксиметилфенолов
Формула / Реферат
1. Способ получения соединения формулы (I)
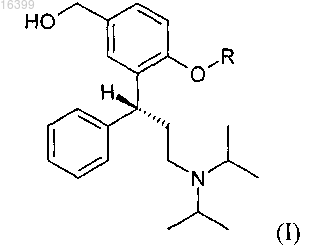
где R означает водород, прямую или разветвленную C1-С6-алкилкарбонильную или фенилкарбонильную группу,
или его соли, включающий следующие стадии:
а) реакцию соединения формулы (II)
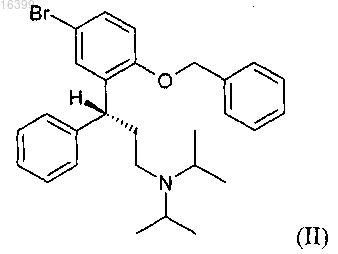
со смесью Mg и инициатора Гриньяра формулы R1MgX, где R1 представляет собой C1-С12-алкил, C2-С6-алкенил, С2-С6-алкинил, фенил, замещенный C1-С6-алкилом, C1-С6-алкокси или CF3, незамещенный фенил или фенил(C1-С6)алкил и X выбирают из бромида, хлорида и йодида, с образованием реагента Гриньяра;
b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а);
с) реакцию реагента Гриньяра с избытком карбоната, выбранного из группы ди(C1-С6-алкил)карбонатов и циклических C1-С6-алкиленкарбонатов с получением соединения формулы (III)
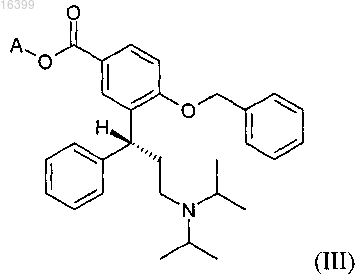
где А представляет собой C1-С6-алкильную группу; и
d) последующее восстановление соединения формулы (III) до соответствующего производного метилового спирта
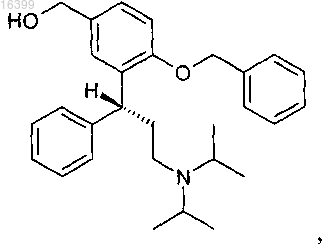
и дебензилирование защищенного фенола и, при необходимости, фенольное моноацилирование с получением соединения формулы (I), а также, при необходимости, образование фармацевтически приемлемой соли.
2. Способ по п.1, в котором инициатором Гриньяра является метилмагнийхлорид (MeMgCl).
3. Способ по любому из пп.1 и 2, в котором карбонатом является диметилкарбонат.
4. Способ по любому из предшествующих пунктов, в котором соединение формулы (III) кристаллизуют перед реакцией получения соединения формулы (I).
5. Способ по п.4, в котором кристаллизацию соединения формулы (III) осуществляют в изопропаноле.
6. Способ по любому из предшествующих пунктов, в котором соединением формулы (I) является фезотеродин формулы (Ia)
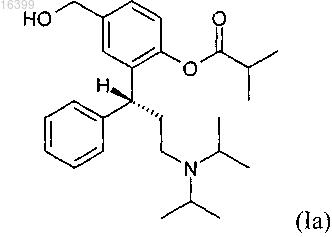
или его соль.
7. Способ по п.6, в котором солью фезотеродина является кислая фумаровая соль.
8. Способ по любому из предшествующих пунктов, в котором на стадии с) карбонат используют в 5-50-кратном избытке.
9. Способ по любому из предшествующих пунктов, в котором на стадии с) используют растворитель, предпочтительно гексан.
10. Способ по п.9, в котором на стадии с) карбонат растворяют в гексане, а затем дистиллируют до снижения содержания воды до 0,01% или ниже, после чего добавляют реагент Гриньяра.
11. Способ по любому из предшествующих пунктов, в котором после стадии с) производят остановку реакции путем резкого добавления к смеси подходящего реагента.
12. Способ по п.11, в котором реагентом является водный раствор хлорида аммония.
13. Способ по любому из предшествующих пунктов, где молярное отношение инициатора Гриньяра к Mg составляет 1:2-2:1, а молярное отношение инициатора Гриньяра к соединению формулы (II) составляет около 1:1-2:1.
14. Способ по любому из предшествующих пунктов, в котором стадия а) включает:
a1) растворение соединения формулы (II) в подходящем растворителе с образованием раствора;
а2) добавление полученного раствора к смеси инициатора Гриньяра и Mg в подходящем растворителе.
15. Способ по п.14, в котором растворитель, используемый на стадии a1) для растворения соединения формулы (II), является толуолом.
16. Способ по любому из пп.14 или 15, в котором растворителем на стадии а2) является ТГФ.
17. Способ по любому из пп.14-16, в котором
на стадии a1) соединение формулы (II) растворяют в толуоле,
на стадии а2) указанный раствор добавляют к смеси инициатора Гриньяра и Mg в ТГФ и перемешивают до завершения реакции,
на стадии b) смесь, полученную на стадии а2), продолжают перемешивать,
на стадии с) смесь добавляют к избытку карбоната в гексане, после чего следует остановка реакции резким добавлением водного раствора NH4Cl.
18. Способ по любому из предшествующих пунктов, в котором температура реакции на стадии а) составляет 40-50°С.
19. Способ по любому из предшествующих пунктов, в котором температура реакции на стадии b) составляет 20-25°С.
20. Способ по любому из предшествующих пунктов, в котором температура реакции на стадии с) ниже 10°С.
21. Способ по любому из предшествующих пунктов, в котором на стадии с) реакционную смесь перемешивают со скоростью ≥90 об/мин.
22. Способ получения фармацевтической композиции, содержащей кислую фумаровую соль фезотеродина, включающий следующие стадии:
(a) получение кислой фумаровой соли фезотеродина способом согласно любому из предшествующих пунктов и
(b) составление обычным способом фармацевтической композиции с полученной кислой фумаровой солью фезотеродина.
23. Способ получения промежуточного соединения формулы (III) при получении соединения формулы (I), включающий реакцию карбоната, выбранного из группы ди(C1-С6-алкил)карбонатов и циклических C1-С6-алкиленкарбонатов, с реагентом Гриньяра с получением соединения формулы (III)
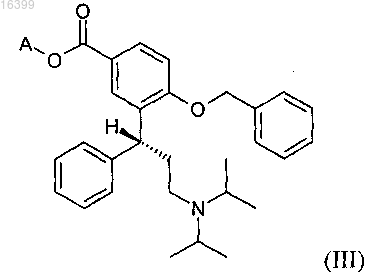
в которой А представляет собой C1-С6-алкильную группу,
где реагент Гриньяра получают реакцией соединения формулы (II)
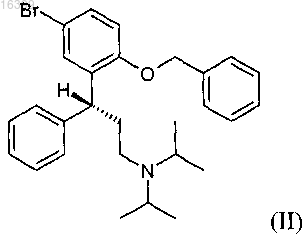
со смесью Mg и инициатора Гриньяра формулы R1MgX, где R1 представляет собой C1-С12-алкил, С2-С6-алкенил, С2-С6-алкинил, фенил, замещенный C1-С6-алкилом, C1-С6-алкокси или CF3, незамещенный фенил или фенил(C1-С6)алкил и X выбирают из бромида, хлорида и йодида, в растворе.
24. Способ по п.23, в котором инициатором Гриньяра является MeMgCl, a карбонатом - диметилкарбонат.
25. Способ по любому из пп.23 и 24, включающий кристаллизацию соединения формулы (III) в изопропаноле.
26. Способ получения соединения формулы (I) или его соли
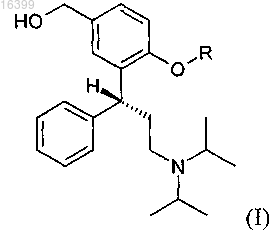
где R представляет собой водород, прямую или разветвленную C1-С6-алкилкарбонильную или фенилкарбонильную группу,
включающий следующие стадии:
а) реакцию соединения формулы (II)
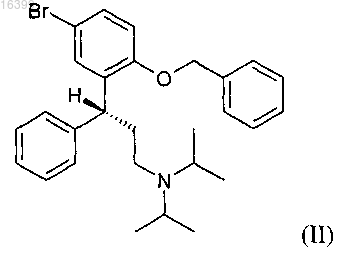
со смесью Mg и инициатора Гриньяра формулы R1MgX, где R1 представляет собой C1-С12-алкил, C2-С6-алкенил, C2-С6-алкинил, фенил, замещенный C1-С6-алкилом, C1-С6-алкокси или CF3, незамещенный фенил или фенил(С1-С6)алкил и X выбирают из бромида, хлорида и йодида, с образованием реагента Гриньяра;
b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а);
c) реакцию реагента Гриньяра с избытком карбоната, выбранного из группы ди(C1-С6-алкил)карбонатов и циклических C1-С6-алкиленкарбонатов, с получением соединения формулы (III)
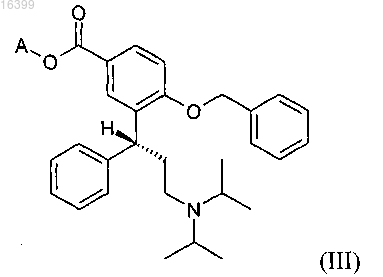
где А представляет собой C1-С6-алкильную группу;
d) кристаллизацию соединения формулы (III) в изопропаноле;
e) последующее восстановление соединения формулы (III) до соответствующего производного метилового спирта

и дебензилирование защищенного фенола и, при необходимости, фенольное моноацилирование с получением соединения формулы (I) и, при необходимости, образование фармацевтически приемлемой соли.
27. Способ по п.26, в котором соединение формулы (III) является сложным метиловым эфиром R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты.
28. Способ по любому из пп.26 и 27, где соединением формулы (I) является фезотеродин или его соль.
29. Способ по любому из пп.26-28, где соединением формулы (I) является кислая фумаровая соль фезотеродина.
Текст
СПОСОБ СИНТЕЗА ЗАМЕЩЕННЫХ ГИДРОКСИМЕТИЛФЕНОЛОВ Настоящее изобретение описывает способ получения 2-(3-диизопропиламино-1-фенилпропил)-4(гидроксиметил)фенола или его сложных фенольных моноэфиров или их солей, включающий следующие стадии: а) реакцию соединения формулы (II) со смесью инициатора Гриньяра и Mg в растворителе с образованием реагента Гриньяра; b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а); c) реакцию полученного реагента Гриньяра с избытком карбоната в растворителе с получением соединения формулы (III) где А представляет собой C1-С 6-алкил; и d) последующее восстановление соединения формулы (III) обычным способом до получения целевого продукта. 016399 Описывается способ получения 2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола,известного как активный метаболит толтеродина (далее называемого "активным метаболитом"), и его сложных фенольных моноэфиров по укороченному пути синтеза посредством реакции Гриньяра. Целевые соединения имеют следующую формулу (I): где R представляет собой водород, прямую или разветвленную C1-С 6-алкилкарбонильную или фенилкарбонильную группу. Если R в формуле (I) представляет собой водород, формула представляет собой активный метаболит. Особо предпочтительным примером сложных фенольных моноэфиров формулы (I) является фезотеродин, который можно химически определить как сложный 2-(3-диизопропиламино-1-фенилпропил)4-(гидроксиметил)феноловый эфир R-(+)-изомасляной кислоты. Фезотеродин представлен ниже формулой (Ia) Соединения формулы (I), включая активный метаболит и его сложные фенольные моноэфиры формулы (I), известны из WO 99/058478. Описывается также способ получения солей соединения формулы (I), в частности, включающий получение солей фезотеродина, еще конкретнее - получение кислой фумаровой соли (гидрофумарата) фезотеродина. Также раскрывается получение фармацевтических составов, содержащих соединения формулы (I),такие как фезотеродин, и получение фармацевтических составов, содержащих фармацевтически приемлемую соль любого соединения формулы (I), включая, например, кислую фумаровую соль (гидрофумарат) или гидрат солянокислой соли (хлорида) фезотеродина. У человека нормальные сокращения мочевого пузыря происходят частично посредством стимулирования холинергического мускаринового рецептора. Мускариновые рецепторы не только частично способствуют нормальным сокращениям мочевого пузыря, но также способствуют большей части сокращений в сверхактивном мочевом пузыре, что приводит к таким симптомам, как частое мочеиспускание,срочные позывы и недержание мочи при напряжении. После введения фезотеродина и других сложных фенольных моноэфиров формулы (I) млекопитающим, например людям, эти соединения расщепляются эстеразами с образованием в организме активного метаболита. Известно, что активный метаболит является мощным и конкурирующим антагонистом мускаринового рецептора (WO 94/11337). Таким образом, фезотеродин и другие сложные фенольные эфиры формулы (I) представляют собой потенциальные пролекарства для активного метаболита. В частности, было показано, что фезотеродин является эффективным лекарством для лечения сверхактивного мочевого пузыря с симптомами недержания мочи при напряжении, срочных позывов и частого мочеиспускания, а также суперактивности детрузора (как описано в US 6713464 и ЕР-В-1077912). Комплексный подход к получению активного метаболита и сложных моноэфиров фенольной гидроксильной группы активного метаболита, такого как фезотеродин, описан в US 6713464 следующим образом. На первой стадии получают эфирный раствор из R-(-)-[3-(2-бензилокси-5-бромфенил)-3 фенилпропил]диизопропиламина, этилбромида и магния; этот раствор разбавляют сухим ТГФ и охлаждают до -60 С. На второй стадии небольшими порциями добавляют порошкообразную твердую двуокись углерода,и реакционную смесь нагревают до комнатной температуры. На третьей стадии реакцию останавливают путем добавления водного раствора хлорида аммония. На четвертой стадии устанавливают pH водной фазы охлажденной реакционной смеси на уровне 0,95. На пятой стадии фазу с установленным pH фильтруют, а из твердого вещества может быть получен гидрохлорид R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты.-1 016399 На шестой стадии полученную в результате очищенную бензойную кислоту этерифицируют, получая соответствующий сложный метиловый эфир. Ниже показана общая схема этого многостадийного синтеза.US 6713464 также описывает преобразование сложного метилового эфира в активный метаболит и затем этерификацию активного метаболита с получением сложного фенольного эфира, такого как фезотеродин.WO 94/11337 также описывает многостадийный процесс синтеза предшественника активного метаболита. Эти ранее описанные способы получения активного метаболита требуют выполнения многих стадий, что приводит к сложным процедурам очистки, большой длительности и большой вероятности человеческой ошибки и тем самым препятствует достижению оптимальной эффективности и экономичности. Кроме того, твердый диоксид углерода труден в использовании в больших масштабах в связи с необходимостью работать при очень низких температурах и порциями добавлять дробленый лед, а также в связи с трудностью контроля реакции с выраженным экзотермическим эффектом. Настоящее изобретение направлено на преодоление этих проблем и недостатков. Было установлено, что использование ди(С 1-С 6-алкил)карбоната, предпочтительно диметилкарбоната, или использование циклического C1-C6-алкиленкарбоната в реакции Гриньяра приводит к получению очень чистого продукта, в то же время устраняя образование бензойной кислоты и необходимость ее очистки. Описываемые способы неожиданны и удивительны, поскольку согласно существующим и хорошо известным учебникам добавление реагентов Гриньяра к карбонатам и другим сложным эфирам дает третичные спирты в качестве преобладающего продукта. Например, в F.A. Carey, R.J. Sundberg, "AdvancedOrganic Chemistry", Springer Media, 2001 указывается, что добавление реагентов Гриньяра к сложным эфирам (включая карбонаты) обычно используется для получения третичных спиртов (с. 447-448). Точно так же в хорошо известном руководстве "March's Advanced Organic Chemistry", Wilex-IntersciencePublication, John WileySons, Inc., 5th edition, 2001, p. 1214 указывается, что в реакциях Гриньяра "карбонаты дают третичный спирт, в котором все три группы R являются одинаковыми" (с. 1214). Однако удивительно, что в описываемом способе реакция карбоната с реагентом Гриньяра, который образуется после добавления магния и инициатора Гриньяра к соединениям формулы (II), ведет к образованию сложного алкильного эфира формулы (III) в качестве преобладающего продукта, в то время как третичный спирт образуется только как побочный продукт. Обычно приблизительно от 60 до 70% прямых продуктов описываемой реакции Гриньяра приходится на соединение формулы (III). Также неожиданным образом получается, что третичный спирт и другие примеси, образованные в результате применения описываемых способов, можно легко и эффективно удалить в процессе кристаллизации сложного эфира формулы (III) в изопропаноле. Это не прогнозировалось, исходя их существующего уровня техники. Таким образом, использование карбонатов, таких как диметилкарбонат или его более высокие гомологи, в реакции Гриньяра обеспечивает укороченный и более экономичный синтетический подход к соединениям формулы (I) за счет устранения синтеза производного бензойной кислоты и его очистки. Кроме того, эти способы больше подходят к крупномасштабным процессам, чем реакция, требующая использования твердого диоксида углерода, известная из предыдущего уровня техники.-2 016399 Кроме того, неожиданно выяснилось, что особо предпочтительным является использование метилмагнийхлорида в качестве инициатора Гриньяра. Чистота формулы (III) после кристаллизации в изопропаноле составляет обычно 96,1-97,4% при использовании метилмагнийхлорида для инициирования реакции Гриньяра, в то время как чистота соединения формулы (III) не превышает 94% в трех порциях, полученных с использованием изопропилмагнийбромида в качестве инициатора Гриньяра. Описывается укороченный способ получения соединения формулы (I) где R представляет собой водород, прямую или разветвленную С 1-С 6-алкилкарбонильную или фенилкарбонильную группу, включая активный метаболит и его сложные фенольные моноэфиры, такие как фезотеродин и его соли, еще точнее - кислую фумаровую соль фезотеродина. Укороченный синтез соединений формулы (I) можно характеризовать следующими стадиями: а) реакция соединения формулы (II) со смесью Mg и инициатора Гриньяра предпочтительно в растворителе с образованием реагента Гриньяра;b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а) иc) реакция реагента Гриньяра с карбонатом, таким как ди(С 1-С 6-алкил)карбонат или циклическийC1-С 6-алкиленкарбонат, и предпочтительно с диметилкарбонатом с получением соединения формулы (III) где А представляет собой С 1-С 6-алкил и предпочтительно метильную группу. В вышеописанном способе в качестве инициатора Гриньяра предпочтительно используетсяMeMgCl. Применительно к данному тексту термин "карбонат" включает ди(С 1-С 6-алкил)карбонаты, такие как, например, диметилкарбонат и диэтилкарбонат. а также циклические С 1-С 6-алкиленкарбонаты, такие как этиленкарбонат или пропиленкарбонат. Применительно к данному тексту термин "С 1-С 6-алкил" относится к любой прямой, разветвленной или циклической углеводородной цепи, имеющей от 1 до 6 атомов углерода. Применительно к данному тексту термин "инициатор Гриньяра" относится к соединению общей формулы R1MgX, где R1 представляет собой С 1-С 12-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, замещенный или незамещенный фенил или фенил(С 1-С 6)алкил, где указанный фенил может замещаться, например,C1-С 6-алкилом, C1-С 6-алкокси или CF3 и где X выбирают из группы, состоящей из бромида, хлорида и йодида. R1 предпочтительно выбирают из С 1-С 6-алкила, винила, аллила, пропенила, этинила, фенила или бензила, и предпочтительно он представляет собой С 1-С 4-алкил. Конкретными примерами инициаторов Гриньяра являются изопропилмагнийбромид, трет-бутилмагнийхлорид или особо предпочтительно метилмагнийхлорид.-3 016399 Описывается также укороченный способ получения соединения формулы (I) в которой R представляет собой водород, прямую или разветвленную C1-С 6-алкилкарбонильную или фенилкарбонильную группу, включая активный метаболит и его сложные фенольные моноэфиры,такие как фезотеродин и его соли, точнее кислую фумаровую соль и гидрат солянокислой соли фезотеродина,охарактеризующийся следующими стадиями: а) реакция соединения формулы (II)b) при необходимости, снижение температуры реакционной смеси, полученной на стадии (а), до уровня ниже температуры на стадии (а) иc) реакция реакционной смеси, полученной на стадии (а), с карбонатом, предпочтительно ди(С 1-С 6 алкил)карбонатом или циклическим C1-С 6-алкиленкарбонатом и еще предпочтительнее с диметилкарбонатом с получением соединения формулы (III) где А представляет собой C1-С 6-алкил и предпочтительно метильную группу. Далее соединение формулы (III) можно очистить, предпочтительно кристаллизацией в подходящем растворителе, предпочтительно в изопропаноле. Полученное в результате соединение формулы (III) предпочтительно имеет чистоту не менее примерно 93%. Например, если в качестве инициатора Гриньяра используется изопропилмагнийбромид,обычная чистота соединения формулы (III) после кристаллизации составляет примерно 93-96%. Еще предпочтительнее, если после кристаллизации соединение формулы (III) имеет чистоту 9699,5%, например 96,1-97,4%. Особо предпочтительным инициатором Гриньяра для реакции Гриньяра,обеспечивающим предпочтительную чистоту, является метилмагнийхлорид. После кристаллизации соединение формулы (III) может далее вступать в реакцию известным способом для получения соединения формулы (I) или его соли. Большинство примесей, полученных в результате описываемой здесь реакции Гриньяра, если таковые имеются, могут далее удаляться известным способом (например, как описано в US 6858650) с получением активного метаболита с чистотой более 99%. Кроме того, описываются соединения формулы (I) или формулы (III), полученные посредством любого описанного здесь способа. Далее также описываются фармацевтические композиции, содержащие соединения формулы (I) или формулы (III), полученные посредством любого описанного здесь способа.-4 016399 Описывается также способ получения соединений формулы (III), обладающих чистотой не менее 93%, предпочтительнее чистотой не менее 96-99,5%, в частности не менее 96,1-96,4%, посредством реакции соединения формулы (II) с Mg и инициатором Гриньяра, предпочтительно смесью Mg и MeMgCl в растворителе, а затем реакцией полученного соединения с вышеописанным карбонатом. Далее, со ссылкой на предпочтительные исполнения приводится более подробное описание укороченного синтеза посредством реакции Гриньяра с инициатором Гриньяра (предпочтительно MeMgCl),Mg и карбонатом, предпочтительно диметилкарбонатом, который может применяться для получения активного метаболита и его сложных фенольных моноэфиров, описанных формулой (I), таких как фезотеродин, в частности кислая фумаровая соль фезотеродина. На стадии а) описываемого способа соединение формулы (II) вступает в реакцию со смесью Mg и инициатором Гриньяра в растворителе с образованием реагента Гриньяра. Мольное отношение инициатора Гриньяра (например, MeMgCl) к Mg составляет предпочтительно 1:2-2:1, наиболее предпочтительно 1:1, а мольное отношение инициатора Гриньяра и Mg к соединению формулы (II) предпочтительно составляет 1:1 и 2:1, предпочтительнее 1:1-1,5:1. В одном из исполнений весь или часть Mg может быть свежеприготовленным, например, посредством реакции хлорида магния с нафталидом щелочного металла, предпочтительно с нафталидом лития(так называемый магний Райке (Rieke-Mg. Стадия а) может быть предпочтительно выполнена посредством:a1) растворения соединения формулы (II) в подходящем растворителе с образованием раствора и а 2) добавления указанного раствора к смеси MeMgCl и Mg в подходящем растворителе с образованием реагента Гриньяра. Предпочтительным растворителем для растворения соединения (II) на стадии реакции a1) является толуол, хотя возможно использование и других подходящих растворителей. Желательное содержание воды в растворе, содержащем соединение (II), не боле 0,05%. Предпочтительным растворителем для растворения инициатора Гриньяра, предпочтительноMeMgCl, на стадии реакции а 2) является ТГФ, однако возможно использование других подходящих простых эфиров, известных специалистам в данной области, включая диэтиловый эфир и третбутилметиловый эфир. Образование реагента Гриньяра, описанное на стадии а), выполняется в температурном диапазоне 40-55 С и наиболее предпочтительно - в температурном диапазоне 40-50 С. Реакцию можно проводить при перемешивании вплоть до завершения. В предпочтительном исполнении реагент Гриньяра можно затем охладить до температуры окружающей среды, например, до 20-25 С и сохранять, предпочтительно при помешивании, до использования на следующих стадиях способа. На стадии с) полученный реагент Гриньяра вступает в реакцию с подходящим карбонатом, таким как ди(C1-С 6-алкил)карбонат, предпочтительно с диметилкарбонатом для получения описанного ниже соединения формулы (III), где А представляет собой C1-С 6-алкил, предпочтительно метильную группу. В сравнении с соединением формулы (II) желателен избыток карбоната, предпочтительно диметилкарбоната, причем более предпочтителен избыток от 1,1- до 50-кратного, а наиболее предпочтителен избыток от 5- до 50-кратного. Наиболее предпочтительным карбонатом является диметилкарбонат. Другие подходящие карбонаты включают ди(C1-С 6-алкил)карбонаты, например, такие как диэтилкарбонат, и циклические C1-С 6-алкиленкарбонаты, такие как этиленкарбонат или пропиленкарбонат. Карбонат можно растворить в растворителе на стадии с). Предпочтительным растворителем для растворения карбоната является гексан, но можно использовать любой инертный растворитель с температурой кипения ниже температуры кипения используемого карбоната, например предпочтительного диметилкарбоната, который способен образовывать постоянно азеотропную смесь с водой, включая гептан, изомеры гексана и их подходящие смеси. Часть гексана, использованного для растворения карбоната, предпочтительно диметилкарбоната,может быть удалена дистилляцией, такой как азеотропная дистилляция, перед добавлением реагента Гриньяра. Такой дистилляцией можно удалить до 90-95% гексана. Дистилляция растворителя также удаляет воду из смеси карбоната с растворителем, что может минимизировать образование дезбромаминовой примеси при соединении с реагентом Гриньяра. Желательно, чтобы содержание воды в дистиллированной смеси карбоната с растворителем было не более 0,1 мас.%, предпочтительнее не более 0,05 мас.% и еще предпочтительнее не более 0,01 мас.%. В наиболее предпочтительном исполнении настоящего изобретения реакция реагента Гриньяра с карбонатом, предпочтительно с диметилкарбонатом, протекает при температуре ниже 10 С при перемешивании. Одним из предпочтительных вариантов является медленное добавление реагента Гриньяра (например, MeMgCl) в перемешиваемую смесь карбоната с растворителем для обеспечения быстрого и равномерного разбавления полученного простого эфира формулы (III) в реакционном растворе. Желательно,чтобы скорость перемешивания во время добавления и последующей реакции реагента Гриньяра с карбонатом была как можно более высокой, например не менее 75 об/мин, предпочтительно около 90 об/мин. Можно также добавить смесь карбоната с раствором к реагенту Гриньяра, желательно при перемешивании. Предпочтительное время перемешивания около 2-3 ч. Стадия с) завершается путем остановки реакции резким добавлением к реакционной смеси подходящего реагента. Предпочтительным реагентом для остановки реакции является водный хлорид аммония, хотя можно использовать другие останавливающие реакцию реагенты, известные специалистам в данной области, включая водный этилацетат, водный хлорид натрия или водный раствор соляной кислоты. Затем осуществляется замена растворителя Гриньяра (например, толуола и/или ТГФ) на растворитель, подходящий для кристаллизации (например, изопропанол). Изопропанол оказался очень эффективным растворителем для очистки сложного метилового эфираR-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты. Поэтому одним из предпочтительных исполнений настоящего изобретения является кристаллизация соединения формулы (III), предпочтительно сложного метилового эфира R-(-)-4-бензилокси-3-(3 диизопропиламино-1-фенилпропил)бензойной кислоты, в изопропаноле. Еще одним предпочтительным исполнением является способ получения описанного выше соединения формулы (I) или его соли, характеризующийся тем, что данный способ включает стадию кристаллизации соединения формулы (III), предпочтительно сложного метилового эфира R-(-)-4-бензилокси-3-(3 диизопропиламино-1-фенилпропил)бензойной кислоты, в изопропаноле. После добавления охлаждающего реагента, могут выполняться следующие стадии: промывание водой; удаление воды из органической фазы, например обезвоживанием посредством азеотропной перегонки; удаление органической фазы дистилляцией; кристаллизация в изопропаноле и при необходимости, промывание в подходящем растворителе, таком как изопропиловый спирт, и сушка. После этого соединение формулы (III) может быть получено с хорошей чистотой (обычно около 96 и около 99,5%) и с хорошим выходом. Вышеприведенный способ более детально описывается в примере 1 экспериментальной части изобретения.-6 016399 Еще одним предпочтительным исполнением настоящего изобретения является способ получения соединения формулы (I) где R представляет собой водород, прямую или разветвленную C1-С 6-алкилкарбонильную группу или фенилкарбонильную группу,или его солей, или предшественника соединения формулы (I), включающий стадию кристаллизации вышеописанного соединения формулы (III), предпочтительно сложного метилового эфираR-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты, в изопропаноле. Затем соединение формулы (III) может далее вступать в реакцию для получения соединения формулы (I). Особо предпочтительным исполнением настоящего изобретения является способ получения активного метаболита и, при желании, его сложных фенольных моноэфиров, особенно фезотеродина или его соли, предпочтительно фармацевтически приемлемой соли фезотеродина и наиболее предпочтительно кислой фумаровой соли фезотеродина, включающий следующие стадии:a1) растворение соединения формулы (II) в растворителе, таком как толуол, с образованием реакционной смеси; а 2) добавление полученной реакционной смеси к смеси инициатора Гриньяра, предпочтительноMeMgCl, Mg и ТГФ для получения реагента Гриньяра, где реакция может выполняться при температуре 40-50 С;b) при необходимости, снижение температуры реагента Гриньяра ниже температуры на стадии а 2),предпочтительно до температуры в диапазоне 20-25 С, и поддержание более низкой температуры реагента Гриньяра, при необходимости, при перемешивании;c) проведение реакции полученного реагента Гриньяра с избытком карбоната, предпочтительно диметилкарбоната, в гексане при температуре реакции ниже 10 С и при скорости перемешивания не менее 90 об/мин, а затем остановка реакции в полученной таким образом смеси водным раствором хлорида аммония с получением соединения формулы (III). Это соединение затем выделяют и очищают, как описано выше. После образования соединения формулы (III) возможна дальнейшая реакция соединения формулы(III) с получением соединения формулы (I). Это можно осуществить, выполнив:d) восстановление сложного метилового эфира до соответствующего метилового спирта е) дебензилирование защищенного спирта с образованием указанного выше активного метаболита. Другая возможность состоит в преобразовании активного метаболита в его сложный эфир, такой как фезотеродин или соль фезотеродина, предпочтительно кислая фумаровая соль фезотеродина, выполняя Примеры стадий d)-g) описываются, например, в US 6858650, который включен в данное описание на правах ссылки. Образование других сложных фенольных моноэфиров активного метаболита возможно посредством использования других органических галогенидов на стадии f) вышеприведенной схемы. Конечное соединение (I) или (Ia) (сложные фенольные моноэфиры активного метаболита, включая фезотеродин или его фармацевтически приемлемые соли) может быть переведено обычным способом в фармацевтическую композицию с получением перорального, парентерального или трансдермального лекарственного средства. Другим аспектом настоящего изобретения является способ получения предшественника соединений формулы (I), в том числе активного метаболита или фезотеродина, включающий стадию реакции карбонатов, таких как диметилкарбонат, с реагентом Гриньяра для получения соединения формулы (III) в которой А представляет собой C1-С 6-алкильную группу,где реагент Гриньяра образован реакцией соединения формулы (II) со смесью инициатора Гриньяра, предпочтительно MeMgCl, и Mg в растворителе. В данном способе соединение формулы (III) может быть получено кристаллизацией в изопропаноле, как описано выше. Настоящее описание изобретения также иллюстрируется следующими неисчерпывающими примерами. Примеры не имеют целью ограничивать объем притязаний данного описания, как указано ниже в формуле изобретения. Начальное соединение формулы (II) можно получить известным способом, например, таким как способ, описанный в экспериментальной части US 6713464. Предпочтительными исполнениями настоящего изобретения являются также: А) Способ получения соединения формулы (I) где R представляет собой водород, прямую или разветвленную C1-С 6-алкилкарбонильную или фенилкарбонильную группу,или его соли, включающий следующие стадии:-8 016399 а) реакция соединения формулы (II) со смесью MeMgCl и Mg в растворителе с образованием реагента Гриньяра,b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а), иc) реакция реагента Гриньяра с избытком диметилкарбоната с получением соединения формулы где А представляет собой метильную группу,а затем реакция соединения формулы (III) в соответствии с известным способом с получением соединения формулы (I) и, при необходимости, образованием соли.B) Способ в соответствии с исполнением А), где соединение формулы (III) кристаллизуют перед реакцией для получения формулы (I).C) Способ в соответствии с исполнением В), где кристаллизацию соединения формулы (III) осуществляют в изопропаноле.D) Способ в соответствии с любым исполнением А)-С), где соединением формулы (I) является фезотеродин, имеющий формулу (Ia)E) Способ в соответствии с исполнением D), где солью фезотеродина является кислая фумаровая соль.F) Способ в соответствии с любым исполнением А)-Е). характеризующийся тем, что на стадии с) диметилкарбонат используют в 5-50-кратном избытке.G) Способ в соответствии с любым исполнением A)-F), характеризующийся тем, что на стадии с) используют растворитель, предпочтительно гексан. Н) Способ в соответствии с исполнением G), характеризующийся тем, что на стадии с) диметилкарбонат растворяют в гексане и затем дистиллируют до снижения содержания воды до 0,01% или ниже, а затем добавляют реагент Гриньяра.I) Способ в соответствии с любым исполнением А)-Н), где после стадии с) реакции для остановки реакции следует резкое добавление к реакционной смеси подходящего реагента.J) Способ в соответствии с исполнением I), где реагентом является водный раствор NH4Cl.K) Способ в соответствии с любым исполнением А)-J), где мольное отношение MeMgCl к Mg составляет 1:2-2:1, а мольное отношение MeMgCl к соединению формулы (II) составляет 1:1-2:1.a1) растворения соединения формулы (II) в подходящем растворителе с образованием раствора и а 2) добавления указанного раствора к смеси MeMgCl и Mg в подходящем растворителе. М) Способ в соответствии с исполнением L), где растворителем на стадии a1), используемым для растворения соединения формулы (II), является толуол.N) Способ в соответствии с исполнением L) или М), характеризующийся тем, что растворителем на стадии а 2) является ТГФ.-9 016399 О) Способ в соответствии с любым исполнением L)-N), где на стадии a1) соединение формулы (II) растворяют в толуоле,на стадии а 2) указанный раствор добавляют к смеси MeMgCl и Mg в ТГФ и перемешивают до завершения реакции,на стадии b) смесь, полученную на стадии а 2), продолжают перемешивать,на стадии с) смесь добавляют к избытку диметилкарбоната в гексане. после чего следует остановка реакции водным раствором NH4Cl. Р) Способ в соответствии с любым исполнением А)-О), характеризующийся тем, что температура реакции на стадии а) составляет 40-50 С.Q) Способ в соответствии с любым исполнением А)-Р), характеризующийся тем, что температура реакции на стадии b) составляет 20-25 С.R) Способ в соответствии с любым исполнением A)-Q), характеризующийся тем, что температура реакции на стадии с) ниже 10 С.S) Способ в соответствии с любым исполнением A)-R), характеризующийся тем, что на стадии с) реакционную смесь перемешивают со скоростью 90 об/мин. Т) Способ получения фармацевтической композиции, содержащей кислую фумаровую соль фезотеродина, включающий следующие стадии:(i) получение кислой фумаровой соли фезотеродина способом в соответствии с любым из предшествующих исполнений и(ii) составление обычным способом композиции с полученной кислой фумаровой солью фезотеродина с получением фармацевтической композиции.U) Способ получения предшественника или промежуточного соединения для получения активного метаболита или фезотеродина, включающий стадию реакции диметилкарбоната с реагентом Гриньяра с получением соединения формулы (III) в которой А представляет собой метильную группу,где реагент Гриньяра образуется реакцией соединения формулы (II)V) Способ в соответствии с исполнением U), включающий кристаллизацию соединения формулы(III) в изопропаноле. Примеры Пример 1. Получение сложного метилового эфира R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты формулы (III).(а) Стехиометрия MeMgCl:Mg:R-(-)-[3-(2-бензилокси-5-бромфенил)-3-фенилпропил]диизопропиламин = 1,5:1,5:1,0. Смесь магния (18 кг, 741 моль) и ТГФ (1066 кг) загрузили в подходящую емкость, после чего добавили метилмагнийхлорид (3 М в ТГФ, 246 кг, 743 моль). Затем добавили растворR-(-)-[3-(2-бензилокси-5-бромфенил)-3-фенилпропил]диизопропиламина (формула (II, приготовленный из 486 моль R-(-)-3-(2-бензилокси-5-бромфенил)-3-фенилпропионовой кислоты с применением процедуры, описанной в US-B-6713464, поддерживая температуру реакции на уровне 40-50 С. После завершения реакции реагент Гриньяра R-(-)-[3-(2-бензилокси-5-бромфенил)-3-фенилпропил]диизопропиламина(формула (II выдерживали при температуре около 20-25 С. В футерованной стеклом емкости излишек диметилкарбоната (1312 кг, 14 кмоль) в гексане (1846 кг) дистиллировали при атмосферном давлении до достижения объема в диапазоне 1200-1260 л и анализировали на предмет содержания воды до тех пор,пока содержание воды не стало равным или меньшим чем 0,01 мас.%. Затем реагент Гриньяра загрузили- 10016399 в раствор диметилкарбоната, используя фильтр для удаления остатков магния и поддерживая температуру ниже 10 С. Скорость перемешивания во время добавления и последующей реакции составляла 90 об/мин. Реакция смеси реагента Гриньяра и карбоната-растворителя была остановлена путем резкого добавления водного раствора хлорида аммония (660 кг) в емкости из нержавеющей стали. После перемешивания двухфазной смеси дали отстояться и отделили слои. Перед разделением фаз для растворения солейMg, которые могут осаждаться во время остановки реакции хлоридом аммония, необязательно может быть добавлен избыток воды. После добавления воды слои можно разделить, извлечь водный слой толуолом и объединить органические фазы. Органический слой дважды промыли водой (2600 кг). Органическую фазу дистиллировали до объема 1400-1750 л в емкости из нержавеющей стали, а затем перенесли в емкость, футерованную стеклом, перед заменой растворителя изопропанолом и повторением дистилляции. При необходимости, можно произвести дополнительную замену растворителя изопропанолом. После удаления избытка диметилкарбоната и толуола органический раствор восстановили до объема 400-800 л. После этого смесь выдерживали при температуре примерно 20-25 С в течение не менее 2 ч. Затем смесь центрифугировали для отделения выпавшей фазы, которую промыли охлажденным изопропанолом (63 кг). Полученный в результате сложный метиловый эфир (R-(-)-4-бензилокси-3-(3 диизопропиламино-1-фенилпропил)бензойной кислоты (формула (III высушили при температуре примерно 40-50 С и выделили его в кристаллической форме. Было получено шесть порций сложного метилового эфира R-(-)-4-бензилокси-3-(3 диизопропиламино-1-фенилпропил)бензойной кислоты, имеющих следующую типичную чистоту: порция 1: 96,5%; порция 2: 97,4%; порция 3: 96,9%; порция 4: 96,4%; порция 5: 96,4%; порция 5: 96,9%; порция 6: 96,1%.(b) Стехиометрия MeMgCl:Mg:R-(-)-[3-(2-бензилокси-5-бромфенил)-3-фенилпропил]диизопропиламин = 1:1:1 Реакция Гриньяра был выполнена, как описано в (а), с той лишь разницей, что изменилась стехиометрия. В результате был получен сложный метиловый эфир R-(-)-4-бензилокси-3-(3-диизопропиламино-1 фенилпропил)бензойной кислоты с чистотой 99,4%. Пример 2. Получение R-(+)-[4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)фенил]метанола (восстановление). Раствор сложного метилового эфира R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты (28 г) растворили в сухом диэтиловом эфире (230 мл). Этот раствор медленно (около 2 ч) по каплям добавляли в атмосфере азота к суспензии лития алюминия гидрида (1,8 г) в простом эфире(140 мл) при температуре ниже 20 С. После перемешивания в течение 18 ч реакцию остановили резким добавлением воды (4,7 мл). Органическую фазу высушили над безводным сульфатом натрия, отфильтровали и выпарили до сухого состояния, получив R-(+)-[4-бензилокси-3-(3-диизопропиламино-1 фенилпропил)фенил]метанол (26 г, с выходом 98,9%) в виде постепенно кристаллизующегося масла. Пример 3. Получение R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола (дебензилирование). Раствор R-(+)-[4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)фенил]метанола (9,1 г) в метаноле (100 мл) гидрировали над никелем Ренея (4,5 г) в условиях окружающей среды. После полного гидрогенолиза, как было установлено посредством тонкослойной хроматографии, проводимой в течение 4-5 ч, катализатор отфильтровали, а раствор выпарили до сухого состояния, получив масло (6,95 г, с выходом 96,5%), которое затем растворили в этилацетате. Этот раствор промыли водным раствором гидрокарбоната натрия (5 мас.%). Органическую фазу отделили и высушили азеотропной перегонкой в этилацетате. Раствор этилацетата снова дистиллировали до объема, в котором 1 часть (по массе) R-(+)-2-(3 диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола растворили в 1,5 части (по объему) этилацетата. Затем этот раствор остудили до -10 С и перемешивали в течение 30-60 мин. После этого можно выделить R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол в виде осадка и далее промыть его небольшим количеством холодного этилацетата. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) где R означает водород, прямую или разветвленную C1-С 6-алкилкарбонильную или фенилкарбонильную группу,или его соли, включающий следующие стадии: а) реакцию соединения формулы (II) со смесью Mg и инициатора Гриньяра формулы R1MgX, где R1 представляет собой C1-С 12-алкил,C2-С 6-алкенил, С 2-С 6-алкинил, фенил, замещенный C1-С 6-алкилом, C1-С 6-алкокси или CF3, незамещенный фенил или фенил(C1-С 6)алкил и X выбирают из бромида, хлорида и йодида, с образованием реагента Гриньяра;b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а) и с) реакцию реагента Гриньяра с избытком карбоната, выбранного из группы ди(C1-С 6-алкил)карбонатов и циклических C1-С 6-алкиленкарбонатов с получением соединения формулы (III)d) последующее восстановление соединения формулы (III) до соответствующего производного метилового спирта и дебензилирование защищенного фенола и, при необходимости, фенольное моноацилирование с получением соединения формулы (I), а также, при необходимости, образование фармацевтически приемлемой соли. 2. Способ по п.1, в котором инициатором Гриньяра является метилмагнийхлорид (MeMgCl). 3. Способ по любому из пп.1 и 2, в котором карбонатом является диметилкарбонат. 4. Способ по любому из предшествующих пунктов, в котором соединение формулы (III) кристаллизуют перед реакцией получения соединения формулы (I). 5. Способ по п.4, в котором кристаллизацию соединения формулы (III) осуществляют в изопропаноле. 6. Способ по любому из предшествующих пунктов, в котором соединением формулы (I) является фезотеродин формулы (Ia) или его соль. 7. Способ по п.6, в котором солью фезотеродина является кислая фумаровая соль. 8. Способ по любому из предшествующих пунктов, в котором на стадии с) карбонат используют в 5-50-кратном избытке.- 12016399 9. Способ по любому из предшествующих пунктов, в котором на стадии с) используют растворитель, предпочтительно гексан. 10. Способ по п.9, в котором на стадии с) карбонат растворяют в гексане, а затем дистиллируют до снижения содержания воды до 0,01% или ниже, после чего добавляют реагент Гриньяра. 11. Способ по любому из предшествующих пунктов, в котором после стадии с) производят остановку реакции путем резкого добавления к смеси подходящего реагента. 12. Способ по п.11, в котором реагентом является водный раствор хлорида аммония. 13. Способ по любому из предшествующих пунктов, где молярное отношение инициатора Гриньяра к Mg составляет 1:2-2:1, а молярное отношение инициатора Гриньяра к соединению формулы (II) составляет около 1:1-2:1. 14. Способ по любому из предшествующих пунктов, в котором стадия а) включает:a1) растворение соединения формулы (II) в подходящем растворителе с образованием раствора; а 2) добавление полученного раствора к смеси инициатора Гриньяра и Mg в подходящем растворителе. 15. Способ по п.14, в котором растворитель, используемый на стадии a1) для растворения соединения формулы (II), является толуолом. 16. Способ по любому из пп.14 или 15, в котором растворителем на стадии а 2) является ТГФ. 17. Способ по любому из пп.14-16, в котором на стадии a1) соединение формулы (II) растворяют в толуоле,на стадии а 2) указанный раствор добавляют к смеси инициатора Гриньяра и Mg в ТГФ и перемешивают до завершения реакции,на стадии b) смесь, полученную на стадии а 2), продолжают перемешивать,на стадии с) смесь добавляют к избытку карбоната в гексане, после чего следует остановка реакции резким добавлением водного раствора NH4Cl. 18. Способ по любому из предшествующих пунктов, в котором температура реакции на стадии а) составляет 40-50 С. 19. Способ по любому из предшествующих пунктов, в котором температура реакции на стадии b) составляет 20-25 С. 20. Способ по любому из предшествующих пунктов, в котором температура реакции на стадии с) ниже 10 С. 21. Способ по любому из предшествующих пунктов, в котором на стадии с) реакционную смесь перемешивают со скоростью 90 об/мин. 22. Способ получения фармацевтической композиции, содержащей кислую фумаровую соль фезотеродина, включающий следующие стадии:(a) получение кислой фумаровой соли фезотеродина способом согласно любому из предшествующих пунктов и(b) составление обычным способом фармацевтической композиции с полученной кислой фумаровой солью фезотеродина. 23. Способ получения промежуточного соединения формулы (III) при получении соединения формулы (I), включающий реакцию карбоната, выбранного из группы ди(C1-С 6-алкил)карбонатов и циклических C1-С 6-алкиленкарбонатов, с реагентом Гриньяра с получением соединения формулы (III) в которой А представляет собой C1-С 6-алкильную группу,где реагент Гриньяра получают реакцией соединения формулы (II) со смесью Mg и инициатора Гриньяра формулы R1MgX, где R1 представляет собой C1-С 12-алкил,С 2-С 6-алкенил, С 2-С 6-алкинил, фенил, замещенный C1-С 6-алкилом, C1-С 6-алкокси или CF3, незамещенный фенил или фенил(C1-С 6)алкил и X выбирают из бромида, хлорида и йодида, в растворе. 24. Способ по п.23, в котором инициатором Гриньяра является MeMgCl, a карбонатом - диметилкарбонат. 25. Способ по любому из пп.23 и 24, включающий кристаллизацию соединения формулы (III) в изопропаноле.- 13016399 26. Способ получения соединения формулы (I) или его соли где R представляет собой водород, прямую или разветвленную C1-С 6-алкилкарбонильную или фенилкарбонильную группу,включающий следующие стадии: а) реакцию соединения формулы (II) со смесью Mg и инициатора Гриньяра формулы R1MgX, где R1 представляет собой C1-С 12-алкил,C2-С 6-алкенил, C2-С 6-алкинил, фенил, замещенный C1-С 6-алкилом, C1-С 6-алкокси или CF3, незамещенный фенил или фенил(С 1-С 6)алкил и X выбирают из бромида, хлорида и йодида, с образованием реагента Гриньяра;b) при необходимости, снижение температуры реагента Гриньяра до уровня ниже температуры на стадии а);c) реакцию реагента Гриньяра с избытком карбоната, выбранного из группы ди(C1-С 6-алкил)карбонатов и циклических C1-С 6-алкиленкарбонатов, с получением соединения формулы (III)d) кристаллизацию соединения формулы (III) в изопропаноле;e) последующее восстановление соединения формулы (III) до соответствующего производного метилового спирта и дебензилирование защищенного фенола и, при необходимости, фенольное моноацилирование с получением соединения формулы (I) и, при необходимости, образование фармацевтически приемлемой соли. 27. Способ по п.26, в котором соединение формулы (III) является сложным метиловым эфиромR-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты. 28. Способ по любому из пп.26 и 27, где соединением формулы (I) является фезотеродин или его соль. 29. Способ по любому из пп.26-28, где соединением формулы (I) является кислая фумаровая соль фезотеродина.
МПК / Метки
МПК: C07C 219/28, C07C 213/06, C07C 215/54, C07C 227/42, C07C 229/38, C07C 213/00, C07C 213/10
Метки: замещенных, гидроксиметилфенолов, способ, синтеза
Код ссылки
<a href="https://eas.patents.su/15-16399-sposob-sinteza-zameshhennyh-gidroksimetilfenolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза замещенных гидроксиметилфенолов</a>
Предыдущий патент: Комплексы переходных металлов, нанесенные на активирующий фторированный носитель
Следующий патент: Болеутоляющее средство для наружного применения
Случайный патент: Способ выделения конденсируемых веществ из газов или газовых смесей












