Производные пиримидин-4-она
Формула / Реферат
1. Соединение формулы
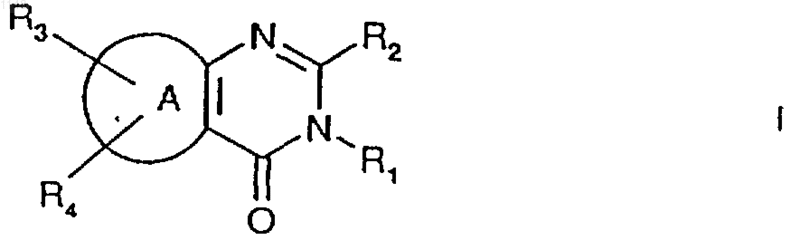
где R1 обозначает С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, каждый из которых может быть незамещенным или может быть замещен галогеном;
R2 обозначает OR5;
R3 и R4 каждый независимо друг от друга обозначает водород, галоген;
R5 обозначает С1-С6алкил или С3-С6циклоалкил, каждый из которых может быть незамещенным или может быть замещен галогеном; и
A обозначает тиенил.
2. Соединение формулы I по п.1,
где R1 обозначает С1-С6алкил, циклопропил, циклобутил;
R2 обозначает OR5;
R3 и R4 каждый независимо друг от друга обозначает водород, хлор, бром, йод;
R5 обозначает С2-С6алкил.
3. Соединение формулы I по п.2,
где A обозначает тиенил[2.3-d],
R1 обозначает С3-С6алкил,
R2 обозначает OR5,
R3 и R4 каждый независимо друг от друга обозначает водород, хлор, бром, йод и
R5 обозначает С2-С6алкил.
4. Соединение по п.3, выбранное из группы, включающей:
6-хлор-2-пропокси-3-пропил-3Н-тиено [2.3-d]пиримидин-4-он,
6-хлор-2-пропокси-3-изобутил-3Н-тиено [2.3-d]пиримидин-4-он,
6-хлор-2-изобутокси-3-пропил-3Н-тиено [2.3-d]пиримидин-4-он,
6-хлор-2-пропокси-3-бутил-3Н-тиено[2.3-d]пиримидин-4-он,
6-бром-2-пропокси-3-бутил-3Н-тиено[2.3-d]пиримидин-4-он,
6-хлор-2-бутокси-3-пропил-3Н-тиено[2.3-d]пиримидин-4-он,
6-бром-2-бутокси-3-пропил-3Н-тиено[2.3-d]пиримидин-4-он,
6-хлор-2-бутокси-3-бутил-3Н-тиено[2.3-d] пиримидин-4-он,
6-бром-2-бутокси-3-бутил-3Н-тиено[2.3-d] пиримидин-4-он,
6-хлор-2-бутокси-3-изобутил-3Н-тиено [2.3-d]пиримидин-4-он,
6-бром-2-бутокси-3-изобутил-3Н-тиено [2.3-d]пиримидин-4-он,
6-бром-2-пропокси-3-изобутил-3Н-тиено [2.3-d]пиримидин-4-он,
6-хлор-2-этокси-3-изобутил-3Н-тиено[2.3-d]пиримидин-4-он,
6-бром-2-этокси-3-изобутил-3Н-тиено[2.3-d]пиримидин-4-он,
6-бром-2-изобутокси-3-пропил-3Н-тиено [2.3-d]пиримидин-4-он.
Текст
1 Настоящее изобретение относится к новым производным пиримидин-4-она формулы I, которые обладают пестицидной, в частности, фунгицидной активностью, где R1 обозначает С 1-С 6 алкил, С 2-С 6 алкенил, С 2 С 6 алкинил, С 3-С 6 циклоалкил, каждый из которых может быть незамещенным или может быть замещен галогеном;R3 и R4 каждый независимо друг от друга обозначают водород, галоген;R5 обозначает С 1-С 6 алкил или С 3-С 6 циклоалкил, каждый из которых может быть незамещенным или может быть замещен галогеном; и А обозначает тиенил. Соединения формулы I и необязательно их таутомеры могут быть получены в форме их солей. Поскольку соединения формулы I имеют,по крайней мере, один основный центр, они могут,например,образовывать кислотноаддитивные соли. Кислотно-аддитивные соли,например, образуются с минеральными кислотами, обычно с серной кислотой, фосфорной кислотой или галоидводородом, с органическими карбоновыми кислотами, обычно с уксусной кислотой, щавелевой кислотой, малоновой кислотой, малеиновой кислотой, фумаровой кислотой или фталевой кислотой, с гидроксикарбоновыми кислотами, обычно с аскорбиновой кислотой, молочной кислотой, яблочной кислотой, винной кислотой или лимонной кислотой,или с бензойной кислотой, или с органическими сульфоновыми кислотами, обычно с метансульфоновой кислотой или паратолуолсульфоновой кислотой. Вместе, по крайней мере, с одной кислотной группой соединения формулы I могут также образовывать соли с основаниями. Приемлемыми солями с основаниями являются, например,соли металлов, обычно соли щелочных металлов или соли щелочно-земельных металлов, например соли натрия, соли калия или соли магния, или соли аммиака или органического амина, например морфолина, пиперидина, пирролидина, моно-, ди- или триалкиламина, обычно этиламина, диэтиламина, триэтиламина или диметилпропиламина, или моно-, ди- или тригидроксиалкиламина, обычно моно-, ди- или триэтаноламина. При необходимости также могут быть образованы соответствующие внутренние соли. Агрохимически приемлемые соли являются предпочтительными в объеме настоящего изобретения. Когда в соединениях формулы I присутствуют асимметричные атомы углерода, эти соединения могут находиться в оптически актив 001148 2 ной форме. В результате присутствия двойных связей соединения могут быть получены в [Е]и/или [Z]-форме. Кроме того, может встречаться атропоизомерия соединений. Изобретение относится к чистым изомерам, таким как энантиомеры и диастереомеры, а также ко всем возможным смесям изомеров, например к смесям диастереомеров, рацематам или смесям рацематов. Если не указано иное, общие понятия, использованные выше и ниже, имеют следующие значения. Алкильные группы в соответствии с количеством атомов углерода имеют прямую или разветвленную цепь и обычно могут обозначать метил, этил, н-пропил, изопропил, н-бутил,втор-бутил, изобутил, трет-бутил, н-амил, третамил, 1-гексил или 3-гексил. Под алкенилом следует понимать алкенил с прямой или разветвленной цепью, такой как аллил, металлил, 1-метилвинил или бут-2-ен-1 ил. Предпочтительные алкильные радикалы содержат 3-4 атома углерода в цепи. Алкинил также в соответствии с количеством атомов углерода может иметь прямую цепь или разветвленную цепь и обычно обозначает пропаргил, бут-1-ин-1-ил или бут-1-ин-3-ил. Предпочтительно алкинил обозначает пропаргил. Под галогеном и галоидными заместителями обычно понимают фтор, хлор, бром или йод. Предпочтительными являются фтор, хлор или бром. Галоидалкил может содержать одинаковые или различные атомы галогена и обычно обозначает фторметил, дифторметил, дифторхлорметил, трифторметил, хлорметил, дихлорметил,трихлорметил, 2,2,2-трифторэтил, 2-фторэтил,2-хлорэтил,2,2,2-трихлорэтил,3,3,3 трифторпропил. Циклоалкил в зависимости от размера кольца обозначает циклопропил, циклобутил,циклопентил, пиклогексил или циклогептил. А обозначает тиенил, включая все 3 изомера. Специальной группой, которую следует отметить в контексте изобретения, являются соединения формулы I, в которых R1 обозначает С 3-С 6 алкил, циклопропил, циклобутил;R3 и R4 каждый независимо друг от друга обозначают водород, хлор, бром, йод;R5 обозначает С 2-С 6 алкил, циклопропил или циклобутил (подгруппа Г). Предпочтительной группой подгруппы Г являются соединения формулы I, в которых А обозначает тиенил[2.3-d],R1 обозначает С 3-С 6 алкил,R2 обозначает OR5,R3 и R4 каждый независимо друг от друга обозначают водород, хлор, бром, йод и 3 Наиболее предпочтительными соединениями по изобретению, представленными в настоящем описании, являются следующие соединения: 6-хлор-2-пропокси-3-пропил-3 Н-тиено[2.3d]пиримидин-4-он ( 2.41),6-хлор-2-пропокси-3-изобутил-3 Н-тиено[2.3-d]пиримидин-4-он ( 2.136). Соединения формулы I могут быть получены следующим образом: Схема 1 4 563, S. Gronowitz и др. Другие гетероциклы могут быть получены по описанным в литературе методам. Синтез, например, этил-5-аминотиазол-4-карбоксилата и этил-5-амино-2-метилтиазол-4-карбоксилата описан у Golankiewicz и др. в Tetrahedron 1985, 41, 5989. ВзаимодействиеNaOH, КОН, СаСО 3, Nа 2 СО 3, К 2 СО 3, NаНСО 3,N(Et)3, пиридина и другие, в растворителях, таких, как CH2Cl2, СНСl3, простой эфир, тетрагидрофуран и другие, возможно в двухфазной смеси, состоящей из СНСl3/воды или СН 2 Сl2/воды или толуола/воды, в диапазоне температур от 0 С до температуры дефлегмации. Образовавшиеся изотиоцианаты затем превращают с помощью первичных аминов, таких как нбутиламин, н-пропиламин, изопропиламин, аллиламин, пропаргиламин, циклопропиламин и другие, в растворителе (простом эфире, тетрагидрофуране, CH2Cl2, СНСl3, бензоле, толуоле,диметилформамиде, диметилсульфоксиде) в диапазоне температур от 0 С до температуры дефлегмации в тиокарбамилгетероциклы IV(стадия 2 на схеме 1), которые также могут быть получены взаимодействием гетероциклических аминов II с изотиоцианаталканами, такими как 1-изотиоцианатпропан, 1-изотиоцианатбутан и др., в этаноле, н-пропаноле, н-бутаноле, диметилформамиде или диметилсульфоксиде в качестве растворителей при температуре от 50 С до температуры дефлегмации (стадия 1 б на схеме 1). Тиокарбамилгетероциклы IV в большинстве случае немедленно циклизуются (стадия 3 на схеме 1). В некоторых случаях циклизацию проводят в присутствии сильных оснований, таких как трет-бутилат калия, гидрид натрия или гидрид калия в растворителях, таких как терагидрофуран, диметилформамид или диметилсульфоксид, в диапазоне температур 20-140 С. Производные 2-тиоксопиримидин-4-она после этого депротонируют (используя основания, такие как(галоген обозначает Вr, I) (стадия 4 на схеме 1). Реакция с метилйодидом приводит к получению производного 2-метилсульфанилпиримидин-4 она, которое является важным промежуточным продуктом для синтеза алкоксизамещенных и аминоалкилзамещенных пиримидин-4-онов. Замещение тиометильной группы (стадия 5 на схеме 1) алкоксигруппой наиболее предпочтительно проводят путем взаимодействия с алкоксидами металлов, такими как NaOMe, NaOEt,NaO-пропил, в соответствующем спирте, тетрагидрофуране или диметилсульфоксиде в качестве растворителя в диапазоне температур 20150 С. 5 Вышеуказанный путь синтеза представляет собой первый описанный путь получения характерных производных 3 Н-тиено[2.3-d] пиримидин-4-она, имеющих представленное в данном описании формулой I строение. Изобретение также относится к промежуточным продуктам формул IV и V и прежде всего к таковым, в которых А обозначает тиенил[2.3-d]. Введение дополнительных заместителей в 5-членное кольцо тиенопиримидин-4-онов также может проводиться с помощью металлорганической методологии. Тиено[3.2-d]пиримидин 4-оны и тиенил[2.3-d]пиримидин-4-оны, например, могут быть избирательно депротонированы в положении 6. Особенно пригодными основаниями для этой цели являются диизопропиламид лития (ДАЛ), циклогексилизопропиламид лития (ЦИАЛ), вторичный бутиллитий/ТМЭДА. Большая часть указанных выше радикалов R3 может быть введена путем взаимодействия образовавшихся анионов с электрофильными соединениями (стадия 1 на схеме 2), обычно с такими реагентами, как Br2, N-БС, F2, ICl, Cl2, F+. Схема 2. Синтез определенных гетероциклов.E+1.2 обозначают реагенты N-БС (Nбромсукцинимид), N-XC (N-хлорсукцинимид),Cl2, Br, FCl, F+. Схема 3. Синтез определенных тиенопиримидин-4-онов (специальные методы введения галогена в тиофеновое кольцо). а) Тиено[2.3-d]пиримидин-4-оны: Для галогенирования используют 1-3 молярных эквивалента N-бромсукцинимида или Nхлорсукцинимида (или газообразного Сl2 или Вr2). В качестве растворителя применяют, например, пиридин в диапазоне температур от 0 С до температуры дефлегмации. Время реакции составляет 1-24 ч. а 2) Метод "чистого" хлорирования: Смешанные галогенизированные соединения (hal1 отличается от hal2) также могут быть получены аналогично способу, приведенному на стадии б 2). Другим представляющим интерес объектом изобретения является применение металлоорганической методологии для получения тиено[3.4-d] пиримидин-4-онов, замещенных в положении 5. Схема 4 Е 1 и Е 2 имеют значения, указанные для схемы 2. Описанные реакции проводят хорошо известным способом, например, в присутствии пригодного растворителя или разбавителя либо их смеси или же без них, при необходимости при охлаждении, при комнатной температуре или при нагревании, например, в диапазоне температур от приблизительно -20 С до температуры кипения реакционной смеси, предпочтительно в диапазоне температур от приблизительно -20 С до приблизительно +150 С и при необходимости в закрытом сосуде под давлением в атмосфере инертного газа и/или в безводных условиях. Наглядными примерами таких растворителей и разбавителей являются ароматические,алифатические и алициклические углеводороды и галогенированные углеводороды, обычно бензол, толуол, ксилол, хлорбензол, бромбензол,петролейный эфир, гексан, циклогексан, дихлорметан, трихлорметан, дихлорэтан или трихлорэтан; простые эфиры, обычно диэтиловый эфир, метил-трет-бутиловый эфир, тетрагидро 7 фуран или диоксан; кетоны, обычно ацетон или метилэтилкетон; спирты, обычно метанол, этанол, пропанол, бутанол, этиленгликоль или глицерин; сложные эфиры, обычно этилацетат или бутилацетат; амиды, обычно N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон или триамид гексаметилфосфоновой кислоты; нитрилы, обычно ацетонитрил; и сульфоксиды, обычно диметилсульфоксид. В качестве растворителей или разбавителей также могут применяться используемые в избытке основания, такие как триэтиламин, пиридин, Nметилморфолин или N,N-диэтиланилин. Приемлемыми основаниями для проведения реакции являются, например, гидроксид щелочного или щелочно-земельного металла,гидрид щелочного или щелочно-земельного металла, амид щелочного или щелочноземельного металла, алканолят щелочного или алканолят металла, карбонат щелочного или щелочно-земельного металла, диалкиламид щелочного или щелочно-земельного металла либо алкилсилиламид щелочного или щелочноземельного металла, алкиламины, алкилендиамины, необязательно N-алкилированные, необязательно ненасыщенные циклоалкиламины, основные гетероциклические соединения, гидроксиды аммония и карбоциклические амины. В качестве примеров можно назвать гидроксид натрия, гидрид натрия, амид натрия, метанолят натрия, карбонат натрия, трет-бутанолят калия,карбонат калия, диизопропиламид лития,бис(триметилсилил)амид калия, гидрид кальция,триэтиламин, триэтилендиамин, циклогексиламин, N-циклогексил-N,N-диметиламин, N,Nдиэтиланилин, пиридин, 4-(N,N-диметиламино) пиридин, N-метилморфолин, гидроксид бензилтриметиламмония и 1,8-диазабицикло[5.4.0] ундек-5-ен (ДБУ). Производные хиназолинона, обладающие фунгицидной активностью, известны из WO 94/26722 или ЕР-А 276825. Неожиданно было обнаружено, что новые соединения формулы I с точки зрения практического применения обладают весьма полезным спектром активности для защиты растений от болезней, вызываемых грибами, а также бактериями и вирусами. Соединения формулы I могут применяться в сельскохозяйственном секторе и в близких областях в качестве действующих веществ для борьбы с вредителями растений. Новые соединения проявляют очень высокую активность при низких нормах расхода, при этом они хорошо переносятся растениями и являются безопасными для окружающей среды. Они обладают очень хорошими лечебными, профилактическими и системными свойствами и пригодны для защиты многочисленных культурных растений. Соединения формулы I могут применяться для ингибирования или уничтожения вредителей,которые встречаются на растениях или на час 001148 8 тях указанных растений (плоды, цветки, листья,стебли, клубни, корни) различных культурных или полезных растений, защищая в то же время также те части растений,которые вырастут позднее, например, от фитопатогенных микроорганизмов. Соединения формулы I также можно применять в качестве препаратов для протравливания семян, предназначенных для обработки материала для размножения растения, в частности семенного материала (плоды, клубни, зерна) и саженцев растений (например, риса), для защиты от заражения грибами, а также от фитопатогенных грибов, встречающихся в почве. Соединения формулы I, например, эффективны в отношении фитопатогенных грибов следующих классов: Fungi imperfecti (например,Botrytis, Pyricularia, Helminthosporium, Fusarium,Septoria, Cercospora и Alternaria) и Basidiomycetes (например, Rhizoctonia, Hemileia, Puccinia). Кроме того, они также эффективны в отношении грибов из класса Ascomycetes (например,Venturia и Erysiphe, Podosphaera, Monilinia, Uncinula) и из класса Oomycetes (например, Phytophtora, Pythium, Plasmopara). Кроме того, новые соединения формулы I эффективны в отношении фитопатогенных бактерий и вирусов (например, в отношении Xanthomonas spp., Pseudomonas spp., Erwinia amylovora, а также в отношении вируса мозаики табака). В объеме настоящего изобретения подлежащие защите культурные растения обычно включают следующие виды растений: зерновые(пшеница, ячмень, рожь, овес, рис, кукуруза,сорго и родственные виды); свекольные (сахарная свекла и кормовая свекла); семечковые, косточковые плодовые культуры и ягодные плодовые культуры (яблони, груши, сливы, персики,миндаль, вишни, земляника, малина и ежевика); бобовые растения (бобы, чечевица, горох, соя); масличные культуры (рапс, горчица, мак, маслины, подсолнечник, кокос, клещевина, какао,арахис); огуречные растения (тыквы, огурцы,дыни); волокнистые растения (хлопчатник, лен,конопля, джут); цитрусовые культуры (апельсины, лимоны, грейпфруты, мандарины); овощные культуры (шпинат, салат, спаржа, капустные,моркови, луки, томаты, картофель, сладкий перец); лавровые растения (авокадо, коричное дерево, камфорное дерево); или такие растения,как табак, орехи, кофе, баклажаны, сахарный тростник, чай, перец, виноград, хмель, банановые растения и природные каучуконосы, а также декоративные растения. Соединения формулы I обычно применяют в форме композиций, и их можно вносить в посевную площадь или обрабатывать растения одновременно или последовательно с другими соединениями. Эти дополнительные соединения могут представлять собой, например, удобрения или доноры микроэлементов или другие препараты, влияющие на рост растений. Они могут 9 также представлять собой селективные гербициды, а также инсектициды, фунгициды, бактерициды, нематоциды, моллюскициды или смеси нескольких этих препаратов, при необходимости с дополнительными носителями, поверхностно-активными веществами или способствующими нанесению адъювантами, обычно применяемыми в области изготовления препаративных форм. Соединения формулы I могут быть смешаны с другими фунгицидами, что приводит в ряде случаев к неожиданным синергетическим эффектам. Особенно предпочтительными применямыми в смесях компонентами являются азолы,такие как пропиконазол, дифеноконазол, ципроконазол, эпоксиконазол, тебуконазол, тетраконазол, фенбуконазол, метконазол, бромконазол; а также фенпропидин, фенпропиморф, ципродинил,пириметаннил,S-метилбензо-1,2,3 тиадиазол-7-тиокарбоксилат; и стробилурины,такие, как азоксистробин и крезоксимеметил. Пригодные носители и адъюванты могут быть твердыми или жидкими и представляют собой соединения, пригодные для изготовления препаративных форм, например, натуральными или регенерированными минеральными веществами, растворителями, диспергирующими агентами, смачивающими агентами, прилипателями,наполнителями, связующими веществами или удобрениями. Предпочтительным методом обработки соединения формулы I или сельскохозяйственной композиции, содержащей, по крайней мере, одно из таких соединений, является обработка листьев. Частота обработки и норма расхода должны определяться риском заражения соответствующим патогеном. Однако соединения формулы I также могут проникать в растение через корневую систему из почвы (системное действие) при насыщении места обитания растений жидкой композицией или при внесении соединений в твердой форме в почву, например,в форме гранул (почвенное внесение). В случае культур, выращиваемых в воде, например, риса,такие гранулы могут быть внесены на затопленное рисовое поле. Соединения формулы I также могут быть нанесены на семена (покрытие) либо путем пропитки семян или клубней жидкой композицией фунгицида, либо путем нанесения слоя твердой композиции. Соединения формулы I применяют в немодифицированной форме или предпочтительно вместе с адъювантами, обычно применяемыми для изготовления препаративных форм. В этом случае их обычно изготавливают известными способами в виде эмульсионных концентратов,покрывающих паст, готовых к применению распыляемых или разбавляемых растворов, разбавленных эмульсий, смачивающихся порошков,растворимых порошков, дустов, гранул, а также в виде препаратов, инкапсулированных, напри 001148 10 мер, в полимерные вещества. В соответствии с типом композиции, а также с поставленными целями и превалирующими обстоятельствами выбирают такие методы обработки, как опрыскивание, обработка в виде туманов, опыливание, разбрасывание, намазывание или полив. Предпочтительные нормы расхода обычно находятся в диапазоне от 5 г до 2 кг действующего вещества (д.в.) на гектар (га), предпочтительно от 10 г до 1 кг д.в./га, наиболее предпочтительно от 20 до 600 г д.в./га. При использовании в качестве препарата для протравливания семян обычные дозы составляют от 10 мг до 1 г действующего вещества на 1 кг семян. Препаративные формы, т.е. композиции,содержащие соединение формулы I и при необходимости твердый или жидкий адъювант, получают известным способом, обычно путем тщательного смешения и/или измельчения соединения с наполнителями, например с растворителями, твердыми носителями и необязательно с поверхностно-активными веществами (детергентами). Пригодными растворителями обычно являются ароматические углеводороды, предпочтительно фракции, содержащие 8-12 атомов углерода, такие как ксилоловые смеси или замещенные нафталины; фталаты, такие как дибутил- или диоктилфталат; алифатические углеводороды, такие как циклогексан или парафины; спирты и гликоли и их простые и сложные эфиры, такие как этанол, диэтиленгликоль, 2 метоксиэтанол или 2-этоксиэтанол; кетоны, такие как циклогексанон; высокополярные растворители такие как N-метил-2-пирролидон,диметилсульфоксид или диметилформамид; а также растительные масла или эпоксидированные растительные масла, такие как эпоксидированное кокосовое масло или соевое масло; и вода. Твердые носители, обычно применяемые для дустов и диспергируемых порошков, как правило, представляют собой природные минеральные наполнители, такие как кальцит, тальк,каолин, монтмориллонит или аттапульгит. С целью улучшения физических свойств также возможно добавление высокодисперсной кремниевой кислоты или высокодисперсных абсорбирующих полимеров. Пригодными гранулированными абсорбционными носителями являются носители пористого типа, например, пемза,битый кирпич, сепиолит или бентонит, а пригодными несорбирующими носителями являются такие материалы, как кальцит или песок. Кроме того, может применяться большое число гранулированных материалов неорганического или органического происхождения, например,особенно предпочтительны доломит или растертые в порошок растительные остатки. В зависимости от природы соединения формулы I, подлежащего включению в препаративную форму, пригодными поверхностно 11 активными соединениями являются неионогенные, катионогенные и/или анионогенные поверхностно-активные вещества, обеспечивающие хорошие эмульгирующие, диспергирующие и смачивающие свойства. Под поверхностноактивными веществами также следует понимать смеси поверхностно-активных веществ. Пригодными анионогенными поверхностно-активными веществами могут служить так называемые водорастворимые мыла, а также водорастворимые синтетические поверхностноактивные вещества. В качестве примерa неионогенных поверхностно-активных веществ можно упомянуть нонилфенолполиэтоксилаты, полиэтоксилированное касторовое масло, аддукты полипропилена и полиэтиленоксида, трибутилфенолполиэтоксилат, полиэтоксилат полиэтиленгликоля и октилфенола. Также пригодны эфиры жирных кислот и полиоксиэтиленсорбитана,такие как триолеат полиоксиэтиленсорбитана. Катионогенными поверхностно-активными веществами предпочтительно являются соли четвертичного аммония, содержащие в качестве заместителей, по крайней мере, один С 8 С 22 алкильный радикал, и в качестве дополнительных заместителей радикалы необязательно галогенированного (низш.)алкила, бензила или(низш.)гидроксиалкила. Другие поверхностно-активные вещества,обычно применяемые в области изготовления препаративных форм, известны специалистам в данной области техники или могут быть обнаружены в доступной литературе. Как правило, сельскохозяйственные композиции включают от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.% соединения формулы I и от 99,9% до 1 мас.%, предпочтительно от 99,8% до 5 мас.% твердого или жидкого адъюванта и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.% поверхностно-активных веществ. В то время как концентрированные композиции являются более предпочтительными в качестве поставляемых в продажу продуктов,непосредственный потребитель, как правило,применяет разбавленные композиции. Композиции также могут содержать дополнительные адъюванты, такие как стабилизаторы, пеногасители, регуляторы вязкости, связующие вещества или прилипатели, а также удобрения, доноры микроэлементов или другие композиции, способствующие достижению требуемого эффекта. Приведенные ниже примеры служат для более детальной иллюстрации описанного выше изобретения, но не направлены на ограничение его объема. Температура указана в градусах Цельсия. Использованы следующие сокращения: 12 плавления; ЯМР обозначает спектр ядерного магнитного резонанса; МС обозначает массспектр; % обозначает мас.%, если соответствующие концентрации не приведены в других единицах. Примеры получения Пример Р-1. 3-пропил-2-тиоксо-2,3 дигидро-1 Н-тиено[3.2-d]пиримидин-4-он. В сосуде для сульфирования 1,7 г (0,028 моля) н-пропиламина добавляют по каплям к 30 мл тетрагидрофурана и 5,2 г (0,026 моля) метил 3-изотиоцианаттиофен-2-карбоксилата, растворенного в 30 мл тетрагидрофурана таким образом, чтобы внутренняя температура не превышала 35 С. Затем реакционную смесь перемешивают в течение 16 ч при температуре дефлегмации и затем тетрагидрофуран удаляют в вакууме, создаваемом водоструйным насосом. Остаток растворяют в этилацетате и трижды экстрагируют водой. Затем органическую фазу сушат над сульфатом натрия и растворитель удаляют в вакууме, создаваемом водоструйным насосом,получая 3-пропил-2-тиоксо-2,3 дигидро-1 Н-тиено[3.2-d]пиримидин-4-он в виде неочищенного продукта, который может быть очищен путем дигерирования в метил-третбутиловом эфире. Слегка коричневатый порошок (5,3 г) имеет tпл 230 С. Пример Р-2. 2-метилсульфанил-3-пропил 3 Н-тиено[3.2-d]пиримидин-4-он. В сосуде для сульфирования 0,84 г (0,021 моля) приблизительно 60%-ной дисперсии гидрида натрия добавляют к 20 мл абсолютного тетрагидрофурана, а затем по каплям добавляют 4,8 г (0,021 моля) 3-пропил-2-тиоксо-2,3 дигидро-1 Н-тиено[3.2-d]пиримидин-4-она, растворенного в 80 мл тетрагидрофурана таким образом, чтобы внутренняя температура поддерживалась примерно на уровне 25 С. Затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре, после чего в виде одной порции добавляют 4,3 г (0,03 моля) метилйодида. Смесь кипятят с обратным холодильником в течение 4 ч, а затем тетрагидрофуран удаляют в вакууме, создаваемом водоструйным насосом. Остаток растворяют в этилацетате и органическую фазу трижды экстрагируют водой. Органическую фазу сушат над сульфатом натрия и растворитель удаляют в вакууме, создаваемом водоструйным насосом, получая неочищенный продукт, который очищают с помощью колоночной хроматографии на силика 13 чают 1,22 г 2-пропокси-3-пропил-3 Н-тиено[3.2d]пиримидин-4-она в виде порошка бежевого цвета с tпл 42-45 С. Пример Р-5. 7-хлор-2-пропокси-3 пропилтиено[3.4-d]пиримидин-4-он.[соединение 1.4] В сосуде для сульфирования 9,6 г (0,04 моля) 2-метилсульфанил-3-пропил-3 Н-тиено[3.2d]пиримидин-4-она добавляют к 200 мл абсолютного терагидрофурана. Затем 4,07 г (0,042 моля) диизопропиламида лития, растворенного в 50 мл абсолютного тетрагидрофурана, добавляют по каплям в атмосфере N2 таким образом,чтобы внутренняя температура поддерживалась на уровне примерно -78 С. Затем смесь перемешивают в течение 1 ч при -78 С, после чего по каплям добавляют раствор, содержащий 8,5 г(0,048 моля) N-бромсукцинимида в 40 мл абсолютного тетрагидрофурана, таким образом, чтобы внутренняя температура поддерживалась на уровне примерно -78 С. Затем конденсатор удаляют и смесь медленно нагревают до комнатной температуры. Тетрагидрофуран удаляют в вакууме, создаваемом водоструйным насосом, и остаток растворяют в этилацетате. Органическую фазу промывают водой, сушат над сульфатом натрия и затем этилацетат удаляют в вакууме, создаваемом водоструйным насосом. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1:5), получая 3,8 г 6-бром-2 метилсульфанил-3-пропил-3 Н-тиено[3.2d]пиримидин-4-она в виде порошка желтого цвета с tпл 138-141 С. Пример Р-4. 2-пропокси-3-пропил-3 Нтиено[3.2-d]пиримидин-4-он.[соединение 3.46] В сосуде для сульфирования 2,02 г (0,008 моля) 2-пропокси-3-пропилтиено[3.2-d]пиримидин-4-она добавляют при перемешивании к 10 мл абсолютного пиридина. Затем внутреннюю температуру повышают до 70 С, после чего примерно в течение 5 мин небольшими порциями добавляют 1,60 г (0,012 моля) Nхлорсукцинимида (N-XC). После перемешивания в течение 1 ч при 70-75 С пиридин удаляют в вакууме, создаваемом водоструйным насосом,и остаток растворяют в этилацетате. Смесь повторно промывают разбавленной водной соляной кислотой, сушат над сульфатом натрия и растворитель удаляют в вакууме, создаваемом водоструйным насосом. Полученный таким путем неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле (элюент: н-гексан/этилацетат 9:1), получая 2,2 г 7 хлор-2-пропокси-3-пропилтиено[3.4-d]пиримидин-4-она в виде порошка зеленого цвета с tпл 93-95 С. Пример Р-6. Метил-2-изотиоцианаттиофен-3-карбоксилат.[соединение 1.40] В сосуде для сульфирования 1,66 г (0,02 моля) пропилата натрия и 1,5 г (0,00624 моля) 2 метилсульфанил-3-пропил-3 Н-тиено[3.2-d]пиримидин-4-она перемешивают в 50 мл абсолютного н-пропанола в течение 3 ч в атмосфере N2 при температуре дефлегмации. Затем нпропанол удаляют в вакууме, создаваемом водоструйным насосом, и остаток растворяют в этилацетате/воде и трижды экстрагируют водой. Органическую фазу сушат над сульфатом натрия и растворитель удаляют в вакууме, создаваемом водоструйным насосом, получая неочищенный продукт, который очищают с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1:3). Таким путем полу В сосуде для сульфирования 50,2 г (0,32 моля) 2-аминотиофен-3-карбоксилата добавляют к 480 мл хлороформа и 320 мл воды. Затем 40,5 г (0,35 моля) тиофосгена и 1000 мл насыщенного водного раствора бикарбоната натрия одновременно добавляют при перемешивании в течение 40 мин. Перемешивание продолжают в течение 1 ч при комнатной температуре и затем органическую фазу отделяют. Водную фазу дважды экстрагируют хлороформом и органическую фазу сушат над сульфатом натрия. После удаления хлороформа в вакууме, создаваемом водоструйным насосом, получают 61,3 г темного масла, которое дополнительно очищают с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1:5). Таким путем получают 41,5 г метил-2 изотиоцианаттиофен-3-карбоксилата в виде порошка коричневого цвета с tпл 63-65 С. Пример Р-7 (способ 1). Метил-2-(3 пропилтиоуреидо)тиофен-3-карбоксилат.[соединение 9.1] В сосуде для сульфирования 13,5 г (0,023 моля) н-пропиламина добавляют по каплям к 350 мл тетрагидрофурана и 41,3 г (0,021 моля) метил-2-изотиоцианаттиофен-3-карбоксилата таким образом, чтобы внутренняя температура не превышала 40 С. Затем реакционную смесь перемешивают в течение 4 ч при температуре дефлегмации и далее тетрагидрофуран удаляют в вакууме, создаваемом водоструйным насосом. Остаток растворяют в этилацетате и трижды экстрагируют водой. Затем органическую фазу сушат над сульфатом натрия и растворитель удаляют в вакууме, создаваемом водоструйным насосом, получая неочищенный продукт, который очищают с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1:3). Получают 32,4 г метил-2-(3 пропилтиоуреидо)тиофен-3-карбоксилата в виде порошка бежевого цвета, имеющего tпл 123126 С. Пример Р-7 (способ 2). Метил-2-(3 пропилтиоуреидо)тиофен-3-карбоксилат. В сосуде для сульфирования 2,02 г (0,02 моля) 1-изотиоцианатпропана добавляют по каплям к 30 мл диметилформамида и 3,0 г (0,019 ммоля) метил-2-аминотиофен-3-карбоксилата. Затем реакционную смесь перемешивают при 130-135 С в течение 12 ч и после охлаждения добавляют к 120 мл воды. Затем образовавшуюся смесь экстрагируют трижды этилацетатом и отделенную органическую фазу сушат над сульфатом натрия. Затем растворитель удаляют в вакууме, создаваемом водоструйным насосом, получая неочищенный продукт в виде темного масла, которое очищают с помощью колоночной хроматографии на силикагеле(элюент: метил-трет-бутиловый эфир/гексан 2:3). Таким путем получают 2,0 г метил-2-(3-пропилтиоуреидо)тиофен-3-карбоксилата в виде порошка желтого цвета с tпл 122124 С. Пример Р-8. 3-бутил-2-тиоксо-2,3-дигидро 1 Н-тиено[2.3-d]пиримидин-4-он.[соединение 10.4] В сосуде для сульфирования 0,2 г (0,0049 моля) примерно 60%-ной дисперсии гидрида натрия добавляют к 20 мл абсолютного тетрагидрофурана. Затем 1,29 г (0,0047 моля) метил 001148 16 2-(3-бутилтиоуреидо)тиофен-3-карбоксилата,растворенного в 10 мл абсолютного тетрагидрофурана, добавляют по каплям таким образом,чтобы внутренняя температура поддерживалась на постоянном уровне примерно 25 С. Смесь перемешивают при температуре дефлегмации в течение 3 ч и затем растворитель удаляют в вакууме, создаваемом водоструйным насосом, и остаток растворяют в этилацетате/воде. После добавления уксусной кислоты смесь экстрагируют трижды этилацетатом и органическую фазу сушат над сульфатом натрия. После удаления растворителя в вакууме, создаваемом водоструйным насосом, получают 1,06 г 3-бутил-2 тиоксо-2,3-дигидро-1 Н-тиено[2.3-d]пиримидин 4-она в виде порошка коричневого цвета с tпл 200-203 С. Пример Р-9. 2-метилсульфанил-3-пропил 3 Н-тиено[2.3-d]пиримидин-4-он. В сосуде для сульфирования 2,9 г (0,072 моля) примерно 60%-ной дисперсии гидрида натрия добавляют к 50 мл абсолютного тетрагидрофурана. Затем 17,7 г (0,069 моля) метил-2(3-пропилтиоуреидо)тиофен-3-карбоксилата,растворенного в 100 мл абсолютного тетрагидрофурана, добавляют по каплям таким образом,чтобы внутренняя температура поддерживалась на постоянном уровне примерно 25 С. Смесь перемешивают при температуре дефлегмации в течение 5 ч и после охлаждения до комнатной температуры добавляют по каплям 10,9 г (0,077 моля) метилйодида, растворенного в 10 мл тетрагидрофурана. Затем смесь перемешивают в течение еще 2 ч при температуре дефлегмации. По завершении реакции тетрагидрофуран удаляют в вакууме, создаваемом водоструйным насосом, и остаток растворяют в этилацетате. Органический слой дважды промывают водой и затем сушат над сульфатом натрия. После удаления растворителя в вакууме, создаваемом водоструйным насосом, получают неочищенный продукт, который очищают с помощью дегирирования в н-гексане. Таким путем получают 15,1 г 2-метилсульфанил-3-пропил-3 Н-тиено[2.3-d]пиримидин-4-она в виде слегка желтоватого порошка с tпл 94-96 С. Пример Р-10. 2-пропокси-3-пропил-3 Нтиено[2.3-d]пиримидин-4-он.[соединение 2.40] В сосуде для сульфирования 12,5 г (0,15 моля) пропилата натрия и 12,0 г (0,05 моля) 2 17 метилсульфанил-3-пропил-3 Н-тиено[2.3-d]пиримидин-4-она перемешивают в 120 мл абсолютного н-пропанола в течение 4 ч в атмосфере азота при температуре дефлегмации. Затем нпропанол удаляют в вакууме, создаваемом водоструйным насосом, остаток растворяют в этилацетате/воде и органическую фазу дважды экстрагируют водой. Органическую фазу сушат над сульфатом натрия и растворитель удаляют в вакууме, создаваемом водоструйным насосом,получая неочищенный продукт, который затем очищают с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1:3). Таким путем получают 6,7 г 2-пропокси-3 пропил-3 Н-тиено[2.3-d]пиримидин-4-она в форме смолы коричневого цвета (данные 1HЯМР см. в таблице 11). Пример Р-11. 6-хлор-2-пропокси-3-пропил 3 Н-тиено[2.3-d]пиримидин-4-он.[соединение 2.41] В сосуде для сульфирования 10,1 г (0,04 моля) 2-пропокси-3-пропил-3 Н-тиено[2.3-d]пиримидин-4-она добавляют при перемешивании к 50 мл абсолютного пиридина. Затем внутреннюю температуру повышают до 70-75 С и добавляют в течение 10 мин в виде небольших порций 9,0 г (0,07 моля) N-хлорсукцинимида(N-XC). После перемешивания в течение 2 ч при 70-75 С пиридин удаляют в вакууме, создаваемом водоструйным насосом, и остаток растворяют в этилацетате. После двукратной промывки холодной разбавленной водной соляной кислотой, сушки над сульфатом натрия и удаления растворителя в вакууме, создаваемом водоструйным насосом, получают неочищенный продукт. Очистку неочищенного продукта проводят с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1:5), получая 7,8 г 6-хлор-2-пропокси-3-пропил-3 Нтиено[2.3-d]пиримидин-4-она в виде порошка белого цвета с tпл 62-65 С. Соединения, приведенные в следующих таблицах, могут быть получены аналогичным способом или другим способом, соответствующим указанным выше. Таблица 1 Примеры композиций, включающих соединения формулы I Примеры F-1.1 - F-1.3: Эмульсионные концентраты. КомпонентыF-1.1 соединение из таблиц 1-3 25% додецилбензолсульфонат кальция 5% полиэтоксилированное касторовое масло (36 молей этиленоксидных звеньев) 5% трибутилфенолполиэтоксилат(30 молей этиленоксидных звеньев) циклогексанон ксилоловая смесь 65% Эмульсии любой требуемой концентрации могут быть получены разбавлением этого концентрата водой. Пример F-2. Эмульсионный концентрат. Компоненты соединение из таблиц 1-3 октилфенолполиэтоксилат (4-5 молей этиленоксидных звеньев) додецилбензолсульфонат кальция полиэтоксилированное касторовое масло Эмульсии любой требуемой концентрации могут быть получены разбавлением этого концентрата водой. Примеры F-3.1 - F-3.4. Растворы. КомпонентыF-3.1 F-3.2 F-3.3 соединение из таблиц 1-3 80% 10% 5% монометиловый эфир пропиленгликоля 20% полиэтиленгликоль (относительная молекулярная масса: 400 атомных единиц массы) 70% 23 эпоксидированное кокосовое масло бензин (пределы кипения: 160-190) Растворы пригодны для применения в виде микрокапель. Примеры F-4.1 - F-4.4. Грануляты.F-4.1 соединение из таблиц 1-3 каолин высокодисперсная кремниевая кислота аттапульгит Новое соединение растворяют в дихлорметане, раствор распыляют на носитель и затем растворитель выпаривают под вакуумом. Примеры F-5.1 и F-5.2. Дусты. КомпонентыF-5.1 соединение из таблиц 1-3 2% высокодисперсная кремниевая кислота 1% тальк 97% каолин Путем тщательного смешения всех компонентов получают готовые к применению дусты. Примеры F-6.1 - F-6.3. Смачивающиеся порошки. КомпонентыF-6.1 соединение из таблиц 1-3 25% лигносульфонат натрия 5% лаурилсульфат натрия 3% диизобутилнафталинсульфонат натрия октилфенолполиэтоксилат (7-8 молей этиленоксидных звеньев) высокодисперсная кремниевая кислота 5% каолин 62% Все компоненты смешивают и смесь тщательно измельчают в пригодной для этой цели мельнице, получая смачивающиеся порошки,которые могут быть разбавлены водой до получения суспензий любой требуемой концентрации. Биологические примеры. Фунгицидное действие Пример В-1. Активность в отношении Puccinia graminis на пшенице. а) Остаточное защитное действие Растения пшеницы через 6 дней после посадки опрыскивают до появления капель водной смесью для опрыскивания (0,02% действующего вещества), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка, и через 24 ч заражают суспензией уредоспор гриба. После инкубации в течение 48 ч (условия: относительная влажность 95-100%,20 С) растения выдерживают в теплице при 24 22 С. Через 12 дней после заражения оценивают поражение грибом. б) Системное действие Водной смесью для опрыскивания (0,006% действующего вещества по отношению к объему почвы), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка, орошают почву вокруг растений пшеницы через 5 дней после посадки. Принимают меры предосторожности, исключая попадание раствора для опрыскивания на надземные части растений. Через 48 ч растения заражают суспензией уредоспор гриба. После инкубации в течение 48 ч (условия: относительная влажность 95-100%, 20 С) растения выдерживают в теплице при 22 С. Через 12 дней после заражения оценивают поражение грибом. Соединения, представленные в таблицах 13, проявляют высокую эффективность. Пример В-2. Активность в отношенииColletotrichum lagenarium на огурцах. Растения огурцов через 2 недели после посадки опрыскивают водной смесью для опрыскивания (0,002% действующего вещества), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка,и через 2 дня заражают суспензией спор гриба(1,510 спор/мл) и инкубируют при 23 С и высокой влажности воздуха в течение 36 ч. Затем инкубацию продолжают при нормальной влажности воздуха и температуре приблизительно 22 С. Через 8 дней после заражения оценивают поражение грибом. Соединения, представленные в таблицах 13, проявляют высокую эффективность. Пример В-3. Остаточное защитное действие в отношении Venturia inaequalis на яблонях. Черенки яблони со свежими побегами длиной 10-20 см опрыскивают до появления капель водной смесью для опрыскивания (0,02% действующего вещества), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка. Через 24 ч растения заражают суспензией конидий гриба. После этого растения инкубируют при относительной влажности воздуха 90-100% в течение 5 дней, а затем выдерживают в теплице при температуре 20-24 С в течение еще 10 дней. Через 12 дней после заражения оценивают поражение грибом. Соединения, представленные в таблицах 13, проявляют высокую эффективность. Пример В-4. Активность в отношении Erysiphe graminis на ячмене. а) Остаточное защитное действие Растения ячменя высотой приблизительно 8 см опрыскивают до появления капель водной смесью для опрыскивания (0,02% действующего вещества), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка, и через 3-4 ч обработанные растения опыляют конидиями гриба. Зараженные растения выдерживают в теплице при 22 С. Че 25 рез 12 дней после заражения оценивают поражение грибом. б) Системное действие Водной смесью для опрыскивания (0,002% действующего вещества по отношению к объему почвы), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка, орошают почву вокруг растений ячменя высотой приблизительно 8 см. Принимают меры предосторожности, исключая попадание раствора для опрыскивания на надземные части растений. Через 48 ч растения опыляют конидиями гриба. Зараженные растения выдерживают в теплице при температуре 22 С. Через 12 дней после заражения оценивают поражение грибом. По сравнению с контрольными растениями заражение растений, обработанных соединениями формулы I, например соединениями 1.40,1.41, 1.42, 1.50, 1.51, 1.52, 1.97, 2.20, 2.21, 2.31,2.32, 2.33, 2.40, 2.41, 2.42, 2.50, 2.51, 2.61, 2.62,2.83, 2.90, 2.92, 2.99, 2.101, 2.102, 2.105, 2.106,2.107, 2.108, 2.111, 2.112, 2.113, 2.129, 2.130,2.131, 2.132, 2.133, 2.134, 2.135, 2.136, 3.12, 3.15,3.16, 3.46, 3.47 и 3.51, составляет 20% или менее. Следующие соединения проявляют очень высокую эффективность (при их применении заражение отсутствует полностью): 2.41, 2.42,2.83, 2.106, 2.107, 2.112, 2.113, 2.129, 2.130,2.131, 2.132, 2.133, 2.134, 2.135, 2.136. Пример В-5. Активность в отношении Podosphaera leucotricha на побегах яблони. Черенки яблони со свежими побегами длиной 15 см опрыскивают смесью для опрыскивания (0,06% действующего вещества). Через 24 ч обработанные растения заражают суспензией конидий гриба и помещают в климатическую камеру с относительной влажностью воздуха 70% и температурой 20 С. Через 12 дней после заражения оценивают поражение грибом. Соединения, представленные в таблицах 13, обладают высокой эффективностью. Следующие соединения проявляют особенно высокую эффективность: 2.41, 2.42, 2.83, 2.106,2.107, 2.112, 2.113, 2.129, 2.130, 2.131, 2.132,2.133, 2.134, 2.135, 2.136 (0-5% поражения). Пример В-6. Активность в отношенииPlasmopara viticola на культурном винограде. а) Остаточное профилактическое действие Чубуки культурного винограда сорта"Chasselas" выращивают в теплице. На стадии 10 листьев три растения опрыскивают смесью для опрыскивания (200 част. д.в./млн). После высыхания нанесенного при помощи опрыскивания покрытия нижнюю поверхность листьев растений равномерно заражают суспензией спор гриба. Затем растения в течение 8 дней выдерживают во влажной камере, после чего на контрольных растениях могут быть обнаружены выраженные симптомы болезни. Количество и 26 размер повреждений на необработанных растениях используют в качестве контроля для оценки эффективности тестируемых соединений. б) Лечебное действие Чубуки культурного винограда сорта"Chasselas" выращивают в теплице и на стадии 10 листьев заражают нижнюю поверхность листьев суспензией спор Plasmopara viticola. После этого растения выдерживают в течение 24 ч во влажной камере и затем их опрыскивают смесью для опрыскивания (200 част./млн д.в.). Далее растения выдерживают во влажной камере еще 7 дней. За этот промежуток времени на контрольных растениях могут быть обнаружены симптомы болезни. Количество и размер повреждений на необработанных растениях используют в качестве контроля для оценки эффективности тестируемых соединений. Соединения, представленные в таблицах 13, проявляют высокую эффективность. Пример В-7. Активность в отношении Uncinula necator на культурном винограде. Чубуки культурного винограда через 5 недель после посадки опрыскивают смесью для опрыскивания (200 част./млн д.в.), полученной из композиции на основе тестируемого соединения в виде смачивающегося порошка. Через 24 ч после этого растения заражают, стряхивая конидии с сильно зараженных листьев винограда на опытные растения. Затем растения инкубируют при 26 С и относительной влажности 60%. Приблизительно через 14 дней после заражения оценивают поражение грибом. По сравнению с контрольными растениями заражение растений, обработанных соединениями формулы I, например соединениями 1.40,1.41, 1.42, 1.50, 1.51, 1.52, 1.97, 2.20, 2.21, 2.31,2.32, 2.33, 2.40, 2.41, 2.42, 2.44, 2.50, 2.51, 2.61,2.62, 2.83, 2.90, 2.92, 2.99, 2.101, 2.102, 2.105,2.106, 2.107, 2.108, 2.111, 2.112, 2.113, 2.129,2.130, 2.131, 2.132, 2.133, 2.134, 2.135, 2.136,3.12, 3.15, 3.16, 3.46, 3.47 и 3.51, составляет 20% или менее. Следующие соединения проявляют очень высокую эффективность (при их применении заражение отсутствует полностью): 2.41,2.42, 2.83, 2.106, 2.107, 2.112, 2.113, 2.129, 2.130,2.131, 2.132, 2.133, 2.134, 2.135, 2.136. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R1 обозначает С 1-С 6 алкил, С 2-С 6 алкенил, С 2 С 6 алкинил, С 3-С 6 циклоалкил, каждый из которых может быть незамещенным или может быть замещен галогеном;R3 и R4 каждый независимо друг от друга обозначает водород, галоген;R5 обозначает С 1-С 6 алкил или С 3 С 6 циклоалкил, каждый из которых может быть незамещенным или может быть замещен галогеном; иR3 и R4 каждый независимо друг от друга обозначает водород, хлор, бром, йод;R5 обозначает С 2-С 6 алкил. 3. Соединение формулы I по п.2,где A обозначает тиенил[2.3-d],R1 обозначает С 3-С 6 алкил,R2 обозначает OR5,R3 и R4 каждый независимо друг от друга обозначает водород, хлор, бром, йод, и
МПК / Метки
МПК: C07D 495/04, A01N 43/54
Метки: пиримидин-4-она, производные
Код ссылки
<a href="https://eas.patents.su/15-1148-proizvodnye-pirimidin-4-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидин-4-она</a>
Предыдущий патент: Лекарственный препарат для терапевтического лечения вирусного гепатита
Следующий патент: Акриловые сополимеры в качестве добавок для ингибирования осаждения парафинов в сырых маслах и композиции, их содержащие
Случайный патент: Способ запроса электронной информации



















