Замещенные соединения бифенила, способ их получения и фармацевтические композиции содержащие их
Номер патента: 5766
Опубликовано: 30.06.2005
Авторы: Бенжан Каролин, Да Коста Эрве, Ренар Пьер, Декамп-Франсуа Кароль, Вио Мари-Клод, Делагранж Филипп, Лесьё Даниэль, Йо Саид, Гийом Жеральд
Формула / Реферат
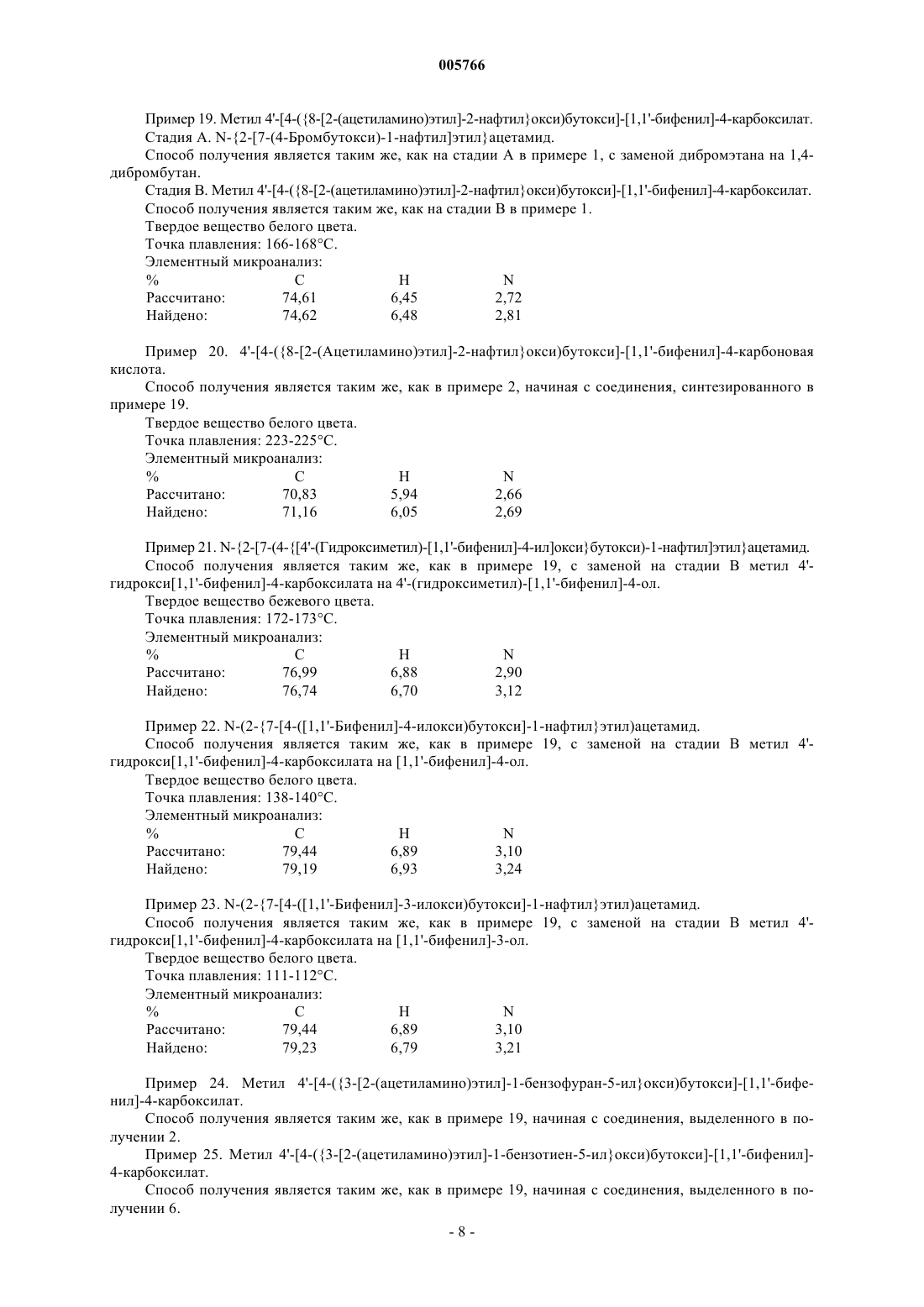
1 Соединения формулы (I)
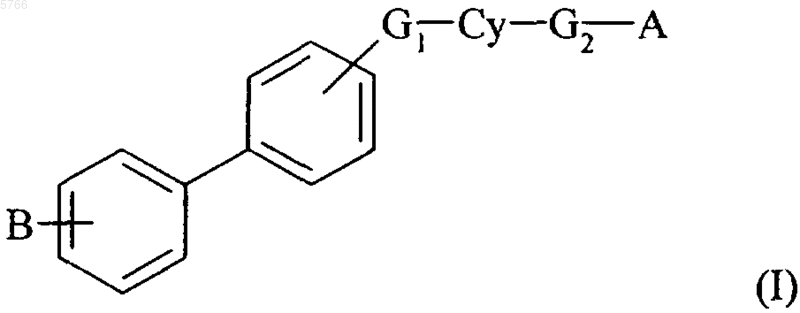
в которой B обозначает атом водорода, COOR-группу или CH2OR-группу (в которых R обозначает атом водорода или линейную или разветвленную (C1-C6)алкильную группу),
G1 обозначает -X'-(CH2)n-X-(CH2)m-X"-цепь, в которой
X обозначает CH2-группу,
X' и X" каждый обозначает атом кислорода,
n и m, которые могут быть одинаковыми или разными, каждый представляет 0, 1, 2 или 3,
Cy обозначает группу формулы (II)

в которой D обозначает фенил или пиридин,
W обозначает атом кислорода или серы, или CH2-группу, или NR-группу (в которой R принимает значения, указанные выше),
R1 обозначает атом галогена или R, OR или COOR-группу (в которой R принимает значения, указанные выше),
и обозначение - - - значит, что связь является одинарной или двойной, следует понимать, что валентность атомов соответствующая,
или группу формулы (III)
в которой R1 и обозначение - - - такие, как указанно выше,
G2 обозначает -CH2-CH2-, и
A обозначает NHCOR'-группу (в которой R' обозначает линейную или разветвленную алкильную группу),
их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
2. Соединения формулы (I) по п.1, в которой B обозначает COOR-группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
3. Соединения формулы (I) по п.2, в которой B обозначает COOR-группу, в которой R обозначает атом водорода, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
4. Соединения формулы (I) по п.2, в которой B обозначает COOR-группу, в которой R обозначает линейную или разветвленную (C1-C6)алкильную группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
5. Соединения формулы (I) по п.1, в которой B обозначает CH2OR-группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
6. Соединения формулы (I) по п.1, в которой Cy обозначает нафталиновую группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
7. Соединение формулы (I) по п.1, которое представляет собой метил 4'-[4-({8-[2-(ацетиламино)этил]-2-нафтил}окси)бутокси]-[1,1'-бифенил]-4-карбоксилат, а также его соли присоединения фармацевтически приемлемых кислот или оснований.
8. Соединение формулы (I) по п.1, которое представляет собой 4'-[4-({8-[2-(ацетиламино)этил]-2-нафтил}окси)бутокси]-[1,1'-бифенил]-4-карбоновую кислоту, а также его соли присоединения фармацевтически приемлемых кислот или оснований.
9. Соединение формулы (I) по п.1, которое представляет собой N-{2-[7-(4-{[4'-(гидроксиметил)-[1,1'-бифенил]-4-ил]окси}бутокси)-1-нафтил]этил}ацетамид, а также его соли присоединения фармацевтически приемлемых кислот или оснований.
10. Соединение формулы (I) по п.1, которое представляет собой N-(2-{7-[4-([1,1'-бифенил]-4-илокси)бутокси]-1-нафтил}этил)ацетамид, а также его соли присоединения фармацевтически приемлемых кислот или оснований.
11. Соединение формулы (I) по п.1, которое представляет собой N-(2-{7-[4-([1,1'-бифенил]-3-илокси)бутокси]-1-нафтил}этил)ацетамид, а также его соли присоединения фармацевтически приемлемых кислот или оснований.
12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (IV)
MeO-Cy-G2-A (IV),
в которой A, G2 и Cy принимают значения, указанные для формулы (I),
которое подвергают деметилированию, используя обычные агенты, такие как HBr, AlCl3, AlBr3, BBr3 или двухкомпонентные системы кислота Льюиса/нуклеофил, такие как AlCl3/PhCH2SH или BBr3/Me2S, например, с получением соединения формулы (V)
HO-Cy-G2-A (V),
в которой A, G2 и Cy принимают значения, указанные выше,
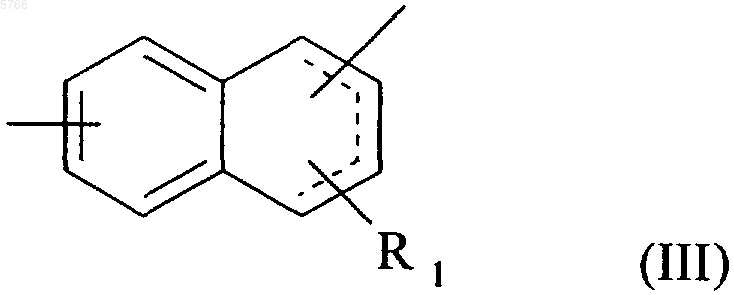
которое конденсируют с соединением формулы (IX)
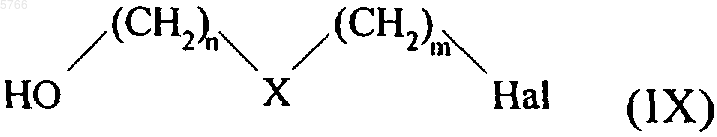
в которой Hal обозначает атом брома, хлора или иода и X, n и m принимают значения, указанные для формулы (I),
с получением соединения формулы (X)
HO-(CH2)n-X-(CH2)m-X"-Cy-G2-A (X),
в которой A, G2, Cy, X, X", n и m принимают значения, указанные выше,
гидроксильную функцию, которую превращают стандартным способом в уходящую группу, такую как, например, мезилат, тозилат, или галогенированное соединение, с получением соединения формулы (X')
E-(CH2)n-X-(CH2)m-X"-Cy-G2-A (X'),
в которой A, G2, Cy, X, X", n и m принимают значения, указанные выше, и E обозначает мезильную или тозильную группу или атом галогена,
которое вступает в реакцию в основной среде с соединением формулы (XI)
B'-Ph-Ph-X'H (XI),
в которой X' принимает значения, указанные для формулы (I), и B' может иметь те же значения, что и B, указанные для формулы (I), за исключением группы COOH,
с получением соединения формулы (I/a), частного случая соединений формулы (I)
B'-Ph-Ph-G1-Cy-G2-A (I/a),
в которой A, G2, G1, Cy и B' принимают значения, указанные выше,
соединение формулы (I/a), когда B' обозначает COOH-группу, подвергают гидролизу с получением соединения формулы (I/b), частного случая соединений формулы (I)
B"-Ph-Ph-G1-Cy-G2-A (I/b),
в которой A, G2, G1 и Cy принимают значения, указанные выше, и B" обозначает COOH группу,
совокупность соединений (I/a) и (I/b), составляющих соединения формулы (I), при желании, очищают по обычной методике очистки, необязательно разделяют на их изомеры согласно обычной методике разделения и, при желании, преобразуют в соли присоединения с фармацевтически приемлемыми кислотами или основаниями.
13. Фармацевтические композиции, содержащие в качестве активного ингредиента, по крайней мере, одно соединение формулы (I) по любому из пп.1-11 или его фармацевтически приемлемую соль присоединения с кислотой или основанием в сочетании с одним или более фармацевтически приемлемым эксципиентом.
14. Применение фармацевтической композиции, содержащей в качестве активного ингредиента по крайней мере одно соединение формулы (I) по любому из пп.1-11 или его фармацевтически приемлемую соль присоединения с кислотой или основанием в сочетании с одним или более фармацевтически приемлемым эксципиентом для лечения расстройств, связанных с мелатонинергической системой.
Текст
005766 Настоящее изобретение касается новых замещенных производных бифенила, способа их получения,а также фармацевтических композиций, содержащих их. Из литературы известны индольные производные бифенила, которые являются полезными в качестве ингибиторов металлопротеазы (WO 96 15096) или специфичных лигандов 5 НТ-1 В и 5HT-1D рецепторов (WO 95 01334). В патентной заявке ЕР 468470 описаны также бензимидазольные производные бифенила как ингибиторы ангиотензина. Ввиду нового строения соединения настоящего изобретения являются новыми, и их фармакологические свойства показывают сильное влияние в отношении мелатонинергических рецепторов. За последние 10 лет многочисленные исследования показали, что мелатонин (N-ацетил-5 метокситриптамин) играет значительную роль в большом количестве физиопатологических явлений, а также в контроле циркадного ритма, но вследствие быстрых метаболических процессов мелатонин имеет довольно короткий период полураспада. Поэтому огромный интерес заключается в возможности создания доступных клинических аналогов мелатонина, которые были бы метаболически более устойчивыми,имели бы агонистический или антагонистический характер и, можно ожидать, имели бы терапевтический эффект как у непосредственно самого гормона или выше. В дополнение к их положительному эффекту в отношении нарушений циркадного ритма (J. Neurosurg.,1985, 63, стр. 321-341) и расстройств сна (Psychopharmacology, 1990, 100, стр. 222-226), лиганды мелатонинергических систем имеют ценные фармакологические свойства в отношении центральной нервной системы, например транквилизаторные и нейролептические свойства (Neuropharmacology of Pineal Secretions,1990, S (3-4), стр. 264-272), болеутоляющие свойства (Pharmacopsychiat., 1987, 20, стр. 222-223), они также пригодны для лечения болезни Паркинсона (J. Neurosurg., 1985, 63, стр. 321-341) и болезни Альцгеймера (Brain Research, 1990, 528, стр. 170-174). Эти соединения также показали активность в отношении некоторых раковых опухолей (Melatonin - Clinical Perspectives, Oxford University Press, 1988, стр. 164165), овуляции (Science 1987, 227. стр. 714-720), диабета (Clinical Endocrinology, 1986, 24, стр. 359-364) и при лечении ожирения (International Journal of Eating Disorders, 1996, 20 (4), стр. 443-446). Указанные различные эффекты проявляются via посредника определенных рецепторов мелатонина. Молекулярно-биологические исследования показали существование множества подтипов рецепторов,которые способны связывать этот гормон (Trends Pharmacol. Sci., 1995, 16, стр. 50; WO 97.04094). Некоторые из этих рецепторов были установлены и охарактеризованы для различных видов, включая млекопитающих, для того чтобы лучше понимать физиологические функции этих рецепторов и для того чтобы иметь в наличии определенные лиганды, которые представляют огромный интерес. Кроме того, такие соединения, взаимодействуя выборочно с одним или другим из этих рецепторов, могут быть превосходными медикаментами для клинициста при лечении патологий, связанных с мелатонинергической системой, некоторые из которых были упомянуты выше. Помимо новизны, соединения настоящего изобретения показывают очень сильное сродство к рецепторам мелатонина и/или селективность к одним или другим подтипам мелатонинергических рецепторов. Более конкретно, настоящее изобретение касается соединений формулы (I) в которой В обозначает атом водорода, COOR-группу, CONRR'-группу, или линейную или разветвленную (С 1-С 6)алкильную группу, замещенную COOR-, CONRR'- или OR-группами (в которых R и R', которые могут быть одинаковыми или разными, каждый обозначает атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 2-С 6)алкенильную группу, линейную или разветвленную (С 2-С 6)алкинильную группу, арильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильний остаток может быть линейным или разветвленным, гетероарильную группу, гетероарил-(С 1-С 6)алкильную группу, в которой алкильний остаток может быть линейным или разветвленным,полигалоген-(С 1-С 6)алкильную группу, в которой алкильний остаток может быть линейным или разветвленным, (С 3-С 8)циклоалкильную группу или (С 3-С 8)циклоалкил-(С 1-С 6)алкильную группу, в которой алкильний остаток может быть линейным или разветвленным, кроме того, R и R' могут образовывать вместе с атомом азота, несущим их, морфолинильную, пиперидильную, пиперазинильную или пирролидинильную группу),G1 обозначает -Х'-(СН 2)m-Х-(СН 2)m-Х"-цепь, в которой Х обозначает атом кислорода или серы, или СН 2-группу, или NR-группу (в которой R принимает значения, указанные выше),X' и X", которые могут быть одинаковыми или разными, каждый представляет атом кислорода или серы или NR-группу (в которой R принимает значения, указанные выше),n и m, которые могут быть одинаковыми или разными, каждый представляет 0, 1, 2, 3, 4 или 5,-1 005766 понимают, что невозможно иметь два последовательно соединенных гетероатома и что цепь, заданная таким образом, может содержать одну или более ненасыщенных связей,Су обозначает группу формулы (II) в которой D обозначает фенил или пиридин,W обозначает атом кислорода или серы, или СН 2 группу, или NR группу (в которой R принимает значения, указанные выше),R1 обозначает атом галогена или R, OR или COOR группу (в которой R принимает значения, указанные выше),и обозначение - - - значит, что связь является одинарной или двойной, следует понимать, что валентность атомов соответствующая,или группу формулы (III) в которой R1 и обозначение - - - такие, как указанно выше,G2 обозначает цепь, содержащую от 1 до 6 атомов углерода, которая необязательно замещена одной или более группами, выбранными из R, OR, COR, COOR (в которых R принимает значения, указанные выше) и атомов галогена,и А обозначает NRCOR', NRCS R', CONRR', CSNRR', NRCONR'R" или NRCSNR'R"-группу (в которых R и R' принимают значения, указанные выше, и R" может принимать такие же значения, как R и R'),где выражение "арил" следует понимать в значении фенильной или нафтильной группы, которая является незамещенной или замещенной одной или более одинаковыми или разными группами, выбранными из R, OR, COR, COOR, NRR' групп (в которых R и R' принимают значения, указанные выше), нитрогруппы, цианогруппы и атомов галогена,выражение "гетероарил" следует понимать в значении любой моно- или бициклической группы, содержащей от 5 до 10 кольцевых членов и способной содержать от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, данная группа является незамещенной или замещенной одной или более одинаковыми или разными группами, выбранными из R, OR, COR, COOR, NRR' групп (в которых R и R' принимают значения, указанные выше), нитрогруппы, цианогруппы и атомов галогена,а также их энантиомеров и диастереоизомеров и солей присоединения фармацевтически приемлемых кислот или оснований. Среди фармацевтически приемлемых кислот можно отметить посредством перечисления, не ограничивающегося примерами, хлористо-водородную, бромистово-дородную, серную, фосфорную, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую, фумаровую,винную, малеиновую, лимонную, аскорбиновую, метансульфоновую, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить посредством перечисления, не ограничивающегося примерами, гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями изобретения являются соединения формулы (I), в которой В обозначаетCOOR-группу, в которой R - предпочтительно атом водорода или линейная или разветвленная (С 1 С 6)алкильная группа, такая как, например, метил,или линейную или разветвленную (С 1-С 6)алкильную группу, замещенную COOR или OR-группой,особенно предпочтительно СООН группой, алкоксикарбонильной группой, ОН или алкоксигруппой. Предпочтительной G1 группой соединений согласно изобретению является группа -O-(СН 2)р-O-, в которой р представляет целое число, которое 0 р 6, такая как, например, -O-(СН 2)4-O-. Изобретение в особенности касается соединений формулы (I), в которой Су обозначает нафталиновую, тетрагидронафталиновую, бензотиофеновую, бензофурановую, индольную, инденовую или азаиндольную группу.G2 предпочтительно обозначает -(СН 2)2- или -(СН 2)3- группу. Предпочтительными значениями для А являются группы NRCOR' и CONRR', особенно группыNHCOR' и CONHR. Еще предпочтительнее изобретение касается следующих соединений формулы (I): метил 4'-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоксилат,4'-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоновая кислота,N-2-[7-(4-[4'-(гидроксиметил)-[1,1'-бифенил]-4-ил]оксибутокси)-1-нафтил]этилацетамид,N-(2-7-[4-([1,1'-бифенил]-4-илокси)бутокси]-1-нафтилэтил)ацетамид,-2 005766N-(2-7-[4-([1,1'-бифeнил]-3-илoкcи)бyтoкcи]-1-нaфтилэтил)aцeтaмид. Энантиомеры, диастереоизомеры и соли присоединения фармацевтически приемлемых кислот или оснований предпочтительных соединений изобретения образуют неотъемлемую часть изобретения. Настоящее изобретение касается также способа получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества используют соединение формулы(IV),в которой А, G2 и Су принимают значения, указанные для формулы (I),которое подвергают деметилированию, используя обычные агенты, такие как НВr, АlСl3, АlBr3,ВВr3 или двухкомпонентные системы кислота Льюиса/нуклеофил, такие как АlСl3/РhСН 2SН или ВВr3/Ме 2S, например, с получением соединения формулы (V)(V),HO-Cy-G2-A в которой A, G2 и Су принимают значения, указанные выше,которое превращают стандартным способом: действием, например, N,N-диметилтиокарбамата натрия, в соответствующий тиол формулы (VI)(VI),в которой A, G2 и Су принимают значения, указанные выше,или в соответствующее аминопроизводное формулы (VII)(VII),в которой A, G2, Су и R принимают значения, указанные выше,соединения формулы (V), (VI) и (VII) представляют соединение формулы (VIII),в которой Hal обозначает атом брома, хлора или иода и X, n и m принимают значения, указанные для формулы (I) (понимают, что невозможно иметь два последовательно соединeнных гетероатома и что цепь, заданная таким образом, может содержать одну или более ненасыщенных связей),с получением соединения формулы (X)(X),в которой A, G2, Су, X, X", n и m принимают значения, указанные выше (понимают, что невозможно иметь два последовательно соединенных гетероатома в НО-(СН 2)n-Х-(СН 2)m-Х"-цепи и что цепь, заданная таким образом, может содержать одну или более ненасыщенных связей),гидроксильную функцию, которую превращают стандартным способом в уходящую группу, такую как, например, мезилат, тозилат, или галогенированное соединение, с получением соединения формулы (X')(X'),в которой A, G2, Су, X, X", n и m принимают значения, указанные выше, и Е обозначает мезил или тозил или атом галогена,которое вступает в реакцию в основной среде с соединением формулы (XI)(XI),в которой X' принимает значения, указанные для формулы (I), и В' может иметь те же значения, как В,указанные для формулы (I), за исключением группы СООН и алкильной группы, замещенной СООНгруппой,с получением соединения формулы (I/a), частного случая соединений формулы (I)COOR1'-группой (в которой R1' может принимать любое из значений R, указанных выше, за исключением атома водорода), подвергают гидролизу с получением соединения формулы (I/b), частного случая соединений формулы (I)(I/b),в которой A, G2, G1 и Су принимают значения, указанные выше, и В" обозначает СООН группу или алкильную группу, замещенную СООН-группой,совокупность соединений (I/a) и (I/b), составляющих соединения формулы (I), при желании, очищают по обычной методике очистки, необязательно разделяют на их изомеры согласно обычной методике разделения и, при желании, преобразуют в соли присоединения с фармацевтически приемлемыми кислотами или основаниями. Специалист, квалифицированный в данной области техники, может легко получить соединения формулы (IV) согласно методам, описанным в литературе. Соединения изобретения и фармацевтические композиции, содержащие их, являются полезными при лечении расстройств мелатонинергической системы.-3 005766 Фармакологическое исследование соединений изобретения фактически показало, что они являются нетоксичными, имеют высокое сродство к рецепторам мелатонина и значительную активность в отношении центральной нервной системы и микроциркуляции, что дает возможность утверждать, что продукты изобретения являются полезными при лечении стресса, расстройств сна, беспокойств, сезонных эмоциональных расстройств, сердечно-сосудистых патологий, патологий пищеварительной системы, бессонницы и усталости вследствие нарушение суточного ритма организма, шизофрении, острого тревожного состояния с реакцией паники, депрессий, расстройств аппетита, ожирения, бессонницы, боли, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных расстройств, связанных с нормальным или патологическим старением, мигрени, потери памяти, болезни Альцгеймера и расстройств мозгового кровообращения. В другой области активности оказалось, что продукты изобретения могут использоваться при лечении половых дисфункций, что они имеют свойства ингибирования овуляции и иммуномодулирующую активность и что они могут использоваться при лечении раковых опухолей. Соединения предпочтительно будут использоваться при лечении сезонных эмоциональных расстройств, расстройств сна, сердечно-сосудистых патологий, бессонницы и усталости вследствие нарушения суточного ритма организма, расстройств аппетита и ожирения. Например, соединения будут использоваться при лечении сезонных эмоциональных расстройств и расстройств сна. Настоящее изобретение касается также фармацевтических композиций, содержащих, по крайней мере, одно соединение формулы (I) самостоятельно или в комбинации с одним или более фармацевтически приемлемыми эксипиентами. Среди фармацевтических композиций согласно изобретению можно особенно отметить те, которые являются подходящими для перорального, парентерального, назального, под- или чрескожного, ректального, подъязычного, глазного или респираторного применения, особенно таблетки или драже, подъязычные таблетки, сашеты, пакетики, желатиновые капсулы, глоссеты, пилюли, свечи, кремы, мази, кожные гели и питьевые или инъекционные ампулы. Дозировку варьируют в зависимости от пола, возраста и веса пациента, способа применения, природы терапевтического показания или, возможно, сопутствующего лечения, она составляет от 0,01 мг до 1 г в сутки в один или больше приемов. Следующие примеры иллюстрируют изобретение, но никак не ограничивают его. Следующие способы получения приводят к соединениям изобретения или к промежуточным соединениям, которые являются полезными для получения соединений изобретения. Получение 1. N-[2-(7-Гидрокси-1-нафтил)этил]ацетамид. В инертной атмосфере растворяют 27,5 ммоль комплекса ВВr3/Ме 2S в 100 мл дихлорметана и перемешивают в течение 15 мин при комнатной температуре. Добавляют раствор 13,7 ммоль N-[2-(7 метокси-1-нафтил)этил]ацетамида в 50 мл дихлорметана и нагревают реакционную смесь с обратным холодильником в течение 30 ч. После охлаждения реакционную смесь осторожно гидролизуют и упаривают дихлорметан. Потом смесь экстрагируют этилацетатом и объединенные органические фазы промывают водным 1 М раствором гидрокарбоната калия. Органическую фазу высушивают над сульфатом магния и концентрируют. Выделяют соединение, указанное в названии. Белое твердое вещество. Точка плавления: 125-126 С. В соответствии со способом, приведенным выше для получения 1, и с использованием в качестве исходного соединения подходящего субстрата, осуществляют получения 2-14. Получение 2. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]aцетамид. Получение 3. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]циклопропанкарбоксамид. Получение 4. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]-2-фурамид. Получение 5. N-[2-(7-Гидрокси-1-нафтил)этил]бутанамид. Получение 6. N-[2-(5-Гидрокси-1-бензотиен-3-ил)этил]ацетамид. Получение 7. N-[2-(5-Гидрокси-1 Н-пирроло[2,3-b]пирид-3-ил)этил]циклопропанкарбоксамид. Получение 8. N-[2-(5-Гидрокси-1 Н-индол-3-ил)этил]ацетамид. Получение 9. N-[2-(5-Гидрокси-1 Н-пирроло[2,3-b]пирид-3-ил)этил]aцетамид. Получение 10. N-[2-(7-Гидрокси-1-нафтил)этил]циклобутанкарбоксамид. Получение 11. 2,2,2-Трифтор-N-[2-(7-гидрокси-1-нафтил)этил]ацетамид. Получение 12. N-[2-(7-Гидрокси-1-нафтил)этил]-2-фурамид. Получение 13. N-[2-(2-Бензил-5-гидрокси-1H-пирроло[2,3-b]пирид-3-ил)этил]ацетамид. Получение 14. N-[2-(5-Гидрокси-1H-инден-3-ил)этил]пентанамид. Получение 15. N-[2-(5-Меркапто-1-бензофуран-3-ил)этил]ацетамид. Продукт, выделенный в получении 2 (9 ммоль), добавляют с перемешиванием к раствору гидроксида калия (10 ммоль), растворенного в 15 мл воды и 16 мл тетрагидрофурана. Раствор охлаждают с использованием лед/солевой бани и добавляют по каплям при перемешивании в раствор, содержащий 9 ммоль диметилтиокарбамоилхлорида в 15 мл тетрагидрофурана. После перемешивания в течение получаса при охлаждении реакционную смесь экстрагируют хлороформом. Органические фазы объединяют, высушивают над сульфатом магния, отфильтровывают и затем концентрируют при пониженном давлении. Оста-4 005766 ток переносят в дифениловый эфир (10 мл) и нагревают в атмосфере азота с обратным холодильником в течение 1 ч. Дифениловый эфир упаривают при пониженном давлении до получения приблизительно 2 мл раствора. 2 мл дистиллята осторожно выливают, пока он еще горячий, в 50 мл гексана, с получением,после охлаждения, твердого вещества которое выделяют фильтрованием. Твердое вещество, полученное таким образом, переносят в раствор гидроксида калия (380 мг), растворенного в смеси (1 мл/10 мл) вода/метанол. Раствор нагревают с обратным холодильником в течение 12 ч и затем охлаждают и концентрируют при пониженном давлении. Остаток переносят в 20 мл хлороформа и экстрагируют 3 раза водой. Органическую фазу высушивают над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток хроматографируют на силикагеле с получением заглавного соединения. Получение 16. N-[2-(5-Амино-1-бензофуран-3-ил)этил]ацетамид. Стадия А. N-[2-(5-Бром-1-бензофуран-3-ил)этил]ацетамид. Трифенилфосфин (10 ммоль) и ацетонитрил (70 мл) заливают в трехгорлую колбу на 150 мл, оборудованную капельной воронкой, холодильником, на вершине которого установлена хлор кальциевая трубка, и механической мешалкой. Раствор охлаждают с использованием ледяной бани при перемешивании и добавляют бром (10 ммоль). Когда добавление завершено, ледяную баню убирают и затем добавляют продукт выделенный в получении 2 (8 ммоль). Реакционную смесь перемешивают при 60-70 С до исчезновения исходного соединения. В конце реакции смесь отфильтровывают и затем фильтрат концентрируют при пониженном давлении. Остаток переносят в этилацетат, промывают водой затем насыщенным раствором гидрокарбоната калия, еще раз водой и затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаток отфильтровывают через силикагель с получением заглавного соединения. Стадия В. N-[2-(5-Иод-1-бензофуран-3-ил)этил]ацетамид. Смесь продукта, полученного на cтадии А (2 ммоль), йодистого калия (30 ммоль) и иодида меди (I)(10 ммоль) в гексаметилфосфорамиде (6 мл) нагревают при 150-160 С при перемешивании, в атмосфере азота, до достижения 90%-ного превращения. Потом добавляют раствор разбавленной соляной кислоты с последующим добавлением эфира, после этого смесь отфильтровывают, чтобы удалить нерастворимые соли меди (I). Органическую фазу отделяют, промывают раствором сульфита натрия и водой, высушивают над сульфатом магния и упаривают, чтобы получить остаток, который хроматографируют на силикагеле, с получением заглавного соединения. Стадия С. N-[2-(5-Винил-1-бензофуран-3-ил)этил]ацетамид. 15 ммоль продукта, полученного на стадии В, 16 ммоль винилтрибутилолова и 0,43 ммоль тетракис(трифенилфосфин)палладия нагревают в течение 3 ч при 110 С, при перемешивании, в 30 мл Nметилпирролидинона. После удаления растворителя упариванием остаток переносят в 20 мл дихлорметана и обрабатывают водным 10%-ным раствором фтористого калия. Экстрагируют, концентрируют при пониженном давлении и хроматографируют на силикагеле с получением заглавного соединения. Стадия D. N-[2-(5-Формил-1-бeнзофуран-3-ил)этил]aцетамид. Добавляют при комнатной температуре 1,10 г четырехокиси осмия в 2-метил-2-пропаноле и затем 8,70 г периодата натрия к раствору 10 ммоль продукта, полученного на cтадии С, в смеси 50 мл диоксана и 25 мл воды. После перемешивания в течение ночи при комнатной температуре суспензию отфильтровывают и фильтрат концентрируют при пониженном давлении. Полученный остаток переносят в дихлорметан. Органическую фазу промывают водой, высушивают и упаривают. Остаток очищают хроматографированием на силикагеле с получением заглавного соединения. Стадия Е. 3-[2-(Aцетиламино)этил]-1-бензофуран-5-карбоновая кислота. Добавляют при комнатной температуре 2,7 г перманганата калия в 50 мл ацетон/водной смеси(50/50) к раствору 6,88 ммоль продукта, полученного на стадии D, в 30 мл ацетона. Раствор перемешивают в течение 2 ч при комнатной температуре и затем отфильтровывают. Фильтрат концентрируют при пониженном давлении и хроматографируют на силикагеле с получением заглавного соединения. Стадия F. Хлорангидрид 3-[2-(ацетиламино)этил]-1-бензофуран-5-карбоновой кислоты. 5 ммоль продукта, полученного на стадии Е, растворяют в 40 мл хлористого тионила. После перемешивания в инертной атмосфере в течение 1 ч хлористый тионил удаляют упариванием при пониженном давлении с получением заглавного соединения. Стадия G. N-[2-(5-Амино-1-бензофуран-3-ил)этил]ацетамид. Раствор продукта, полученного на стадии F (20 ммоль) в дихлорметане (30 мл), содержащего тетрабутиламмонийбромид (20 мг), охлаждают на ледяной бане. После добавления азида натрия (25 ммоль),растворенного в 5 мл воды, раствор энергично перемешивают при 0 С в течение 2 ч. Органическую фазу отделяют, промывают водой (2 х 5 мл) и высушивают над сульфатом магния. После фильтрования добавляют (30 ммоль) трифторуксусной кислоты и перемешивают раствор с обратным холодильником в течение 60 ч. После охлаждения органическую фазу промывают насыщенным раствором гидрокарбоната натрия (2 х 5 мл) и концентрируют при пониженном давлении. Потом остаток переносят в метанол (20 мл),затем добавляют воду (80 мл) и карбонат калия (30 ммоль). После перемешивания при комнатной температуре в течение 20 ч реакционную смесь концентрируют при пониженном давлении до объема приблизительно 60 мл после этого экстрагируют 3 раза эфиром (3 х 50 мл). После высушивания над сульфатом-5 005766 натрия органическую фазу отфильтровывают и затем упаривают при пониженном давлении. Остаток хроматографируют на силикагеле с получением заглавного соединения. Получение 17. N-[2-(5-Амино-1-бензофуран-3-ил)этил]-2-фурамид. Способ получения является таким же, как в получении 16, начиная с соединения, полученного в получении 4. Получение 18. N-[2-(5-Гидpoкcи-1-мeтил-1H-пирpoлo[2,3-b]пирид-3-нл)этилацeтамид. Способ получения является таким же, как в получении 1. Получение 19. N-[2-(7-Гидрокси-1,2,3,4-тетрагидро-1-нафтил)этил]ацетамид. Способ получения является таким же, как в получении 1. Получение 20. N-2-(5-Гидрокси-1-метил-1H-пирроло[3,2-b]пирид-3-ил)этил]ацетамид. Способ получения является таким же, как в получении 1. Пример 1. Метил 4'-[2-(8-[2-(ацетиламино)этил]-2-нафтилокси)этокси]-[1,1'-бифенил]-4-карбоксилат. Стадия А. N-2-[7-(2-Бромэтокси)нафт-1-ил]этилацетамид. Соединение, выделенное в получении 1 (0,009 моль), растворяют в 20 мл смеси диметилсульфоксида (6 мл) и бутанона (14 мл). Добавляют 0,027 моль карбоната калия и 0,036 моль дибромэтана, затем смесь нагревают с обратным холодильником в течение 48 ч. Потом реакционную смесь охлаждают и выливают в воду. Водную фазу экстрагируют Et2O и затем органическую фазу промывают водой до нейтральной реакции промывных вод, с последующим высушиванием над сульфатом магния и упариванием при пониженном давлении. Полученный остаток очищают хроматографированием на силикагеле (элюант: ацетон/циклогексан (2/8 и перекристаллизовывают. Твердое вещество белого цвета. Точка плавления: 110-111 С. Элементный микроанализ:N Рассчитано: 57,15 5,40 4,17 Найдено: 57,28 5,38 3,91 Стадия В. Метил 4'-[2-(8-[2-(ацетиламино)этил]-2-нафтилокси)этокси]-[1,1'-бифенил]-4-карбоксилат. В круглодонной колбе на 100 мл растворяют 0,003 моль метил 4'-гидрокси[1,1'-бифенил]-4-карбоксилата и 0,003 моль соединения, полученного на стадии А, в смеси 3 мл диметилсульфоксида и 20 мл бутанона. Добавляют 0,009 моль карбоната калия и 1 моль иодида калия кристаллического, затем смесь нагревают с обратным холодильником в течение 12 ч. После этого реакционную смесь охлаждают и выливают в 100 мл воды. Сформированный осадок отсасывают и перекристаллизовывают с получением заглавного соединения. Пример 2. 4'-[2-(8-[2-(Ацетиламино)этил]-2-нафтилокси)этокси]-[1,1'-бифенил]-4-карбоновая кислота. В круглодонную колбу на 100 мл помещают 19 ммоль соединения, полученного в примере 1, суспендированного в 25 мл ТГФ, затем 15 мл метанола, 15 мл воды и 38 ммоль гидроксида натрия. Реакционную смесь выдерживают при комнатной температуре при перемешивании в течение 10 ч. Затем раствор концентрируют, выливают в воду и подкисляют 12 М НСl. Полученный осадок отфильтровывают,промывают водой и перекристаллизовывают с получением заглавного соединения,Пример 3. Метил 4'-[2-(3-[2-(ацетиламино)этил]-1-бензофуран-5-илокси)этокси]-[1,1'-бифенил]-4 карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 2. Пример 4. Метил 4'-2-[(3-2-[(циклопропилкарбонил)амино]этил-1-бензофуран-5-ил)окси]этокси-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 3. Пример 5. Метил 4'-[2-(3-[2-(2-фуроиламино)этил]-1-бензофуран-5-илокси)этокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 4. Пример 6. Метил 4'-[2-(3-[2-(ацетиламино)этил]-1-бензофуран-5-иламино)этокси]-[1,1'-бифенил]4-карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 16. Пример 7. Метил 4'-[2-(8-[2-(бутириламино)этил]-2-нафтилокси)этокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 5. Пример 8. Метил 4'-[2-(3-[2-(ацетиламино)этил]-1-бензотиен-5-илокси)этокси]-[1,1'-бифенил]-4 карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 6.-6 005766 Пример 9. Метил 4'-2-[(3-2-[(циклoпpoпилкapбoнил)aминo]этил-1 Н-пиppoлo-[2,3-b]пирид-5-ил) окси]этокси-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 7. Пример 10. N-2-[7-(2-[4'-(Гидроксиметил)-[1,1'-бифенил]-4-ил]оксиэтокси)-1-нафтил]этилацетамид. Способ получения является таким же, как в примере 1, с заменой на стадии В соединения метил 4'гидрокси[1,1'-бифенил]-4-карбоксилат на 4'-(гидроксиметил)-[1,1'-бифенил]-4-ол. Пример 11. Метил 4'-[2-(3-[2-(ацетиламино)этил]-1H-индол-5-илокси)этокси]-[1,1'-бифенил]-4 карбоксилат. Способ получения является таким же, как в примере 1, с заменой на стадии А соединения, выделенного в получении 1, соединением, выделенным в получении 8. Пример 12. 4'-[2-(3-[2-(Ацетиламино)этил]-1 Н-индол-5-илокси)этокси]-[1,1'-бифенил]-4-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, полученного в примере 11. Пример 13. Метил 4'-[3-(8-[2-(ацетиламино)этил]-2-нафтилокси)пропокси]-[1,1'-бифенил]-4-карбоксилат. Стадия A. N-2-[7-(3-Гидроксипропилокси)нафт-1-ил]этилацетамид. В круглодонной колбе на 100 мл растворяют 0,022 моль соединения, синтезированного в получении 1, в 30 мл диметилформамида. Добавляют 0,066 моль карбоната калия и 0,033 моль 3-бромпропан-1-ола,затем смесь нагревают при 80 С в течение 4 ч. Реакционную смесь охлаждают и выливают в 100 мл 1 М раствора НСl. Водную фазу экстрагируют 3 раза Et2O и затем органическую фазу высушивают надMgSO4 и упаривают при пониженном давлении. Перекристаллизовывают с получением заглавного соединения. Твердое вещество белого цвета. Точка плавления: 141-142 С. Стадия В. 3-(8-[2-(Aцетиламино)этил]-2-нафтилокси)пропилметансульфонат. В круглодонную колбу на 250 мл помещают спирт, полученный на cтадии А, растворенный в 50 мл дихлорметана, и 0,012 моль триэтиламина. Смесь охлаждают на лед/солевой бане при -10 С и затем добавляют 0,012 моль мезилхлорида, по каплям с перемешиванием на магнитной мешалке. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Потом добавляют 100 мл воды и экстрагируют СН 2 Сl2. Органическую фазу промывают водой, высушивают над MgSO4 и упаривают при пониженном давлении. Полученное масло очищают хроматографированием на силикагеле (элюант: ацетон/ циклогексан (2/8. Стадия С. Метил 4'-[3-(8-[2-(ацетиламино)этил]-2-нaфтилокси)пропокси]-[1,1'-бифенил]-4-карбоксилат. В круглодонную колбу на 100 мл, содержащую 30 мл метанола, добавляют маленькими порциями 0,06 г натрия. Когда натрий полностью прореагирует, добавляют 0,0033 моль метил 4'-гидрокси[1,1'бифенил]-4-карбоксилата и смесь перемешивают в течение 20 мин. Метанол удаляют упариванием при пониженном давлении, а остаток переносят в 15 мл ДМФА, затем добавляют 0,0027 моль соединения,полученного на cтадии В. Реакционную смесь нагревают с обратным холодильником в течение 12 ч,охлаждают и выливают в смесь 100 мл воды и 10 мл 3 М НСl. После экстракции этилацетатом органическую фазу промывают 10%-ным раствором гидроксида натрия и затем водой. После высушивания надMgSO4 удаляют растворитель упариванием при пониженном давлении, заглавное соединение очищают хроматографированием на силикагеле. Пример 14. Метил 4'-3-[(8-2-[(циклобутилкарбонил)амино]этил-2-нафтил)окси]пропокси-[1,1'бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 13, начиная с соединения, выделенного в получении 10. Пример 15. Метил 4'-[3-(3-[2-(2-фуроиламино)этил]-1-бензофуран-5-иламино)пропокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 13, начиная с соединения, выделенного в получении 17. Пример 16. 4'-[3-(3-[2-(2-Фуроиламино)этил]-1-бензофуран-5-иламино)пропокси]-[1,1'-бифенил]4-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 15. Пример 17. Метил 4'-3-[(8-2-[(трифторацетил)амино]этил-2-нафтил)окси]пропокси-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 13, с заменой соединения получения 1 на соединение получения 11. Пример 18. 4'-3-[(8-2-[(Трифторацетил)амино]этил-2-нафтил)окси)пропокси-[1,1'-бифенил]-4 карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 17.-7 005766 Пример 19. Метил 4'-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Стадия А. N-2-[7-(4-Бромбутокси)-1-нафтил]этилацетамид. Способ получения является таким же, как на стадии А в примере 1, с заменой дибромэтана на 1,4 дибромбутан. Стадия В. Метил 4'-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как на стадии В в примере 1. Твердое вещество белого цвета. Точка плавления: 166-168 С. Элементный микроанализ:N Рассчитано: 74,61 6,45 2,72 Найдено: 74,62 6,48 2,81 Пример 20. 4'-[4-(8-[2-(Ацетиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 19. Твердое вещество белого цвета. Точка плавления: 223-225 С. Элементный микроанализ:N Рассчитано: 70,83 5,94 2,66 Найдено: 71,16 6,05 2,69 Пример 21. N-2-[7-(4-[4'-(Гидроксиметил)-[1,1'-бифенил]-4-ил]оксибутокси)-1-нафтил]этилацетамид. Способ получения является таким же, как в примере 19, с заменой на стадии В метил 4'гидрокси[1,1'-бифенил]-4-карбоксилата на 4'-(гидроксиметил)-[1,1'-бифенил]-4-ол. Твердое вещество бежевого цвета. Точка плавления: 172-173 С. Элементный микроанализ:N Рассчитано: 76,99 6,88 2,90 Найдено: 76,74 6,70 3,12 Пример 22. N-(2-7-[4-([1,1'-Бифенил]-4-илокси)бутокси]-1-нафтилэтил)ацетамид. Способ получения является таким же, как в примере 19, с заменой на стадии В метил 4'гидрокси[1,1'-бифенил]-4-карбоксилата на [1,1'-бифенил]-4-ол. Твердое вещество белого цвета. Точка плавления: 138-140 С. Элементный микроанализ:N Рассчитано: 79,44 6,89 3,10 Найдено: 79,19 6,93 3,24 Пример 23. N-(2-7-[4-([1,1'-Бифенил]-3-илокси)бутокси]-1-нафтилэтил)ацетамид. Способ получения является таким же, как в примере 19, с заменой на стадии В метил 4'гидрокси[1,1'-бифенил]-4-карбоксилата на [1,1'-бифенил]-3-ол. Твердое вещество белого цвета. Точка плавления: 111-112 С. Элементный микроанализ:N Рассчитано: 79,44 6,89 3,10 Найдено: 79,23 6,79 3,21 Пример 24. Метил 4'-[4-(3-[2-(ацетиламино)этил]-1-бензофуран-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 2. Пример 25. Метил 4'-[4-(3-[2-(ацетиламино)этил]-1-бензотиен-5-илокси)бутокси]-[1,1'-бифенил]4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 6.-8 005766 Пример 26. Метил 4'-[4-(3-[2-(ацетиламино)этил]-1H-пирроло[2,3-b)пирид-5-илокси)бутокси][1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 9. Пример 27. 4'-[4-(3-[2-(Ацетиламино)этил]-1-бензофуран-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 24. Пример 28. 4'-[4-(3-[2-(Ацетиламино)этил]-1-бензотиен-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 25. Пример 29. 4'-[4-(3-[2-(Ацетиламино)этил]-1H-пирроло[2,3-b]пирид-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 26. Пример 30. Метил 4'-[4-(3-[2-(ацетиламино)этил]-2-бензил-1H-пирроло[2,3-b]пирид-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 13. Пример 31. Метил 4'-[4-(8-[2-(2-фуроиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 12. Пример 32. Метил 4'-[4-(3-[2-(пентаноиламино)этил]-1H-инден-5-илокси)бутокси]-[1,1'-бифенил]-4 карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 14. Пример 33. Метил 4'-[4-(3-[2-(ацетиламино)этил]-1-бензофуран-5-илтио)бутокси]-[1,1'-бифенил]4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 15. Пример 34. Метил 4'-[4-(3-[2-(ацетиламино)этил]-1-метил-1H-пирроло[2,3-b]пирид-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 18. Пример 35. Метил 3'-[4-(8-[2-(ацетиламино)этил]-5,6,7,8-тетрагидро-2-нафтилокси)бутокси]-[1,1'бифенил]-3-карбоксилат. Способ получения является таким же; как в примере 19, начиная с соединения, выделенного в получении 19. Пример 36. 3'-[4-(8-[2-(Ацетиламино)этил]-5,6,7,8-тетрагидро-2-нафтилокси)бутокси]-[1,1'-бифенил]-3-карбоновая кислота. Способ получения является таким же, как в примере 2, начиная с соединения, синтезированного в примере 35. Пример 37. Этил 4'-[4-(3-[2-(ацетиламино)этил]-1-метил-1 Н-пирроло[3,2-b]пирид-5-илокси)бутокси]-[1,1'-бифенил]-4-карбоксилат. Способ получения является таким же, как в примере 19, начиная с соединения, выделенного в получении 20, и этил 4'-гидрокси[1,1'-бифенил]-4-карбоксилата. Точка плавления: 145-146 С. Элементный микроанализ:N Рассчитано: 70,30 6,66 7,93 Найдено: 69,84 6,67 7,94 Фармакологическое исследование Пример А. Исследование острой токсичности. Острую токсичность оценивали после перорального применения к группам животных, каждая из которых включала 8 мышей (262 г). Животных обследовали с равными интервалами в течение первого дня и ежедневно в течение последующих 2 недель после обработки. Установленная доза LD50 (доза, которая вызывает смерть 50% животных), показала низкую токсичность соединений представленного изобретения.-9 005766 Пример В. Исследование связывания рецептора мелатонина на Pars tuberalis клетках овец. Исследование связывания рецептора мелатонина соединениями изобретения было проведено согласно обычным методам на Pars tuberalis клетках овец. Pars tuberalis аденогипофиза у млекопитающих фактически характеризуется высокой плотностью рецепторов мелатонина (Journal of Neuroendocrinology,1, стр. 1-4, 1989). Протокол. 1) Pars tuberalis мембраны овец подготавливают и используют в качестве обрабатываемой ткани в экспериментах насыщения, чтобы определить связывающую емкость и сродство для 2-[125I]-индомелатонина. 2) Pars tuberalis мембраны овец используют в качестве обрабатываемой ткани в сравнительных экспериментах насыщения, используя различные тестируемые соединения в сравнении с мелатонином. Каждый эксперимент был проведен 3 раза, с разными концентрациями каждого тестируемого соединения. Результаты после статистической обработки позволяют определить связывающие свойства тестируемого соединения. Результаты. Соединения изобретения показывают наличие сильного сродства к рецепторам мелатонина. Пример С. Изучение связывания мелатонин MT1 и МТ 2 рецепторов. Эксперименты связывания MT1 или MT2 рецепторов проводили с использованием 2-[125I]индомелатонина в качестве радиолиганда сравнения. Удерживаемую радиоактивность определяли с использованием жидкостного сцинтилляционного счетчика. Каждый сравнительный эксперимент связывания был проведен 3 раза с разными тестируемыми соединениями и разными концентрациями каждого тестируемого соединения. Результаты позволяют определить связывающие свойства тестируемых соединений (IC50). Таким образом, значения IC50, определенные для соединений изобретения, показывают связывание одного или другого из МТ 1 и МТ 2 подтипов рецепторов при значении 10 М. Пример D. Действие соединений изобретения на циркадные ритмы двигательной активности крысы. Участие мелатонина во влиянии на большинство физиологических, биохимических и поведенческих циркадных ритмов с чередованием в течение дня/ночи позволило установить фармакологическую модель для исследования мелатонинергических лигандов. Были проверены эффекты соединений в отношении многочисленных параметров, и в частности относительно циркадных ритмов двигательной активности, которые являются надежным индикатором активности эндогенных циркадных часов. В этом исследовании оценивали эффекты соединений на специфической экспериментальной модели, а именно крысу помещали во временную изоляцию (постоянная темнота). Экспериментальный протокол. Одномесячные крысы мужского пола, как только они попадали в лабораторию, подвергались световому циклу 12 ч света в 24 ч (LD 12: 12). После 2-3 недель адаптации их помещали в клетки с установленным колесом, связанным с записывающей системой, чтобы определить фазы двигательной активности и таким образом контролировать суточный (LD) или циркадный (DD) ритмы. Как только записанные ритмы показывали стабильную картину в световом цикле LD 12:12, крыс помещали в постоянную темноту (DD). 2-3 недели спустя, когда свободный курс (ритм, отражающий эндогенные часы) точно установился,крысам назначали ежедневное применение тестируемого соединения. Обследования сделаны посредством наблюдения ритмов активности: влияние светового ритма на ритмы активности,исчезновение влияния на ритмы в постоянной темноте,влияние ежедневного применения соединения; кратковременный или длительный эффект. Пакет программ позволяет измерять продолжительность и интенсивность активности, период ритма животных в течение светового курса и в течение лечения,при необходимости, демонстрировать с помощью спектрального анализа существование циркадной и нециркадной (например, ультрадиановой) компоненты. Результаты. Соединения изобретения отчетливо показывают значительное влияние на циркадный ритм via мелатонинергическую систему. Пример Е. Испытание свет/темнота в клетке. Соединения изобретения тестируют на модели поведения, испытании свет/темнота в клетке, которая позволяет выявить транквилизаторную активность соединений. Оборудование включает две поливиниловые коробки, закрытые Плексигласом. Одна из коробок находится в темноте. Лампу помещают над другой коробкой, подавая интенсивность света приблизительно 4000 люксов в центре коробки. Непрозрачный пластмассовый туннель отделяет освещенную ко- 10005766 робку от темной коробки. Животных тестируют индивидуально с 5-минутными сеансами. Дно каждой коробки очищают перед каждым следующим сеансом. В начале каждого испытания мышь помещают в туннель, поворачивая в сторону темной коробки. Время, потраченное мышью в освещенной коробке, и количество прохождений через туннель фиксировали после первого вхождения в темную коробку. После применения соединений, за 30 мин до начала испытания, соединения изобретения значительно увеличили время, проводимое в освещенной коробке, и количество прохождений через туннель, что указывает на транквилизаторную активность соединений изобретения. Пример F. Активность соединений изобретения на каудальной артерии крысы. Соединения изобретения были проверены in vitro на каудальной артерии крысы. Мелатонинергические рецепторы присутствуют в том сосуде, таким образом обеспечивая релевантную фармакологическую модель для исследования активности мелатонинергического лиганда. Стимуляция рецепторов может вызвать или вазоконстрикцию, или расширение, в зависимости от изучаемого артериального сегмента. Протокол. Одномесячных крыс приучали к циклу свет/темнота 12 ч/12 ч на протяжении 2-3 недель. После умерщвления подопытного животного хвостовую артерию выделили и содержали в высоконасыщенной кислородом среде. После этого артерии канюлировали на обоих концах, подвешивали вертикально в камере для органов в подходящей среде и перфузировали через их проксимальный конец. По изменениям давления в перфузионном потоке оценивали сосудосуживающий или сосудорасширяющий эффект соединений. Активность соединений оценивали на сегментах, которые были предварительно обработаны фенилэфрином (1 M). Кривая концентрация/эффект определялась некумулятивно добавлением концентрации тестируемого соединения на предварительно обработанный сегмент. Когда наблюдаемый эффект достигал равновесия, среду заменяли и подготовленный образец оставляли на 20 мин перед добавлением той же самой концентрации фенилэфрина и затем концентрации тестируемого соединения. Результаты. Соединения изобретения значительно изменяют диаметр хвостовых артерий, предсжатых фенилэфрином. Пример G. Фармацевтическая композиция: таблетки. 1000 таблеток, каждая содержит дозу 5 мг 4'-[4-(8-[2-(ацетиламино)этил]-2 нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоновой кислоты (пример 20) 5 г Пшеничный крахмал 20 г Маисовый крахмал 20 г Лактоза 30 г Стеарат магния 2 г Кремнезем 1 г Гидроксипропилцеллюлоза 2 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1 Соединения формулы (I) в которой В обозначает атом водорода, COOR-группу или СН 2 ОR-группу (в которых R обозначает атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу),G1 обозначает -X'-(CH2)n-X-(CH2)m-X"-цепь, в которой Х обозначает СН 2-группу,X' и X" каждый обозначает атом кислорода,n и m, которые могут быть одинаковыми или разными, каждый представляет 0, 1, 2 или 3,Су обозначает группу формулы (II) в которой D обозначает фенил или пиридин,W обозначает атом кислорода или серы, или СН 2-группу, или NR-группу (в которой R принимает значения, указанные выше),R1 обозначает атом галогена или R, OR или COOR-группу (в которой R принимает значения, указанные выше),- 11005766 и обозначение - - - значит, что связь является одинарной или двойной, следует понимать, что валентность атомов соответствующая,или группу формулы (III) в которой R1 и обозначение - - - такие, как указанно выше,G2 обозначает -СН 2-СН 2- и А обозначает NHCOR'-группу (в которой R' обозначает линейную или разветвленную алкильную группу),их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 2. Соединения формулы (I) по п.1, в которой В обозначает COOR-группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 3. Соединения формулы (I) по п.2, в которой В обозначает COOR-группу, в которой R обозначает атом водорода, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 4. Соединения формулы (I) по п.2, в которой В обозначает COOR-группу, в которой R обозначает линейную или разветвленную (С 1-С 6)алкильную группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 5. Соединения формулы (I) по п.1, в которой В обозначает CH2OR-группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 6. Соединения формулы (I) по п.1, в которой Су обозначает нафталиновую группу, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 7. Соединение формулы (I) по п.1, которое представляет собой метил 4'-[4-(8-[2(ацетиламино)этил]-2-нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоксилат, а также его соли присоединения фармацевтически приемлемых кислот или оснований. 8. Соединение формулы (I) по п.1, которое представляет собой 4'-[4-(8-[2-(ацетиламино)этил]-2 нафтилокси)бутокси]-[1,1'-бифенил]-4-карбоновую кислоту, а также его соли присоединения фармацевтически приемлемых кислот или оснований. 9. Соединение формулы (I) по п.1, которое представляет собой N-2-[7-(4-[4'-(гидроксиметил)[1,1'-бифенил]-4-ил]оксибутокси)-1-нафтил]этилацетамид, а также его соли присоединения фармацевтически приемлемых кислот или оснований. 10. Соединение формулы (I) по п.1, которое представляет собой N-(2-7-[4-([1,1'-бифенил]-4 илокси)бутокси]-1-нафтилэтил)ацетамид, а также его соли присоединения фармацевтически приемлемых кислот или оснований. 11. Соединение формулы (I) по п.1, которое представляет собой N-(2-7-[4-([1,1'-бифенил]-3 илокси)бутокси]-1-нафтилэтил)ацетамид, а также его соли присоединения фармацевтически приемлемых кислот или оснований. 12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (IV) МеО-Су-G2-А(IV),в которой A, G2 и Су принимают значения, указанные для формулы (I),которое подвергают деметилированию, используя обычные агенты, такие как HBr, АlСl3, АlВr3,ВВr3 или двухкомпонентные системы кислота Льюиса/нуклеофил, такие как AlCl3/PhCH2SH или ВВr3/Ме 2S, например, с получением соединения формулы (V) НО-Су-G2-А в которой Hal обозначает атом брома, хлора или иода и X, n и m принимают значения, указанные для формулы (I),с получением соединения формулы (X)(X),в которой A, G2, Су, X, X", n и m принимают значения, указанные выше,гидроксильную функцию, которую превращают стандартным способом в уходящую группу, такую как, например, мезилат, тозилат, или галогенированное соединение, с получением соединения формулы(X'),в которой А, G2, Су, X, X", n и m принимают значения, указанные выше, и Е обозначает мезильную или тозильную группу или атом галогена,которое вступает в реакцию в основной среде с соединением формулы (XI)(XI),в которой X' принимает значения, указанные для формулы (I), и В' может иметь те же значения, что и В,указанные для формулы (I), за исключением группы СООН,с получением соединения формулы (I/a), частного случая соединений формулы (I)(I/a),в которой A, G2, G1, Су и В' принимают значения, указанные выше,соединение формулы (I/a), когда В' обозначает СООН-группу, подвергают гидролизу с получением соединения формулы (I/b), частного случая соединений формулы (I)(I/b),в которой А, G2, G1 и Су принимают значения, указанные выше, и В" обозначает СООН-группу,совокупность соединений (I/a) и (I/b), составляющих соединения формулы (I), при желании, очищают по обычной методике очистки, необязательно разделяют на их изомеры согласно обычной методике разделения и, при желании, преобразуют в соли присоединения с фармацевтически приемлемыми кислотами или основаниями. 13. Фармацевтические композиции, содержащие в качестве активного ингредиента, по крайней мере, одно соединение формулы (I) по любому из пп.1-11 или его фармацевтически приемлемую соль присоединения с кислотой или основанием в сочетании с одним или более фармацевтически приемлемым эксципиентом. 14. Применение фармацевтической композиции, содержащей в качестве активного ингредиента по крайней мере одно соединение формулы (I) по любому из пп.1-11 или его фармацевтически приемлемую соль присоединения с кислотой или основанием в сочетании с одним или более фармацевтически приемлемым эксципиентом для лечения расстройств, связанных с мелатонинергической системой.
МПК / Метки
МПК: C07C 233/18, C07D 307/81, A61K 31/165
Метки: композиции, соединения, способ, содержащие, бифенила, получения, фармацевтические, замещенные
Код ссылки
<a href="https://eas.patents.su/14-5766-zameshhennye-soedineniya-bifenila-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные соединения бифенила, способ их получения и фармацевтические композиции содержащие их</a>
Предыдущий патент: Высококонцентрированные стабильные растворы мелоксикама
Следующий патент: Перорально вводимая система контролируемой доставки лекарственного средства, обеспечивающая временной и пространственный контроль
Случайный патент: Полипептиды и пути биосинтеза