Стероиды с фторированной 17α-алкильной цепью, обладающие антигестагенным действием
Номер патента: 3092
Опубликовано: 26.12.2002
Авторы: Шведе Вольфганг, Клар Ульрих, Нееф Гюнтер, Фурманн Ульрике, Клеве Арвед, Хвалисц Кристоф, Шнейдер Мартин, Хесс-Штумпп Хольгер
Формула / Реферат
1. 17a-фторалкильные стероиды общей формулы I
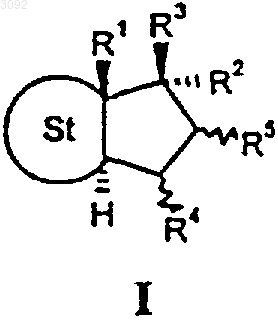
в которой
R1 представляет собой метильную либо этильную группу,
R2 представляет собой остаток формулы СnFmНo, где n равно 2, 3, 4, 5 или 6, m>1 и m+o=2n+1,
R3 представляет собой свободную этерифицированную либо эстерифицированную гидроксильную группу,
R4 и R5 каждый обозначает атом водорода, а оба вместе образуют дополнительную связь или представляют собой метиленовую группу,
St обозначает стероидную циклическую систему АВС частичной формулы А, В или С
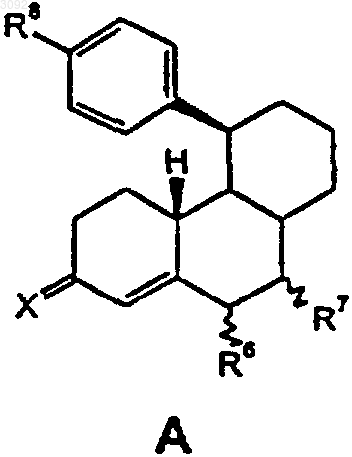
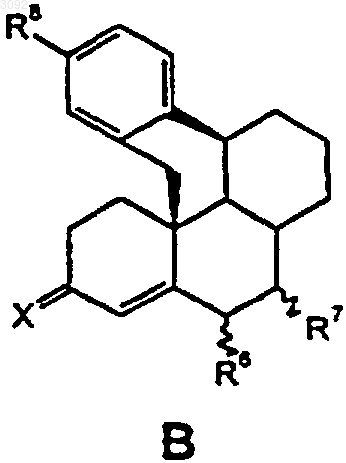
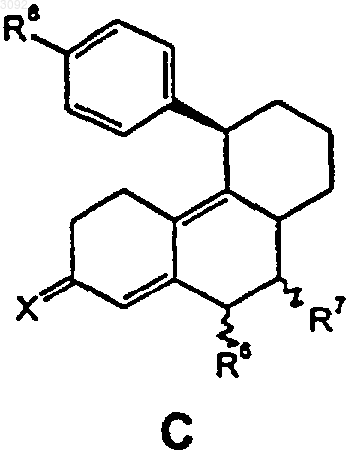
где R6 представляет собой атом водорода, прямоцепную С1-С4- либо разветвленную С3-С4алкильную группу или атом галогена,
R7 представляет собой атом водорода, прямоцепную С1-С4- либо разветвленную С3-С4алкильную группу или если St обозначает стероидную циклическую систему АВС частичной формулы А или В, то R6 и R7 оба вместе, кроме того, образуют дополнительную связь,
Х обозначает атом кислорода, гидроксииминогруппировку =N~OH или два атома водорода,
R8 представляет собой остаток Y либо необязательно многократно замещенный группой Y арильный остаток, где Y обозначает атом водорода, атом галогена, -ОН, -NO2, -N3, -CN, -NR9aR9b, -NHSO2R9, -CO2R9, С1-С10алкильную, С1-С10алкокси-, С1-С10алканоилокси-, бензоилокси-, С1-С10алканоильную, C1-С10гидроксиалкильную или бензоильную группу, a R9a и R9b являются идентичными либо разными и аналогично R9 обозначают атом водорода или С1-С10алкильную группу,
и в случае остатков -NR9aR9b также их физиологически приемлемые соли с кислотами, а в случае остатков -CO2R9 при R9, обозначающем атом водорода, а также их физиологически приемлемые соли с основаниями.
2. 17a-Фторалкильные стероиды по п.1, где St обозначает стероидную циклическую систему частичной формулы А.
3. 17a-Фторалкильные стероиды по п.1, где St обозначает стероидную циклическую систему частичной формулы В.
4. 17a-Фторалкильные стероиды по п.1, где St обозначает стероидную циклическую систему частичной формулы С.
5. 17a-Фторалкильные стероиды по п.1, где n равно 2, 3 или 4.
6. 17a-Фторалкильные стероиды по п.5, где о равно 0.
7. 17a-Фторалкильные стероиды по п.6, где n равно 2.
8. 17a-Фторалкильные стероиды по п.1, где R3 представляет собой свободную гидроксильную группу.
9. 17a-Фторалкильные стероиды по п.1, где R8 представляет собой один из остатков Y.
10. 17a-Фторалкильные стероиды по п.9, где Y представляет собой С1-С10ацильную группу.
11. 17a-Фторалкильные стероиды по п.10, где Y представляет собой формильную, ацетильную или пропионильную группу.
12. 17a-Фторалкильные стероиды по п.9, где Y представляет собой C1-С10гидроксиалкильную группу.
13. 17a-Фторалкильные стероиды по п.12, где Y представляет собой гидроксиметильную или 1-гидроксиэтильную группу.
14. 17a-Фторалкильные стероиды по п.9, где Y представляет собой гидроксильную группу.
15. 17a-Фторалкильные стероиды по п.9, где Y представляет собой ацетилоксигруппу.
16. 17a-Фторалкильные стероиды по п.9, где Y представляет собой метоксикарбонильную группу.
17. 17a-Фторалкильные стероиды по п.1, где R8 представляет собой замещенный группой Y арильный остаток.
18. 17a-Фторалкильные стероиды по п.17, где арильный остаток представляет собой фенил, нафталинил, фуранил, бензофуранил, тиенил или пиридинил.
19. 17a-Фторалкильные стероиды по п.18, где R8 представляет собой 4-цианфенильный остаток.
20. 17a-Фторалкильные стероиды по п.18, где R8 представляет собой 4-галогенфенильный остаток.
21. 17a-Фторалкильные стероиды по п.20, где R8 представляет собой 4-фторфенильный остаток.
22. 17a-Фторалкильные стероиды по п.1, где R4 и R5 каждый представляет собой атом водорода.
23. 17a-Фторалкильные стероиды по п.1, где R4 и R5 оба вместе образуют дополнительную связь.
24. 17a-Фторалкильные стероиды по п.1, где R6 и R7 каждый представляет собой атом водорода.
25. 17a-Фторалкильные стероиды по п.1, а именно
11b-(4-ацетилфенил)-17b-гидрокси-17a-(1,1,2,2,2-пентафторэтил)эстр-4-ен-3-он;
11b-(4-ацетилфенил)-17b-гидрокси-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он;
11b-(4-ацетилфенил)-17b-гидрокси-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9,15-триен-3-он;
6'-ацетил-9,11a-дигидро-17b-гидрокси-17a-(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]эстр-4-ен-3-он;
4-[9,11a-дигидро-17b-гидрокси-3-оксо-17a-(1,1,2,2,2-пентафтоpэтил)-4'H-нaфт[3',2',1':10,9,11]эcтp-4-eн-6'-ил]бeнзoнитpил;
9,11a-дигидро-6'-(4-фторфенил)-17b-гидрокси-17a-(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]эстр-4-ен-3-он;
17b-гидрокси-11b-(4-гидроксифенил)-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он;
11b-[4-(ацетилокси)фенил]-17b-гидрокси-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он;
17b-гидрокси-11b-[4-(гидроксиметил)фенил]-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он;
4-[17b-гидрокси-3-оксо-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-11b-ил]бензальдегид;
метиловый эфир 4-[17b-гидрокси-3-оксо-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-11b-ил]бензойной кислоты;
17b-гидрокси-11b-[4-(1-гидроксиэтил)фенил]-17a-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он.
26. Фармацевтические препараты, содержащие, по меньшей мере, один 17a-фторалкильный стероид общей формулы I по п.1 и один фармацевтически приемлемый носитель.
27. Фармацевтические препараты по п.26, содержащие дополнительно, по меньшей мере, одно соединение с антиэстрогенным действием.
28. Применение 17a-фторалкильных стероидов общей формулы I по п.1 для изготовления лекарственных средств.
29. Применение по п.28 дополнительно с использованием соединения с антиэстрогенным действием.
Текст
1 Настоящее изобретение относится к обладающим антигестагенным действием стероидам с фторированной 17-алкильной цепью, к способу их получения, к содержащим их фармацевтическим препаратам и к их применению для изготовления лекарственных средств. Объектом изобретения являются 17 фторалкильные стероиды общей формулы I в которой R1 представляет собой метильную либо этильную группу,R2 представляет собой остаток формулы СnFmНo, где n равно 2, 3, 4, 5 или 6, m1 иm+о=2n+1,R3 представляет собой свободную, этерифицированную либо эстерифицированную гидроксильную группу,R4 и R5 каждый обозначает атом водорода,а оба вместе образуют дополнительную связь или представляют собой метиленовую группу,St обозначает стероидную циклическую систему АВС частичной формулы А, В или СR6 представляет собой атом водорода,прямоцепную С 1-С 4- либо разветвленную С 3-С 4 алкильную группу или атом галогена,R7 представляет собой атом водорода,прямоцепную С 1-С 4- либо разветвленную С 3-C4 алкильную группу, или, если St обозначает стероидную циклическую систему АВС частичной формулы А или В, то R6 и R7 оба вместе, кроме того, образуют дополнительную связь,Х обозначает атом кислорода, гидроксииминогруппировку =NOH или два атома водорода,R8 представляет собой остаток Y либо необязательно многократно замещенный группой 2 С 1-С 10 алкокси-, С 1-С 10 алканоилокси-, бензоилокси-, С 1-С 10 алканоильную, С 1-С 10 гидроксиалкильную или бензоильную группу, а R9a и R9b являются идентичными либо разными и аналогично R9 обозначают атом водорода или С 1 С 10 алкильную группу,и в случае остатков -NR9aR9b относится также к их физиологически приемлемым солям с кислотами, а в случае остатков -CO2R9 при R9,обозначающем атом водорода, также к их физиологически приемлемым солям с основаниями. Указанные для остатков R6 и R7 волнистые линии означают, что соответствующий заместитель может находиться в - либо -положении. Под указанными в контексте настоящего описания в качестве R6 и R7 алкильными группами имеются в виду метил, этил, н- либо изопропил, н-, изо- либо трет-бутил. Касательно других С 1-С 10 алкильных групп Y, R9, R9a, R9b в дополнение к названным значениям следует назвать также высшие гомологи, такие, например, как пентил, неопентил, группы от гексильной до децильной. Под понятие "С 1-С 10 алкильные группы" подпадают и карбоциклические или алкилциклоалкильные группы с числом атомов углерода до 10, например, циклопропил,циклопентил, циклогептил, метилциклопропил,метилциклопентил или метилциклогексил. К предпочтительным во всех вышеуказанных случаях относятся метальная или этильная группы. С 1-С 10 алкоксигруппы представляют собой производные вышеназванных алкильных групп с удлиненной одним атомом кислорода цепью,т.е., например, метокси, этокси, н- либо изопропокси, н-, изо- либо трет-бутокси. Под С 1-С 10 алканоилом имеются в виду ацильные остатки прямоцепных и разветвленных С 1-С 10 алканкарбоновых кислот, т.е., например, формил, ацетил, пропионил, бутирил или изобутирил и т.д. С 1-С 10 алканоилоксиостатки представляют собой указанные выше алканоильные остатки с удлиненной одним атомом кислорода цепью,т.е. ацетилокси, пропионилокси, бутирилокси. Если в качестве заместителя указан атом галогена, то под этим подразумевается атом фтора, хлора либо брома. Предпочтителен из них фтор. Для остатков R2 следует предпочесть перфторированные боковые цепи с длиной n, равной 2-4, а среди них в свою очередь наиболее предпочтителен пентафторэтильный фрагмент.R3 представляет собой в первую очередь свободную гидроксильную группу. В случае этерифицированной или эстерифицированной гидроксильной группы в качестве 17-заместителя последняя предпочтительно этерифицирована С 1-С 10 алкильной группой или эстерифицирована С 1-С 10 алканоильной группой. Для этих алкильной, соответственно алканоильной групп 3 справедливы те же значения, которые указаны выше. Этерификацию, соответственно эстерификацию гидроксильной группы осуществляют по методам, известным специалисту в данной области техники.R4 и R5 предпочтительно обозначают каждый атом водорода, а оба вместе образуют дополнительную связь. Если R8 обозначает группу Y, то последняя представляет собой предпочтительно С 1-С 10 алканоильную либо (1-гидрокси)-С 1-С 10 алкильную группу, причем особенно предпочтительны из этих групп ацетил и пропионил. К предпочтительным карбоциклическим или гетероциклическим арильным остаткам относятся фенил, 1- либо 2-нафталинил, 2- либо 3 фуранил, 2- либо 3-бензофуранил, 2- либо 3 тиенил, 2-, 3- либо 4-пиридинил. В качестве замещенных арильных остатков R8 следует назвать в первую очередь 4-цианфенил и 4 галогенфенил, прежде всего 4-фторфенил. Среди всех указанных для R8 в качестве предпочтительных остатков особенно предпочтительно его значение Y, где Y в свою очередь особенно предпочтительно обозначает ацетил. Согласно изобретению к наиболее предпочтительным относятся представленные ниже следующие соединения: 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстр-4-ен-3-он; 4'-[17-гидрокси-3-оксо-17-(1,1,2,2,2 пентафторэтил)эстр-4-ен-11-ил][1,1'-бифенил]4-карбонитрил; 11-(4'-фтор[1,1'-бифенил]-4-ил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстр-4-ен-3 он; 17-гидрокси-17-(1,1,2,2,2-пентафторэтил)-11-[4-(3-пиридинил)фенил]эстр-4-ен-3 он; 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстра-4,15-диен-3-он; 4'-[17-гидрокси-3-оксо-17-(1,1,2,2,2 пентафторэтил)эстра-4,15-диен-11-ил][1,1'бифенил]-4-карбонитрил; 11-(4'-фтор[1,1'-бифенил]-4-ил)-17 гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра 4,15-диен-3-он; 17-гадрокси-17-(1,1,2,2,2-пентафторэтил)-11-[4-(3-пиридинил)фенил]эстра-4,15 диен-3-он; 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он; 4'-[17-гидрокси-3-оксо-17-(1,1,2,2,2 пентафторэтил)эстра-4,9-диен-11-ил][1,1'-бифенил]-4-карбонитрил; 11-(4'-фтop[1,1'-бифeнил]-4-ил)-17 гидpoкcи-17-(1,1,2,2,2-пентафторэтил)эстра 4,9-диен-3-он; Введение фторированных боковых цепей в положении 17 осуществляют аналогично методам, многократно описанным для других боковых цепей, путем нуклеофильного присоединения металлоорганического соединения формулы МСnFmНo к 17-кетону общей формулы II,где М представляет собой такой металл, например, как Li, Na, К, Mg-галоген (галоген =Сl, Вr,I) или другие металлы, a n, m и о имеют значения, уже указанные в общей формуле I. Предпочтительным является присоединение реагентов Гриньяра (СnFmНoMg-галоген), соответственно литийорганических соединений типаLiСnFmНo. Для введения перфторированных боковых цепей особенно пригоден метод генерирования литийорганических реагентов, осуществляемый исходя из соответствующих иодидов с помощью комплекса метиллитий/бромид лития (см. Journ. Org. Chem. 1987, 52, 2481 и Tetrahedron Lett. 1985, 26, 5243). Указанные в общей формуле II заместители R1, R4, R5 и St имеют значения, указанные выше в общей формуле I, причем содержащиеся 6 в St функциональные группы при необходимости могут защищаться с помощью методов, известных специалисту в данной области техники. В частности карбонильные группы, как, например, 3-кетогруппировку, в большинстве случаев можно защищать соответствующим образом,например, за счет образования соответствующего кеталя либо путем восстановления до гидроксильной группы и необязательно перевода этой гидроксильной группы в простой или сложный эфир. В качестве кетальзащитной группы можно назвать, например, этилендиокси- или 2,2 диметилпропилен-1,3-диоксигруппу. В равной степени приемлемы и другие обычные кетозащитные группы. В случае защищенной гидроксильной группы последняя может быть защищена, например, в форме метоксиметилового,метоксиэтилового, тетрагидроксипиранилового либо силилового эфира. Отщепление защитной группы и окисление свободной гидроксильной группы приводят к высвобождению кетогруппы. Затем на соответствующей стадии после присоединения 17-боковой цепи защитные группы по известной технологии удаляют и при необходимости гидроксильную группу окисляют до сопряженной кетогруппы. Присоединение 17-боковой цепи можно проводить выборочно также в присутствии других свободных карбонильных групп, в том числе и 3-кетогруппы. Материалы общей формулы II, служащие исходными для получения соединений общей формулы I, описаны в целом ряде патентов, патентных заявок и в других публикациях: ЕР-А 0057115, ЕР-А 0129499, ЕР-А 02592489, ЕР-А 0186834, ЕР-А 0447014, ЕР-А 0116974, ЕР-А 0190759, ЕР-А 0147361, ЕР-А 192598. ЕР-А 0283428, ЕР-А 0404283, WO-A 89/00578, WO-A 91/18917, WO-A 91/18918, WO-A 92/11277, WOA 92/11278, WO-A 93/23020, Steroids 44 (1984),349; можно сослаться и на другие, известные специалисту источники, касающиеся данного вопроса. В вышеуказанных охранных документах описано введение остатков, подобных заявляемым в настоящем изобретении остаткам R4, R5,R6, R7 и R8. В принципе присоединение боковой цепи можно осуществлять на любой промежуточной стадии синтеза с помощью свободной 17 кетогруппы. В случае введения фторированной 17-алкильной боковой цепи на одной из ранних промежуточных стадий синтеза другие указанные в St остатки R6, R7 и R8 можно вводить в присутствии этой 17-боковой цепи по известным методам, описанным, в частности, в вышеупомянутых патентах, патентных заявках и других публикациях. Новые соединения общей формулы I являются ценными фармакологическими биологически активными веществами. Они отличаются 7 исключительно высокой антигестагенной эффективностью. Они представляют собой конкурентные антагонисты прогестерона, поскольку вытесняют прогестерон из его рецептора. В то же время, если они и проявляют другие эндокринные побочные действия, как, например, андрогенная, эстрогенная или антиглюкокортикоидная активность, то лишь в крайне незначительной степени. Поэтому соединения по изобретению могут применяться в медицинских целях. Соединения с антигестагенным действием(конкурентные антагонисты прогестерона) впервые приобрели известность в 1982 г. (см.RU 486=ЕР-А 0057115) и за истекший период времени были неоднократно описаны, в частности, в указанных выше источниках. Однако среди всех описанных в публикациях соединений отсутствуют таковые с многократно фторированной, содержащей, по меньшей мере, 2 атома углерода 17-алкильной боковой цепью, и лишь в WO 83/03099 говорится о том, что предлагаемые в этой заявке 3-кето-4,9-19-норстероиды могут нести 17-алкильную боковую цепь, которая необязательно может быть замещена атомом галогена. Фтор же в качестве галогена вообще не указывается. Таким образом, конкретных примеров касательно 17-алкильной цепи,содержащей, по меньшей мере, 2 атома углерода, на сегодняшний день нет. Активные вещества такого типа с ярко выраженной антигестагенной активностью пригодны для провоцирования абортов (выкидышей) в силу того, что они вытесняют из рецептора прогестерон, необходимый для сохранения беременности. Поэтому их ценность и перспективность для применения в целях контроля фертильности (репродуктивной способности) после полового сношения совершенно очевидны. Предлагаемые в изобретении соединения общей формулы I могут применяться также для изготовления препаратов, предназначенных для предупреждения беременности (контрацепции) у женщин (ср. WO-A 93/23020 и WO-A 93/21927). Кроме того, они могут применяться для борьбы с нарушениями жизненно важных циклов, обусловленными гормональными причинами, для инициирования менструации и стимулирования родов. Касательно других показаний к применению в области гинекологии можно назвать гормонозамещающую терапию(WO-A 94/18983), лечение болей, сопутствующих дисменорее, и эндометриоза (ЕР-а 0266303), а также для лечения миом. Соединения по изобретению на позитивных рецепторах прогестерона при исследовании на моделях рака молочной железы у грызунов и человека проявляют высокую противоопухолевую активность. Их антипролиферативное действие наблюдалось in vitro на линии T47D раковых клеток молочной железы человека. In vivo 8 ингибирующие развитие опухоли эффекты были подтверждены на опухоли МХТ грудной железы мыши и на моделях карциномы грудной железы крысы, индуцированной химическим путем с помощью НММ (N-нитрозометилмочевины) или ДМБА (диметилбензантрацена). Соединения по изобретению пригодны поэтому для наиболее эффективного лечения гормонозависимых карцином, таких, например, как рак молочной железы, на позитивных рецепторах прогестерона. Предлагаемые в изобретении соединения могут применяться для терапии гормонозависимых злокачественных опухолей как при первичной терапии, так и при вторичной терапии, прежде всего при недостаточности тамоксифена. Обладающие антигестагенным действием соединения общей формулы I по изобретению могут применяться также в сочетании с обладающими антиэстрогенным действием соединениями для изготовления фармацевтических препаратов, предназначенных для лечения гормонозависимых опухолей (ср. ЕР-А 0310542),для стимулирования родов, для прерывания беременности, а также для лечения гинекологических нарушений (ср. ЕР-А 0310541) и для контрацепции у женщин (ср. WO 96/19997). При лечении гормонозависимых опухолей антигестаген и антиэстроген могут вводиться в организм одновременно либо последовательно. При последовательном введении предпочтительно начинать с антиэстрогена, а затем переходить к антигестагену. Для комбинированного применения с антигестагенами согласно изобретению можно использовать при этом, например,следующие антиэстрогены: тамоксифен, ICI 182.780 (=7[9-(4,4,5,5,5-пентафторпентилсульфинил)нонил]эстра-1,3,5(10)-триен-3,17-диол),описанные в РСТ/ЕР 97/04517 антиэстрогенные соединения и ингибиторы ароматазы, например,фадрозол, форместан, летрозол, анастрозол или атаместан. Экспериментальному исследованию были подвергнуты следующие антигестагены: А: 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстр-4-ен-3-он (пример 1); Б: 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он(пример 3); В: 6'-ацетил-9,11-дигидро-17-гидрокси 17-(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11] эстр-4-ен-3-он (пример 5); Г: 11-[4-(диметиламино)фенил]-17-гидрокси-17-(1-пропил)эстра-4,9-диен-3-он (RU 38486); Д: 11-(4-ацетилфенил)-19,24-динор-17,23 эпокси-17-хола-4,9,20-триен-3-он (Org 33628). Все представленные ниже тесты проводили по известным методам на крысах. 9 Тест на абортирование s.c. и р.о.: см., например, ЕР-А 0283428. Тест на андроген р.о.: стимулирование роста простаты в весовом выражении с помощью испытуемого соединения, лекарственная форма в виде раствора: s.c. бензилбензоат/ касторовое масло (1+4); p.o. NaCl-Myrj; известное соединение для сравнения: пропионат тестостерона. Вплоть до дозировки 10 мг испытуемое соединение/животное/день стимулирование роста простаты практически не наблюдалось. 10 Тест по исследованию роста матки p.o. на эстрогенное действие: стимулирование роста матки в весовом выражении с помощью испытуемого соединения, лекарственная форма в виде раствора: s.c. бензилбензоат/касторовое масло (1+4); p.o. NaCl-Myrj; обработка овариэктомированных животных в течение 3 дней; параметры: рост матки в весовом выражении и высота эпителия эндометрия; вагинальный мазок отрицательный; известное соединение для сравнения: эстрадиол 0,1 мкг. Антитимолизный р.о. на антиглюкокортикоидное действие: см., например, ЕР-А 0283428 Соед.А Соед. Б Соед. В Соед. Г Тест на абортирование крысы, s.c.,0,3 (4/4) 0,3 (4/4) 0,3 (4/4) 3 (4/4) доза [мг/животное/день] 0,1 (4/4) 0,1 (4/4) 0,1 (4/4) 1 (3/4)(n абортированных/n общее) 0,03 (4/4) 0,03 (4/4) 0,03 (4/4) 0,3 (0/6) Тест на абортирование крысы, р.о.,0,3 (4/4) 0,3 (4/4) 0,3 (4/4) 3 (4/4) доза [мг/животное/день] 0,1 (4/4) 0,1 (4/4) 0,1 (4/4) 1 (2/4)(% стимулирования роста простаты) 1 (1,6) Тест на рост матки крысы, р.о., доза 10 (3,7) 10 (2,6) 10 (4,4) 10 (6,4)(% отмены индуцированной дексаме 1 (6,0) 1 (1,2) 2,2 (7,2) 1 (19) тазоном супрессии тимуса) Примечание: "не опр." означает не определяли. В соответствии с вышеизложенным изобретение относится также к лекарственным средствам на основе фармацевтически приемлемых, т.е. в применяемой дозировке не токсичных соединений общей формулы I, необязательно в сочетании с антиэстрогеном, совместно с обычными вспомогательными веществами и носителями. Настоящее изобретение относится далее к применению соединений общей формулы I, необязательно в сочетании с антиэстрогеном, для изготовления лекарственных средств. Из соединений по изобретению по известным методам галеники могут изготавливаться фармацевтические препараты для энтерального,чрескожного, парентерального или местного назначения. Их можно вводить в организм в виде таблеток, драже, желатиновых капсул, гранулятов, суппозиториев, имплантатов, предназначенных для инъекции стерильных водных либо масляных растворов, суспензий или эмульсий, мазей, кремов и гелей или с помощью внутривагинальных (например, вагинальных колец) либо внутриматочных систем (пессарии,спирали). При этом активное(ые) вещество(ва) можно смешивать с обычными используемыми в галенике вспомогательными веществами, такими, например, как гуммиарабик, тальк, крахмал, маннит, метилцеллюлоза, лактоза, и тензидами (ПАВ), как, например, Tween или Myrj, Соед.Д 0,3 (4/4) 0,1 (3/4) 0,03 (0/4) 0,3 (4/4) 0,1 (4/4) 0,03 (0/4) 10 (4,4) 3 (5,6) 1 (4,0) 10 (2,4) 3 (1,3) 10 (44,7) 3 (19,1) 1 (4,3) стеарат магния, с водными либо неводными носителями, производными парафина, смачивателями, диспергаторами, эмульгаторами, консервантами и ароматизаторами в качестве коррегентов вкуса (например, эфирные масла). Унифицированная доза содержит активное(ые) вещество(ва) в количестве от 0,1 до 100 мг. Суточная доза соединений по изобретению составляет для человека от 0,1 до 400 мг. Ниже настоящее изобретение более подробно поясняется на примерах. Пример 1. 11-(4-Ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстр-4-ен-3 он. 1 а) 3,3;17,17-бис[1,2-Этандиилбис(окси)]11-[4-(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфонил]окси]фенил]эстр-5-ен. К раствору из 6 г 4-[3,3;17,17-бис[1,2-этандиилбис(окси)]эстр-5-ен-11-ил]фенола, получение которого описано в WO 91/18917 и WO 91/18918, в 100 мл абсолютного тетрагидрофурана при 0 С добавляют 9,2 мл 1,6-молярного раствора бутиллития в гексане. Далее оставляют в течение 30 мин при 0 С для перемешивания,после чего добавляют 5 мл 1,1,2,2,3,3,4,4,4 нонафтор-1-бутансульфонилфторида. Затем перемешивают в течение 1 ч при 0 С. Реакционную смесь сливают на насыщенный водный раствор гидрокарбоната натрия. Затем экстрагируют этилацетатом, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют под вакуу 11 мом. После колоночной хроматографии сырого продукта на силикагеге с помощью смеси гексан/этилацетат получают 8,2 г соединения 1 а) в виде белого пенистого вещества. 1(J=5 Гц, 1 Н, Н-6); 4,00-3,80 m (8H, кеталь); 3,50 ушир. dd (J=7 Гц + 5 Гц, 1 Н, Н-11); 0,53 s (3 Н,Н-18). 1 б) 3,3-[1,2-Этандиилбис(окси)]-11-[4(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфонил] окси]фенил]эстр-5-ен-17-он. 8,2 г описанного в 1 а) соединения перемешивают с 22 г силикагеля и 2 мл насыщенного водного раствора щавелевой кислоты в 85 мл дихлорметана в течение 5 ч при комнатной температуре. Затем фильтруют через броунмиллерит. Далее концентрируют под вакуумом и сырой продукт очищают путем кристаллизации из диизопропилового эфира. Таким путем получают 5,3 г указанного в заголовке 1 б) соединения в виде белых кристаллов. 1(J=5 Гц, 1 Н, Н-6); 4,00-3,88 m (4H, кеталь); 3,52 ушир. dd (J=7 Гц + 5 Гц, 1 Н, Н-11); 0,55 s (3 Н,Н-18). 1 в) 3,3-[1,2-Этандиилбис(окси)]-11-[4(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфонил] окси]фенил]-17-(1,1,2,2,2- пентафторэтил)эстр 5-ен-17-ол. 1 мл конденсированного пентафторэтилиодида смешивают с раствором из 691 мг соединения 1 б) в 10 мл абсолютного диэтилового эфира при -78 С. При этой температуре добавляют 4,77 мл 1,5-молярного раствора комплекса метиллитий-бромид лития в диэтиловом эфире. Затем перемешивают в течение 1 ч при -78 С,после чего реакционную смесь сливают на насыщенный водный раствор гидрокарбоната натрия. Далее экстрагируют этилацетатом, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют под вакуумом. После хроматографии полученного сырого продукта на силикагеле с помощью смеси из гексана/этилацетата получают 719 мг указанного в заголовке 1 в) соединения в виде белого пенистого вещества. 1(1-этоксиэтенил)трибутилстаннана, 41 мг тетракис(трифенилфосфин)палладия (0), 263 мг хлорида лития и 0,1 мл пиридина в 12 мл диоксана кипятят в течение 1,5 ч с обратным холодильни 003092 12 ком. Затем реакционную смесь сливают на воду. Далее экстрагируют этилацетатом и к органической фазе добавляют насыщенный водный раствор хлорида аммония и 3 мл насыщенного водного раствора щавелевой кислоты. Далее перемешивают в течение 30 мин при комнатной температуре, после чего органическую фазу отделяют и промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем сушат над сульфатом натрия и концентрируют под вакуумом. После колоночной хроматографии полученного сырого продукта на силикагеле с помощью смеси из гексана/этилацетата получают 440 мг указанного в заголовке 1 г) соединения. 1(J=5 Гц, 1H, Н-6); 3,88-4,00 m (4H, кеталь); 3,55 ушир. dd (J=7 Гц + 5 Гц, 1 Н, Н-11); 2,61 s (3 Н,ацетил); 0,62 s (3 Н, Н-18). 1 д) 11-(4-Ацетилфенил)-17-гидрокси 17-(1,1,2,2,2-пентафторэтил)эстр-4-ен-3-он. 440 мг соединения 1 г) растворяют в 10 мл ацетона, после чего добавляют 1 мл 4 н. водной соляной кислоты и перемешивают в течение 1,5 ч при комнатной температуре. Затем реакционную смесь сливают на насыщенный раствор гидрокарбоната натрия. Далее экстрагируют дихлорметаном, органическую фазу промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют под вакуумом. После колоночной хроматографии полученного сырого продукта на силикагеле с помощью смеси из гексана/этилацетата получают 311 мг указанного в заголовке 1 д) соединения в виде пенистого вещества белого цвета. 1(3 Н, Н-18). Пример 2. 11-(4-Адетилфенил)-17-гидрокси-17-(1,1,2,2,3,3,4,4,4-нонафторбутил) эстр-4-ен-3-он. 2 а) 3,3,-[1,2-Этандиилбис(окси)]-17(1,1,2,2,3,3,4,4,4-нонафторбутил)-11-[4-(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфонил]окси]фенил]эстр-5-ен-17-ол. Аналогично примеру 1 в) 691 мг соединения 1 б) в 15 мл абсолютного диэтилового эфира подвергают взаимодействию с реагентом, образованным из 0,52 мл 1-иод-1,1,2,2,3,3,4,4,4 нонафторбутана и 1,67 мл 1,5-молярного раствора комплекса метиллитийбромид лития в диэтиловом эфире. После хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 838 мг указанного в заголовке 2 а) соединения в виде пенистого вещества белого цвета.(1-этоксиэтенил)трибутилстаннана, 43 мг тетракис(трифенилфосфин) палладия (0), 272 мг хлорида лития и 0,1 мл пиридина в 12 мл диоксана. После переработки и обработки насыщенным водным раствором хлорида аммония и насыщенным водным раствором щавелевой кислоты и после колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 505 мг указанного в заголовке 2 б) соединения в виде пенистого вещества белого цвета. 1(J=5 Гц, 1 Н, H-6); 3,88-4,00 m (4H, кеталь); 3,55 ушир. dd (J=7 Гц + 5 Гц, 1H, Н-11); 2,61 s (3H,ацетил); 0,63 s (3H, Н-18). 2 в) 11-(4-Ацетилфенил)-17-гидрокси 17-(1,1,2,2,3,3,4,4,4-нонафторбутил)эстр-4-ен 3-он. Аналогично примеру 1 д) 505 мг соединения 26) подвергают взаимодействию с 4 н. соляной кислотой в ацетоне. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 372 мг указанного в заголовке 2 в) соединения в виде пенистого вещества белого цвета. 1(окси)]-17-(1,1,2,2,2-пентафторэтил)-11-[4(2,5,5-триметил-1,3-диоксолан-2-ил)фенил]-5 эстр-9-ен-5,17-диол. Аналогично примеру 1 в) 1,08 г 3,3-[2,2 диметил-1,3-пропандиил-бис(окси)]-5-гидрокси 11-[4-(2,5,5-триметил-1,3-диоксолан-2-ил)фенил]-5-эстр-9-ен-17-она, получение которого описано в ЕР 0190759, пример 6 с), в 19 мл абсолютного диэтилового эфира подвергают взаимодействию с реагентом, образованным из 1,9 мл 1-иод-1,1,2,2,2-пентафторэтана и 8,7 мл 1,5 молярного раствора комплекса метиллитийбромид лития в диэтиловом эфире. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 644 14 мг указанного в заголовке 3 а) соединения в виде бесцветного пенистого вещества. 1H-ЯМР (СDСl3):= 7,29 d (J=9 Гц, 2 Н,арил); 7,23 d (J=9 Гц, 2 Н, арил); 4,42 s (1H, 5 ОН); 4,35 ушир. d (J=7 Гц, 1H, H-11); 1,52 s (3 Н,арилкеталь); 1,26 s (3 Н, арилкеталь); 1,04 s (3 Н,3-кеталь); 0,89 s (3 Н, 3-кеталь); 0,57 s (3 Н, арилкеталь); 0,51 s (3 Н, Н-18). 3 б) 11-(4-Ацетилфенил)-17-гидрокси 17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3 он. 635 мг соединения, описанного в 3 а), перемешивают в 9 мл метанола с 0,4 мл водной полуконцентрированной серной кислоты в течение 2 ч при комнатной температуре. Затем сливают на насыщенный водный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют под вакуумом. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 428 мг указанного в заголовке соединения в виде бесцветного пенистого вещества.(окси)]-17-(1,1,2,2,2-пентафторэтил)-11-[4(2,5,5-триметил-1,3-диоксолан-2-ил)фенил]-5 эстра-9,15-диен-5,17-диол. Аналогично примеру 1 в) 1,15 г 3,3-[2,2 диметил-1,3-пропандиил-бис(окси)]-5-гидрокси 11-[4-(2,5,5-триметил-1,3-диоксолан-2-ил)фенил]-5-эстра-9,15-диен-17-она, получение которого описано в WO 89/00578, пример 1b), в 20 мл абсолютного диэтилового эфира и 10 мл абсолютного тетрагидрофурана подвергают взаимодействию с реагентом, образованным из 2,0 мл 1-иод-1,1,2,2,2-пентафторэтана и 9,3 мл 1,5 молярного раствора комплекса метиллитийбромид лития в диэтиловом эфире. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 1,16 г указанного в заголовке 4 а) соединения в виде бесцветного пенистого вещества. 1 15 1,15 г описанного в 4 а) соединения по способу, описанному в примере 3 б), подвергают в 16,5 мл метанола взаимодействию с 0,73 мл водной полуконцентрированной серной кислоты, получая в результате 572 мг указанного в заголовке соединения в виде бесцветного пенистого вещества.tпл 213,9 С (диизопропиловый эфир),[]D22= +210,5 (СНСl3, с=0,615). Пример 5. 9,11-Дигидpo-6'-(4-фтopфeнил)-17-гидpoкcи-17-(1,1,2,2,2-пентафторэтил)-4'H-нафт[3',2',1':10,9,11]эстр-4-ен-3-он. 5 а) 9,11-Дигидро-3,3-[2,2-диметил-1,3 пропандиилбис(окси)]6'-(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфонил]окси]-17-(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]-5-эстран 5,17-диол. Раствор из приблизительно 4 мл пентафторэтилиодида в 20 мл простого безводного эфира смешивают при -78 С в атмосфере сухого аргона с 13,4 мл 1,7-молярного раствора третбутиллития в гексане и перемешивают в течение 30 мин. Затем по каплям добавляют раствор из 2,0 г (2,62 ммоля) 9,11-дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5-гидрокси-6'(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфонил] окси]-4'Н-нафт[3',2',1':10,9,11]-5-эстран-17-она,полученного по способу, аналогично описанному в DE 4216003 (пример 1b), в 60 мл безводного толуола и оставляют в течение 2 ч для нагревания до -10 С. Затем сливают в насыщенный водный раствор гидрокарбоната натрия, несколько раз экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и удаления растворителя остаток очищают посредством хроматографии на приблизительно 300 мл тонкоизмельченного силикагеля с помощью системы градиентов из гексана и этилацетата. Таким путем выделяют 1,40 г (1,59 ммоля, 61%) указанного в заголовке 5 а) соединения в виде бесцветного твердого вещества, а также 730 мг (0,96 ммоля, 36%) исходного материала. 1(1 Н), 6,98 (1 Н), 7,04 (1 Н), 7,47 (1 Н) част./млн. 56) 9,11-Дигидро-3,3-[2,2-диметил-1,3 пропандиилбис(окси)]-6'-(4-фторфенил)-17(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]-5-эстран-5,17-диол. Раствор из 400 мг (453 мкмоля) полученного согласно примеру 5 а) соединения в смеси из 7 мл безводного толуола и 3 мл безводного этанола смешивают последовательно с 43 мг хлорида лития, 0,66 мл 2 М раствора карбоната натрия, 82 мг (4-фторфенил)бороновой кислоты,50 мг тетра-кис(трифенилфосфин)палладия (0) и 16 нагревают в атмосфере аргона в течение 1,5 ч до 95 С. Затем реакционную смесь разбавляют водой, экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и удаления растворителя остаток очищают посредством хроматографии на приблизительно 150 мл тонкоизмельченного силикагеля с помощью системы градиентов из гексана и этилацетата. Таким путем выделяют 264 мг (389 мкмолей, 86%) указанного в заголовке 5 б) соединения в виде бесцветного твердого вещества. 1(1H), 7,11 (2 Н), 7,23 (1H), 7,33 (1H), 7,45 (1H),7,54 (2 Н) част./млн. 5 в) 9,11-Дигидро-6'-(4-фторфенил)-17 гидрокси-17-(1,1,2,2,2-пентафторэтил)-4'Ннафт[3',2',1':10,9,11]эстр-4-ен-3-он. Раствор из 260 мг (383 мкмоля) полученного согласно примеру 5 б) соединения в 13 мл ацетона смешивают с 700 мкл водной 4 н. соляной кислоты и нагревают в течение 4 ч до 50 С. Затем эту смесь сливают в насыщенный водный раствор гидрокарбоната натрия, несколько раз экстрагируют дихлорметаном, объединенные органические экстракты промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и удаления растворителя остаток очищают посредством хроматографии на приблизительно 100 мл тонкоизмельченного силикагеля с помощью системы градиентов из гексана и этилацетата. Таким путем выделяют 206 мг (359 мкмолей, 94%) указанного в заголовке соединения в виде кристаллического твердого вещества. 1(1 Н), 5,90 (1 Н), 7,12 (2 Н), 7,27 (1 Н), 7,37 (1 Н),7,45-7,60 (3 Н) част./млн. Пример 6. 6'-Адетил-9,11-дигидро-17 гидрокси-17-(1,1,2,2,2-пентафторэтил)-4'Ннафт[3',2',1':10,9,11]эстр-4-ен-3-он. Раствор из 600 мг (680 мкмолей) полученного согласно примеру 5 а) соединения в 7 мл безводного N,N-диметилформамида последовательно смешивают в атмосфере сухого аргона с 69 мг хлорида лития, 381 мкл (1-этоксиэтенил) трибутилстаннана, 25 мг тетракис(трифенилфосфин) палладия (0) и нагревают в течение 1,5 ч до 110 С. После охлаждения смешивают с 10 мл ацетона, 1,5 мл водной 4 н. соляной кислоты,выдерживают в течение 2 ч при 23 С, после чего нагревают еще в течение 3 ч до 50 С. Затем сливают в насыщенный водный раствор гидрокарбоната натрия, несколько раз экстрагируют 17 дихлорметаном, объединенные органические экстракты промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Из полученного после фильтрации и удаления растворителя остатка путем кристаллизации из дихлорметана и ацетона получают 206 мг еще содержащего загрязняющие примеси указанного в заголовке соединения, которое подвергают дальнейшей очистке на 10 аналитических тонкослойных пластинах. В качестве растворителя служит смесь из гексана и этилацетата, а в качестве элюента - смесь из дихлорметана и метанола. В результате выделяют 160 мг (306 мкмолей, 45%) указанного в заголовке соединения в виде бесцветного твердого вещества. 1[3',2'1':10,9,11]эстр-4-ен-6'-ил]бензонитрил. 7 а) 4-[9,11-Дигидро-5,17-гидрокси-3,3[2,2-диметил-1,3-пропандиил-бис(окси)]-17(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]-5-эстран-6'-ил]бензонитрил. 400 мг (453 мкмоля) полученного согласно примеру 5 б) соединения аналогично примеру 5 б) подвергают взаимодействию с 4-(5,5 диметил-1,3,2-диоксаборинан-2-ил)бензонитрилом и после переработки и очистки выделяют 301 мг (439 мкмолей, 97%) указанного в заголовке 7 а) соединения в виде кристаллического твердого вещества. 7 б) 4-[9,11-Дигидро-17-гидрокси-3 оксо-17-(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]эстр-4-ен-6'-ил]бензонитрил. 296 мг (431 мкмоль) полученного согласно примеру 7 а) соединения превращают аналогично примеру 5 в) и после переработки и очистки выделяют 228 мг (392 мкмоля, 91%) указанного в заголовке соединения в виде кристаллического твердого вещества. 1(окси)]-5-гидрокси-11-[4-(фенилметокси)фенил]-5-эстр-9-ен-17-он. 1,17 г магниевой стружки загружают в атмосфере защитного газа в 4 мл абсолютного тетрагидрофурана и смешивают с одной каплей 1,2-дибромэтана. После начала реакции медленно добавляют по каплям раствор из 12,7 г 1 003092Journ. Amer. Chem. Soc. 42, 657 (1920 в 80 мл абсолютного тетрагидрофурана. Реакционную смесь нагревают с обратным холодильником до полного превращения магния. Затем охлаждают до 0 С и смешивают с 2,39 г хлорида меди (I). Далее медленно добавляют по каплям другой раствор из 3 г 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5,10-эпокси-5,10-эстр-9(11)-ен-17 она (получение см. Tetrahedron Lett. 26, 20692072 (1985 в 80 мл абсолютного тетрагидрофурана. Реакционную смесь перемешивают в течение ночи при комнатной температуре, после чего сливают на насыщенный водный раствор хлорида аммония. Водную фазу экстрагируют этилацетатом, органические фазы объединяют,промывают их насыщенным водным раствором хлорида натрия и сушат их над сульфатом натрия. Затем фильтруют и концентрируют под вакуумом. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 3,7 г указанного в заголовке 8 а) соединения в виде бесцветного пенистого вещества. 1(окси)]-17-(1,1,2,2,2-пентафторэтил)-11-[4(фенилметокси)фенил]-5-эстр-9-ен-5,17-диол. Алалогично примеру 1 в) 1,35 г описанного в 8 а) соединения в 48 мл абсолютного толуола подвергают взаимодействию с реагентом, образованным из 1,18 г 1-иод-1,1,2,2,2-пентафторэтана и 2,4 мл 1,5-молярного раствора комплекса метиллитийбромид лития в диэтиловом эфире. После колоночной хроматографии на силикагеле с помощью смеси гексана/этилацетата получают 730 мг указанного в заголовке 8 б) соединения в виде бесцветного пенистого вещества. 1(окси)]-17-(1,1,2,2,2-пентафторэтил)-11-(4 гидроксифенил)-5-эстр-9-ен-5,17-диол. 730 мг полученного в 8 б) соединения растворяют в 11 мл метанола и смешивают с 341 мг формиата аммония и 73 мг 10%-ного палладия на активированном угле. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, после чего фильтруют через Celite. Остаток тщательно промывают этилацетатом. Фильтрат концентрируют под вакуумом. Таким путем получают 631 мг указанного в за 19 головке 8 в) соединения, которое в сыром виде используют в последующей реакции. 8 г) 17-Гидрокси-11-(4-гидроксифенил)17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3 он. 631 мг описанного в 8 в) соединения аналогично описанному в 3 б) способу подвергают в 11 мл метанола взаимодействию с 0,48 мл водной полуконцентрированной серной кислоты,получая в результате 428 мг указанного в заголовке соединения в виде бесцветного пенистого вещества. 1(1 Н, ОН); 5,80 s (1 Н, Н-4); 4,38 ушир. d (J=7 Гц,1H, H-11); 0,61 s (3H, Н-18). Пример 9. 11-[4-(Ацетилокси)фенил]17-гидрокси-17-(1,1,2,2,2-пентафторэтил) эстра-4,9-диен-3-он. 300 мг описанного в 8 г) соединения растворяют в 12 мл пиридина и в течение 4 ч перемешивают при комнатной температуре с 61 мкл ангидрида уксусной кислоты. Затем реакционную смесь сливают на насыщенный водный раствор хлорида аммония. Водную фазу экстрагируют этилацетатом, органические фазы объединяют, промывают их насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. Далее фильтруют и концентрируют под вакуумом. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 248 мг указанного в заголовке соединения в виде бесцветного пенистого вещества. 1(окси)]-5-гидрокси-11-[4-[(метоксиметокси) метил]фенил]-5-эстр-9-ен-17-он. Из 6,0 г 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5,10-эпокси-5,10-эстр-9(11)-ен-17 она в 160 мл абсолютного тетрагидрофурана,22,32 г 1-бром-4-[(метоксиметокси)метил]бензола (получение см. Synth. Commun. 20, 14691472 (1990 в 160 мл абсолютного тетрагидрофурана, 2,35 г магниевой стружки в 10 мл абсолютного тетрагидрофурана и 4,78 г хлорида меди (I) по способу, аналогично описанному в 8 а),после колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 7,14 г указанного в заголовке 10 а) соединения в виде бесцветного пенистого вещества. 1(окси)]-17-(1,1,2,2,2-пентафторэтил)-11-[4[(метоксиметокси)метил]фенил]-5-эстр-9-ен 5,17-диол. Аналогично примеру 1 в) 4,85 г описанного в 10 а) соединения в 200 мл абсолютного толуола подвергают взаимодействию с реагентом,образованным из 18,2 г 1-иод-1,1,2,2,2-пентафторэтана и 43,3 мл 1,5-молярного раствора комплекса метиллитий-бромид лития в диэтиловом эфире. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 4,13 г указанного в заголовке 106) соединения в виде бесцветного пенистого вещества. 1(3H, Н-18). 10 в) 17-Гидрокси-11-[4-(гидроксиметил) фенил]-17-(1,1,2,2,2-пентафторэтил)эстра-4,9 диен-3-он. 4,13 г описанного в 10 б) соединения по способу, аналогично описанному в 3 б), подвергают в 65 мл метанола взаимодействию с 2,84 мл водной полуконцентрированной серной кислоты, получая в результате 2,26 г указанного в заголовке соединения в виде бесцветного пенистого вещества. 1H-ЯМР (СDСl3):= 7,27 d (J=9 Гц, 2 Н,арил); 7,17 d (J=9 Гц, 2 Н, арил); 5,78 s (1H, H-4); 4,64 s (2 Н, бензил); 4,45 ушир. d (J=6,5 Гц, 1 Н,Н-11); 0,59 s (3 Н, Н-18). Пример 11. 4-[17-Гидрокси-3-оксо-17(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-11 ил]бензальдегид. 497 мг полученного в примере 10 в) соединения перемешивают с 431 мг хлорохромата пиридиния в 10 мл дихлорметана в течение 2 ч при комнатной температуре, после чего фильтруют через силикагель. Остаток тщательно промывают этилацетатом и фильтрат концентрируют под вакуумом. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 415 мг указанного в заголовке соединения в виде бесцветного пенистого вещества. 1H-ЯМР (СDСl3):= 9,97 s (1H, формил); 7,81 d (J=9 Гц, 2 Н, арил); 7,39 d (J=9 Гц, 2 Н,арил); 5,81 s (1H, H-4); 4,52 ушир. d (J=7 Гц, 1H,Н-11); 0,58 s (3H, Н-18). Пример 12. Метиловый эфир 4-[17 гидрокси-3-оксо-17-(1,1,2,2,2-пентафторэтил) эстра-4,9-диен-11-ил]бензойной кислоты. Раствор из 125 мг полученного в примере 11 соединения в 2,5 мл метанола добавляют к 81,4 мг цианида калия в 1,25 мл метанола, после 21 чего к реакционной смеси добавляют 390 мг оксида марганца (IV) и 22 мл ледяной уксусной кислоты и затем всю смесь перемешивают в течение 1 ч при комнатной температуре. Далее фильтруют через Celite, фильтрат растворяют с помощью этилацетата/воды и водную фазу экстрагируют этилацетатом. Объединенные органические фазы промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют под вакуумом. После колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 120 мг указанного в заголовке соединения в виде бесцветного пенистого вещества. 1(окси)]-5-гидрокси-11-[4-[1-[(тетрагидро-2 Нпиран-2-ил)окси]этил]фенил]-5-эстр-9-ен-17 он. Из 1,6 г 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5,10-эпокси-5,10-эстр-9(11)-ен-17 она в 40 мл абсолютного тетрагидрофурана, 7,4 г 2-[1-(4-бромфенил)этокси]тетрагидро-2 Нпирана (получение см. Arzneimitt. Forsch. 25,1495-1501 (1975 в 40 мл абсолютного тетрагидрофурана, 1,3 г магниевой стружки в 2 мл абсолютного тетрагидрофурана и 1,3 г хлорида меди (I) по способу, аналогично описанному в примере 8 а), после колоночной хроматографии на силикагеле с помощью смеси из гексана/ этилацетата получают 2,06 г указанного в заголовке 13 а) соединения в виде смеси диастереомеров в положении ацеталя и бензила. 1(окси)]-17-(1,1,2,2,2-пентафторэтил)-11-[4-[1[(тетрагидро-2 Н-пиран-2-ил)окси]этил]фенил]5-эстр-9-ен-5,17-диол. Аналогично примеру 1 в) 1,45 г описанного в 13 а) соединения в 50 мл абсолютного толуола подвергают взаимодействию с реагентом, образованным из 4,9 г 1-иод-1,1,2,2,2-пентафторэтана и 11,7 мл 1,5-молярного раствора комплекса метиллитий-бромид лития в диэтиловом эфире, и после колоночной хроматографии на силикагеле с помощью смеси из гексана/этилацетата получают 1,22 г указанного в заголовке 136) соединения в виде смеси диастереомеров в положении ацеталя и бензила.(3 Н, 3-кеталь); 0,51 s (3 Н, Н-18). 13 в) 17-Гидрокси-11-[4-(1-гидроксиэтил)фенил]-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он. 1,22 г описанного в 13 б) соединения по способу, аналогично описанному в примере 3 б),подвергают в 18 мл метанола взаимодействию с 778 мкл водной полуконцентрированной серной кислоты, получая в результате 693 мг указанного в заголовке соединения в виде бесцветного пенистого вещества, представляющего собой смесь эпимеров по бензилкарбинолу. 1(J=6 Гц, 1H, Н-11); 1,49 d (J=6 Гц, 3 Н, метил); 0,60 s (3 Н, Н-18). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 17-фторалкильные стероиды общей формулы IR1 представляет собой метильную либо этильную группу,R2 представляет собой остаток формулы СnFmНo, где n равно 2, 3, 4, 5 или 6, m1 иm+o=2n+1,R3 представляет собой свободную этерифицированную либо эстерифицированную гидроксильную группу,R4 и R5 каждый обозначает атом водорода,а оба вместе образуют дополнительную связь или представляют собой метиленовую группу,St обозначает стероидную циклическую систему АВС частичной формулы А, В или С где R6 представляет собой атом водорода, прямоцепную С 1-С 4- либо разветвленную С 3-С 4 алкильную группу или атом галогена,R7 представляет собой атом водорода,прямоцепную С 1-С 4- либо разветвленную С 3-С 4 алкильную группу или если St обозначает стероидную циклическую систему АВС частичной формулы А или В, то R6 и R7 оба вместе, кроме того, образуют дополнительную связь,Х обозначает атом кислорода, гидроксииминогруппировку =NOH или два атома водорода,R8 представляет собой остаток Y либо необязательно многократно замещенный группойY арильный остаток, где Y обозначает атом водорода, атом галогена, -ОН, -NO2, -N3, -CN,-NR9aR9b, -NHSO2R9, -CO2R9, С 1-С 10 алкильную,С 1-С 10 алкокси-, С 1-С 10 алканоилокси-, бензоилокси-, С 1-С 10 алканоильную, C1-С 10 гидроксиалкильную или бензоильную группу, a R9a и R9b являются идентичными либо разными и аналогично R9 обозначают атом водорода или С 1-С 10 алкильную группу,и в случае остатков -NR9aR9b также их физиологически приемлемые соли с кислотами, а в случае остатков -CO2R9 при R9, обозначающем атом водорода, а также их физиологически приемлемые соли с основаниями. 2. 17-Фторалкильные стероиды по п.1,где St обозначает стероидную циклическую систему частичной формулы А. 3. 17-Фторалкильные стероиды по п.1,где St обозначает стероидную циклическую систему частичной формулы В. 4. 17-Фторалкильные стероиды по п.1,где St обозначает стероидную циклическую систему частичной формулы С. 5. 17-Фторалкильные стероиды по п.1,где n равно 2, 3 или 4. 6. 17-Фторалкильные стероиды по п.5,где о равно 0. 7. 17-Фторалкильные стероиды по п.6,где n равно 2. 8. 17-Фторалкильные стероиды по п.1,где R3 представляет собой свободную гидроксильную группу. 9. 17-Фторалкильные стероиды по п.1,где R8 представляет собой один из остатков Y. 10. 17-Фторалкильные стероиды по п.9,где Y представляет собой С 1-С 10 ацильную группу. 11. 17-Фторалкильные стероиды по п.10,где Y представляет собой формильную, ацетильную или пропионильную группу. 12. 17-Фторалкильные стероиды по п.9,где Y представляет собой C1-С 10 гидроксиалкильную группу. 13. 17-Фторалкильные стероиды по п.12,где Y представляет собой гидроксиметильную или 1-гидроксиэтильную группу. 14. 17-Фторалкильные стероиды по п.9,где Y представляет собой гидроксильную группу. 15. 17-Фторалкильные стероиды по п.9,где Y представляет собой ацетилоксигруппу. 16. 17-Фторалкильные стероиды по п.9,где Y представляет собой метоксикарбонильную группу. 17. 17-Фторалкильные стероиды по п.1,где R8 представляет собой замещенный группойY арильный остаток. 18. 17-Фторалкильные стероиды по п.17,где арильный остаток представляет собой фенил, нафталинил, фуранил, бензофуранил, тиенил или пиридинил. 19. 17-Фторалкильные стероиды по п.18,где R8 представляет собой 4-цианфенильный остаток. 20. 17-Фторалкильные стероиды по п.18,где R8 представляет собой 4-галогенфенильный остаток. 21. 17-Фторалкильные стероиды по п.20,где R8 представляет собой 4-фторфенильный остаток. 22. 17-Фторалкильные стероиды по п.1,где R4 и R5 каждый представляет собой атом водорода. 23. 17-Фторалкильные стероиды по п.1,где R4 и R5 оба вместе образуют дополнительную связь. 24. 17-Фторалкильные стероиды по п.1,где R6 и R7 каждый представляет собой атом водорода. 25. 17-Фторалкильные стероиды по п.1, а именно 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстр-4-ен-3-он; 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он; 11-(4-ацетилфенил)-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстра-4,9,15-триен-3 он; 6'-ацетил-9,11-дигидро-17-гидрокси 17-(1,1,2,2,2-пентафторэтил)-4'Н-нафт[3',2',1':10,9,11]эстр-4-ен-3-он; 4-[9,11-дигидро-17-гидрокси-3-оксо 17-(1,1,2,2,2-пентафтоpэтил)-4'H-нaфт[3',2',1':10,9,11]эcтp-4-eн-6'-ил]бeнзoнитpил; 9,11-дигидро-6'-(4-фторфенил)-17 гидрокси-17-(1,1,2,2,2-пентафторэтил)-4'Ннафт[3',2',1':10,9,11]эстр-4-ен-3-он; 17-гидрокси-11-(4-гидроксифенил)-17(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он; 26 26. Фармацевтические препараты, содержащие, по меньшей мере, один 17-фторалкильный стероид общей формулы I по п.1 и один фармацевтически приемлемый носитель. 27. Фармацевтические препараты по п.26,содержащие дополнительно, по меньшей мере,одно соединение с антиэстрогенным действием. 28. Применение 17-фторалкильных стероидов общей формулы I по п.1 для изготовления лекарственных средств. 29. Применение по п.28 дополнительно с использованием соединения с антиэстрогенным действием.
МПК / Метки
МПК: C07J 41/00, A61K 31/567, A61P 5/36
Метки: обладающие, действием, цепью, стероиды, 17α-алкильной, фторированной, антигестагенным
Код ссылки
<a href="https://eas.patents.su/14-3092-steroidy-s-ftorirovannojj-17alpha-alkilnojj-cepyu-obladayushhie-antigestagennym-dejjstviem.html" rel="bookmark" title="База патентов Евразийского Союза">Стероиды с фторированной 17α-алкильной цепью, обладающие антигестагенным действием</a>
Предыдущий патент: Синтез олигонуклеотидов в жидкой фазе
Следующий патент: Производные карбоксамидотиазолов, их получение, содержащие их фармацевтические композиции
Случайный патент: Теплообменник