Синтез олигонуклеотидов в жидкой фазе
Формула / Реферат
1. Способ получения триэфира фосфоротиоата, включающий в себя жидкофазное связывание Н-фосфоната со спиртом в присутствии связывающего агента для получения, таким образом, диэфира Н-фосфоната и in situ реакцию диэфира Н-фосфоната с агентом по переносу серы для получения триэфира фосфоротиоата.
2. Способ по п.1, при котором Н-фосфонат представляет собой защищенный нуклеозид или олигонуклеотид, содержащий функцию 3'-Н-фосфоната.
3. Способ по любому из пп.1 или 2, при котором спирт представляет собой защищенный нуклеозид или олигонуклеотид, содержащий свободную функцию 5'-гидрокси.
4. Способ по любому из предшествующих пунктов, при котором связывающий агент представляет собой диарилфосфорохлоридат формулы (АrО)2РОСl, в котором Аr является фенилом, 2-хлорфенилом, 2,4,6-трихлорфенилом или 2,4,6-трибромфенилом.
5. Способ по любому из предшествующих пунктов, при котором агент по переносу серы имеет общую химическую формулу
![]()
в которой L является отщепляемой группой, а А представляет собой замещенную или незамещенную фенильную или нафтильную группу, метильную группу, замещенную группу C1-4алкила или группу C1-4алкенила.
6. Способ по п.5, при котором отщепляемая группа представляет собой морфолин-3,5-дион, фталимид, сукцинимид, малеимид или индазол, а А представляет собой 4-галогенфенильную группу, 4-алкилфенильную группу, метильную группу, бензильную группу, алкилбензильную группу, галогенбензильную группу, аллильную группу, кротильную группу, 2-цианоэтильную группу или 2-(4-нитрофенил)этильную группу.
7. Способ по любому из предшествующих пунктов, в котором Н-фосфонат и спирт выбраны из группы, состоящей из дезоксирибонуклеозидов, олигодезоксирибонуклеотидов, рибонуклеозидов, 2'-O-(C1-4алкил, С1-4алкокси-С1-4алкил или C1-4алкенил)рибонуклеозидов, олигорибонуклеотидов и 2'-O-(C1-4алкил, C1-4алкокси-С1-4алкил или C1-4алкенил)олигорибонуклеотидов.
8. Н-фосфонат, имеющий общую химическую формулу
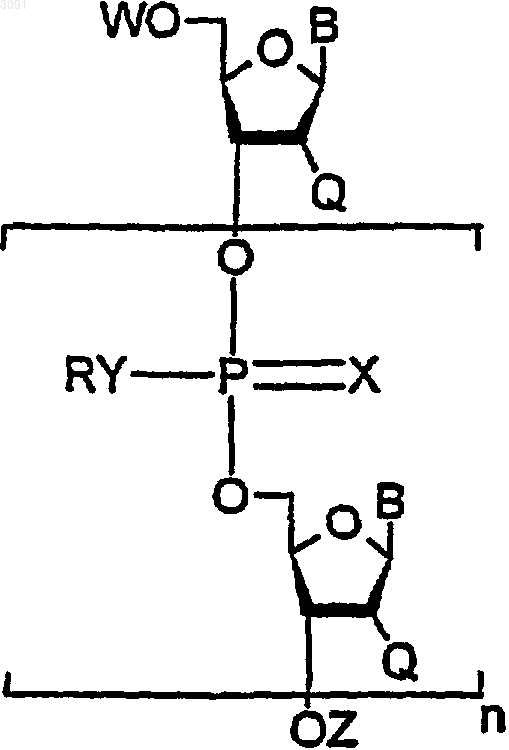
в которой
каждый В независимо является основанием, выбранным из A, G, T, С или U;
каждый Q независимо является Н или OR', где R' представляет собой C1-4алкил, замещенный С1-4алкил, C1-4алкенил или защитную группу;
каждый R независимо является замещенным или незамещенным фенилом или нафтилом, метилом, замещенным C1-4алкилом или C1-4алкенильной группой;
W является Н, защитной группой или группой Н-фосфоната формулы
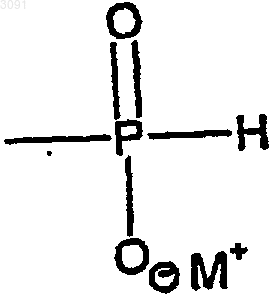
в которой М+ представляет собой одновалентный катион;
каждый Х независимо является О или S;
каждый Y независимо является О или S;
Z является Н, защитной группой или группой Н-фосфоната формулы
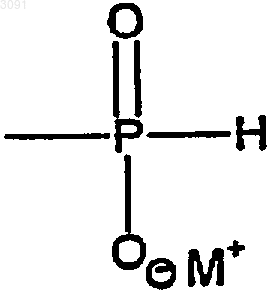
в которой М+ представляет собой одновалентный катион; и n - целое число, по меньшей мере, равное 2;
при условии, что когда W является Н или защитной группой, то Z является группой Н-фосфоната, а когда Z представляет собой Н или защитную группу, то W является группой Н-фосфоната.
9. Н-фосфонат, имеющий общую химическую формулу
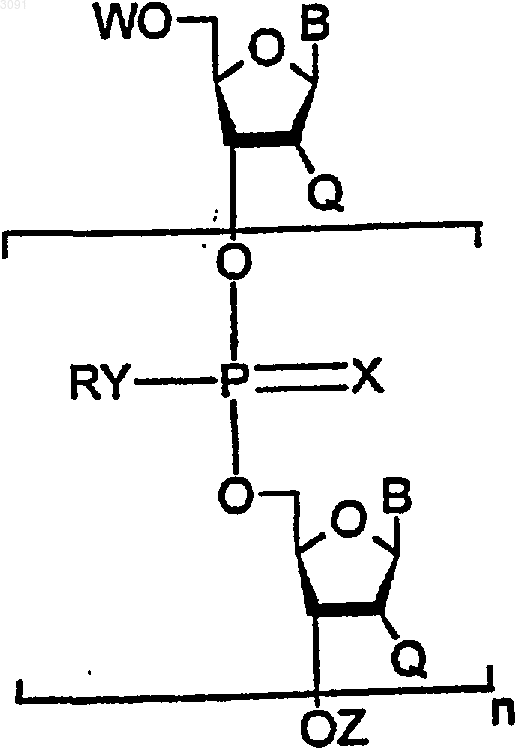
в которой
каждый В независимо является основанием, выбранным из A, G, T, С или U;
каждый Q независимо является Н или OR' , где R' представляет собой C1-4алкил, замещенный C1-4алкил, C1-4алкенил или защитную группу;
каждый R независимо является замещенным или незамещенным фенилом или нафтилом, метилом, замещенным C1-4алкилом или C1-4алкенильной группой;
W является Н, защитной группой или группой Н-фосфоната формулы
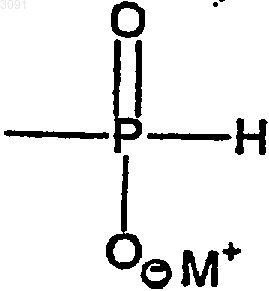
в которой М+ представляет собой одновалентный катион;
каждый Х независимо является О или S;
каждый Y является S;
Z является Н, защитной группой или группой Н-фосфоната формулы
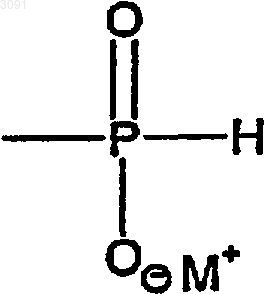
в которой М+ представляет собой одновалентный катион; и n - целое число;
при условии, что когда W является Н или защитной группой, то Z является группой Н-фосфоната, а когда Z представляет собой Н или защитную группу, то W является группой Н-фосфоната.
10. Н-фосфонат по п.9, в котором W представляет собой защитную группу, каждый Х представляет собой O, а каждый R представляет собой метильную группу, бензильную группу, 2-цианоэтильную группу, незамещенную фенильную группу или 4-галогенфенильную группу, М+ представляет собой ион три(С1-4алкиламмония), а n принимает значения от 1 до 16.
11. Способ получения Н-фосфоната олигонуклеотида, содержащего 3'-концевую или 5'-концевую группу Н-фосфоната, где олигонуклеотид, содержащий свободную 3'- или 5'-гидроксифункцию, подвергают реакции
a) либо с C1-4алкил-Н-фосфонатом, где алкильная группа замещена группой галогена,
b) либо с солью замещенного или незамещенного фенил-Н-фосфоната,
в присутствии активатора.
12. Способ по п.11, при котором олигонуклеотид, включающий в себя свободную 3'- или 5'-гидрокcифункцию, представляет собой защищенный олигодезоксирибонуклеотид или олигорибонуклеотид.
13. Способ по п.11 или 12, при котором соль алкил- или арил-Н-фосфоната представляет собой аммониевую соль фенил-, C1-4алкилфенил- или галогенфенил-Н-фосфоната.
14. Способ по любому из пп.11-13, при котором активатор представляет собой арилфосфорохлоридат или хлорид алкилкислоты.
15. Способ по п.14, при котором активатор представляет собой пивалоилхлорид.
16. Способ по любому из пп.11-15, при котором свободная гидроксифункция представляет собой 3'-гидроксифункцию.
17. Н-фосфонат по п.8, в котором W представляет собой защитную группу, каждый Х является О, а каждый R является метильной группой, бензильной группой, 2-цианоэтильной группой, незамещенной фенильной группой или 4-галогенфенильной группой, М+ представляет собой ион три(C1-4алкиламмония), а n принимает значения от 2 до 16.
18. Н-фосфонат по любому из пп.8 или 17, в котором n принимает значения 2 или 3.
19. Н-фосфонат по любому из пп.9 или 10, в котором n принимает значения 1, 2 или 3.
20. Способ по любому из пп.1-3, при котором связывающий агент представляет собой диарилфосфорохлоридат формулы (ArO)zPOCl, в которой Аr представляет собой фенил, 2-хлорфенил, 2,4,6-трихлорфенил или 2,4,6-трибромфенил; а агент по переносу серы имеет общую химическую формулу
![]()
в которой L является отщепляемой группой, а А представляет собой арильную группу, метильную группу, замещенную алкильную группу или алкенильную группу.
21. Способ по п.20, при котором отщепляемая группа представляет собой морфолин-3,5-дион, фталимид, сукцинимид, малеимид или индазол, а А представляет собой 4-галогенфенильную группу, 4-алкилфенильную группу, метильную группу, бензильную группу, алкилбензильную группу, галогенбензильную группу, аллильную группу, кротильную группу, 2-цианоэтильную группу или 2-(4-нитрофенил)этильную группу.
22. Способ по п.20 или 21, при котором Н-фосфонат и спирт выбраны из группы, состоящей из дезоксирибонуклеозидов, олигодезоксирибонуклеотидов, рибонуклеозидов, 2'-O-(алкил, алкоксиалкил или алкенил)рибонуклеозидов, олигорибонуклеотидов и 2'-O-(алкил, алкоксиалкил или алкенил)олигорибонуклеотидов.
23. Способ получения фосфодиэфира олигонуклеотида со снятой защитой, фосфоротиоата олигонуклеотида со снятой защитой или олигонуклеотида со снятой защитющ, содержащего как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи, который включает в себя
а) жидкофазное связывание защищенного Н-фосфоната нуклеозида или олигонуклеотида, содержащего функцию 3'- или 5'-Н-фосфоната, с защищенным нуклеозидом или олигонуклеотидом, содержащим свободную 3'- или 5'-гидроксифункцию, в присутствии связывающего агента для получения, таким образом, диэфира Н-фосфоната и in situ реакцию диэфира Н-фосфоната с агентом по переносу серы для получения триэфира фосфоротиоата; и
b) снятие защиты с триэфира фосфоротиоата, полученного на стадии а), для получения, таким образом, фосфодиэфира олигонуклеотида со снятой защитой, фосфоротиоата олигонуклеотида со снятой защитой или олигонуклеотида со снятой защитой, содержащего как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи.
24. Способ по п.23, при котором защищенный Н-фосфонат нуклеозида или олигонуклеотида содержит функцию 3'-Н-фосфоната, а защищенный нуклеозид или олигонуклеотид содержит свободную 5'-гидроксифункцию.
25. Способ по п.23 или 24, при котором связывающий агент представляет собой диарилфосфорохлоридат формулы (ArO)zPOCl, в которой Аr представляет собой фенил, 2-хлорфенил, 2,4,6-трихлорфенил или 2,4,6-трибромфенил.
26. Способ по любому из пп.23-25, при котором агент по переносу серы имеет общую химическую формулу
![]()
в которой L является отщепляемой группой, а А представляет собой замещенную или незамещенную фенильную или нафтильную группу, метильную группу, замещенную C1-4алкильную группу или С1-4алкенильную группу.
27. Способ по п.26, при котором отщепляемая группа представляет собой морфолин-3,5-дион, фталимид, сукцинимид, малеимид или индазол, а А представляет собой 4-галогенфенильную группу, 4-алкилфенильную группу, метильную группу, бензильную группу, алкилбензильную группу, галогенбензильную группу, аллильную группу, кротильную группу, 2-цианоэтильную группу или 2-(4-нитрофенил)этильную группу.
28. Способ по любому из пп.23-27, при котором используют Н-фосфонат олигонуклеотида и/или олигонуклеотид, содержащий 3'- или 5'-гидроксифункцию, и либо один из них, либо оба они - Н-фосфонат олигонуклеотида и олигонуклеотид, содержащий 3'- или 5'-гидроксифункцию, - содержат одну или более фосфоротиоатных интернуклеотидных связей.
29. Способ по любому из пп.23-28, при котором олигонуклеотид со снятой защитой подвергается дальнейшей очистке.
30. Способ по п.29, при котором олигонуклеотид со снятой защитой содержит одну или более фосфоротиоатдиэфирных связей.
31. Способ по любому из пп.11-16, при котором олигонуклеотид, содержащий свободную гидроксигруппу, содержит одну или более фосфоротиоатных интернуклеотидных связей.
32. Способ по любому из пп.2-7, при котором Н-фосфонат, содержащий функцию 3'-Н-фосфоната, представляет собой защищенный Н-фосфонат олигонуклеотида, содержащий, по меньшей мере, одну фосфоротиоатную интернуклеотидную связь.
33. Способ по любому из пп.3-7, при котором спирт, содержащий свободную 5'-гидроксифункцию, представляет собой олигонуклеотид, содержащий, по меньшей мере, одну фосфоротиоатную интернуклеотидную связь.
34. Способ по п.33, при котором Н-фосфонат представляет собой защищенный Н-фосфонат олигонуклеотида, содержащий функцию 3'-Н-фосфоната, а также содержащий, по меньшей мере, одну фосфоротиоатную интернуклеотидную связь.
35. Соединение формулы
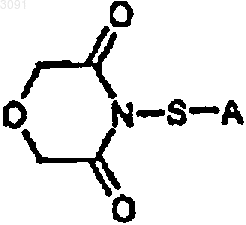
в которой А представляет собой замещенную или незамещенную фенильную или нафтильную группу, метил, замещенную C1-4алкильную или C1-4алкенильную группу.
36. Соединение по п.35, в котором А представляет собой -Ph или -CH2CH2CN.
37. Способ введения группы формулы -S-A во фрагмент Н-фосфоната, который включает в себя реакцию субстрата, содержащего фрагмент Н-фосфоната, с соединением формулы
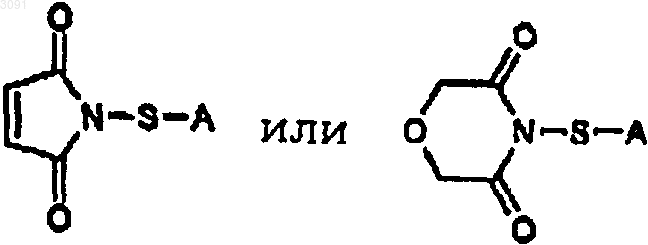
в которой А представляет собой замещенную или незамещенную фенильную или нафтильную группу, метильную группу, замещенную C1-4алкильную или C1-4алкенильную группу.
38. Способ по п.37, при котором А представляет собой -Ph или -CH2CH2CN.
39. Соединение формулы
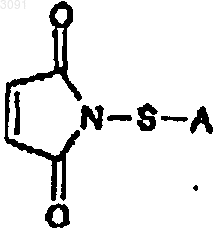
в которой А представляет собой -CH2CH2CN или С1-4алкенил.
40. Способ введения группы формулы -S-A во фрагмент Н-фосфоната, который включает в себя реакцию субстрата, содержащего фрагмент Н-фосфоната, с соединением формулы

в которой А представляет собой метильную или C1-4алкенильную группу.
41. Соединение формулы
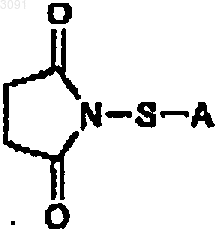
в которой А представляет собой C1-4алкенил.
42. Усовершенствованный способ синтеза фосфодиэфира олигонуклеотида со снятой защитой, фосфоротиоата олигонуклеотида со снятой защитой или олигонуклеотида со снятой защитой, содержащего как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи, который включает в себя способ соединения, при котором образуется защищенный триэфир фосфоротиоата олигонуклеотида, и способ снятия защиты, при котором образуется фосфодиэфир олигонуклеотида со снятой защитой, фосфоротиоат олигонуклеотида со снятой защитой или олигонуклеотид со снятой защитой, содержащий как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи, усовершенствование, при котором способ соединения включает в себя жидкофазное связывание защищенного Н-фосфоната нуклеозида или олигонуклеотида, содержащего функцию 3'- или 5'-Н-фосфоната, с защищенным нуклеозидом или олигонуклеотидом, содержащим свободную 3'- или 5'-гидроксифункцию, в присутствии связывающего агента для получения, таким образом, диэфира Н-фосфоната и in situ реакцию диэфира Н-фосфоната с агентом по переносу серы для получения триэфира фосфоротиоата.
43. Способ по п.42, при котором фосфодиэфир олигонуклеотида со снятой защитой, фосфоротиоат олигонуклеотида со снятой защитой или олигонуклеотид со снятой защитой, содержащий как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи, подвергаются дальнейшей очистке.
Текст
1 Данное изобретение предусматривает способ синтеза олигонуклеотидов и олигонуклеотидных фосфоротиоатов на основе связывания Н-фосфоната и переноса серы in situ, осуществляемый при низкой температуре. Далее изобретение предусматривает способ поэтапного синтеза олигонуклеотидов и олигонуклеотидных фосфоротиоатов, при котором одновременно добавляют один нуклеозидный остаток, а также блок-синтеза олигонуклеотидов и олигонуклеотидных фосфоротиоатов, при котором одновременно добавляют два или более нуклеотидных остатков. В течение приблизительно 15 последних лет был достигнут громадный прогресс в развитии синтеза олигодезоксирибонуклеотидов (последовательности ДНК), олигорибонуклеотидовOligonucleotides and Analogs. Agrawal, S. Ed.,Humana Press, Totowa, 1993). Большая часть работы была проведена на микромолярном или даже более низком уровне, при этом наиболее удобным подходом оказался автоматизированный твердофазный синтез, с включением мономерных фосфорамидитных строительных блоков (Beaucage, S. L.; Carathers, M. H. TetrahedronLett., 1981, 22, 1859-1862). В самом деле, высокомолекулярные последовательности ДНК и относительно высокомолекулярные последовательности РНК теперь могут быть получены рутинным способом при помощи синтезаторов,выпускаемых для промышленных целей. Эти синтетические олигонуклеотиды удовлетворяют ряд важных потребностей в биологии и биотехнологии. Исходя из основополагающего открытия Замекника и Стивенсона (Zamecnik and Stephenson), что синтетический олигонуклеотид может избирательно ингибировать экспрессию генов в вирусе саркомы Рауса (Zamecnik, P.; Stephenson,M. Proc Natl. Acad. Sci. USA, 1978, 75, 280-284),идея о том, что синтетические олигонуклетиды или их аналоги могут легко найти применение в химиотерапии, привлекла большое внимание как в академических, так и в промышленных лабораториях. Например, возможное применение олигонуклеотидов и их фосфоротиоатных аналогов в химиотерапии было описано в докладе Gura, Т. Science, 1995, 270, 575-577. Так называемые "антисмысловой" и "антигенный" подходы к химиотерапии (Oligonucleotides. Antisense Inhibitors of Gene Expression, Cohen.J.S.,Rd., Macmillan, Basingstoke 1989 Moser H.S.;Dervan P.B. Science 1987, 238, 645-649) оказали сильное влияние на требования к синтетическим олигонуклеотидам. В то время как обычно для молекулярно-биологических целей было достаточно количества, исчисляемого в миллиграммах, для клинических испытаний требуются количества от грамма до 100 г и более. Несколько олигонуклеотидных аналогов, являю 003091 2 щихся сильными антисмысловыми лекарственными препаратами, в настоящее время проходят продвинутые клинические испытания. Если, как это представляется возможным в ближайшем будущем, одна из этих последовательностей будет одобрена, скажем, для лечения СПИДа или какого-либо вида рака, потребуются килограммовые или, что более вероятно, многокилограммовые количества конкретной последовательности или последовательностей. В течение нескольких последних лет проводилась большая работа по увеличению масштабов синтеза олигонуклеотидов. Почти вся эта работа включала в себя создание все больших и больших синтезаторов и такой же фосфорамидитной химии на твердой основе. Заявителю неизвестны какие-либо последние улучшения в методологии фосфоротриэфирного подхода к синтезу олигонуклеотидов в растворе, которые бы делали его более подходящим для широко- и даже среднемасштабного применения в синтезе, чем твердофазный синтез. Основные преимущества твердофазного синтеза над жидкофазным заключаются в следующем: (i) первый намного быстрее, (ii) результаты связывания обычно выше, (iii) он может быть легко автоматизирован и (iv) он чрезвычайно гибок в отношении последовательности. Таким образом, твердофазный синтез особенно применим в тех случаях, когда требуются сравнительно небольшие количества большого числа олигонуклеотидных последовательностей,скажем, для комбинаторных целей. Однако когда конкретная последовательность среднего размера идентифицирована и одобрена в качестве лекарственного препарата и требуются килограммовые количества, скорость и гибкость становятся относительно неважными, а синтез в растворе становится в высшей степени предпочтительным. Синтез в растворе также имеет то преимущество над твердофазным синтезом, что блок-связывание (т.е. присоединение двух или более нуклеотидных остатков одновременно) более легко осуществимо и увеличение масштабов до любого уровня вряд ли является проблемой. Намного легче и, конечно же, намного дешевле увеличивать размер реактора, чем производить все большие и большие автоматические синтезаторы. В прошлом олигонуклеотидный синтез в растворе осуществлялся главным образом известным способом с применением фосфоротриэфира, разработанным в 1970-е годы (Reese,С.В., Tetrahedron, 1978, 34, 3143-3179; KaplanPress, Orlando, 1987, pp. 9-4-3). Этот способ также может быть использован в твердофазном синтезе, однако, реакции связывания несколько быстрее и его результаты несколько выше при использовании фосфорамидитных мономеров. 3 Поэтому автоматизированный твердофазный синтез в большой степени был основан на применении фосфорамидитных строительных блоков; вероятно по той же причине специалисты,нуждающиеся в относительно больших количествах синтетических олигонуклеотидов, решили попробовать увеличить масштаб твердофазного синтеза, основанного на фосфорамидитах. Три основных способа, а именно, применение фосфотриэфира (Reese, Tetrahedron, 1978), фосфорамидита (Beaucage, S.L. in Methods in MolecularRec. Trav. Chim. Pays-Bas, 1987, 106, p. 512),оказались эффективными для химического синтеза олигонуклеотидов. В то время как способ с применением фосфотриэфира использовался наиболее широко для синтеза в растворе, способы с применением фосфорамидита и Нфосфоната использовались почти исключительно в твердофазном синтезе. При использовании фосфотриэфира в растворе применялось два различных синтетических подхода. Вероятно, наиболее широко используемый способ синтеза олигодезоксирибонуклеотидов в растворе включает в себя реакцию связывания между защищенным нуклеозидом или олигонуклеотид-3'-(2-хлорфенил)фосфатом(Chattopadhyaya, J.B.; Reese, С.В. Nucleic Acids Res.,1980, 8, 2039-2054) и защищенным нуклеозидом или олигонуклеотидом со свободной 5'гидрокси-функцией для получения фосфотриэфира. Необходим связывающий агент, такой как 1-(мезитиден-2-сульфонил)-3-нитро-1,2,4-Нтриазол (MSNT) (Reese, С.В.; Titmas, R.C.; Yau,L. Tetrahedron Lett., 1978, 2727-2730). Этот подход также использовался при синтезе аналогов фосфоротиоата. В этом случае связывание между защищенным нуклеозидом или олигонуклеотид-3'-S-(2-пианоэтил или,например,4 нитробензил) фосфоротиоатом (Liu, X.; Reese,С.В. J. Chem. Soc., Perkin Trans. 1, 1995, 16851695) и защищенным нуклеозидом или олигонуклеотидом со свободной 5'-гидрокси- функцией осуществляется таким же способом. Основными недостатками этого известного способа с применением фосфотриэфира является сопутствующее 5'-сульфирование второго компонента (Reese, С.В.; Zhang, P.-Z., J. Chem. Soc.,Perkin. Trans. 1, 1995, 2291-2301) и тот факт, что реакции связывания обычно протекают относительно медленно. Побочная реакция сульфирования приводит к снижению выхода, а также препятствует очистке желаемого продукта. Второй подход в синтезе олигодезоксирибонуклеотидов в растворе включает в себя применение бифункционального реагента, полученного из арил (обычно, 2-хлорфенил) фосфо 003091 4 родихлоридата и двух молекулярных эквивалентов добавки, такой как 1-оксибензотриазол(van der Marel, et al., Tetrahedron Lett.,. 1981, 22,3887-3890). Родственный бифункциональный реагент, полученный из 2,5-дихлорфенилфосфородихлоридотиоата (схема 1b), использовался подобным образом (Kemal O. et al., J. Chem.Soc., Chem. Commun., 1983, 591-593) при получении олигонуклеотидных фосфоротиоатов. Основные недостатки второго подхода связаны непосредственно с применением биофункционального реактива. Таким образом, существует возможность образования симметричных продуктов связывания, а присутствие небольших количеств влаги может привести к существенному снижению результатов связывания. Целью некоторых аспектов данного изобретения является разработка новой процедуры связывания для синтеза олигонуклеотидов в растворе, являющейся во многих вариантах осуществления изобретения (а) чрезвычайно эффективной и не вызывающей побочного действия, (b) протекающей относительно быстро и(с) одинаково подходящей для получения олигонуклеотидов, их фосфоротиоатных аналогов и химерных олигонуклеотидов, содержащих как фосфодиэфирные, так и фосфоротиоат-диэфиринтернуклеотидные связи. В соответствии с первым аспектом данного изобретения разработан способ получения фосфоротиоаттриэфира, включающий в себя жидкофазное связывание Н-фосфоната со спиртом в присутствии связывающего агента для получения диэфира Н-фосфоната и реакцию на месте диэфира Н-фосфоната с агентом по переносу серы для получения триэфира фосфоротиоата. Н-фосфонат, применяемый в способе согласно изобретению, предпочтительно представляет собой защищенный нуклеозид или олигонуклеотид-Н-фосфонат, предпочтительно включающий в себя функцию 5'- или 3'-Нфосфоната, особенно предпочтительно, функцию 3'-Н-фосфоната. Предпочтительными нуклеозидами являются 2'-дезоксирибонуклеозиды и рибонуклеозиды; предпочтительными олигонуклеотидами являются олигодезоксирибонуклеотиды и олигорибонуклеотиды. Когда Н-фосфонатный строительный блок представляет собой производное дезоксирибонуклеозида, рибонуклеозида, олигодезоксирибонуклеотида или олигорибонуклеотида, включающее в себя функцию 3'-Н-фосфоната, функция 5'-гидрокси предпочтительно защищена подходящей защитной группой. Примеры таких подходящих защитных групп включают в себя кислотно-защитные лабильные группы, в частности, тритиловые и замещенные тритиловые группы, такие как диметокситритил- и 9 фенидксантен-9-ил-группы; а также основные лабильнозащитные группы, такие как FMOC. 5 Когда Н-фосфонатный строительный блок представляет собой производное дезоксирибонуклеозида, рибонуклеозида, олигодезоксирибонуклеотида или олигорибонуклеотида, включающее в себя функцию 5'-Н-фосфоната, то функцию 3'-гидрокси предпочтительно защищают подходящей защитной группой. Подходящие защитные группы включают в себя группы, перечисленные выше для защиты функций 5'-гидрокси 3'-Н-фосфонатных строительных блоков, а также ацильные группы, такие как левулиноидовые и замещенные левуиноиловые группы. Когда Н-фосфонат представляет собой защищенный рибонуклеозид или защищенный олигорибонуклеотид, то 2'-гидрокси- функцию предпочтительно защищают подходящей защитной группой, например, кислотно-лабильной ацетальной защитной группой, в частности,1-(2-фторфенил)-4-метоксипиперидин-4-ил(Fpmp); а также триалкилсилильными группами,зачастую три(С 1-4-алкил)силильными группами,такими как третичный бутилдиметилсилильная группа. Альтернативно, рибонуклеозид или олигорибонуклеотид может представлять собой производное 2'-O-алкила,2'-O-алкоксиалкила или 2'-O-алкенила, обычно производное С 1-4 алкила, С 1-4 алкокси-С 1-4 алкила или алкенила; в этом случае позиция 2' не нуждается в дополнительной защите. Другие Н-фосфонаты, которые могут быть использованы в способе согласно изобретению,получают из других полифункциональных спиртов, особенно алкиловых спиртов, предпочтительно диолов или триолов. Примеры алкиловых диолов включают в себя этан-1,2-диол и низкомолекулярные поли(этилен гликоли), например, имеющие молекулярную массу до 400. Примеры алкиловых триолов включают в себя глицериновые и бутановые триолы. Обычно присутствует только одна функция Н-фосфоната, а оставшиеся оксигруппы защищены подходящими защитными группами, такими как группы, перечисленные выше для защиты в позициях 5'- или 2'- рибонуклеозидов. Спирт, применяемый в способе согласно изобретению, обычно представляет собой защищенный нуклеозид или олигонуклеотид,включающий в себя свободную гидроксигруппу, предпочтительно, свободную 3'- или 5'гидроксигруппу, и особенно предпочтительно,5'-гидроксигруппу. Когда спирт представляет собой защищенный нуклеозид или защищенный олигонуклеотид, то предпочтительными нуклеозидами являются дезоксирибонуклеозиды и рибонуклеозиды, а предпочтительными олигонуклеотидами являются олигодезоксирибонуклеотиды и олигорибонуклеотиды. Когда спирт представляет собой производное дезоксирибонуклеозида, рибонуклеозида,олигодезоксирибонуклеотида или олигорибо 003091 6 нуклеотида, включающее в себя свободную 5'гидроксигруппу, то функцию 3'-гидрокси предпочтительно защищают подходящей защитной группой. Примеры таких защитных групп включают в себя ацильные группы, обычно содержащие до 16 атомов углерода, например, группы, полученные из гамма-кетокислот, такие как левулиноиловые группы и замещенные левуиноиловые группы. Замещенные левулиноиловые группы включают в себя, в частности, 5-галолевулиноиловые группы, такие как 5,5,5-трифторлевулиноиловые и бензоилпропиониловые группы. Другие такие защитные группы включают в себя жирные алканоиловые группы,включая, в частности, линейные или разветвленные С 6-16-алканоиловые группы, такие как лауроиловые группы; бензоиловые и замещенные бензоиловые группы, такие как алкил,обычно C1-4-алкил-, и гало, обычно хлор- или фторзамещенные бензоиловые группы; а также простые силиловые эфиры, такие как алкил,обычно C1-4-алкил, арил, обычно фенил, простые силиловые эфиры, в частности, третичные бутилдиметилсилиловые и третичные бутилдифенилсилиловые группы. Когда спирт представляет собой защищенный дезоксирибонуклеозид, рибонуклезид, олигодезоксирибонуклеотиды или олигорибонуклеотид, включающий в себя свободную 3'гидроксигруппу, то функцию 5'-гидрокси предпочтительно защищают подходящей защитной группой. Подходящими защитными группами являются группы, перечисленные выше, для защиты 5'-гидроксигруппы дезоксирибонуклеозидов, рибонуклеозидов, олигодезоксирибонуклеотидов и 3'-Н-фосфонатов олигорибонуклеотидов. Когда спирт представляет собой рибонуклеозид или олигорибонуклеотид, то функцию 2'гидрокси предпочтительно защищают подходящей защитной группой, такой как ацеталь, в частности, 1-(2-фторфенил)-4-метоксипиперидин-4-ил (Fpmp); a также триалкилсилильными группами, зачастую три(С 1-4-алкил)силильными группами, такими как третичный бутилдиметилсилильная группа. Альтернативно рибонуклеозид или олигорибонуклеотид может представлять собой производное 2'-O-алкила, 2'-Oалкоксиалкила или 2'-O-алкенила, обычно производное C1-4-алкила, С 1-4-алкоксиС 1-4-алкила или алкенила; в этом случае положение 2' не нуждается в дополнительной защите. Другие спирты, которые могут быть использованы в способе согласно изобретению,представляют собой несахаридные полиолы,особенно алкилполиолы, и предпочтительно диолы или триолы. Примеры алкилдиолов включают в себя этан-1,2-диол и низкомолекулярные поли(этиленгликоли), например, имеющие молекулярную массу до 400. Примеры алкилтриолов включают в себя глицерин и бутантриолы. Обычно присутствует только одна сво 7 бодная гидроксигруппа, а оставшиеся оксигруппы защищены подходящими защитными группами, такими как перечисленные выше, для защиты в позициях 5'- или 2'- рибонуклеозидов. Однако может присутствовать несколько свободных гидроксигрупп при необходимости осуществления идентичного связывания на нескольких гидроксигруппах. Когда Н-фосфонат и спирт оба представляют собой защищенные нуклеозиды или олигонуклеотиды, данное изобретение предусматривает усовершенствованный способ поэтапного и блок-синтеза в растворе олигодезоксирибонуклеотидов, олигорибонуклеотидов и их аналогов на основе реакций связывания Нфосфоната. В соответствии с одним из предпочтительных аспектов данного изобретения, защищенные нуклеозиды или олигонуклеотиды с 3'-терминальной функцией Н-фосфоната и защищенные нуклеозиды или олигонуклеотиды с 5'-терминальной оксифункцией связывают в присутствии подходящего связывающего агента для получения замещенного промежуточного продукта Н-фосфоната динуклеозида или олигонуклеотида, при этом указанные промежуточные продукты подвергают переносу серы на месте в присутствии подходящего агента для переноса серы. Помимо присутствия гидроксизащитных групп, основания, присутствующие в нуклеозидах/нуклеотидах, используемых в данном изобретении, также при необходимости предпочтительно защищают подходящими защитными группами. Применяемые защитные группы представляют собой группы, известные в данной области для защиты таких оснований. Например, А и/или С могут быть защищены бензоилом, включая замещенный бензоил, например, алкил- или алкокси-, зачастую C1-4-алкилили C1-4-алкокси-, бензоилом; пивалоилом; и амидином, в частности, диалкиламинометиленом, предпочтительно ди(C1-4-алкил)-аминометиленом, таким как диметил- или дибутиламинометилен. G может быть защищен фенильной группой, включая замещенный фенил, например, 2,5-дихлорфенил, а также изобутирильной группой. Т и U обычно не нуждаются в защите, однако, в некоторых вариантах осуществления данного изобретения они могут быть предпочтительно защищены, например, при O4 фенильной группой, включая замещенный фенил, например, 2,4-диметилфенил, либо при N3 пивалоилоксиметил-, бензоил-, алкил- или алкоксизамещенным бензоилом, таким как C1-4 алкил- или C1-4-алкоксибензоил. Когда спирт и/или Н-фосфонат представляет собой защищенный нуклеозид или олигонуклеотид, имеющий защищенные гидроксигруппы, то одна из этих защитных групп может быть удалена после осуществления способа в соответствии с первым изобретением. Обычно удаляемая защитная группа находится на 3' 003091 8 гидрокси- функции. После удаления защитной группы полученный таким образом олигонуклеотид может быть превращен в Н-фосфонат, а затем может быть подвергнут поэтапному или блок-связыванию и переносам серы согласно способу данного изобретения при синтезе желаемой олигонуклеотидной последовательности. Затем способ может быть продолжен дальше стадиями по удалению защитных групп с интернуклеотидных связей, 3'- и 5'-гидроксигрупп и оснований. Подобный метод может быть применен к связыванию 5'-Н-фосфонатов, когда удаляемая защитная группа находится на 5'гидрокси-функции. В особенно предпочтительном варианте данное изобретение предусматривает способ,включающий в себя связывание 3'-Н-фосфоната 5'-О-(4,4'-диметокситритил)-2'-дезоксирибонуклеозида или защищенного 3'-Н-фосфоната олигодезоксирибонуклеотида и компонента со свободной функцией 5'-гидрокси в присутствии подходящего связывающего агента и последующий перенос серы in situ в присутствии подходящего агента для переноса серы. В способе согласно изобретению могут быть использованы любые подходящие связывающие агенты и агенты по переносу серы, известные в данной области. Примеры подходящих связывающих агентов включают в себя хлорангидриды алкиларил-кислоты, сульфонилхлориды алкана и арена, хлорформиаты алкила и арила, хлорсульфиты алкила и арила, а также фосфорохлоридаты алкила и арила. Примеры подходящих хлорангидридов алкилкислоты включают в себя С 2-С 7-алканоилхлориды, в частности, пивалоилхлорид. Примеры используемых хлорангидридов арил-кислоты включают в себя замещенные и незамещенные бензоилхлориды, такие как C1-4-алкокси, галоген в частности. Фтор, хлор и бром, а также C1-4 алкил, замещенные бензоилхлориды. При замещении зачастую присутствуют от 1 до 3 заместителей, в частности, если это алкил- и галогензаместители. Примеры подходящих алкансульфонилхлоридов включают в себя С 2-С 7-алкансульфонилхлориды. Примеры аренсульфонилхлоридов,которые могут быть использованы, включают в себя замещенные и незамещенные бензолсульфонидхлориды, также как C1-4-алкокси, галоген,в частности, фтор, хлор и бром, а также C1-4 алкил, замещенные бензил-сульфонидхлориды. При замещении зачастую присутствуют от 1 до 3 заместителей, в частности, если это алкил- и галогензаместители. Примеры подходящих алкилхлорформиатов включают в себя C2-С 7-алкилхлорформиаты. Примеры арилхлорформиатов, которые могут быть использованы, включают в себя замещенные и незамещенные фенилхлорформиаты, такие как C1-4-алкокси, галоген, в частности, фтор, 9 хлор и бром, а также C1-4-алкил, замещенные фенилхлорформиаты. При замещении зачастую присутствуют от 1 до 3 заместителей, в частности, если это алкил- и галогензаместители. Примеры подходящих алкилхлорсульфитов включают в себя С 2-С 7-алкилхлорсульфиты. Примеры арилхлорсульфитов, которые могут быть использованы, включают в себя замещенные и незамещенные фенилхлорсульфиты, такие как C1-4-алкокси, галоген, в частности, фтор,хлор и бром, а также C1-4-алкил, замещенные фенилхлорсульфиты. При замещении зачастую присутствуют от 1 до 3 заместителей, в частности, если это алкил- и галогензаместители. Примеры подходящих алкилфосфорохлоридатов включают в себя ди(C1-С 6-алкил)фосфорохлоридаты. Примеры арилфосфорохлоридатов, которые могут быть использованы, включают в себя замещенные и незамещенные дифенилфосфорохлоридаты, такие как C1-4-алкокси,галоген, в частности, фтор, хлор и бром, а такжеC1-4-алкил, замещенные дифенилфосфорохлоридаты. При замещении зачастую присутствуют от 1 до 3 заместителей, в частности, если это алкил- и галогензаместители. Другими связывающими агентами, которые могут быть использованы, являются соединения хлора, брома и (бензотриазо-1-илокси)фосфония и карбония, описанные Wada et al., inJ.A.C.8., 1997, 119, pp. 12710-12721 (приводится в данном описании в качестве ссылки). Предпочтительными связывающими агентами являются диарилфосфорохлоридаты, в частности, имеющие формулу (АrО)2 РОСl, где Аr предпочтительно является фенилом, 2-хлорфенилом, 2,4,6-трихлорфенилом или 2,4,6 трибромфенилом. Природа агента по переносу серы зависит от того, требуется ли олигонуклеотид, аналог фосфоротиоата либо смешанный олигонуклеотид/олигонуклеотидфосфоротиоат. Агенты по переносу серы, используемые в способе согласно изобретению зачастую имеют следующую общую химическую формулу: где L - отщепляемая группа, а А - арильная группа, метильная или замещенная алкильная группа, либо алкенильная группа. Обычно отщепляемую группу выбирают таким образом,чтобы она содержала связь азот-сера. Примеры подходящих отщепляемых групп включают в себя морфолины, такие как морфолин-3,5-дион; имиды, такие как фталимиды, сукцинимиды и малеимиды; индазолы, в частности, индазолы с удаляющими электроны заместителями, такие как 4-нитроиндазолы; а также триазолы. Когда в конечном продукте требуется стандартная фосфодиэфирная связь, агент по переносу серы, остаток А представляет собой арильную группу, такую как фенил- или нафтилгруппа. Примеры подходящих арильных групп включают в себя замещенные и незаме 003091 10 щенные фенильные группы, в частности, галофенил- и алкилфенильные группы, особенно 4 галофенил- и 4-алкилфенил-, обычно 4-(C1-4 алкил)фенилгруппы, наиболее предпочтительно 4-хлорфенил- и р-толилгруппы. Примером подходящего класса стандартного, направляющего фосфодиэфир агента по переносу серы являетсяN-(арилсульфанил)фталимид (также может быть использован сукцинимид или другой имид). Когда в конечном продукте требуется фосфоротиоатдиэфирная связь, остаток А представляет собой метил, замещенную алкил- или алкенилгруппу. Примеры подходящих замещенных алкил-групп включают в себя замещенные метильные группы, в частности, бензил и замещенный бензил, такие как алкил-, обычноC1-4-алкил-, и гало-, обычно хлор-, замещенные бензилгруппы, а также замещенные этилгруппы,особенно этилгруппы, замещенные в положении 2 удаляющим электрон заместителем, таким как 2-(4-нитрофенил)этил- и 2-цианоэтильная группы. Примерами подходящих алкенильных групп являются аллил и кротил. Примерами подходящего класса фосфоротиоат-направляющих агентов по переносу серы являются, например, производные (2-цианоэтил)сульфанила, такие как 4/(2-цианоэтил)сульфанил/морфолин-3,5-дион,или соответствующий реактив, такой как 3(фталимидосульфанид)пропанонитрил. Подходящая температура для осуществления реакции связывания и переноса серы находится в интервале приблизительно от -55 С до комнатной температуры (обычно в интервале от 10 до 30 С, например, приблизительно 20 С),предпочтительно от -40 до 0 С. Органические растворители, которые могут быть использованы в способе согласно изобретению, включают в себя галогеналканы, в частности, дихлорметан, сложные эфиры, в частности, сложные алкиловые эфиры, такие как этилацетат и метил- или этилпропионат, а также основные, нуклеофильные растворители, такие как пиридин. Предпочтительными растворителями для стадий связывания и переноса серы являются пиридин, дихлорметан и их смеси. Молярное отношение Н-фосфоната к спирту в способе согласно изобретению часто выбирают в интервале приблизительно от 0,9:1 до 3:1, обычно приблизительно от 1:1 до 2:1, и предпочтительно, приблизительно от 1,1:1 до 1,5:1, например, приблизительно 1,2:1. Однако когда связывание на нескольких свободных гидроксилах происходит одновременно, молярные отношения увеличиваются пропорционально. Молярное отношение связывающего агента к спирту часто выбирают в интервале приблизительно от 1:1 до 10:1, обычно приблизительно от 1,5:1 до 5:1, и предпочтительно приблизительно от 2:1 до 3:1. Молярное отношение агента по переносу серы к спирту часто выбирают в интервале приблизительно от 1:1 до 10:1, обыч 11 но приблизительно от 1,5:1 до 5:1, предпочтительно примерно от 2:1 до 3:1. В способе согласно изобретению Нфосфонат и спирт могут быть предварительно смешаны в растворе, а связывающий агент добавлен к этой смеси. Альтернативно Нфосфонат и связывающий агент могут быть предварительно смешаны, зачастую в растворе,а затем добавлены к раствору спирта, либо спирт и связывающий агент могут быть смешаны, обычно в растворе, а затем добавлены к раствору Н-фосфоната. В некоторых вариантах осуществления данного изобретения Н-фосфонат, необязательно в виде раствора, может быть добавлен к раствору, содержащему смесь спирта и связывающего агента. Практически после завершения реакции связывания к раствору диэфира Н-фосфаната, полученного в результате реакции связывания, добавляют агент по переносу серы. Реагенты обычно добавляют непрерывно или с нарастанием на протяжении периода добавления. Способ согласно изобретению обеспечивает возможность получать олигонуклеотиды,содержащие как фосфодиэфирные, так и фосфоротиоат-диэфирные интернуклеотидные связи, в одной и той же молекуле в результате выбора соответствующих агентов по переносу серы,особенно если способ осуществляют поэтапно. Как указано выше, способ согласно изобретению может быть использован для синтеза последовательностей РНК, 2'-O-aлкил-РНК, 2'O-алкоксиалкил-РНК и 2'-O-алкенил-РНК. 3'-Нфосфонаты 2'-О-(Fpmp)-5'-О-(4,4-диметокситритид)рибонуклеозида 1 и 3'-Н-фосфонаты 2'-О(алкил, алкоксиалкил или алкенил)-5'-О-(4,4 диметокситритил)-рибонуклеозида 2 а-с могут быть, например, получены из соответствующих нуклеозидных строительных блоков, аммоний Используют такие же протоколы, как и при синтезе ДНК и последовательностей фосфоротиоата ДНК (схемы 2-4). Следуя стандартной процедуре по снятию блоков (схема 2, стадии v и vi), защитные группы Fpmp удаляют в мягких условиях кислотного гидролиза, приводящих к невыявляемому отщеплению или миграции интернуклеотидных связей (Capaldi, B.C.; ReeseC.B.Nucleic Acids Res., 1994, 22, 2209-2216). Для последовательностей рибозимов, используемых в химиотерапии, относительно широкомасштабный синтез РНК в растворе является делом особой практической важности. Включение 2'O-алкил, 2'-O-замещенный алкил и 2'-O-алкенилfor Oligonucleotides and Analogs, Agrawal, S., Ed.,"Humana Press Totowa, 1993) в олигонуклеотиды в настоящее время является делом большой важности, поскольку эти модификации обеспечивают как сопротивляемость гидролизации нуклеазы, так и хорошие гибридизационные свойства получаемых олигомеров. Стадию переноса серы осуществляют с продуктом связывания Н-фосфоната in situ, т.е. без разделения и очистки промежуточного продукта, полученного в результате реакции связывания. Предпочтительно, агент по переносу серы добавляют к перемешиваемой смеси, получаемой в результате реакции связывания. Помимо того факта, что ее осуществляют в гомогенном растворе, процедура связывания согласно изобретению отличается от процедуры, применяемой при использовании Нфосфоната в твердофазном синтезе (Froehler etal., Methods in Molecular Biology, 1993), по меньшей мере, в двух других важных отношениях. Во-первых, ее можно проводить при очень низкой температуре. Побочных реакций, сопровождающих связывание Н-фосфоната (KuylYeheskiely et al. , Rec. Trav. Chim. , 1986, 105,505-506), можно таким образом избежать даже при использовании в качестве связывающего агента ди-(2-хлорфенил) фосфородихлоридата, а не пивадоилхлорида (Froehler, B.C.; Matteucci,M.D. Tetrahedron Lett., 1986, 27, 469-472). Во-вторых, перенос серы осуществляют после каждой стадии связывания, а не один раз после сбора всей олигомерной последовательности. Защитные группы могут быть удалены с применением способов, известных в данной области, для конкретной защитной группы и функции. Например, временные защитные группы, в частности, гамма-кетокислоты, такие как защитные группы типа левулиноида, могут быть удалены обработкой гидразином, например, забуференным гидразином, например, обработкой гидразином при очень мягких условиях, описанных van Boom. J.H.; Burgers, P.M.J.Tetrahedron Lett., 1976, 4875-4878. Получаемые частично защищенные олигонуклеотиды со свободными 3'-гидрокси-функциями затем могут быть превращены в соответствующие Нфосфонаты, представляющие собой промежуточные продукты, которые могут быть использованы для блок-синтеза олигонуклеотидов и их фосфоротиоатных аналогов. 13 При снятии защиты с желаемого продукта после его получения, защитные группы на фосфоре, образующие фосфоротиоаттриэфирные связи, обычно удаляют первыми. Например,цианоэтиловая группа может быть удалена путем обработки сильно основным амином, таким как DABCO, 1,5-диазабицикло[4.3.0]-нон-5-ен(DBU) или триэтиламин. Фенильные и замещенные фенильные группы на интернуклеотидных связях фосфоротиоатов и на остатках оснований могут быть удалены путем обработки оксиматом, например,сопряженным основанием альдоксима, предпочтительно, основанием Е-2-нитробензальдоксима или пиридин-2-карбоксальдоксима (Keeseal. J. Am. Chem. Soc., 1984, 106, 4552-4557, Sekine, M. et al Tetrahedron, 1985, 41, 5279-5288, в способе синтеза олигонуклеотидов с применением фосфотриэфира в растворе, основанном на промежуточных продуктах 3-фенилфосфоротиоата; а также van Boom с сотрудниками в способе синтеза олигонуклеотидов, основанном на промежуточных продуктах 3-(4-метилфенил) фосфоротиоата (Wreesman, C.T.J. et al., Tetrahedron Lett., 1985, 26, 933-936), показали, что деблокирование S-фенилфосфоротиоатов ионами оксимата (с применением способа Reese et al.,1978, Reese С.В.; Zard, L. Nucleic Acids Res.,1981, 9, 4611-4626) приводит к образованию естественных интернуклеотидных фосфодиэфирных связей. В соответствии с данным изобретением деблокирование S-(4-хлорфенил)защищенных фосфоротиоатов сопряженным основанием Е-2-нитробензальдоксима протекает гладко и без обнаруживаемого расщепления интернуклеотида. Другие основные защитные группы, например, бензоил-, пивалоил- и амидиновые группы могут быть удалены путем обработки концентрированным водным аммиаком. Присутствующие тритиловые группы могут быть удалены путем обработки кислотой. Относительно всего подхода к деблокированию в целом при синтезе олигодезоксирибонуклеотидов другим важным соображением согласно изобретению является то, что удаление тритиловой, зачастую 5'-терминальной DMTr, защитной группы должно проходить без сопутствующей депуринации, особенно всех 6-N-ацил-2' дезоксиаденозиновых остатков. В соответствии с одним из вариантов осуществления данного изобретения, авторы изобретения обнаружили,что такая депуринация, которой, вероятно,трудно избежать полностью при твердофазном синтезе, может быть полностью подавлена удалением тритиловой группы разбавленным раствором хлороводорода при низкой температуре,в частности, приблизительно 0,45 М хлороводородом в растворе диоксана дихлорметана (1:8 объм/ объм) при -50 С. При таких реакцион 003091 14 ных условиях удаление тритиловой группы может быть быстро завершено, в некоторых случаях через 5 мин и ранее. Например, когда 6-Nбензоил-5'-О-(4,4'-диметокситритил)-2'-дезоксиаденозин обрабатывали хлороводородом в таких условиях, удаление тритиловой группы было завершено через 2 мин, при этом депуринации не обнаруживалось даже через 4 ч. Силилзащитные группы могут быть удалены в результате обработки фторидом, например,раствором соли тетраалкиламмонийфторида,такой как тетрабутиламмонийфторид.Fpmp-защитные группы могут быть удалены путем кислотного гидролиза в мягких условиях. Этот новый подход к синтезу олигонуклеотидов в растворе подходит для получения последовательностей с (а) только фосфодиэфиром,(b) только диэфирфосфоротиоатом и (с) сочетанием интернуклеотидных связей как фосфодиэфира, так и диэфира фосфоротиоата. Данное изобретение также относится к разработке блок-связывания (как показано для примера в схеме 4b). В этом отношении примеры представляют собой иллюстрацию синтезаd[Tp(s)Tp(s)Gp(s)Gp(s)Gp(s)Gp(s)Tp(s)T] (ISIS 5320 Ravikuma, V.T.; Cherovallath, Z.S. NucleosidesNucleosides, 1966, 15, 1149-1155), гептафосфоротиоата октадезоксирибонуклеозида, из тетрамерных блоков. Этот аналог олигонулеотида имеет свойства анти-ВИЧ-агента. Другие предлагаемые назначения блок-синтеза включают в себя последовательности с терапевтическим действием, например, ингибиторы тромбина человека и анти-ВИЧ-агентов. Более того,способ согласно изобретению может быть применен для синтеза больших последовательностей. Очевидно, что когда способ согласно изобретению применяют в блок-синтезе, возникает возможность применения ряда альтернативных способов в смысле методов получения желаемого продукта. Это зависит от природы желаемого продукта. Например, октамер может быть получен в результате получения димеров, соединен для получения тетрамеров, которые затем соединяют для получения желаемого октамера. Альтернативно, димер и тример могут быть соединены для получения пентамера, который может быть соединен с дальнейшим тримером для получения желаемого октамера. Выбор способа остается на усмотрении пользователя. Однако общей характеристикой такого блоксоединения является то, что Н-фосфонат олигомера, включающий в себя две или более единиц,соединяют со спиртом олигомера, также включающим в себя две или более единиц. Чаще всего 3'-Н-фосфонаты олигонуклеотидов соединяют с олигонуклеотидами, имеющими свободные 5'-гидрокси-функции. Способ согласно изобретению может быть также использован для получения циклических 15 олигонуклеотидов, особенно циклических одигодезоксирибонуклеотидов и циклических рибонуклеотидов. При получении циклических олигонуклеотидов получают олигонуклетид,содержащий функцию Н-фосфоната, зачастую 3'- или 5'-Н-фосфоната, и свободную гидроксильную функцию вводят в результате соответствующего снятия защиты. Положение свободной гидроксильной функции обычно выбирают соответственно Н-фосфонату, например,5'-гидроксильную функцию соединяют с 3'-Нфосфонатом, а 3'-гидроксильную функцию соединяют с 5'-Н-фосфонатом. Функции гидроксида и Н-фосфоната могут быть затем соединены интрамолекулярно в растворе в присутствии связывающего агента, а после этой реакции следует перенос серы in situ. В соответствии с дальнейшим аспектом данного изобретения разработаны новые олигомерные Н-фосфонаты, имеющие общую химическую формулу где каждый из В независимо является основанием, выбранным из A, G, Т, С или U; каждый Q независимо является Н или OR',где R'-алкил, замещенный алкил, алкенил или защитная группа; каждый R независимо является арилом,метилом, замещенным алкилом или алкенильной группой;W является Н, защитной группой или группой Н-фосфоната формулыZ является Н, защитной группой или группой Н-фосфоната формулы где М+ - одновалентный катион; и n - целое число, по меньшей мере 2; при условии, что когда W является Н или защитной группой, то Z является группой Нфосфоната, и что когда Z является Н или защитной группой, то W является группой Нфосфоната. Также разработаны новые олигомерные Нфосфонаты, имеющие общую химическую формулу: каждый В независимо является основанием, выбранным из А, G, Т, С или U; каждый Q независимо является Н или OR', где R' является алкилом, замещенным алкилом, алкенилом или защитной группой; каждый R независимо является арилом,метилом, замещенным алкилом или алкенильной группой;W является Н, защитной группой или группой Н-фосфоната формулы где М+ - одновалентный катион; каждый Х независимого или представляет собой О или S; каждый из Y является S;Z является Н защитной группой или группой Н-фосфоната формулыn - целое число; при условии, что когда W является Н или защитной группой, то Z является группой Нфосфоната, и когда Z является Н или защитной группой, то W является группой Н-фосфоната. Предпочтительно только один из W или Z представляет собой группу Н-фосфоната, обычно только Z является группой Н-фосфоната. Когда W или Z представляют собой защитную группу, то защитная группа может быть одной из описанных выше для защиты позиций 3'- или 5'-, соответственно. Когда W- защитная группа, то защитная группа представляет собой тритиловую группу, в частности, диметокситритиловую группу. Когда Z - защитная группа, то защитная группа представляет собой тритиловую группу, в частности, диметокситритиловую группу, либо ацил, предпочтительно,левулиноиловую группу. Основания A, G и С, представленные В,предпочтительно защищены, а основания Т и U могут также быть защищены. Подходящие защитные группы включают в себя группы, описанные выше для защиты оснований согласно первому аспекту данного изобретения. Когда Q является группой OR', a R' является алкенилом, то алкенильная группа часто представляет собой C1-4-алкенильную группу,особенно аллильную или кротильную группу. Когда R' является алкилом, то алкил предпочтительно представляет собой C1-4 алкильную 17 группу. Когда R является замещенным алкилом,то замещенная алкильная группа включает в себя алкоксиалкильные группы, особенно С 1-4 алкилоксиС 1-4-алкильные группы, такие как метоксиэтильные группы. Когда R' является защитной группой, то защитная группа обычно представляет собой кислотно-лабильную ацетальную защитную группу, в частности, 1-(2 фторфенил)-4-метоксипиперидин-4-ил (Fpmp) или триалкилсилильную группу, зачастую три(C1-4-алкил)силильную группу, такую как третичный бутилдиметилсилильную группу. Предпочтительно Х представляет собой 0. Во многих вариантах Y является S, а каждый из R представляет собой метил, замещенный алкил, алкенил- или арильную группу, остающуюся от агента (агентов) по переносу серы,применяемых в способе согласно изобретению. Предпочтительно каждый из R независимо представляет собой метильную группу, замещенную метильную группу, в частности, бензил или замещенную бензильную группу, такую как алкил-, обычно C1-4-алкил- или гало-, обычно хлоро-, замещенная бензильная группа; замещенную этильную группу, особенно этильную группу, замещенную в положении 2 электронудаляющим заместителем, таким как 2-(4 нитрофенид) этил или 2-цианоэтильная группа;C1-4-алкенильную группу, предпочтительно аллильную и кротильную группу; либо замещенную или незамещенную фенильную группу, в частности, галогенфенильную или алкилфенильную группу, особенно 4-галогенфенильную группу или 4-алкилфенил-, обычно 4-(C1-4 алкил)фенильную группу, и наиболее предпочтительно, 4-хлорфенил- или n-толилгруппу. М+ предпочтительно представляет собой ион триалкиламмония, такой как ион три (C1-4 алкиламмоний), и предпочтительно, ион триэтиламмония.n Может иметь значение от 1 до любого числа в зависимости от синтезируемого олигонуклеотида, в частности, приблизительно до 20. Предпочтительно n принимает значения от 1 до 16, в частности, от 1 до 9. Н-фосфонат, в котором n - 1, 2 или 3, может быть использован, если необходимо добавить небольшие блоки нуклеотида с соответственно большими величинами n,например, 5, 6, 7 или более при соединении больших блоков олигонуклеотида. Н-фосфонаты согласно изобретению обычно имеют форму растворов, предпочтительно растворов, применяемых в способе по первому аспекту настоящего изобретения. Эти Н-фосфонаты также могут быть использованы как промежуточные продукты при блок-синтезе олигонуклеотидов и фосфоротиоатов олигонуклеотидов. Как указано выше, блоксоединение намного легче проводить в жидкофазном, чем в твердофазном синтезе. Н-фосфонаты олигонуклеотидов могут быть получены с применением общих способов, 003091 18 известных в данной области, для синтеза Нфосфонатов нуклеозидов. Соответственно,дальнейший аспект данного изобретения предусматривает способ получения Н-фосфоната олигонуклеотида, в котором олигонуклеотид,включающий в себя свободную гидроксифункцию, предпочтительно, 3'- или 5'гидроксифункцию, подвергают реакции с солью алкил или арил-Н-фосфата в присутствии активатора. Олигонуклеотид предпочтительно является защищенным олигонуклеотидом, а наиболее предпочтительно - защищенным олигодезоксинуклеотидом или защищенным олигорибонуклеотидом. Соль Н-фосфоната часто является солью аммония, включая соли алкила, арила и смешанные соли алкила и ариламмония. Соль аммония предпочтительно представляет собой соль (NH4)+ или три (С 1-4 алкил) аммония. Примерами алкильных групп, которые могут присутствовать в Н-фосфонате, являются C1-4 алкил, особенно С 2-4-алкил, группы, замещенные сильными электронудаляющими группами,в частности, гало, и предпочтительно, фторогруппами, такими как 2,2,2-трифторэтил- и 1,1,1,3,3,3-гексафторпропан-2-ил- группы. Примеры присутствующих арильных групп включают в себя фенил и замещенный фенил, в частности, алкилфенил, обычно группы C1-4 алкилфенила и галогенфенила, как правило,хлорфенила. Замещенная фенильная группа предпочтительно представляет собой 4 замещенную фенильную группу. В частности,предпочтительными Н-фосфонатами являются аммоний и триэтиламмоний n-крезил-Нфосфонаты. Применяемые активаторы включают в себя соединения, указанные в данном описании как связывающие агенты, в частности,диарилфосфорохлоридаты, а также хлорангидриды алкил- и циклоалкил- кислоты, такие как 1-адамантанкарбонилхлорид, предпочтительно,пивалоилхлорид. Получение Н-фосфонатов предпочтительно происходит в присутствии растворителя, зачастую растворителей, описанных для применения в способе согласно первому аспекту данного изобретения, предпочтительно, пиридина, дихлорметана и их смесей. Одним из преимуществ данного изобретения в синтезе только диэфиров фосфоротиоатов,является то, что при обеспечении мер во избежание десульфуирования во время стадий снятия блоков [в частности, во время нагревания с водным аммонием(например, схема 3, стадияyiii(a] синтез фосфоротиоатов олигонуклеотидов не должен приводить к получению продуктов, загрязненных стандартными фосфодиэфирными интернуклеотидными связями. При твердофазном синтезе фосфоротиоата олигонуклеотида неполный перенос серы в каждом синтетическом цикле обычно приводит к остаточному загрязнению фосфодиэфира (Zon, G.; Stec, W.J.in 'Oligonucleotides and Analogs. A Practical Approach', Eckstein, F Ed., IBL Press, Oxford, 1991,PP. 87-108). Синтез в растворе, предлагаемый в данном изобретении, имеет другое громадное преимущество над твердофазным синтезом, заключающееся в том, что он обеспечивает возможность контроля над реакциями при низких или даже очень низких температурах. Это преимущество распространяется на стадию удаления тритила (схема 3, стадия i) , которая может проходить быстро и количественно ниже 0 С без обнаруживаемой депуринизации. После стадии удаления тритила может быть проведена сравнительно быстрая и эффективная очистка при помощи описанного ранее метода фильтрации(Chaudhuri, В., Reese, С.В.; Weclawek, К. Tetrahedron Lett., 1984, 25, 4037-4040). Это зависит от того, что промежуточные продукты фосфотриэфира (а также триэфира фосфоротиоата), но не оставшиеся, лишенные тритила заряженные мономеры, очень быстро элюируются с коротких колонок из силикагеля при помощи смесей тетрагидрофурана-пиридина. Далее способ согласно изобретению иллюстрируется со ссылкой на нижеследующие примеры, которые не являются ограничивающими. Относительно примеров следует отметить,что подчеркнутые остатки нуклеозидов и интернуклеотидные связи означают, что они каким-то образом защищены. В контексте данного описания А, С, G и Т представляют собой 2'дезоксиаденозин, защищенный на N-6 бензоильной группой, 2'-дезоксицитидин, защищенный на N-4 бензоильной группой, 2'-дезоксигуанозин, защищенный на N-2 и 0-6 группами изобутирила и 2,5-дихлорфенида, и незащищенный тимина. Например, как указано на схеме 3,p(s) и p(s') представляют собой S-(2-цианоэтил) и S-(4-хлорфенил) фосфоротиоаты, соответственно, а р(н), который не защищен и поэтому не подчеркнут (не выделен курсивом), представляет собой простой моноэфир, если он помещен на конце последовательности или прикреплен к мономеру, иначе он представляет собой диэфир Н-фосфоната. Примеры Реакционная схема для получения динуклеозидфосфатов Конкретно ссылаясь на получение динуклеозидфосфатов, схема 2 описывает более подробно способ согласно изобретению для получения олигодезоксирибонуклеотидов и их фосфоротиоатных аналогов.(ix) 20, DBU, MeCN, комнатная температура, 12 ч. Согласно схеме 2, синтез олигонуклеотидов осуществляется через промежуточные продукты 8, 9, 10 и 11, а получение аналогов фосфоротиоата включает в себя промежуточные продукты 8, 9, 12 и 13. Основания 14, 15 и 16 соответствуют защищенному аденину, защищенному цитозину и защищенному гуанину. Основание 17 соответствует тимину, не нуждающемуся в защите. Может быть использована 21 любая обычно применяемая защитная группа. При синтезе РНК тимин заменяют урацилом. Соединение 18 является подходящим связывающим агентом, а соединения 19 и 21 являются подходящими агентами по переносу серы. Эти соединения описаны ниже более подробно. Мономерные строительные блоки, необходимые для процедуры связывания согласно изобретению, показанной на схеме 2, представляют собой 3'-Н-фосфонаты триэтиламмоний-5'-О-(44'-диметокситритил)-2'-дезоксирибонуклеозидов 8 (основания В и В' = 14 - 17), которые могут быть легко получены в почти количественном выходе из соответствующих производных защищенных нуклеозидов при помощи недавно описанной процедуры (Ozola, V., Resse, С.В.,Song, Q., Tetrahedron Lett., 1996, 31, 8621-8624). В качестве иллюстрации 3'-Н-фосфонаты триэтиламмоний 5'-О-(диметокситритил)-2'-дезоксирибонуклеозида 8 получают следующим образом: Н-фосфонат аммоний-4-метилфенила 30(5,0 ммоль), триэтиламин (4,2 мл, 30 ммоль) и сухой пиридин (20 мл) выпаривают вместе при пониженном давлении. Остаток вновь вместе выпаривают с сухим пиридином (20 мл). Остаток растворяют в сухом пиридине (40 мл), и раствор охлаждают до -35 С (ванна из промышленно метилированных спиртов/сухого льда). К перемешиваемому раствору в течение 1 мин по каплям добавляют пивалоилхлорид (1,85 мл, 15,0 ммоль), поддерживая температуру реактивов на уровне -35 С. Через 30 мин добавляют воду (5 мл), и перемешиваемой смеси дают возможность нагреться до комнатной температуры. К продуктам добавляют буфер из фосфата калия(1,0 ммоль дм-3, рН 7,0, 250 мл), и полученную смесь концентрируют при пониженном давлении то тех пор, пока не будет удален весь пиридин. Остаточную смесь распределяют между дихлорметаном (250 мл) и водой (200 мл). Органический слой промывают буфером из фосфата триэтиламмония (0,5 мол дм-3, рН 7,0, 3 х 50 мл), сушат (MgSO4), а затем упаривают при пониженном давлении. Остаток хроматографически фракционируют на коротких колонках с силикагелем (25 г). Соответствующие фракции,разбавленные дихлорметаном-метанолом (95:5 90:10 об./об.) выпаривают, получая (5'-О(диметокситритил)-2'-дезоксирибонуклеозид-3'Н-фосфонат 8. Когда 3'-Н-фосфонат триэтиламмоний-6N-бензоил-5'-O-(4,4'-диметокситритил)-2'-дезоксиаденозина (DMTr-Ap(H (Ozola et al. , Tetrahedron, 1996), 8 (В-14), 4-N-бeнзoил-3'-O-левулиноил-2'-дезоксицитидин (HO-C-Lev) 9 (В' = 15) и ди-(2-хлорфенил) фосфорохлоридат 18 подвергают совместной реакции в растворе пиридина-дихлорметана при -40 С, то через 5-10 мин соответствующий полностью защищенный 22 Н-фосфонат динуклеозида (DMTr-Ap(H)C-Lev) получают, по-видимому, с количественным выходом. Процедура, используемая в этом конкретном примере, включает в себя добавление по каплям раствора ди-(2-хлорфенил) фосфорохлоридата (2,03 г, 6,0 ммоль) в дихлорметане (4 мл) в течение более 5 мин к перемешиваемому,сухому раствору соли триметиламмония DMTrAp(H) 8 (В=14) (3,95 г, приблизительно 4,8 ммоль) и 4-N-бензоил-3'-О-левулиноил-2'-дезоксицитидину 9 (В'=15) (1,72 г, 4,0 ммоль) в пиридине (36 мл), поддерживаемом при -40 С (баня из промышленно метилированных спиртов + сухой лед). Еще через 5 мин только один нуклеотидный продукт, предположительно DMTrAp(H)C-Lev, и некоторые остаточные мономеры Н-фосфоната 8 (В=14) могут быть обнаружены при помощи ВЭЖХ с обращенной фазой. Однако следует отметить, что эти условия реакции могут быть изменены соответствующим образом. Особенно стоит отметить, что такая высокая эффективность связывания была достигнута только приблизительно при 20% избытке мономера Н-фосфоната. Попытки отделить промежуточный Н-фосфонат динуклеозида (DMTrAp(H)C-Lev) не делалось.J. Org. Chem., 1969, 34, 51-55) добавляют к перемешиваемым реактивам, поддерживаемым при -40 С. Через 15 мин продукты обрабатывают и подвергают хроматографии на силикагеле,получая соответствующий фосфоротиоат динуклеозида DMTr-Ap(s')C-Lev 10 (В=14, В'= 15) с выходом, составляющим приблизительно 99%. Таким образом, как стадия связывания, так и стадия переноса серы проходят относительно быстро и фактически количественно при -40 С. Четырехстадийная процедура (схема 2,стадии iii-vi) деблокирования DMTr-Ap(s')-Lev 10 (В=14, В'=15) предпочтительно включает в себя удаление тритила, ацетилирование 5'терминальной гидрокси-функции, обработку оксимата и наконец обработку концентрированным водным аммонием для удаления ацилзащитных групп из остатков оснований и из 3'- и 5'-терминальных окси-функций. Таким образом получают чрезвычайно чистый d[ApC] 11(В=аденин-9-ил, В' = цитозин-1-ил) без дальнейшей очистки и выделяют в виде его соли натрия. Мономерные строительные блоки 8(В=17) и 9 (В'=16) соединяют вместе таким же образом и в таком же масштабе. После переноса серы N-[(4-хлорфенил)сульфанил]фталимидом 19 полностью защищенный фосфоротиоат динуклеозида DMTr-Tp(s')G-Lev 10 (В=17, В'=16) выделяют с выходом, составляющим приблизительно 98%. Вновь, после деблокирования этого материала при помощи вышеописанной процедуры (схема 2, стадии iii-vi) получают очень 23 чистый d[TpG] 11 (В = тимин-1-ил, В' = гуанин 9-ил). Процедура получения полностью защищенных фосфоротиоатов олигонуклеотидов отличается от процедуры, используемой для синтеза олигонуклеотида, только тем, что перенос серы осуществляют 4-[(2-цианоэтил)сульфанил]морфолин-3,5-дионом 21 или 3-(фталимидосульфанил)пропанонитрилом. Однако 4[(2-цианоэтил)сульфанил]морфолин-3,5-дион имеет то преимущество, что морфолин-3,5 дион, подученный в ходе переноса серы, имеет более высокую водорастворимость, чем фталимид. 3'Н-фосфонат триметиламмоний 6-O-(2,5 дихлорфенил)-5'-O-(4,4'-диметокситритил)-2-Nизобутирил-2'-дезоксигуанозина (DMTr-Gp(H 8 (В = 16) (приблизительно 4,8 ммоль), 6-Nбензоил-3'-О-левулиноил-2'-дезоксиаденозин(НО-А-Lev) 9 (В = 14) (4,0 ммоль) и ди-(2-хлорфенил) фосфорохлоридат 18 (6,0 ммоль) подвергают совместной реакции в растворе пиридина-дихлорметана при -40 С в течение 5-10 мин. Затем добавляют 4-[(2-цианоэтил)сульфанил]-морфолин-3,5-дион 21 (8,0 ммоль) (схема 2, стадия vii), поддерживая реагенты при -40 С. Через 15 мин продукты обрабатывают и фракционируют при помощи хроматографии на силикагеле, получая полностью защищенный фосфоротиоат динуклеозида (DMTr-Gp(s)ALev) 12 (В = 14, В' = 16), при этом выделенный выход составляет 99%. Этот материал деблокируют с применением пятистадийной процедуры(схема 2, стадии iii, iv, vii, ix и vi). После стадий удаления тритила и ацетилирования продукт обрабатывают 1,8-диазабицикло-[5.4.0]ундец-7 еном (DBU) в строго безводных условиях для удаления защитной группы S-(2-цианоэтил). Затем защитную группу 6-O-(2,5-дихлорфенил) удаляют из остатка гуанина путем обработки оксиматом и наконец все ацилзащитные группы удаляют аммонолизом. Стадия обработки оксиматом может быть пропущена, если фосфоротиоат олигонуклеотида не содержит каких-либо остатков 2'-дезоксигуанозина. Чрезвычайно чистый d[Gp(s)A 13 (В = гуанин-9-ил, В' = аденин-9-ил) получают без дальнейшей очистки и выделяют в виде его натриевой соли. Получение 4-[(2-цианоэтил)сульфанил] морфолина-3,5-диона. Хлорид S-(2-цианоэтил)изотиоурония получают следующим образом. Тиомочевину (304 г) растворяют с нагреванием в концентрированной соляной кислоте (500 мл). Полученный раствор выпаривают при пониженном давлении и остаточное твердое бесцветное вещество растворяют в кипящем абсолютном этаноле (1300 мл). Раствор охлаждают до комнатной температуры и по порциям при перемешивании к нему добавляют акрилонитрил (400 см 3). Реактивы нагревают при дефлегмации в течение 2 ч. Охлажденные продукты фильтруют, и остаток 24 промывают холодным этанолом, а затем сушат в вакууме над хлоридом кальция. Затем получают ди-(2-цианоэтил) дисульфид следующим образом. Дихлорметан (400 мл) добавляют к перемешиваемому раствору S-(2 цианоэтил)изотиоурония хлорида (83,0 г) в воде(500 мл) при 0 С (водно-ледяная баня). Добавляют тетрагидрат натрия пербората (44,1 г), а затем по каплям добавляют раствор гидроокиси натрия (30,0 г) в воде (250 мл). Реактивы поддерживают при 0 С (водно-ледяная баня). Через 5 ч продукты разделяют и водный слой экстрагируют дихлорметаном (3 х 50 мл). Объединенные органические слои сушат (МgSO4) и выпаривают при пониженном давлении, получая твердое вещество, которое рекристаллизуют из метанола для получения бесцветных кристаллов. Ди-(2-цианоэтил)дисульфид (4,51 г) и морфолин-2,6-дион (5,75 г) суспендируют в ацетонитриле (10 мл), дихлорметане (20 мл) и 2,6 дутидине (17,4 мл) и охлаждают до 0 С. В течение более 30 мин добавляют раствор бромина(4,28 г) в дихлорметане (20 мл). Реакционной смеси дают возможность перемешиваться при 0 С в течение 1,5 ч. Затем продукт осаждают путем добавления ледяного метанола (50 мл) в течение более 30 мин и фильтруют, получая целевое соединения (8,23 г, 82%). Рекристаллизацией из этилацетата получают 4-[(2-цианоэтил)сульфанид]морфолин-3,5-дион в виде бесцветных иголок, температура плавления: 121122 С. Реакционная схема для получения химерных олигонуклеотидов Поэтапный синтез D[TpGp(s)ApC] 25,имеющего один диэфир фосфоротиоата и две связи интернуклеотида фосфодиэфира, схематично иллюстрируется при помощи примера 3 на схеме 3.(viii) а, концентрированный водный NН 3(d,0,88), 50 С, 15 ч, b, Aniberlite IR-120 (плюс),форма а+ Н 2 О. Никакого ограничения масштаба не предусматривается. Реакция, показанная на схеме 3,не должна рассматриваться как ограничивающая, а способ согласно изобретению одинаково подходит для синтеза РНК, 2'-O-алкил-РНК и других олигонуклеотидных последовательностей. Все применяемые реакции использовались выше для получения либо d[ApC] 11 (В = аденин-9-ил, B' = цитозин-1-ил), либо d[Gp(s)A] 13(В = гуанин-9-ил, В' = аденин-9-ил) (схема 2). Вначале полностью защищенный фосфоротиоат динуклеозида DMTr-Ap(s')-Lev 10 (В = 14, В' = 15) (приблизительно 0,75 ммоль) конвертируют за 4 стадии с общим выделенным выходом, составляющим приблизительно 96%(схема 3 а), в частично защищенный тример 23. На каждой стадии связывания используют приблизительно 20% избытка мономера Нфосфоната 8, однако, избыток связывающего агента 18 зависит от масштаба реакции. Кроме того, в этом примере используют двойной избыток агента по переносу серы 19 или 21. Продукты подвергают хроматографии на силикагеле после каждой стадии удаления тритила. Этот материал затем соединяют с DMTrTp(H) 8, и продукт конвертируют за 3 стадии с общим выходом, составляющим приблизительно 93% (схема 3), в полностью защищенный тетрамер 24. Последний материал деблокируют,получая d[TpGp(s)ApC] 25, который выделяют без дальнейшей очистки в виде его сравнительно чистой (приблизительно 96,5%, как установлено при помощи ВЭЖХ) соли натрия. Трифосфат тетрануклеозида d[TpGpApC] и трифосфоротиоат тетрануклеозида d[Cp(s)Tp(s)Gp(s)A] также получают в результате поэтапного синтеза весьма схожим образом. Используемые процедуры отличаются от процедур, показанных на схеме 3, тем, что агент по переносу серы 19 используют только лишь для полученияd[TpGpApC], а агент для получения серы 21 используют только лишь для полученияd[Cp(s)Tp(s)Gp(s)A]. Реакционная схема для блок-связывания В качестве иллюстрации нижеследующая схема 4 показывает пример блок-связывания,составляющего часть данного изобретения.(iv) a, 21, C5H5N, СН 2 Сl2 -35 С 10 мин, b,C5H5N -H2O (1:1 об./об.), -35C до комнатной температуры. Полностью защищенный гептафосфоротиоат октадезоксинуклеозида 29, который был получен с 91% выделенным выходом, является предшественником d[Tp(s)Tp(s)Gp(s)Gp(s)Gp(s)Gp(s)Tp(s)T]. Как указано выше, блоксоединение намного легче проводить в жидкофазном, чем в твердофазном синтезе. Конечно же, этот способ никоим образом не ограничен связыванием тетрамера. На самом деле предполагается, что этот способ с применением Н-фосфоната подходит для связывания вместе достаточно больших блоков олигонуклеотидов (например, 10 + 10). Реакционная схема для получения блок-Нфосфонатов Например, частично защищенные олигонуклеотиды 33 а и соответствующие фосфоротиоаты 33b, которые могут быть получены в результате известного способа с применением фосфотриэфира в растворе (Chattopadhyaya, J.B.;Chem. Soc., Chem. Соmmun., 1983, 931-953),могут быть подобным образом превращены в их 3'-Н-фосфонаты (34 а и 34b, соответственно), как показано на схеме 5.(1,42 мл, 15 ммоль) и реакции дают возможность перемешиваться при комнатной температуре в течение 12 ч. Для погашения реакции добавляют воду (1,5 мл). Через 10 мин смесь охлаждают до 0 С (водно-ледяная баня), и к ней добавляют гидрат гидразина (1,50 г, 30 ммоль) в пиридине (15 мл) и ледяную уксусную кислоту(15 мл). Смесь перемешивают при 0 С в течение 20 мин, а затем распределяют между водой (100 мл) и CH2Cl2 (100 мл). Оба слоя разделяют и органический слой промывают водой (3 х 50 мл). 27 Органический слой сушат (МgSO4) и выпаривают. Остаток очищают при помощи хроматографии на силикагеле. Примеси элюируют метанолом-дихлорметаном (4:96 об./об.), а основной продукт элюируют ацетоном. Выпаривая соответствующие фракции, получают частично защищенный трифосфоротиоаттетрадезоксинуклеозид в виде твердого бесцветного вещества (5,30 г, 93%). Пример 2. Ас-Тр(s)Tp(s)Gp(s)Gp(H). Соль аммония 4-метилфенил Н-фосфоната(15 мл) и триэтиламина (2,1 мл, 15 ммоль). Смесь выпаривают, а затем вновь выпаривают совместно с пиридином (2 х 10 мл) при пониженном давлении. Добавляют Ас-Тр(s)Tp(s)Gp(s)GOH (4,71 г, 2,5 ммоль) и выпаривают вместе с сухим пиридином (20 мл). Остаток растворяют в сухом пиридине (20 мл) и добавляют пивалоил хлорид (1,23 мл, 10 ммоль) при - 35 С в течение 1 мин. Через 30 мин при этой же температуре добавляют воду (5 мл), и смеси дают возможность нагреться до комнатной температуры и перемешиваться в течение 1 ч. Раствор разделяют между водой (100 мл) и дихлорметаном(100 мл). Органический слой разделяют и промывают триэтиламмонийфосфатным буфером(рН 7,0, 0,5 м, 3 х 50 мл), сушат (MgSO4), а затем фильтруют и помещают в колонку с силикагелем (приблизительно 25 г). Соответствующие фракции, которые были элюированы метанолом-дихлорметаном (20:80, об./об.), выпаривают, получая Ас-Тр(s)Tp(s)Gp(s)Gp(H) в виде твердого бесцветного вещества (4,85 г, 94%). Пример 3. Ас-ТР(s)Tp(s)Gp(s)Gp(s)Gp(s)Ac-TP(s)Tp(s)Gp(s)Gp(H) (1,229 г, 0,6 ммоль) и НО-Gp(s)Gp(s)Tp(s)T-Bz (0,973 г, 0,5 ммоль) выпаривают вместе с безводным пиридином (2 х 10 мл), а остаток растворяют в безводном пиридине (10 мл). Раствор охлаждают до -35 С (баня из промышленно метилированных спиртов и сухого льда) и в течение свыше 10 мин добавляют ди-(2-хлорфенил)фосфорохлоридат (0,84 г, 2,5 ммоль) в сухом дихлорметане (1 мл). Добавляют 4-[(2-цианоэтил) сульфанил]морфолин-3,5-дион (0,80 г, 1,0 ммоль) и смеси дают возможность перемешиваться в течение 10 мин при этой же температуре. Затем добавляют воду-пиридин (0,2 мл, 1:1 об./об.) и смесь перемешивают еще в течение 5 мин. Затем реакционную смесь выпаривают при пониженном давлении. Остаток растворяют в дихлорметане (100 мл) и раствор промывают насыщенным водным раствором бикарбоната натрия (3 х 50 мл). Органический слой сушат(MgSC4) и концентрируют при пониженном давлении. Остаток очищают при помощи хроматографии на силикагеле. Вначале липофильные загрязнители удаляют метанодомдихлорметаном (4:96 об./об.), а затем основной продукт элюируют ацетоном. Выпаривая соответствую 003091 28 щие фракции, получают полностью защищенный гептафосфоротиоат октадезоксинуклеозида в виде твердого бесцветного вещества (1,81 г,91%). Полностью защищенный гептафосфоротиоат октадезоксинуклеозида, который был получен с 91% выделенным выходом, является предшественником d[Tp(s)Tp(s)Gp(s)Gp(s)Gp(s)Gp(s)Tp(s)T]. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения триэфира фосфоротиоата, включающий в себя жидкофазное связывание Н-фосфоната со спиртом в присутствии связывающего агента для получения, таким образом, диэфира Н-фосфоната и in situ реакцию диэфира Н-фосфоната с агентом по переносу серы для получения триэфира фосфоротиоата. 2. Способ по п.1, при котором Н-фосфонат представляет собой защищенный нуклеозид или олигонуклеотид, содержащий функцию 3'-Нфосфоната. 3. Способ по любому из п.1 или 2, при котором спирт представляет собой защищенный нуклеозид или олигонуклеотид, содержащий свободную функцию 5'-гидрокси. 4. Способ по любому из предшествующих пунктов, при котором связывающий агент представляет собой диарилфосфорохлоридат формулы (АrО)2 РОСl, в котором Аr является фенилом,2-хлорфенилом, 2,4,6-трихлорфенилом или 2,4,6-трибромфенилом. 5. Способ по любому из предшествующих пунктов, при котором агент по переносу серы имеет общую химическую формулу в которой L является отщепляемой группой, а А представляет собой замещенную или незамещенную фенильную или нафтильную группу,метильную группу, замещенную группу C1-4 алкила или группу C1-4 алкенила. 6. Способ по п.5, при котором отщепляемая группа представляет собой морфолин-3,5 дион, фталимид, сукцинимид, малеимид или индазол, а А представляет собой 4-галогенфенильную группу, 4-алкилфенильную группу,метильную группу, бензильную группу, алкилбензильную группу, галогенбензильную группу,аллильную группу, кротильную группу, 2 цианоэтильную группу или 2-(4-нитрофенил) этильную группу. 7. Способ по любому из предшествующих пунктов, в котором Н-фосфонат и спирт выбраны из группы, состоящей из дезоксирибонуклеозидов, олигодезоксирибонуклеотидов, рибонуклеозидов, 2'-O-(C1-4 алкил, С 1-4 алкокси-С 1-4 алкил или C1-4 алкенил)рибонуклеозидов, олигорибонуклеотидов и 2'-O-(C1-4 алкил, C1-4 алкоксиС 1-4 алкил или C1-4 алкенил)олигорибонуклеотидов. 8. Н-фосфонат, имеющий общую химическую формулу в которой каждый В независимо является основанием, выбранным из A, G, T, С или U; каждый Q независимо является Н или OR',где R' представляет собой C1-4 алкил, замещенный С 1-4 алкил, C1-4 алкенил или защитную группу; каждый R независимо является замещенным или незамещенным фенилом или нафтилом, метилом, замещенным C1-4 алкилом или C1-4 алкенильной группой;W является Н, защитной группой или группой Н-фосфоната формулы в которой М+ представляет собой одновалентный катион; каждый Х независимо является О или S; каждый Y независимо является О или S;Z является Н, защитной группой или группой Н-фосфоната формулы в которой М+ представляет собой одновалентный катион; и n - целое число, по меньшей мере, равное 2; при условии, что когда W является Н или защитной группой, то Z является группой Нфосфоната, а когда Z представляет собой Н или защитную группу, то W является группой Нфосфоната. 9. Н-фосфонат, имеющий общую химическую формулу в которой каждый В независимо является основанием, выбранным из A, G, T, С или U; каждый Q независимо является Н или OR' ,где R' представляет собой C1-4 алкил, замещенный C1-4 алкил, C1-4 алкенил или защитную группу; каждый R независимо является замещенным или незамещенным фенилом или нафтилом, метилом, замещенным C1-4 алкилом или C1-4 алкенильной группой;W является Н, защитной группой или группой Н-фосфоната формулы в которой М+ представляет собой одновалентный катион; каждый Х независимо является О или S; каждый Y является S;Z является Н, защитной группой или группой Н-фосфоната формулы в которой М+ представляет собой одновалентный катион; и n - целое число; при условии, что когда W является Н или защитной группой, то Z является группой Нфосфоната, а когда Z представляет собой Н или защитную группу, то W является группой Нфосфоната. 10. Н-фосфонат по п.9, в котором W представляет собой защитную группу, каждый Х представляет собой O, а каждый R представляет собой метильную группу, бензильную группу,2-цианоэтильную группу, незамещенную фенильную группу или 4-галогенфенильную группу, М+ представляет собой ион три(С 1-4 алкиламмония), а n принимает значения от 1 до 16. 11. Способ получения Н-фосфоната олигонуклеотида, содержащего 3'-концевую или 5'концевую группу Н-фосфоната, где олигонуклеотид, содержащий свободную 3'- или 5'гидроксифункцию, подвергают реакцииa) либо с C1-4 алкил-Н-фосфонатом, где алкильная группа замещена группой галогена,b) либо с солью замещенного или незамещенного фенил-Н-фосфоната,в присутствии активатора. 12. Способ по п.11, при котором олигонуклеотид, включающий в себя свободную 3'- или 5'-гидрокcифункцию, представляет собой защищенный олигодезоксирибонуклеотид или олигорибонуклеотид. 13. Способ по п.11 или 12, при котором соль алкил- или арил-Н-фосфоната представляет собой аммониевую соль фенил-, C1-4 алкилфенил- или галогенфенил-Н-фосфоната. 14. Способ по любому из пп.11-13, при котором активатор представляет собой арилфосфорохлоридат или хлорид алкилкислоты. 15. Способ по п.14, при котором активатор представляет собой пивалоилхлорид. 16. Способ по любому из пп.11-15, при котором свободная гидроксифункция представляет собой 3'-гидроксифункцию. 17. Н-фосфонат по п.8, в котором W представляет собой защитную группу, каждый Х является О, а каждый R является метильной группой, бензильной группой, 2-цианоэтильной группой, незамещенной фенильной группой или 4-галогенфенильной группой, М+ представляет 31 собой ион три(C1-4 алкиламмония), а n принимает значения от 2 до 16. 18. Н-фосфонат по любому из п.8 или 17, в котором n принимает значения 2 или 3. 19. Н-фосфонат по любому из п.9 или 10, в котором n принимает значения 1, 2 или 3. 20. Способ по любому из пп.1-3, при котором связывающий агент представляет собой диарилфосфорохлоридат формулы (ArO)zPOCl,в которой Аr представляет собой фенил, 2 хлорфенил, 2,4,6-трихлорфенил или 2,4,6-трибромфенил; а агент по переносу серы имеет общую химическую формулу в которой L является отщепляемой группой, а А представляет собой арильную группу, метильную группу, замещенную алкильную группу или алкенильную группу. 21. Способ по п.20, при котором отщепляемая группа представляет собой морфолин 3,5-дион, фталимид, сукцинимид, малеимид или индазол, а А представляет собой 4-галогенфенильную группу,4-алкилфенильную группу, метильную группу, бензильную группу,алкилбензильную группу, галогенбензильную группу, аллильную группу, кротильную группу,2-цианоэтильную группу или 2-(4-нитрофенил) этильную группу. 22. Способ по п.20 или 21, при котором Нфосфонат и спирт выбраны из группы, состоящей из дезоксирибонуклеозидов, олигодезоксирибонуклеотидов,рибонуклеозидов,2'-O(алкил, алкоксиалкил или алкенил)рибонуклеозидов, олигорибонуклеотидов и 2'-O-(алкил,алкоксиалкил или алкенил)олигорибонуклеотидов. 23. Способ получения фосфодиэфира олигонуклеотида со снятой защитой, фосфоротиоата олигонуклеотида со снятой защитой или олигонуклеотида со снятой защитой, содержащего как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи, который включает в себя а) жидкофазное связывание защищенного Н-фосфоната нуклеозида или олигонуклеотида,содержащего функцию 3'- или 5'-Н-фосфоната, с защищенным нуклеозидом или олигонуклеотидом, содержащим свободную 3'- или 5'-гидроксифункцию, в присутствии связывающего агента для получения, таким образом, диэфира Н-фосфоната и in situ реакцию диэфира Нфосфоната с агентом по переносу серы для получения триэфира фосфоротиоата; иb) снятие защиты с триэфира фосфоротиоата, полученного на стадии а), для получения,таким образом, фосфодиэфира олигонуклеотида со снятой защитой, фосфоротиоата олигонуклеотида со снятой защитой или олигонуклеотида со снятой защитой, содержащего как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи. 32 24. Способ по п.23, при котором защищенный Н-фосфонат нуклеозида или олигонуклеотида содержит функцию 3'-Н-фосфоната, а защищенный нуклеозид или олигонуклеотид содержит свободную 5'-гидроксифункцию. 25. Способ по п.23 или 24, при котором связывающий агент представляет собой диарилфосфорохлоридат формулы (ArO)zPOCl, в которой Аr представляет собой фенил, 2 хлорфенил, 2,4,6-трихлорфенил или 2,4,6 трибромфенил. 26. Способ по любому из пп.23-25, при котором агент по переносу серы имеет общую химическую формулу в которой L является отщепляемой группой, а А представляет собой замещенную или незамещенную фенильную или нафтильную группу,метильную группу, замещенную C1-4 алкильную группу или С 1-4 алкенильную группу. 27. Способ по п.26, при котором отщепляемая группа представляет собой морфолин 3,5-дион, фталимид, сукцинимид, малеимид или индазол, а А представляет собой 4-галогенфенильную группу, 4-алкилфенильную группу,метильную группу, бензильную группу, алкилбензильную группу, галогенбензильную группу,аллильную группу, кротильную группу, 2 цианоэтильную группу или 2-(4-нитрофенил) этильную группу. 28. Способ по любому из пп.23-27, при котором используют Н-фосфонат олигонуклеотида и/или олигонуклеотид, содержащий 3'- или 5'-гидроксифункцию, и либо один из них, либо оба они - Н-фосфонат олигонуклеотида и олигонуклеотид, содержащий 3'- или 5'-гидроксифункцию, - содержат одну или более фосфоротиоатных интернуклеотидных связей. 29. Способ по любому из пп.23-28, при котором олигонуклеотид со снятой защитой подвергается дальнейшей очистке. 30. Способ по п.29, при котором олигонуклеотид со снятой защитой содержит одну или более фосфоротиоатдиэфирных связей. 31. Способ по любому из пп.11-16, при котором олигонуклеотид, содержащий свободную гидроксигруппу, содержит одну или более фосфоротиоатных интернуклеотидных связей. 32. Способ по любому из пп.2-7, при котором Н-фосфонат, содержащий функцию 3'-Нфосфоната, представляет собой защищенный Нфосфонат олигонуклеотида, содержащий, по меньшей мере, одну фосфоротиоатную интернуклеотидную связь. 33. Способ по любому из пп.3-7, при котором спирт, содержащий свободную 5'-гидроксифункцию, представляет собой олигонуклеотид, содержащий, по меньшей мере, одну фосфоротиоатную интернуклеотидную связь. 34. Способ по п.33, при котором Нфосфонат представляет собой защищенный Нфосфонат олигонуклеотида, содержащий функ 33 цию 3'-Н-фосфоната, а также содержащий, по меньшей мере, одну фосфоротиоатную интернуклеотидную связь. 35. Соединение формулы в которой А представляет собой замещенную или незамещенную фенильную или нафтильную группу, метил, замещенную C1-4 алкильную илиC1-4 алкенильную группу. 36. Соединение по п.35, в котором А представляет собой -Ph или -CH2CH2CN. 37. Способ введения группы формулы -S-A во фрагмент Н-фосфоната, который включает в себя реакцию субстрата, содержащего фрагмент Н-фосфоната, с соединением формулы в которой А представляет собой замещенную или незамещенную фенильную или нафтильную группу, метильную группу, замещенную C1-4 алкильную или C1-4 алкенильную группу. 38. Способ по п.37, при котором А представляет собой -Ph или -CH2CH2CN. 39. Соединение формулы в которой А представляет собой -CH2CH2CN или С 1-4 алкенил. 40. Способ введения группы формулы -S-A во фрагмент Н-фосфоната, который включает в себя реакцию субстрата, содержащего фрагмент Н-фосфоната, с соединением формулы 34 в которой А представляет собой метильную или в которой А представляет собой C1-4 алкенил. 42. Усовершенствованный способ синтеза фосфодиэфира олигонуклеотида со снятой защитой, фосфоротиоата олигонуклеотида со снятой защитой или олигонуклеотида со снятой защитой, содержащего как фосфодиэфирные,так и фосфоротиоатдиэфирные интернуклеотидные связи, который включает в себя способ соединения, при котором образуется защищенный триэфир фосфоротиоата олигонуклеотида,и способ снятия защиты, при котором образуется фосфодиэфир олигонуклеотида со снятой защитой, фосфоротиоат олигонуклеотида со снятой защитой или олигонуклеотид со снятой защитой, содержащий как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи, усовершенствование, при котором способ соединения включает в себя жидкофазное связывание защищенного Н-фосфоната нуклеозида или олигонуклеотида, содержащего функцию 3'или 5'-Н-фосфоната, с защищенным нуклеозидом или олигонуклеотидом, содержащим свободную 3'- или 5'-гидроксифункцию, в присутствии связывающего агента для получения, таким образом, диэфира Н-фосфоната и in situ реакцию диэфира Н-фосфоната с агентом по переносу серы для получения триэфира фосфоротиоата. 43. Способ по п.42, при котором фосфодиэфир олигонуклеотида со снятой защитой, фосфоротиоат олигонуклеотида со снятой защитой или олигонуклеотид со снятой защитой, содержащий как фосфодиэфирные, так и фосфоротиоатдиэфирные интернуклеотидные связи,подвергаются дальнейшей очистке.
МПК / Метки
МПК: C07F 9/165, C07H 21/00
Метки: фазе, жидкой, синтез, олигонуклеотидов
Код ссылки
<a href="https://eas.patents.su/18-3091-sintez-oligonukleotidov-v-zhidkojj-faze.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез олигонуклеотидов в жидкой фазе</a>
Следующий патент: Стероиды с фторированной 17α-алкильной цепью, обладающие антигестагенным действием
Случайный патент: Устройство управления












