Фармацевтические композиции, включающие бриварацетам
Номер патента: 22057
Опубликовано: 30.10.2015
Авторы: Барийаро Валери, Бервар Моник, Фанара Доменико, Кюйпер Серж
Формула / Реферат
1. Пероральная фармацевтическая композиция в форме таблетки с немедленным высвобождением, включающая частицы, которые содержат активный ингредиент и в качестве эксципиента от 0,1 до 60 мас.% циклодекстринового агента в расчете на общую массу частиц, а активным ингредиентом является бриварацетам.
2. Композиция по п.1, где циклодекстриновый агент выбирают из α-циклодекстрина, β-циклодекстрина, гидроксипропил-β-циклодекстрина, метил-β-циклодекстрина, сульфобутил-β-циклодекстрина, γ-циклодекстрина и гидроксипропил-γ-циклодекстрина.
3. Композиция по п.2, где циклодекстриновым агентом является β-циклодекстрин.
4. Композиция по любому из пп.1-3, где частицы включают от 1,0 до 30 мас.% циклодекстринового агента в расчете на общую массу частиц.
5. Композиция по любому из пп.1-4, где частицы включают дезинтегрирующий агент в качестве эксципиента.
6. Композиция по п.5, где дезинтегрирующим агентом является натриевая соль кроскармелозы.
7. Композиция по п.5 или 6, где частицы включают от 0,5 до 25 мас.% дезинтегрирующего агента в расчете на общую массу частиц.
8. Композиция по любому из предшествующих пунктов, где частицы включают в качестве эксципиента разбавитель.
9. Композиция по п.8, где разбавителем является моногидрат лактозы.
10. Композиция по п.8 или 9, где частицы включают от 5 до 95 мас.% разбавителя в расчете на общую массу частиц.
11. Композиция по п.1, включающая частицы, содержащие
бриварацетам в качестве активного ингредиента,
от 0,1 до 60 мас.% циклодекстринового агента,
от 0,5 до 25 мас.% дезинтегрирующего агента и
от 5 до 95 мас.% разбавителя в расчете на общую массу частиц.
12. Композиция по п.1, включающая частицы, содержащие
бриварацетам в качестве активного ингредиента,
от 0,1 до 60 мас.% циклодекстринового агента,
от 0,5 до 25 мас.% натриевой соли кроскармелозы и
от 5 до 95 мас.% моногидрата лактозы в расчете на общую массу частиц.
13. Способ получения композиции по любому из предшествующих пунктов, включающий, по крайней мере, стадию сухой грануляции.
14. Способ по п.13, включающий
первую стадию, на которой смешивают активный ингредиент, циклодекстриновый агент и эксципиенты,
вторую стадию, на которой полученную смесь прессуют и/или уплотняют, и
третью стадию, на которой смесь измельчают, при этом получают частицы.
15. Способ по п.14, включающий
четвертую стадию, на которой смешивают полученные частицы и эксципиенты, и
пятую стадию, на которой конечную смесь прессуют и/или уплотняют, при этом получают таблетки.
Текст
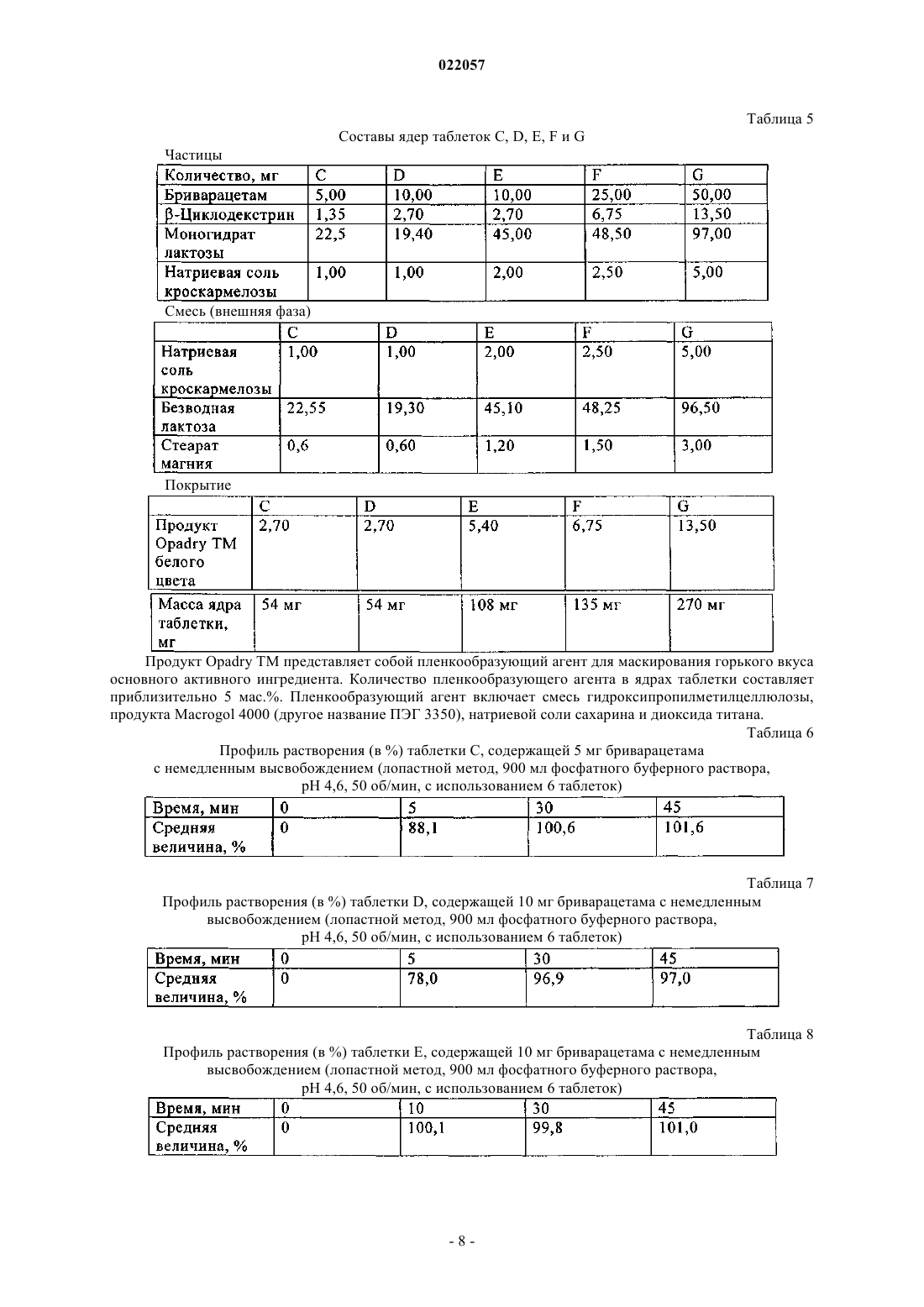
В настоящем изобретении предлагается фармацевтическая композиция бриварацетама, способ ее получения и применение для лечения. В заявке WO 01/62726 описаны производные 2-оксо-1-пирролидина и способы их получения. Прежде всего описан (2S)-2-[(4R)-2-оксо-4-пропилпирролидин-1-ил]бутанамид, международное непатентованное название - бриварацетам. В заявке WO 2005/121082 описан способ получения производных 2-оксо-1-пирролидина и прежде всего способ получения (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксо-4-пропилпирролидин-1-ил]бутанамида,международное непатентованное название - селетрацетам. Таким образом, производные 2-оксо-1-пирролидина часто используют в фармацевтической промышленности. Бриварацетам является пригодным для лечения эпилепсии. Клинические испытания выявили эффективность и безопасность бриварацетама (5, 20 и 50 мг/сут.) при дополнительном лечении эпилепсии взрослых пациентов, у которых парциальные судороги с вторичной генерализацией или без нее не поддаются лечению. Бриварацетам также является эффективным при лечении пациентов, страдающих от постгерпетической невралгии. Селетрацетам также проявляет эффективность при лечении эпилепсии. Проводили два клинических испытания селетрацетама при лечении эпилепсии, в ходе которых оценивали его эффективность и безопасность при дополнительном лечении взрослых пациентов, у которых парциальные судороги не поддаются лечению и которым в ходе испытаний вводили противоэпилептические лекарственные средства. Одним объектом настоящего изобретения является фармацевтическая композиция, которую можно вводить перорально с немедленным высвобождением фармацевтически активных веществ. Поскольку согласно биофармацевтической классификационной системе бриварацетам и селетрацетам относятся к классу BCS I, то их профили растворения in vitro (прибор USP 711,2), определенные по методике испытаний композиций при растворении in vitro, описанной в документе "Guidance forIndustry Immediate Release Solid Oral Dosage Forms" (Центр оценки и исследований лекарственных средств, ноябрь 1995), должны удовлетворять критерию, описанному в положении А документации по растворению: растворение 85% в течение 15 мин в 900 мл 0,1 н. HCl. Если профили не удовлетворяют указанному критерию, то они должны удовлетворять критериям испытаний, описанных в положении В или С. Термин "немедленное высвобождение", использованный в данном контексте, в основном обозначает отсутствие модифицированного или контролируемого высвобождения и высвобождение in vitro (прибор USP 711,2) по крайней мере 75% в течение 45 мин в соответствующей буферной водной среде. В настоящем изобретении предлагается пероральная фармацевтическая композиция в форме таблетки с немедленным высвобождением, включающая частицы, которые содержат активный ингредиент и в качестве эксципиента от 0,1 до 60 мас.% циклодекстринового агента в расчете на общую массу частиц,а активным ингредиентом является бриварацетам. Термин "активный ингредиент", использованный в данном контексте, обозначает вещество или лекарственное средство с лечебным действием. Кроме того, он может обозначать смесь веществ с лечебным действием. Содержание активного ингредиента в фармацевтической композиции по настоящему изобретению может изменяться в зависимости от пациента, которому вводят композиции, и от заболевания, подлежащего лечению. Пероральная композиция по настоящему изобретению находится в твердой форме. Термин "частицы" включает гранулы, микрогранулы, микрочастицы, пеллеты. Обычно фармацевтическая композиция по настоящему изобретению включает частицы, включающие, по крайней мере, активный ингредиент и, по крайней мере, циклодекстриновый агент. Существуют различные типы фармацевтических композиций, содержащих частицы, такие как таблетки, порошки,гранулы, капсулы. Частицами можно заполнять пакетики, такие как пакетики, содержащие дозу активного агента. Таким образом, препарат удобно вводить и частицы можно делить и дозировать простым способом. Термин "циклодекстриновый агент", использованный в данном контексте, обозначает фармацевтически приемлемый эксципиент, который представляет собой циклический олигосахарид, состоящий из 6,7 или 8 -D-глюкопиранозных звеньев и известный под названием -, - или -циклодекстрин соответственно. Обычно циклодекстриновый агент выбирают из -циклодекстрина, -циклодекстрина, гидроксипропилциклодекстрина, метилциклодекстрина, сульфобутилциклодекстрина, -циклодекстрина и гидроксипропилциклодекстрина. Предпочтительным циклодекстриновым агентом является циклодекстрин с кристаллической структурой в отличие от аморфного циклодекстрина. В предпочтительном варианте циклодекстриновым агентом является -циклодекстрин с содержанием воды от 4 до 18 мас.%, предпочтительно от 5 до 16 мас.% и более предпочтительно от 10 до 16 мас.%. Наилучшие результаты были получены для -циклодекстрина с содержанием воды от 10 до 14 мас.%. Более предпочтительно циклодекстриновым агентом является -циклодекстрин, выпускаемый под торговым названием Kleptose, Betadex или CavamaxW7. Обычно фармацевтическая композиция по настоящему изобретению включает от 0,1 до 50 мас.% циклодекстринового агента в расчете на общую массу частиц. Прежде всего фармацевтическая композиция по настоящему изобретению включает от 0,1 до 45 мас.% циклодекстринового агента. Предпочтительно фармацевтическая композиция по настоящему изобретению включает от 0,5 до 40 мас.% циклодекстринового агента, более предпочтительно от 1,0 до 30 мас.% циклодекстринового агента и наиболее предпочтительно от 1,0 до 15 мас.% циклодекстринового агента в расчете на общую массу частиц. Наилучшие результаты были получены для циклодекстринового агента в количестве 4,0 до 11 мас.%. Частицы по настоящему изобретению могут также включать в качестве эксципиента дезинтегрирующий агент, разбавитель, технологическую добавку, смазывающий агент, скользящий агент и их смеси. Частицы по настоящему изобретению могут также включать в качестве эксципиента дезинтегрирующий агент. Термин "дезинтегрирующий агент", использованный в данном конетксте, обозначает агент, ускоряющий распадение таблетки и диспергирование активного ингредиента в воде или желудочнокишечном соке. Дезинтегрирующий агент можно включать в состав фармацевтической композиции в виде одного соединения или в виде смеси соединений. Примеры дезинтегрирующих агентов включают крахмалы, предварительно желатинизированный крахмал, натриевую соль кроскармелозы (другое название сшитая натриевая соль карбоксиметилцеллюлозы) и сшитый поливинилпирролидон. Предпочтительные дезинтегрирующие агенты по настоящему изобретению включают сшитый поливинилпирролидон, натриевую соль гликолята крахмала и натриевую соль кроскармелозы. Наиболее предпочтительным дезинтегрирующим агентом является натриевая соль кроскармелозы (сшитая натриевая соль карбоксиметилцеллюлозы). Предпочтительно частицы по настоящему изобретению включают от 0,5 до 25 мас.% дезинтегрирующего агента, более предпочтительно от 1,0 до 15 мас.% дезинтегрирующего агента, наиболее предпочтительно от 1,5 до 8 мас.% дезинтегрирующего агента в расчете на массу частиц. Наилучшие результаты были получены для дезинтегрирующего агента в количестве 2,0 до 5 мас.%. Частицы по настоящему изобретению могут также включать в качестве эксципиента разбавитель. Термин "разбавитель", использованный в данном контексте, обозначает агент, используемый в качестве наполнителя для обеспечения требуемого объема или массы композиции. Разбавитель может присутствовать в фармацевтической композиции в гранулах в виде отдельно соединения или смеси соединений. Примеры разбавителей включают, но не ограничиваясь только ими, лактозу, крахмал, предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, силилированную микрокристаллическую целлюлозу, ацетат целлюлозы, декстрозу, маннит, фосфат натрия, фосфат калия, фосфат кальция, фруктозу, мальтозу, сорбит или сахарозу. Предпочтительными разбавителями являются лактоза и крахмал. Более предпочтительными разбавителями являются моногидрат лактозы, безводная лактоза или их смесь. Наилучшие результаты были получены для моногидрата лактозы. Обычно частицы по настоящему изобретению включают от 5 до 95 мас.% разбавителя в расчете на массу частиц. Предпочтительно частицы по настоящему изобретению включают от 10 до 90 мас.% разбавителя в расчете на общую массу частиц. Более предпочтительно частицы по настоящему изобретению включают от 30 до 90 мас.% разбавителя в расчете на массу частиц. Частицы по настоящему изобретению могут также включать в качестве эксципиента смазывающий агент. Примеры смазывающих агентов включают, но не ограничиваясь только ими, тальк, стеарат магния,стеарат кальция, полоксамер, лаурилсульфат натрия, стеариновую кислоту, гидрированное касторовое масло. Предпочтительным смазывающим агентом по настоящему изобретению является стеарат магния. Обычно частицы по настоящему изобретению включают от 0 до 5,50 мас.% смазывающего агента в расчете на общую массу частиц. Предпочтительно частицы по настоящему изобретению включают от 0,001 до 2,50 мас.% смазывающего агента в расчете на массу частиц. Более предпочтительно частицы по настоящему изобретению включают от 0,01 до 2,0 мас.% смазывающего агента в расчете на общую массу частиц. Настоящее изобретение предпочтительно включает указанные частицы в качестве дисперсной фазы в твердой непрерывной фазе, которая является внешней фазой гранул. Указанная твердая внешняя фаза может являться фазой матрицы (например, в таблетке) или смесью эксципиентов (например, в капсуле или пакетике). Частицы по настоящему изобретению также можно включать во внешнюю фазу, включающую в качестве эксципиента другие неактивные ингредиенты, такие как дезинтегрирующие агенты, разбавитель, технологическую добавку, смазывающий агент, скользящий агент и их смеси. Частицы смешивают с внешней фазой. Примеры смазывающих агентов включают, но не ограничиваясь только ими, тальк, стеарат магния,-2 022057 стеарат кальция, полоксамер, лаурилсульфат натрия, стеариновую кислоту, гидрированное касторовое масло. Предпочтительным смазывающим агентом по настоящему изобретению является стеарат магния. Обычно фармацевтическая композиция по настоящему изобретению включает от 0 до 5,50 мас.% смазывающего агента в расчете на общую массу композиции. Предпочтительно фармацевтическая композиция по настоящему изобретению включает от 0,5 до 2,50 мас.% смазывающего агента. Более предпочтительно фармацевтическая композиция включает от 0,5 до 2,0 мас.% смазывающего агента в расчете на общую массу композиции. Фармацевтическая композиция по настоящему изобретению может также включать в качестве эксципиента дезинтегрирующий агент. Примеры дезинтегрирующих агентов включают крахмалы, предварительно желатинизированный крахмал, натриевую соль кроскармелозы (другое название сшитая натриевая соль карбоксиметилцеллюлозы) поливинилпирролидон. Предпочтительные дезинтегрирующие агенты по настоящему изобретению включают поливинилпирролидон, натриевую соль гликолята крахмала и натриевую соль кроскармелозы. Наиболее предпочтительным дезинтегрирующим агентом является натриевая соль кроскармелозы (сшитая натриевая соль карбоксиметилцеллюлозы). Предпочтительно фармацевтическая композиция по настоящему изобретению включает от 0 до 7,0 мас.% дезинтегрирующего агента, более предпочтительно от 1,5 до 6,0 мас.% дезинтегрирующего агента,наиболее предпочтительно от 3,0 до 5,0 мас.% дезинтегрирующего агента в расчете на общую массу композиции. Фармацевтическая композиция по настоящему изобретению может также включать внешнюю фазу. Внешняя фаза может включать в качестве эксципиента разбавители, смазывающий агент и/или скользящий агент. Предпочтительно внешняя фаза не включает активный ингредиент. Примеры разбавителей включают, но не ограничиваясь только ими, лактозу, крахмал, предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, силилированную микрокристаллическую целлюлозу, ацетат целлюлозы, декстрозу, маннит, фосфат натрия, фосфат калия, фосфат кальция, фруктозу, мальтозу, сорбит или сахарозу. Предпочтительными разбавителями являются лактоза и крахмал. Более предпочтительными разбавителями являются моногидрат лактозы, безводная лактоза или их смесь. Наилучшие результаты были получены для безводной лактозы. Обычно фармацевтическая композиция по настоящему изобретению включает от 5 до 90 мас.% разбавителя в расчете на общую массу фармацевтической композиции. Предпочтительно она включает от 10 до 90 мас.% разбавителя. Более предпочтительно она включает от 15 до 60 мас.% разбавителя в расчете на общую массу композиции. Внешняя фаза фармацевтической композиции по настоящему изобретению может также включать смазывающий агент. Примеры смазывающих агентов включают, но не ограничиваясь только ими, тальк, стеарат магния,стеарат кальция, полоксамер, лаурилсульфат натрия, стеариновую кислоту, гидрированное касторовое масло. Предпочтительным смазывающим агентом по настоящему изобретению является стеарат магния. Обычно фармацевтическая композиция по настоящему изобретению включает от 0,25 до 5,50 мас.% смазывающего агента в расчете на общую массу композиции. Предпочтительно фармацевтическая композиция по настоящему изобретению включает от 0,5 до 2,50 мас.% смазывающего агента. Более предпочтительно фармацевтическая композиция по настоящему изобретению включает от 0,5 до 2,0 мас.% смазывающего агента в расчете на общую массу композиции. Внешняя фаза фармацевтической композиции по настоящему изобретению может также включать скользящий агент. Примеры скользящих агентов включают, но не ограничиваясь только ими, коллоидный диоксид кремния и тальк. Предпочтительным скользящим агентом по настоящему изобретению является коллоидный диоксид кремния. Обычно фармацевтическая композиция по настоящему изобретению включает от 0 до 5,00 мас.% скользящего агента в расчете на общую массу фармацевтической композиции. Предпочтительно композиция включает от 0 до 2,50 мас.% скользящего агента. Более предпочтительно композиция включает от 0 до 2,00 мас.% скользящего агента в расчете на общую массу композиции. В одном варианте осуществления настоящего изобретения фармацевтическая композиция включает частицы, включающие в качестве активного агента бриварацетам и от 0,1 до 60 мас.%, по крайней мере,циклодекстринового агента в расчете на общую массу частиц. Прежде всего, фармацевтическая композиция включает частицы, включающие бриварацетам в качестве активного ингредиента,от 0,1 до 60 мас.%, по крайней мере, циклодекстринового агента,от 0,5 до 25 мас.% дезинтегрирующего агента и от 5 до 95 мас.% разбавителя в расчете на общую массу частиц. Прежде всего фармацевтическая композиция включает частицы, включающие бриварацетам в качестве активного ингредиента,от 0,1 до 50 мас.%, по крайней мере, циклодекстринового агента,-3 022057 от 1,0 до 15 мас.% дезинтегрирующего агента и от 10 до 90 мас.% разбавителя в расчете на общую массу частиц. Прежде всего фармацевтическая композиция включает частицы, включающие бриварацетам в качестве активного ингредиента,от 1,0 до 30 мас.%, по крайней мере, циклодекстринового агента,от 1,5 до 8 мас.% дезинтегрирующего агента и от 30 до 90 мас.% разбавителя в расчете на общую массу частиц. В другом варианте осуществления настоящего изобретения фармацевтическая композиция включает частицы, включающие в качестве активного агента бриварацетам и от 0,1 до 60 мас.%, по крайней мере, циклодекстринового агента в расчете на общую массу частиц, натриевую соль кроскармелозы и моногидрат лактозы. Прежде всего фармацевтическая композиция включает частицы, включающие бриварацетам в качестве активного ингредиента,от 0,1 до 60 мас.%, по крайней мере, циклодекстринового агента,от 0,5 до 25 мас.% натриевой соли кроскармелозы и от 5 до 95 мас.% моногидрата лактозы в расчете на общую массу частиц. Прежде всего фармацевтическая композиция включает частицы, включающие бриварацетам в качестве активного ингредиента,от 0,1 до 50 мас.%, по крайней мере, циклодекстринового агента,от 2,0 до 15 мас.% натриевой соли кроскармелозы и от 10 до 90 мас.% моногидрата лактозы в расчете на общую массу частиц. Прежде всего фармацевтическая композиция включает частицы, включающие бриварацетам в качестве активного ингредиента,от 1,0 до 30 мас.%, по крайней мере, циклодекстринового агента,от 2,5 до 8 мас.% натриевой соли кроскармелозы и от 30 до 90 мас.% моногидрата лактозы в расчете на общую массу частиц. В предпочтительном варианте осуществления настоящего изобретения композиция включает частицы, включающие 10,00 мг бриварацетама, 2,70 мг -циклодекстрина, 19,40 мг моногидрата лактозы и 1,00 мг натриевой соли кроскармелозы. В другом предпочтительном варианте осуществления настоящего изобретения композиция включает частицы, включающие 10,00 мг бриварацетама, 2,70 мг -циклодекстрина, 19,30 безводной лактозы,19,40 мг моногидрата лактозы и 2,00 мг натриевой соли кроскармелозы. В еще одном предпочтительном варианте осуществления настоящего изобретения композиция включает частицы, включающие 25,00 мг бриварацетама, 6,75 мг -циклодекстрина, 48,50 мг лактозы и 2,50 мг натриевой соли кроскармелозы. В другом предпочтительном варианте осуществления настоящего изобретения композиция включает частицы, включающие 50,00 мг бриварацетама, 13,50 мг -циклодекстрина, 97,00 мг лактозы и 5,00 мг натриевой соли кроскармелозы. В предпочтительном варианте осуществления настоящего изобретения композиция представляет собой таблетку, которая включает частицы и фармацевтически приемлемые добавки, при этом указанные частицы включают 10,00 мг бриварацетама, 2,70 мг -циклодекстрина, 19,40 мг моногидрата лактозы и 1,00 мг натриевой соли кроскармелозы и добавки, включающие 1,00 мг натриевой соли кроскармелозы,19,30 безводной лактозы и 0,60 мг стеарата магния. В другом предпочтительном варианте осуществления настоящего изобретения композиция представляет собой таблетку, которая включает частицы и фармацевтически приемлемые добавки, при этом указанные частицы включают 10,00 мг бриварацетама, 2,70 мг -циклодекстрина, 45,00 мг моногидрата лактозы и 2,00 мг натриевой соли кроскармелозы и добавки во внешней фазе, включающей 2,00 мг натриевой соли кроскармелозы, 45,10 безводной лактозы и 1,20 мг стеарата магния. В еще одном предпочтительном варианте осуществления настоящего изобретения композиция представляет собой таблетку, которая включает частицы и фармацевтически приемлемые добавки, при этом указанные частицы включают 25,00 мг бриварацетама, 6,75 мг -циклодекстрина, 48,50 мг моногидрата лактозы и 2,50 мг натриевой соли кроскармелозы и добавки, включающие 2,50 мг натриевой соли кроскармелозы, 48,25 безводной лактозы и 1,50 мг стеарата магния. В другом предпочтительном варианте осуществления настоящего изобретения композиция представляет собой таблетку, которая включает частицы и фармацевтически приемлемые добавки, при этом указанные частицы включают 50,00 мг бриварацетама, 13,50 мг -циклодекстрина, 97,00 мг моногидрата лактозы и 5,00 мг натриевой соли кроскармелозы и добавки, включающие 5,00 мг натриевой соли кроскармелозы, 96,50 безводной лактозы и 3,00 мг стеарата магния. В еще одном предпочтительном варианте осуществления настоящего изобретения композиция представляет собой таблетку, которая включает частицы и фармацевтически приемлемые добавки, при этом указанные частицы включают 9,2 мг бриварацетама, 2,50 мг -циклодекстрина, 41,5 мг моногидрата лактозы и 1,80 мг натриевой соли кроскармелозы и добавки, включающие 1,80 мг натриевой соли кроскармелозы, 41,6 мг безводной лактозы, 0,5 мг коллоидного диоксида кремния и 1,10 мг стеарата магния. Фармацевтическую композицию по настоящему изобретению получают методом сухой грануляции. Способ получения частиц по настоящему изобретению включает первую стадию, на которой смешивают активный ингредиент, циклодекстриновый агент и эксципиенты, вторую стадию, на которой полученную смесь прессуют и/или уплотняют, и третью стадию, на которой смесь измельчают, при этом получают частицы. Способ получения таблеток по настоящему изобретению включает четвертую стадию, на которой смешивают полученные частицы и эксципиенты, и пятую стадию, на которой конечную смесь прессуют и/или уплотняют, при этом получают таблетки. Способ получения сухой грануляцией включает начальную стадию смешивания активного ингредиента, циклодекстринового агента, разбавителя и дезинтегрирующего агента. Полученную смесь прессуют на ротационном прессе или машине для таблетирования, а затем измельчают, при этом получают частицы. Полученные частицы, разбавитель и дезинтегрирующий агент смешивают в блендере, затем добавляют смазывающий агент и снова смешивают. Конечную смесь прессуют, при этом получают таблетки. Необязательно на ядра таблеток наносят покрытие с использованием суспензии или раствора для нанесения покрытий. Частицы включают активный ингредиент, разбавитель, циклодекстриновый агент, дезинтегрирующий агент и необязательно смазывающий агент. Частицы получают следующим образом: активный ингредиент, циклодекстриновый агент и дезинтегрирующий агент смешивают в планетарном смесителе. Затем необязательно добавляют смазывающий агент и смесь перемешивают. Предварительно полученную смесь уплотняют на ротационном прессе, и полученные ленты при необходимости просеивают, при этом получают частицы. При необходимости получения таблеток частицы смешивают с дезинтегрирующим агентом и необязательно со смазывающим агентом. Конечную смесь прессуют на машине для таблетирования, при этом получают ядра таблеток. Основные стадии способа получения таблеток включают следующие стадии: смешивание циклодекстринового агента, натриевой соли кроскармелозы, моногидрата лактозы и активного ингредиента: смешивание проводят в диффузионных смесителях, конвекционных смесителях и/или пневматических смесителях,прессование: прессование проводят с использованием пресса для таблетирования и/или сухого гранулятора с использованием комкования или ротационного уплотнения,измельчение: измельчение лент, полученных после сухой грануляции, можно проводить с использованием ситовых мельниц с размером ячеек от 0,22 до 5 мм и более предпочтительно от 0,33 мм до 4 мм,добавление безводной лактозы, натриевой соли кроскармелозы и необязательно стеарата магния,смешивание: смешивание проводят в диффузионных смесителях, конвекционных смесителях и/или пневматических смесителях,необязательно добавление смазывающего агента (стеарата магния),конечное смешивание,прессование: прессование проводят с использованием пресса для таблетирования,нанесение пленочного покрытия: нанесение покрытия проводят с использованием поддона для нанесения покрытия или устройства для нанесения покрытия с использованием газовой суспензии и более предпочтительно перфорированного поддона для нанесения покрытия. Циклодекстриновый агент можно использовать в качестве связующего для сухой грануляции. При этом комплексы включения между активным ингредиентом и циклодекстриновым агентом не образуются. Неожиданно был установлен связывающий эффект циклодекстринового агента в фармацевтической композиции по настоящему изобретению. Циклодекстриновый агент снижает склеивание лент, полученных после уплотнения, и обеспечивает получение частиц определенного размера после уплотнения. Если фармацевтическая композиция по настоящему изобретению представляет собой таблетку, то способ может включать дополнительную стадию нанесения пленочного покрытия, при которой воду,предпочтительно очищенную воду, добавляют в пленкообразующий агент и полученную суспензию и/или раствор наносят на таблетку при распылении. В другом объекте настоящего изобретения предлагается фармацевтическая композиция, включающая бриварацетам, пригодная для лечения или профилактики заболевания. Термин "заболевание" обозначает заболевание, которое выбирают из группы, включающей эпилептогенез, эпилептические припадки, судороги, болезнь Паркинсона, дискинезию, вызванную заместительной терапией допамином, позднюю дискинезию, вызванную введением нейролептиков, хорею Гентингтона и другие неврологические нарушения, включая биполярные нарушения, манию, депрессию, тревогу, синдром дефицита внимания с гиперактивностью (СДВГ), мигрень, кластерную головную боль, невралгию троичного нерва и другие невралгии, хроническую боль, невропатическую боль, церебральную ишемию, сердечную аритмию, миопатию, злоупотребление кокаином и другими веществами (например,алкоголем, бензодиазепинами, опиатами, марихуаной, барбитуратами, амфетаминами, другими возбуж-5 022057 дающимисредствами), инсульт, миоклонию, дистонию, дискинезию, тремор и эссенциальный тремор,простой или сложный тики, синдром Турета, синдром беспокойных ног и другие нарушения движения,синдром ненонатального кровоизлияния в мозг, амиотрофический боковой склероз, мышечную спастичность и дегенеративные нарушения. Термин "лечение", использованный в данном контексте, обозначает лечебное действие и профилактическое лечение. Термин "лечебный" обозначает эффективность при лечении наблюдаемого симптоматического эпизода нарушения или состояния. Термин "профилактический" обозначает предотвращение развития или рецидива нарушения или состояния. В настоящем изобретении предлагается также способ лечения человека с использованием фармацевтической композиции. В настоящем изобретении предлагается также фармацевтическая композиция для применения в качестве лекарственного средства, предназначенная для лечения указанного заболевания. В настоящем изобретении предлагается также применение фармацевтической композиции для получения лекарственного средства, предназначенного для лечения указанного заболевания. Предпочтительно указанное заболевание выбирают в основном из группы, включающей эпилепсию, болезнь Паркинсона, дискинезию, мигрень, тремор, эссенциальный тремор, биполярные нарушения,хроническую боль, невропатическую боль или бронхиальные, астматические или аллергические состояния. Более предпочтительным указанным заболеванием является эпилепсия. Способ сухой грануляции, который используют для получения фармацевтической композиции по настоящему изобретению, является простым, быстрым, недорогостоящим и может защищать активный ингредиент от деградации, например, при гидролизе. Эксципиенты используют в максимально низких количествах для снижения массы таблетки. Другое преимущество фармацевтической композиции по настоящему изобретению заключается в том, что можно получать пропорциональные составы и таким образом одну и ту же смесь можно прессовать в ядро таблетки с большим размером и массой в зависимости от требуемой дозы. Добавление циклодекстринового агента в фармацевтическую композицию по настоящему изобретению позволяет получить удовлетворительный профиль прессования, прессуемость и/или в конечном результате удовлетворительный профиль растворения in vitro. Циклодекстриновый агент характеризуется высокой прессуемостью, причем при получении таблеток не требуется высокое давление прессования. Бриварацетам является очень липким соединением (способность к адгезии). Основным преимуществом циклодекстринового агента является снижение липкости при прессовании и прежде всего при ротационном прессовании. Другое преимущество заключается в улучшении растворения лекарственного средства. Приведенные ниже примеры предназначены только для иллюстрации и не ограничивают объем настоящего изобретения. Специалистам в данной области техники представляется очевидным, что возможны стандартные варианты и модификации приведенных ниже примеров, не выходя за пределы сущности или объема изобретения. Примеры Пример 1. Таблетку следующего состава получали сухой грануляцией (табл. 1). Таблица 1 Состав таблетки массой 100 мг Частицы включают активный ингредиент, разбавитель, циклодекстриновый агент, часть дезинтегрирующего агента и часть смазывающего агента. Внешняя фаза включает вторую часть дезинтегрирующего агента и вторую часть смазывающего агента. Частицы получали следующим образом. Бриварацетам в качестве активного ингредиента, моногидрат лактозы, циклодекстриновый агент и половину количества натриевой соли кроскармелозы смешивали в соответствующем блендере. Смесь перемешивали до образования гомогенной смеси. Затем смесь уплотняли на уплотнителе или машине для таблетирования и полученные ленты или необработанные ядра таблеток просеивали, при этом получали частицы. Затем частицы смешивали с половиной количества натриевой соли кроскармелозы и со стеаратом магния, при этом получали гомогенную смесь. Конечную смесь прессовали на машине для таблетирования, при этом получали ядра таблеток. Таблица 2 Профиль растворения (в %) таблеток бриварацетама с немедленным высвобождением массой 100 мг(лопастной метод, 900 мл водного буферного раствора, 50 об/мин) В табл. 2 показано немедленное высвобождение бриварацетама, что соответствует условиям растворения in vitro. Профили растворения таблеток в воде in vitro определяли по стандартной методике USP 711(прибор 2, 50 об/мин, 900 мл водной среды, фосфатный буферный раствор, рН 6). Растворение проводили при 37 С. Добавление циклодекстринового агента в фармацевтическую композицию по настоящему изобретению обеспечивает удовлетворительный профиль прессования и прессуемость. Циклодекстриновый агент характеризуется высокой прессуемостью и не требуется высоких давлений прессования при получении таблеток. Циклодекстриновый агент снижает липкость при ротационном прессовании. Пример 2. Таблетку следующего состава получали сухой грануляцией (табл. 3). Таблица 3 Состав таблетки, содержащей 5 мг активного ингредиента Частицы получали следующим образом. Бриварацетам в качестве активного ингредиента, моногидрат лактозы, циклодекстриновый агент и половину количества натриевой соли кроскармелозы смешивали в соответствующем блендере. Смесь перемешивали до образования гомогенной смеси. Затем смесь уплотняли на уплотнителе или машине для таблетирования и полученные ленты или необработанные ядра таблеток просеивали, при этом получали частицы. Затем частицы смешивали с половиной количества натриевой соли кроскармелозы, с безводной лактозой и со стеаратом магния, при этом получали гомогенную смесь. Конечную смесь прессовали на машине для таблетирования, при этом получали ядра таблеток. Таблица 4 Профиль растворения (в %) таблеток бриварацетама с немедленным высвобождением, содержащих 5 мг активного ингредиента (лопастной метод, 500 мл фосфатного буферного раствора, 50 об/мин) В табл. 4 показано немедленное высвобождение бриварацетама, что соответствует условиям растворения in vitro. Пример 3. Ядра таблеток С, D, E, F и G следующего состава получали сухой грануляцией (табл. 5). Способ аналогичен способу, описанному в примере 2. После получения ядер таблеток на них наносили пленочное покрытие из водной суспензии продукта Opadry TM белого цвета с использованием соответствующего оборудования, при этом получали таблетки с пленочным покрытием. Таблица 5 Составы ядер таблеток С, D, E, F и G Частицы Продукт Opadry TM представляет собой пленкообразующий агент для маскирования горького вкуса основного активного ингредиента. Количество пленкообразующего агента в ядрах таблетки составляет приблизительно 5 мас.%. Пленкообразующий агент включает смесь гидроксипропилметилцеллюлозы,продукта Macrogol 4000 (другое название ПЭГ 3350), натриевой соли сахарина и диоксида титана. Таблица 6 Профиль растворения (в %) таблетки С, содержащей 5 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Таблица 7 Профиль растворения (в %) таблетки D, содержащей 10 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Таблица 8 Профиль растворения (в %) таблетки Е, содержащей 10 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Таблица 9 Профиль растворения (в %) таблетки F, содержащей 25 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Таблица 10 Профиль растворения (в %) таблетки G, содержащей 50 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Таблетки С, D, E, F и G характеризуются профилем немедленного высвобождения бриварацетама,что соответствует условиям растворения in vitro. Пример 4. Таблетки Н и I получали прямым прессованием из ядер следующего состава (табл. 13). Таблица 13 Таблетки Н и I Ниже приведены основные стадии способа получения таблеток: смешивание циклодекстринового агента, всех эксципиентов и бриварацетама: смешивание проводили в соответствующем смесителе, при этом получали гомогенную смесь,уплотнение: уплотнение проводили в сухом грануляторе или в машине для таблетирования,измельчение: полученные ленты измельчали,прессование: таблетирование проводили в прессе для таблетирования. Таблетки характеризуются профилем немедленного высвобождения бриварацетама, что удовлетворяет условиям растворения in vitro. Таблица 14 Профиль растворения (в %) таблетки Н, содержащей 10 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Таблица 15 Профиль растворения (в %) таблетки I, содержащей 25 мг бриварацетама с немедленным высвобождением (лопастной метод, 900 мл фосфатного буферного раствора,рН 4,6, 50 об/мин, с использованием 6 таблеток) Пример 5. Гранулы следующего состава получали сухой грануляцией (табл. 16). Гранулы включают активный ингредиент, эксципиенты и циклодекстриновый агент. Гранулы получали следующим образом. Активный ингредиент, эксципиенты и циклодекстриновый агент смешивали в планетарном смесителе. Смесь перемешивали. Полученную предварительную смесь уплотняли на ротационном уплотнителе и полученные ленты просеивали, при этом получали гранулы. Капсулы заполняли гранулами. Капсулы характеризуются профилем немедленного высвобождения бриварацетама, что соответствует условиям растворения in vitro. Пример 6. Гранулы следующего состава получали сухой грануляцией (табл. 17). Таблица 17 Гранулы получали, как описано в примере 5. Капсулы характеризуются профилем немедленного высвобождения селетрацетама, что соответствует условиям растворения in vitro. Пример 7. Таблетки следующего состава получали сухой грануляцией (табл. 17). Таблица 18 Композиция 50 мг Результаты испытания свидетельствуют о том, что таблетка с немедленным высвобождением удовлетворяет условиям растворения in vitro. Пример 8. Частицы содержат активный ингредиент, разбавитель, циклодекстриновый агент и часть дезинтегрирующего агента. Внешняя фаза включает вторую часть дезинтегрирующего агента, смазывающий агент и скользящий агент. Частицы получали следующим образом. Бриварацетам в качестве активного агента, моногидрат лактозы, циклодекстриновый агент и половину количества натриевой соли кроскармелозы смешивали в планетарном смесителе. Смесь перемешивали. Затем смесь уплотняли на ротационном уплотнителе и полученные ленты просеивали, при этом получали частицы. Затем частицы смешивали с половиной количества натриевой соли кроскармелозы, со стеаратом магния и с коллоидным диоксидом кремния. Конечную смесь прессовали на машине для таблетирования, при этом получали ядра таблеток. Ниже приведены основные стадии способа получения таблеток: смешивание циклодекстринового агента, натриевой соли кроскармелозы, моногидрата лактозы и бриварацетама: смешивание проводили в диффузионных смесителях, конвекционных смесителях и/или пневматическом смесителе,уплотнение: уплотнение проводили в машине для таблетирования или сухом грануляторе методом комкования или ротационного уплотнения,измельчение: ленты, полученные сухой грануляцией, просеивали через сита с размером ячеек от 0,33 мм до 4 мм,добавление безводной лактозы, натриевой соли кроскармелозы, коллоидного диоксида кремния,стеарата магния,смешивание: смешивание проводили в диффузионных смесителях, конвекционных смесителях и/или пневматических смесителях,прессование: таблетирование проводили в прессе для таблетирования,нанесение пленочного покрытия: нанесение покрытия проводили в поддоне для нанесения покрытия, в устройстве для нанесения покрытий из газовой суспензии и более предпочтительно с использованием перфорированного поддона для нанесения покрытия. Время распадаемости описанных выше таблеток, определенное по стандартной методике, описанной в европейской фармакопее, раздел 2.9.1, составляло 1 мин 53 с, таким образом, результаты испытания свидетельствуют о том, что таблетка с немедленным высвобождением удовлетворяет условиям растворения in vitro. Пример 9. Все эксперименты проводили согласно инструкциям местного этического комитета по экспериментам на животных. Ответные эпилептиформные реакции в гиппокампальных срезах: леветирацетам снижает ответную эпилептиформную реакцию, индуцированную в гиппокампальных срезах крыс при высоких концентрациях K+/низких концентрациях Са 2+ в перфузионной жидкости и индуцированную бикукуллином. Действие бриварацетама на ответную эпилептиформную реакцию, индуцированную высокими концентрациями K+/низкими концентрациями Са 2+ или бикукуллином, оценивали в поперечных гиппокампальных срезах крыс Sprague-Dawley, полученных по ранее описанным стандартным методикам. Ответную эпилептиформную реакцию индуцировали при замене нормальной перфузии искусственной цереброспинальной жидкостью (ACSF) (K+ 3 мМ, Са 2+ 2,4 мМ) на жидкость с высокой концентрацией K+/низкой концентрацией Са 2+ (HKLCF) (K+ 7,5 мМ, Са 2+ 0,5 мМ) или на жидкость ACSF, содержащую 5 М метиодид бикукуллина (BMI). Полевые внеклеточные потенциалы (ПП) регистрировали в участках СА 3 с использованием стеклянных микроэлектродов, заполненных 2 М NaCl. Индуцированные ПП регистрировали через каждые 10 мин в ответ на фимбриальную стимуляцию прямоугольными импульсами постоянного тока, которая вызывает один популяционный спайк (ПС) с максимальной амплитудой 50-75%, когда срез находится вACSF. В модели HKLCF была также зарегистрирована спонтанная активность в течение 2 мин в середине каждого 10-минутного интервала между регистрациями индуцированных ответных реакций. Бриварацетам либо леветирацетам добавляли в промывную жидкость срезов за 20 мин до замены жидкости на жидкость ACSF или HKLCF или на жидкость ACSF, содержащую 5 М BMI, и выдерживали в перфузионной жидкости в ходе всего эксперимента. Рефлекторный акустикогенный эпилептический припадок у мышей: использовали генетически чувствительных к звуку самцов мышей (16-28 г; n=10 в группе), у которых в ответ на акустикогенную стимуляцию наблюдаются частые, прокурсивные клонические и тонические судороги. Рефлекторный акустикогенный эпилептический припадок индуцировали акустическим стимулом (90 дБ, 10-20 кГц) в течение 30 с. Мышам предварительно вводили солевой раствор, бривацетам (внутрибрюшинно, 30 мин) или леветирацетам (внутрибрюшинно, 60 мин), и число мышей, защищенных от клонических эпилептических судорог, использовали в качестве конечного параметра противосудорожной активности. Химически индуцированные судороги у мышей: пентилентетразол, 83 мг/кг подкожно, использовали для оценки противосудорожных свойств бриварацетама. Дозу выбирали на основании кривых зависимости эффекта от дозы для животных, которым вводили солевой раствор в качестве судорожной дозы,вызывающей клонические судороги во всех четырех конечностях у 97% животных. Сразу после введения хемоконвульсанта мышей размещали каждую отдельно в маленькие пластмассовые клетки (25138 см) и наблюдали наличие клонических судорог во всех четырех конечностях в течение 60 мин. В этот период регистрировали также развитие тонических судорог (вытягивание задней конечности) и смертность. Рассчитывали число мышей, защищенных от клонических конвульсий, его использовали в качестве конечного параметра противосудорожной активности. Результаты. Ответная эпилептиформная реакция в гиппокампальных срезах: при замене перфузии гиппокампальных срезов крыс нормальной жидкостью ACSF на жидкость HKLCF наблюдается эпилептиформная ответная реакция: возрастание полевых внеклеточных потенциалов в участках СА 3 в ответ на фимбри- 11022057 альную стимуляцию импульсами постоянного тока. В контрольных срезах при перфузии только жидкостью HKLCF, амплитуда ПС значительно возрастает, достигая плато в течение 20 мин (4.250.77 мВ), почти вдвое выше по сравнению с ПС, регистрируемыми при перфузии жидкостью ACSF (2.180.15 мВ,среднее значение для n=10 срезов). Всплески повторных популяционных спайков (ПС, то есть ПС 2, ПС 3 и т.д.), индуцированные одним стимулом прямого тока, также возрастают по величине в первые 30 мин перфузии HKLCF от ПС 1 до средней величины ПС 7.62.3 на один популяционный спайк, и продолжают возрастать до средней величины ПС 8.81.6 на один популяционный спайк через 80 мин перфузии жидкостью HKLCF. Бриварацетам и леветирацетам, оба, снижают указанную эпилептиформную ответную реакцию. Через 15 мин перфузии жидкостью HKLCF наблюдаются спонтанные полевые всплески в 4 из 10 срезов при перфузии только одной жидкостью HKLCF, в то время как через 25 мин и до завершения регистрации во всех контрольных срезах наблюдаются регулярные полевые всплески. Бриварацетам (3,2 М), но не леветирацетам (32 М) снижает степень таких спонтанных всплесков. Испытания in vivo: у крыс с полностью раздраженным миндалевидным телом бривацетам вызывает значительное подавление тяжести моторного приступа в дозе 21,2 мг/кг, а леветирацетам оказывает аналогичное действие в дозе 170 мг/кг. Бриварацетам также значительно снижает продолжительность разряда последействия в самой высокой из исследованных доз (212,3 мг/кг), а леветирацетам не оказывает никакого действия на этот параметр в дозе вплоть до 1700 мг/кг. Чувствительные к звуку мыши, у которых наблюдались судороги в ответ на звуковую стимуляцию,были защищены от клонических судорог при введении бриварацетама и леветирацетама. Бриварацетам,введенный внутрибрюшинно за 30 мин до индукции судорог у мышей, также защищал от клонических судорог, индуцированных пентилентетразолом, и от тонического вытягивания задней конечности, индуцированного максимальным электрошоком у мышей, хотя и с более высоким значением ED50. Бриварацетам значительно подавлял спонтанные пик-волновые разряды (SWD) у крыс GAERS в дозе 2,1 мг/кг, причем полное подавление наблюдалось в самой высокой исследованной дозе (67,9 мг/кг). Предварительное введение бриварацетама мышам в ходе провоцирования припадков при повторной стимуляции роговицы приводило к значительному снижению частоты генерализованных моторных приступов, и аналогичное снижение частоты приступов наблюдалось при введении леветирацетама в более высоких дозах. При непрерывной стимуляции роговицы после завершения лечения наблюдалось устойчивое снижение частоты генерализованных моторных приступов в группе животных, которым предварительно вводили самую высокую дозу бриварацетама. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пероральная фармацевтическая композиция в форме таблетки с немедленным высвобождением,включающая частицы, которые содержат активный ингредиент и в качестве эксципиента от 0,1 до 60 мас.% циклодекстринового агента в расчете на общую массу частиц, а активным ингредиентом является бриварацетам. 2. Композиция по п.1, где циклодекстриновый агент выбирают из -циклодекстрина, циклодекстрина,гидроксипропилциклодекстрина,метилциклодекстрина,сульфобутил-циклодекстрина, -циклодекстрина и гидроксипропилциклодекстрина. 3. Композиция по п.2, где циклодекстриновым агентом является -циклодекстрин. 4. Композиция по любому из пп.1-3, где частицы включают от 1,0 до 30 мас.% циклодекстринового агента в расчете на общую массу частиц. 5. Композиция по любому из пп.1-4, где частицы включают дезинтегрирующий агент в качестве эксципиента. 6. Композиция по п.5, где дезинтегрирующим агентом является натриевая соль кроскармелозы. 7. Композиция по п.5 или 6, где частицы включают от 0,5 до 25 мас.% дезинтегрирующего агента в расчете на общую массу частиц. 8. Композиция по любому из предшествующих пунктов, где частицы включают в качестве эксципиента разбавитель. 9. Композиция по п.8, где разбавителем является моногидрат лактозы. 10. Композиция по п.8 или 9, где частицы включают от 5 до 95 мас.% разбавителя в расчете на общую массу частиц. 11. Композиция по п.1, включающая частицы, содержащие бриварацетам в качестве активного ингредиента,от 0,1 до 60 мас.% циклодекстринового агента,от 0,5 до 25 мас.% дезинтегрирующего агента и от 5 до 95 мас.% разбавителя в расчете на общую массу частиц. 12. Композиция по п.1, включающая частицы, содержащие бриварацетам в качестве активного ингредиента,от 0,1 до 60 мас.% циклодекстринового агента,от 0,5 до 25 мас.% натриевой соли кроскармелозы и от 5 до 95 мас.% моногидрата лактозы в расчете на общую массу частиц. 13. Способ получения композиции по любому из предшествующих пунктов, включающий, по крайней мере, стадию сухой грануляции. 14. Способ по п.13, включающий первую стадию, на которой смешивают активный ингредиент, циклодекстриновый агент и эксципиенты,вторую стадию, на которой полученную смесь прессуют и/или уплотняют, и третью стадию, на которой смесь измельчают, при этом получают частицы. 15. Способ по п.14, включающий четвертую стадию, на которой смешивают полученные частицы и эксципиенты, и пятую стадию, на которой конечную смесь прессуют и/или уплотняют, при этом получают таблетки.
МПК / Метки
МПК: A61K 9/16, A61K 31/4015, A61K 9/20
Метки: композиции, фармацевтические, бриварацетам, включающие
Код ссылки
<a href="https://eas.patents.su/14-22057-farmacevticheskie-kompozicii-vklyuchayushhie-brivaracetam.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, включающие бриварацетам</a>
Предыдущий патент: Пешеходный переход
Следующий патент: Способ создания водорастворимых сокристаллов ацетилсалициловой кислоты и теанина
Случайный патент: Система и способ совместной визуализации множества атрибутов в реальном масштабе времени