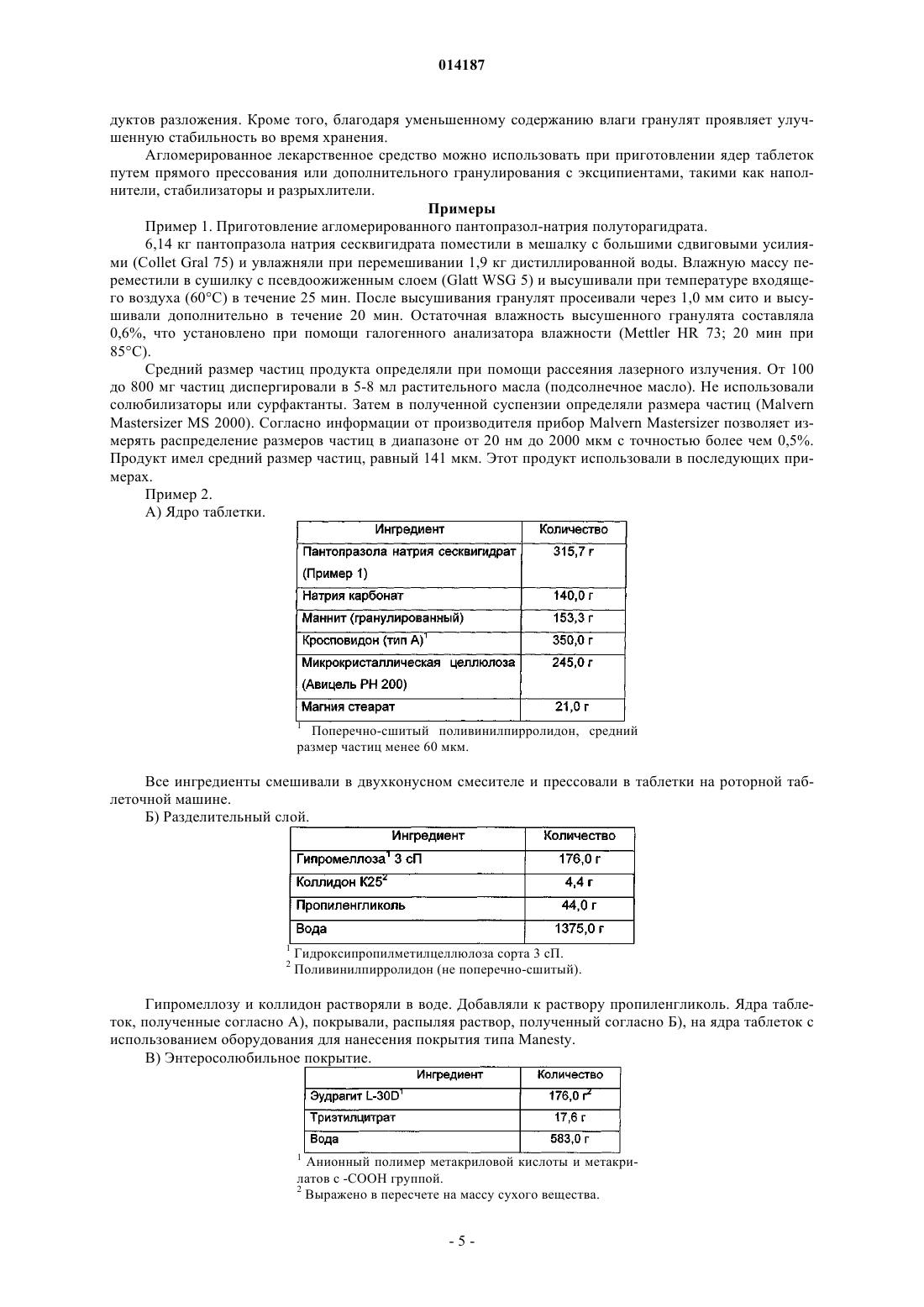
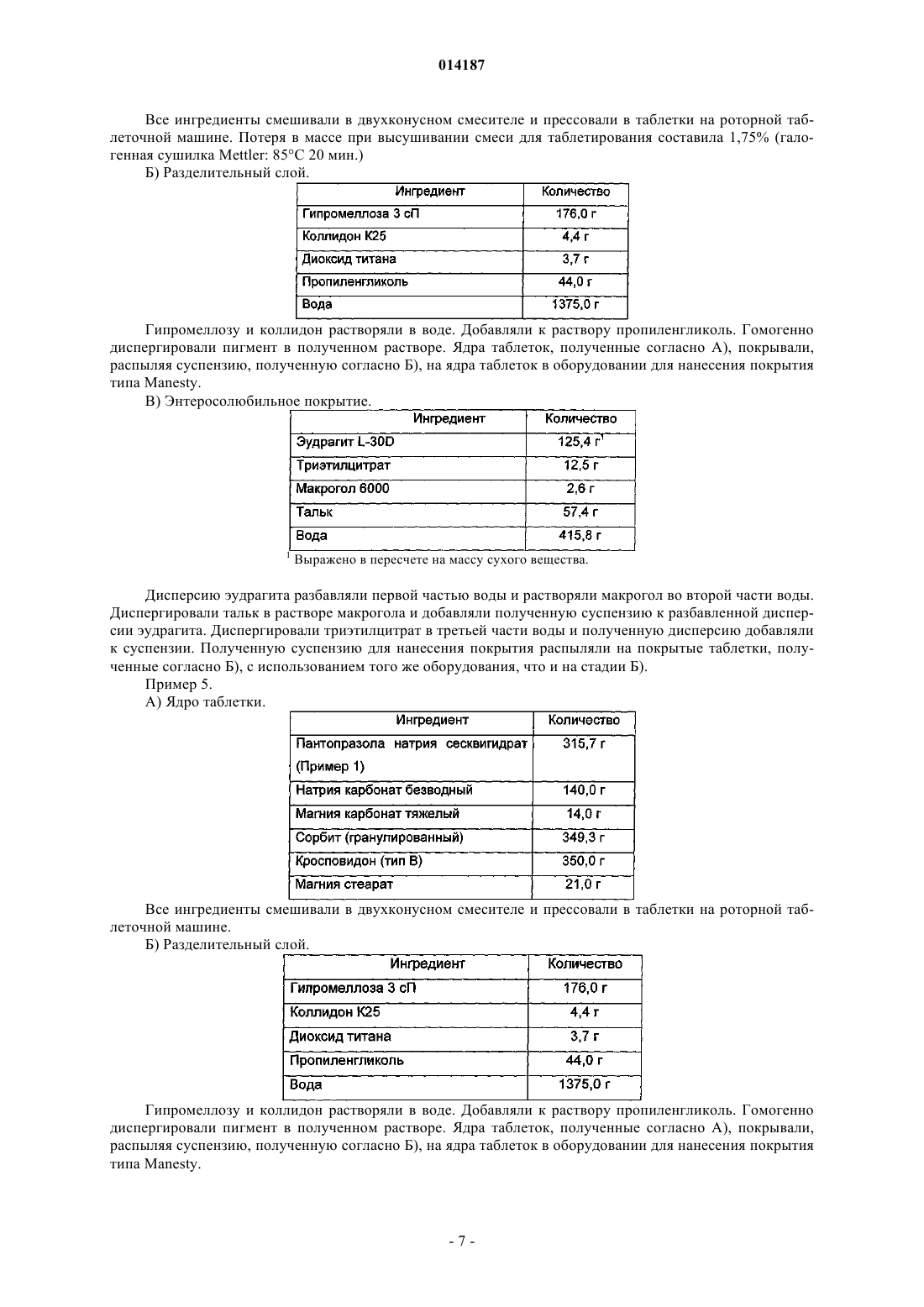
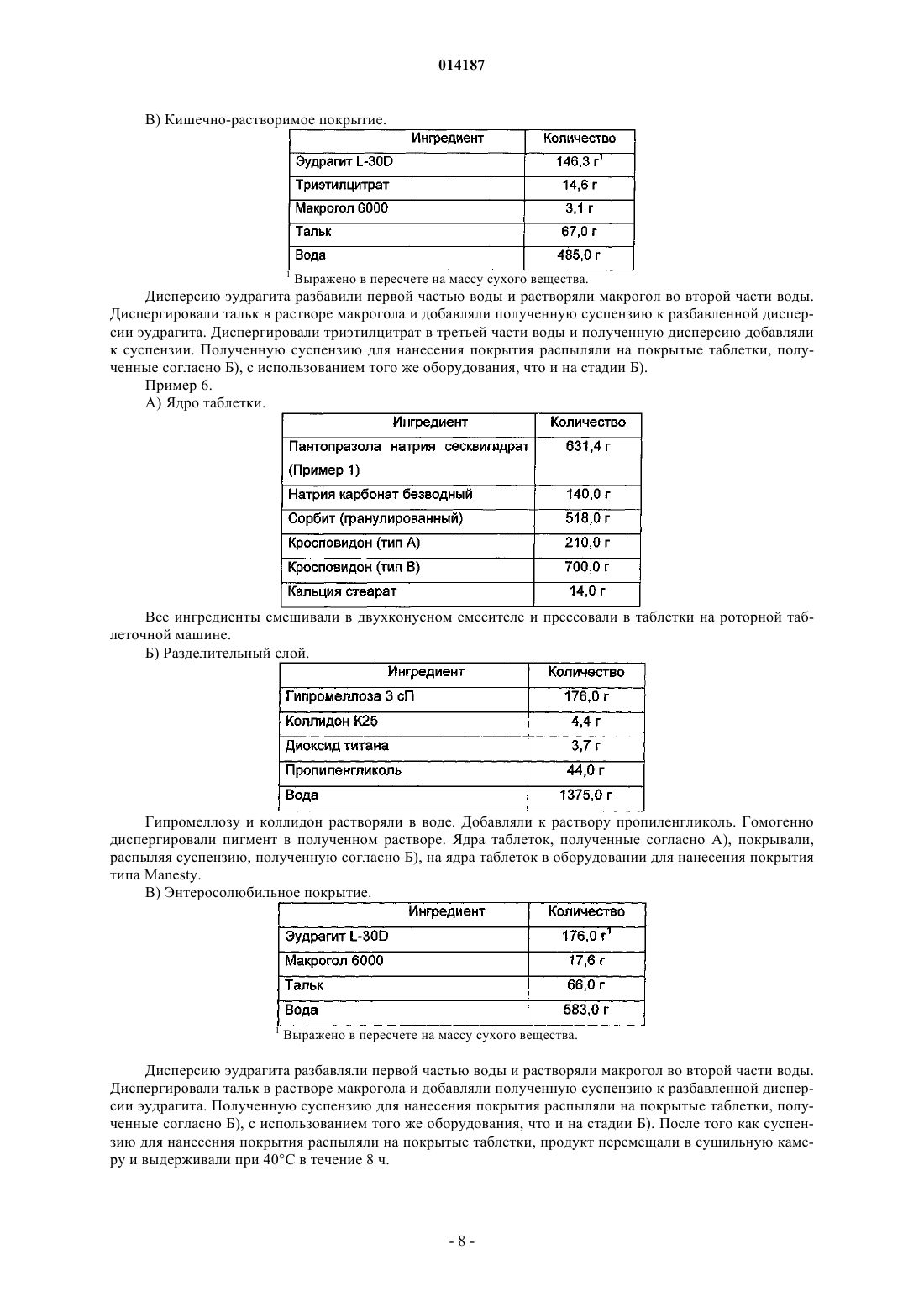
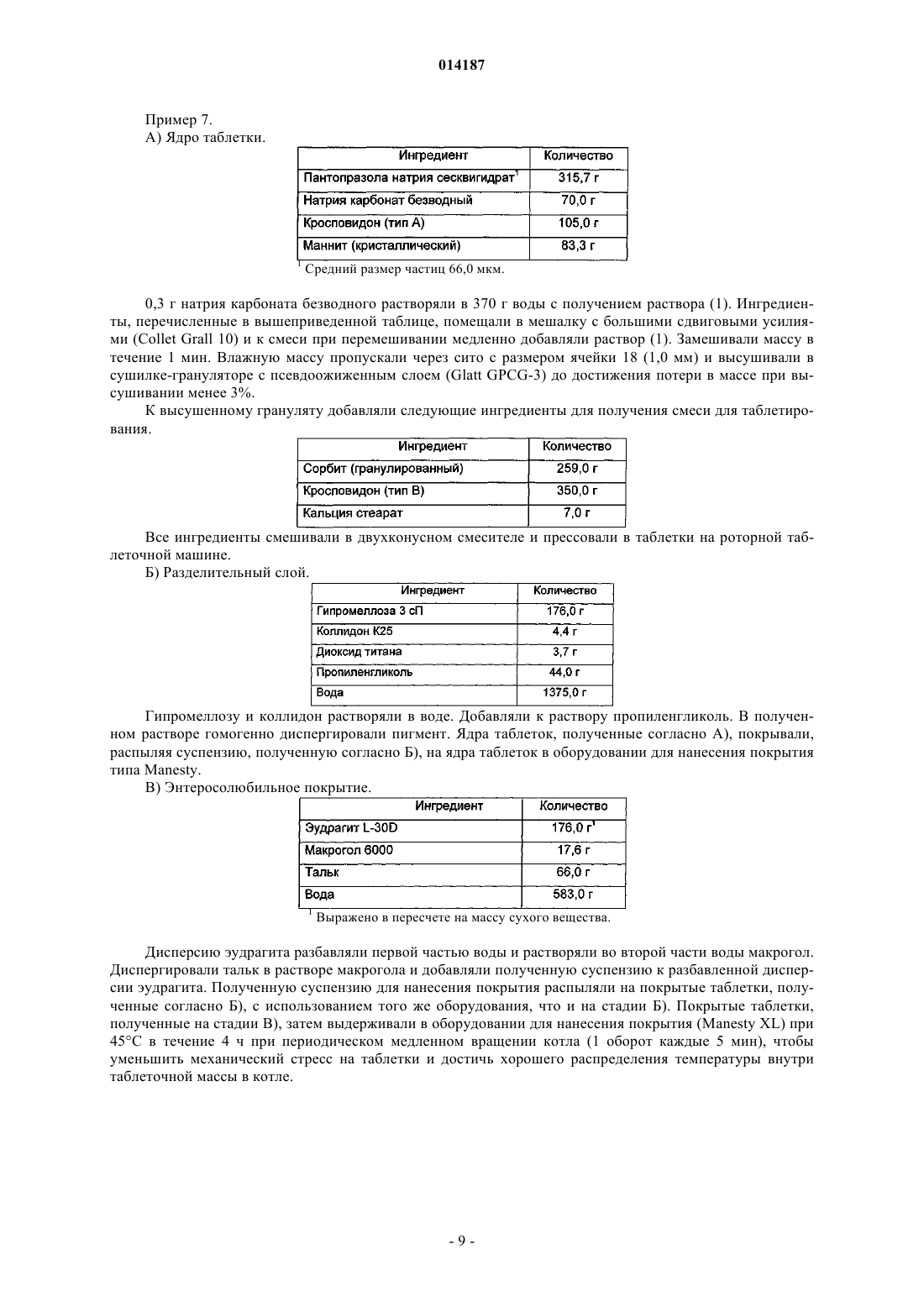
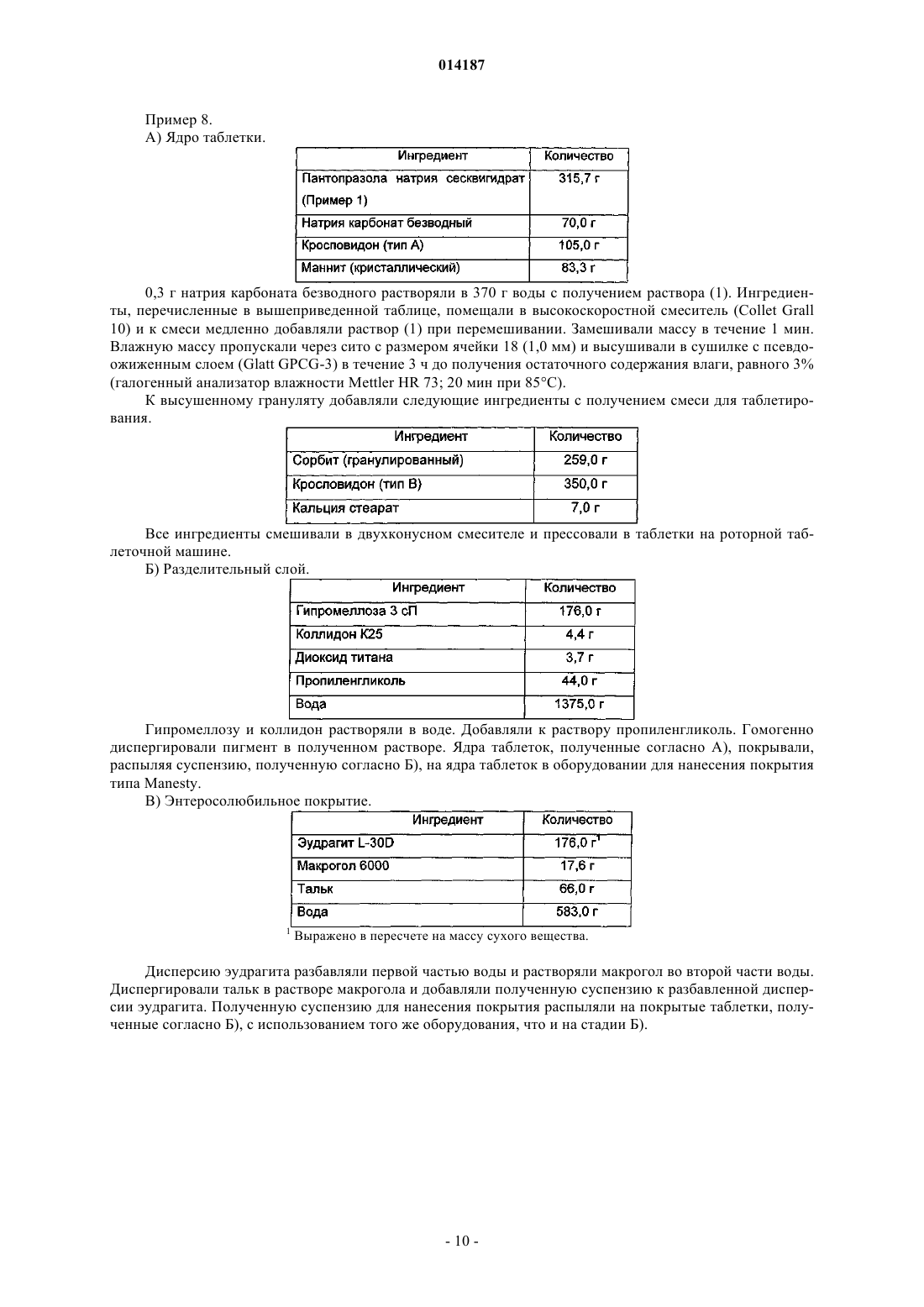
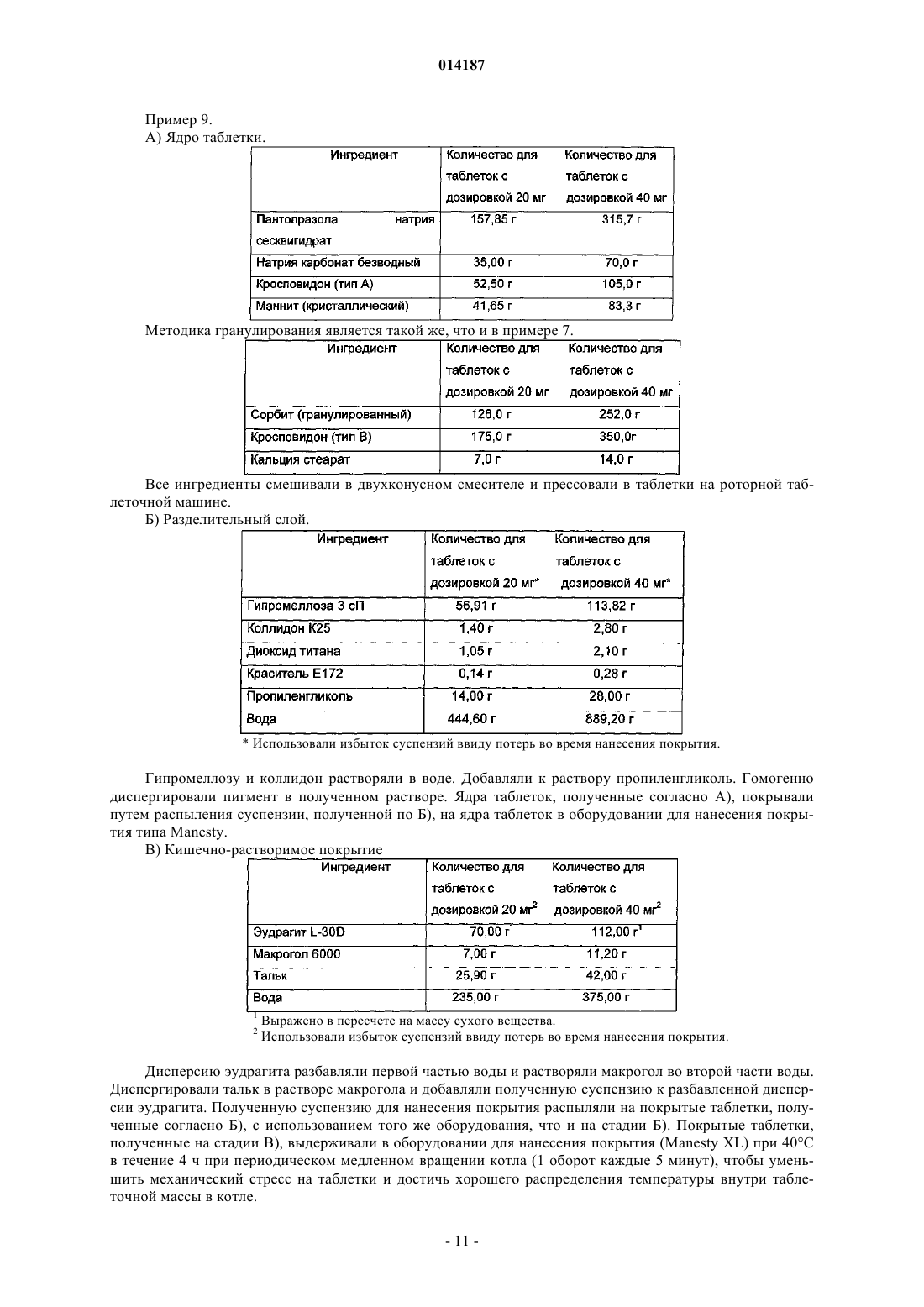
Таблетка содержащая гранулированный пантопразол
Номер патента: 14187
Опубликовано: 29.10.2010
Авторы: Церноса Лидия, Ритлоп Грегор, Врецер Франц, Турк Урска, Ферлан Андрей, Брезник Маянца, Крамар Андрейка
Формула / Реферат
1. Таблетка, содержащая пантопразол в качестве активного ингредиента и включающая:
а) ядро, содержащее активный ингредиент, подщелачивающее вещество, наполнитель и разрыхлитель;
(б) необязательный водорастворимый разделительный слой или подложку и
(в) энтеросолюбильное покрытие,
отличающаяся тем, что пантопразол представлен в форме частиц, имеющих средний размер от 60 до 250 мкм, и тем, что слой энтеросолюбильного покрытия имеет толщину от 85 до 150 мкм.
2. Таблетка по п.1, где частицы пантопразола имеют средний размер от 100 до 250 мкм.
3. Таблетка по п.1 или 2, где частицы пантопразола имеют средний размер от 125 до 230 мкм.
4. Таблетка по любому из пп.1-3, где частицы пантопразола имеют средний размер от 140 до 200 мкм.
5. Таблетка по любому из пп.1-4, где пантопразол присутствует в форме натриевой соли.
6. Таблетка по п.5, где пантопразол присутствует в форме пантопразола натрия сесквигидрата.
7. Таблетка по любому из пп.1-6, где подщелачивающий агент представляет собой гидроксид щелочного или щелочно-земельного металла, карбонат щелочного или щелочно-земельного металла, гидрокарбонат щелочного или щелочно-земельного металла, фосфат, глюкозамин или смесь из двух или более этих соединений, предпочтительно натрия гидроксид, натрия карбонат, натрия гидрокарбонат, натрия фосфат или смесь из двух или более этих компонентов, более предпочтительно натрия карбонат.
8. Таблетка по любому из пп.1-7, где наполнитель представляет собой лактозу или сахарный спирт, такой как маннит, сорбит, мальтит, эритрит или смесь из двух или более этих компонентов.
9. Таблетка по п.8, где наполнитель представляет собой смесь маннита и сорбита.
10. Таблетка по п.9, где смесь содержит 1 мас.ч. маннита и от 1 до 5 мас.ч. сорбита, предпочтительно от 2 до 4 мас.ч. сорбита и более предпочтительно от 2,8 до 3,8 мас.ч. сорбита.
11. Таблетка по любому из пп.1-10, где сахарный спирт имеет средний размер частиц от 30 до 500 мкм.
12. Таблетка по любому из пп.1-11, где разрыхлитель представляет собой кросповидон, натрий-крахмал гликолят, натрий-кроскармелозу, натрий-карбоксиметилкрахмал, натрий-карбоксиметилцеллюлозу, калий-карбоксиметилцеллюлозу или смесь из двух или более этих компонентов.
13. Таблетка по п.12, где разрыхлитель представляет собой смесь кросповидона, имеющего средний размер частиц от 10 до 60 мкм, и кросповидона, имеющего средний размер частиц от 80 до 200 мкм.
14. Таблетка по п.13, где разрыхлитель представляет собой смесь 1 мас.ч. кросповидона, имеющего средний размер частиц, составляющий от 10 до 60 мкм, и от 1 до 5 мас.ч. кросповидона, имеющего средний размер частиц, составляющий от 80 до 200 мкм.
15. Таблетка по любому из пп.1-14, где ядро дополнительно содержит смазывающее вещество, выбранное из стеариновой кислоты, гидрогенизированного растительного масла, парафина или стеарата щелочного или щелочно-земельного металла, алюминия стеарата, натрия стеарилфумарата или смеси из двух или более этих соединений, предпочтительно магния или кальция стеарат, более предпочтительно магния калия стеарат.
16. Таблетка по любому из пп.1-15, где ядро дополнительно содержит связывающее вещество, выбранное из микрокристаллической целлюлозы, гидроксипропилметилцеллюлозы, поливинилпирролидона или смеси из двух или более этих соединений.
17. Таблетка по любому из пп.1-16, где ядро содержит от 15 до 50 мас.% активного ингредиента, от 2 до 25 мас.% подщелачивающего вещества, от 10 до 50 мас.% наполнителя и от 10 до 50 мас.% разрыхлителя.
18. Таблетка по любому из пп.1-17, где необязательный разделительный слой содержит водорастворимое пленкообразующее вещество, предпочтительно гидроксипропилметилцеллюлозу.
19. Таблетка по любому из пп.1-18, где необязательный разделительный слой имеет толщину, составляющую от 20 до 120 мкм.
20. Таблетка по любому из пп.1-19, где кишечно-растворимое покрытие содержит пленкообразующие вещества, предпочтительно ацетатфталатцеллюлозу, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, гидроксипропилметилцеллюлозы ацетатсукцинат, сополимер этилакрилата и метакриловой кислоты, сополимер метилметакрилата и метакриловой кислоты, шеллак, предпочтительно сополимеры метакриловой кислоты и сложных эфиров метакриловой кислоты, такие как анионный полимер метакриловой кислоты и метакрилатов с -СООН группами.
21. Таблетка по п.1, содержащая от 20 до 40 мг пантопразола в форме натриевой соли гидрата или натриевой соли гидрата сесквигидрата.
22. Способ получения пантопразола, имеющего средний размер частиц от 60 до 250 мкм, включающий стадии увлажнения пантопразола водой в мешалке с большими сдвиговыми усилиями; пропускания влажного пантопразола через сито, имеющее размер ячейки от 0,8 до 2 мм; и высушивания массы в сушилке с псевдоожиженным слоем, причем порядок выполнения стадий просеивания и высушивания может варьировать.
23. Способ по п.22, где высушивание осуществляют при температуре продукта, составляющей от 35 до 50°С.
24. Способ по любому из пп.22 и 23, где массу высушивают до остаточного содержания влаги, составляющего менее 1 мас.%.
25. Способ по любому из пп.22-24, где вода, используемая для увлажнения, имеет значение рН, составляющее от 10 до 12.
26. Продукт, полученный при помощи способа по любому из пп.22-25.
27. Таблетка по любому из пп.1-21, высвобождающая более чем 50% активного ингредиента в течение 45 мин, более чем 80% активного ингредиента в течение 60 мин согласно определению в фосфатном буфере с рН 6,4 с помощью Аппарата 1 согласно Фармакопее США (USP), при 100 об/мин, после 1 ч хранения в 0,1 М растворе HCl с рН 1.
Текст
Таблетка, содержащая пантопразол в качестве активного ингредиента. Пантопразол присутствует в форме частиц, имеющих средний размер от 60 до 250 мкм. Пантопразол, имеющий средний размер частиц от 60 до 250 мкм, получают при помощи способа, включающего стадии увлажнения пантопразола водой, имеющей значение рН от 10 до 12, в мешалке с большими сдвиговыми усилиями; пропускания влажного пантопразола через сито, имеющее размер ячейки от 0,8 до 1,2 мм; и высушивания массы в сушилке с псевдоожиженным слоем. 014187 Область техники Данное изобретение относится к таблеткам, которые содержат гранулированный пантопразол в качестве активного ингредиента, и к способу получения гранулированного пантопразола. Предпосылки создания изобретения Пантопразол (5-(дифторометокси)-2(3,4-диметокси-2-пиридинил)метил]сульфинил-Н-бензимидазол) представляет собой ингибитор протонного насоса, принадлежащий к группе бензимидазолов. Это соединение ингибирует образование кислоты желудочного сока, и вследствие этого оно является очень эффективным для лечения язв желудка и двенадцатиперстной кишки, желудочно-пищеводного рефлюкса и т.п. заболеваний. Оно ингибирует секрецию кислоты желудочного сока путем ингибирования активностиH+-K+ АТФазы (аденозинтрифосфатазы) (активности протонного насоса). Пантопразол и его физиологически приемлемые соли известны из ЕР 0166287 и Kohl et al., The Journal of Medicinal Chemistry; 1992, 35, 6, 1049-1057. Пантопразол, как известно, является чувствительным к нагреванию и нестабильным в кислой среде,а также в присутствии влаги и органических растворителей. Таким образом, фармацевтические композиции, содержащие это лекарственное средство, а также способы его изготовления следует разрабатывать так, чтобы защищать лекарственное средство от влаги и кислых условий. Из-за быстрой деградации лекарственного средства, которая происходит в кислой среде желудочного сока, такие составы обычно содержат энтеросолюбильное покрытие. Проблемы стабильности, связанные с соединениями бензимидазола, хорошо известны из уровня техники, в котором описаны различные меры для получения стабильных составов, содержащих соединения бензимидазола. Наиболее распространенным подходом является использование щелочного ядра,разделительного слоя и энтеросолюбильного покрытия. Путем использования щелочного вещества внутри ядра соединения бензимидазола можно защитить от разложения в кислой среде. В ЕР 0244380 описаны фармацевтические препараты, содержащие неустойчивые к кислотам соединения. Препараты состоят из ядра, содержащего активный ингредиент вместе с соединением, дающим щелочную реакцию, или щелочную соль активного ингредиента, одного или более водорастворимого слоя подложки, который может также содержать щелочной компонент, и слоя энтеросолюбильного покрытия. Согласно WO 92/22284 некоторые ингредиенты, такие как лактоза, микрокристаллическая целлюлоза и гидроксипропилцеллюлоза, присутствующие в композициях по ЕР 0244380, ускоряют разложение пантопразола. Считают, что более стабильные препараты можно получить путем использования поливинилпирролидона и/или гидроксипропилметилцеллюлозы в качестве связывающего вещества и маннита в качестве необязательного инертного наполнителя в ядре таблетки. С другой стороны, в WO 2005/051348 описано, что гигроскопичные полимерные связывающие вещества, такие как поливинилпирролидон, ухудшают высвобождение активного ингредиента после хранения вследствие абсорбции влаги. Обнаружено, что благодаря использованию надлежащим образом подобранных эксципиентов, совместимых с активным ингредиентом, можно избежать применения полимерного связывающего агента. В данном документе описано использование ядер таблеток, содержащих пантопразол в качестве активного ингредиента, высушенный с помощью распылительной сушки,или гранулированный маннит, имеющий средний размер частиц от 100 до 500 мкм, подщелачивающее вещество, разрыхлитель и смазывающий агент. Активный ингредиент можно гранулировать при помощи водного раствора маннита, чтобы улучшить его текучесть. Известно, что высушивание гранулятов, основанных на сахарных спиртах, затруднено и является продолжительным по времени, а также требует значительного расхода энергии. Кроме того, длительное время высушивания является недостатком ввиду термочувствительности пантопразола. Описание изобретения Целью настоящего изобретения является разработка таблеток, содержащих пантопразол в качестве активного ингредиента, которые являются стабильными и которые можно получить способом прямого прессования. Дополнительной целью настоящего изобретения является разработка способа гранулирования пантопразола, который не требует излишнего нагревания. Авторами настоящего изобретения было обнаружено, что данной цели можно достичь благодаря использованию пантопразола в форме частиц, имеющих средний размер от 60 до 250 мкм, предпочтительно от 100 до 250 мкм, более предпочтительно от 125 до 250 мкм, еще более предпочтительно от 125 до 230 мкм и наиболее предпочтительно от 140 до 200 мкм. Когда пантопразол, имеющий средний размер частиц от 60 до 250 мкм, смешивают с другими ингредиентами, такими как подщелачивающие вещества, наполнители и разрыхлители, смесь можно легко формовать в ядра таблеток путем ее прямого прессования без добавления воды. Коммерчески доступный пантопразол может иметь даже такой малый средний размер частиц, как 25 мкм. Это открытие является неожиданным, поскольку пантопразол проявляет физические свойства, не подходящие для прямого прессования. Кроме того, ядра таблеток обычно содержат от 20 до 50 мас.%,предпочтительно от 25 до 30 мас.% пантопразола. Ввиду сравнительно высокого содержания активного ингредиента добавление других эксципиентов, которые лучше подходят для прямого прессования, огра-1 014187 ничено. Если размер ядер таблеток превышает определенную массу, дезинтеграция таблеток в тонком кишечнике задерживается и фармакологический эффект активного ингредиента уменьшается. Термин "средний размер частиц", используемый в настоящем описании, относится к объемному среднему диаметру частиц. Объемный средний диаметр можно определить путем рассеяния лазерного излучения с использованием, например, устройства Malvern-Mastersizer Apparatus MS 2000. Размеры частиц определяют измерением углового распределения лазерного излучения, рассеянного гомогенной суспензией частиц. Распределение размеров определяют, исходя из данных рассеяния излучения с использованием теории рассеяния света, разработанной Густавом Ми. Помимо пантопразола, частицы пантопразола могут содержать дополнительные добавки, но предпочтительно, чтобы они по существу, а более предпочтительно полностью состояли из пантопразола или его фармацевтически приемлемой соли. Таблетки согласно изобретению содержат в качестве активного ингредиента пантопразол, предпочтительно в форме его фармацевтически приемлемой соли, такой как натриевая соль пантопразола, более предпочтительно сесквигидрат натриевой соли пантопразола. Таблетки включают в себя:(б) необязательный водорастворимый разделительный слой или подложку и(в) энтеросолюбильное покрытие. На слой энтеросолюбильного покрытия можно нанести дополнительный водорастворимый защитный слой. Таблетки согласно изобретению содержат в качестве подщелачивающего агента предпочтительно гидроксид щелочного или щелочно-земельного металла, карбонат щелочного или щелочно-земельного металла, гидрокарбонат щелочного или щелочно-земельного металла, фосфат щелочного металла, такой как натрия фосфат, глюкозамин, или смесь из двух или более этих соединений, предпочтительно натрия гидроксид, натрия карбонат, натрия гидрокарбонат, или смесь из двух или более этих компонентов, более предпочтительно натрия карбонат. В качестве наполнителя таблетки предпочтительно содержат лактозу или сахарный спирт, такой как маннит, сорбит, мальтит, эритрит, или смесь из двух или более из этих компонентов. Наиболее предпочтительными наполнителями являются маннит и сорбит и их смеси. Предпочтительно, чтобы наполнитель имел средний размер частиц, составляющий от 30 до 500 мкм, более предпочтительно от 250 до 500 мкм. Маннит известен отсутствием гигроскопичности, в то время как сорбит, который представляет собой изомер маннита, гигроскопичен. Оказалось, что смеси маннита и сорбита являются особенно подходящими в качестве наполнителя. Это открытие является неожиданным, поскольку считают, что гигроскопичные добавки ухудшают высвобождение пантопразола после хранения. Таблетки, приготовленные в соответствии с настоящим изобретением, не показали значительного уменьшения растворимости активного ингредиента после хранения, даже если использовали единственный наполнитель сорбит. Предпочтительно использовать смеси, содержащие 1 мас.ч. маннита и от 1 до 5 мас.ч. сорбита, более предпочтительно от 2 до 4 мас.ч. сорбита и наиболее предпочтительно от 2,8 до 3,8 мас.ч. сорбита. Предпочтительные разрыхлители представляют собой кросповидон, натрий-крахмал гликолят, поперечно-связанные карбоксилированные метилцеллюлозы, такие как натрий-кроскармелоза, натрийкарбоксиметилкрахмал, натрий-карбоксиметилцеллюлоза, калий-карбоксиметилцеллюлоза, или смесь из двух или более этих компонентов. Наиболее предпочтительным разрыхлителем является кросповидон. Кросповидон представляет собой поперечно-сшитый поливинилпирролидон. Содержащие пантопразол таблетки должны быстро дезинтегрироваться на выходе из желудка, достигая верней части кишечника, где физиологическое значение рН поднимается до значений выше чем 5,5 и где растворяется полимер энтеросолюбильного покрытия. Неожиданно было установлено, что дезинтеграцию покрытых таблеток можно улучшить, используя разрыхлитель, имеющий определенный размер частиц. Используя комбинацию разрыхлителя со средним размером частиц, составляющим от 10 до 60 мкм (тип А), предпочтительно кросповидона, и разрыхлителя со средним размером частиц, составляющим от 80 до 200 мкм (тип В), предпочтительно кросповидона, можно значительно уменьшить время дезинтеграции. Смеси, содержащие 1 мас.ч. разрыхлителя типа А и от 1 до 5 мас.ч. разрыхлителя типа В, предпочтительно от 2 до 4 мас.ч. разрыхлителя типа В, оказались особенно предпочтительными. Таблетки по настоящему изобретению предпочтительно высвобождают более 50% активного ингредиента в течение 45 мин и более 80% активного ингредиента в течение 60 мин согласно определению в фосфатном буфере с рН 6,4 с помощью Аппарата 1, согласно Фармакопее США (USP), при 100 об/мин,после 1 ч хранения в 0,1 М растворе HCl с рН 1. Ядра таблеток предпочтительно также содержат смазывающее вещество. Предпочтительные смазывающие вещества представляют собой стеариновую кислоту, гидрогенизированные растительные масла, парафин или стеараты щелочных или щелочно-земельных металлов, стеарат алюминия, натрия стеарилфумарат или смеси двух или более этих соединений. Наиболее предпочтительными смазывающими-2 014187 агентами являются магния стеарат и кальция стеарат. Ядра таблеток могут также содержать связывающее вещество, такое как микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон (повидон) или смеси из двух или более таких соединений. Ядра таблеток предпочтительно содержат: от 15 до 50 мас.%, предпочтительно от 20 до 30 мас.%, более предпочтительно от 25 до 30 мас.% активного ингредиента; от 2 до 25 мас.%, предпочтительно от 5 до 20 мас.%, более предпочтительно от 5 до 15 мас.% подщелачивающего вещества; от 10 до 50 мас.%, предпочтительно от 20 до 40 мас.%, более предпочтительно от 25 до 35 мас.% наполнителя и от 10 до 50 мас.%, предпочтительно от 20 до 40 мас.%, более предпочтительно от 25 до 40 мас.% разрыхлителя. Согласно предпочтительному варианту воплощения таблетка с пленочным покрытием в соответствии с изобретением содержит на поверхности ядра таблетки подложку или разделительный слой. Необязательный водорастворимый разделительный слой, нанесенный на ядро таблетки, может содержать пленкообразующие вещества, обычно используемые для приготовления таблеток с пленочным покрытием. Предпочтительное водорастворимое пленкообразующее вещество представляет собой гидроксипропилметилцеллюлозу, взятую отдельно или в комбинации с другими водорастворимыми полимерами, такими как поливинилпирролидон. Кроме пленкообразующего полимера, в составе покрытия можно использовать необязательные дополнительные вспомогательные агенты, такие как пластификаторы, например полиэтиленгликоль, пропиленгликоль, диоксид титана и тальк. Подложку используют для того, чтобы отделить покрытие, устойчивое к действию желудочного сока, от прямого контакта с ядром таблетки. Подложку предпочтительно наносят в количестве от 2 до 20 мас.%, предпочтительно от 5 до 15 мас.% (относительно общей массы таблетки). Необязательный разделительный слой имеет предпочтительно толщину, равную от 20 до 120 мкм,более предпочтительно от 50 до 90 мкм. Слой энтеросолюбильного покрытия предпочтительно содержит пленкообразующие вещества, такие как ацетатфталатцеллюлоза, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы,гидроксипропилметилцеллюлозы ацетатсукцинат, сополимер этилакрилата и метакриловой кислоты,сополимер метилметакрилата и метакриловой кислоты, шеллак, более предпочтительно сополимеры метакриловой кислоты и сложных эфиров метакриловой кислоты, такие как анионный полимер метакриловой кислоты и метакрилатов с -СООН группами, например, L-формы Эудрагитов. Данные полимеры можно использовать в виде органических растворов или предпочтительно в виде водных дисперсий, и к ним необязательно могут добавлять пластификаторы, например триацетин, полиэтиленгликоль (макрогол) или триэтилцитрат, или тальк. Энтеросолюбильное покрытие нерастворимо в кислой среде. Это предотвращает дезинтеграцию таблеток в кислой среде желудка, что вызвало бы деградацию пантопразола и впоследствии уменьшило бы терапевтический эффект такой таблетки. Слой энтеросолюбильного покрытия предпочтительно наносят в количестве от 8 до 20 мас.%, более предпочтительно от 10 до 15 мас.% (относительно общей массы таблетки). Слой кишечно-растворимого покрытия имеет предпочтительно толщину, равную от 85 до 150 мкм или больше, более предпочтительно от 90 до 120 мкм. Таблетки предпочтительно содержат от 20 до 40 мг, в частности 20 или 40 мг, пантопразола в пересчете на химически чистый пантопразол. Это означает, что в каждую таблетку включено, например, 20 или 40 мг химически чистого пантопразола. Если пантопразол используют в форме соли и/или гидрата,фактически используемую массу активного ингредиента рассчитывают таким образом, чтобы она соответствовала от 20 до 40 мг химически чистого пантопразола. Согласно предпочтительному варианту воплощения изобретения энтеросолюбильное покрытие этих таблеток имеет одинаковую толщину, даже если таблетки отличаются по дозировке активного ингредиента, размеру или количествам ингредиентов. Одинаковая толщина означает, что толщина слоя кишечно-растворимого покрытия таблеток не отличается более чем на 5% при измерении при помощи сканирующей электронной микроскопии среза таблеток. Если площадь поверхности ядер таблеток неодинакова, то количество материала для энтеросолюбильного покрытия, который наносят на ядра, регулируют таким образом, чтобы достичь одинаковой толщины слоя кишечно-растворимого покрытия. Толщину слоя кишечно-растворимого покрытия различных таблеток можно отрегулировать таким образом, чтобы добиться одинаковой функциональности. Функциональность слоев кишечнорастворимого покрытия для различных таблеток определяют путем сравнения результатов теста на растворение активного ингредиента (% высвобождения пантопразола в растворе фосфатного буфера, рН 6,8,Аппарат 2 согласно Фармакопее США, 50 об/мин, при 37 С; таблетки сначала выдерживают в течение 2 ч в 0,1 М растворе HCl и затем среду заменяют на раствор фосфатного буфера с рН 6,8; коэффициенты подобия для профилей растворения различных таблеток затем можно рассчитать и сравнить). Сходство профилей растворения сравнивают, рассчитывая коэффициент подобия (согласно руководству Европей-3 014187 ского Агентства по Оценке Медикаментов (ЕМЕА) CPMP/QWP/604/96 NOTE FOR GUIDANCE ONDOSAGE FORMS SECTION I (QUALITY. Коэффициент подобия определяют следующим образом: где f2 обозначает коэффициент подобия;n обозначает количество временных точек;R(t) обозначает среднюю процентную долю лекарственного средства, растворившегося, например,из текущего состава;T(t) обозначает среднюю процентную долю лекарственного средства, растворившегося, например,из модифицированной таблетки. Оценка сходства основана на следующих условиях:(1) минимум три временные точки;(2) 12 индивидуальных значений для каждой временной точки;(3) не более одного среднего значения для 85% растворения;(4) стандартное отклонение от среднего должно быть менее 10%, начиная от второй и до последней временной точки. Значение f2 от 50 до 100 позволяет предположить, что два профиля растворения являются схожими. Толщину слоя подложки и энтеросолюбильного покрытия измеряют при помощи сканирующей электронной микроскопии среза покрытых таблеток. Таблетку с пленочным покрытием согласно изобретению, содержащую пантопразол, можно приготовить, как описано далее. Сначала получают ядро таблетки путем смешивания активного ингредиента,разрыхлителя, наполнителя, подщелачивающего агента и любых возможных компонентов и прессования гомогенной смеси до получения таблеток без добавления воды. Смешивание предпочтительно выполняют в двухконусном смесителе и таблетки предпочтительно формируют на роторной таблеточной машине. Полученные таким образом таблетки затем покрывают сначала водорастворимым покрытием, затем энтеросолюбильным покрытием, устойчивым к действию кислоты желудочного сока, и в последнюю очередь необязательным дополнительным водорастворимым покрытием. Композиции таблеток можно подвергнуть возможной стадии затвердевания. Стадию затвердевания предпочтительно проводят после нанесения дисперсии нерастворимого в кислоте полимера (покрытие,устойчивое к действию среды желудка). Стадию затвердевания предпочтительно проводят в оборудовании для нанесения покрытия, таком как перфорированный дражировочный котел, известный из уровня техники (например, типа Manesty, Accela Cota, GS дражировочный котел или аппарат для нанесения покрытия Glatt), и/или в сушильной камере. Затвердевание предпочтительно проводят при температуре композиции, равной от 30 до 50 С, более предпочтительно от 35 до 45 С, и предпочтительное время затвердевания составляет от 1 до 16 ч, более предпочтительно от 2 до 8 ч. Частицы пантопразола, используемые для приготовления таблеток, можно получить, например,кристаллизацией. Предпочтительно получать частицы путем агломерации более маленьких частиц, которые коммерчески доступны. Агломерацию проводят увлажнением пантопразола водой, пропусканием влажного пантопразола через сито, имеющее размер ячейки от 0,8 до 2 мм, предпочтительно от 0,8 до 1,2 мм, более предпочтительно 1,0 мм, и высушиванием массы в сушилке с псевдоожиженным слоем предпочтительно при температурах продукта от 35 до 50 С. Порядок выполнения стадии просеивания и стадии высушивания может меняться. Значение рН воды предпочтительно доводят до 10-12 путем добавления подщелачивающего агента,такого как натрия гидроксид, натрия карбонат, тринатрия фосфат, меглюмин или глюкозамин. Смешивание предпочтительно осуществляют в мешалке с большими сдвиговыми усилиями. В качестве исходного материала можно использовать коммерчески доступный пантопразол, предпочтительно используют пантопразол, имеющий средний размер частиц, равный по меньшей мере 25 мкм. Высушивание предпочтительно осуществляют при температуре, равной от 35 до 50 С. Согласно способу по настоящему изобретению гранулирование активного ингредиента можно осуществить без добавления других ингредиентов, таких как сахарные спирты и разрыхлители. Гранулят по настоящему изобретению можно высушить в значительно более короткое время, чем гранулят, приготовленный согласно известному уровню техники, например с использованием водного раствора маннита. Гранулят агломерированного пантопразола натрия сесквигидрата, полученного согласно настоящему изобретению, можно высушить до остаточного содержания влаги менее 1 мас.% в течение менее чем 1 ч,в то время как содержание влаги в грануляте, полученном при помощи водного раствора маннита, составляет лишь менее 3 мас.% после высушивания при идентичных условиях в течение от 2 до 3 ч. Остаточную влагу определяют при помощи галогенного анализатора влажности (Mettler HR 73; 20 мин при 85 С). Таким образом, согласно настоящему изобретению предложен гранулят, содержащий меньше влаги, чем грануляты согласно известному уровню техники, предпочтительно меньше чем 1 мас.%, и меньшее количество продуктов разложения, поскольку высушивание гранулятов согласно известному уровню техники до содержания влаги, составляющего менее 1 мас.%, неизбежно приводит к образованию про-4 014187 дуктов разложения. Кроме того, благодаря уменьшенному содержанию влаги гранулят проявляет улучшенную стабильность во время хранения. Агломерированное лекарственное средство можно использовать при приготовлении ядер таблеток путем прямого прессования или дополнительного гранулирования с эксципиентами, такими как наполнители, стабилизаторы и разрыхлители. Примеры Пример 1. Приготовление агломерированного пантопразол-натрия полуторагидрата. 6,14 кг пантопразола натрия сесквигидрата поместили в мешалку с большими сдвиговыми усилиями (Collet Gral 75) и увлажняли при перемешивании 1,9 кг дистиллированной воды. Влажную массу переместили в сушилку с псевдоожиженным слоем (Glatt WSG 5) и высушивали при температуре входящего воздуха (60 С) в течение 25 мин. После высушивания гранулят просеивали через 1,0 мм сито и высушивали дополнительно в течение 20 мин. Остаточная влажность высушенного гранулята составляла 0,6%, что установлено при помощи галогенного анализатора влажности (Mettler HR 73; 20 мин при 85 С). Средний размер частиц продукта определяли при помощи рассеяния лазерного излучения. От 100 до 800 мг частиц диспергировали в 5-8 мл растительного масла (подсолнечное масло). Не использовали солюбилизаторы или сурфактанты. Затем в полученной суспензии определяли размера частиц (MalvernMastersizer MS 2000). Согласно информации от производителя прибор Malvern Mastersizer позволяет измерять распределение размеров частиц в диапазоне от 20 нм до 2000 мкм с точностью более чем 0,5%. Продукт имел средний размер частиц, равный 141 мкм. Этот продукт использовали в последующих примерах. Пример 2. А) Ядро таблетки. Поперечно-сшитый поливинилпирролидон, средний размер частиц менее 60 мкм. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Ядра таблеток, полученные согласно А), покрывали, распыляя раствор, полученный согласно Б), на ядра таблеток с использованием оборудования для нанесения покрытия типа Manesty. В) Энтеросолюбильное покрытие. Анионный полимер метакриловой кислоты и метакрилатов с -СООН группой. 2 Выражено в пересчете на массу сухого вещества.-5 014187 Дисперсию эудрагита разбавляли водой и диспергировали триэтилцитрат в разбавленной дисперсии эудрагита. Эту дисперсию для нанесения покрытия, содержащую эудрагит L-30D, триэтилцитрат и воду,распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Пример 3. А) Ядро таблетки. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Ядра таблеток, полученные согласно А), покрывали, распыляя раствор, полученный согласно Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. В) Энтеросолюбильное покрытие. Выражено в пересчете на массу сухого вещества. Полиэтиленгликоль. Дисперсию эудрагита разбавляли частью воды и растворяли в оставшейся части воды макрогол. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Полученную суспензию распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Пример 4. А) Ядро таблетки. Поперечно-сшитый поливинилпирролидон, средний размер частиц менее менее 60 мкм. 2 Поперечно-сшитый поливинилпирролидон, средний размер частиц более 80 мкм.-6 014187 Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Потеря в массе при высушивании смеси для таблетирования составила 1,75% (галогенная сушилка Mettler: 85C 20 мин.) Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Гомогенно диспергировали пигмент в полученном растворе. Ядра таблеток, полученные согласно А), покрывали,распыляя суспензию, полученную согласно Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. В) Энтеросолюбильное покрытие. Выражено в пересчете на массу сухого вещества. Дисперсию эудрагита разбавляли первой частью воды и растворяли макрогол во второй части воды. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Диспергировали триэтилцитрат в третьей части воды и полученную дисперсию добавляли к суспензии. Полученную суспензию для нанесения покрытия распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Пример 5. А) Ядро таблетки. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Гомогенно диспергировали пигмент в полученном растворе. Ядра таблеток, полученные согласно А), покрывали,распыляя суспензию, полученную согласно Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. Выражено в пересчете на массу сухого вещества. Дисперсию эудрагита разбавили первой частью воды и растворяли макрогол во второй части воды. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Диспергировали триэтилцитрат в третьей части воды и полученную дисперсию добавляли к суспензии. Полученную суспензию для нанесения покрытия распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Пример 6. А) Ядро таблетки. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Гомогенно диспергировали пигмент в полученном растворе. Ядра таблеток, полученные согласно А), покрывали,распыляя суспензию, полученную согласно Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. В) Энтеросолюбильное покрытие. Выражено в пересчете на массу сухого вещества. Дисперсию эудрагита разбавляли первой частью воды и растворяли макрогол во второй части воды. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Полученную суспензию для нанесения покрытия распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). После того как суспензию для нанесения покрытия распыляли на покрытые таблетки, продукт перемещали в сушильную камеру и выдерживали при 40 С в течение 8 ч. Средний размер частиц 66,0 мкм. 0,3 г натрия карбоната безводного растворяли в 370 г воды с получением раствора (1). Ингредиенты, перечисленные в вышеприведенной таблице, помещали в мешалку с большими сдвиговыми усилиями (Collet Grall 10) и к смеси при перемешивании медленно добавляли раствор (1). Замешивали массу в течение 1 мин. Влажную массу пропускали через сито с размером ячейки 18 (1,0 мм) и высушивали в сушилке-грануляторе с псевдоожиженным слоем (Glatt GPCG-3) до достижения потери в массе при высушивании менее 3%. К высушенному грануляту добавляли следующие ингредиенты для получения смеси для таблетирования. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. В полученном растворе гомогенно диспергировали пигмент. Ядра таблеток, полученные согласно А), покрывали,распыляя суспензию, полученную согласно Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. В) Энтеросолюбильное покрытие. Выражено в пересчете на массу сухого вещества. Дисперсию эудрагита разбавляли первой частью воды и растворяли во второй части воды макрогол. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Полученную суспензию для нанесения покрытия распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Покрытые таблетки,полученные на стадии В), затем выдерживали в оборудовании для нанесения покрытия (Manesty XL) при 45 С в течение 4 ч при периодическом медленном вращении котла (1 оборот каждые 5 мин), чтобы уменьшить механический стресс на таблетки и достичь хорошего распределения температуры внутри таблеточной массы в котле. 0,3 г натрия карбоната безводного растворяли в 370 г воды с получением раствора (1). Ингредиенты, перечисленные в вышеприведенной таблице, помещали в высокоскоростной смеситель (Collet Grall 10) и к смеси медленно добавляли раствор (1) при перемешивании. Замешивали массу в течение 1 мин. Влажную массу пропускали через сито с размером ячейки 18 (1,0 мм) и высушивали в сушилке с псевдоожиженным слоем (Glatt GPCG-3) в течение 3 ч до получения остаточного содержания влаги, равного 3%(галогенный анализатор влажности Mettler HR 73; 20 мин при 85 С). К высушенному грануляту добавляли следующие ингредиенты с получением смеси для таблетирования. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Гомогенно диспергировали пигмент в полученном растворе. Ядра таблеток, полученные согласно А), покрывали,распыляя суспензию, полученную согласно Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. В) Энтеросолюбильное покрытие. Выражено в пересчете на массу сухого вещества. Дисперсию эудрагита разбавляли первой частью воды и растворяли макрогол во второй части воды. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Полученную суспензию для нанесения покрытия распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Методика гранулирования является такой же, что и в примере 7. Все ингредиенты смешивали в двухконусном смесителе и прессовали в таблетки на роторной таблеточной машине. Б) Разделительный слой. Использовали избыток суспензий ввиду потерь во время нанесения покрытия. Гипромеллозу и коллидон растворяли в воде. Добавляли к раствору пропиленгликоль. Гомогенно диспергировали пигмент в полученном растворе. Ядра таблеток, полученные согласно А), покрывали путем распыления суспензии, полученной по Б), на ядра таблеток в оборудовании для нанесения покрытия типа Manesty. В) Кишечно-растворимое покрытие Выражено в пересчете на массу сухого вещества. Использовали избыток суспензий ввиду потерь во время нанесения покрытия. Дисперсию эудрагита разбавляли первой частью воды и растворяли макрогол во второй части воды. Диспергировали тальк в растворе макрогола и добавляли полученную суспензию к разбавленной дисперсии эудрагита. Полученную суспензию для нанесения покрытия распыляли на покрытые таблетки, полученные согласно Б), с использованием того же оборудования, что и на стадии Б). Покрытые таблетки,полученные на стадии В), выдерживали в оборудовании для нанесения покрытия (Manesty XL) при 40 С в течение 4 ч при периодическом медленном вращении котла (1 оборот каждые 5 минут), чтобы уменьшить механический стресс на таблетки и достичь хорошего распределения температуры внутри таблеточной массы в котле.- 11014187 Устойчивость к действию кислой среды желудка и сходство профилей растворения таблеток пантопразола с дозировкой 20 мг и 40 мг определяли в 0,1 М HCl, 500 мл, Аппарат 1 согласно Фармакопее США (вращающаяся корзинка), 100 об/мин, 2 ч. Количественное содержание интактного пантопразола в таблетках после 2 ч пребывания в 0,1 М HCl определяли при помощи способа высокоэффективной жидкостной хроматографии (ВЭЖХ) и выражали в процентах от заявленного количества. Растворение пантопразола для расчета коэффициента подобия на буферной стадии определяли с использованием фосфатного буфера с рН 6,8, 900 мл, Аппарат 1 согласно Фармакопее США (вращающаяся корзинка), 100 об/мин, после кислотной стадии (0,1 М HCl, 500 мл, Аппарат 1 согласно Фармакопее США (вращающаяся корзинка), 100 об/мин, 2 ч). Процентную долю высвобождения пантопразола изучали в эксперименте продолжительностью 60 мин и определяли при помощи способа ультрафиолетовой спектрофотометрии. Среднее значение по 6 определениям. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Таблетка, содержащая пантопразол в качестве активного ингредиента и включающая: а) ядро, содержащее активный ингредиент, подщелачивающее вещество, наполнитель и разрыхлитель;(б) необязательный водорастворимый разделительный слой или подложку и(в) энтеросолюбильное покрытие,отличающаяся тем, что пантопразол представлен в форме частиц, имеющих средний размер от 60 до 250 мкм, и тем, что слой энтеросолюбильного покрытия имеет толщину от 85 до 150 мкм. 2. Таблетка по п.1, где частицы пантопразола имеют средний размер от 100 до 250 мкм. 3. Таблетка по п.1 или 2, где частицы пантопразола имеют средний размер от 125 до 230 мкм. 4. Таблетка по любому из пп.1-3, где частицы пантопразола имеют средний размер от 140 до 200 мкм. 5. Таблетка по любому из пп.1-4, где пантопразол присутствует в форме натриевой соли. 6. Таблетка по п.5, где пантопразол присутствует в форме пантопразола натрия сесквигидрата. 7. Таблетка по любому из пп. 1-6, где подщелачивающий агент представляет собой гидроксид щелочного или щелочно-земельного металла, карбонат щелочного или щелочно-земельного металла, гидрокарбонат щелочного или щелочно-земельного металла, фосфат, глюкозамин или смесь из двух или более этих соединений, предпочтительно натрия гидроксид, натрия карбонат, натрия гидрокарбонат, натрия фосфат или смесь из двух или более этих компонентов, более предпочтительно натрия карбонат. 8. Таблетка по любому из пп.1-7, где наполнитель представляет собой лактозу или сахарный спирт,такой как маннит, сорбит, мальтит, эритрит или смесь из двух или более этих компонентов. 9. Таблетка по п.8, где наполнитель представляет собой смесь маннита и сорбита. 10. Таблетка по п.9, где смесь содержит 1 мас.ч. маннита и от 1 до 5 мас.ч. сорбита, предпочтительно от 2 до 4 мас.ч. сорбита и более предпочтительно от 2,8 до 3,8 мас.ч. сорбита. 11. Таблетка по любому из пп.1-10, где сахарный спирт имеет средний размер частиц от 30 до 500 мкм. 12. Таблетка по любому из пп.1-11, где разрыхлитель представляет собой кросповидон, натрийкрахмал гликолят,натрий-кроскармелозу,натрий-карбоксиметилкрахмал,натрийкарбоксиметилцеллюлозу, калий-карбоксиметилцеллюлозу или смесь из двух или более этих компонентов. 13. Таблетка по п.12, где разрыхлитель представляет собой смесь кросповидона, имеющего средний размер частиц от 10 до 60 мкм, и кросповидона, имеющего средний размер частиц от 80 до 200 мкм. 14. Таблетка по п. 13, где разрыхлитель представляет собой смесь 1 мас.ч. кросповидона, имеющего средний размер частиц, составляющий от 10 до 60 мкм, и от 1 до 5 мас.ч. кросповидона, имеющего средний размер частиц, составляющий от 80 до 200 мкм. 15. Таблетка по любому из пп.1-14, где ядро дополнительно содержит смазывающее вещество, выбранное из стеариновой кислоты, гидрогенизированного растительного масла, парафина или стеарата щелочного или щелочно-земельного металла, алюминия стеарата, натрия стеарилфумарата или смеси из двух или более этих соединений, предпочтительно магния или кальция стеарат, более предпочтительно магния калия стеарат. 16. Таблетка по любому из пп.1-15, где ядро дополнительно содержит связывающее вещество, вы- 12014187 бранное из микрокристаллической целлюлозы, гидроксипропилметилцеллюлозы, поливинилпирролидона или смеси из двух или более этих соединений. 17. Таблетка по любому из пп.1-16, где ядро содержит от 15 до 50 мас.% активного ингредиента, от 2 до 25 мас.% подщелачивающего вещества, от 10 до 50 мас.% наполнителя и от 10 до 50 мас.% разрыхлителя. 18. Таблетка по любому из пп.1-17, где необязательный разделительный слой содержит водорастворимое пленкообразующее вещество, предпочтительно гидроксипропилметилцеллюлозу. 19. Таблетка по любому из пп.1-18, где необязательный разделительный слой имеет толщину, составляющую от 20 до 120 мкм. 20. Таблетка по любому из пп.1-19, где кишечно-растворимое покрытие содержит пленкообразующие вещества, предпочтительно ацетатфталатцеллюлозу, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, гидроксипропилметилцеллюлозы ацетатсукцинат, сополимер этилакрилата и метакриловой кислоты, сополимер метилметакрилата и метакриловой кислоты, шеллак, предпочтительно сополимеры метакриловой кислоты и сложных эфиров метакриловой кислоты, такие как анионный полимер метакриловой кислоты и метакрилатов с -СООН группами. 21. Таблетка по п.1, содержащая от 20 до 40 мг пантопразола в форме натриевой соли гидрата или натриевой соли гидрата сесквигидрата. 22. Способ получения пантопразола, имеющего средний размер частиц от 60 до 250 мкм, включающий стадии увлажнения пантопразола водой в мешалке с большими сдвиговыми усилиями; пропускания влажного пантопразола через сито, имеющее размер ячейки от 0,8 до 2 мм; и высушивания массы в сушилке с псевдоожиженным слоем, причем порядок выполнения стадий просеивания и высушивания может варьировать. 23. Способ по п.22, где высушивание осуществляют при температуре продукта, составляющей от 35 до 50 С. 24. Способ по любому из пп.22 и 23, где массу высушивают до остаточного содержания влаги, составляющего менее 1 мас.%. 25. Способ по любому из пп.22-24, где вода, используемая для увлажнения, имеет значение рН, составляющее от 10 до 12. 26. Продукт, полученный при помощи способа по любому из пп.22-25. 27. Таблетка по любому из пп.1-21, высвобождающая более чем 50% активного ингредиента в течение 45 мин, более чем 80% активного ингредиента в течение 60 мин согласно определению в фосфатном буфере с рН 6,4, с помощью Аппарата 1 согласно Фармакопее США (USP), при 100 об/мин, после 1 ч хранения в 0,1 М растворе HCl с рН 1.
МПК / Метки
МПК: A61K 31/4439, A61K 9/28, A61K 9/16
Метки: пантопразол, содержащая, гранулированный, таблетка
Код ссылки
<a href="https://eas.patents.su/14-14187-tabletka-soderzhashhaya-granulirovannyjj-pantoprazol.html" rel="bookmark" title="База патентов Евразийского Союза">Таблетка содержащая гранулированный пантопразол</a>
Предыдущий патент: Усовершенствования для аналоговых соединений трифосфата 6-тиогуанозина, их применение в областях медицины и способы их получения
Следующий патент: Макроциклические ингибиторы вируса гепатита с
Случайный патент: Средство для косметического ухода за ногтями и кожей лица, волосистой части головы, спины, ног и рук