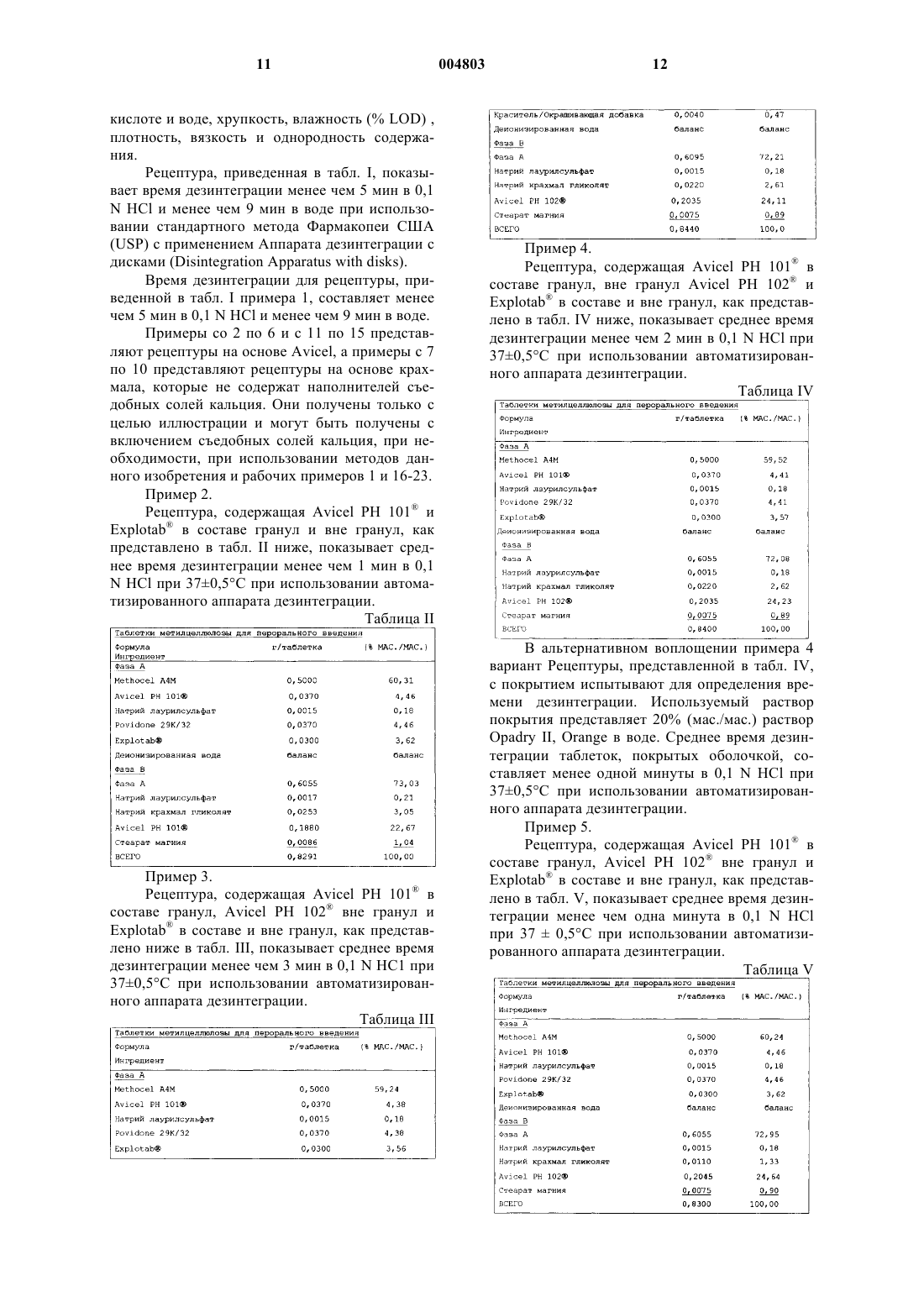
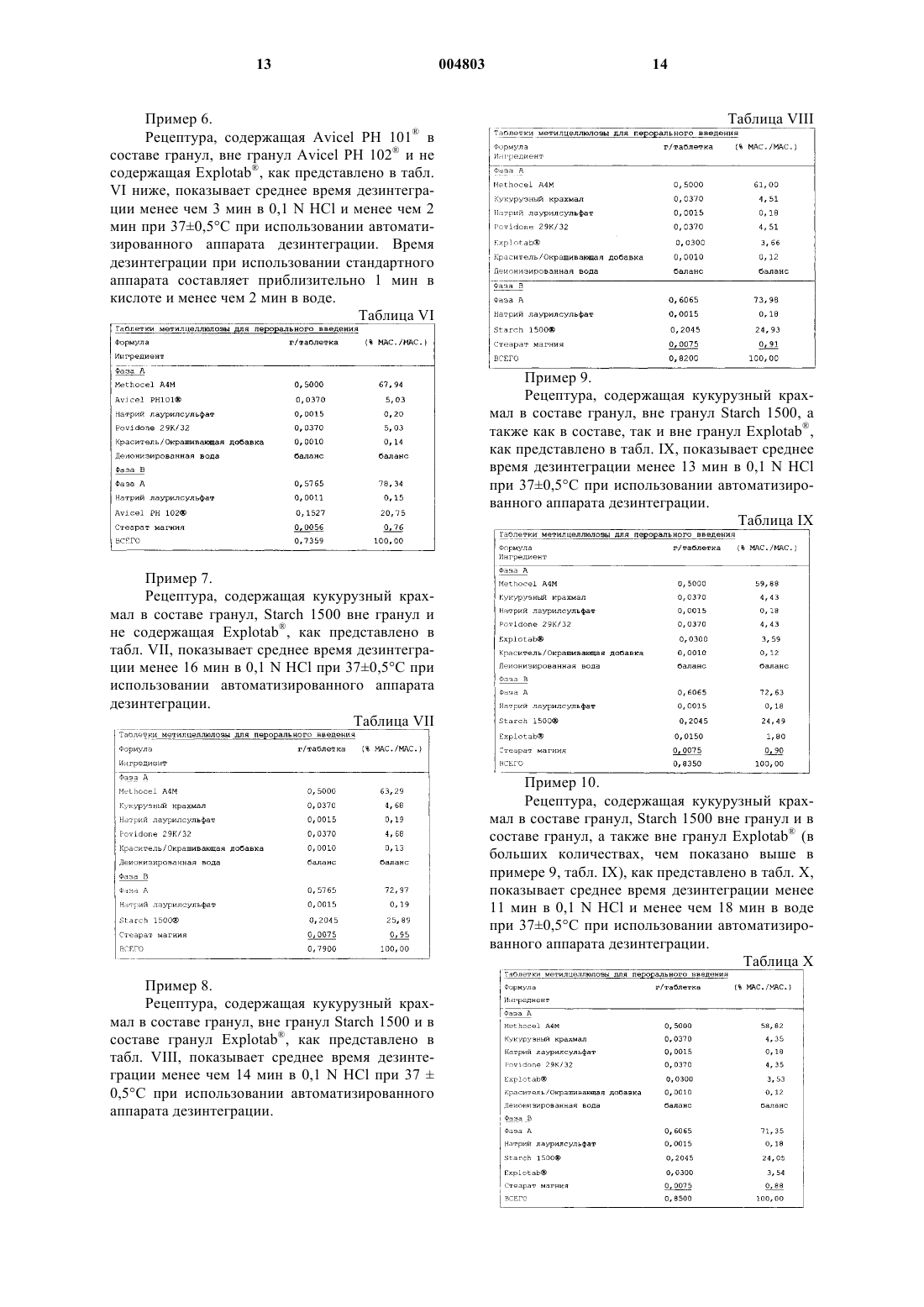
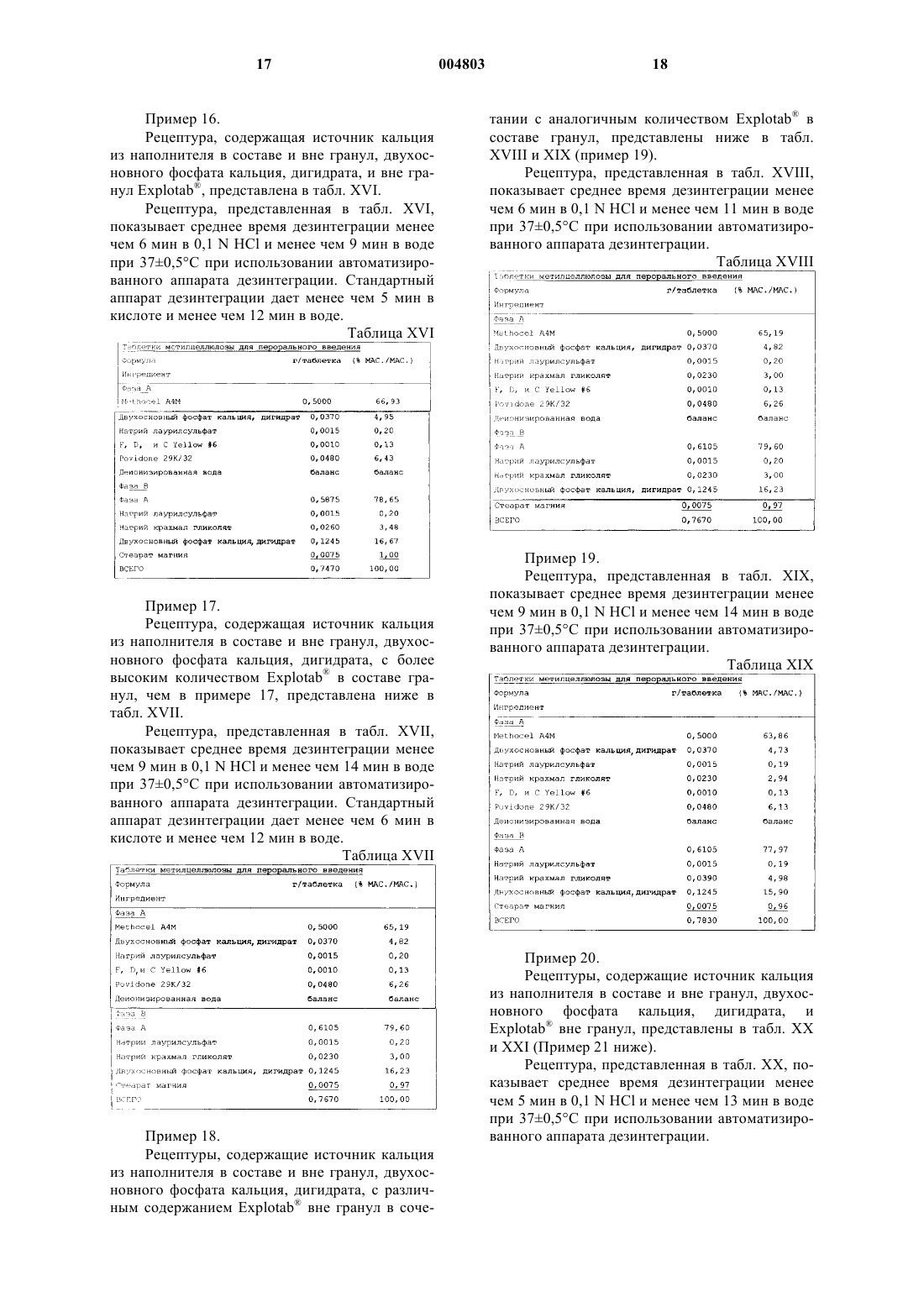
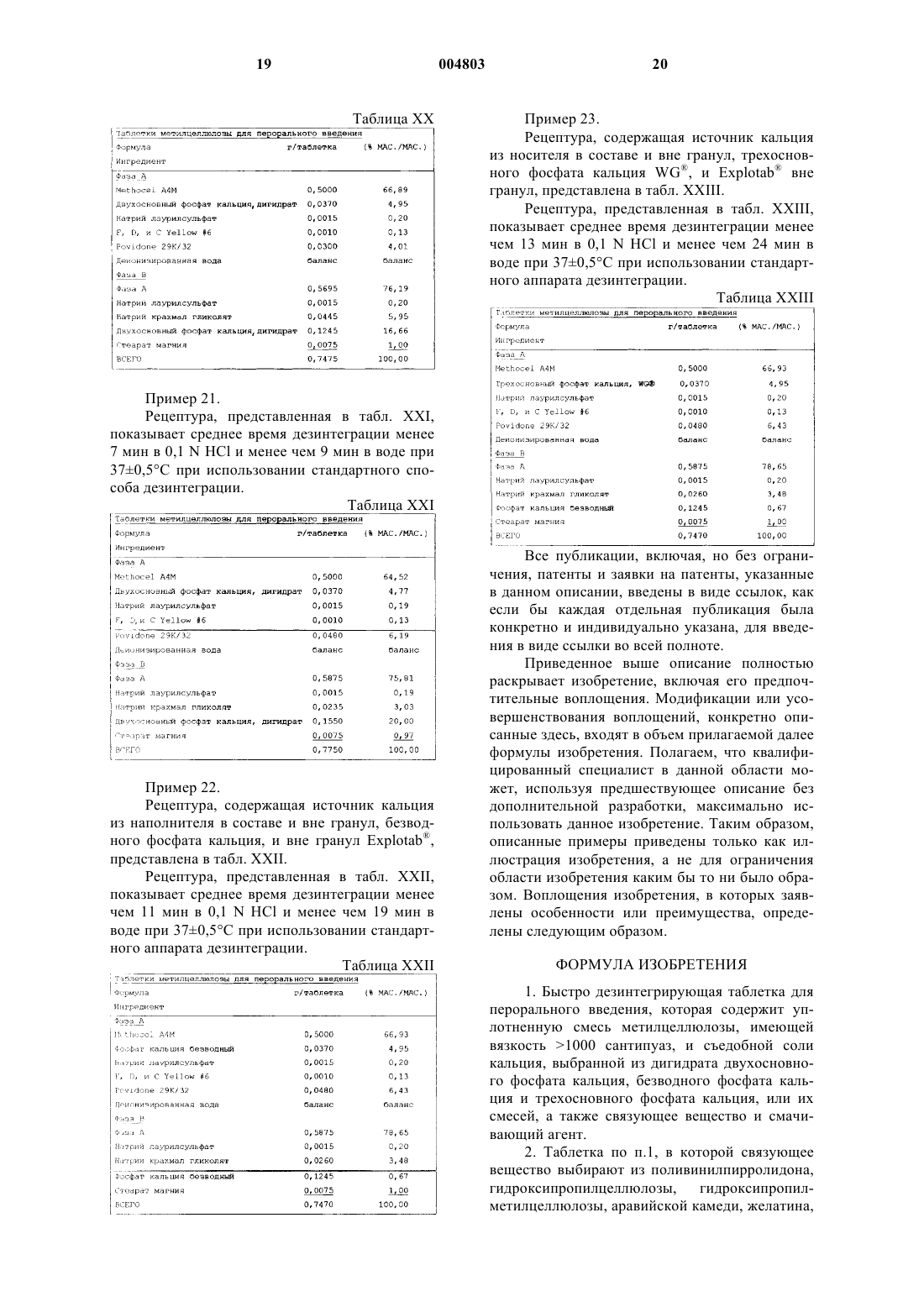
Быстро дезинтегрирующая таблетка метилцеллюлозы и способы ее получения
Формула / Реферат
1. Быстро дезинтегрирующая таблетка для перорального введения, которая содержит уплотненную смесь метилцеллюлозы, имеющей вязкость >1000 сП, и съедобной соли кальция, выбранной из дигидрата двухосновного фосфата кальция, безводного фосфата кальция и трехосновного фосфата кальция или их смесей, а также связующее вещество и смачивающий агент.
2. Таблетка по п.1, в которой связующее вещество выбирают из поливинилпирролидона, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, аравийской камеди, желатина, трагаканта, предварительно желатинированного крахмала или крахмала.
3. Таблетка по п.2, в которой связующим веществом является поливинилпирролидон.
4. Таблетка по любому из пп.1-3, которая дополнительно включает дезинтегрирующий агент, выбранный из натрий-крахмалгликолята, натрий-карбоксиметилцеллюлозы, натрий-кросскармелозы, карбоксиметилцеллюлозы, силиката магния-алюминия, альгината, агара, гуара, трагаканта, сердцевины плодов рожкового дерева, смолы карайи, пектина или кросповидона.
5. Таблетка по п.4, в которой дезинтегрирующий агент представляет натрий-крахмалгликолят.
6. Таблетка по п.5, в которой натрий-крахмалгликолят присутствует в количестве от приблизительно 3 до приблизительно 8% (мас./мас.).
7. Таблетка по п.1, в которой смачивающим агентом является натрий-лаурилсульфат.
8. Таблетка по любому из пп.1-7, которая дополнительно включает смазку.
9. Таблетка по п.8, в которой смазкой является стеарат магния, стеарат кальция, стеарат натрия, коллоидная двуокись кремния, порошкообразный силикагель, стеариновая кислота или тальк.
10. Таблетка по п.9, в которой смазкой является стеарат магния.
11. Таблетка по любому из пп.1-10, в которой метилцеллюлоза имеет вязкость >2000 сП.
12. Таблетка по п.11, в которой метилцеллюлоза имеет вязкость >3000 сП.
13. Таблетка по п.12, в которой метилцеллюлоза имеет вязкость >4000 сП.
14. Таблетка по любому из пп.1-13, в которой съедобная соль кальция присутствует в количестве, дающем соотношение метилцеллюлозы и кальция в интервале от приблизительно 2 до приблизительно 4:1.
15. Таблетка по любому из пп.1-12, которая, кроме того, содержит дополнительные наполнители и разбавители, выбранные из следующих сочетаний:
натрий-лаурилсульфат:натрий-крахмалгликолят:трехосновный фосфат кальция:повидон 29K/32:стеарат магния в соотношении 0,40:3,5:21,6:6,4:1,0 и
натрий-лаурилсульфат:натрий-крахмалгликолят:безводный фосфат кальция:повидон 29K/32:стеарат магния в соотношении 0,40:3,5:21,6:6,4:1,0.
16. Таблетка по любому из пп.1-15, в которой метилцеллюлоза присутствует в количестве от приблизительно 450 до приблизительно 550 мг.
17. Таблетка по п.16, в которой метилцеллюлоза присутствует в количестве от приблизительно 200 до приблизительно 300 мг.
18. Быстро дезинтегрирующая таблетка для перорального введения по п.12, которая содержит метилцеллюлозу, имеющую вязкость >3000 сП, двухосновный фосфат кальция, натрий-лаурилсульфат, повидон, натрий-крахмалгликолят и стеарат магния.
19. Быстро дезинтегрирующая таблетка для перорального введения, которая включает уплотненную смесь метилцеллюлозы, имеющей вязкость >1000 сП, и съедобной соли кальция, выбранной из дигидрата двухосновного фосфата кальция, безводного фосфата кальция, трехосновного фосфата кальция или их смеси, где отношение метилцеллюлозы к соли кальция составляет от приблизительно 2:1 до приблизительно 4:1, а также связующее вещество и смачивающий агент.
20. Таблетка по п.19, в которой отношение метилцеллюлозы к соли кальция составляет от приблизительно 2,6:1 до приблизительно 3,1:1.
21. Таблетка по п.19, в которой связующее вещество выбирают из поливинилпирролидона, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, аравийской камеди, желатина, трагаканта, предварительно желатинированного крахмала или крахмала.
22. Таблетка по п.21, в которой связующим веществом является поливинилпирролидон.
23. Таблетка по п.22, в которой поливинилпирролидон присутствует в количестве от около 4 до около 6,5% (мас./мас.).
24. Таблетка по п.19, которая дополнительно включает дезинтегрирующий агент.
25. Таблетка по п.24, в которой дезинтегрирующий агент выбирают из натрий-крахмалгликолята, натрий-карбоксиметилцеллюлозы, натрий-кросскармелозы, карбоксиметилцеллюлозы, силиката магния-алюминия, альгината, агара, гуара, трагаканта, сердцевины плодов рожкового дерева, смолы карайи, пектина или кросповидона.
26. Таблетка по п.25, в которой дезинтегрирующий агент представляет натрий-крахмалгликолят.
27. Таблетка по п.26, в которой натрий-крахмалгликолят присутствует в количестве от приблизительно 3 до приблизительно 8% (мас./мас.).
28. Таблетка по п.19, в которой смачивающим агентом является натрий-лаурилсульфат.
29. Таблетка по п.19, которая дополнительно включает смазку.
30. Таблетка по п.29, в которой смазкой является стеарат магния.
31. Таблетка по п.19, в которой метилцеллюлоза имеет вязкость >2000 сП.
32. Таблетка по п.31, в которой метилцеллюлоза имеет вязкость >3000 сП.
33. Таблетка по п.32, в которой метилцеллюлоза имеет вязкость >4000 сП.
34. Способ получения препарата в форме таблетки по любому из пп.1-18 или 19-33, который включает
a) смешение вместе метилцеллюлозы высокой вязкости (>3000 сП), части смачивающего агента, части повидона или натрий-крахмалгликолята и части съедобной соли кальция, где съедобную соль кальция выбирают из дигидрата двухосновного фосфата кальция, безводного фосфата кальция и трехосновного фосфата кальция или их смесей, с образованием интрагранулярной смеси;
b) добавление к смеси со стадии (a) водного раствора поливинилпирролидона или, альтернативно, опрыскивание смеси со стадии (a) водным раствором поливинилпирролидона и получение гранулята;
c) смешение вместе оставшейся части съедобной соли кальция, оставшейся части смачивающего агента; смазки и оставшейся части повидона или натрий-крахмалгликолята или их смеси с получением экстрагранулярной смеси; и
d) спрессовывание гранулятов со стадии (b) с экстрагранулярной смесью со стадии (c).
35. Способ по п.34, где съедобная соль кальция представляет собой дигидрат двухосновного фосфата кальция.
36. Способ получения фармацевтической таблетки по любому из пп.1-18 или 19-33, который включает
a) смешение гранулятов, включающих метилцеллюлозу высокой вязкости (>3000 сП), часть смачивающего агента, часть повидона или натрий-крахмалгликолята и часть съедобной соли кальция;
b) смешение с получением экстрагранулярной смеси, оставшейся части съедобной соли кальция, оставшейся части смачивающего агента, смазки, оставшейся части повидона или натрий-крахмалгликолята или их смеси; и
c) спрессовывание гранулятов со стадии (b) с гранулированной смесью со стадии (a); и
d) прессование таблетки.
37. Способ получения гранулята, используемого для изготовления фармацевтической таблетки по любому из пп.1-18 или 19-33, который включает
a) смешение метилцеллюлозы высокой вязкости (>3000 сП), смачивающего агента и съедобной соли кальция, где съедобную соль кальция выбирают из дигидрата двухосновного фосфата кальция, безводного фосфата кальция и трехосновного фосфата кальция или их смесей, и
b) добавление к смеси со стадии (a) водного раствора поливинилпирролидона или опрыскивание смеси стадии (a) водным раствором поливинилпирролидона и получение гранулята.
38. Способ по п.37, в котором гранулят смешивают со вторым смачивающим агентом, смазывающим агентом и дезинтегрирующим агентом и спрессовывают с образованием таблетки.
39. Способ по п.38, в котором дезинтегрирующий агент выбирают из натрий-крахмалгликолята, натрий-карбоксиметилцеллюлозы, натрий-кросскармелозы, карбоксиметилцеллюлозы, силиката магния-алюминия, альгината, агара, гуара, трагаканта, сердцевины плодов рожкового дерева, смолы карайи, пектина или кросповидона.
40. Способ по п.39, в котором смачивающим агентом является натрий-лаурилсульфат.
41. Способ по п.38, т котором вторым смачивающим агентом является натрий-лаурилсульфат.
42. Способ по п.34, в котором гранулят дополнительно содержит разбавитель.
43. Способ по п.42, в котором разбавителем является микрокристаллическая целлюлоза, кукурузный крахмал или крахмал 1500.
44. Способ по п.34, в котором гранулят дополнительно содержит дезинтегрирующий агент.
45. Способ по п.44, в котором дезинтегрирующий агент представляет собой натрий-крахмалгликолят.
Текст
1 Техническая область изобретения Данное изобретение относится к усовершенствованному способу получения прессованных таблеток, содержащих метилцеллюлозу,которые удовлетворяют стандартам Фармакопеи США по дезинтеграции. Описание предшествующего уровня История простых эфиров целлюлозы, таких как метилцеллюлоза и карбоксиметилцеллюлоза, говорит о том, что эти соединения эффективны в качестве объемных слабительных средств (bulk laxatives). Механизм их действия включает повышение как содержания воды в стуле, так и объемного содержания стула, а также смазку стула; таким образом, полностью или частично облегчая запор. Простые эфиры целлюлозы вводились в качестве объемных слабительных средств в лекарственных формах, включая таблетки, суспензии и объемные порошки; последние - как не содержащие сахара, или в композициях, содержащих большие количества сахара. Простые эфиры целлюлозы, вводимые в виде суспензии в воде, могут содержать высокие концентрации сахарозы или других сахаров и вкусовых веществ. В таких рецептурах сахар конкурирует с простым эфиром целлюлозы за доступную воду, защищая, таким образом, простой эфир целлюлозы от достаточной для образования геля гидратации. Преимущества применения суспензионной рецептуры состоят в том,что простой эфир целлюлозы в достаточной степени диспергирован, чтобы избежать любого значительного комкообразования в пищеварительном тракте. Однако эти суспензии являются вязкими, полу-гелеобразными и визуально непривлекательны для потребителя. Еще одним недостатком является неприятный вкус суспензий вследствие ощущения липкости во рту и приторности таких суспензий. Поэтому эти лекарственные формы не получили значительного признания у потребителей. Сыпучие порошки простых эфиров целлюлозы зачастую дают образование комков из отдельных частиц и образование геля и, таким образом, остаются нерастворенными при прохождении через пищеварительный тракт. Кроме того, введение сыпучих порошков вызывало крепление, тошноту и рвоту у некоторых пациентов. Таким образом, сыпучие порошки не являются предпочтительной лекарственной формой простых эфиров целлюлозы. Приятные на вкус и визуально привлекательные сыпучие порошки, тем не менее, были получены посредством добавления воды или другой водной жидкости к сухой порошковой смеси простого водорастворимого эфира целлюлозы и дисперсанта/компонента, придающего сладкий вкус, обычно сахара. Эта технология описана в Патенте Южной Африки 841044,опубликованном 26 сентября 1984 года. Недостатком этих композиций является то, что их 2 питательная ценность составляет приблизительно 400 калорий на дозу, главным образом вследствие высокого содержания сахара. Эта высокая калорийность не приемлема для средних потребителей или для потребителей, страдающих от заболеваний, связанных с содержанием сахара в крови, включая диабетиков. Пожилые люди обычно являются той группой населения, кто страдает от запора и чаще использует слабительные средства, а также обычно страдает заболеваниями, связанными с содержанием сахара в крови. Потребление больших количеств сахара могло отягчать расстройства, связанные с содержанием сахара в крови. Простые эфиры целлюлозы, покрытые сахаром, были предложены в качестве альтернатив сыпучим порошкам, содержащим высокие количества сахара. Такие рецептуры 1) содержат меньше сахара, такого как природный сахар или сочетание сахаров, таких как сахароза, глюкоза, фруктоза или сухая кукурузная патока; 2) содержат меньшее количество калорий и 3) легко диспергируются в холодных водных жидкостях.Citrucel Orange Flavor - объемообразующее слабительное, содержащее метилцеллюлозу в качестве активного ингредиента, впервые поступило в продажу в 1986 году. Этот продукт содержит 15 г сахарозы в 19 г дозе для взрослого, которая соответствует 2 г дозе метилцеллюлозы. Для снижения содержания сахара в этом продукте в 1988 году была разработана и внедрена натуральная вкусовая формула с меньшим содержанием калорий и содержащая только 1 г сахарозы. Дополнительная патентная защита для этого продукта была сосредоточена на получении порошка, не содержащего сахара и фактически не содержащего калорий. Продукт,содержащий свободное от сахара вкусовое вещество, придающее сладкий вкус, другие наполнители и вкусовое вещество, поступил на рынок в 1991 году под торговой маркой SugarFree Citrucel Orange Flavor. Тем не менее, сохраняется потребность в данной области в разработке быстро дезинтегрирующей твердой лекарственной формы объемообразующего средства, предпочтительно метилцеллюлозы, которую удобно брать и транспортировать, которая не содержит сахара и легко вводится потребителям, страдающим заболеваниями, связанными с содержанием сахара в крови, или, например, диабетикам. Краткое описание изобретения Данное изобретение относится к усовершенствованному способу получения таблеток метилцеллюлозы, которые являются легко диспергируемыми и удовлетворяют стандартам Фармакопеи США для дезинтеграции. Метилцеллюлоза спрессована в таблетки, которые содержат съедобную соль кальция в предпочтительных соотношениях (мас./мас.). Предпочтительно, таблетки быстро дезинтегрируются invitro в 0,1 N соляной кислоте и в воде при 37 С 0,5 С. Подробное описание изобретения Обычно полагают, что простые эфиры целлюлозы в виде таблеток не легко растворяются в пищеварительном тракте, поскольку эти простые эфиры целлюлозы являются высоко гигроскопичными. Внешняя часть таблетки, как полагают, образует гелеподобный гидрат, который защищает таблетку от разрушения и в значительной степени замедляет гидратацию внутренней части таблетки. Данное изобретение устраняет признанные проблемы в этой области и включает получение новой композиции и способ получения, посредством которого получают быстро дезинтегрирующую таблетку метилцеллюлозы. Таблетки получают новым способом,включающим мокрую грануляцию с высоким усилием сдвига, последующую сушку в псевдоожиженном слое, измельчение, смешение с другими ингредиентами и прессование. Данное изобретение относится к таблетке метилцеллюлозы, которая включает метилцеллюлозу, имеющую вязкость 1000 сантипуаз и,по меньшей мере, один наполнитель, выбранный из съедобной соли кальция. Признается,что рецептура также будет включать разбавители и наполнители, хорошо известные квалифицированному специалисту. Рецептуры таблеток данного изобретения преимущественны относительно других лекарственных форм метилцеллюлозы, благодаря удобству введения и быстрой дезинтеграции. Это отличает их от таблеток метилцеллюлозы,изготовленных в виде рецептур 100% (мас./мас.) метилцеллюлозы массой по 0,5 г, которые, как было установлено, не дезинтегрируют в 0,1 N растворе НСl при использовании стандартного аппарата растворения даже спустя два часа. Таблетки данного изобретения должны разлагаться в 0,1 N НСl в течение от приблизительно 20 до приблизительно 30 мин, предпочтительно в течение от приблизительно 10 до приблизительно 19 мин и более предпочтительно в течение менее чем 10 мин; в воде таблетки должны разлагаться в течение от приблизительно 25 до приблизительно 30 мин, предпочтительно в течение от приблизительно 15 до приблизительно 24 мин и, более предпочтительно, в течение менее чем 15 мин. Было установлено, что метилцеллюлоза с низкой молекулярной массой (м.м.) является менее эффективной для применения в качестве слабительного средства и, следовательно, менее желательна для применения в рецептуре быстро дезинтегрирующих таблеток. Таким образом, в данном изобретении как желательна, так и необходима метилцеллюлоза более высокой молекулярной массы. Волокно должно иметь достаточную вязкость для геля и удерживать воду в кишечнике для обеспечения разрыхления и 4 смягчения стула для применения в качестве слабительного. При использовании методов испытания метилцеллюлозы в стандартных условиях, таких как обоснованный в Фармакопее США (USPXXII, p. 894) способ Кажущейся вязкости для Метилцеллюлозы (Apparent Viscosity method forHandbook of Pharmaceutical Excipients, APhA,установлено, что предпочтительная метилцеллюлоза должна иметь вязкость 1000 сантипуаз(спз), предпочтительно 2000 сантипуаз, более предпочтительно 3000 сантипуаз и наиболее предпочтительно 4000 сантипуаз. Метилцеллюлоза более высокой молекулярной массы, чем описанные здесь, также является желательной,однако ограничивающим фактором является коммерческая доступность этого сорта метилцеллюлозы. В настоящее время верхним пределом коммерческой доступности является приблизительно 6000 спз, что входит в область данного изобретения. Доступным в настоящее время метилцеллюлозным продуктом для применения в данном изобретении является MethocelA4M, выпускаемый Dow Chemical Company,Midland Michigan как Dow Methocel A4M и имеющий вязкость от приблизительно 3000 до приблизительно 5600 спз, которая составляет от 75 до 140 % желательной в данном изобретении целевой вязкости. Некоторыми дополнительными разбавителями или наполнителями для применения в этой рецептуре являются предпочтительно добавки,обладающие способностью набухать, и они могут включать, но без ограничения, микрокристаллическую целлюлозу различных сортов,таких как Avicel PH101, Avicel PH102,AvicelPH200; Кукурузный крахмал (Corn starch); или Крахмал 1500 (Starch 1500). Съедобные соли кальция, подходящие для применения в данном изобретении, включают,но без ограничения, двухосновный фосфат кальция дигидрат, безводный фосфат кальция и трехосновный фосфат кальция или их смеси. Предпочтительной съедобной солью кальция является двухосновный фосфат кальция дигидрат - соль, которая обеспечивает хорошую способность к прессованию. Если добавлена микрокристаллическая целлюлоза, предпочтительно она имеет размер частиц от 50 до 180 микрон, более предпочтительно приблизительно 50. Avicel PH 101 имеет средний размер частиц приблизительно 50;Avicel PH 102 имеет средний размер частиц приблизительно 100; и Avicel PH 200 имеет средний размер частиц приблизительно 190 микрон. Наиболее предпочтительной микрокристаллической целлюлозой является Avicel PH 101. Отмечается, что соотношение метилцеллюлозы, съедобной соли кальция и дополнительных разбавителей будет зависеть от вы 5 бранного разбавителя, и квалифицированный специалист точно определит необходимые пропорции. Однако подходящие пропорции для конкретных разбавителей описаны ниже: метилцеллюлоза : двухосновный фосфат кальция дигидрат - от приблизительно 2 до приблизительно 4:1, предпочтительно от приблизительно 2,6-3,1:1; метилцеллюлоза : фосфата кальция безводный от приблизительно 2 до приблизительно 4:1,предпочтительно от приблизительно 3,1 метилцеллюлоза : трехосновный фосфат кальция, WG - от приблизительно 2 до приблизительно 4:1, предпочтительно от приблизительно 3,1 : 1; метилцеллюлоза : микрокристаллическая целлюлоза - от приблизительно 2:1 до приблизительно 14:1. Предпочтительно для Avicel РН 101PH 200 - от приблизительно 2,4-4:1; метилцеллюлоза : кукурузный крахмал - от приблизительно 7,5 до приблизительно 15, предпочтительно от приблизительно 13,5:1; метилцеллюлоза : Starch 1500 - от приблизительно 2,0 до приблизительно 5,0:1, предпочтительно от приблизительно 2,4:1; метилцеллюлоза : Explotab - от приблизительно 5 до приблизительно 25:1, предпочтительно от приблизительно 8,1 до приблизительно 21,3:1. Установлено, что наряду со съедобной солью кальция рецептура может также включать ингредиент, который сохраняет целостность гранул, то есть связующее вещество. Предпочтительным связующим веществом является PVP или альтернативные добавки, указанные ниже. Кроме представленной(ых) выше съедобной(ых) соли(ей) кальция, необязательных разбавителей или наполнителей и связующего(их) вещества (веществ) рецептура может также включать дополнительные компоненты, такие как (но без ограничения указанным перечнем) смачивающий агент, (супер)дезинтегрант(ы),второе связующее(ие) вещество(а), краситель(и) или окрашивающие добавки и смазки, которые предпочтительно используются для получения таблетки, которая легко смачивается и быстро дезинтегрирует в 0,1 N соляной кислоте и воде,в соответствии со стандартным испытанием Фармакопеи США для метилцеллюлозы. Предпочтительным смачивающим агентом является натрий лаурилсульфат. Предпочтительной смазкой является стеарат магния. Предпочтительным связующим веществом является поливинил-пирролидон или PVP, такой как Povidone 29K/32. Предпочтительно, PVP присутствует в количестве от приблизительно 4 до приблизительно 6,5% (мас/мас). Предпочтительным дезинтегрантом является натрий крахмал гликолят, такой как Explo 004803tab. Предпочтительно натрий крахмал гликолят присутствует в количестве от приблизительно 3 до приблизительно 8 % маc./маc. Поскольку различные наполнители или разбавители будут вводиться в рецептуру вместе и использоваться в ней в сочетании, предполагаемые соотношения, выраженные в %(маc./маc), для различных рецептур, представлены ниже. Хотя не все из этих соотношений включают съедобные соли кальция, они являются просто иллюстративными для данного изобретения, и квалифицированный специалист легко поймет, как получить рецептуру продукта данного изобретения с добавлением съедобных солей кальция. Натрий лаурилсульфат : Explotab : двухосновный фосфат кальция, дигидрат : Povidone 29K/32 : стеарат магния включают : 0,380,40:3,5-7,9:20,6-24,8:4,0-6,5:0,5-1,0. Натрий лаурилсульфат : Explotab : трехосновный фосфат кальция WG : Povidone 29K/32: стеарат магния включают : 0,40:3,5:21,6:6,4:1,0. Натрий лаурилсульфат : Explotab : фосфат кальция безводный : Povidone 29K/32 : стеарат магния включают : 0,40:3,5:21,6:6,4:1,0. Метилцеллюлоза : натрий лаурилсульфат(sodium lauril sulfate - SLS), от приблизительно 60 до приблизительно 170:1, предпочтительно от приблизительно 155:1-170:1; Метилцеллюлоза : Povidone, предпочтительно PVP 29K/32, от приблизительно 8 до приблизительно 22:1, предпочтительно от приблизительно 10,4:1-16,7:1; Метилцеллюлоза : стеарат магния от приблизительно 50 до приблизительно 150: 1, предпочтительно от приблизительно 58-132:1; Натрий лаурилсульфат: Explotab : AvicelPH 101: Povidone 29 К/32: стеарат магния включают : 0,35-0,46:3,05-6,17:4,38-27,13:4,386,66:0,76-1,14; Натрий лаурилсульфат : Explotab : AvicelPovidone 29K/32: стеарат магния включают: 0,38-0,42:19,27-25,53:5,99-6,66:0,94-1,04; Натрий лаурилсульфат: Explotab: кукурузный крахмал : Povidone 29 К/32 : стеарат магния включают: 0,36-0,38:3,66-7,07:4,35-4,68:4,354,68:0,88-0,95; Натрий лаурилсульфат; Explotab: Starch 1500: Povidone 29 К/32: стеарат магния включают: 0,36-0,38:3,66-7,07:24,05-25,89:4,35-4,68: 0,88-0,95. Кроме определенных наполнителей, приведенных выше, в данном изобретении могут также использоваться следующие альтернативные добавки. Смазки, альтернативные стеарату магния,включают, но без ограничения указанным пе 7 речнем, стеарат кальция, стеарат натрия, Cab-OSil, Syloid, стеариновую кислоту и тальк. Связующие вещества, альтернативныеPVP, включают (но без ограничения указанным перечнем) гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, акасию, желатин,трагакант, предварительно желатинированный крахмал и крахмал. Дезинтегранты, альтернативные Explotab,включают (но без ограничения указанным перечнем) натрий карбоксиметилцеллюлозу, Acdisol,карбоксиметилцеллюлозу,веегум(veegum), альгинаты, агар, гуар, трагакант, плоды рожкового дерева (locust bean), karaya, пектин и сшитый повидон (crospovidon). Смачивающие агенты, альтернативные натрий лаурилсульфату, включают (но без ограничения указанным перечнем) магний лаурилсульфат. Все эти рецептуры могут быть получены с сахаром и без него. Рецептура, свободная от сахара, обладает преимуществом в том, что она может легко вводиться потребителям с заболеваниями, связанными с содержанием сахара в крови, или диабетикам, нуждающимся в таких препаратах. Другое преимущественное свойство данного изобретения состоит в том, что рецептуры содержат кальций, такой как двухосновный фосфат кальция дигидрат. Эти рецептуры, например, будут содержать приблизительно 80 мг/дозу, при изготовлении рецептуры 0,5 мг/таблетку X 2 таблетки/дозу метилцеллюлозы. Если это необходимо, количество кальция в этих таблетках может быть увеличено для обеспечения повышенного терапевтического действия для потребителя. Количество метилцеллюлозы, присутствующее в каждой дозе, а также количество доз слабительного, принимаемое в день, будет зависеть в некоторой степени от возраста, пола, размера пациента, тяжести конкретной проблемы пациента, назначения лечащего врача, если оно имеется, и особенностей вкуса и телосложения пациента. Соответственно, таблетки данного изобретения преимущественно вводят в разовой дозе, которая может содержать от 500 до 1000 мг метилцеллюлозной таблетки, или во множестве меньших доз, содержащих как минимум 250 мг на таблетку. Наиболее предпочтительно для слабительного действия, чтобы каждая таблетка содержала приблизительно 500 мг метилцеллюлозы, и пациент мог принимать от 1 до 2 таблеток на дозу. Такая дозировка - 1000 мг должна адекватно обеспечивать оптимальную эффективность слабительного действия. Следовательно, предпочтительная область содержания метилцеллюлозы в таблетке оптимально составляет от приблизительно 450 до 550 мг,предпочтительно приблизительно 500 мг; или,альтернативно, от приблизительно 200 до приблизительно 300 мг для меньшей таблетки, 004803 8 предпочтительно приблизительно 250 мг; или даже в инкрементах приблизительно от 125 мг на таблетку, то есть от 75 до 175 мг на таблетку. Хотя, предпочтительно, прессованные таблетки не имеют покрытия, они могут быть покрыты, если нужно, любым подходящим покрытием, хорошо известным в данной области. Подходящими покрытиями являются покрытия,используемые для немедленного высвобождения, которые будут растворяться в желудочном соке. Такие покрытия хорошо известны специалистам и включают (но без ограничения указанным перечнем) гидроксипропилметилцеллюлозу или метилцеллюлозу или 20% (маc./маc.) OpadryII, orange в воде. Как будет хорошо видно из рабочих примеров, возможно применение различных сочетаний смешения ингредиентов в составе и вне гранул. Все они включены в область данного изобретения. Обычно метилцеллюлоза высокой вязкости, такая как Methocel A4M, сначала будет гранулироваться со связующим веществом,таким как povidone, смачивающим агентом, таким как натрий лаурилсульфат, и подходящим красителем для получения смеси для гранул,которую затем гранулируют. Эти гранулированные компоненты затем смешиваются с дополнительными смачивающими агентами и дезинтегрантами и, наконец, смешиваются со смазкой. Конечная гранулированная смесь затем смешивается и прессуется в таблетки данного изобретения. Следовательно, аспектом данного изобретения является способ получения рецептуры таблетки, который включаетa) смешение вместе метилцеллюлозы высокой вязкости (3000 сП), смачивающего агента, повидона (povidone) или натрий крахмал гликолята, и съедобной соли кальция для образования смеси для гранул; иb) добавление к смеси стадии (а) водного раствора PVP или, альтернативно, опрыскивание смеси стадии (а) водным раствором PVP; и получение гранулятов; иc) смешение вместе съедобной соли кальция, смачивающего агента; смазки; повидона или натрий крахмал гликолята или их смеси - с получением смеси, не входящей в состав гранулd) уплотнение гранулятов стадии (b) со смесью стадии (с) -"внегранульной" смесью. Другим аспектом данного изобретения является способ получения фармацевтической таблетки, который включает смешениеa) гранулятов, включающих метилцеллюлозу высокой вязкости 3000 сП, смачивающего агента, повидона или натрий крахмал гликолята,съедобной соли кальция; иb) смешение с получением "внегранульной" смеси съедобной соли кальция, смачивающего агента; смазки; повидона или натрий крахмал гликолята или их смеси; иc) уплотнение гранулятов стадии (b) с гранулированной смесью стадии (а) иd) прессование таблетки. Еще одним аспектом данного изобретения является способ облегчения запора посредством повышения содержания воды в стуле или обеспечением смазывающего действия на стул у млекопитающего, нуждающегося в нем, который включает введение указанному млекопитающему эффективного количества метилцеллюлозы высокой вязкости, спрессованной в таблетку с подходящим разбавителем. Способы получения Приведенные далее примеры иллюстрируют изобретение, но не подразумевают ограничения его области. Все части и проценты являются массовыми, если не указано другой размерности. Время дезинтеграции рецептур, описанных в таблицах ниже, получены при использовании стандартного аппарата для дезинтеграции. Пример 1. Таблица I Способ получения быстро дезинтегрирующей таблетки метилцеллюлозы осуществляют с использованием определенных количеств ингредиентов, таких как количества, указанные в табл. I выше, используя следующие стадии: 1. Приготовление Раствора PovidoneK29/32 (PVP). Определенное количество PVP взвешивают, добавляют ко взвешенному количеству воды и перемешивают до полного растворения всего PVP. 2. Приготовление Фазы А. Точно взвешенные количества MethocelA4M, двухосновного фосфата кальция, дигидрата, натрий лаурилсульфата и окрашивающей добавки, такой как любой подходящий краситель марки FDC Aluminium lake, переносят в гранулятор Key Hi-shear с высоким усилием сдвига и перемешивают в течение приблизительно 10 мин со скоростью мешалки 135 об./мин и скоростью чоппера при 10%. РастворPVP вносят распылением в смесь в грануляторе со скоростью приблизительно 200 мл/мин. При завершении добавления раствора PVP чоппер останавливают. Смешение в грануляторе про 004803 10 должают до тех пор, пока сопротивление не будет показывать приблизительно 130-135 ватт и время достижения этой мощности в ваттах фиксируют. Отбирают образец из мокрого гранулирования для записи потери массы при сушке(loss on drying - LOD). Влажные гранулы сушат порциями в сушилке с псевдоожиженным слоем(Aeromatic Fluid bed dryer) до тех пор, пока потери массы при сушке не показывают приблизительно 1,0-3,0%. Температуру воздуха в сушилке с псевдоожиженным слоем поддерживают на уровне приблизительно 90-95 С, и образец, как было установлено, сушится при температуре воздуха на выходе приблизительно 32-52 С. Высушенные гранулы пропускают через сито 12 в мельнице Fitz Mill при высокой скорости. Гранулы взвешивают и вычисляют выход в процентном выражении. Измеряют содержание влаги для сухих гранул. Отбирают образец гранул и анализируют его для определения гранулометрического состава, объемного веса и tap плотности, показателя текучести (flow index) и влажности. Гранулы взвешивают и ингредиенты Фазы В вычисляют, исходя из массы остальных гранул. 3. Приготовление конечной смеси. Ко взвешенным измельченным гранулам,полученным в Фазе А, как описано выше, в Vобразном смесителе добавляют определенные количества натрий лаурилсульфата, натрий крахмал гликолята (Ехplotab) и двухосновного фосфата кальция дигидрата и смесь перемешивают в течение приблизительно 10 мин. Затем к смеси добавляют стеарат магния и перемешивание продолжают еще 3 мин или более. Образцы смеси отбирают из различных частей Vобразного смесителя и анализируют для определения однородности смеси. Образец из конечной смеси анализируют для определения гранулометрического состава, насыпного веса и tap плотности, показателя текучести и влажности. Затем гранулы взвешивают. 4. Прессование таблеток метилцеллюлозы. Конечную смесь загружают в бункер одиночного штамповочного пресса для штамповки таблеток (Stokes songle punch 'F' tablet press) и прессуют в формы при использовании подходящего инструмента. Целевая твердость заключается в интервале от 10 до 25, предпочтительно 8-12SCU, предпочтительная целевая масса каждой таблетки менее чем 750 мг, установленная хрупкость менее чем 2,0%, более предпочтительно менее чем 1,0%, целевое время дезинтеграции менее 30 мин в воде и кислоте (более короткое время дезинтеграции - менее чем 10 мин, более предпочтительно - менее чем 8 мин в 0,1 N НСl и менее чем 15 мин в воде, более предпочтительно приблизительно 8 мин - является предпочтительным). Таблетки расфасовывают в Ziplock пакеты (bags). Таблетки испытывают на отклонение от массы, твердость, дезинтеграцию в 11 кислоте и воде, хрупкость, влажность (% LOD) ,плотность, вязкость и однородность содержания. Рецептура, приведенная в табл. I, показывает время дезинтеграции менее чем 5 мин в 0,1N НСl и менее чем 9 мин в воде при использовании стандартного метода Фармакопеи США(USP) с применением Аппарата дезинтеграции с дисками (Disintegration Apparatus with disks). Время дезинтеграции для рецептуры, приведенной в табл. I примера 1, составляет менее чем 5 мин в 0,1 N НСl и менее чем 9 мин в воде. Примеры со 2 по 6 и с 11 по 15 представляют рецептуры на основе Avicel, а примеры с 7 по 10 представляют рецептуры на основе крахмала, которые не содержат наполнителей съедобных солей кальция. Они получены только с целью иллюстрации и могут быть получены с включением съедобных солей кальция, при необходимости, при использовании методов данного изобретения и рабочих примеров 1 и 16-23. Пример 2. Рецептура, содержащая Avicel PH 101 иExplotab в составе гранул и вне гранул, как представлено в табл. II ниже, показывает среднее время дезинтеграции менее чем 1 мин в 0,1N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица IIExplotab в составе и вне гранул, как представлено ниже в табл. III, показывает среднее время дезинтеграции менее чем 3 мин в 0,1 N НС 1 при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица IIIExplotab в составе и вне гранул, как представлено в табл. IV ниже, показывает среднее время дезинтеграции менее чем 2 мин в 0,1 N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица IV В альтернативном воплощении примера 4 вариант Рецептуры, представленной в табл. IV,с покрытием испытывают для определения времени дезинтеграции. Используемый раствор покрытия представляет 20% (мас./мас.) растворOpadry II, Orange в воде. Среднее время дезинтеграции таблеток, покрытых оболочкой, составляет менее одной минуты в 0,1 N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Пример 5. Рецептура, содержащая Avicel PH 101 в составе гранул, Avicel PH 102 вне гранул иExplotab в составе и вне гранул, как представлено в табл. V, показывает среднее время дезинтеграции менее чем одна минута в 0,1 N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица VVI ниже, показывает среднее время дезинтеграции менее чем 3 мин в 0,1 N НСl и менее чем 2 мин при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Время дезинтеграции при использовании стандартного аппарата составляет приблизительно 1 мин в кислоте и менее чем 2 мин в воде. Таблица VI Пример 9. Рецептура, содержащая кукурузный крахмал в составе гранул, вне гранул Starch 1500, а также как в составе, так и вне гранул Explotab,как представлено в табл. IX, показывает среднее время дезинтеграции менее 13 мин в 0,1 N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица IX Пример 7. Рецептура, содержащая кукурузный крахмал в составе гранул, Starch 1500 вне гранул и не содержащая Explotab, как представлено в табл. VII, показывает среднее время дезинтеграции менее 16 мин в 0,1 N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица VII Пример 10. Рецептура, содержащая кукурузный крахмал в составе гранул, Starch 1500 вне гранул и в составе гранул, а также вне гранул Explotab (в больших количествах, чем показано выше в примере 9, табл. IX), как представлено в табл. X,показывает среднее время дезинтеграции менее 11 мин в 0,1 N НСl и менее чем 18 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица X Пример 8. Рецептура, содержащая кукурузный крахмал в составе гранул, вне гранул Starch 1500 и в составе гранул Explotab, как представлено в табл. VIII, показывает среднее время дезинтеграции менее чем 14 мин в 0,1 N НСl при 370,5 С при использовании автоматизированного аппарата дезинтеграции.PH101 в гранулах и различные уровни содержания вне гранул Avicel PH102 ( как показано в примерах 6, 7 и 8 выше), получают для определения их влияния на время дезинтеграции таблеток. Рецептура, представленная в табл. XI ниже, показывает среднее время дезинтеграции менее одной минуты в 0,1 N НСl и менее чем 2 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 1 мин как в кислоте, так и в воде. Таблица XI Пример 14. Приготавливают две рецептуры, содержащие Avicel PH 101 в составе гранул с различными уровнями содержания Avicel PH 200 вне гранул (представлены в табл. XIV и XV ниже) для определения влияния на время дезинтеграции таблеток. Рецептура, представленная в табл. XIV,показывает среднее время дезинтеграции менее чем 7 мин в 0,1 N НСl и менее чем 9 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 8 мин в кислоте и менее чем 13 мин в воде. Таблица XIV Пример 12. Рецептура, представленная в табл. XII, показывает среднее время дезинтеграции менее 5 мин в 0,1 N НСl и менее чем 7 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 5 мин в кислоте и менее чем 8 мин в воде. Таблица XII Пример 15. Рецептура, представленная в табл. XV, показывает среднее время дезинтеграции менее чем 4 мин в 0,1 N НСl и менее чем 7 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 5 мин в кислоте и менее чем 9 мин в воде. Таблица XV Пример 13. Рецептура, представленная в табл. XIII,показывает среднее время дезинтеграции менее чем 10 мин в 0,1 N НСl и менее чем 14 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 14 мин в кислоте и менее чем 22 мин в воде. 17 Пример 16. Рецептура, содержащая источник кальция из наполнителя в составе и вне гранул, двухосновного фосфата кальция, дигидрата, и вне гранул Explotab, представлена в табл. XVI. Рецептура, представленная в табл. XVI,показывает среднее время дезинтеграции менее чем 6 мин в 0,1 N НСl и менее чем 9 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 5 мин в кислоте и менее чем 12 мин в воде. Таблица XVI Пример 17. Рецептура, содержащая источник кальция из наполнителя в составе и вне гранул, двухосновного фосфата кальция, дигидрата, с более высоким количеством Explotab в составе гранул, чем в примере 17, представлена ниже в табл. XVII. Рецептура, представленная в табл. XVII,показывает среднее время дезинтеграции менее чем 9 мин в 0,1 N НСl и менее чем 14 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Стандартный аппарат дезинтеграции дает менее чем 6 мин в кислоте и менее чем 12 мин в воде. Таблица XVII Пример 18. Рецептуры, содержащие источник кальция из наполнителя в составе и вне гранул, двухосновного фосфата кальция, дигидрата, с различным содержанием Explotab вне гранул в соче 004803XVIII и XIX (пример 19). Рецептура, представленная в табл. XVIII,показывает среднее время дезинтеграции менее чем 6 мин в 0,1 N НСl и менее чем 11 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица XVIII Пример 19. Рецептура, представленная в табл. XIX,показывает среднее время дезинтеграции менее чем 9 мин в 0,1 N НСl и менее чем 14 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. Таблица XIX Пример 20. Рецептуры, содержащие источник кальция из наполнителя в составе и вне гранул, двухосновного фосфата кальция, дигидрата, иExplotab вне гранул, представлены в табл. XX и XXI (Пример 21 ниже). Рецептура, представленная в табл. XX, показывает среднее время дезинтеграции менее чем 5 мин в 0,1 N НСl и менее чем 13 мин в воде при 370,5 С при использовании автоматизированного аппарата дезинтеграции. 20 Пример 23. Рецептура, содержащая источник кальция из носителя в составе и вне гранул, трехосновного фосфата кальция WG, и Explotab вне гранул, представлена в табл. XXIII. Рецептура, представленная в табл. XXIII,показывает среднее время дезинтеграции менее чем 13 мин в 0,1 N НСl и менее чем 24 мин в воде при 370,5 С при использовании стандартного аппарата дезинтеграции. Таблица XXIII Пример 21. Рецептура, представленная в табл. XXI,показывает среднее время дезинтеграции менее 7 мин в 0,1 N НСl и менее чем 9 мин в воде при 370,5 С при использовании стандартного способа дезинтеграции. Таблица XXI Пример 22. Рецептура, содержащая источник кальция из наполнителя в составе и вне гранул, безводного фосфата кальция, и вне гранул Explotab,представлена в табл. XXII. Рецептура, представленная в табл. XXII,показывает среднее время дезинтеграции менее чем 11 мин в 0,1 N НСl и менее чем 19 мин в воде при 370,5C при использовании стандартного аппарата дезинтеграции. Таблица XXII Все публикации, включая, но без ограничения, патенты и заявки на патенты, указанные в данном описании, введены в виде ссылок, как если бы каждая отдельная публикация была конкретно и индивидуально указана, для введения в виде ссылки во всей полноте. Приведенное выше описание полностью раскрывает изобретение, включая его предпочтительные воплощения. Модификации или усовершенствования воплощений, конкретно описанные здесь, входят в объем прилагаемой далее формулы изобретения. Полагаем, что квалифицированный специалист в данной области может, используя предшествующее описание без дополнительной разработки, максимально использовать данное изобретение. Таким образом,описанные примеры приведены только как иллюстрация изобретения, а не для ограничения области изобретения каким бы то ни было образом. Воплощения изобретения, в которых заявлены особенности или преимущества, определены следующим образом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Быстро дезинтегрирующая таблетка для перорального введения, которая содержит уплотненную смесь метилцеллюлозы, имеющей вязкость 1000 сантипуаз, и съедобной соли кальция, выбранной из дигидрата двухосновного фосфата кальция, безводного фосфата кальция и трехосновного фосфата кальция, или их смесей, а также связующее вещество и смачивающий агент. 2. Таблетка по п.1, в которой связующее вещество выбирают из поливинилпирролидона,гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, аравийской камеди, желатина, 21 трагаканта, предварительно желатинированного крахмала или крахмала. 3. Таблетка по п.2, в которой связующим веществом является поливинилпирролидон. 4. Таблетка по любому из пп.1-3, которая дополнительно включает дезинтегрирующий агент, выбранный из натрий крахмал гликолята,карбоксиметилцеллюлозы, натрий кросскармелозы, карбоксиметилцеллюлозы, силиката магния-алюминия, альгината, агара, гуара, трагаканта, сердцевины плодов рожкового дерева,смолы карайи, пектина или кросповидона. 5. Таблетка по п.4, в которой дезинтегрирующий агент представляет натрий крахмал гликолят. 6. Таблетка по п.5, в которой натрий крахмал гликолят присутствует в количестве от приблизительно 3 до приблизительно 8%(мас./мас.). 7. Таблетка по п.1, в которой смачивающим агентом является натрий лаурилсульфат. 8. Таблетка по любому из пп.1-7, которая дополнительно включает смазку. 9. Таблетка по п.8, в которой смазкой является стеарат магния, стеарат кальция, стеарат натрия, коллоидная двуокись кремния, порошкообразный силикагель, стеариновая кислота или тальк. 10. Таблетка по п.9, в которой смазкой является стеарат магния. 11. Таблетка по любому из пп.1-10, в которой метилцеллюлоза имеет вязкость 2000 сантипуаз. 12. Таблетка по п.11, в которой метилцеллюлоза имеет вязкость 3000 сантипуаз. 13. Таблетка по п.12, в которой метилцеллюлоза имеет вязкость 4 000 сантипуаз. 14. Таблетка по любому из пп.1-13, в которой съедобная соль кальция присутствует в количестве, дающем соотношение метилцеллюлозы и кальция в интервале от приблизительно 2 до приблизительно 4:1. 15. Таблетка по любому из пп.1-12, которая, кроме того, содержит дополнительные наполнители и разбавители, выбранные из следующих сочетаний: натрий лаурилсульфат : натрий крахмал гликолят : трехосновный фосфат кальция : повидон 29K/32 : стеарат магния в соотношении 0,40:3,5:21,6:6,4:1,0; и натрий лаурилсульфат : натрий крахмал гликолят : безводный фосфат кальция : повидон 29K/32 : стеарат магния в соотношении: 0,40:3,5:21,6:6,4:1,0. 16. Таблетка по любому из пп.1-15, в которой метилцеллюлоза присутствует в количестве от приблизительно 450 до приблизительно 550 мг. 17. Таблетка по п.16, в которой метилцеллюлоза присутствует в количестве от приблизительно 200 до приблизительно 300 мг. 22 18. Быстро дезинтегрирующая таблетка для перорального введения по п.12, которая содержит метилцеллюлозу, имеющую вязкость 3000 сантипуаз; двухосновный фосфат кальция, натрий лаурилсульфат, повидон, натрий крахмал гликолят и стеарат магния. 19. Быстро дезинтегрирующая таблетка для перорального введения, которая включает уплотненную смесь метилцеллюлозы, имеющей вязкость 1000 сантипуаз, и съедобной соли кальция, выбранной из дигидрата двухосновного фосфата кальция, безводного фосфата кальция, трехосновного фосфата кальция или их смеси, где отношение метилцеллюлозы к соли кальция составляет от приблизительно 2:1 до приблизительно 4:1, а также связующее вещество и смачивающий агент. 20. Таблетка по п.19, в которой отношение метилцеллюлозы к соли кальция составляет от приблизительно 2,6:1 до приблизительно 3,1:1. 21. Таблетка по п.19, в которой связующее вещество выбирают из поливинилпирролидона,гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, аравийской камеди, желатина,трагаканта, предварительно желатинированного крахмала или крахмала. 22. Таблетка по п.21, в которой связующим веществом является поливинилпирролидон. 23. Таблетка по п.22, в которой поливинилпирролидон присутствует в количестве от около 4 до около 6,5% (мас./мас.). 24. Таблетка по п.19, которая дополнительно включает дезинтегрирующий агент. 25. Таблетка по п.24, в которой дезинтегрирующий агент выбирают из натрий крахмал гликолята, натрий карбоксиметилцеллюлозы,натрий кросскармелозы, карбоксиметилцеллюлозы, силиката магния-алюминия, альгината,агара, гуара, трагаканта, сердцевины плодов рожкового дерева, смолы карайи, пектина или кросповидона. 26. Таблетка по п.25, в которой дезинтегрирующий агент представляет натрий крахмал гликолят. 27. Таблетка по п.26, в которой натрий крахмал гликолят присутствует в количестве от приблизительно 3 до приблизительно 8%(мас./мас.). 28. Таблетка по п.19, в которой смачивающим агентом является натрий лаурилсульфат. 29. Таблетка по п.19, которая дополнительно включает смазку. 30. Таблетка по п.29, в которой смазкой является стеарат магния. 31. Таблетка по п.19, в которой метилцеллюлоза имеет вязкость 2000 сантипуаз. 32. Таблетка по п.31, в которой метилцеллюлоза имеет вязкость 3000 сантипуаз. 33. Таблетка по п.32, в которой метилцеллюлоза имеет вязкость 4000 сантипуаз. 34. Способ получения препарата в форме таблетки по любому из пп.1-18 или 19-33, который включает:a) смешение вместе метилцеллюлозы высокой вязкости (3000 сП), части смачивающего агента, части повидона или натрий крахмал гликолята и части съедобной соли кальция, где съедобную соль кальция выбирают из дигидрата двухосновного фосфата кальция, безводного фосфата кальция и трехосновного фосфата кальция или их смесей, с образованием интрагранулярной смеси;b) добавление к смеси со стадии (а) водного раствора поливинилпирролидона или, альтернативно, опрыскивание смеси со стадии (а) водным раствором поливинилпирролидона и получение гранулята;c) смешение вместе оставшейся части съедобной соли кальция, оставшейся части смачивающего агента; смазки и оставшейся части повидона или натрий крахмал гликолята или их смеси с получением экстрагранулярной смеси; иd) спрессовывание гранулятов со стадии(b) с экстрагранулярной смесью со стадии (с). 35. Способ по п.34, где съедобная соль кальция представляет собой дигидрат двухосновного фосфата кальция. 36. Способ получения фармацевтической таблетки по любому из пп.1-18 или 19-33, который включает:a) смешение гранулятов, включающих метилцеллюлозу высокой вязкости ( 3000 спз),часть смачивающего агента, часть повидона или натрий крахмал гликолята, и часть съедобной соли кальция;b) смешение, с получением экстрагранулярной смеси, оставшейся части съедобной соли кальция, оставшейся части смачивающего агента; смазки; оставшейся части повидона или натрий крахмал гликолята или их смеси; иc) спрессовывание гранулятов со стадии(b) с гранулированной смесью со стадии (а); иd) прессование таблетки. 37. Способ получения гранулята, используемого для изготовления фармацевтической 24 таблетки по любому из пп.1-18 или 19-33, который включает:a) смешение метилцеллюлозы высокой вязкости (3000 сП), смачивающего агента и съедобной соли кальция, где съедобную соль кальция выбирают из дигидрата двухосновного фосфата кальция, безводного фосфата кальция и трехосновного фосфата кальция, или их смесей иb) добавление к смеси со стадии (а) водного раствора поливинилпирролидона или опрыскивание смеси стадии (а) водным раствором поливинилпирролидона; и получение гранулята. 38. Способ по п.37, в котором гранулят смешивают со вторым смачивающим агентом,смазывающим агентом и дезинтегрирующим агентом и спрессовывают с образованием таблетки. 39. Способ по п.38, в котором дезинтегрирующий агент выбирают из натрий крахмал гликолята, натрий карбоксиметилцеллюлозы,натрий кросскармелозы, карбоксиметилцеллюлозы, силиката магния-алюминия, альгината,агара, гуара, трагаканта, сердцевины плодов рожкового дерева, смолы карайи, пектина или кросповидона. 40. Способ по п.39, в котором смачивающим агентом является натрий лаурилсульфат. 41. Способ по п.38, в котором вторым смачивающим агентом является натрий лаурилсульфат. 42. Способ по п.34, в котором гранулят дополнительно содержит разбавитель. 43. Способ по п.42, в котором разбавителем является микрокристаллическая целлюлоза,кукурузный крахмал или крахмал 1500. 44. Способ по п.34, в котором гранулят дополнительно содержит дезинтегрирующий агент. 45. Способ по п.44, в котором дезинтегрирующий агент представляет собой натрий крахмал гликолят.
МПК / Метки
Метки: способы, метилцеллюлозы, дезинтегрирующая, быстро, получения, таблетка
Код ссылки
<a href="https://eas.patents.su/13-4803-bystro-dezintegriruyushhaya-tabletka-metilcellyulozy-i-sposoby-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Быстро дезинтегрирующая таблетка метилцеллюлозы и способы ее получения</a>
Предыдущий патент: Модифицированные вич-пептиды на основе белка gag p24, антигены, вакцинные композиции, набор для иммуноанализа и способ определения вич-индуцированных антител
Следующий патент: Применение доцетаксела для лечения печеночно-клеточного рака
Случайный патент: Радиолокационная установка и способ измерения для определения ориентации и глубины объекта, находящегося под землей