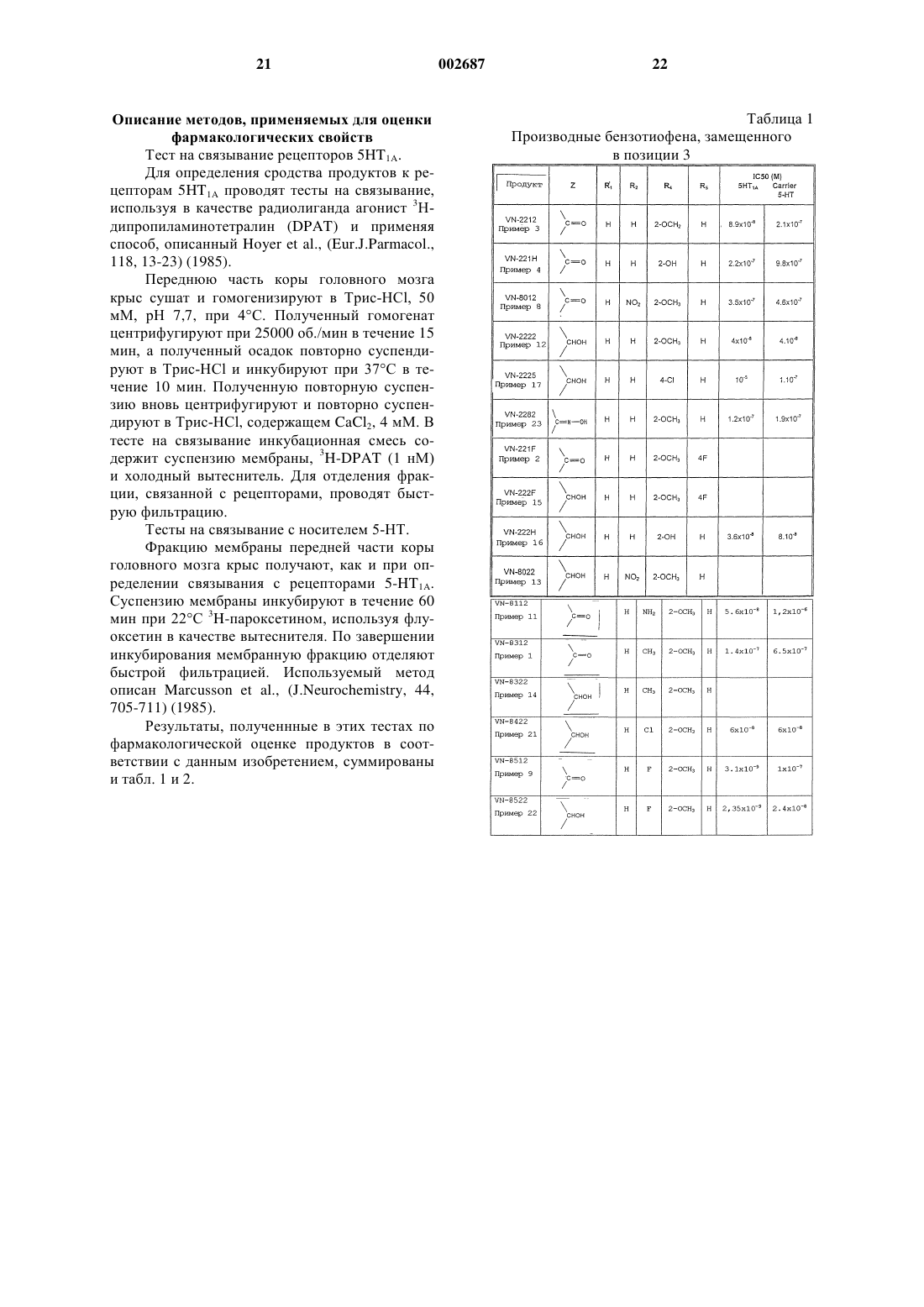
Производные бензотиофена, их применение и композиции
Номер патента: 2687
Опубликовано: 29.08.2002
Авторы: Рока Асин Хуан, Монге Вега Антонио, Дель Рио Самбрана Хоакин, Бош Ровира Анна, Ласерас Альдас Берта, Дель Кастильо Ньето Хуан Карлос, Палоп Кубильо Хуан Антонио
Формула / Реферат
1. Соединения производных бензотиофена общей формулы (I)
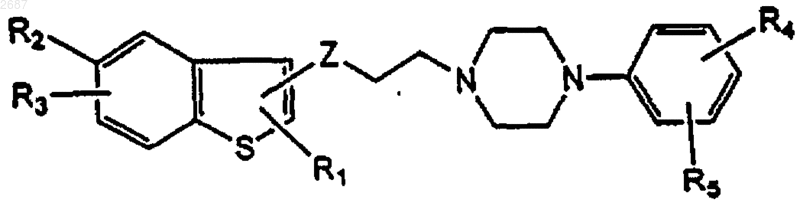
где Z представляет -СО-, -СН(ОR6)-, -C(NOR7)-;
R1 представляет Н, C1-С6 алкил, галоген или -OR8;
R2 и R3 независимо представляют Н, C1-С6 алкил, галоген, -OR8, нитро, циано, -NR9R10, -COR8, -CO2R8, -SO2NR9R10, -SO2R8, -SR8, -CONR9R10;
R4 и R5, одинаковые или различные, каждый представляет Н, C1-С6 алкил, галоген, галоалкил, -OR8, нитро, -NR9R10, -COR8, -CO2R8, -SO2NR9R10, -SO2R8, -SR8, циано, -CONR9R10 или R4 и R5 вместе могут образовывать бензольное кольцо, конденсированное с фенильным кольцом;
R6 представляет Н, C1-С6 алкил, CO2R8, -C(O)NR9R10, нафтил или фенил, необязательно замещенный одним или более заместителями, выбранными из группы Н, галоалкил, алкил, галоген, C1-С6 алкокси, метилендиокси, нитро, циано;
R7 представляет Н или C1-С6 алкил;
R8 представляет Н, C1-С6 алкил или фенил;
R9 и R10 независимо представляют Н, C1-С6 алкил или фенил или R9 и R10 вместе с N, к которому они присоединены, образуют 5- или 6-членное кольцо, в котором необязательно может присутствовать N, О или S,
или их соль или сольваты, или геометрические изомеры или оптические изомеры, или полиморфы.
2. Соединения по п.1, где Z представляет -СО-:
1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он гидрохлорид,
1-(3,5-диметилбензо[b]тиофен-2-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он гидрохлорид,
1-(5-фторбензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он,
1-(5-хлорбензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он гидрохлорид.
3. Соединения по п.1, где Z представляет -СН(ОR6)-:
1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-ол,
1-(бензо[b]тиофен-3-ил)-3-[4-(2-гидроксифенил)пиперазин-1-ил]пропан-1-ол,
1-(3,5-диметилбензо[b]тиофен-2-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-ол,
1-(3-метилбензо[b]тиофен-2-ил)-3-[4-(2-гидроксифенил)пиперазин-1-ил]пропан-1-ол,
1-(5-хлорбензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-ол,
1-(5-фторбензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-ол.
4. Соединения по п.1, где Z представляет -C(NOR7)-:
1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он оксим.
5. Применение соединения по любому из пп.1-4 для получения фармацевтической композиции для лечения неврологических нарушений.
6. Применение по п.5 для получения фармацевтической композиции для лечения тревоги и/или депрессии.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 в терапевтически активном количестве для лечения тревоги и/или депрессии и достаточное количество носителя.
Текст
1 Область изобретения Настоящее изобретение относится к синтезу новых производных бензотиофена, их солей,оптических изомеров и полиморфов, имеющих общую формулу (I) а также к соответствующим фармацевтическим композициям и их применению при получении этих фармацевтических композиций для лечения неврологических нарушений, в частности для лечения тревоги и/или депрессии, в качестве антидепрессантов, имеющих двойную активность: ингибирование повторного поглощения серотонина и сродство к рецептору 5-HT1A. Предпосылки изобретения Лекарственные препараты для лечения депрессии известны на протяжении более 30 лет. Как первый ингибитор моноаминооксидазы (ингибитор МАО), ипрониазид, так и первый трициклический антидепрессант (Т.АСА), имипрамин, появились на рынке в конце 50-х годов. Второе поколение антидепрессантов значительно лучше по сравнению с традиционными трициклическими антидепрессантами или необратимыми неспецифическими ингибиторами моноаминооксидазы. Несмотря на это, они всетаки оказывают побочные действия, и, что более важно, латентный период до возникновения терапевтического действия все еще слишком велик для того, чтобы лечение считалось оптимальным. Последний класс имеющихся на рынке антидепрессантов был классом, включающим селективные ингибиторы повторного поглощения серотонина, представителями которых являются флуоксетин (Lilly, ES 433720), пароксетин (Ferrosan, ES422734) или сертралин (Pfizer,ES49443). Продукты этого класса имеют высокую степень структурного разнообразия по сравнению с другими типами ингибиторов повторного поглощения серотонина, например с трициклическими антидепрессантами. Несмотря на свое структурное разнообразие, эти соединения высокоселективны по отношению к рецептору серотонина. Фактически их связывание с- и -адренергическими, допаминергическими,гистаминовыми и мускариновыми рецепторами несущественно. Предполагается, что это может происходить благодаря большой структурной схожести с факмакофором, отвечающим на их специфичность, и относительному сродству к соответствующему рецептору серотонина. Одним из наиболее часто встречающихся видов побочного действия ингибиторов повторного поглощения серотонина являются желудочно-кишечные расстройства. Большая часть 2 из них также вызывает ингибирование метаболизма в печени других лекарственных препаратов в результате соответствующего фармакодинамического взаимодействия и оказывает запоздалое начало их антидепрессивного действия. Ввиду вышеизложенного возникает необходимость продолжать исследования в целью создания третьего поколения антидепрессантов. Четырьмя условиями, которым должен отвечать антидепрессант третьего поколения,являются: 1. Более быстрое действие. 2. Более широкая эффективность. 3. Меньшее побочное действие. 4. Большая безопасность в случае передозировки. Первый из четырех пунктов представляет наибольшую трудность в исследовании антидепрессантов из-за очевидного вредного действия,оказываемого на больного депрессией, заключающегося в том, что лекарственный препарат начинает проявлять свое действие через несколько недель после начала лечения. Видимо, причиной медленного улучшения недомогания после лечения ингибиторами повторного поглощения моноамина является процесс десенсибилизации пресинаптических рецепторов 5-НТ 1A, означающий снижение серотонинергического тонуса до наступления этой десенсибилизации. Из вышесказанного можно сделать вывод,что антидепрессивное лечение, которое дополнительно к ингибированию повторного поглощения серотонина должно включать блокирование или быструю десенсибилизацию соматодентритических ауторецепторов 5-HT1A, увеличивает антидепрессивную эффективность, обеспечивая быстрый подъем концентрации серотонина в серотонинергических окончаниях. В этом смысле было предложено одновременное введение ингибиторов повторного поглощения серотонина с селективными антагонистами рецептора 5-HT1A, таким и как пиндолол (Artigas F. etP. et al., J.Clin.Pharmfcol., 15, 217-222 (1995 для облегчения как можно более быстрого наступления антидепрессивного действия. Эта теория натолкнула исследователей на идею о том, что добавление продуктов, блокирующих ауторецепторы типа 5-HT1A, может предупредить начало этой негативной системы обратной связи и усилить действие ингибиторов повторного поглощения серотонина. Один из патентов Lilly (EP 0687472) описывает усиление действия ингибиторов повторного поглощения серотонина путем увеличения доступности определенных нейротрансмиттеров головного мозга (включая серотонин) путем соединения ингибиторов повторного поглощения серотонина с селективными антагонистами рецептора 5-HT1A. 3 Следовательно, ввиду вышеизложенного,целью данного изобретения является синтез соединений, обладающих такой двойной активностью, т.е. ингибиторов повторного поглощения серотонина с сродством к рецептору 5-HT1A. В частности, данное изобретение относится к синтезу и фармакологической активности новых производных бензотиофена общей формулы 5-HT1A. Продукты, в некоторой степени схожие с описываемыми продуктами, раскрыты в литературе. Так, например, патент США 2979507 описывает продукты, имеющие общую формулу где R среди прочих может представлять собой Н или 2-ОСН 3. Документ ЕР 0596120 описывает продукты общей формулы где X, как правило, означает -S или S(O)-, но,среди прочего, может означать -С(О)-,-CH(OR)-, -C(N-OR)-, -CH(NH2)-; А может означать алкиленовую группу, и Т, как правило, означает 1,2-бензоизоксазольное или 1,2-бензотиазольное кольцо, но, однако,может означать любое другое ароматическое кольцо. Тем не менее, вышеуказанный документ не упоминает о том, что R1 и R2 вместе образуют кольцо, в результате чего описываемые продукты не включают бензотиофены. Документ GB 1096341 описывает продукт общей формулы где R может означать -CH2-CH2-C(О)-Аr, и Аr может означать, среди прочего, тиофеновое кольцо, хотя и не бензотиофеновое кольцо. Точнее, в вышеуказанном патенте описаны продукты где R1 представляет 2-F или 4-F, или 4 Сl. Патент США 3002976 описывает соединения общей формулы где R представляет Н, метил или галоген. Документы WO 9616052 и WO 9615792 описывают продукты общей формулы где Z представляет N или СН, и Аr1 может означать бензотиофеновое кольцо. В этих соединениях ароматическое кольцо (Аr2) непосредственно не связано с пиперазиновым кольцом, а через спейсер (связывающую группу) Х (СН 2,СО и т.д.), в отличие от соединений данного изобретения. Документ DE 2360545 описывает пиперазины, включающие соединение бензотиофен, который подобно вышеуказанным соединениям не имеет ароматического кольца,непосредственно связанного с пиперазином. Описание изобретения Как указано выше, объектом данного изобретения являются новые производные бензотиофена общей формулы (I), соответствующие композиции, и их применение для получения композиций, имеющих фармакологическую активность.R5 вместе могут образовывать бензольное кольцо, конденсированное с фенильным кольцом;R6 представляет Н, C1-С 6 алкил, CO2R8,-C(O)NR9R10, нафтил или фенил, необязательно замещенный одним или более заместителями,выбранными из группы Н, галоалкил, C1 С 6 алкил, галоген, C1-C6 алкокси, метилендиокси,нитро, циано;R8 представляет Н, низкомолекулярный алкил или фенил;R9 и R10 независимо представляет Н, низкомолекулярный алкил или фенил, или R9 и R10 вместе с N, к которому они присоединены, образуют 5- или 6-членное кольцо, в котором необязательно может присутствовать N, О или S. 5 Данное изобретение также включает физиологически приемлемые соли, сольваты и соли сольватов соединений формулы (I), которые,среди прочих, включают кислотно-аддитивные соли, образованные с неорганическими и органическими кислотами, например гидрохлориды,гидробромиды, сульфаты, нитраты, фосфаты,формиаты, мезилаты, цитраты, бензоаты, фумараты, малеаты, лактаты и сукцинаты. Когда соль соединения формулы (I) образуется с дикарбоновой кислотой, такой как янтарная кислота,соль может содержать 1-2 молей соединения формулы (I) на моль кислоты. Предпочтительными солями являются гидрохлориды. Предпочтительными сольватами являются гидраты. Соединения формулы (I) также дополнительно включают геометрические изомеры цис/транс (Z и Е), когда группа Z означаетZ означает -C(NOR7)-, и оптические изомеры (R и S), когда Z означает -СН(ОR6)-, и также их энантиомерные смеси. Предпочтительными соединениями в соответствии с данным изобретением, являются соединения формулы (I), гдеR5 представляет Н, гидрокси или низший алкокси;R8, R9, R10 независимо представляет Н или алкил. Соединения настоящего изобретения полезны для лечения расстройств, связанных с повторным поглощением серотонина, и других расстройств, связанных с пост- или пресинаптической передачей серотонина, и, в частности, для лечения депрессии. Лечение может быть профилактическим или лечебным и осуществляется путем введения любым известным способом соединения формулы (I) либо его физиологически приемлемой соли или сольвата. Более конкретно, настоящее изобретение относится к производным бензотиофена, имеющим следующие химические названия: 1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-ол,1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он,1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он оксим,1-(бензо[b]тиофен-3-ил)-3-[4-(2-гидроксифенил)пиперазин-1-ил]пропан-1-ол, 002687 1-(3,5-диметилбензо[b]тиофен-2-ил)-3-[4(2-метоксифенил)пиперазин-1-ил]пропан-1-ол,1-(3,5-диметилбензо[b]тиофен-2-ил)-3-[4(2-метоксифенил)пиперазин-1-ил]пропан-1-он,1-(3-метилбензо[b]тиофен-2-ил)-3-[4-(2 гидроксифенил)пиперазин-1-ил]пропан-1-ол,1-(5-фторбензо[b]тиофен-3-ил)-3-[4-(2 метоксифенил)пиперазин-1-ил]пропан-1-он,1-(5-хлорбензо[b]тиофен-3-ил)-3-[4-(2 метоксифенил)пиперазин-1-ил]пропан-1-он,1-(5-хлорбензо[b]тиофен-3-ил)-3-[4-(2 метоксифенил)пиперазин-1-ил]пропан-1-ол,1-(5-фторбензо[b]тиофен-3-ил)-3-[4-(2 метоксифенил)пиперазин-1-ил]пропан-1-ол. В соответствии с этим, данное изобретение также обеспечивает приемлемую фармацевтическую композицию для применения в медицине, содержащую: (а) фармацевтически эффективное количество соединения формулы (I) и/или его соли или сольвата, и (b) фармацевтически приемлемый носитель для перорального,подъязычного, парентерального, замедленного или интраназального введения, либо введения в виде, сответствующем для введения путем ингаляции, либо инсуффляции. Данное изобретение также относится к применению производного бензотиофена формулы (I) для получения лекарственного препарата, имеющего терапевтическое применение в качестве антидепрессанта. Фармацевтические композиции для перорального введения могут быть твердыми, как,например, таблетки или капсулы, полученные традиционными средствами с фармацевтически приемлемыми носителями, либо жидкими, как,например, водяные или масляные растворы,сиропы, эликсиры, эмульсии или суспензии,полученные традиционными средствами с фармацевтически приемлемыми добавками. Соединения фомулы (I) и их физиологически приемлемые соли или сольваты могут быть получены путем адаптации общих способов,представленных ниже. Описание процедур синтеза Получение кетонов формулы (Iа). Производные кетонов формулы (Ia) (Z представляет С=O) получают, применяя Способ А. Реакция Манниха соответствующего ацилбензо[b]тиофена с соответствующим пиперазином согласно следующей схеме: 8 Получение оксимов (Iс). Оксимы (Ic) (Z представляет C=N-OH) получают из кетонов (Iа), применяя известные способы, описанные в литературе, при этом предпочтительным способом является обработка кетонов (Iа) гидрохлоридом гидроксиламина в EtOH при флегме. где R1, R2, R3, R4 и R5 имеют значения, указанные выше. Способ В. Альтернативный способ получения кетонов формулы (Iа) состоит из взаимодействия соответствующего 1-арил-3-гало-1-пропанона с соответствующим пиперазином, согласно следующей схеме: где Hal означает галоген. Способ С. Третий способ получения кетонов формулы (Iа) состоит из превращения посредством способов, описанных в литературе, заместителя в соединении формулы (Iа) в другой заместитель, получая, таким образом, другое соединение, структурно отвечающее такому же типу формулы (Ia). Один пример таких превращений состоит из восстановления ароматической группы NO2 способами, описанными в литературе, в аминогруппу. Получение спиртов формулы (Ib). Производные спирта формулы (Ib) (Z представляет СНОН) получают путем восстановления кетонов (Iа) обычными способами,описанными в литературе, согласно следующей реакции: Предпочтительный способ восстановления состоит из применения гидроборида натрия в качестве восстановителя в этиловой или метиловой спиртовой среде при температуре от-20 С до температуры флегмы соответствующего спирта. Восстановление предпочтительно проводят при 0 С. где R1-R5 имеют вышеуказанные значения. Целью нижеследующих примеров является объяснение, а не ограничение данного изобретения. Экспериментальная часть Способы синтеза продуктов формулы (Iа). Способ А. Пример 1. 1-5-(Метилбензо[b]тиофен-3 ил)-3-[4-(2-метоксифенил)пиперазин-1-ил] пропан-1-он дигидрохлорид (VN8312). 1. 3-Ацетил-5-метилбензо[b]тиофен. 1 г 5-метилбензо[b]тиофена (6,7510-3 моль) перемешивают при 55 С с 0,8 мл Ас 2 О(8,1010-3 моль). Добавляют 0,83 мл BF3Et2O и перемешивание продолжают в течение 8 ч 11. Растворитель удаляют в роторном испарителе и остаток экстрагируют AcOEt и H2O. Его декантируют и промывают NaHCO3 и Н 2 О. Его сушат при помощи Na2SO4, растворитель удаляют и продукт очищают в последовательных колонках, содержащих AcOEt/гексан (1:1) и толуол соответственно. Получают продукт, представляющий собой смесь изомеров, замещенных в позициях 2- и 3-бензо[b]тиофенового кольца в пропорции приблизительно 20/80 (определеной отношениями площадей сигналов ЯМР (NMR,который передают на следующую реакцию. Выход: 50%. Смесь имеет следующие спектроскопические характеристики: ИК (см-1): 1668 (mf, С=О) 1 Н ЯМР (CDCl3, 200 МГц) : 2.47 (s, 3H,Аr-СН 3 (изомер 2; 2.50 (s, 3H, Аr-СН 3 (изомер 3; 2.63 (s, 3H, СО-СН 3 (изомер 2 + изомер 3; 7.22-7.27 (m, 1H, Н 6) (изомер 2 + изомер 3); 7.66(3,4210-3 моль) и 860 мг 2-метоксифенилпиперазин гидрохлорида (3,7610-3 моль) растворяют в 15 мл EtOH и НСl до рН=2-3. При температуре образования флегмы смеси к ней добавляют 310 мг параформальдегида (1010-3 моль). После 24 ч перемешивания при температуре образования флегмы реакционную смесь выливают на лед и экстрагируют AcOEt. Ее промывают Н 2O и сушат Na2SO4, растворитель удаляют досуха и очищают на колонке с двуокисью кремния, используя AcOEt/гексан (1:1) в качестве подвижной фазы. Полученное масло растворяют в этиловом эфире (20 мл) и EtOH (4 мл), которое осаждается в виде гидрохлорида после добавления HCl(k). Выход: 10%. Температура плавления = 189-190 С. ИК (см-1): 1666 (mf, C=O); 1240 (mf, Ar-O). 1(M+, 81); 205 (55); 175 (100). Пример 2. 1-(Бензо[b]тиофен-3-ил)-3-[4-(4 фтор-2-метоксифенил)пиперазин-1-ил]пропан 1-он гидрохлорид (VN-221F). 1. 2-Метокси-4-фторанилин гидрохлорид. 3,70 г 3-метокси-4-нитрофторбензола (21,610-3 моль) растворяют в 40 мл МеОН. По каплям добавляют 0,6 г Ni-Raney и 4 мл гидразингидрата, позволяя смеси реагировать при 5055 С в течение двух часов. Ее фильтруют над целитом и удаляют растворитель. Остаток растворяют в 200 мл этилового эфира и добавляют 2-3 мл HCl(k) в 40 мл EtOH, получая тем самым продукт, который собирают фильтрацией. Выход: 65%. Температура плавления: 167-168 С. ИК (см-1); 3380 (m, NH2); 1245 (mf, Ar-O-). 1(M+, 6.8). 2. 1-4-Фтор-2-метоксифенил(пиперазин). 9 мл Хлорбензола и Н 2O дистиллируют из раствора 1,14 г р-TosOH (6,0310-3 моль) в 200 мл хлорбензола. Раствор охлаждают до 20 С, а затем добавляют 1,19 г 4-фтор-2-метоксианилин гидрохлорида (6,710-3 моль) и 1,31 г бис 2(хлорэтил)амин гидрохлорида (7,3610-3 моль). Реакцию выдерживают при температуре 10 образования флегмы в течение 72 ч, после чего удаляют растворитель, а остаток экстрагируют 5 мл NaOH 2N и 30 мл толуола. Органическую фазу промывают H2O, сушат Na2SO4 и удаляют толуол. Продукт очищают на колонке с двуокисью кремния, используя дихлорметан/МеОН(9:1) в качестве подвижной фазы получая масло. Выход: 25%. ИК (см-1); 3380 (m, NH2); 1245 (mf, Ar-O-). 1(1,2510-3 моль) и 263 мг 1-(4-фтор-2 метоксифенил)пиперазина (1,2510-3 моль) в 5 мл EtOH с достаточным количеством HCl(k),чтобы обеспечить рН=2-3, нагревают до температуры образования флегмы. Затем добавляют 110 мг параформальдегида и дефлегмацию поддерживают в течение 8 ч. После этого реакционной массе дают возможность охладиться и выливают ее на лед и H2O. В результате этого гидрохлорид продукта выпадает в осадок и его собирают фильтрацией. Фильтраты подщелачивают NaOH 2N и экстрагируют AcOEt. Органическую фазу промывают Н 2O и насыщенным раствором NaCl, сушат Na2SO4 и растворитель удаляют. Дальнейшую фракцию продукта получают в колонке с двуокисью кремния с(M+, 5); 147 (63); 120 (100); 175 (56). Способ В. Пример 8. 3-[4-(2-Метоксифенил)пиперазин-1-ил]-1-(5-нитробензо[b]тиофен-3-ил)пропан-1-он гидрохлорид (VN-8012). 1. Сложный этиловый эфир 5-нитробензо[b]тиофен-2-карбоновой кислоты. 15 г (80,810-3 моль) 2-хлор-5-нитробензальдегида, растворенного в EtOH, по каплям добавляют к раствору 19,41 г (80,810-3 моль)Na2S9H2O в EtOH при 40C. Смесь выдерживают при температуре образования флегмы в течение 2 ч, а затем к ней добавляют 9 мл (80,8 12 10-3 моль) этилбромацетата. Через 2 ч при 50 С добавляют Et3N до рН=8-9. Смесь оставляют реагировать в течение ночи при комнатной температуре. Желтый продукт собирают фильтрацией. При добавлении к фильтрату Н 2 О осаждается дополнительное количество продукта, который очищают перекристаллизацией в гексане/AcOEt. Выход: 75%. Температура плавления: 165 С. ИК (см-1); 1714 (mf, С=O); 1533-1505, 13341258 (mf, NO2) 1(82); 206 (100); 160 (45). 2. 5-Нитробензо[b]тиофен-2-карбоновая кислота. 10 г (39,810-3 моль) сложного этилового эфира 5-нитробензо[b]тиофен-2-карбоновой кислоты в 250 мл EtOH и 60 мл Н 2 О подвергают реакции с 3,8 г (67,810-3 моль) КОН при 60 С в течение 2 ч, после чего соль калия продукта собирают фильтрацией. Дополнительную фракцию продукта собирают, добавляя к фильтрату изопропанол. Соль растворяют в воде и после подкисления раствора HCl(k) протонированную форму кислоты осаждают. Ее очищают перекристаллизацией в H2O/EtOH. Выход: 85%. Температура плавления: 238 С. ИК (см-1); 1688 (f, C=O); 1532; 1357-1307(100). 3. 5-Нитробензо[b]тиофен. 5 г (22,410-3 моль) 5-нитробензо[b] тиофен-2-карбоновой кислоты в 105 мл хинолина нагревают вместе с 5,2 г порошковой меди до температуры 180-190 С в течение 45 мин. Реакционную смесь фильтруют в вакууме и фильтр промывают этиловым эфиром. Смесь дважды экстрагируют этиловым эфиром, фазам дают возможность хорошо декантироваться и эфирную фазу промывают НСl 6N до полного удаления остатков хинолина. Ее сушат Na2SO4, растворитель удаляют и продукт очищают перекристаллизацией в гексане/изопропаноле. Выход: 65%. Температура плавления: 150 С. ИК (см-1); 1714 (mf, С=O); 1533-1505, 13341258 (mf, NO2) 1[b]тиофена и 0,65 мл (6,6410-3 моль) 2 хлорпропионил хлорида, растворенного в 40 мл сухого хлороформа, по каплям добавляют к 650 мг хлорида алюминия, растворенного в 20 мл сухого хлороформа, в атмосфере азота. Смесь оставляют реагировать в течение 24 ч при комнатной температуре, после чего к ней дополнительно добавляют 650 мг хлорида алюминия и 0,65 мл 2-хлорпропионил хлорида. Через 48 ч реакции добавляют 100 мл НСl 1,5N с последующим декантированием и органическую фазу последовательно промывают разбавленным раствором NaHCO3, H2O и насыщенным растворомNaCl. Ее сушат Na2SO4, растворитель удаляют, а остаток очищают на колонке с двуокисью кремния, используя гексан/толуол (25:75) в качестве подвижной фазы. Выход: 30%. Температура плавления: 128 С. ИК (см-1); 1670 (mf, С=O); 1510, 1335 (mf,NO2) 1(17); 206 (100). 5. 3-[4-(2-Метоксифенил)пиперазин-1-ил]1-(5-нитробензо-[b]тиофен-3-ил)пропан-1-он гидрохлорид. К 600 мг (5-нитробензо[b]тиофен-3-ил)-3 хлорпропан-1-она (2,2610-3 моль), растворенным в 30 мг тетрагидрофурана (ТГФ), добавляют 1,3 г 2-метоксифенилпиперазина (6,7810-3 моль) и 244 мг Nа 2 СО 3 (2,2610-3 моль). После перемешивания в течение 72 ч при комнатной температуре завершение реакции проверяют при помощи тонкослойной хроматографии. Тетрагидрофуран удаляют, остаток выливают в воду/лед, экстрагируют AcOEt, органическую фазу промывают Н 2O и насыщенным растворомNaCl, а растворитель удаляют. Остаток очищают на колонке с двуокисью кремния, используя(M+; 10); 206 (68); 150 (100). Применяя способ, описанный в примере 8,из соответствующего хлорпропанона получают следующие соединения: Пример 9. 1- (5-Фторбензо[b]тиофен-3-ил)3-[4-(2-метоксифенил)пиперазин-1-ил] пропан 1-он дигидрохлорид (VN-8512). Температура плавления: 197 С.(M+; 72); 205 (53); 195 (100). Способ С. Пример 11. 1-(5-Аминобензо[b]тиофен-3 ил)-3-[4-(2-метоксифенил)пипразин-1-ил]пропан-1-он дигидрохлорид (VN-8112). 200 мг 1-[(5-нитробензо[b]тиофен-3-ил) пиперазин-1-ил]пропан-1-он дигидрохлорида,полученного в соответствии со способом, описанным в примере 8, растворяют в 20 мл тетрагидрофурана со 100 мг Ni-Ренея и подвергают воздействию давления, составляющего 50 фунтов на кв.дюйм (3,5155 кг/см 2), и температуры еще 100 мг Ni-Ренея. Через 24 ч, на протяжении которых реакцию поддерживают при регулярном перемешивании, тонкослойная хроматография с применением дихлорметана/МеОН (9:1) показывает отсутствие исходного продукта. Смесь фильтруют через целит, растворитель быстро удаляют, чтобы избежать возможного окисления, а остаток растворяют в 10 мл этилового эфира и 2 мл EtOH. Гидрохлорид продукта осаждается после добавления 0,1 мл НСl(k). Твердое вещество промывают горячим ацетоном и продукт фильтруют. Выход: 57%. Температура плавления: 200-201 С. ИК (см-1); 3354 (m, NH2); 1667 (mf, C=O); 1245 (mf, Ar-O-). 1(M+; 2.2); 176 (40); 150 (100). Способ синтеза продуктов формулы (Ib). Пример 12. 1-(Бензо[b]тиофен-3-ил)-3-[4(2-метоксифенил)пиперазин-1-ил]пропан-1-ол 15 К 500 мг 1-(бензо[b]тиофен-3-ил)-3-[4-(2 метоксифенил)пиперазин-1-ил]пропан-1-он гидрохлорид (1,2010-3 моль) в 30 мл МеОН при 0C в течение приблизительно 20 мин добавляют NaBH4 до тех пор, пока реакция не перестанет развиваться. Через 2 ч к среде добавляют 50 мл Н 2 О, ее перемешивают в течение нескольких минут и дважды экстрагируют 200 мл AcOEt. Органическую фазу трижды промывают Н 2 О, сушат Na2SO4 и удаляют растворитель. Продукт очищают на колонке с двуокисью кремния с помощью AcOEt/гексана (1:1). Таким образом получают свободное основание в виде твердого белого вещества. Выход: 30%. Получают две полиморфные формы этого продукта,температуры плавления которых составляют 108 и 120 С соответственно. ИК (см-1); 3220 (m, ОН); 1243 (mf, Ar-O-). 1(M+; 6.8); 120 (100). Применяя способ, описанный в примере 12 и исходя из соответствующих кетонов, описанных в примерах 1-11, получают следующие продукты либо в виде свободного основания,либо гидрохлорида последующим осаждением НСl(k): Пример 13. 3-[4-(2-Метоксифенил)пиперазин-1-ил]-1-(5-нитробензо[b]тиофен-3-ил)пропан-1-ол моногидрат дигидрохлорид (VK-8022). Температура плавления: 130-131 С. ИК (см-1); 3404 (m, OH); 1510-1330 (mf,N2O); 1245 (mf, Ar-O-). 1(3); 205 (100). Способ синтеза продуктов формулы (Iс). Пример 23. 1-(Бензо[b]тиофен-3-ил)-3-[4(2-метоксифенил)пиперазин-1-ил]пропан-1-он Е-оксим (VN-2282). 0,5 г 1-(бензо[b]тиофен-3-ил)-3-[4-(2 метоксифенил)пиперазин-1-ил]пропан-1-он гидрохлорида (1,2010-3 моль) в 20 мл EtOH и 0,5 г гидрохлорида гидроксиламина (7,1910-3 моль) нагревают до температуры образования флегмы в течение 1,5 ч. После этого реакционную смесь подщелачивают NaOH, растворен 1 18 ным в EtOH и H2O, и позволяют взаимодействовать в течение 1 ч при температуре образования флегмы. К среде добавляют H2O, избыточныйEtOH удаляют в роторном испарителе и водную фазу экстрагируют при помощи AcOEt. Органическую фазу промывают H2O, сушат Na2SO4 и удаляют растворитель. Продукт очищают на колонке с двуокисью кремния, используяAcOEt/гексан в качестве подвижной фазы. Таким образом получают Е-изомер оксима. Выход: 60%. Температура плавления: 191 С. ИК (см-1); 3426 (f, ОН); 1242 (mf, Ar-O). 1(M+; 4,1); 379 (5,4); 205 (100). Следующие продукты получают способом,подобным способу, описанному в примере 23. Пример 24. 1-(3,5-Диметилбензо[b]тиофен 2-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил] пропан-1-он оксим (VN-7182). Температура плавления: 72-74 С. ИК (КВr) (см-1); 3421 (f, N-OH); 1450 (m,C-N). 1(M+; 13); 393 (25); 205 (100). Пример 26. Энантиомерное разделение продукта 1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-ол(VN2222). Хлороформ (2 мл), триэтиламин (538 мкл,3,88 ммоль) и 4-диметиламинопиридин (108 мг,0,88 ммоль) добавляют в каждую из двух опытных пробирок, содержащих по 500 мг (1,31 ммоль) рацемической смеси VN-2222. Эти растворы добавляют в две колбы, содержащие, соответственно, 531 мг (2,88 ммоль) и 542 мг (2,94 ммоль) (S)-(+)метоксифенилуксусного хлорангидрида. Им позволяют реагировать в течение одного часа и сливают в одну колбу с добавлением хлороформа до 50 мл. Смесь промывают разбавленной НСl (50 мл 3), разбавленным Nа 2 СО 3 (50 мл 3), насыщенным NaCl (50 мл 2) и H2O (50 мл 2). Хлороформ удаляют при пониженном давлении, получая масло, соответствующее смеси диастереоизомеров (R)VN-2222-(S)-ОММ и (S)-VN-2222(S)-ОММ(880 мг, 1,66 ммоль). ВЭЖХ (HPLC Waters 600E; детектор Waters LED 994; рабочая станция Millennium; колонка Supelcosil LC-CN, 25 х 0,46 см; подвижная фаза: (гексан/изопропанол+триэтиламин,90/10); скорость потока: 0,7 мл/мин; время пребывания в приборе (tr) в минутах; 8,2 диастереоизомер (R)-VN-2222-(S)-ОММ и 9,3 диастереоизомер (S)-VN-2222-(S)-OMM. После этого смесь диастереоизомеров, растворенных в этилацетате, разделяют препаративной ТСХ, используя пластинки 2040 из силикагеля 60. Подвижная фаза: TDA (толуол,диоксан, уксусная кислота 90:25:4). Две полосы появляются при 8 см (S,S) и 12 см (R,S) (УФ: 254 нм). Этилацетат добавляют в двуокись кремния, соответствующей каждому диастереоизомеру, с последующей фильтрацией, а растворитель удаляют при пониженном давлении. Оба диастереоизомера получают по отдельности: 420 мг (0,79 ммоль) (R,S) и 375 мг (0,71 ммоль) (S,S).H-ЯМР: (CDCl3, 200 МГц)(ppm): 2.232.26 (m, 2H, СНОН-CH2); 2.38-2.43 (m, 2H,(CH2)2-N); 2.59 (m, 4H, (CH2)2-N); 3.07 (m, 4H,(CH2)2N-Ar); 3.38 (s, 3H, СН 3 О-ОММ); 3.84 (s,3H, СН 3 О); 4.83 (s, 1H, OMM); 6.34 (t, 1H,CHOH-OMM); 6.83-6.99 (m, 5H, бензол +Н 2); 7.24-7.40 (m, 7H, H5+H7+5H бензол OMM); 7.697.80 (m, 2H, H4+H7). ВЭЖХ: tr: 9.3 мин. Следующая стадия представляет гидролиз при условиях, не приводящих к рацемизации. Каждый из диастереомеров растворяют в метаноле (40 мл), добавляют избыток К 2 СО 3 и реакционную массу выдерживают при комнатной температуре при постоянном перемешивании в течение 5 ч. К 2 СО 3 удаляют фильтрацией, удаляют растворитель, добавляют воду и проводят экстракцию в хлороформе (350 мл). Хлороформ удаляют при пониженном давлении, по 002687 20 лучая 172 мг (0,45 ммоль) энантиомера (R) и 97 мг (0,25 ммоль) энантиомера (S). Оба энантиомера имеют одинаковый спектр 1H-ЯМР.(ppm); 2.09 (с, 2H, СНОН-СН 2); 2.6-2.9 (m, 6H,(СН 2)3-Н); 3.1-3.3 (m, 4H, (CH2)2N-Ar); 3.86 (s,3H, ОСН 3); 5.35 (t, 1H, СНОН); 7.01-7.31 (m, 4H,бензол); 7.4 (m, 2H, H5+Н 6); 7.44 (d, 1H, Н 2); 7.78-7.789 (m, 2H, Н 4+Н 7). ВЭЖХ: tr:12 мин. Для определения энантиомерной чистоты каждый энантиомер получают, применяя (R)(+)метокси-(трифторметил)фенилуксусный хлорангидрид. Готовят 2 ампулы с 5 мг (0,013 ммоль) каждого энантиомера, хлороформа (2 мл), триэтиламина (6 мкл, 0,039 ммоль) и 4 диметиламинопиридина (2 мг, 0,016 ммоль). Получают два раствора, которые добавляют в каждую из колб, содержащих (R)-(+)метокси-(трифторметил)фенилуксусный хлорангидрид (2 мл гексана, N,N-диметилформамид (4 мкл, 0,05 ммоль), и в две колбы, содержащие (R)-(+)-метокси(трифторметил)фенилуксусную кислоту (10 мг, 0,043 ммоль), добавляют оксалилхлорид (19 мкл, 0,20 ммоль), оставляют их реагировать в течение одного часа, фильтруют и удаляют растворитель, получая хлорангидрид,7,1 мг (0,03 ммоль) и 7,0 мг (0,03 ммоль) соответственно. Обе колбы оставляют на один час,затем добавляют 10 мл хлороформа. Их промывают разбавленной НСl (10 мл 3), разбавленным Nа 2 СО 3 (10 мл 3), насыщенным NaCl (10 мл 2) и Н 2 О (10 мл 2). Хлороформ удаляют,получая в каждом случае масло, соответствующее каждому из диастереомеров: (1R)-1(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропил-(2R)-3,3,3-трифтор-2-метокси-2-фенилацетат, 4,2 мг (0,007 ммоль) и (1S)1-(бензо-[b]-тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропил-(2R)-3,3,3-трифтор 2-метокси-2-фенилацетат, 4 мг (0,007 ммоль). 21 Описание методов, применяемых для оценки фармакологических свойств Тест на связывание рецепторов 5HT1A. Для определения сродства продуктов к рецепторам 5HT1A проводят тесты на связывание,используя в качестве радиолиганда агонист 3 Ндипропиламинотетралин (DPAT) и применяя способ, описанный Hoyer et al., (Eur.J.Parmacol.,118, 13-23) (1985). Переднюю часть коры головного мозга крыс сушат и гомогенизируют в Трис-HCl, 50 мМ, рН 7,7, при 4 С. Полученный гомогенат центрифугируют при 25000 об./мин в течение 15 мин, а полученный осадок повторно суспендируют в Трис-НСl и инкубируют при 37 С в течение 10 мин. Полученную повторную суспензию вновь центрифугируют и повторно суспендируют в Трис-НСl, содержащем CaCl2, 4 мМ. В тесте на связывание инкубационная смесь содержит суспензию мембраны, 3H-DPAT (1 нМ) и холодный вытеснитель. Для отделения фракции, связанной с рецепторами, проводят быструю фильтрацию. Тесты на связывание с носителем 5-НТ. Фракцию мембраны передней части коры головного мозга крыс получают, как и при определении связывания с рецепторами 5-HT1A. Суспензию мембраны инкубируют в течение 60 мин при 22 С 3H-пароксетином, используя флуоксетин в качестве вытеснителя. По завершении инкубирования мембранную фракцию отделяют быстрой фильтрацией. Используемый метод описан Marcusson et al., (J.Neurochemistry, 44,705-711) (1985). Результаты, полученнные в этих тестах по фармакологической оценке продуктов в соответствии с данным изобретением, суммированы и табл. 1 и 2. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения производных бензотиофена общей формулы (I)R4 и R5 вместе могут образовывать бензольное кольцо, конденсированное с фенильным кольцом;R6 представляет Н, C1-С 6 алкил, CO2R8,-C(O)NR9R10, нафтил или фенил, необязательно замещенный одним или более заместителями,выбранными из группы Н, галоалкил, алкил, 24 галоген, C1-С 6 алкокси, метилендиокси, нитро,циано;R9 и R10 независимо представляют Н, C1-С 6 алкил или фенил или R9 и R10 вместе с N, к которому они присоединены, образуют 5- или 6 членное кольцо, в котором необязательно может присутствовать N, О или S,или их соль или сольваты, или геометрические изомеры или оптические изомеры, или полиморфы. 2. Соединения по п.1, где Z представляет-C(NOR7)-: 1-(бензо[b]тиофен-3-ил)-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан-1-он оксим. 5. Применение соединения по любому из пп.1-4 для получения фармацевтической композиции для лечения неврологических нарушений. 6. Применение по п.5 для получения фармацевтической композиции для лечения тревоги и/или депрессии. 7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 в терапевтически активном количестве для лечения тревоги и/или депрессии и достаточное количество носителя.
МПК / Метки
МПК: C07D 333/22, A61P 25/22, A61K 31/497
Метки: композиции, применение, бензотиофена, производные
Код ссылки
<a href="https://eas.patents.su/13-2687-proizvodnye-benzotiofena-ih-primenenie-i-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензотиофена, их применение и композиции</a>
Предыдущий патент: Средство для обработки воды, предназначенной для содержания водных животных
Следующий патент: Способы инактивации клеток-мишеней, агенты и композиции, вызывающие цитолиз, и соединения, используемые для получения этих агентов
Случайный патент: Способ предотвращения коррозии металлов с применением силанов