Применение аналогов розувастатина для лечения болезненных состояний, которые поддаются лечению путем ингибирования hmg-coa редуктазы
Формула / Реферат
1. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата
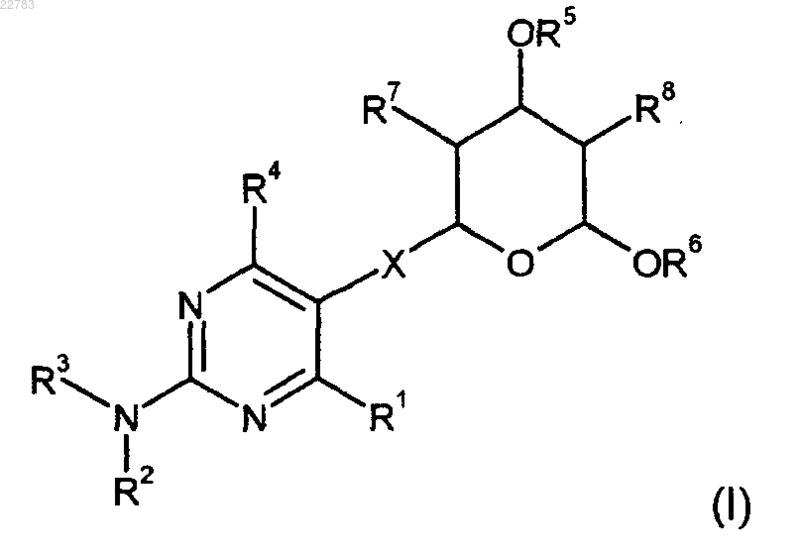
где R1 представляет собой C1-6алкил;
R2 представляет собой -S(O)2R9, где R9 представляет собой С1-6алкил;
R3 представляет собой С1-6алкил;
R4 представляет собой арил, замещенный галогеном;
R5 и R6 независимо выбирают из группы, состоящей из водорода, C1-6алкила, C1-6галоидалкила, С2-6алкенила, арила, С1-6алкиларила и C1-6алканоилгетероарила; при условии, что всегда R5 и R6 оба не являются водородом;
R7 и R8 представляют собой Н;
X представляет собой -(CRaRb)m(CRa=CRb)n(CRaRb)o-, где Ra и Rb представляют собой Н, m, n и о независимо равны 0 или 1 при условии, что m + n + о не более 3;
арильные группы включают ароматические кольцевые системы, содержащие 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов углерода в кольце;
гетероарильные группы включают ароматические гетероциклические кольцевые системы, содержащие 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов углерода в кольце с 1-4 гетероатомами, независимо выбранными из азота, кислорода и серы;
каждая из групп R5 и R6 может быть, если это возможно химически, незамещенной или независимо замещена 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3алкила, гало-С1-3алкила, С1-3алкокси, C1-3галоалкокси, гидрокси и цианогруппы,
для лечения болезненных состояний, которые поддаются лечению путем ингибирования фермента 3-гидрокси-3-метилглютарил-коэнзим А редуктазы (редуктазы HMG-CoA), где указанные болезненные состояния выбирают из группы, состоящей из гиперхолестеринемии, атеросклероза, гиперлипидемии, сердечно-сосудистых заболеваний, ишемической болезни сердца, инфаркта миокарда, инсульта, заболевания периферических артерий, воспаления, деменции, рака, ядерной катаракты и гипертонии.
2. Применение по п.1, где R1 представляет собой изопропил, R2 представляет -S(O)2Me, R3 представляет собой метил и R4 представляет собой 4-фторфенил.
3. Применение по любому из предшествующих пунктов, где R5 выбирают из группы, состоящей из водорода, C1-6алкила, арила, C1-6алкиларила и C1-6алканоилгетероарила.
4. Применение по п.3, где R5 является водородом.
5. Применение по п.3, где R5 выбирают из группы, состоящей из -C1-алкил-Ph, -С2-алкил-Ph, -С3-алкил-Ph и -С4-алкил-Ph.
6. Применение по п.5, где R5 представляет собой бензил.
7. Применение по п.3, где R5 представляет собой C1-6алканоилпиридин.
8. Применение по п.7, где R5 представляет собой 3-метаноилпиридин.
9. Применение по любому из предшествующих пунктов, где R6 выбирают из группы, состоящей из C1-6алкила, C1-6галоидалкила, C2-6алкенила и арила.
10. Применение по п.9, где R6 выбирают из группы, состоящей из C1-6алкила, C1-6галоидалкила и C2-6алкенила.
11. Применение по п.10, где R6 выбирают из группы, состоящей из метила, этила, пропила, бутила, хлорметила, хлорэтила, хлорпропила, хлорбутила и пропилена.
12. Применение по п.9, где R6 является незамещенным арилом или арилом, замещенным 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3алкила, гало-С1-3алкила, C1-3алкокси, C1-3галоалкокси, гидрокси и цианогруппы.
13. Применение по п.12, где R6 выбирают из группы, состоящей из C1-6алкоксизамещенного фенила и галогензамещенного фенила.
14. Применение по п.12, где R6 выбирают из группы, состоящей из 2,4,6-трифторфенила и 2,4-диметоксифенила.
15. Применение по любому из пп.1, 2, где R5 представляет собой водород и R6 является незамещенным арилом или арилом, замещенным 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, С1-3алкила, гало-С1-3алкила, С1-3алкокси, С1-3галоалкокси, гидрокси и цианогруппы.
16. Применение по любому из пп.1, 2, где R5 представляет собой незамещенный или замещенный бензил и R6 представляет собой незамещенный или замещенный C1-6алкил, незамещенный или замещенный C2-6алкенил или С1-6галоидалкил, где замещенная группа замещена 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, С1-3алкила, гало-С1-3алкила, С1-3алкокси, С1-3галоалкокси, гидрокси и цианогруппы.
17. Применение по любому из пп.1, 2, где R5 представляет собой C1-6алканоилгетероарил и R6 представляет собой незамещенный C1-6алкил или C1-6алкил, замещенный от 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, С1-3алкила, гало-С1-3алкила, С1-3алкокси, С1-3галоалкокси, гидрокси и цианогруппы.
18. Применение по любому из предшествующих пунктов, где Ra представляет собой H, Rb представляет собой Н, m = 0, n = 1 и о = 0.
19. Применение по п.1, где структуру соединения выбирают из следующих:
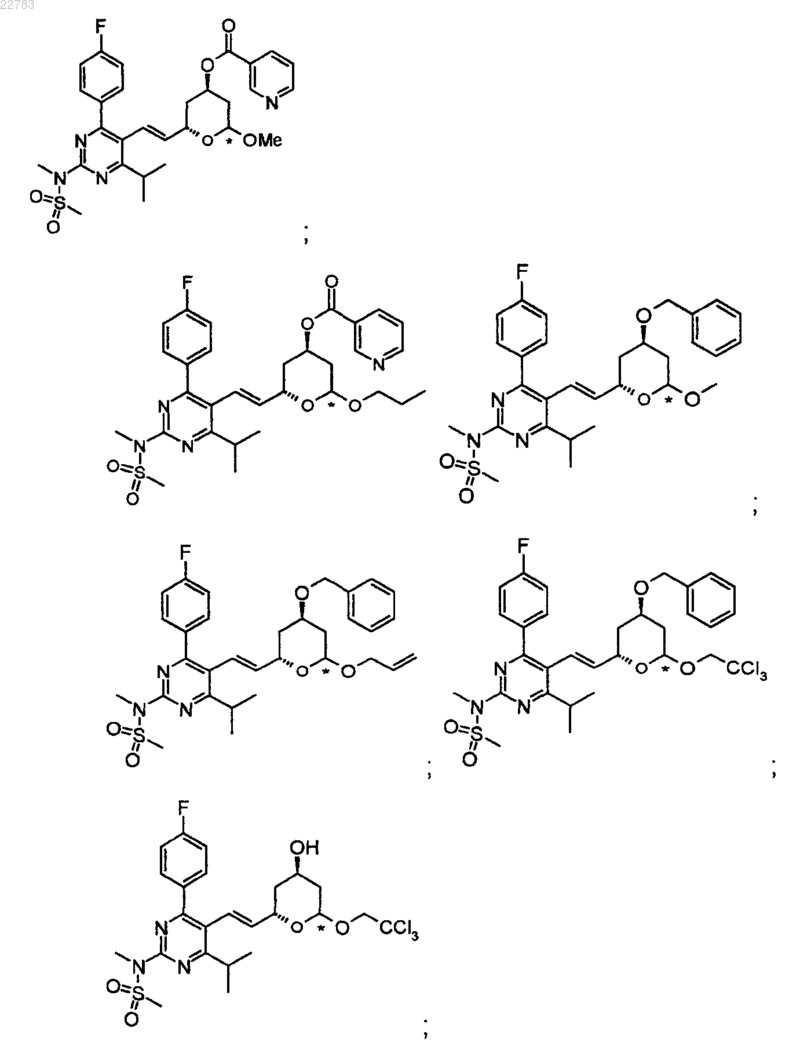
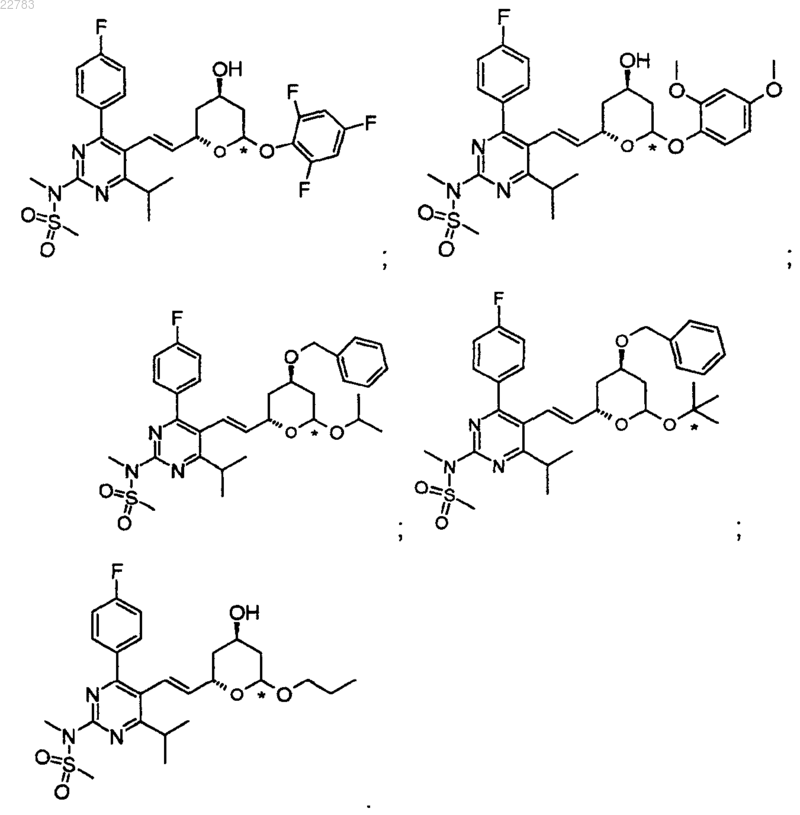
Текст
ПРИМЕНЕНИЕ АНАЛОГОВ РОЗУВАСТАТИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕННЫХ СОСТОЯНИЙ, КОТОРЫЕ ПОДДАЮТСЯ ЛЕЧЕНИЮ ПУТЕМ ИНГИБИРОВАНИЯ Данное изобретение относится к применению аналогов розувастатина формулы (I), где все заместители раскрыты в формуле изобретения, для лечения болезненных состояний, которые поддаются лечению путем ингибирования HMG-СоА редуктазы.(71)(73) Заявитель и патентовладелец: РЕДКС ФАРМА ПИЭЛСИ (GB) Область техники, к которой относится изобретение Настоящее изобретение относится к применению аналогов розувастатина. В частности, изобретение относится к применению розувастатин лактолов в производстве препаратов для лечения некоторых болезненных состояний. К числу болезненных состояний, поддающихся лечению соединениями по настоящему изобретению, относятся состояния, которые модулируются ферментом 3-гидрокси-3 метилглютарил-коэнзим А редуктазой (редуктазой HMG-CoA). Поэтому ингибирование фермента является важной терапией многих заболеваний. В изобретении используются производные 6-(3- или 4 карбоксамидозамещенный пиррол-1-ил)-4-гидрокси-3,5-дигидропиран-2-ола. Сведения о предшествующем уровне техники Розувастатин - 7-[4-(4-фторфенил)-6-(1-метилэтил)-2-(метилметансульфониламидо)пиримидин-5 ил]-3,5-дигидрокси-гепт-6-еновая кислота - и его применение для ингибирования биосинтеза холестерина были впервые описаны в ЕР 0521471. Розувастатин является сильным ингибитором фермента HMGCoA. В работе Clin Invest Med, Vol. 24,5, p. 258-72, 2001 (Baker and Tamopolsky) найдено, что в то время как статины с открытой конформацией оксикислоты являются активными, лактоны, их циклические аналоги, не активны. При печеночном гидролизе при щелочном рН происходит in vivo дециклизация и, следовательно, активация лактоновых пролекарств ловастатина и симвастатина. Однако проблема таких соединений состоит в том, что экстенсивный пресистемный метаболизм ведет к быстрому выведению из организма таких статинов. Аналогично в работе Trends in Pharmacological Sciences, Vol. 19, Issue 1, 1 January 1998, p. 26-37 показано, что лактоны, не активные в ингибировании редуктазы HMG-CoA, должны превратиться в соответствующие разомкнутые оксикислотные формы так, как это имеет место в случае розувастатина. С лактонной формой и также активной формой с разомкнутым циклом связаны также проблемы устойчивости в течение длительного периода времени. Эта проблема важна для производства главного активного вещества или при его длительном хранении. Например, может происходить потеря гидроксильной группы по реакции дегидратации. Полученный продукт разложения может иметь двойную связь,сопряженную с карбонильной группой лактона, что облегчает процесс возможного разложения. Аналогично в случае формы с разомкнутым циклом один из возможных продуктов разложения может также содержать двойную связь, сопряженную с карбонильной группой кислоты. Сущность изобретения Поэтому целью настоящего изобретения является применение соединений, способных ингибировать редуктазу HMG-CoA. Розувастатин является весьма сильным ингибитором резуктазы HMG-CoA. Вот почему целью настоящего изобретения является также предложение применения соединений, способных ингибировать редуктазу HMG-CoA, характеризующихся величиной IC50, сравнимой с розувастатином или выше. Было бы идеально, чтобы эти соединения обладали более высокой устойчивостью и биодоступностью по сравнению с розувастатином. Таким образом, целью изобретения является предложение применения соединений с повышенной устойчивостью. В идеале соединения должны иметь увеличенный срок хранения на складе. Таким образом, целью настоящего изобретения является предложение применения соединений с повышенным сроком хранения, способных ингибировать редуктазу HMGCoA. Таким образом, целью настоящего изобретения является предложение применения соединений,способных ингибировать редуктазу HMG-CoA и обладающих повышенной биодоступностью. Также целью настоящего изобретения является предложение применения соединений, способных ингибировать редуктазу HMG-CoA и усиливать промотирование липопротеинов высокой плотности (HDL). Также целью настоящего изобретения является предложение применения соединений, способных понижать уровень липопротеинов низкой плотности (LDL) и усиливать промотирование липопротеинов высокой плотности (HDL). Конкретно, целью настоящего изобретения является предложение применения соединений, способных понижать уровень липопротеинов низкой плотности (LDL) и усиливать промотирование липопротеинов высокой плотности (HDL) более чем на 10%, предпочтительно более чем на 15% или более. Таким образом, данное изобретение посвящено поиску способов терапии для ингибирования биосинтеза холестерина. Также целью изобретения является применение соединений для лечения группы заболеваний, при которых ингибируется образование холестерина. Настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли или сольвата для лечения болезненных состояний, которые поддаются лечению путем ингибирования фермента 3-гидрокси-3-метилглютарил-коэнзим А редуктазы (редуктазы HMG-CoA), причем болезненные состояния выбирают из группы, состоящей из гиперхолестеринемии, атеросклероза, гиперлипидемии, сердечно-сосудистых заболеваний, ишемической болезни сердца, инфаркта миокарда, инсульта или заболевания периферических артерий, воспаления, деменции, рака, ядерной катаракты и гипертонии, в которомR5 и R6 независимо выбирают из группы, состоящей из водорода, C1-6 алкила, C1-6 галоидалкила,С 2-6 алкенила, арила, C1-6 алкиларила и C1-6 алканоилгетероарила; при условии, что всегда R5 и R6 оба не являются водородом;X представляет собой -(CRaRb)m(CRa=CRb)n(CRaRb)o-, где Ra и Rb представляют собой Н, и m, n и о независимо равны 0 или 1 при условии, что m + n + о не более 3; арильные группы включают ароматические кольцевые системы, содержащие 6, 7, 8, 9, 10, 11,12, 13,14, 15 или 16 атомов углерода в кольце; гетероарильные группы включают ароматические гетероциклические кольцевые системы, содержащие 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов углерода в кольце с 1-4 гетероатомами, независимо выбранными из азота, кислорода и серы; каждая из групп R5 и R6 может быть, если это возможно химически, незамещнной или независимо и необязательно замещена 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3 алкила, гало-С 1-3 алкила, C1-3 алкокси, C1-3 галоалкокси, гидрокси и цианогруппы. Обычно болезненные состояния, которые модулируются HMG-CoA редуктазой, - это те состояния,которые можно было лечить путем ингибирования фермента с помощью соединений по настоящему изобретению. Соединения могут быть активными сами по себе или в некоторых случаях могут подвергаться раскрытию цикла в физиологических условиях с образованием соответствующих соединений, обладающих ингибирующей активностью. Сопровождающая фигура (фиг. 1) иллюстрирует влияние введения розувастатина (25 мг/кг перорально) и четырех аналогов розувастатина (25 мг/кг) на уровень триглицеридов в плазме крыс. Фармацевтически приемлемые соли соединений формулы (1) включают соли присоединения кислоты и соли присоединения основания. Подходящие соли кислот образуются из кислот, образующих нетоксичные соли. Примеры включают следующие соли: ацетат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат,цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 1,5-нафталиндисульфонат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/однозамещенный фосфат/двузамещенный фосфат, сахарат, стеарат, сукцинат, тартрат, тозилат и трифторацетат. Подходящие основные соли получают из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина,лизина, магния, меглюмина, оламина, калия, натрия, трометамина и цинка. Могут образоваться также частично замещенные соли кислот и оснований, например, гемисульфат и частично замещенные соли кальция. Обзор пригодных солей см. "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" byStahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемые соли соединений формулы (1) можно получить одним или несколькими из трех способов:(i) по реакции соединения формулы (1) с соответствующей кислотой или основанием;(ii) путем удаления кислотной или основной лабильной защитной группы из подходящего предшественника соединения формулы (1) или раскрытия цикла в подходящем циклическом предшественнике,например лактоне или лактаме, с помощью нужной кислоты или основания; или(iii) путем превращения одной соли соединения формулы (1) в другую по реакции с соответствующей кислотой или основанием или с помощью подходящей ионообменной колонки. Все три реакции обычно проводят в растворе. Полученную соль можно осадить и выделить путем фильтрации или путем выпаривания растворителя. Степень ионизации полученной соли может варьироваться от полной ионизации до почти не ионизованной формы. Соединения могут существовать как в несольватированной, так и сольватированной форме. Термин"сольват" использован здесь для описания молекулярного комплекса, включающего соединение по изобретению и стехиометрическое количество одной или нескольких молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используют, когда указанным растворителем является вода. В объем изобретения включены также комплексы типа клатратов, т.е. комплексов включения лекарство-хозяин, в которых в отличие от указанных выше сольватов лекарство и хозяин присутствуют в стехиометрическом или нестехиометрическом количествах. Также включены комплексы лекарства, содержащие два или несколько органических и/или неорганических компонента, которые могут присутствовать в стехиометрическом или нестехиометрическом количествах. Полученные комплексы могут быть ионизированы, частично ионизированы или не ионизированы. Обзор таких комплексов см. J. Pharm Sci,64 (8), 1269-1288 by Haleblian (August 1975). Все приведенные далее ссылки на соединения формулы (1) включают ссылки на соли, сольваты и их комплексы, сольваты и комплексы их солей. Соединения для применения по данному изобретению включают указанные выше соединения формулы (1), в том числе их полиморфные модификации и кристаллические формы, пролекарства и изомеры(включая оптические, геометрические изомеры и таутомерные формы), как указано ниже, и изотопномеченные соединения формулы (1). Соединения для применения по настоящему изобретению могут существовать перед очисткой в виде смеси энантиомеров в зависимости от метода синтеза. Например, соединения по данному изобретению могут существовать в виде смеси энантиомеров с соотношением от 2:1 до 3:1, хотя могут быть и другие соотношения. Энантиомеры можно разделить известными специалистам традиционными методами. Таким образом, данное изобретение включает индивидуальные энантиомеры, а также их смеси. В случае, когда описанные здесь химические структуры включают символ , это означает, что присутствует смесь энантиомеров с соотношением от 2:1 до 3:1. На некоторых стадиях способа получения соединений (1) бывает необходимо защитить потенциально реакционноспособные группы, которые не желательно вводить в реакции, и в дальнейшем удалить эти защитные группы. В таком случае можно использовать любые совместимые защитные радикалы. В качестве конкретных способов защиты и снятия защиты можно использовать способы, описанные T.W.(Protecting groups, Georg Thieme Verlag, 1994). Все вышеуказанные реакции и способы получения новых исходных веществ, использованные в предшествующих способах, являются традиционными, и соответствующие реагенты и условия реакций для их осуществления, а также методики выделения целевых продуктов хорошо известны специалистам в данной области, знакомым с литературными прецедентами и примерами синтеза. Кроме того, соединения формулы (1), так же как промежуточные соединения в их синтезе, можно очищать разными хорошо известными способами, например кристаллизацией или хроматографией. В одном варианте R1 представляет собой изопропил. В одном варианте R2 представляет собой -S(O)2Me, R3 представляет собой метил и R4 представляет собой 4-фторфенил. В одном варианте R5 выбирают из группы, включающей водород, C1-6 алкил, арил, C1-6 алкиларил,C1-6 алканоиларил, гетероарил, C1-6 алканоилгетероарил и C1-6 алкилгетероарил. В другом варианте R5 выбирают из группы, включающей водород, C1-6 алкил, арил, C1-6 алкиларил и C1-6 алканоилгетероарил, илиR5 является водородом, или R5 выбирают из группы, состоящей из -С 1 алкил-Ph, -С 2 алкил-Ph, -С 3 алкил-Ph и -С 4 алкил-Ph, или R5 представляет собой бензил, или R5 представляет собой C1-6 алканоилпиридин или представляет собой 3-метаноилпиридин. В одном варианте R6 выбирают из группы, состоящей из C1-6 алкила, C1-6 галоидалкила, C2-6 алкенила и арила. В другом варианте R6 выбирают из группы, состоящей из C1-6 алкила, C1-6 галоидалкила иC2-6 алкенила. В еще одном варианте R6 выбирают из группы, состоящей из метила, этила, пропила, бутила, хлорметила, хлорэтила, хлорпропила, хлорбутила и пропилена. При этом R6 является незамещенным арилом или арилом, замещенным от 1 до 5 группами, выбранными независимо в каждом случае из групп,состоящих из гало, С 1-3 алкила, гало-С 1-3 алкила, С 1-3 алкокси, С 1-3 галоалкокси, гидрокси и циано. В одном варианте R6 выбирают из группы, состоящей из C1-6 алкоксизамещенного фенила и галогензамещенного фенила. В еще одном варианте R6 выбирают из группы, состоящей из 2,4,6-трифторфенила и 2,4 диметоксифенила. В следующем варианте R5 представляет собой водород и R6 является незамещенным арилом или арилом, замещенным от 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3 алкила, гало-C1-3 алкила, C1-3 алкокси, C1-3 галоалкокси, гидрокси и цианогруппы. В предпочтительном варианте R6 является 2,4,6-трифторфенилом. В еще одном предпочтительном варианте R6 является 2,4-диметоксифенилом. В следующем варианте R5 представляет собой незамещенный бензил и R6 представляет собой незамещенный или замещенный C1-6 алкил, незамещенный или замещенный C2-6 алкенил или C1-6 галоидалкил,где замещенная группа замещена от 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3 алкила, гало-C1-3 алкила, C1-3 алкокси, C1-3 галоалкокси, гидрокси и цианогруппы. В другом варианте R5 представляет собой C1-6 алканоилгетероарил и R6 представляет собой незамещенный C1-6 алкил или C1-6 алкил, замещенный 1-5 группами, которые независимо в каждом случае выби-3 022783 рают из группы, состоящей из галогена, C1-3 алкила, гало-C1-3 алкила, C1-3 алкокси, C1-3 галоалкокси, гидрокси и цианогруппы. В одном варианте Ra представляет собой H, Rb представляет собой Н, m = 0, n = 1 и о = 0. Арильные группы включают ароматические циклические системы, содержащие 6, 7, 8, 9, 10, 11, 12,13, 14, 15 или 16 атомов углерода в цикле. Арильные группы могут содержать один цикл, но это могут быть полициклические системы с двумя или несколькими циклами, из которых по меньшей мере один является ароматическим. Арильные группы включают фенил, нафтил, флуоренил, азуленил, инденил и антрил. В одном варианте арил является фенилом. Гетероарильные группы включают ароматические гетероциклические циклические системы, содержащие 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов в цикле с 1-4 гетероатомами, которые независимо выбирают из азота, кислорода и серы. Такая группа может представлять собой полициклическую систему с двумя или несколькими циклами, из которых по меньшей мере один цикл является ароматическим, но чаще это бывает моноциклическая система. Предпочтительными являются моноциклические гетероарильные группы, содержащие 5-6 атомов в цикле. Гетероарильные группы включают пирролил,пиразолил, имидазолил, пиразинил, оксазолил, изоксазолил, тиазолил, фурил, тиофенил, пиридил, пиримидил, бензимидазолил, индолил, изохинолил, хиноксалинил и хинолил. В одном варианте гетероарильную группу выбирают из группы, включающей пиридин, пиримидин,пиразин, пиразол и оксазол. Предпочтительной гетероарильной группой является пиридин. В случае, когда одна или несколько из указанных групп являются необязательно замещенными,предпочтительно, чтобы каждый необязательный заместитель был независимо выбранным атомом галогена. Среди них предпочтительны хлор и фтор. Предпочтительно, чтобы атомы галогена, если их более одного, были одинаковыми. В одном варианте R1 представляет собой C1-4 алкил, предпочтительно изопропил. В другом варианте R2 представляет собой -S(O)2R9, где R9 является C1-6 алкилом, предпочтительно метилом, R3 представляет собой водород или C1-6 алкил, предпочтительно метил. В одном варианте R1 представляет собой C1-4 алкил, предпочтительно изопропил; R2 представляет собой -S(O)2R9, где R9 представляет собой C1-6 алкил, предпочтительно метил; R3 представляет собой водород или C1-6 алкил, предпочтительно метил; R4 представляет собой необязательно замещенный арил,предпочтительно 4-фторфенил. Соотношение между группами R5 и R6 является важным для активности соединений. Таким образом, группы R5 и R6 не могут быть водородом. Аналогично, в случае когда R5 представляет водород, было бы идеально, чтобы R6 не был незамещенной C1-6 алкильной группой, например метилом, этилом, изопропилом или трет-бутилом. В одном варианте R5 не является водородом. В другом варианте R6 не является водородом. В другом варианте R5 представляет собой водород и R6 является необязательно замещенной ароматической группой. В этом варианте предпочтительно, чтобы ароматическая группа была замещена 1-5 заместителями, как указано выше. Предпочтительно, чтобы ароматическая группа содержала 2-3 заместителя в орто- и/или пара-положениях. Предпочтительно, чтобы заместителями в ароматической группе были атомы галогена (например, фтора или хлора). Предпочтительно, чтобы заместителями в ароматической группе были С 1-4 алкокси (например, метокси). В другом варианте R5 представляет собой водород и R6 представляет собой C1-6 галоидалкильную группу. В этом варианте предпочтительно, чтобы галоидалкильная группа была хлоралкильной группой. Предпочтительно, чтобы галоидалкильная группа была галоидэтильной группой. Особенно предпочтительной группой является группа -CH2CCl3-. В другом варианте R5 представляет собой необязательно замещенный бензил и R6 представляет собой необязательно замещенный С 2-6 алкил, предпочтительно метил, пропил, изопропил, бутил, изобутил или трет-бутил. В еще одном варианте R5 представляет собой необязательно замещенный бензил и R6 представляет собой необязательно замещенный С 2-6 алкенил, предпочтительно пропилен. В следующем варианте R5 представляет собой бензил и R6 является C2-6 галоидалкилом, предпочтительно 2,2,2 трихлорэтилом. В одном варианте R5 представляет собой C1-6 алканоилгетероарильную группу и R6 представляет собой необязательно замещенный C1-6 алкил, предпочтительно метил, этил или пропил. В одном варианте соединение имеет структуру, которую выбирают из следующих: Как указано выше, известно, что статины, имеющие конформацию открытой оксикислоты, обладают эффектом ингибирования HMG-CoA редуктазы. Известно также, что лактон - аналог с замкнутым кольцом такой оксикислоты - не активен в ингибировании HMG-CoA редуктазы и для активации лактона необходима его дециклизация. Однако авторы установили, что функционализированные лактолы по настоящему изобретению сами по себе оказывают значительное ингибирующее действие на HMG-CoA редуктазу. Это удивительно, ввиду того, что эти молекулы в замкнутой циклической форме имеют конформационное напряжение. Примеры болезненных состояний, которые можно лечить ингибированием редуктазы HMG-CoA,включают гиперхолестеринемию, атеросклероз и гиперлипидемию. Статины используют для вторичной профилактики сердечно-сосудистых заболеваний или для первичного предотвращения сердечнососудистых заболеваний, когда возрастает риск сердечно-сосудистых заболеваний. Поэтому ожидается,что соединения по настоящему изобретению найдут применение в лечении или профилактике сердечнососудистых заболеваний благодаря их ингибиторной активности. Примеры сердечно-сосудистых заболеваний, которые можно лечить соединениями по настоящему изобретению, включают ишемическую болезнь сердца, инфаркт миокарда, инсульт и болезни периферических артерий. Кроме того, эти соединения могут быть весьма полезны в лечении воспалений, деменции, рака, ядерной катаракты, диабета и гипертонии. Болезненные состояния, которые можно лечить путем ингибирования редуктазы HMG-CoA, могут наблюдаться у человека и животных. Эти соединения особенно предназначены для людей. Способы синтеза соединений по настоящему изобретению описаны в WO2005/092867, в частности в примерах. Описание патента в WO2005/092867 в отношении методик синтеза составляет часть описания настоящего изобретения. Для краткости подробности этих методик синтеза не воспроизводятся здесь, но включены ссылкой в описание этого документа. Настоящее изобретение также включает синтез всех фармацевтически приемлемых изотопномеченных соединений формулы (I), в которых один или несколько атомов замещены атомами с тем же атомным номером, но атомной массой или массовым числом, отличными от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, пригодных для введения в соединения по данному изобретению, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора,такие как 32 Р, и серы, такие как 35S. Некоторые изотопно-меченные соединения, например, такие, которые включают радиоактивный изотоп, полезны при изучении лекарства и/или его распределения в тканях субстрата. Особенно полезны для этой цели радиоактивные изотопы: тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, ввиду легкости их введения и детектирования. Замещение более тяжелыми изотопами типа дейтерия, т.е. 2 Н, может иметь некоторые терапевтические преимущества, обусловленные повышенной метаболической устойчивостью, например, увеличенным временем полупревращения in vivo или пониженным требованием к дозе, и, следовательно, при некоторых обстоятельствах может быть предпочтительным. Замещение позитрон-активными изотопами, такими как 11 С, 18F, 15O и 13N, можно использовать для исследования степени занятости рецептора субстратом методом позитронной эмиссионной топографии(ПЭТ). Изотопно-меченные соединения обычно можно синтезировать традиционными методами, известными специалистам в данной области, или способами, аналогичными описанным, с применением соответствующих изотопно-меченных реагентов вместо применявшихся раньше немеченых реагентов. Во всем описании и формуле термины "включать" или "содержать" и их варианты, например"включающий" и "содержащий", означают "включающий, но не ограничивающийся этим" и не исключают другие фрагменты, добавки, компоненты, целые числа или стадии. Во всем описании и формуле единственное число охватывает множественное, если контекст не требует другого. В частности, при использовании неопределенного артикля описание следует понимать как включающее множественность так же, как единственность, если контекст не требует иного. Особенности, целые числа, характеристики, соединения, химические фрагменты или группы, описанные в связи с конкретным вариантом, вариантом или примером изобретения, следует понимать как применимые к любому другому описанному здесь аспекту, варианту или примеру, за исключением случая их несовместимости. Сведения, подтверждающие возможность осуществления изобретения Общая методика. Все анализы проводили в реакционном буфере, содержащем 100 нМ KXPO4 при рН 7.2, 1 мМ ЭДТА, 500 мМ KCl и 1 мг/мл BSA. Концентрации каждого из NADPH и HMG-CoA составляли 200 мкМ. Концентрация используемого фермента не известна, хотя эта концентрация в 10 раз ниже концентрации исходного продажного раствора. Ингибиторы растворяли в 75% ДМСО. Когда было установлено, что ингибиторы не растворяются или только частично растворяются в 75% ДМСО, использовали 100% ДМСО. Реакцию активировали путем добавления фермента и после добавления встряхивали в течение 12 с. Затем каждые 20 с следили за поглощением в течение 600 с. В начальных тестах концентрацию каждого ингибитора устанавливали на уровне 50 нМ для идентификации лучших ингибиторов по сравнению с известным ингибитором правастатином. После такой идентификации анализы проводили, варьируя их концентрации от 0 до 50 нМ, и рассчитывали величины IC50. Пример 1. Применили следующую методику с использованием набора для анализа редуктазы HMG-CoA отSigma-Aldrich (номер в каталоге CS1090). Анализ основан на стектрофотометрическом определении уменьшения поглощения раствора NADPH при 340 нм. Уменьшение поглощения вызвано окислениемNADPH под действием каталитической субъединицы HMGR в присутствии субстрата HMG-СоА. Эффективное ингибирование HMG-CoA ведет к уменьшению окисления NADPH, которое в свою очередь ведет к меньшему снижению поглощения при 340 нм во времени. Это проиллюстрировано следующей схемой реакции: Соединениями, проявляющими наибольшую ингибирующую активность, являются те, которые минимально уменьшают поглощение. Приготовление раствора для анализа. Для приготовления реагентов и во время опытов использовали воду сверхвысокой чистоты (с удельным сопротивлением 17 M-см или ее эквивалент). Вначале приготовили буферный раствор следующим образом: 0.2 мл 5-кратного аналитического буферного раствора (номер в каталоге А 5981) разбавили с помощью 0.8 мл сверхчистой воды. Полученный буферный раствор для дальнейшего использования держали на льду или хранили при -20 С. Затем 25 мг NADPH (номер в каталоге N6505) разбавили 1.5 мл буферного раствора. Рабочие дозы полученного раствора NADPH хранили при -20 С. В ходе всего анализа раствор субстрата HMG-CoA (номер в каталоге S7447), редуктазу HMG-CoA(номер в каталоге Н 8789) и раствор ингибитора (например, правастатина, номер в каталоге I5909) держали на льду. 1. Перед началом анализа на спектрофотометре установили кинетическую программу: 37 С, мониторинг при 340 нм, 1 мл образца, замер через каждые 20 с в течение 10 мин. 2. Добавили соответствующие объемы реакционных растворов согласно табл. 1 (1 мл анализ). Таблица 1 Объемы реакционных растворов на 1 мл образцаa) добавить буферный раствор ко всем образцам;c) добавить разбавленный раствор NADPH ко всем образцам;d) добавить раствор субстрата (HMG-CoA) ко всем образцам;f) тщательно перемешать образцы. 3. Сразу запустили кинетическую программу. Активность продукта рассчитывали по следующему уравнению:TV = общий объем реакции в мл (1 мл в кюветах); Пример 2. В следующей таблице приведены величины IC50 для конкретных соединений розувастатина по настоящему изобретению. Пример 3. Следующий пример демонстрирует эффективность соединений по данному изобретению. Пример демонстрирует эффект лечения дважды в день в течение 3-5 суток четырьмя соединениями розувастатина по настоящему изобретению и розувастатином (все по 25 мг/кг перорально) на уровень триглицеридов в плазме крыс через 16 ч после последнего приема дозы. Считается, что определение изменения в уровне триглицеридов в плазме крыс является хорошим тестом на активность редуктазы HMG СоА. 112 самцов крыс SD (Harlan) содержали в группах по 6 особей при 12-часовых циклах свет-темнота(свет включали в 07.00 ч) и свободном доступе к пище (обычная лабораторная еда) и воде. Животные массой 148-183 г были распределены по 8 особей на испытуемые группы по массе тела и тесты усредняли по всем клеткам. Четыре аналога розувастатина были приготовлены в растворе 10% PEG300/10% кремафор/80% метилцеллюлоза (0.5%) (носитель 1) с концентрацией 5 мг/мл. Использовали следующие соединения розувастатина: н-пропилацеталь розувастатин лактола (диастереомерное соотношение 2/1) (BPL001); никотиноиловый эфир н-пропилацеталя розувастатин лактола (диастереомерное соотношение 2/1)(BPL002); бензиловый эфир изопропилацеталя розувастатин лактола (BPL003); никотиноиловый эфир метилацеталя розувастатин лактола (диастереомерное соотношение 2/1)(BPL004). Приготовили препарат розувастатина с 0.5% Tween в 0.5% растворе метилцеллюлозы (носитель 2) в виде суспензии с концентрацией 5 мг/кг. Крысам вводили перорально носитель 1, один из четырех аналогов розувастатина в носителе 1 (25 мг/кг), носитель 2 или розувастатин в носителе 2 (25 мг/кг перорально) дважды в сутки в течение 3-5 дней. Через 16 ч после введения последней дозы взяли последние образцы плазмы, выдержали при -20 С и перенесли на сухом льду для анализа на уровень триглицеридов. Для каждой временной точки проводили однофакторный дисперсионный анализ (однофакторныйANOVA) и апостериорный тест Даннетта. Результаты представлены на фигуре, из которых следует, что введение розувастатина (25 мг/кг перорально) дважды в сутки в течение 3-5 дней вызывает заметное уменьшение содержания триглицеридов в плазме. Все четыре аналога розувастатина также значительно уменьшили содержание триглицеридов в плазме после введения препарата дважды в сутки в течение 3-5 дней. Все животные хорошо переносили лечение розувастатином без признаков отрицательных эффектов. Эффект от аналогов розувастатина был эквивалентен эффекту от розувастатина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольватаR5 и R6 независимо выбирают из группы, состоящей из водорода, C1-6 алкила, C1-6 галоидалкила, С 25 6 6 алкенила, арила, С 1-6 алкиларила и C1-6 алканоилгетероарила; при условии, что всегда R и R оба не являются водородом;X представляет собой -(CRaRb)m(CRa=CRb)n(CRaRb)o-, где Ra и Rb представляют собой Н, m, n и о независимо равны 0 или 1 при условии, что m + n + о не более 3; арильные группы включают ароматические кольцевые системы, содержащие 6, 7, 8, 9, 10, 11, 12, 13,14, 15 или 16 атомов углерода в кольце; гетероарильные группы включают ароматические гетероциклические кольцевые системы, содержащие 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов углерода в кольце с 1-4 гетероатомами, независимо выбранными из азота, кислорода и серы; каждая из групп R5 и R6 может быть, если это возможно химически, незамещнной или независимо замещена 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3 алкила, гало-С 1-3 алкила, С 1-3 алкокси, C1-3 галоалкокси, гидрокси и цианогруппы,для лечения болезненных состояний, которые поддаются лечению путем ингибирования фермента 3-гидрокси-3-метилглютарил-коэнзим А редуктазы (редуктазы HMG-CoA), где указанные болезненные состояния выбирают из группы, состоящей из гиперхолестеринемии, атеросклероза, гиперлипидемии,сердечно-сосудистых заболеваний, ишемической болезни сердца, инфаркта миокарда, инсульта, заболевания периферических артерий, воспаления, деменции, рака, ядерной катаракты и гипертонии. 2. Применение по п.1, где R1 представляет собой изопропил, R2 представляет -S(O)2Me, R3 представляет собой метил и R4 представляет собой 4-фторфенил. 3. Применение по любому из предшествующих пунктов, где R5 выбирают из группы, состоящей из водорода, C1-6 алкила, арила, C1-6 алкиларила и C1-6 алканоилгетероарила. 4. Применение по п.3, где R5 является водородом. 5. Применение по п.3, где R5 выбирают из группы, состоящей из -C1-алкил-Ph, -С 2-алкил-Ph, -С 3 алкил-Ph и -С 4-алкил-Ph. 6. Применение по п.5, где R5 представляет собой бензил. 7. Применение по п.3, где R5 представляет собой C1-6 алканоилпиридин. 8. Применение по п.7, где R5 представляет собой 3-метаноилпиридин. 9. Применение по любому из предшествующих пунктов, где R6 выбирают из группы, состоящей изC1-6 алкила, C1-6 галоидалкила, C2-6 алкенила и арила. 10. Применение по п.9, где R6 выбирают из группы, состоящей из C1-6 алкила, C1-6 галоидалкила и C26 алкенила. 11. Применение по п.10, где R6 выбирают из группы, состоящей из метила, этила, пропила, бутила,хлорметила, хлорэтила, хлорпропила, хлорбутила и пропилена. 12. Применение по п.9, где R6 является незамещенным арилом или арилом, замещенным 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, C1-3 алкила, гало-С 1-3 алкила, C1-3 алкокси, C1-3 галоалкокси, гидрокси и цианогруппы. 13. Применение по п.12, где R6 выбирают из группы, состоящей из C1-6 алкоксизамещенного фенила и галогензамещенного фенила. 14. Применение по п.12, где R6 выбирают из группы, состоящей из 2,4,6-трифторфенила и 2,4 диметоксифенила. 15. Применение по любому из пп.1, 2, где R5 представляет собой водород и R6 является незамещен- 10022783 ным арилом или арилом, замещенным 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, С 1-3 алкила, гало-С 1-3 алкила, С 1-3 алкокси, С 1-3 галоалкокси, гидрокси и цианогруппы. 16. Применение по любому из пп.1, 2, где R5 представляет собой незамещенный или замещенный бензил и R6 представляет собой незамещенный или замещенный C1-6 алкил, незамещенный или замещенный C2-6 алкенил или С 1-6 галоидалкил, где замещенная группа замещена 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, С 1-3 алкила, гало-С 1-3 алкила, С 13 алкокси, С 1-3 галоалкокси, гидрокси и цианогруппы. 17. Применение по любому из пп.1, 2, где R5 представляет собой C1-6 алканоилгетероарил и R6 представляет собой незамещенный C1-6 алкил или C1-6 алкил, замещенный от 1-5 группами, которые независимо в каждом случае выбирают из группы, состоящей из галогена, С 1-3 алкила, гало-С 1-3 алкила, С 13 алкокси, С 1-3 галоалкокси, гидрокси и цианогруппы. 18. Применение по любому из предшествующих пунктов, где Ra представляет собой H, Rb представляет собой Н, m = 0, n = 1 и о = 0. 19. Применение по п.1, где структуру соединения выбирают из следующих:
МПК / Метки
МПК: A61P 9/10, A61P 3/06, A61K 31/505, A61P 9/00
Метки: розувастатина, поддаются, аналогов, лечению, применение, которые, состояний, лечения, болезненных, путем, hmg-cоa, ингибирования, редуктазы
Код ссылки
<a href="https://eas.patents.su/13-22783-primenenie-analogov-rozuvastatina-dlya-lecheniya-boleznennyh-sostoyanijj-kotorye-poddayutsya-lecheniyu-putem-ingibirovaniya-hmg-coa-reduktazy.html" rel="bookmark" title="База патентов Евразийского Союза">Применение аналогов розувастатина для лечения болезненных состояний, которые поддаются лечению путем ингибирования hmg-coa редуктазы</a>
Предыдущий патент: Способ получения г-ксф человека
Следующий патент: Оптический элемент с антибликовым или отражающим покрытием, содержащим электропроводящую пленку на основе оксида олова, и способ его изготовления
Случайный патент: Способ превращения природного газа в ароматические углеводороды с электрохимическим отделением водорода и электрохимическим превращением водорода в воду












