Соединения-аналоги 6-окса-8α-стероидных эстрогенов, способ их получения и их применение
Номер патента: 19708
Опубликовано: 30.05.2014
Авторы: Морозкина Светлана Николаевна, Шавва Александр Григорьевич, Пизон Ульрих
Формула / Реферат
1. Соединение, выбранное из
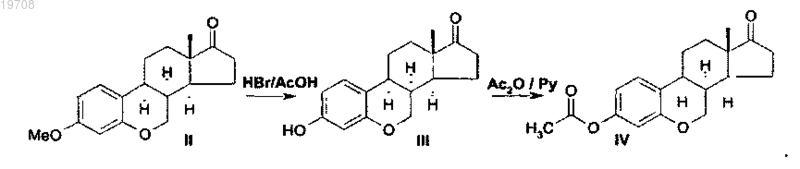
соединения формулы IV
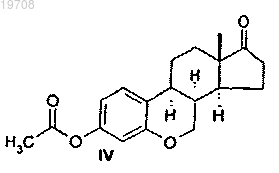
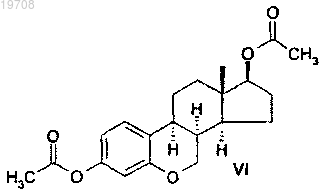
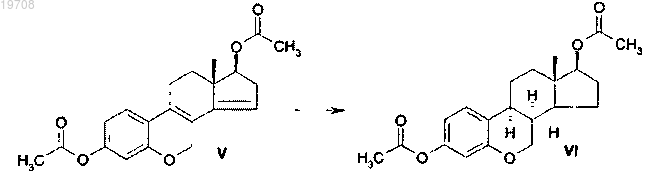
соединения формулы VI
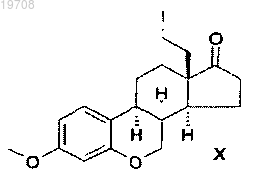
соединения формулы X
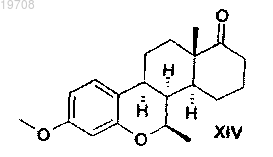
соединения формулы XIV
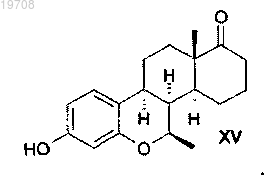
и соединения формулы XV
2. Способ получения ацетата 6-окса-8α-эстрона формулы IV, включающий каталитическую гидрогенизацию 3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаен-17-она формулы I с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой:
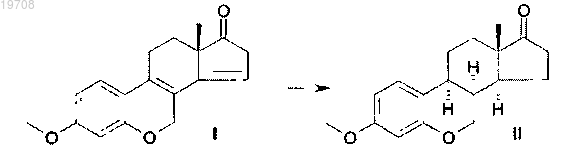
с последующим ацилированием метилового эфира 6-окса-8α-эстрона формулы II по следующей схеме:
3. Способ получения диацетата 6-окса-8α-эстрона формулы VI, включающий каталитическую гидрогенизацию 3,17β-диацетокси-6-оксаэстра-1,3,5(10),8,14-пентаена формулы V с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой:
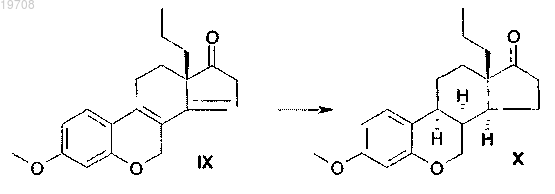
4. Способ получения 18-этил-3-метокси-6-окса-8α-эстра-1,3,5(10)-триен-17-она формулы X, включающий каталитическую гидрогенизацию 18-этил-3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаена формулы IX с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой:
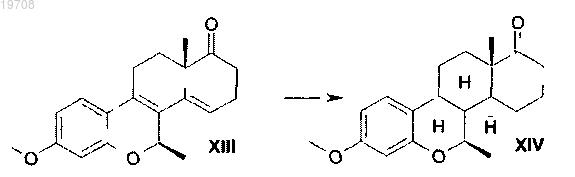
5. Способ получения метилового эфира 7β-метил-D-гомо-6-окса-8α-эстрона формулы XIV, включающий каталитическую гидрогенизацию 3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаен-17-она формулы XIII с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой:
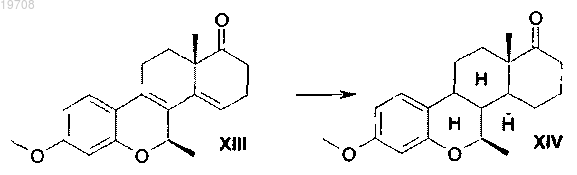
6. Способ получения 7β-метил-D-гомо-6-окса-8α-эстрона формулы XV, включающий каталитическую гидрогенизацию 7β-метил-D-гомо-6-окса-8α-эстра-1,3,5(10)-пентаена формулы XIII с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой:
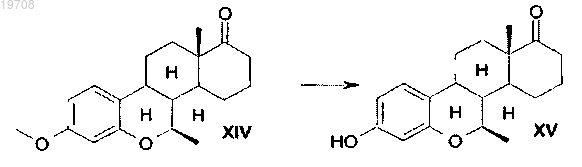
с последующим воздействием на метиловый эфир 7β-метил-D-гомо-6-окса-8α-эстрона формулы XIV HBr и АсОН при использовании обратного холодильника в соответствии со следующей схемой:
7. Применение соединения по п.1 для лечения или предупреждения симптомов менопаузы, воспаления, дисменореи и дисфункционального маточного кровотечения, остеопороза, гирсутизма и/или сердечно-сосудистого заболевания.
8. Применение соединения по п.1 для лечения или предупреждения заболеваний, связанных с функционированием эстрогена, метаболического синдрома, поражающего кости, хрящи или влияющего на вес тела, рака молочной железы, матки или предстательной железы, воспалительных заболеваний, выбранных из ревматоидного артрита, язвенного колита, болезни Крона, септицемии или эндометриоза, сердечно-сосудистого заболевания, нарушения когнитивной функции, церебральных дегенеративных расстройств, рестеноза, гинекомастии, пролиферации клеток гладкой мускулатуры кровеносных сосудов и недержания у млекопитающего.
9. Применение соединения по п.1 для лечения или предупреждения постклимактерического остеопороза, повышенного уровня LDL-холестерина, нарушения когнитивной функции, дегенеративных мозговых расстройств, эндометриоза, метаболического синдрома и/или рака, выбранного из рака молочной железы, матки и/или предстательной железы у млекопитающего.
Текст
СОЕДИНЕНИЯ-АНАЛОГИ 6-ОКСА-8-СТЕРОИДНЫХ ЭСТРОГЕНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ Изобретение относится к области новых 6-окса-8-стероидных аналогов эстрогена и к синтезу этих новых биологически активных стероидных аналогов эстрогена, а именно к приготовлению 6 окса-8-стероидных эстрогенов и их применению в качестве модуляторов эстрогенных рецепторов. Эти новые аналоги эстрогенов представляют собой лиганды для эстрогенных рецепторов и,как таковые, могут быть полезными в лечении и профилактике ряда патологических состояний,связанных с функционированием эстрогенов. Эти состояния включают костные и хрящевые расстройства, повышенный уровень LDL-холестерина, сердечно-сосудистые заболевания,нарушение когнитивной функции, дегенеративные мозговые расстройства, эндометриоз и другие типы воспаления, метаболический синдром и рак, в особенности молочной железы, матки и предстательной железы. Пизон Ульрих (DE), Шавва Александр Григорьевич, Морозкина Светлана Николаевна (RU) Дементьев В.Н. (RU) Изобретение относится к области новых 6-окса-8-стероидных аналогов эстрогена и к синтезу этих новых биологически активных стероидных аналогов эстрогена, а именно к приготовлению 6-окса-8 стероидных эстрогенов и их применению в качестве модуляторов эстрогенных рецепторов. Эти новые аналоги эстрогенов представляют собой лиганды для эстрогенных рецепторов и, как таковые, могут быть полезными в лечении и профилактике ряда патологических состояний, связанных с функционированием эстрогенов. Эти состояния включают костные и хрящевые расстройства, повышенный уровень LDLхолестерина, сердечно-сосудистые заболевания, нарушение когнитивной функции, дегенеративные мозговые расстройства, эндометриоз и другие типы воспаления, метаболический синдром и рак, в особенности молочной железы, матки и предстательной железы. Предпосылки создания изобретения Природные и синтетические эстрогены имеют широкое терапевтическое применение, включая облегчение симптомов менопаузы, лечение рака молочной железы и рака предстательной железы, лечение разных типов воспаления, лечение дисменореи и дисфункциональных маточных кровотечений, лечение остеопороза, лечение гирсутизма и профилактику сердечно-сосудистых заболеваний. Поскольку эстроген представляет большую терапевтическую ценность, имеется большой интерес к синтезу и изготовлению искусственных аналогов эстрогена или к обнаружению других соединений, которые имитируют эстрогеноподобное поведение в тканях, чувствительных к эстрогенам. Например, эстрогеноподобные соединения были бы полезны для лечения и профилактики симптомов менопаузы, таких как остеопороз. Только в США остеопорозом поражены приблизительно от 20 до 25 млн женщин постклимактерического возраста. Теоретически было постулировано, что быстрая потеря костной массы у этих женщин происходит вследствие прекращения выработки эстрогена в яичниках. Поскольку исследования показали, что эстроген замедляет потерю костной массы вследствие остеопороза, заместительная терапия эстрогеном является общепризнанным способом лечения постклимактерического остеопороза. В дополнение к костной массе эстроген оказывает влияние на биосинтез холестерина и состояние сердечно-сосудистой системы. Статистически, распространение сердечно-сосудистых заболеваний примерно равно у женщин постклимактерического возраста и пожилых мужчин, однако частота сердечнососудистых заболеваний у женщин предклимактерического возраста намного меньше, чем у мужчин соответствующей возрастной группы. Поскольку у женщин постклимактерического возраста имеется недостаточность эстрогена, считается, что эстроген играет благотворную роль в предупреждении сердечнососудистых заболеваний. Механизм не очень понятен, но фактические данные указывают на то, что эстроген способен повышающим образом регулировать холестериновые рецепторы фракции липопротеинов низкой плотности (LDL) в печени, способствуя удалению избыточного холестерина. У женщин постклимактерического возраста, получающих заместительную терапию эстрогеном, наблюдается возвращение концентрации липидов к тому уровню, который ассоциируется с предклимактерическим состоянием. Таким образом, заместительная терапия эстрогеном может быть эффективным способом лечения такого заболевания. Однако побочные эффекты, связанные с длительным применением эстрогена, ограничивают эту альтернативу лечения. Другими заболеваниями, поражающими женщин постклимактерического возраста, являются рак молочной железы и рак матки. В качестве химиотерапии для лечения пациентов раком молочной железы часто используются антиэстрогенные соединения, например тамоксифен. Тамоксифен, двойственный антагонист и агонист эстрогенных рецепторов, полезен при лечении эстрогензависимого рака молочной железы. Однако лечение тамоксифеном далеко не идеально, поскольку агонистическое поведение тамоксифена усиливает его нежелательные побочные эстрогенные эффекты. Например, тамоксифен и другие соединения, которые способствуют функции эстрогенных рецепторов, проявляют тенденцию к увеличению выработки раковых клеток в матке. Лучшей терапией для раков такого типа было бы применение антиэстрогенного соединения, которое проявляет пренебрежимо малые свойства агониста или вообще не проявляет их. Несмотря на то что эстроген может быть полезен при лечении таких видов патологии, как потеря костной ткани, повышенный уровень липидов и рак, длительная терапия эстрогеном была связана с развитием ряда заболеваний, включая увеличение риска рака матки и рака эндометрия. Эти и другие побочные эффекты заместительной терапии эстрогеном неприемлемы для многих женщин, что существенно ограничивает ее применение. В дополнение к женщинам постклимактерического возраста пользу от антиэстрогенных соединений могут также получить мужчины, страдающие раком предстательной железы. Рак предстательной железы часто чувствителен к гормональным воздействиям, причем стимуляция андрогена способствует росту опухоли, тогда как супрессия андрогена замедляет рост опухоли. Введение эстрогена полезно при лечении и сдерживании рака предстательной железы, поскольку введение эстрогена понижает уровень гонадотропина и, следовательно, уровень андрогена. Было обнаружено, что эстрогенные рецепторы имеют две формы: ER и ER. Лиганды связываются с этими двумя формами избирательно, причем каждая форма имеет разную тканевую специфичность к связыванию лигандов. Таким образом, можно иметь избирательные соединения для ER или ER и, следовательно, предоставлять определенную степень тканевой специфичности конкретному лиганду. Поэтому в данной области техники нужны соединения, способные вызывать такие же положительные реакции, как и природные эстрогены, но при этом лишенные побочных эффектов. Также нужны эстрогеноподобные соединения, которые приводят в действие избирательные эффекты в разных тканях организма. Изобретение относится к новым искусственным стероидным аналогам эстрогена, а именно к 6-окса 8-стероидным эстрогенам и к новому способу изготовления этих соединений. Соединения, предлагаемые настоящим изобретением, обладают противовоспалительной активностью, антипролиферативной активностью, остеопротективной активностью и активностью по снижению холестерина. В дополнение к этому, новые синтетические аналоги можно применять в качестве предшественников ингибиторов сульфатазы эстрона и модуляторов эстрогенных рецепторов, то есть они могут быть полезными при лечении ряда патологических состояний, связанных с функционированием эстрогена. Сущность изобретения Настоящее изобретение относится к соединениям, выбранным из соединения формулы IV Настоящее изобретение также относится к способам получения соединений, предлагаемых этим изобретением. Настоящее изобретение также относится к применению соединений, предлагаемых этим изобретением, для лечения или предупреждения симптомов менопаузы, воспаления, дисменореи и дисфункционального маточного кровотечения, остеопороза, гирсутизма и/или сердечно-сосудистого заболевания. Настоящее изобретение также относится к применению соединений, предлагаемых этим изобретением, для лечения или профилактики заболеваний, связанных с функционированием эстрогена, метаболического синдрома, поражающего кости, хрящи или влияющего на вес тела, рака молочной железы,матки или предстательной железы, воспалительных заболеваний, таких как ревматоидный артрит, язвенный колит, болезнь Крона, септицемия или эндометриоз, сердечно-сосудистого заболевания, нарушения когнитивной функции, церебральных дегенеративных расстройств, рестеноза, гинекомастии, пролиферации клеток гладкой мускулатуры кровеносных сосудов и недержания у нуждающегося в этом млекопитающего. Настоящее изобретение также относится к применению соединений, предлагаемых этим изобретением, для лечения или предупреждения постклимактерического остеопороза, повышенного уровня LDLхолестерина, нарушения когнитивной функции, дегенеративных мозговых расстройств, эндометриоза,метаболического синдрома и/или рака, выбранного из рака молочной железы, матки и/или предстательной железы у млекопитающего. Подробное описание изобретения Настоящее изобретение относится к соединениям, полезным в качестве модуляторов эстрогенных рецепторов. Соединения, предлагаемые настоящим изобретением, описаны следующими химическими формулами: соединения формулы IV Примером осуществления изобретения является способ вызова эффекта модулирования эстрогенных рецепторов у нуждающегося в этом млекопитающего, причем указанный способ включает введение млекопитающему терапевтически эффективного количества любого из описанных выше соединений или любой из их фармацевтических композиций. Характерные соединения, предлагаемые настоящим изобретением, типично проявляют субмикромолярную аффинность к альфа и/или бета-эстрогенным рецепторам. Таким образом, соединения, предлагаемые этим изобретением, полезны при лечении млекопитающих, которые страдают заболеваниями, связанными с функционированием эстрогена. Фармакологически эффективные количества соединений, включая их фармацевтически эффективные соли, вводят млекопитающему для лечения заболеваний, связанных с функционированием эстрогена. Один аспект осуществления изобретения представлен способом, в котором эффект модулирования эстрогенных рецепторов представляет собой антагонистический эффект. Вариант осуществления изобретения представлен способом, в котором эстрогенным рецептором является рецептор ER. Второй вариант осуществления изобретения представлен способом, в котором эстрогенным рецептором является рецептор ER. Третий вариант осуществления изобретения представлен способом, в котором эффект модулирования эстрогенных рецепторов представляет собой смешанный антагонистический эффект для рецепторов ER и ER. Второй аспект осуществления изобретения представлен способом, в котором эффект модулирования эстрогенных рецепторов представляет собой агонистический эффект. Вариант осуществления изобретения представлен способом, в котором эстрогенным рецептором является рецептор ER. Второй вариант осуществления изобретения представлен способом, в котором эстрогенным рецептором является рецептор ER. Третий вариант осуществления изобретения представлен способом, в котором эффект модулирования эстрогенных рецепторов представляет собой смешанный агонистический эффект для рецепторов ER и ER. Еще один аспект осуществления изобретения представляет собой способ лечения или предупреждения постклимактерического остеопороза, повышенного уровня холестерина фракции LDL, сердечнососудистых заболеваний, нарушения когнитивной функции, церебральных дегенеративных расстройств,эндометриоза и других типов воспаления, метаболического синдрома и рака, в особенности молочной железы, матки и предстательной железы у нуждающегося в этом млекопитающего, причем указанный способ заключается во введении млекопитающему терапевтически эффективного количества любого из описанных выше соединений или любой их фармацевтической композиции. Соединения, предлагаемые настоящим изобретением, можно применять в комбинации с другими средствами для лечения патологических состояний, опосредованных эстрогеном. Индивидуальные компоненты таких комбинаций можно вводить по отдельности и в разное время по ходу курса лечения либо одновременно в разделенных на части или единых лекарственных формах. Таким образом, настоящее изобретение следует понимать как охватывающее все такие схемы одновременного или попеременного лечения, а термин "введение" следует интерпретировать соответствующим образом. Следует понимать,что диапазон комбинаций соединений, предлагаемых этим изобретением, с другими средствами, полезными для лечения патологических состояний, опосредованных эстрогеном, в принципе, включает любую комбинацию с любой фармацевтической композицией, полезной для лечения заболеваний, связанных с функционированием эстрогена. Термины, использованные в этом описании изобретения, как правило, имеют свое обычное значение в данной области знаний как в контексте изобретения в целом, так и в специфическом контексте применительно к употреблению каждого термина. Некоторые термины обсуждаются ниже или в других местах данного описания изобретения, чтобы дать дополнительные разъяснения специалисту-практику в описании композиций и способов, имеющих отношение к изобретению, а также руководящие указания по их изготовлению и применению. При использовании в этом документе термин "композиция" предназначен для охвата продуктов,содержащих заданные ингредиенты в определенном количестве, а также любой продукт, который прямым или непрямым образом получается в результате комбинации указанных ингредиентов в заданном количестве. Соединения, предлагаемые настоящим изобретением, можно вводить в таких пероральных лекарственных формах, как таблетки, капсулы (каждая из которых включает рецептуры с длительным непрерывным или рассчитанным по времени высвобождением), пилюли, порошки, гранулы, эликсиры,тинктуры, суспензии, сиропы и эмульсии. Кроме того, их можно вводить внутривенно (болюсной инъекцией или вливанием), внутрибрюшинно, топически (например, в виде глазных капель), подкожно, внутримышечно или чрескожно (например, в виде бляшек), то есть используя все перечисленные лекарственные формы, хорошо известные среднему специалисту в области фармацевтической техники. Схему введения доз соединений, предлагаемых настоящим изобретением, выбирают, принимая во внимание многие факторы, включая тип пациента, его биологическую видовую принадлежность, возраст, вес, пол и медицинское состояние, тяжесть заболевания, подлежащего лечению, способ введения лекарства, функцию почек и печени у пациента, а также конкретное соединение или его соль, которые применяются в конкретном случае. Врач с обычным уровнем компетентности как клиницист, так и ветеринар, может достаточно легко определить и предписать пациенту эффективное количество лекарства,необходимое для предупреждения заболевания/патологического состояния, противодействия ему или задержки его прогрессирования. Пероральные дозы, предлагаемые настоящим изобретением, при использовании лекарства для достижения нужного эффекта будут варьироваться в приблизительном диапазоне от 0,01 до 100 мг/кг/день,предпочтительно от 0,01 до 10 мг/кг/день и наиболее предпочтительно от 0,1 до 5,0 мг/кг/день. Предпочтительной для перорального введения является лекарственная форма таблеток, содержащих 0,01, 0,05,0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100 и 500 мг активного ингредиента для подбора дозы пациенту, подлежащему лечению, в зависимости от симптомов. В типичном случае медикамент содержит приблизительно от 0,01 до 500 мг активного ингредиента, предпочтительно приблизительно от 1 до 100 мг активного ингредиента. При внутривенном вливании с постоянной скоростью наиболее предпочтительные дозы будут варьироваться в приблизительном диапазоне от 0,1 до 10 мг/кг в 1 мин. Соединения, предлагаемые настоящим изобретением, преимущественно можно вводить ежедневно в одной суточной дозе, либо общую суточную дозу можно вводить дробными частями два, три или четыре раза в день. Кроме того, предпочтительные соединения, предлагаемые настоящим изобретением, можно вводить в интраназальной форме посредством топического применения подходящих интраназальных наполнителей, а также чрескожными путями, используя те формы чрескожных бляшек, накладываемых на поверхность кожи, которые хорошо известны среднему специалисту в данной области. При использовании чрескожной системы доставки введение дозы, разумеется, носит более длительный и непрерывный характер, чем перемежающееся поступление лекарства при использовании других схем терапии. В способах, рассматриваемых настоящим изобретением, соединения, подробно описанные в этом документе, могут образовывать активный ингредиент и типично их вводят в смеси с подходящими фармацевтическими разбавителями, наполнителями или носителями (упоминаемыми в этом документе под собирательным названием материалы "носители"), которые соответствующим образом выбирают с учетом намеченной формы введения, то есть пероральными таблетками, капсулами, эликсирами, сиропами и т.д., а также в соответствии с общепринятыми стандартами фармацевтической практики. Например, при пероральном введении в форме таблетки или капсулы активный компонент лекарства можно комбинировать с такими пероральными нетоксичными и фармацевтически приемлемыми инертными носителями, как лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, стеарат магния, вторичный кислый фосфат кальция, сульфат кальция, маннит, сорбит и т.д., а при пероральном введении в жидкой форме компоненты лекарства можно комбинировать с любыми пероральными нетоксичными и фармацевтически приемлемыми инертными носителями, такими как этанол, глицерин, вода и т.д. Кроме того, по желанию или при необходимости в смесь также можно включить подходящие связующие вещества, смазки, дезинтегрирующие агенты и красители. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы,природные и синтетические камеди (смолы), такие как гуммиарабик, трагакант или альгинат натрия,карбоксиметилцеллюлозу, полиэтиленгликоль, воски и т.д. Смазки, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.д. Дезинтегрирующие вещества включают (не ограничиваясь ими) крахмал, метилцеллюлозу,агар, бентонит, ксантановую камедь и т.д. Соединения, предлагаемые настоящим изобретением, также можно вводить в липосомных системах доставки, таких как мелкие однослойные везикулы, крупные однослойные везикулы и многослойные везикулы. Липосомы можно формировать из ряда фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединения, предлагаемые настоящим изобретением, также можно доставлять в организм, используя в качестве индивидуальных носителей моноклональные антитела, с которыми сцеплены молекулы этих соединений. Соединения, предлагаемые настоящим изобретением, также можно соединять с растворимыми полимерами, играющими роль наводимых носителей лекарств. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный остатками пальмитоила. Кроме того, соединения, предлагаемые настоящим изобретением, можно соединять с классом биологически разрушаемых полимеров, полезных для достижения контролируемого высвобождения лекарства, например с полимолочной кислотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксибутировой кислотой, полиортоэфирами, полиацетатами, полигидропиранами, полицианоакрилатами и поперечно сшитыми или амфипатическими блок-сополимерами гидрогелей. Соединения, предлагаемые настоящим изобретением, также можно доставлять в организм, используя многофункциональные наночастицы, такие как это описано в патентном документе WO 2007/093451[10]. Термин "пациент" при использовании в этом документе относится к млекопитающим, включая, но,не ограничиваясь ими, приматов, в том числе обезьян и человека. Термин "предупреждение" в контексте настоящего изобретения означает избавление от эффектов болезненного состояния или причинного фактора болезни вследствие введения агента из числа тех, что раскрыты в этом изобретении. Аналогичным термином в этом контексте является "профилактика". Кроме того, термин "профилактически эффективное количество" относится к такому количеству соединения,предлагаемого изобретением, которое необходимо для предупреждения заболевания. При использовании в этом документе термины "лечение", "врачевание" и т.п. относятся к получению желательного фармакологического и/или физиологического эффекта. Такой эффект может быть профилактическим (в смысле полного или частичного предупреждения одного или более из указанных заболеваний либо их симптомов) или терапевтическим (в смысле частичного или полного излечения заболевания и/или неблагоприятных эффектов, свойственных заболеванию). Термин "лечение" при использовании в этом документе охватывает любое лечение заболевания у млекопитающего, особенно у человека, и включает (а) предупреждение заболевания, которое могло бы развиться у субъекта в результате контакта с патогеном, (b) подавление заболевания, т.е. приостановка его развития, (с) облегчение заболевания, т.е. вызов его регресса. Однако "терапевтическое" и "профилактическое" лечение следует рассматривать в их самом широком контексте. Термин "терапевтический (ая, ое)" не обязательно означает, что субъект вылечивается до полного выздоровления. Подобным образом, термин "профилактический (ая, ое)" не обязательно означает, что у субъекта в конечном итоге не разовьются симптомы, которые связаны с заболеваниями, упоминаемыми в контексте настоящего изобретения. В соответствии с этим терапевтическое и профилактическое лечение включают облегчение симптомов конкретного патологического состояния, а также предупреждение или в других отношениях уменьшение риска развития конкретного патологического состояния. Термин "профилактический (ая,-5 019708 ое)" можно рассматривать в смысле уменьшения тяжести или отсрочки начала конкретного патологического состояния. Термин "терапевтический (ая, ое)" также относится к снижению тяжести существующего патологического состояния. Термин "побочный эффект" при использовании в этом документе относится к нежелательному отрицательному последствию, связанному с введением фармацевтических соединений, упоминаемых в этом описании изобретения. Следовательно, термин "побочный эффект" используется синонимически с термином "неблагоприятная реакция на лекарство", тогда как положительные побочные эффекты не входят в смысловое значение термина. При использовании в этом документе термин "носитель" включает любые (и все) растворители,дисперсионные среды, транспортировщики, покрытия, разбавители, антибактериальные и противогрибковые агенты, изотонические и замедляющие всасывание агенты, буферы, транспортирующие растворы,суспензии, коллоиды и т.д. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области знаний. Применение таких традиционных сред или агентов в терапевтических композициях рассматривается кроме тех случаев, когда среда или агент несовместимы с активным ингредиентом. В композиции также могут быть включены добавочные активные ингредиенты. Синтез. Настоящее изобретение также относится к процессам изготовления 6-окса-8-стероидных аналогов эстрогена, которые пригодны для массового производства. Синтез достигался при использовании катализатора Pd/C в THF (тетрагидрофуране) для гидрогенизации под атмосферным давлением. Эта система гидрогенизации катализатор-растворитель была эффективно использована для синтеза 6-оксаэстра 1,3,5(10),8,14-пентаенов. Субстраты для каталитической гидрогенизации были синтезированы в соответствии со схемой Торгова-Ананченко [3-5]. Существуют две хорошо известные крупномасштабные процедуры для синтеза 6-окса-8 стероидных эстрогенов: каталитическая гидрогенизация 6-оксаэстра-1,3,5(10),8,14-пентаенов, катализированная Pd/C [1] (прототип) и катализированная Ni/Ra [2]. Основной недостаток первого подхода заключается в низкой стереоспецифичности реакции. Таким образом, рацемический метиловый эфир 6 окса-8-эстрона получают из соответствующего эстрапентаена с выходом 15%, а метиловый эфир 18 метил-6-окса-8-эстрона - с выходом 13% (в этом случае еще одним недостатком является многоэтапная схема синтеза) [1]. Недостатком второго способа является необходимость использования высокого давления, а также необходимость использования бензола высокой степени очистки, из-за чего себестоимость целевого стероида становится очень высокой. В дополнение к этому, второй способ также имеет недостатки, связанные с дополнительным этапом окисления продуктов гидрогенизации. Новые соединения, предлагаемые настоящим изобретением, можно изготовить в соответствии с процедурой, представленной в последующих схемах и примерах, используя подходящие материалы, что далее проиллюстрировано последующими специфическими примерами. Однако соединения, проиллюстрированные в примерах, не следует воспринимать как единственный род соединений, относящихся к настоящему изобретению. Приведенные ниже примеры дополнительно иллюстрируют подробности изготовления соединений, предлагаемых настоящим изобретением. Компетентный специалист легко поймет, что для изготовления этих соединений можно использовать известные вариации условий и процессов описанных здесь препаративных процедур. Все температурные показатели приведены в градусах Цельсия, если специально не указано иное. 10% катализатор Pd/C, растворители и реактивы (метанол, хлороформ, тетрагидрофуран, уксусный ангидрид, уксусная кислота, пиридин, HCl и т.д.) были закуплены у компании Acros Organics и использовались без дополнительной очистки. Урсоловая кислота была выделена из Arcostaphylos та ursi (L.) и Sorbus aucuparia L. Точки плавления были определены с помощью прибора Boetius и не подвергались коррекции. Спектры ЯМР (ядерного магнитного резонанса) были получены при помощи спектрометра Bruker DPX300 (300 МГц для спектров ЯМР 1 Н и 75 МГц для спектров ЯМР 13 С). Элементные анализы были проведены на приборе Hewlett Packard 185B. Анализы ТСХ (тонкослойной хроматографии) были проведены на планшетах Silufol (Kavalier) и Alugram (Machereynagel). Пример 1. Метиловый эфир 6-окса-8-эстрона (II) Соединение II было синтезировано с применением 10% Pd/C (300 мг), добавленного к раствору 3 метокси-6-оксаэстра-1,3,5(10),8,14-пентаен-17-она I (1 г) в 50 мл THF. Прогрессирование гидрогенизации мониторировали измерениями излучения в спектре УФ. Реакцию останавливали после исчезновения характерной ароматической длины волны. Затем катализатор отфильтровывали и отмывали с применениемTHF (50 мл). Органические слои объединяли, а растворитель удаляли в вакууме. Остаток кристаллизовали из смеси CHCl3 - МеОН. Выход целевого стероида II составил 64% (0,65 г), точка плавления 149-150 С. ЯМР 1 Н в CDCl3 (, ppm) отразил следующие результаты: 0,93 s (3H, С 13-СН 3), 1,43 (1H, С 12-Н),1,68 (1H, С 11-Н), 1,84 (1H, С 12-Н), 1,90 (2 Н, С 15-Н и С 15-Н), 1,96 (1H, С 14-Н), 2,00 (1 Н, С 11-Н), 2,18(1H, С 7-Н), 6,38 (1H, С 4-Н), 6,49 (1 Н, С 2-Н), 6,99 (1H, С 1-Н). Мы получили следующий выход в %: С 75,46, Н 7,79. С 18 Н 22 О 3. Расчетные %: С 75,50, Н 7,74. Мы получили соединение, полезное для синтеза других производных, например, таких как это показано в примере 2. Пример 2. Ацетат 6-окса-8-эстрона (IV) Соединение IV было синтезировано с применением раствора 3-метокси-6-окса-8-эстра-1,3,5(10)триен-17-она II (573 мг) в HBr и АсОН (20 мл, 3/7, об./об.) под рефлюксом в течение 2 ч при 70 С. Реакционную смесь заливали в воду, осадок отфильтровывали и прополаскивали водой до достижения нейтрального рН. Продукт высушивали на воздухе. Выход продукта после гидролиза составлял 440 мг (80,5%). После этого соединение использовали на следующем этапе синтеза без какой-либо дополнительной очистки. Указанное соединение растворяли в 10 мл смеси пиридин/уксусный ангидрид (1:9 об.), выдерживали при 100 С 2,5 ч, а затем оставляли на ночь при комнатной температуре. Осадок отфильтровывали,промывали гексанами и высушивали в вакууме. Конечный выход целевого стероида IV составил 230 мкг (37%), точка плавления 135-138 С. ЯМР 1 Н в CDCl3 (, ppm) отразил следующие результаты: 0,95 s (3H, С 18-Н), 1,46 td (1H, J1=3,6 Гц,J2=13 Гц, С 12-Н), 1,69-2,04 m (6 Н, С 11-Н, С 11-Н, С 12-Н, С 15-Н, С 15-Н, С 16-Н), 2,29 s (3 Н, С 3-ОСН 3),2,14-2,34 m (1H, С 14-Н), 2,24 d (1H, J=8 Гц, С 16-Н), 2,55 m (1H, С 8-Н), 2,66 m (1H, С 9-Н), 4,09 t (1H, J=11 Гц, С 7-Н), 4,25 dd (1H, J1=2 Гц, J2=8 Гц, С 7-Н), 6,58 d (1 Н, J=2 Гц, С 4-Н), 6,64 dd (1H, J1=2 Гц, J2=8 Гц,С 2-Н), 7,10 d (1H, J=8 Гц, С 1-Н). ЯМР 13 С в CDCl3 (, ppm) отразил следующие результаты: 16,95 (С 18), 21,49 (С 15), 21,80 (СН 3 С=О),28,27 (С 11), 32,08 (С 12), 36,01 (С 16), 37,27 (С 9), 37,59 (С 8), 46,92 (С 14), 47,07 (С 13), 64,79 (С 7), 110,55 (С 1),114,30 (С 2), 124,88 (С 10), 130,61 (С 4), 150,03 (С 5), 155,37 (С 3), 169,89 (Ас), 219,74 (С 17=О). Мы получили следующий выход в %: С 72,49, Н 7,09. С 19 Н 22 О 4. Расчетные %: С 72,59, Н 7,05. Пример 3. Диацетат 6-окса-8-эстрона (IV) Соединение VI было синтезировано с применением 10% Pd/C на химически чистом угле (200 мг),добавленного к раствору 3,17-диацетокси-6-оксаэстра-1,3,5(10),8,14-пентаена V (1 г) в 50 мл THF. Гидрогенизацию проводили в условиях, описанных в примере 1. Катализатор отфильтровывали и отмывали с применением THF (10 мл). Растворитель удаляли в вакууме, а остаток кристаллизовали из МеОН. Выход целевого соединения составил 0,51 г (50%), точка плавления 158-160 С. ЯМР 1 Н в CDCl3 (, ppm) отразил следующие результаты: 7,07, 1H, d, J=8,0 Гц (Н-C1), 6,61, 1 Н, dd,J=2,2 Гц, J=8,0 Гц (Н-С 2), 6,54, 1H, d, J=2,2 Гц (Н-С 4); 4,63, 1 Н, t, J=8,7 Гц (Н-С 17), 4,25-4,15, 1H, m (НС 7), 4,1-4,0, 1H, m (Н-С 7), 2,65-1,3, 11 Н, m (Н-С 8, Н-С 9, Н 2-С 11, Н 2-С 12, Н-С 14, Н 2-С 15, Н 2-С 16), 2,26, 3 Н, s(H3CCOO-C3), 205, 3 Н, s (Н 3 ССОО-С 17), 0,84, 3 Н, s (Н 3-С 18). ЯМР 13 С в CDCl3 (, ppm) отразил следующие результаты: 171,2 (С(=О)-ОС 17), 169,7 (С(=О)-ОС 3),155,3 (С 3), 149,7 (С 5), 130,4 (С 1), 125,1 (С 10), 113,8 (С 2), 110,2 (С 4), 82,2 (С 17), 64,4 (С 7), 45,5, 45,5, 41,6,37,5, 36,9, 36,1, 28,2, 27,0, 22,4, 21,3, 13,8 (С 18). Мы получили следующий выход в %: С 70,26, Н 7,40. С 21 Н 26 О 5. Расчетные %: С 70,37, Н 7,31. Соединение X было синтезировано с применением 10% Pd/C на химически чистом угле (100 мг),добавленного к раствору 18-этил-3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаена IX (1 г) в THF (40 мл). Гидрогенизацию проводили в условиях, описанных в примере 1. Катализатор отфильтровывали и отмывали THF (10 мл). Растворитель удаляли в вакууме, а остаток кристаллизовали из МеОН. Точка плавления 146,5-147,5 С. Соединение XIV было синтезировано с применением 10% Pd/C (0,3 г), добавленного к раствору 7 метил-D-гомо-6-окса-8-эстра-1,3,5(10)-пентаена XIII (1 г) в THF (100 мл). Гидрогенизацию проводили в условиях, описанных в примере 1. Целевое соединение (0,55 г, 54%) было получено после сепарации аналога, точка плавления 149-151 С.MS, m/z (I, %): 314 (100), 299 (9), 285 (6), 271 (5), 257 (5), 343 (7), 229 (5), 215 (23), 189 (11), 176 (17),175 (22), 161 (45), 150 (22), 137 (21). ЯМР 13 С в CDCl3 (, ppm) отразил следующие результаты: 18,69, 19,47, 24,50, 26,37, 27,01, 32,02,34,49, 37,30, 40,76, 44,80, 47,10, 55,08, 70,96, 102,34, 107,35, 118,34, 129,13, 152,87,158,86, 214,90. Мы получили следующий выход в %: С 76,29, Н 8,36. С 20 Н 26 О 3. Расчетные %: С 76,40, Н 8,24. Пример 6. 7-Метил-D-гомо-8-эстрон (XV) Соединение XV было синтезировано с применением раствора 3-метокси-7-этил-D-гомо-6-окса-8 эстра-1,3,5(10)-триен-17-она XIV (103 мг) в HBr и АсОН (3 мл, 3/7, об./об.) под рефлюксом в течение 2 ч при 70 С. Реакционную смесь заливали в воду, осадок отфильтровывали и прополаскивали водой до достижений нейтрального рН. Продукт высушивали на воздухе. Выход продукта после гидролиза составлял 64 мг (65%). Точка плавления 251-253 С. ЯМР 1H в CDCl3 (, ppm) отразил следующие результаты: 1,14 s (3H, С 13-СН 3), 1,40 d (7 Гц, 3 Н),1,83-2,14 m (10 Н), 2,5-2,7 m (3 Н), 4,35-4,40 m (1H), 6,06 d (2 Гц, 1H), 6,23 dd (6 Гц, 2 Гц, 1H), 6,89 d (6 Гц,1H), 8,79 (1H, ОН). Биологические свойства. 6-Окса-8-стероидные аналоги эстрогена, изготовленные способами, которые описаны в разделе"Синтез", являются модуляторами эстрогенных рецепторов, то есть обладают остеопротективной активностью и активностью по снижению холестерина. Эти аналоги также обладают противовоспалительной и антипролиферативной активностями. Кроме того, такие аналоги представляют большой интерес как предшественники для производства соединений с другими биологическими свойствами. Так, например,ингибитор сульфатазы эстрона был получен из соединения XV. Этот ингибитор обладает лечебным потенциалом при гормонально зависимом раке молочной железы [7, 8]. Полезность соединений, предлагаемых настоящим изобретением, можно без затруднений определить способами, хорошо известными среднему специалисту в данной области знаний. Эти способы включают, но не ограничиваясь ими, следующее: анализ связывания эстрогенных рецепторов,анализ на крысах с удаленными яичниками, анализ на снижение уровня холестерина у крыс,анализ эстрогензависимой пролиферации клеток MCF-7, крысиная модель эндометриоза. Примеры биологических свойств 6-окса-8-стероидных аналогов эстрогена приведены в следующих разделах и таблицах. Пример 1. Остеопротективные свойства и способность снижать уровень холестерина. 6-Окса-8-стероидные аналоги эстрогена обладают остеопротективной активностью и активностью по снижению уровня холестерина. Биологические свойства 6-окса-8-стероидных аналогов IV, XIV иXV в этом отношении в сводном виде представлены как примеры в табл. 1-5. Исследование биологических свойств стероидов было выполнено на ложнооперированных крысах и на крысах с удаленными яичниками (Sprague Dawley) при соблюдении следующих условий: соединения IV, XIV и XV в оливковом масле давались ежедневно в течение 35 дней [6]. Таблица 1 Свойства ацетата 6-окса-8-эстрона (соединение IV) у крыс с удаленными яичниками по воздействию на матку, бедро и уровень холестерина в сыворотке В качестве контрольного лекарства при лечении был использован 17-этинилэстрадиол (ЕЕ). Типичные аналоги эстрогена, имеющие утеротропный эффект, также, как правило, обладают гипертриглицеридемической активностью. Этот нежелательный эффект можно частично уменьшить под воздействием урсоловой кислоты (см. формулу ниже). Таблица 2 Свойства метилового эфира 7-метил-D-гомо-8-эстрона (соединение XIV) и 7-метил-D-гомо-8-эстрона (соединение XV) по воздействию на матку, бедро, а также уровень холестерина и триглицеридов в сыворотке В качестве контроля был использован 17-этинилэстрадиол (ЕЕ). По контрасту с другими аналогами соединение XV не влияет на массу и количество клеток в селезенке, содержание клеток, формирующих антитело, или массу и количество клеток в тимусе у самок гибридных мышей FiCBAC57BI6 при введении разовой дозы per os (5 мг/кг ВТ). Способ описан в статье [9].estrogens with fluorine in position 2. Russ. J. Bioorg. Chem., 2007, 42(3), 293-301. 7. Gluzdikov I.A. Synthesis of sulphatase estrone inhibitors. PhD thesis. St.Petersburg, 2007. 8. Gluzdikov I.A., Purohit A., Reed M.J., Shavva A.G. Novel estrone sulphatase inhibitors. XVIII Mendeleev Congress on General and Applied Chemistry. Moscow, September 23-28, 2007. Abstracts. P. 9. Shavva A.G., Selivanov S.I., Starova G.L. et al. Russ. J. Bioorg. Chem., 2002, 28(3), 242-250. 10. Multimodal Imaging Using a Three Compartment Polymer Nanoparticles With Cell Specificity; WO 2007/093451. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, выбранное из соединения формулы IV 2. Способ получения ацетата 6-окса-8-эстрона формулы IV, включающий каталитическую гидрогенизацию 3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаен-17-она формулы I с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой: с последующим ацилированием метилового эфира 6-окса-8-эстрона формулы II по следующей схеме: 3. Способ получения диацетата 6-окса-8-эстрона формулы VI, включающий каталитическую гидрогенизацию 3,17-диацетокси-6-оксаэстра-1,3,5(10),8,14-пентаена формулы V с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой: 4. Способ получения 18-этил-3-метокси-6-окса-8-эстра-1,3,5(10)-триен-17-она формулы X, включающий каталитическую гидрогенизацию 18-этил-3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаена формулы IX с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой: 5. Способ получения метилового эфира 7-метил-D-гомо-6-окса-8-эстрона формулы XIV, включающий каталитическую гидрогенизацию 3-метокси-6-оксаэстра-1,3,5(10),8,14-пентаен-17-она формулыXIII с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой: 6. Способ получения 7-метил-D-гомо-6-окса-8-эстрона формулы XV, включающий каталитическую гидрогенизацию 7-метил-D-гомо-6-окса-8-эстра-1,3,5(10)-пентаена формулы XIII с использованием катализатора Pd/C в тетрагидрофуране в соответствии со следующей схемой: с последующим воздействием на метиловый эфир 7-метил-D-гомо-6-окса-8-эстрона формулыXIV HBr и АсОН при использовании обратного холодильника в соответствии со следующей схемой: 7. Применение соединения по п.1 для лечения или предупреждения симптомов менопаузы, воспаления, дисменореи и дисфункционального маточного кровотечения, остеопороза, гирсутизма и/или сердечно-сосудистого заболевания. 8. Применение соединения по п.1 для лечения или предупреждения заболеваний, связанных с функционированием эстрогена, метаболического синдрома, поражающего кости, хрящи или влияющего на вес тела, рака молочной железы, матки или предстательной железы, воспалительных заболеваний,выбранных из ревматоидного артрита, язвенного колита, болезни Крона, септицемии или эндометриоза,сердечно-сосудистого заболевания, нарушения когнитивной функции, церебральных дегенеративных расстройств, рестеноза, гинекомастии, пролиферации клеток гладкой мускулатуры кровеносных сосудов и недержания у млекопитающего. 9. Применение соединения по п.1 для лечения или предупреждения постклимактерического остеопороза, повышенного уровня LDL-холестерина, нарушения когнитивной функции, дегенеративных мозговых расстройств, эндометриоза, метаболического синдрома и/или рака, выбранного из рака молочной железы, матки и/или предстательной железы у млекопитающего.
МПК / Метки
МПК: A61K 31/566, A61P 5/30, C07J 73/00, A61K 31/56
Метки: способ, эстрогенов, 6-окса-8α-стероидных, применение, соединения-аналоги, получения
Код ссылки
<a href="https://eas.patents.su/13-19708-soedineniya-analogi-6-oksa-8alpha-steroidnyh-estrogenov-sposob-ih-polucheniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения-аналоги 6-окса-8α-стероидных эстрогенов, способ их получения и их применение</a>
Предыдущий патент: Производные 7-азаиндола в качестве селективных ингибиторов 11-бета-гидроксистероида дегидрогеназы 1 типа
Следующий патент: Спирогетероциклы и их применение в качестве лекарственных средств
Случайный патент: Специфичные к меланокортиновым рецепторам пептиды для лечения сексуальной дисфункции












