Способ асимметричного синтеза замещенных 2-аминотиазолонов
Формула / Реферат
1. Способ асимметрического синтеза соединения формулы 2 или его стереоизомера или фармацевтически приемлемой соли
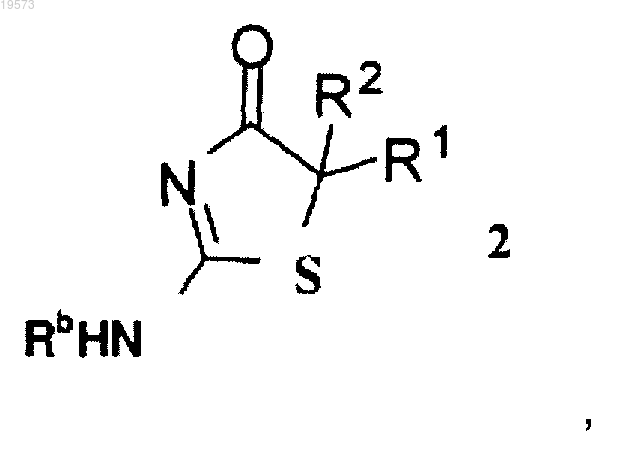
включающий реакцию соединения формулы 1

с соединением формулы RbHNH;
при этом R" выбран из группы, состоящей из (С1-С8)алкила, (С6-С14)арила, (С3-С8)циклоалкила и (С6-С14)арил(С1-С6)алкила;
каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и (С1-С8)алкила, при условии, что
R1 и R2 не представляют собой одновременно водород;
Rb выбран из группы, состоящей из (С1-С8)алкила, (С2-С8)алкенила, (С2-С8)алкинила, (С3-С8)циклоалкила, (С4-С8)бициклоалкила, (С6-С14)арила, (С3-С8)циклоалкил(С1-С6)алкила и (С6-С14)арил(С1-С6)алкила,
при этом атом углерода, к которому присоединены R1 и R2, является хиральным.
2. Способ по п.1, дополнительно включающий получение соединения формулы 1, при этом указанный способ включает приведение во взаимодействие соединения формулы 3
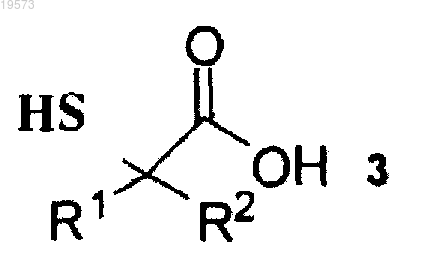
с соединением формулы R''S-CN, при этом R" определен в п.1.
3. Способ по п.2, отличающийся тем, что соединение формулы 3 представляет собой (S)-2-меркапто-2,3-диметилбутановую кислоту, а соединение формулы R''S-CN представляет собой метилтиоцианат.
4. Способ по п.1, отличающийся тем, что R1 и R2 независимо выбраны из (С1-С8)алкилов.
5. Способ по п.1, отличающийся тем, что соединение формулы 1 представляет собой (S)-5-изопропил-5-метил-2-(метилтио)тиазол-4(5Н)-он.
6. Способ по п.5, отличающийся тем, что RbHNH представляет собой (S)-экзоаминонорборнан.
7. Способ по п.1, отличающийся тем, что включает взаимодействие (S)-5-изопропил-5-метил-2-(метилтио)тиазол-4(5Н)-она с (S)-экзоаминонорборнаном.
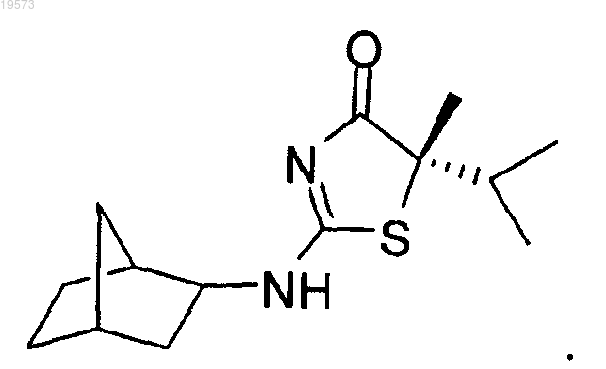
8. Способ по п.1, отличающийся тем, что соединение формулы 2 представляет собой
9. Способ асимметрического синтеза соединения формулы 2 или его стереоизомера, сольвата или фармацевтически приемлемой соли
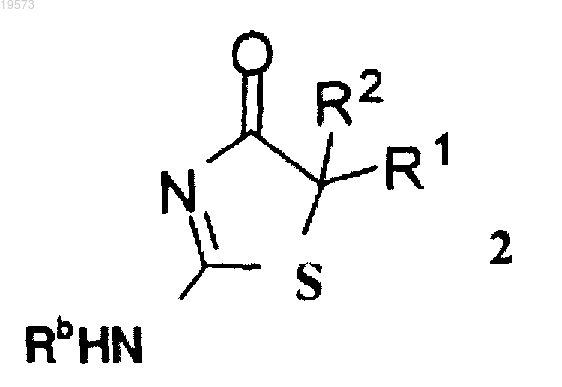
включающий приведение во взаимодействие соединения формулы 5
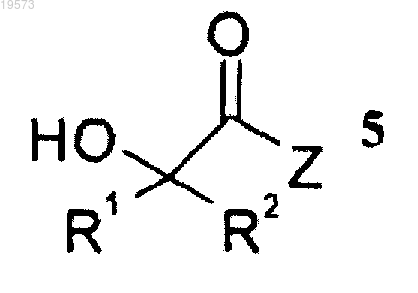
с соединением формулы 6
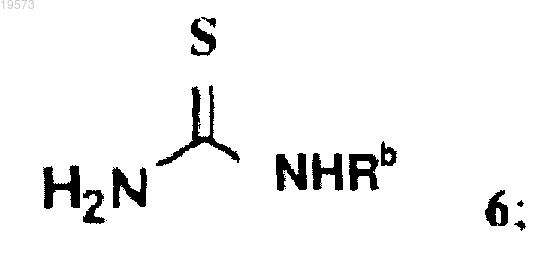
при этом Z выбран из группы, состоящей из галогена, OR6 и SR6;
каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и (С1-С8)алкила, при условии, что R1 и R2 не представляют собой одновременно водород;
R6 выбран из группы, состоящей из (С1-С8)алкила, пентафторфенила, нитрофенила, динитрофенила, CF3-фенила, п-толуолсульфонила и метансульфонила; и
Rb выбран из группы, состоящей из (С1-С8)алкила, (С2-С8)алкенила, (С2-С8)алкинила, (С3-С8)циклоалкила, (С4-С8)бициклоалкила, (С6-С14)арила, (С3-С8)циклоалкил(С1-С6)алкила и (С6-С14)арил(С1-С6)алкила,
при этом атом углерода, к которому присоединены R1 и R2, является хиральным.
10. Способ по п.9, отличающийся тем, что R1 и R2 независимо выбраны из (С1-С8)алкилов.
11. Способ по п.9, отличающийся тем, что соединение формулы 5 представляет собой (S)-2-гидрокси-2,3-диметилбутановую кислоту и соединение формулы 6 представляет собой (S)-экзонорборнилтиомочевину.
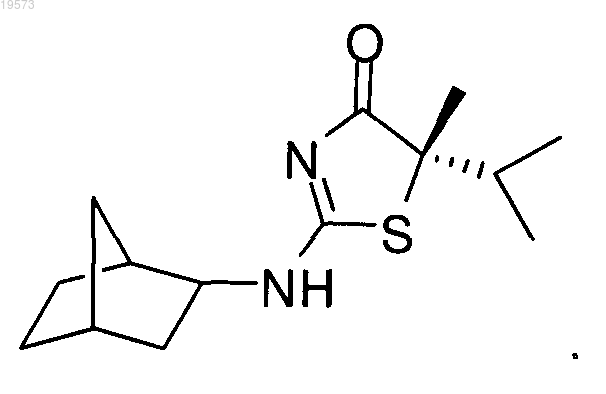
12. Способ по п.9, отличающийся тем, что соединение формулы 2 представляет собой
Текст
СПОСОБ АСИММЕТРИЧНОГО СИНТЕЗА ЗАМЕЩЕННЫХ 2-АМИНОТИАЗОЛОНОВ В изобретении предложены два способа получения замещенных аминотиазолоновых соединений,выступающих в качестве ингибиторов 11 гидроксистероидной дегидрогеназы типа 1. Способы обеспечивают стереоселективный синтез целевых соединений без применения стехиометрических количеств хиральных катализаторов. Уровень техники Настоящее изобретение в целом относится к новой методике органического синтеза и ее применению для получения соединений, которые можно использовать в качестве ингибиторов 11-гидроксистероидной дегидрогеназы типа 1. Гидроксистероидные дегидрогеназы (HSD, ГСД) регулируют заполнение и активацию рецепторов стероидных гормонов посредством взаимопревращения стероидных гормонов и их неактивных форм. В публикации Nobel et al., Eur. J. Biochem. 2001, 268:4113-4125 представлен недавний обзор на эту тему. Существует много классов ГСД. 11-Гидроксистероидная дегидрогеназа (11-ГСД) представляет собой оксидоредуктазу, в которой окислительный компонент метаболизирует биологически активный глюкокортикостероид (такой как кортизол и кортикостерон) в неактивные С-11 окисленные метаболиты,кортизон и 11-дегидрокортикостерон. См. публикацию Ragosh et al., J. Endocrinology, 1997, 155:171-180. Изоформа 11 гидроксистероидной гидрогеназы типа 1 (11-ГСД 1) экспрессируется в печени, жировой ткани, мозге, легких и других глюкортикоидных тканях и представляет собой потенциальную цель для терапии, направленной на различные нарушения, такие как диабеты, ожирение и возрастная когнитивная дисфункция, которые могут быть смягчены посредством снижения глюкортикоидного действия. См. работу Seekl et al., Endocrinology, 2001, 142:1371-1376. Изоформа 11-ГСД 1 также присутствует в островковых клетках поджелудочной железы, в которых она участвует в регулировании секреции инсулина. См. работу Oppermann et al., J. Biological Chemistry,2000, 275(45):34841-34844. Глюкокортикоидные гормоны, такие как кортизол (активная форма) и кортизон (неактивная кетоформа), играют значительную роль в регулировании метаболизма углеводов. Повышенные уровни кортизола способствуют глюконеогенезу и замедляют секрецию инсулина, что приводит к высокому содержанию глюкозы в сыворотке, которое представляет собой патогенез диабета. С другой стороны, известный ингибитор 11-ГСД 1 карбеноксолон обращает ингибирование секреции инсулина кортизолом в зависимости от дозировки и также увеличивает чувствительность к инсулину. Данные исследования показывают, что 11-ГСД 1 в островковых клетках поджелудочной железы играют важную роль в регулировании метаболизма глюкокортикоидов и секреции инсулина. Таким образом, 11-ГСД 1 представляет собой фермент, который является важной мишенью для разработки улучшенных антидиабетических лекарственных средств. Было показано, что С 5-замещенные 2-аминотиазолиноны являются сильными ингибиторами 11-ГСД 1. В частности, 5S-2-(бицикло[2.2.1]гептан-2-иламино)-5-изопропил-5-метилтиазол-4(5 Н)-он,который представлен ниже, представляет собой сильный наномолярный ингибитор указанного фермента. Существующие способы синтеза указанного аналога 2-аминотиазолона включают множество стадий и требуют применения больших количеств дорогостоящих хиральных катализаторов для энантиоселективного присоединения изопропильной группы к С 5 атому исходного 2-аминотиазолона. Таким образом, существует потребность в разработке альтернативной методики получения, которая бы приводила к простому и стереоселективному получению 5S-2-(бицикло[2.2.1]гептан-2-иламино)-5 изопропил-5-метилтиазол-4(5 Н)-она и родственных соединений, с использованием коммерчески доступных исходных веществ и небольших количеств хирального катализатора. Краткое описание изобретения Настоящее изобретение удовлетворяет указанные и другие потребности и предлагает эффективный способ асимметрического синтеза соединения формулы 2, его стереоизомера или фармацевтически приемлемых солей этого соединения Таким образом, один из вариантов реализации настоящего изобретения представляет собой способ получения соединения формулы 2 посредством приведения во взаимодействие соединения формулы 1 с соединением формулы RbHNH. В различных вариантах реализации настоящего изобретения R" выбирают из группы, состоящей из-1 019573 С 5-Заместители R1 и R2 независимо выбирают из группы, состоящей из водорода и (С 1-С 8)алкила,при условии, что R1 и R2 не являются одновременно атомом водорода. Заместитель Rb выбирают из группы, состоящей из (С 1-С 8)алкила, (С 2-С 8)алкенила,(С 2-С 8)алкинила, (С 3-С 8)циклоалкила, (С 4-С 8)бициклоалкила, (С 6-С 14)арила, (С 3-С 8)циклоалкил(С 1-С 6)алкила, и (С 6-С 14)арил(С 1-С 6)алкила, при этом атом углерода, к которому присоединены R1 и R2, является хиральным. В другом варианте реализации настоящего изобретения предложен способ получения соединения формулы 1 посредством приведения во взаимодействие соединения формулы 3 с соединением формулы В другом варианте реализации настоящего изобретения предложен способ получения соединения формулы 2, его стереоизомера или фармацевтически приемлемой соли: Способ включает приведение во взаимодействие соединения формулы 5 В формулах 2, 5 и 6 Z выбирают из группы, состоящей из галогена, OR6 и SR6. В тех вариантах реализации, в которых уходящая группа Z представляет собой OR6 и SR6,6R выбирают из группы, состоящей из (С 1-С 8)алкила, пентафторфенила, нитрофенила, динитрофенила,CF3-фенила, п-толуолсульфонила и метансульфонила. Кроме того, каждый из заместителей R1 и R2 независимо выбран из группы, состоящей из водорода и (С 1-С 8)алкила, при условии, что R1 и R2 не представляют собой одновременно водород.(С 6-С 14)арил(С 1-С 6)алкила, при этом атом углерода, к которому присоединены R1 и R2, является хиральным. Подробное описание Определения Используемые в настоящем описании термины имеют следующие значения. Термин "алкил", используемый в настоящем описании, относится к насыщенному углеводороду с линейной или разветвленной цепью, содержащему указанное количество атомов углерода. Например,предполагается, что (C1-С 6)алкил включает, но не ограничивается, метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил и неогексил. Алкильная группа, описываемая в настоящем изобретении, может быть незамещенной или возможно замещенной одним или более заместителем. Термин "алкенил", используемый в настоящем описании, относится к ненасыщенному углеводороду с линейной или разветвленной цепью, содержащему указанное количество атомов углерода и по меньшей мере одну двойную связь. Примеры (С 2-С 8)алкенильных групп включают, но не ограничиваются, этилен, пропилен, 1-бутилен, 2-бутилен, изобутилен, втор-бутилен, 1-пентен, 2-пентен, изопентен,1-гексен, 2-гексен, 3-гексен, изогексен, 1-гептен, 2-гептен, 3-гептен, изогептен, 1-октен, 2-октен, 3-октен,4-октен и изооктен. Алкенильная группа может быть незамещенной или возможно замещенной одним или более заместителем, как описано далее. Термин "алкинил", используемый в настоящем описании, относится к ненасыщенному углеводороду с линейной или разветвленной цепью, содержащему указанное количество атомов углерода и по меньшей мере одну тройную связь. Неограничивающими примерами (С 2-С 8)алкинильной группы являются ацетилен, пропин, 1-бутин,2-бутин, 1-пентин, 2-пентин, 1-гексин, 2-гексин, 3-гексин, 1-гептин, 2-гептин, 3-гептин, 1-октин, 2-октин,3-октин и 4-октин. Алкинильная группа может быть незамещенной или возможно замещенной одним или более заместителем, как описано далее. Термин "алкокси", используемый в настоящем описании, относится к -О-алкильной группе, содержащей указанное количество атомов углерода. Например, (C1-С 6)алкоксигруппа включает -О-метил,-О-этил, -О-пропил, -О-изопропил, -О-бутил, -О-втор-бутил, -О-трет-бутил, -О-пентил, -О-изопентил,-О-неопентил, -О-гексил, -О-изогексил и -О-неогексил. Термин "аминоалкил", используемый в настоящем описании, относится к алкильной группе (как правило, содержащие от одного до шести атомов углерода), в которой один или более атомов водорода(C1-С 6)алкильной группы замещен аминной группой -N(Rc)2, где каждый из Rc независимо представляет собой -Н или (С 1-С 6)алкил. Примеры аминоалкильных групп включают, но не ограничиваются,-CH2NH2,-CH2CH2NH2,-CH2CH2CH2NH2,-CH2CH2CH2CH2NH2,-CH2CH2CH2CH2CH2NH2,-CH2CH2CH2CH2CH2CH2NH2, CH2CH2CH2N(CH3)2, трет-бутиламинометил, изопропиламинометил и т.д. Термин "арил", используемый в настоящем описании, относится к 6-14-членной моноциклической,бициклической или трициклической ароматической углеводородной кольцевой системе. Примеры арильных групп включают фенил и нафтил. Арильная группа может быть незамещенной или возможно замещенной одним или более заместителем, как описано далее. Термин "циклоалкил", используемый в настоящем описании, относится к насыщенной или ненасыщенной неароматической моноциклической, бициклической или трициклической углеводородной кольцевой системе, содержащей от 3 до 14 атомов. В указанный класс также включены циклоалкильные группы, которые сконденсированы с бензольным кольцом. Типичными неограничивающими примерами циклоалкильных групп являются циклопропил, циклобутил, циклобутенил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, 1,3-циклогексадиенил, циклогептил, циклогептенил, 1,3-циклогептадиенил, 1,4-циклогептадиенил, 1,3,5-циклогептатриенил, циклооктил, циклооктенил,1,3-циклооктадиенил, 1,4-циклооктадиенил, 1,3,5-циклооктатриенил, декагидронафталин, октагидронафталин, гексагидронафталин, октагидроинден, гексагидроинден, тетрагидроинден, декагидробензоциклогептен, октагидробензоциклогептен, гексагидробензоциклогептен, тетрагидробензоциклогептен, додекагидрогептален, декагидрогептален, октагидрогептален, гексагидрогептален и тетрагидрогептален, (1s,3s)бицикло[1.1.0]бутан, бицикло[1.1.1]пентан, бицикло[2.1.1]гексан, бицикло[2.2.1]гептан, бицикло[2.2.2]октан, бицикло[3.1.1.]гептан, бицикло[3.2.1]октан, бицикло[3.3.1]нонан, бицикло[3.3.2]декан,бицикло[3.3.3]ундекан, бицикло[4.2.2]декан, бицикло[4.3.1]декан. Циклоалкильная группа может быть незамещенной или возможно замещенной одним или более заместителем, как описано далее. Термин "галоген", используемый в настоящем описании, относится к -F, -Cl, -Br или -I. Термин "галогеналкил", используемый в настоящем описании, относится к C1-С 6-алкильной группе,в которой один или более атомов водорода С 1-С 6-алкильной группы замещены атомами галогена, которые могут быть одинаковыми или различными. Неограничивающими примерами галогеналкильных групп являются трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил, пентахлорэтил и 1,1,1-трифтор-2-бром-2-хлорэтил. Термин "гетероалкил", сам по себе или в сочетании с другим термином, означает, если не указано обратное, алкил с линейной или разветвленной цепью или их комбинацию, состоящий из атомов углерода и от одного до трех гетероатомов, выбранных из группы, состоящей из О, N и S, где атомы азота и серы могут быть окислены и гетероатом азота может находиться в четвертичной форме. Гетероатом(ы) О, N и S могут быть расположены в любой позиции гетероалкильной группы. Примеры включают-CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2-S(O)-CH3,-CH2-CH2-S(O)2-CH3 и -CH2-CH=N-OCH3. Последовательно могут быть соединены до двух гетероатомов,как, например, в случае -CH2-NH-OCH3. В случае, когда для описания гетероалкильной группы используют приставку, такую как (C2-C8), понимают, что указанное количество атомов углерода (от 2 до 8 в указанном примере) также включает гетероатомы. Например, понимают, что С 2-гетероалкильная группа включает, например, -СН 2 ОН (один атом углерода и один гетероатом, заменяющий атом углерода) иCH2SH. Другой иллюстрацией определения гетероалкильной группы, в которой гетероатом представляет собой кислород, может быть оксиалкильная группа. Например, понимают, что (С 2-С 5)оксиалкил включает, например, -CH2-O-CH3 (С 3-оксиалкильная группа с двумя атомами углерода и одним атомом кислорода, заменяющим атом углерода), CH2CH2CH2CH2OH и т.д. Термин "гетероарил", используемый в настоящем описании, относится к ароматическому гетероциклическому кольцу, содержащему от 5 до 14 членов и содержащему по меньшей мере один гетероатом, выбранный из азота, кислорода и серы и содержащий по меньшей мере 1 атом углерода, включая моноциклические, бициклические и трициклические кольцевые системы. Типичные гетероарилы представляют собой триазолил, тетразолил, оксадиазолил, пиридил, фурил, бензофуранил, тиофенил, бензотиофенил, хинолинил, пирролил, индолил, оксазолил, бензоксазолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изоксазолил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил,триазинил, циннолинил, фталазинил, хиназолинил, пиримидил, азепинил, оксепинил, хиноксалинил и оксазолил. Гетероарильная группа может быть незамещенной или возможно замещенной одним или более заместителем, как описано далее. Предполагается, что используемый в настоящем описании термин "гетероатом" включает кислород(О), азот (N) и серу (S). Используемый в настоящем описании термин "гетероцикл" относится к кольцевым системам, содержащим от 3 до 14 членов, которые могут быть насыщенными, ненасыщенными или ароматическими и которые содержат от 1 до 4 гетероатомов, независимо выбранных из азота, кислорода и серы, и в которых гетероатом азота может находиться в четвертичной форме, включая моноциклические, бициклические и трициклические кольцевые системы. Бициклические и трициклические кольцевые системы могут включать гетероцикл или гетероарил, сконденсированный с бензольным кольцом. Гетероцикл может быть присоединен через гетероатом или атом углерода. Гетероциклы включают вышеописанные гетероарилы. Неограничивающими примерами гетероциклов являются азиридинил, оксиранил, тииранил,триазолил, тетразолил, азиринил, диазиридинил, диазиринил, оксазаринил, азетидинил, азетидинонил,оксетанил, тиетанил, пиперидинил, пиперазинил, морфолинил, пирролил, оксазинил, тиазинил, диазинил, диоксанил, триазинил, тетразинил, имидазолил, тетразолил, пирролидинил, изоксазолил, фуранил,фуразанил, пиридинил, оксазолил, бензоксзолил, бензизооксазолил, тиазолил, бензтиазолил, тиофенил,пиразолил, триазолил, пиримидинил, бензимидазолил, изоиндолил, индазолил, бензодиазолил, бензотриазолил, бензоксазолил, бензизооксазолил, пуринил, индолил, изохинолинил, хинолинил и хиназолинил. Гетероциклическая группа может быть незамещенной или возможно замещенной одним или более заместителем, как описано далее. Термин "гетероциклоалкил", сам по себе или в сочетании с другими терминами, представляет собой, если не указано обратное, циклические формы "гетероалкила". Кроме того, гетероатом может занимать положение, в котором гетероцикл присоединен к остатку молекулы. Примеры гетероциклоалкила включают 1-(1,2,5,6-тетрагидропиридил),1-пиперидинил,2-пиперидинил,3-пиперидинил,4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.д. Термин "гидроксиалкил", используемый в настоящем описании, относится к алкильной группе, содержащей указанное количество атомов углерода, где один или более атом водорода алкильной группы замещен -ОН группой. Примеры гидроксиалкильных групп включают, но не ограничиваются, -СН 2 ОН,-СН 2 СН 2 ОН, -СН 2 СН 2 СН 2 ОН, -СН 2 СН 2 СН 2 СН 2 ОН, -CH2CH2CH2CH2CH2OH, СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 ОН и их разветвленные формы. Заместители групп, которые называют как алкил, гетероалкил, алкилен, алкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил и гетероциклоалкенил, могут быть выбраны из множества групп,включающих -ORd', =O, =NRd', =N-ORd', -NRd'Rd", -галоген, -SiRd'RdRd, -OC(O)Rd', -C(O)Rd', -CO2Rd',-CONRd'Rd,-OC(O)NRd'Rd,-NRdC(O)Rd',-NRdC(O)NRd'd,-NRdSO2NRd'Rd,-NRdCO2Rd',d'-NO2, в количестве от 0 до 3, причем примерами являются те группы, которые содержат ноль, один или два заместителя. Каждый из Rd', Rd и Rd независимо обозначает водород, незамещенный (С 1-С 8)алкил,незамещенный гетеро(С 1-С 8)алкил, незамещенный арил и арил, замещенный от одного до трех заместителями, выбранными из галогена, незамещенного алкила, незамещенной алкоксигруппы, незамещенной тиоалкоксигруппы и незамещенного арил(С 1-С 4)алкила. В случае, когда Rd' и Rd присоединены к одному атому азота, они могут совместно с атомом азота образовывать 5-, 6- или 7-членное кольцо. Например,-NRd'Rd может представлять собой 1-пирролидинил или 4-морфолинил. Как правило, алкильная или гетероалкильная группа содержит от нуля до трех заместителей, причем указанные группы, содержащие два или менее заместителя, являются типичными для настоящего изобретения. Алкильный или гетероалкильный радикал могут быть незамещенными или монозамещенными. В некоторых вариантах реализации алкильный или гетероалкильный радикал является незамещенным. Из вышеуказанного специалисту в данной области техники будет понятно, что предполагается, что термин "алкил" включает группы, такие как тригалогеналкил (например, -CF3 и CH2CF3). Типичные заместители алкильных и гетероалкильных радикалов включают, но не ограничиваются,-ORd', =O, =NRd', =N-ORd', -NRd'Rd, -галоген, -SiRd'RdRd, -OC(O)Rd', -C(O)Rd', -CO2Rd', -CONRd'Rd,-OC(O)NRd'Rd, -NRdC(O)Rd', -NRdC(O)NRd'd, -NRdSO2NRd'Rd, -NRdCO2Rd', -NHC(NH2)=NH,-NRd'C(NH2)=NH, -NHC(NH2)=NRd', -S(O)Rd', -SO2Rd', -SO2NRd'Rd, -NRdSO2Rd', -CN и -NO2, где Rd', Rd иRd определены выше. Типичные заместители могут быть выбраны из -ORd', =O, -NRd'Rd, -галоген,-OC(O)Rd', -CO2Rd', -CONRd'Rd, -OC(O)NRd'Rd, -NRdC(O)Rd', -NRdSO2NRd'Rd, -NRdCO2Rd', -SO2Rd',-SO2NRd'Rd, -NRdSO2Rd', -CN и -NO2. Аналогично, заместители арильной и гетероарильной групп разнообразны и выбраны из следующих: -галоген, -ORe', -OC(O)Re', -NRe'Re, -SRe', -Re', -CN, -NO2, -CO2Re', -C(O)NRe'Re, -C(O)Re',-OC(O)NRe'Re, -NReC(O)Re', -NReCO2Re', -NReC(O)NRe'Re, -NReSO2NRe'Re, -NHC(NH2)=NH,-NRe'C(NH2)=NH, -NH-C(NH2)=NRe', -S(O)Re', -SO2Re', -SO2NRe'Re, -NReSO2Re', -N3, -CH(Ph)2, перфторалкокси и перфтор(С 1-С 4)алкил, в количестве от нуля до общего числа открытых валентностей ароматической кольцевой системы; где Re', Re и Re независимо выбирают из водорода, незамещенного гетероарильная группа содержит от нуля до трех заместителей, причем указанные группы, обладают двумя или менее заместителями, типичными для настоящего изобретения. В одном из вариантов реализации изобретения арильная или гетероарильная группа является незамещенной или монозамещенной. В другом варианте реализации арильная или гетероарильная группа является незамещенной. Два из заместителей при соседних атомах арильного или гетероарильного кольца арильной или гетероарильной группы, описанных в настоящем изобретении, могут быть возможно замещены заместителем формулы -T-C(O)-(CH2)q-U-, где Т и U независимо представляют собой -NH-, -О-, -СН 2- или одинарную связь, a q представляет собой целое число от 0 до 2. Альтернативно, два заместителя при соседних атомах арильного или гетероарильного кольца могут быть возможно замещены заместителем формулы-J-(СН 2)r-K-, где J и K независимо представляют собой -CH2-, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NRfили одинарную связь, а r представляет собой целое число от 1 до 3. Одна из одинарных связей полученного таким образом нового кольца может быть возможно замещена двойной связью. Также два заместителя при соседних атомах арильного или гетероарильного кольца могут быть возможно замещены заместителем формулы -(CH2)s-Х-(СН 2)t, где s и t независимо представляют собой целые числа от 0 до 3, а X представляет собой -О-, -NRf'-, -S-, -S(O)-, -S(O)2- или -S(O)2NRf'-. Заместитель Rf' в -NRf'- и -S(O)2NRRf'выбирают из водорода или незамещенного (С 1-С 6)алкила. Следует понимать, что в случае, если присутствует заместитель -CO2H, -COOH группа может быть возможно замещена биоизостерами, такими как: и т.д. См., например, The Practice of Medicinal Chemistry; Wermuth, C.G., Ed.; Academic Press: New York,1996; p. 203. Также следует понимать, что присоединение двух реагентов часто требует активации функциональной группы, присутствующей в одном из реагентов перед связыванием. В этом отношении термин"активация" обозначает стандартное применение подходящих активирующих агентов. Например, карбоксильная группа активируется карбоксильными активирующими агентами. Реагенты, содержащие карбоксильную группу в качестве заместителя, могут быть активированы различными стандартными активирующими агентами, такими как тионилхлорид, фосфорилхлорид, диимидазолкарбонил,N,N'-дициклогексилкарбодиимид (ДЦК), N,N'-диизопропилкарбодиимид (ДИК) или O-бензотриазол-1 ил-N,N,N',N'-тетраметилуроний-гексафторфосфат (БТУГ) в присутствии или в отсутствие 4-диметиламинопиридина (DMAP), 1-гидроксибензотриазола (НОВТ), бензотриазол-1-илокси-трис(диметиламино)фосфоний-гексафторфосфата (ВОР), бис-(2-оксо-3-оксазолидинил)фосфин хлорида(BOPCl), DEPBT (3-(диэтоксифосфорилокси)-3 Н-бензо[d][1,2,3]триазин-4-он), ВЕР (тетрафторборат 2-бром-1-этилпиридина), HATU (гексафторфосфат N,N,N',N'-тетраметил-O-(7-азабензотриазол-1 ил)урония), TBTU (тетрафторборат N,N,N',N'-тетраметил-O-(бензотриазол-1-ил)урония), PyBop (гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония) и т.д. Соединение формулы 2 также может существовать в различных изомерных формах, включающих конфигурационные, геометрические и конформационные изомеры, так же как и в различных таутомерных формах, в особенности те соединения, которые отличаются положением присоединения атома водорода. Используемый в настоящем описании термин "изомер" вводят для описания всех изомерных форм соединения формулы 2, включая таутомерные формы соединения. Соединения формулы 2 имеют в своей структуре асимметрические центры и, следовательно, существуют в различных энантиомерных и диастереомерных формах. Соединение может существовать в форме оптического изомера или диастереомера. Соответственно, изобретение включает соединения формулы 2 в формах оптических изомеров, диастереомеров и их смесей, включая рацемические смеси. Если не указано обратное, термин "стереоизомер", используемый в настоящем описании, означает один из стереоизомеров соединения, который, по существу, не содержит другие стереоизомеры указанного соединения. Например, стереомерно чистое соединение, содержащее один хиральный центр, по существу, не содержит второго энантиомера соединения. Стереомерно чистое соединение, содержащее два хиральных центра, по существу, не содержит другие стереоизомеры соединения. В некоторых вариантах реализации стереомерно чистое соединение содержит более чем примерно 80 мас.% одного из стереоизомеров соединения и менее чем примерно 20 мас.% других стереоизомеров соединения, например более чем примерно 90 мас.% одного из стереоизомеров соединения и менее чем примерно 10 мас.% других стереоизомеров соединения, или более чем примерно 95 мас.% одного из стереоизомеров соединения и менее чем примерно 5 мас.% других стереоизомеров соединения, или более чем примерно 97 мас.% одного из стереоизомеров соединения и менее чем примерно 3 мас.% других стереоизомеров соединения. Следует отметить, что в случае если существует различие между изображенной структурой и названием указанной структуры, то следует учитывать изображенную структуру. В дополнение, если стереохимия структуры или части структуры не указана, например, при помощи жирных, клинообразных или пунктирных линий, то следует понимать, что структура или часть структуры описывает все стереоизомеры. Способ получения. В настоящем изобретении предложены два простых способа синтеза 5-замещенных 2-аминотиазолонов, которые представлены далее на схемах 1 и 2. Как будет понятно специалисту, способы, описанные в настоящем изобретении, позволяют выполнить синтез различных гетероциклов, представленных формулой 2. Идентичность заместителей R1 и R2 в положении С-5 аналога 2-аминотиазолона зависит от выбора исходного кетона (1). В одном из вариантов реализации R1 и R2 независимо представляют собой(С 1-С 3)алкильные группы. Примеры указанных групп включают метильную, этильную, пропильную и изопропильную группы. В качестве альтернативы, в настоящем изобретении также рассматривают получение соединения формулы 2, где R1 и R2 представляют собой одинаковые группы или соединения, гдеR1 представляет собой алкил и R2 представляет собой возможно замещенную арильную, гетероарильную,алкинильную, алкенильную, циклоалкильную или гетероциклоалкильную группу. Соединение формулы 2 получают посредством замещения R"S в соединении формулы 1 с применением незамещенного или замещенного амина (RbHNH). В одном из вариантов реализации, следовательно, Rb представляет собой циклоалкил или бициклоалкил, которые описаны выше. Таким образом, в некоторых вариантах реализации Rb представляет собой незамещенный бициклоалкан, такой как, например, норборнильная группа (бицикло[2.2.1]гептан). В другом варианте реализации уходящая группа R"S в формуле 1 представляет собой алкил- или арилтиол. В другом варианте реализации в способе согласно изобретению предложено соединение формулы 2, которое получают посредством реакции внутримолекулярного замещения. Как отмечено выше, идентичность заместителей R3 и R4 в положении С-5 аналога 2-аминотиазолона зависит от выбора исходного кетона. В одном из вариантов реализации, например, R3 представляет собой метил, a R4 представляет собой изопропильную группу. В другом варианте реализации уходящая группа Z в формуле 5 представляет собой галоген, сложноэфирную группу, мезилат, тозилат или тиосложноэфирную группу. Другие уходящие группы хорошо известны из уровня техники и предполагаются в настоящем изобретении. В случае, если Z представляет собой галоген, Z может представлять собой хлор, бром или йод. 5-Замещенные 2-аминотиазолоны, полученные с применением методики настоящего изобретения,включают реакцию асимметричного гидроцианирования соответствующего кетона с получением циангидрина. В соответствии с одним из вариантов реализации изобретения металлический катализатор и соответствующий хиральный лиганд применяют для получения хирального циангидрина. Так как некоторые пары катализатор-лиганд известны из уровня техники, в одном из вариантов реализации переходный металл представляет собой алюминий с формальной степенью окисления +3. Лиганды, пригодные для применения с металлическим катализатором, включают монодентатные и полидентатные лиганды. В одном из вариантов реализации, в случае, если лиганд является монодентатным, для координирования с металлом используют более чем один монодентатный лиганд. В соответствии со стандартным определением, известным из уровня техники, термин "полидентатный" относится к лиганду, который координирован с переходным металлом или его ионом посредством двух или более атомов. Таким образом, лиганд может быть, например, бидентатным или тридентатным. В другом варианте реализации лиганд является бидентатным. Типичным бидентатным лигандом являет-6 019573 ся фосфин, который координируется с металлом или ионом посредством двух атомов фосфора. Другие примеры бидентатных лигандов включают, например, различные пары электрондонорных атомов фосфора, серы, азота и кислорода. В другом варианте реализации бидентатный лиганд является аналогом бромофенолового синего. Мольная доля катализатора в одном из вариантов реализации может находиться в пределах от примерно 0,001 до примерно 10 мол.%. В другом варианте реализации мольная доля может находиться в пределах от примерно 0,01 до примерно 5 мол.%. В другом варианте реализации мольная доля может находиться в пределах от 0,1 до примерно 1,0 мол.%. Типичное содержание катализатора составляет примерно 0,5 мол.%. Соединения формулы 2, в дополнение к тому, что оно имеет хиральный центр в положении С 5, может содержать один или более стереохимических центров, что таким образом приводит к существованию диастереомеров. Изобретение предусматривает получение всех указанных стереохимических изомеров соединения формулы 2. При необходимости, дополнительная очистка и разделение энантиомеров и диастереомеров могут быть выполнены при помощи процедур, известных из уровня техники. Таким образом, например, разделение энантиомеров соединения формулы 2 может быть достигнуто применением хиральной ВЭЖХ и сходных хроматографических методик. Диастереомеры могут быть разделены аналогичным способом. В некоторых случаях, тем не менее, диастереомеры могут быть разделены простыми физическими способами, такими как, например, контролируемое осаждение или кристаллизация. Способ согласно изобретению, при проведении в соответствии с описанием, может быть проведен при температурах, которые обычно применяют в технике. В одном из вариантов реализации способ проводят при температуре, находящейся в диапазоне от примерно 25 до примерно 110 С. В другом варианте реализации температура находится в диапазоне от примерно 40 до примерно 100 С. В другом варианте реализации температура находится в пределах от примерно 50 до примерно 95 С. В соответствии с общим описанием, представленным выше, способ проводят в присутствии основания. Основание может представлять собой любое подходящее органическое или неорганическое соединение. Как правило, основание не является нуклеофильным. Таким образом, в одном из вариантов реализации, основание выбрано из карбонатов, фосфатов, алкоксидов и солей дисилазанов. Способ согласно изобретению, при проведении в соответствии с описанием, может быть, по существу, завершен в течение периода времени от нескольких минут до нескольких часов в зависимости от природы и количеств реагентов и температуры проведения реакции, например. Определить, является ли реакция, по существу, завершенной, можно с помощью стандартных методик, известных из уровня техники, таких как, например, ВЭЖХ, ЖХМС, ТСХ и 1H ЯМР. Примеры Настоящее изобретение не ограничено в объеме конкретными вариантами реализации, описанными в примерах, которые предназначены для того, чтобы проиллюстрировать небольшое число вариантов реализации изобретения, также изобретение не ограничено любыми вариантами реализации, которые являются функциональными эквивалентами в рамках настоящего изобретения. Фактически, различные модификации изобретения в дополнение к модификациям, представленным и описанным в настоящем документе, будут очевидны специалистам в данной области техники и подпадают под прилагаемую формулу изобретения. Поэтому следует отметить, что один или более атомов водорода или метильная группа могут быть опущены в изображенных структурах в соответствии с принятым сокращенным обозначением указанных органических соединений и что специалисту в области органической химии будет очевидно их присутствие. Способ внутримолекулярного замещения для синтеза 5-дизамещенных 2-аминотиазолонов. В одном из вариантов реализации настоящего изобретения синтез целевого соединения, как правило, включает асимметричное гидроцианирование 3-метилбутан-2-она (1) с получением соответствующего R-2-гидрокси-3-метилбутаннитрила. Активация гидроксила посредством образования мезилата перед нуклеофильным замещением сульфидом натрия приводит к получению соответствующего 2-меркапто 2,3-диметилбутаннитрила, обладающего противоположной (S-) стереохимией С-2 атома. Гидролиз цианогруппы с последующим взаимодействием получаемой карбоксильной кислоты (5) с метилизотиоцианатом и циклизацией полученного аддукта приводит к получению (S)-5-метил-2-(метилтио)тиазол-4(5 Н)она (6). Целевое соединение получают посредством взаимодействия соединения (6) сS-аминонорборнаном. Указанная последовательность реакций представлена на схеме 1, и нижеследующие примеры соответствуют порядку проведения последовательных реакций.(75 мл) и полученный раствор перемешивали в течение 1 ч при 23 С в атмосфере азота. 3-Метилбутан-2 он (50,0 г, 0,58 моль) добавили при помощи шприца и смесь охладили до -30 С. Добавили 2-E)-1S,2S)2-E)-5-бром-2-гидроксибензилиденамино)-1,2-дифениленэтилимино)метил)-4-бромфенол(1,67 г,0,0029 моль) и триэтилалюминий (0,33 г, 0,0029 моль) и реакционную смесь перемешивали в течение 24 ч. Смесь нагрели до 23 С и концентрировали (30 мм рт.ст.) Остаток перегнали при пониженном давлении (30 мм рт.ст., 80 С) с получением 47,2 г (88%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3)1,86 (септаплет, 1 Н, J=4 Гц), 1,53 (s, 3 Н), 1,04 (d, 3 Н, J=4 Гц), 1,02 (d,3 Н, J=4 Гц), 0,25 (s, 9H); 13 С ЯМР (100 МГц, CDCl3)121,5, 73,4, 39,1, 26,0, 17,1, 16,9, 1,15; ИКС (без примесей): 2969, 1375, 1254, 1160, 991, 841, 755 см-1; точная масса (C9H19NOSi + Na): вычисленная = 208,1128, измеренная = 208,1130.(110 мл) в атмосфере азота. Добавили воду (2,2 мл) и CSA (0,68 г, 0,00295 моль) и раствор перемешивали в течение 3 ч. Реакционную смесь обработали насыщенным водным раствором NaHCO3 (100 мл), фазы разделили и водную фазу экстрагировали 2-МеТГФ (250 мл). Объединенные органические фазы промыли солевым раствором, осушили (Na2SO4) и концентрировали при пониженном давлении (1 мм рт.ст.). Осадок растворили в 2-МеТГФ (100 мл) в атмосфере азота. Через шприцы добавили Et3N (10,9 мл,0,077 моль) и MsCl (5,98 мл, 0,077 моль) и реакционную смесь перемешивали в течение 2 ч. Смесь обработали насыщенным водным раствором NaHCO3 (100 мл), фазы разделили и водную фазу экстрагировали 2-МеТГФ (350 мл). Объединенные органические фазы промыли солевым раствором, осушили(Na2SO4) и концентрировали при пониженном давлении. Хроматографическая очистка (70 г силикагеля,10-20% EtOAc/гексан) оставшегося вещества привела к получению 10,36 г (92%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3)3,17 (s, 3 Н), 2,24 (септаплет, 1H, J=8 Гц), 1,89 (s, 3 Н), 1,14 (t, 6H,J=8 Гц); 13 С ЯМР (100 МГц, CDCl3)116,7, 82,6, 39,7, 37,8, 23,1, 16,7, 16,6; ИКС (без примесей): 2979, 1466, 1358, 1180, 1048, 901, 805 см"1; точная масса (C7H13NO3S + Na): вычисленная = 214,0508, измеренная = 214,0510. Пример 3. Получение (S)-2-меркапто-2,3-диметилбутановой кислоты (5). Гидрат NaSH (1,2 г, 0,097 моль) растворили в воде (62 мл) и раствор нагрели до 45 С в атмосфере азота. рН водного раствора довели до 8-9 добавлением 0,31 мл концентрированной водной HCl. Через шприц добавили (R)-2-циано-3-метилбутан-2-илметансульфонат (3,1 г, 0,016 моль) и реакционную смесь перемешивали в течение 20 ч. К полученному раствору добавили KOH (62 г, 1,1 моль) в виде твердого вещества и смесь нагрели до 95 С. Раствор перемешивали в течение 18 ч и охладили до 23 С. Смесь влили в охлажденный (0 С) водный раствор концентрированной HCl (60 мл) (внутреннюю температуру полученной водной смеси поддерживали ниже 50 С). Раствор экстрагировали с применением IPAC(350 мл). Объединенные органические фазы промыли солевым раствором, осушили (Na2SO4) и концентрировали при пониженном давлении. Хроматографическая очистка (15 г силикагеля, 10-50%EtOAc/гексан) оставшегося вещества привела к получению (S)-2-меркапто-2,3-диметилбутанамида. Хиральная ГХ промежуточного продукта бутанамида: 80,6% э.и. Водный раствор концентрированной HCl (30 мл) нагрели до 85 С в атмосфере азота. Добавили(S)-2-меркапто-2,3-диметилбутанамид в виде твердого вещества и смесь перемешивали в течение 24 ч. Раствор охладили до 23 С и экстрагировали с применением IPAC (320 мл). Объединенные органические фазы промыли солевым раствором, осушили (Na2SO4) и концентрировали при пониженном давлении. Хроматографическая очистка (15 г силикагеля, 10-40% EtOAc/гексан) оставшегося вещества привела к получению 1,41 г (59%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3)2,25 (септаплет, 1H, J=4 Гц), 2,22 (s, 1H), 1,43 (s, 3 Н), 1,09 (d, 3 Н,J=4 Гц), 0,98 (d, 3 Н, J=4 Гц); 13 С ЯМР (100 МГц, CDCl3)181,5, 53,9, 36,4, 20,2, 18,2, 17,3; ИКС (без примесей): 2968, 2877, 1693, 1404, 1276, 1110, 925 см-1; точная масса (C6H12NO2S + Na): вычисленная = 171,0450, измеренная = 171,0449.(S)-2-Меркапто-2,3-диметилбутановую кислоту (1,5 г, 0,01 моль) растворили в толуоле (15 мл) в атмосфере азота. Добавили активированные 3 сита (1,5 г) и MeSCN (1,1 мл, 0,015 моль) и полученную смесь нагрели до 110 С. Смесь перемешивали в течение 2 ч и охладили до 23 С. Смесь обработали насыщенным водным раствором NaHCO3 (20 мл), фазы разделили и водную фазу экстрагировали EtOAc(315 мл). Объединенные органические фазы промыли солевым раствором, осушили (Na2SO4) и концентрировали при пониженном давлении. Хроматографическая очистка (10 г силикагеля, 20-30%EtOAc/гексан) оставшегося вещества привела к получению (S)-5-изопропил-5-метил-2-(метилтио)тиазол 4(5 Н)-она. Указанное вещество растворили в МеОН (15 мл) и добавили (S)-экзоаминонорборнан (1,35 г,0,015 моль, 99,3 э.и.) в атмосфере азота. Раствор перемешивали в течение 4 ч и концентрировали. Хроматографическая очистка (10 г силикагеля, 10-40% EtOAc/гексан) оставшегося вещества привела к получению 1,73 г (64%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3, 90,15/9,85 смесь диастереомеров, сигналы преимущественно содержащегося диастереомера)3,33-3,40 (m, 1 Н), 2,36-2,45 (m, 2 Н), 2,21 (септаплет, 1H, J=8 Гц), 1,84-1,91 (m, 1H),1,60-1,83 (m, 1 Н), 1,42-1,68 (m, 3 Н), 1,62 (s, 3 Н), 1,13-1,30 (m, 4 Н), 1,05 (d, 3 Н, J=8 Гц), 0,90 (d, 3 Н,J=8 Гц); 13 С ЯМР (100 МГц, CDCl3, 90,15/9,85 смесь диастереомеров, сигналы для преимущественно содержащегося диастереомера)191,1, 180,9, 70,9, 59,5, 43,0, 38,5, 35,9, 35,7, 35,6, 28,2, 26,6, 25,6, 19,0, 18,4; ИКС (без примесей): 3168, 2959, 2869, 1696, 1585, 1440, 1327, 1256, 1090, 1017, 829 см-1; точная масса (C14H22N2OS + Н): вычисленная = 267,1526, измеренная = 267,1525. Хиральная ЖХ: 90,15/9,85. В другом варианте синтез целевых 5-замещенных аминотиазолоном осуществляют посредством асимметричного гидроцианирования 3-метилбутан-2-она с получением цианогидрина, который затем гидролизуют в соответствующую кислоту (4), как представлено на схеме 2. Активация карбоксилатной группы с последующим взаимодействием полученного ацилхлорида с S-экзо-норборнилтиомочевиной и внутремолекулярной циклизацией аддукта в основных условиях приводит к получению 5S-2-(бицикло[2.2.1]гептан-2-иламино)-5-изопропил-5-метилтиазол-4(5 Н)-она в качестве продукта.TMSCN (28,8 г, 0,29 моль) и N,N-диметиланилиноксид (0,2 г, 0,015 моль) растворили в ТГФ (75 мл) и полученный раствор перемешивали в течение 1 ч при 23 С в атмосфере азота. Через шприц добавили 3-метилбутан-2-он (50,0 г, 0,58 моль) и смесь охладили до -30 С. Добавили 2-Е)-1R,2R)-2-Е)-5-бром 2-гидроксибензилиденамино)-1,2-дифенилэтилимино)метил)-4-бромфенол (1,67 г, 0,0029 моль) и триэтилалюминий (0,33 г, 0,0029 моль) и реакционную смесь перемешивали в течение 24 ч. Смесь нагрели до 23 С и концентрировали (30 мм рт.ст.). Остаток перегнали при пониженном давлении (30 мм рт.ст,80 С) с получением 45,6 г (85%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3)1,86 (септаплет, 1 Н, J=4 Гц), 1,53 (s, 3H), 1,04 (d, 3 Н, J=4 Гц), 1,02 (d,3 Н, J=4 Гц), 0,25 (s, 9H); 13 С ЯМР (100 МГц, CDCl3)121,5, 73,4, 39,1, 26,0, 17,1, 16,9, 1,15; ИКС (без примесей): 2969, 1375, 1254, 1160, 992, 841, 755 см-1; точная масса (C9H19NOSi + Na): вычисленная = 208,1128, измеренная = 208,1129.[]D при 23 С и 17,0 г/л в CDCl3 = -12,13. Хиральная ГХ: 87,28% э.и. Пример 6. Получение (S)-2-гидрокси-2,3-диметилбутановой кислоты (с). Водный раствор концентрированной HCl (50 мл) нагрели до 85 С в атмосфере азота. Добавили(S)-2,3-диметил-2-(триметилсилилокси)бутаннитрил (5,0 г, 0,027 моль) и смесь перемешивали в течение 12 ч. Раствор охладили до 23 С и экстрагировали с применением IPAC (350 мл). Объединенные органические фазы промыли солевым раствором, осушили (Na2SO4) и концентрировали при пониженном давлении. Хроматографическая очистка (30 г силикагеля, 10-50% EtOAc/гексан) оставшегося вещества привела к получению 1,75 г (49%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3)2,02 (септаплет, 1 Н, J=8 Гц), 1,44 (s, 3 Н), 1,00 (d, 3 Н, J=8 Гц), 0,93 (d,3 Н, J=8 Гц); 13 С ЯМР (100 МГц, CDCl3)182,1, 77,1, 35,5, 23,3, 17,2, 15,8; ИКС (без примесей): 3433, 2973, 2882, 1725, 1460, 1377, 1247, 1164, 1120, 1045, 948, 855, 737 см-1; точная масса (С 6 Н 12 О 3 + Na): вычисленная = 155,0678, измеренная = 155,0679.[]D при 23 С и 17,0 г/л в CDCl3 = +2,83. Хиральная ГХ: 87,34% э.и. (измерение проводили с применением соответствующего этилового сложного эфира). Температура плавления = 47-49 С. Рентгенокристаллограмма соли(S)-2-Гидрокси-2,3-диметилбутановую кислоту (0,3 г, 0,0023 моль) растворили в ДМФ (1,5 мл) и 2-МеТГФ (4,5 мл) в атмосфере азота. Через шприц добавили POOMeCl2 (0,34 г, 0,0023 моль) и раствор перемешивали при 23 С в течение 2,5 ч. К раствору добавили (S)-экзонорборнилтиомочевину (0,27 г,0,0016 моль, 99,2% э.и.) в виде твердого вещества. Сразу после этого по каплям через шприц добавилиiPr2EtN (0,84 мл, 0,0046 моль) и полученную смесь перемешивали в течение 12 ч. Смесь обработали насыщенным водным раствором NaHCO3 (10 мл), фазы разделили и водную фазу экстрагировали EtOAc(315 мл). Объединенные органические фазы промыли солевым раствором, осушили (Na2SO4) и концен- 10019573 трировали при пониженном давлении. Хроматографическая очистка (5 г силикагеля, 10-30%EtOAc/гексан) оставшегося вещества привела к получению 0,28 г (66%) указанного в заголовке соединения. 1 Н ЯМР (400 МГц, CDCl3, 90,8/9,2 смесь диастереомеров, сигналы преимущественно содержащегося диастереомера)3,33-3,40 (m, 1 Н), 2,36-2,45 (m, 2H), 2,21 (септаплет, 1 Н, J=8 Гц), 1,84-1,91 (m, 1H),1,60-1,83 (m, 1H), 1,42-1,68 (m, 3H), 1,62 (s, 3H), 1,13-1,30 (m, 4H), 1,05 (d, 3H, J=8 Гц), 0,90 (d, 3H,J=8 Гц); 13 С ЯМР (100 МГц, CDCl3, 90,8/9,2 смесь диастереомеров, сигналы преимущественно содержащегося диастереомера)191,1, 180,9, 70,9, 59,5, 43,0, 38,5, 35,9, 35,7, 35,6, 28,2, 26,6, 25,6, 19,0, 18,4; ИКС (без примесей): 3168, 2957, 1696, 1587, 1440, 1327, 1256, 1090, 1017, 834 см-1; точная масса (C14H22N2OS + Н): вычисленная = 267,1526, измеренная = 267,1525. Хиральная ЖХ: 90,8/9,2. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ асимметрического синтеза соединения формулы 2 или его стереоизомера или фармацевтически приемлемой соли включающий реакцию соединения формулы 1(С 6-С 14)арил(С 1-С 6)алкила; каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и (С 1-С 8)алкила, при условии, чтоR1 и R2 не представляют собой одновременно водород;(С 6-С 14)арил(С 1-С 6)алкила,при этом атом углерода, к которому присоединены R1 и R2, является хиральным. 2. Способ по п.1, дополнительно включающий получение соединения формулы 1, при этом указанный способ включает приведение во взаимодействие соединения формулы 3 с соединением формулы RS-CN, при этом R" определен в п.1. 3. Способ по п.2, отличающийся тем, что соединение формулы 3 представляет собой(S)-2-меркапто-2,3-диметилбутановую кислоту, а соединение формулы RS-CN представляет собой метилтиоцианат. 4. Способ по п.1, отличающийся тем, что R1 и R2 независимо выбраны из (С 1-С 8)алкилов. 5. Способ по п.1, отличающийся тем, что соединение формулы 1 представляет собой(S)-5-изопропил-5-метил-2-(метилтио)тиазол-4(5 Н)-он. 6. Способ по п.5, отличающийся тем, что RbHNH представляет собой (S)-экзоаминонорборнан. 7. Способ по п.1, отличающийся тем, что включает взаимодействие (S)-5-изопропил-5-метил-2(метилтио)тиазол-4(5 Н)-она с (S)-экзоаминонорборнаном. 8. Способ по п.1, отличающийся тем, что соединение формулы 2 представляет собой 9. Способ асимметрического синтеза соединения формулы 2 или его стереоизомера, сольвата или фармацевтически приемлемой соли включающий приведение во взаимодействие соединения формулы 5 при этом Z выбран из группы, состоящей из галогена, OR6 и SR6; каждый из R1 и R2 независимо выбран из группы, состоящей из водорода и (С 1-С 8)алкила, при условии, что R1 и R2 не представляют собой одновременно водород;(С 6-С 14)арил(С 1-С 6)алкила,при этом атом углерода, к которому присоединены R1 и R2, является хиральным. 10. Способ по п.9, отличающийся тем, что R1 и R2 независимо выбраны из (С 1-С 8)алкилов. 11. Способ по п.9, отличающийся тем, что соединение формулы 5 представляет собой(S)-экзонорборнилтиомочевину. 12. Способ по п.9, отличающийся тем, что соединение формулы 2 представляет собой
МПК / Метки
МПК: C07D 277/54
Метки: синтеза, способ, 2-аминотиазолонов, замещенных, асимметричного
Код ссылки
<a href="https://eas.patents.su/13-19573-sposob-asimmetrichnogo-sinteza-zameshhennyh-2-aminotiazolonov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ асимметричного синтеза замещенных 2-аминотиазолонов</a>
Предыдущий патент: Фармацевтические пероральные композиции с пролонгированным высвобождением, включающие производные 2-оксо-1-пирролидина
Следующий патент: Дельта-эндотоксиновый ген axmi-150 и способы его применения
Случайный патент: Силовая схема возбуждения для управления ультразвуковым преобразователем с переменной нагрузкой

















