Антигрибковые композиции с улучшенной биологической доступностью.
Номер патента: 1219
Опубликовано: 25.12.2000
Авторы: Тоне Дани, Веррек Герт, Барт Ливен Элвир Колетт
Формула / Реферат
1. Частица, представляющая собой твердую дисперсию, включающая
(a) итраконазол, или один из его стереоизомеров, или смесь из двух или трех, или четырех его стереоизомеров, и
(b) один или более фармацевтически пригодных водорастворимых полимеров.
2. Частица по п.1, имеющая размер менее 600 мкм.
3. Частица по п.1 или 2, в которой итраконазол находится в некристаллической фазе.
4. Частица по п.3, в форме твердого раствора, включающего (a) и (b), или в форме дисперсии, в которой аморфный или микрокристаллический (а), или аморфный или микрокристаллический (b) распределен более или менее равномерно в твердом растворе, включающем (а) или (b).
5. Частица в соответствии с предшествующими пунктами, в которой водорастворимый полимер представляет собой полимер, который имеет кажущуюся вязкость от 1 до 100 mPaъs. (мнъс/м2) при растворении в 2% водном растворе при 20шС.
6. Частица по п.5, в которой водорастворимый полимер выбран из группы, включающей
алкилцеллюлозы, такие как метилцеллюлоза,
гидроксиалкилцеллюлозы, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза,
гидроксипропилцеллюлоза и гидроксибутилцеллюлоза,
гидроксиалкилалкилцеллюлозы, такие как гидроксиэтилметилцеллюлоза и гидроксипропилметилцеллюлоза,
карбоксиалкилцеллюлозы, такие как карбоксиметилцеллюлоза,
соли щелочных металлов и карбоксиалкилцеллюлоз, такие как натрий карбоксиметилцеллюлоза,
карбоксиsub>5 является водородом, низшим алкилом или радикалом -COR10,
где R10 имеет значения, определенные ниже,
R6 является: (а) водородом; (б) низшим алкилом; (в) радикалом формулы
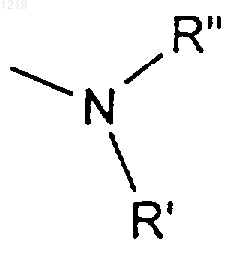
где R' и R" имеют значения, определенные ниже; (г) радикалом -ОR11, где R11 имеет значения, определенные ниже,
R8 и R9, одинаковые или различные, являются водородом или низшим алкилом,
R10 является низшим алкилом,
R11 является водородом, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом моно- или полигидроксиалкилом, арилом или аралкилом, которые могут быть замещены, или остатком сахара, или остатком аминокислоты, или пептида,
R' и R", одинаковые или различные, являются водородом, низшим алкилом, моно- или полигидроксиалкилом, арилом, который может быть замещен, или остатком аминокислоты или сахара, или вместе образуют гетероцикл,
а также их соли и оптические и геометрические изомеры.
2. Соединения по п.1, отличающиеся тем, что они находятся в виде солей щелочного или щелочно-земельного металла, ведения.
14. Лекарственная форма по п.12, характеризующаяся немедленным высвобождением итраконазола после приема внутрь, в которой указанные частицы гомогенно распределены в смеси разбавителя или дезинтегратора.
15. Лекарственная форма по п.13 или 14, покрытая оболочкой, включающей полимер, образующий оболочку, пластификатор и, необязательно, краситель.
16. Лекарственная форма по п.14, в которой разбавителем является высушенная при распылении смесь моногидрата лактозы и микрокристаллической целлюлозы (75:25), а дезинтегратор представляет собой кросповидон или кроскармеллозу.
17. Лекарственная форма по любому из пп. 12-16, в которой вес указанных частиц составляет, по крайней мере, 40% от общего веса лекарственной формы.
18. Лекарственная форма по п.12, включающая по весу, исходя из общего веса лекарственной формы:
21,65% итраконазола (200 мг)
32,48% НРМС 2910 с вязкостью 5 mPaъs. (мнъс/м2) (300 мг)
30.57% высушенной при распылении смеси моногидрат лактозы:
микрокристаллическая целлюлоза (75:25) (282,4 мг)
8,49% кросповидона (78,4 мг) 2,79% талька (25,8 мг)
0,.93% гидрогенизированного растительного масла Типа I (8,6 мг)
0,28% коллоидного безводного кремния (2,6 мг)
0,24% стеарата магния (2,2 мг), что дает
97,43% основу таблетки, и
1,47% НРМС 2910 5 mPaъs. (мнъс/м2) (13,57)
0,37% пропиленгликоля (3,39 мг)
0,29% талька (2,71 мг)
0,44% двуокиси титана (4,07 мг), что входит в состав
2,57% оболочки таблетки.
19. Лекарственная форма по любому из пп.12-18, характеризующаяся тем, что, по крайней мере, 85% доступного итраконазола растворяется в течение 60 мин, когда лекарственная форма, эквивалентная 200 мг итраконазола, тестируется, как установлено в USP тесте <711>, в USP-2 аппарате для растворения при следующих условиях: 900 мл фосфатного буфера, рН 6.0, 37шС при скорости вращения мешалки 100 об/мин.
20. Способ приготовления частиц, как заявлено в любом из пп.1-11, отличающийся тем, что смешивают компоненты, прессуют указанную смесь при температуре в интервале 120-300шС, измельчают продукт прессования и, необязательно, просеивают полученные частицы.
21.Твердая дисперсия, полученная путем прессования при плавлении
(a) итраконазола, или одного из его стереоизомеров, или смеси из двух или трех его стереоизомеров, и
(b) одного или более фармацевтически приемлемых водорастворимых полимеров.
22. Способ получения фармацевтической лекарственной формы по пп.12-19, отличающийся тем, что смешивают терапевтически эффективное количество частиц по пп.1-11 с фармацевтически приемлемыми наполнителями и прессуют указанную смесь в таблетки.
23. Применение частиц в соответствии с любым из пунктов от 1 до 11 для приготовления фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, которая может вводиться указанному млекопитающему в виде единичной лекарственной формы один раз в день.
24. Применение частиц в соответствии с любым из пунктов от 1 до 11, для получения фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, где указанная лекарственная форма может вводиться в любое время дня независимо от приема пищи указанным млекопитающим.
25. Фармацевтическая упаковка, включающая контейнер, пероральную форму итраконазола по любому из пп.12-19 и прилагаемую к указанной упаковке письменную инструкцию, в которой указывается отсутствие ограничений в применении лекарственной формы до или после еды.
Текст
1 Настоящее изобретение относится к новым фармацевтическим композициям итраконазола,которые могут вводиться млекопитающим,страдающим грибковой инфекцией, в виде одной единицы лекарственной формы, которая может вводиться один раз в день и, кроме того,в любое время дня независимо от приема пищи указанным млекопитающим. Эти новые композиции включают впервые созданные частицы,получаемые с помощью прессования при плавлении смеси, включающей итраконазол и подходящий водорастворимый полимер, и последующего измельчения указанной прессованной при плавлении смеси. Создание фармацевтических композиций,обладающих хорошей биологической доступностью, для итраконазола, соединения, практически нерастворимого в водной среде, остается одной из главных проблем фармацевтической разработки этого соединения. Термин практически нерастворимое или нерастворимое следует понимать, по определению Фармакопеи Соединенных Штатов(USP), как очень слабо растворимое соединение - это соединение для растворения одной части которого требуется от 1000 до 10,000 частей растворителя; термин практически нерастворимое или нерастворимое соединение это соединение, для растворения одной части которого требуется более 10,000 частей растворителя. Под растворителем здесь понимается вода. Итраконазол или ( -цис-4-[4-[4-[4-2-(2,4 дихлорофенил)-2-(1 Н-1,2,4-триазол-1-ил-метил)1,3-диоксолан-4-ил]метокси]фенил]-1-пиперазинил]фенил]-2,4-дигидро-2-(1-метилпропил)-3 Н 1,2,4-триазол-3-он представляет антигрибковое соединение широкого спектра действия, созданное для перорального, парэнтерального и местного применения и описанное в патенте US4,267,179. Его дифтороаналог, саперконазол или(-цис-4-[4-[4-[4-2-(2,4-дифторофенил)-2-(1 Н 1,2,4-триазол-1-илметил)-1,3-диоксолан-4-ил] метокси]фенил]-1-пиперазинил]фенил]-2,4 дигидро-2-(1-метоксипропил)-3 Н-1,2,4-триазол 3-он обладает улучшенной активностью противAspergillus spp. и описан в патенте US-4,916,134. Оба соединения, итраконазол и саперконазол,состоят из смеси четырех диастереоизомеров,получение и применение которых описано в патенте WO 93/19061: диастреоизомеры итраконазола и саперконазола обозначаются как[2R-[2a,4a,4(R),[2R-[2 а,4 а,4(S),[2S[2 а,4 а,4(S) и [2S-[2 а,4 а,4(R). Термин итраконазол, используемый в описании, следует понимать в широком смысле, он включает форму свободного основания и фармацевтически приемлемые соли итраконазола или одного из его стереоизомеров или смесь из двух, или трех,или четырех его стереоизомеров. Предпочтительным соединением итраконазола является 2R4S) или (цис) формы свободного основа 001219 2 ния, имеющие регистрационный номер в Chemical Abstracts [84625-61-6]. Формы с кислыми присадками могут быть получены в реакции формы основания с соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как гидрогалогеновые кислоты, например соляная или бромистоводородная кислоты; серная кислота; азотная кислота; фосфорная кислота и подобные им кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная, 2-гидроксипропионовая, пировиноградная, этандикислота, пропандикислота,бутандикислота,(2)-бутендикислота,(Е)бутендикислота,2-гидроксибутандикислота,2,3-дигидроксибутандикислота,2-гидрокси 1,2,3-пропанотрикарбоновая кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота,циклогексансульфаминовая,2-гидроксибензойная, 4-амино-2-гидроксибензойная и подобные им кислоты. В патенте WO 94/05263, опубликованном 17 марта 1994 года, описаны шарики или гранулы, имеющие сахарную основу размером 25-30 меш (600-710 мкм), покрытые противогрибковым средством, точнее итраконазолом (или саперконазолом), с гидрофильным полимером,точнее гидроксипропилметилцеллюлозой. Запаянные в конечном итоге пленочной оболочкой,такие основы обозначаются как шарики или гранулы. Шарики помещаются в капсулы, пригодные для перорального введения. Итраконазол находится в лекарственной оболочке и легко выделяется с поверхности указанных покрытых оболочкой шариков, что обеспечивает улучшенную биологическую доступность итраконазола (или саперконазола) по сравнению с известными лекарственными формами итраконазола. Для приготовления покрытых оболочкой шариков, как описано в патенте WO 94/05263,требуются специальные технологии и специальное оборудование на построенном для этой цели предприятии. Действительно, шарики, описанные в предшествующих работах, готовятся крайне сложным способом, требующим многостадийных манипуляций. В первую очередь,лекарственный раствор для покрытия получают путем растворения в подходящей системе растворителей соответствующих количеств противогрибкового агента и гидрофильного полимера, предпочтительно гидроксипропилметилцеллюлозы (НРМС). Подходящая система растворителей включает смесь метиленхлорида и спирта. Указанная смесь должна включать, по крайней мере, 50 вес.% метиленхлорида, действующего как растворитель для лекарственного соединения. Так как гидроксипропилметилцеллюлоза полностью не растворяется в метиленхлориде, необходимо добавлять, по крайней мере, 10% спирта. Затем сахарная основа разме 3 ром 25-30 меш (600-710 мкм) покрывается лекарством в псевдожидком слое гранулятора,снабженного вставкой для распыления снизу. Скорость распыления должна не только четко регулироваться, но также принципиально важным является контроль температуры в псевдожидком слое гранулятора. Следовательно, этот процесс требует большого количества контролируемых этапов для воспроизводимого получения продукта хорошего качества. Более того,эта технология адекватно, но все-таки только частично решает проблему удаления остаточных растворителей, таких как метиленхлорид и метанол или этанол, присутствующих в составе для покрытия. Для того чтобы удалить любой из растворителей, которые могут остаться в покрытом лекарством промежуточном продукте,требуется дополнительный этап засушки. Впоследствии применяется запаивание в пленочную оболочку, и это прибавляет еще два дополнительных этапа в процесс производства, так как при этом также привлекается дополнительная стадия высушивания. Шарики около 460 мг, эквивалент примерно 100 мг итраконазола, помещались в твердую желатиновую капсулу (размер 0) и две таких капсулы вводились один раз в день больному,страдающему грибковой инфекцией. Капсулы коммерчески доступны во многих странах под торговой маркой Sporanox. Для того, чтобы достичь желаемого антигрибкового эффекта,существенно, чтобы две капсулы принимали внутрь в конце приема пищи. Это может серьезно ограничить применение, в зависимости от того, насколько легко пациенты соглашаются с предписываемой им терапией; например, некоторые пациенты не в состоянии нормально питаться, или легко проглатывать медикаменты в связи с болезнью, рвотой или в связи с грибковой инфекцией пищевода. Поэтому крайне желательным должно быть создание таких фармацевтических лекарственных форм, которые могут вводиться пациенту или тем же способом любому млекопитающему в любое время дня независимо от приема пищи, то есть лекарственных форм, которые могут вводиться пациентам (млекопитающим) натощак. Лекарственные формы с высоким содержанием лекарства, одна единица которого содержит требуемую дневную дозу активного ингредиента вместо двух таких единиц, являются еще одним желательным усовершенствованием фармацевтической разработки итраконазола. На этом этапе можно отметить, что терапевтически эффективный уровень итраконазола в плазме легко может поддерживаться в течение, по крайней мере, 24 ч, так как период его полужизни является достаточно длинным. Проблема состоит в том, что итраконазол должен достигать плазмы. Абсорбция итраконазола в желудке сама по себе не является проблемой. Таким образом, нет необходимости создания 4 лекарственной формы итраконазола с постоянным высвобождением лекарства, форма с немедленным высвобождением лекарства будет действовать также хорошо. Другими словами,основной проблемой введения итраконазола в терапевтически эффективных количествах является в первую очередь проблема, касающаяся обеспечения того, чтобы достаточное количество итраконазола оставалось в растворе достаточно долго, позволяя ему попасть в систему циркуляции, и чтобы он не превращался в форму, которая характеризуется пониженной биологической доступностью, в особенности в кристаллический итраконазол (который образуется,например, когда итраконазол выпадает в осадок в водной среде). В настоящем изобретении предлагаются фармацевтические композиции итраконазола и водорастворимого полимера, которые могут вводиться млекопитающему, в особенности человеку, страдающему грибковой инфекцией, в виде единственной дозы лекарственной формы,которая может вводиться один раз в день и,кроме того, в любое время дня независимо от приема пищи указанным млекопитающим. Биологическая доступность лекарства из этих лекарственных форм сопоставима у голодных и сытых млекопитающих. Лекарственные формы могут быть легко получены, например, путем традиционной техники получения таблеток. Лекарственные формы включают терапевтически эффективное количество новых частиц, как подробно описано здесь далее. Указанные новые частицы состоят из твердой дисперсии, включающей:(a) итраконазол, или один из его стереоизомеров, или смеси из двух, или трех, или четырех его стереоизомеров, и(b) один или более фармацевтически пригодные водорастворимые полимеры. Термин "твердая дисперсия" обозначает систему в твердом состоянии (в отличие от жидкого или газообразного состояния), включающую, по крайней мере, два компонента, из которых один компонент распылен более менее равномерно по всему другому компоненту или компонентам. Когда указанная дисперсия компонентов такова, что система становится химически и физически однородной или гомогенной,или состоит из одной фазы, как описывается в термодинамике, такая твердая дисперсия будет обозначаться здесь далее как "твердый раствор". Твердые растворы представляют собой предпочтительные физические системы, потому что компоненты в них обычно характеризуются легкой биологической доступностью для организмов, в которые они вводятся. Это преимущество может, видимо, быть объяснено легкостью, с которой указанные твердые растворы могут образовывать жидкие растворы при контакте с жидкой средой, такой как желудочный сок. Легкость растворения может быть приписана, по 5 крайней мере частично, тому факту, что энергия, требуемая для растворения компонентов из твердого раствора, является меньшей, чем требуемая для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Термин "твердая дисперсия" также включает дисперсии, которые являются менее гомогенными во всех отношениях чем твердые растворы. Такие дисперсии не являются химически и физически однородными во всех отношениях или включают более одной фазы. Например,термин твердая дисперсия также относится к частицам, имеющим домены или маленькие участки, в которых аморфный, кристаллический или микрокристаллический (а), или аморфный,кристаллический или микрокристаллический(b), или оба, распылены более менее равномерно в другой фазе, включающей (b) или (а), или твердый раствор, включающий (а) или (b). Указанные домены представляют собой области в частицах, легко отличимые по некоторым физическим характеристикам, небольшие по размеру по сравнению с размером частицы в целом и равномерно и случайно распределенные по частице. Домены (а) обычно имеют размер до 25 мкм, предпочтительно до 20 мкм. Частицы в соответствии с настоящим изобретением могут быть получены путем первоначального приготовления твердой дисперсии компонентов в твердом состоянии и затем, необязательно, размалывания или измельчения этой распыленной системы. Существуют различные технологии получения твердых дисперсий компонентов, включая прессование при плавлении, сушку при распылении и систему растворения - выпаривания, прессование при плавлении является более предпочтительным. Процесс прессования при плавлении включает следующие стадии:a) смешивание компонентов (а) и (b),b) необязательно смешивание присадок с полученной таким образом смесью,c) нагревание полученной таким образом смеси до тех пор, пока не будет получено гомогенное плавление,d) прессование полученного таким образом расплавленного материала пропусканием через одно или более сопл; и е) охлаждение расплавленного материала до его затвердевания. Термины "расплавленный" и "плавление" должны интерпретироваться широко. Для наших целей эти термины означают не только переход состояния вещества из твердого в жидкое,но могут также относиться к переходу в стекловидное состояние или в каучукоподобное состояние и, когда это возможно для одного из компонентов смеси, к достижению более или менее гомогенного включения его в другой компонент. В некоторых случаях один компонент расплавляют; а другой компонент (ы) рас 001219 6 творяют в расплаве, образуя таким образом раствор, который под действием охлаждения может образовывать твердый раствор, имеющий улучшенные свойства в отношении растворения. Одним из наиболее важных параметров прессования при плавлении является температура, при которой осуществляется процедура прессования при плавлении. Обнаружено, что действующая температура может с легкостью колебаться в интервале между около 120 С до около 300 С. При температурах ниже 120 С итраконазол не будет полностью растворяться в большинстве водорастворимых полимеров и продукт прессования не будет иметь требуемую биологическую доступность. Кроме того, процесс затруднен из-за высокой вязкости смеси. При температуре выше 300 С водорастворимый полимер может разрушиться до неприемлемого уровня. Следует отметить, что нет необходимости опасаться разрушения итраконазола при температурах до 300 С, так как активный ингредиент термически очень устойчив. Скорость прохождения процесса также важна, так как даже при относительно низких температурах водорастворимый полимер может начинать разрушаться, если остается слишком долго в контакте с элементом нагревания. Следует отметить, что специалист в этой области будет в состоянии оптимизировать параметры процесса прессования при плавлении в интервалах, данных выше. Рабочие температуры будут также определяться типом пресса или типом используемых операционных параметров пресса. Большая часть энергии, необходимой для плавления, смешивания и растворения компонентов в прессе может быть обеспечена элементами нагревания. Однако, трение материала в прессе может также обеспечить существенное количество энергии для смеси и способствовать формированию гомогенного плавления компонентов. Сушка при распылении раствора компонентов также приводит к образованию твердой дисперсии указанных компонентов и может быть приемлемой альтернативой способа прессования при плавлении особенно в тех случаях,когда водорастворимый полимер недостаточно стабилен для того, чтобы выдержать условия прессования, и когда остаточный растворитель может быть эффективно удален из твердой дисперсии. Еще один возможный способ получения состоит в приготовлении раствора компонентов,выливании указанного раствора на большую поверхность таким образом, что образуется тонкая пленка, и выпаривании из нее растворителя. Продукт распыления в твердом состоянии измельчается или мелется до частиц, имеющих размер менее 600 мкм, предпочтительно менее 400 мкм и особенно предпочтительно менее 125 мкм. Размер частиц оказывается важным фактором, определяющим скорость, с которой таблетки, имеющие достаточную твердость, могут 7 производиться в крупном масштабе; чем меньше частицы, тем быстрее может быть скорость производства таблеток без ущерба для их качества. Распределение размеров частиц таково,что более 70% частиц (при измерении по весу) имеет диаметр, колеблющийся в интервале от около 50 мкм до около 500 мкм, предпочтительно от около 50 мкм до около 200 мкм и наиболее предпочтительно от около 50 мкм до около 125 мкм. Частицы указанной здесь величины могут быть получены путем просеивания их через номинальные стандартные лабораторные сита, как описано в CRC Handbook, 64th ed., page F-114. Номинальные стандартные сита характеризуются по величинам ширины меш/отверстий (мкм),DIN 4188 (мм), ASTM Е 11-70 (No), Tyier (меш) или BS 410 (меш) величинам. Во всем этом описании и в приводимой ниже формуле изобретения размеры частиц обозначаются ссылкой на ширину меш/отверстий в мм и на соответствующий номер сита в стандарте ASTM E11-70. Предпочтительными являются частицы, в которых итраконазол находится в некристаллической фазе, так как они имеют существенно большую скорость растворения, чем те из них, в которых итраконазол частично или полностью находится в микрокристаллической или кристаллической форме. Предпочтительно твердая дисперсия находится в форме твердого раствора, включающего(а) и (b). Альтернативно она может быть дисперсией, в которой аморфный или микрокристаллический (а) или аморфный или микрокристаллический (b) диспергирован более или менее равномерно в твердом растворе, включающем (а) и (b). Водорастворимый полимер в частицах в соответствии с настоящим изобретением представляет собой полимер, который имеет кажущуюся вязкость от 1 до 100 mPas. (мнс/м) при растворении в виде 2% водного раствора при 20 С. Например, водорастворимый полимер может быть выбран из группы, включающей- алкилцеллюлозы, такие как метилцеллюлоза,- гидроксиалкилцеллюлозы, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза,гидроксипропилцеллюлоза и гидроксибутилцеллюлоза,- гидроксиалкилалкилцеллюлозы, такие как гидроксиэтилметилцеллюлоза и гидроксипропилметилцеллюлоза,- карбоксиалкилцeллюлозы, такие как карбоксиметилцеллюлоза,- соли щелочных металлов и карбоксиалкилцеллюлоз, такие как натрий карбоксиметилцеллюлоза,- карбоксиалкилалкилцеллюлозы, такие как карбоксиметилэтилцеллюлоза,- эфиры карбоксиалкилцеллюлоз,- крахмалы, 001219- пектины, такие как натрий карбоксиметиламилопектин,- хитины, такие как хитозан,- полисахариды, такие как альгиновая кислота, ее соли с щелочными металлами и аммонием, галактоманнаны, полисахариды из съедобных водорослей (ирландского мха), трагакант, агар-агар, гуммиарабик, гуаровая камедь и ксантановая камедь,- полиакриловые кислоты и их соли,- полиметакриловые кислоты и их соли,сополимеры метакрилата,- поливиниловый спирт,- поливинилпирролидон, сополимеры поливинилпирролидона с винилацетатом,- полиалкиленоксиды, такие как полиэтиленоксид и полипропиленоксид и cополимеры этиленоксида и пропиленоксида. Неперечисленные полимеры, которые являются фармацевтически приемлемыми и имеют соответствующие физико-химические свойства, описанные здесь ранее, равнопригодны для приготовления частиц в соответствии с настоящим изобретением. Предпочтительными водорастворимыми полимерами являются гидроксипропилметилцеллюлозы или НРМС. Указанная НРМС содержит достаточно гидроксипропильных групп и метоксигрупп для того, чтобы сделать ее водорастворимой. НРМС, имеющая степень замещения метоксигруппами от около 0,8 до около 2,5 и гидроксипропильное молярное замещение от около 0,05 до около 3,0, обычно является водорастворимой. Степень замещения метоксигруппами относится к среднему количеству присутствующих групп метилового эфира на единицу ангидроглюкозы молекулы целлюлозы. Гидроксипропилметилцеллюлоза является принятым в Соединенных Штатах названием гипромеллозы (смотри Martindale, The Extra Pharmacopoeia, 29th edition, page 1435). В четырехзначном числе "2910" первые две цифры представляют собой приблизительный процент метоксигрупп, а третья и четвертая цифры - приблизительный процентный состав гидроксипропильных групп; 5 mPas. (мнс/м 2) представляет собой величину, указывающую кажущуюся вязкость 2% водного раствора при 20 С. Молекулярный вес НРМС обычно влияет как на профиль высвобождения измельченного продукта прессования, так и на его физические свойства. Желаемый профиль высвобождения может, таким образом, быть достигнут путем выбора НРМС соответствующего молекулярного веса; для немедленного высвобождения активного ингредиента из частиц предпочтителен полимер с низким молекулярным весом. НРМС с высоким молекулярным весом более пригоден для создания фармацевтической лекарственной формы с постоянным высвобождением лекарства. Молекулярный вес водорастворимого эфира целлюлозы обычно выражается в величинах 9 кажущейся вязкости водного раствора при 20 С,содержащего два весовых процента указанного полимера. Приемлемые НРМС включают те из них, которые имеют вязкость от около 1 до около 100 mPas. (мнс/м 2), в особенности от около 3 до около 15 mPas.(мнс/м 2), предпочтительно 5 mPas. (мнс/м 2). Наиболее предпочтительным типом НРМС, имеющим вязкость 5 mPas.(мнс/м 2), является коммерчески доступная НРМС 2910 5 mPas. (мнс/м 2), потому что она позволяет создать частицы, из которых могут быть приготовлены наилучшие пероральные лекарственные формы итраконазола, как будет обсуждено далее и в экспериментальной части. Весовое отношение (а) и (b) находится в интервале от 1:1 до 1:17, предпочтительно от 1:1 до 1:5. В случае (итраконазол): (НРМС 2910 5 mPas. (мнс/м 2 указанное отношение может колебаться от около 1:1 до около 1:2, а оптимальным является около 1:1,5 (или 2:3). Весовое отношение итраконазола к другим водорастворимым полимерам может быть определено опытным исследователем непосредственно в эксперименте. Нижний предел определяется путем практических рассуждений. Действительно, при наличии терапевтически эффективного количества итраконазола (от около 50 мг до около 300 мг, предпочтительно около 200 мг в день) нижний предел отношения определяется максимальным количеством смеси, которое может обрабатываться для получения единичной лекарственной формы удобного размера. Если относительное количество водорастворимого полимера слишком велико, абсолютное количество смеси, необходимое для достижения терапевтического уровня будет слишком велико для создания одной капсулы или таблетки. Таблетки, например, имеют максимальный вес около 1 г, и продукт прессования может составлять из него максимально 90 вес.%. Следовательно,нижний предел содержания итраконазола по отношению к гидроксипро-пилметилцеллюлозе будет составлять около 1:17 (50 мг итраконазола+ 850 мг водорастворимого полимера). С другой стороны, если отношение является слишком высоким, это означает, что количество итраконазола является относительно высоким по сравнению с количеством водорастворимого полимера, тогда возникает риск того,что итраконазол не будет достаточно растворяться в водорастворимом полимере и, таким образом, необходимая биологическая доступность не будет достигнута. Степень, до которой соединение растворяется в водорастворимом полимере, часто можно определить визуально: если продукт прессования является прозрачным,то очень вероятно, что соединение действительно полностью растворилось в водорастворимом полимере. Верхний предел 1:1 определен на основе того факта, что выше указанного соотношения обнаруживалось, что продукт прессования, полученный из прессуемого итраконазо 001219 10 ла совместно с НРМС 2910 5 mPas. (мнс/м 2), не является прозрачным, предположительно из-за того, что не весь итраконазол растворился в НРМС. Предполагается, что верхний предел 1:1 недостаточен для некоторых водорастворимых полимеров. Так как это можно легко определить, но требует затрат времени на эксперименты, твердые дисперсии, в которых отношение(а) : (b) больше чем 1:1, также включены в объем настоящего изобретения. Предпочтительными частицами являются те из них, которые получены путем прессования при плавлении компонентов и измельчения и,необязательно, просеивания. В большей степени настоящее изобретение относится к частицам,состоящим из твердого раствора, включающего две весовых части итраконазола и три весовых части гидроксипропилметилцеллюлозы НРМС 2910 5 mPas. (мнс/м 2), полученным при смешивании указанных компонентов, прессовании смеси при ее плавлении при температуре в интервале 120-300 С, размельчении продукта прессования и, необязательно, просеивании полученных таким образом частиц. Получение является легким для выполнения и ведет к получению частиц итраконазола, свободных от органического растворителя. Частицы, описанные здесь выше, могут дополнительно включать один или более приемлемых наполнителей, таких как, например,пластификаторы, вкусовые отдушки, красители,консерванты и тому подобное. Указанные наполнители должны быть термоустойчивыми,другими словами, они не должны проявлять заметных признаков деградации или декомпозиции при рабочей температуре процесса прессования при плавлении. В применяемых в настоящее время составах итраконазола: НРМС 2910 5 mPas. (мнс/м 2) количество пластификатора является предпочтительно небольшим, порядка от 0 до 15%(вес/вес). С другими водорастворимыми полимерами могут быть применены пластификаторы в существенно различающихся количествах,часто более высоких, поскольку пластификаторы, как будет отмечено ниже, снижают температуру, при которой происходит плавление (а), (b) и пластификатора, и это снижение температуры плавления является выгодным, когда полимер имеет ограниченную термоустойчивость. Подходящие пластификаторы представляют собой фармацевтически приемлемые низкомолекулярные полиатомные спирты, такие как этиленгликоль, пропиленгликоль, 1,2-бутиленгликоль,2,3-бутиленгликоль, стиренгликоль; полиэтиленгликоли, имеющие молекулярный вес ниже чем 1,000 г/моль; полипропиленгликоли, имеющие молекулярный вес ниже 200 г/моль; простые эфиры гликоля, такие как монопропиленгликоль, моноизопропиловый эфир; пластификаторы типа сложных эфиров, такие как сорбитол лактат, этиловый эфир молочной кислоты, 11 бутиловый эфир молочной кислоты, этиловый эфир гликолевой кислоты, аллиловый эфир гликолевой кислоты; и амины, такие как моноэтаноламин, диэтаноламин, триэтаноламин, моноизопропаноламин; триэтилентетрамин, 2-амино 2-метил-1,3-пропандиол и тому подобное. Среди них предпочтительными являются полиэтиленгликоли низкого молекулярного веса, этиленгликоль, полипропиленгликоли низкого молекулярного веса и особенно пропиленгликоль. Сразу после получения продукта прессования он перемалывается и просеивается и применяется как "нормальный" ингредиент для приготовления фармацевтических лекарственных форм. Из частиц настоящего изобретения могут быть составлены фармацевтические лекарственные формы, включающие терапевтически эффективное количество частиц. Хотя первоначально рассматривались фармацевтические лекарственные формы для перорального введения,такие как таблетки и капсулы, частицы настоящего изобретения могут быть также использованы для приготовления других фармацевтических лекарственных форм, например, для ректального введения. Предпочтительными являются те лекарственые формы, которые адаптированы для перорального введения и имеют форму таблеток. Они могут быть получены путем традиционной технологии производства таблеток с традиционными ингредиентами или наполнителями и на обычных аппаратах для производства таблеток. Кроме того, они могут быть получены при существенно более низких затратах, чем затраты при производстве основы,покрытой лекарственным средством. Как указывалось выше, эффективная суточная доза для антигрибкового действия итраконазола находится в интервале от около 50 мг до около 300 мг при введении один раз в день и предпочтительно составляет около 200 мг при введении один раз в день. Если рассматривать вариант, при котором весовое отношение (а):(b) максимально составляет около 1:1, то из этого следует, что одна единица лекарственной формы должна весить, по крайней мере, 400 мг. Для того, чтобы ускорить проглатывание такой лекарственной формы млекопитающим, выгодно давать эту лекарственную форму, особенно в таблетках соответствующей формы. Таблетки,которые удобно проглатывать, предпочтительно должны быть удлиненной, а не круглой формы. Особенно предпочтительны двояковыпуклые,сплющенные у полюсов таблетки. Как обсуждалось здесь более подробно выше, покрытая оболочкой таблетка дополнительно способствует облегчению проглатывания. Таблетки, которые характеризуются немедленным высвобождением итраконазола после проглатывания и хорошей биологической доступностью, создаются таким образом, что таблетки быстро разрушаются при попадании в 12 желудок (немедленное высвобождение) и что частицы, которые из них высвобождаются, распределяются раздельно одна от другой таким образом, что они не слипаются, не создают высоких местных концентраций итраконазола и не создают условий для преципитации лекарства(биологическая доступность). Желаемый эффект может быть достигнут путем гомогенного распределения указанных частиц в смеси дезинтегратора и разбавителя. Подходящими дезинтеграторами являются те из них, которые имеют высокий коэффициент расширения. Их примерами являются гидрофильные, нерастворимые или слаборастворимые в воде полимеры с поперечными сшивками, такие как кросповидон (поливинилпирролидон с поперечными сшивками) и кроскармеллоза (натрий-карбоксиметилцеллюлоза с поперечными сшивками). Количество дезинтегратора в таблетках для немедленного высвобождения в соответствии с настоящим изобретением может находиться в подходящих пределах от около 3 до около 15% (вес/вес) и предпочтительно около 7-9%, особенно желательно около 8,5%(вес/вес). Это количество имеет тенденцию быть более высоким, чем обычно применяемое в таблетках, для того, чтобы быть уверенным, что частицы равномерно распределились в большом объеме содержимого желудка после приема внутрь. Поскольку дезинтеграторы по своей природе ведут к постоянному высвобождению составов, когда применяются в массе, выгодно разводить их инертным соединением, называемым разбавителем или наполнителем. В качестве разбавителей или наполнителей могут быть использованы различные материалы. Примерами являются высушенные при распылении или безводные лактоза, сахароза, декстроза, маннитол, сорбитол, крахмал, целлюлозаAvicel), первичный кислый фосфат кальция или безводный вторичный кислый фосфат кальция и другие известные науке соединения, а также их смеси. Предпочтительной является высушенная при распылении смесь моногидрата лактозы (75%) с микрокристаллической целлюлозой (25%), которая коммерчески доступна какMicrocelac. Количество разбавителя или наполнителя в таблетках может варьироваться в соответствии с его пригодностью в интервале от около 20% до около 40% (вес/вес) и предпочтительно колеблется в интервале от около 25% до около 32% (вес/вес). Таблетка может включать различные один или более наполнители, такие как связывающие соединения, забуферивающие агенты, любриканты, агенты, увеличивающие скольжение,загущающие агенты, подсластители, вкусовые отдушки и красители. Некоторые наполнители могут сочетать многие свойства. В производстве определенных лекарственных форм могут применяться агенты, увеличи 13 вающие смазку и скольжение, и это действительно обычно используется при производстве таблеток. Примерами агентов, увеличивающих смазку и скольжение, являются гидрогенизированные растительные масла, например гидрогенизированное хлопковое масло, стеарат магния, стеариновая кислота, лаурилсульфат натрия, лаурилсульфат магния, коллоидный кремний, тальк, их смеси и другие наполнители,известные науке. Вызывающими интерес агентами, увеличивающими смазку и скольжение,являются стеарат магния и смеси стеарата магния с коллоидным кремнием. Предпочтительным любрикантом является гидрогенизированное растительное масло типа I, наиболее предпочтительным гидрогенизированное дезодорированное хлопковое масло (коммерчески доступное от Karlshamns как Akofine NF (называемое ранее Sterotex. Агенты, увеличивающие смазку и скольжение, обычно составляют от 0,2 до 7,0% общего веса таблетки. В таблетки настоящего изобретения могут также добавляться другие наполнители, такие как красители и пигменты. Красители и пигменты включают двуокись титана и красители, пригодные для питания. Краситель является необязательным ингредиентом, но при применении,он должен присутствовать в количестве до 3,5% от общего веса таблетки. Вкусовые отдушки добавляют в композицию по желанию и они могут выбираться из синтетических ароматизирующих масел и цветочных ароматизаторов или натуральных масел,экстрактов из листьев растений, цветов, фруктов и так далее, а также их комбинаций. Они могут включать коричное масло, масло гаултерии,масла мяты перечной, масло лавра, анисовое масло, эвкалиптовое масло и масло чабреца. Как вкусовые отдушки применимы также ваниль,масло цитрусовых, включая лимон, апельсин,виноград, лайм, грейпфрут, и фруктовые эссенции, выключая яблочную, банановую, грушевую, персиковую, клубничную, малиновую,вишневую, сливовую, ананасовую, абрикосовую и так далее. Количество вкусовой отдушки может зависеть от множества факторов, включая желаемые органолептические эффекты. Обычно вкусовые отдушки должны присутствовать в количестве от около 0% до около 3% (вес/вес). Как известно, измельченный состав для производства таблеток может гранулироваться сухим или влажным способом перед формированием таблеток. Сам по себе процесс производства таблеток в других отношениях является стандартным и готовым к практическому применению для формирования таблеток соответствующей формы из желаемой сухой или влажной смеси компонентов с помощью традиционного пресса для производства таблеток. Таблетки настоящего изобретения могут дополнительно покрываться оболочкой для улучшения вкуса, обеспечения легкости прогла 001219 14 тывания и придания привлекательного внешнего вида. Науке известно много подходящих полимерных материалов для использования при покрытии оболочкой. Предпочтительным материалом для покрытия оболочкой является гидроксипропилметилцеллюлоза НРМС, особенно НРМС 2910 5 mPas. (мнс/м 2). В данном случае могут также быть использованы другие подходящие полимеры для покрытия оболочкой,включая гидроксипропилцеллюлозу и акрилатметакрилат кополимеры. Кроме полимера для покрытия оболочкой, покрытие оболочки может дополнительно включать пластификатор (например, пропиленгликоль) и по желанию краситель (например, двуокись титана). Суспензия для покрытия оболочкой также может содержать тальк как антиадгезивный агент. В таблетках с немедленным высвобождением в соответствии с настоящим изобретением оболочка является небольшой в плане веса и составляет менее чем около 3% (вес/вес) от общего веса таблетки. Предпочтительными лекарственными формами являются те из них, в которых вес частиц составляет, по крайней мере, 40% от общего веса всей лекарственной формы, вес разбавителя находится в интервале от 20 до 40%, вес дезинтегратора колеблется в пределах от 3 до 10%, и оставшийся вес распределяется между одним или более наполнителями, описанными выше. Следующий состав может быть представлен как пример предпочтительной пероральной лекарственной формы, включающей 200 мг итраконазола: 21,65% итраконазола (200 мг) 32,48% НРМС 2910 5 mPas, (мнс/м 2) (300 мг) 30,57% высушенной при распылении смеси моногидрат лактозы: микрокристаллическая целлюлоза (75:25)(282,4 мг) 8,49% кросполивидона (78,4 мг) 2,79% талька (25,8 мг) 0,93% гидрогенизированного растительного масла Типа I (8,6 мг) 0,28% коллоидного безводного кремния(13,57) 0,37% пропиленгликоля (3,39 мг) 0,29% талька (2,71 мг) 0,44% двуокиси титана (4,07 мг), что дает 2,57% оболочку таблетки. Предпочтительными лекарственными формами настоящего изобретения являются те,в которых, по крайней мере, 85% доступного итраконазола растворяется в течение 60 мин,когда лекарственная форма, эквивалентная 200 мг итраконазола, тестируется, как прямо установлено в USP тесте 711, в USP-2 аппарате(60'). Таблетки в соответствии с настоящим изобретением предпочтительно должны растворяться быстрее и иметь Q85% (15'), более предпочтительно Q85% (5'). Настоящее изобретение дополнительно относится к способу получения частиц, как описано здесь выше, который характеризуется смешиванием компонентов, прессованием указанной смеси при температуре в интервале 120300 С, измельчением продукта прессования и,по желанию, просеиванием частиц. Изобретение также касается твердых дисперсий, получаемых путем прессования при плавлении(a) итраконазола или одного из его стереоизомеров или смеси из двух, или трех, или четырех его стереоизомеров, и(b) одного или более фармацевтически приемлемых водорастворимых полимеров. В другом варианте, изобретение относится к способу получения фармацевтической лекарственной формы, как описано здесь, характеризуемому смешиванием терапевтически эффективного количества частиц, как описано здесь ранее, с фармацевтически приемлемыми наполнителями и прессованием указанной смеси в таблетки. Дополнительно это изобретение касается частиц, как описано здесь, для применения при приготовлении фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, которая может вводиться указанному млекопитающему как одна единица лекарственной формы один раз в день. Изобретение также относится к частицам,как описано здесь, применяемым в получении фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, где указанная лекарственная форма может вводиться в любое время дня независимо от приема пищи указанным млекопитающим. Настоящее изобретение также касается применения частиц, в соответствии с тем, что описано ранее, для получения фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, в которой одна такая единица лекарственной формы может вводиться один раз в день указанному млекопитающему. Настоящее изобретение также касается применения частиц, как описано ранее, для получения фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, в кото 001219 16 рой указанная лекарственная форма может вводиться в любое время дня независимо от приема пищи указанным млекопитающим. Изобретение также относится к способу лечения грибковой инфекции млекопитающего,который включает введение указанному млекопитающему эффективного как антигрибкового агента количества итраконазола в виде одной единицы лекарственной дозы, которая может вводиться один раз в день. Изобретение также относится к способу лечения грибковой инфекции млекопитающего,который включает введение указанному млекопитающему эффективного как антигрибкового агента количества итраконазола в виде одной единицы лекарственной дозы, которая может вводиться в любое время дня независимо от приема пищи указанным млекопитающим. Изобретение также относится к фармацевтической упаковке, приемлемой для коммерческой продажи, включающей контейнер, пероральную форму итраконазола, как описано в данной заявке, и прилагаемую к указанной упаковке письменную инструкцию, в которой отсутствуют какие-либо ограничения, касающиеся применения лекарственной формы до или после еды. Обнаружено, что таблетки настоящего изобретения характеризуются заметно более низкой зависимостью действия от приема пищи,чем ранее известные науке капсулы Sporanox. Это означает, что различие между приемом медикамента после еды или натощак значительно менее выражены когда вводятся таблетки настоящего изобретения, чем когда вводятся капсулы Sporanox. Это, конечно, огромное достижение, поскольку лекарственная терапия может проводиться в любое время в течение дня и больше не зависит от приема пищи. Более того,больные, которые страдают рвотой или которые не в состоянии принимать пищу, все-таки могут принимать таблетки настоящего изобретения. Пример 1. а) Получение Triaset. Смесь 40/60 (об/об) итраконазола (21,74 кг) и гидроксипропилметилцеллюлозы 2910 5 mPas(1) (мнс/м 2) или НРМС 2910 5 mPas(мнс/м 2) (32,11 кг) просеивали и смешивали в шаровом смесителе до возникновения гомогенности смеси. Эта механическая смесь итраконазола и НРМС известна также под названиемb) Получение продукта прессования при плавлении 1500 г Triaset помещали в двушнековый червячный плавильный пресс типа APVBaker MP19 L/D 15, при соблюдении следующих рабочих параметров: температура первого отделения составляла 245 С, температура второго отделения составляла 265 С, скорость вращения шнеков пресса составляла 20-300 оборотов/мин и прессование проводили в течение 120 мин. Прессованный продукт помещали 17 в молотковую мельницу типа Fitzmill, размер отверстий сита составлял 0,125 дюйма (=0,32 см), а скорость вращения составляла 1640 оборотов в минуту. Измельченный прессованный продукт вновь помещали в молотковую мельницу, на этот раз с размером отверстий сита 0,063 дюйма (=0,16 см) и скоростью вращения 1640 оборотов в минуту. Выход составил 1169 гc) Получение таблетируемой смеси. С помощью шарового смесителя измельченный продукт прессования (1169 г, 71%(вес/вес перемешивали с просеянными микрокристаллической целлюлозой (351 г, 21%(вес/вес, кросповидоном (117 г, 7% (вес/вес,Aerosil (коллоиднной двуокисью кремния) (5 г,0,3% (вес/вес и Sterotex (8 г, 0,5% (вес/вес до достижения гомогенности смеси (15 мин).d) Таблетирование. Используя смесь, полученную в с), приготовили 1450 овальных двояковыпуклых с бороздкой посередине таблеток по 706 мг (длина штампа =17,6 мм, ширина = 8,4 мм) на оборудовании Excenterpress Courtoy 27. Пример 2. Процесс, описанный в примере 1, был повторен, но стадию прессования проводили следующим образом: 1000 г Triaset помещали в плавильный пресс типа APV-Baker MP19 L/D 15, при соблюдении следующих рабочих параметров: температура первого отделения составляла 170 С, температура второго отделения составляла 170 С, скорость вращения двух шнеков пресса составляла 450 оборотов в мин. Прессованный продукт помещали в молотковую мельницу типа Fitzmill, размер отверстий сита составлял 0,125 дюйма (=0,32 см), а скорость вращения составляла 1640 оборотов в минуту. Измельченный прессованный продукт вновь помещали в молотковую мельницу, на этот раз с размером отверстий сита 0,063 дюйма (=0,16 см) и скоростью вращения 1640 оборотов в минуту. Таблетки, полученные тем же способом,что и в примере 1, имели следующие характеристики:- высота: 6,70,1 мм Пример 3. Содержание итраконазола в плазме крови здоровых добровольцев после однократного перорального введения 200 мг двух разных лекарственных форм натощак. Лечение доступными капсулами итраконазола предшествующего поколения. 200 мг в виде двух покрытых кор-капсул Лечение таблетками настоящего изобретения, полученными в примере 1, т.е. 200 мг прессованной при плавлении таблетки натощак Время (ч) Концентрация в плазме, среднее (стандартное отклонение) 0 не определяли(1) 1 54,4 (51,3) 2 143 (97,8) 3 191(111) 4 208 (124) 5 198 (136) 6 153 (107) 8 124 (79) 24 44,5 (24,2) Это ограниченное исследование на добровольцах (п=5) показывает, что в условиях натощак прессованная при плавлении таблетка даетAUC итраконазола (которая служит мерой биологической доступности итраконазола), в 2.3 раза превышающую AUC итраконазола, вводимого в виде 2 капсул Sporanox по 100 мг. Использование непараметрического теста(WILСОХON) показывает, что это различие достоверно с доверительным уровнем 90%. Пример 4.a) Получение таблетируемой смеси. Высушенная распылением смесь моногидрата лактозы (75%) и микрокристаллической целлюлозы (25%) (2,824 кг, 30,57% (вес/вес,кросповидон (784 г, 8,49% (вес/вес, тальк (258 г, 2,79% (вес/вес, Aerosil (26 г, 0,28%(вес/вес, стеарат магния (22 г, 0,24% (вес/вес и Sterotex (86 г, 0,093% (вес/вес просеивали и смешивали с измельченньм продуктом прессования (5 кг, 54,13% (вес/вес с помощью шаровой мельницы до достижения гомогенности (15 мин). Все вес.% (вес/вес) рассчитаны на основе суммарного веса покрытой оболочкой таблетки.(85%). НРМС 2910 5 mPas (мнс/м 2) добавляли в очищенную воду и перемешивали до полного растворения. Раствор оставляли до просветления. Добавляли пропиленгликоль и перемешивали до достижения однородности. Тальк и двуокись титана добавляли к раствору и перемешивали до однородности. Таблетки, полученные вd), помещали в чан для покрытия и опрыскивали окрашенным раствором для покрытия. Средний вес таблетки составлял 924,7 мг.d) Упаковка. Покрытые таблетки упаковывали в облатки из поливинил/алюминиевой фольги со вздутиями, которые в свою очередь упаковывали в картонные коробки. е) Показатели растворимости. Исследования растворения in vitro проводили с лекарственной формой в виде таблеток по 200 мг. Среда представляла собой 900 мл 0,1N НС 1 при 37 С в Аппарате 2 (USP 23, 711 Растворение, с. 1791-1793) (лопастная мешалка,100 об/мин). Концентрацию активного ингредиента итраконазола в тестирующей среде определяли после забора образцов по 3 мл через указанные интервалы времени путем измерения поглощения при 254 нм, на основе чего рассчитывали концентрацию. Получены следующие результаты: Вычисленная концентрация (% весвес) активной дозы Время,мин 0 5 15 30 45 60 Пример 5. а) Получение частиц 125 мкм. 1500 г Triaset подвергали прессованию при плавлении, как описано в примере 1, измельчали в Futzmill молотковой мельнице при 4736 об./мин и просеивали через сито с отверстиями 0,51 мм. Фракцию частиц с размером 125 мкм отделяли последующим просеиванием через сито No 120 (ASTM E11-70); выход составил 10%.b) Таблетирование. Получали смесь для таблетирования с составом, описанным в примере 4, но содержащую частицы с размером 125 мкм, и прессовали на станке для таблетирования Korsch, работающем со скоростью 10,800 таблеток в час при давлении сжатия от 1500 до 1950 кг/см 2 (147191,1 МРа). Длина формы составляла 19 мм,ширина 9,5 мм, радиус кривизны 9,57 мм. 20 Таблетки обладали следующими характеристиками:- хрупкость: 0% ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Частица, представляющая собой твердую дисперсию, включающая(a) итраконазол, или один из его стереоизомеров, или смесь из двух или трех, или четырех его стереоизомеров, и(b) один или более фармацевтически пригодных водорастворимых полимеров. 2. Частица по п.1, имеющая размер менее 600 мкм. 3. Частица по п.1 или 2, в которой итраконазол находится в некристаллической фазе. 4. Частица по п.3, в форме твердого раствора, включающего (a) и (b), или в форме дисперсии, в которой аморфный или микрокристаллический (а), или аморфный или микрокристаллический (b) распределен более или менее равномерно в твердом растворе, включающем(а) или (b). 5. Частица в соответствии с предшествующими пунктами, в которой водорастворимый полимер представляет собой полимер, который имеет кажущуюся вязкость от 1 до 100mPas. (мнс/м 2) при растворении в 2% водном растворе при 20 С. 6. Частица по п.5, в которой водорастворимый полимер выбран из группы, включающей алкилцеллюлозы, такие как метилцеллюлоза,гидроксиалкилцеллюлозы, такие как гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза,гидроксипропилцеллюлоза и гидроксибутилцеллюлоза,гидроксиалкилалкилцеллюлозы, такие как гидроксиэтилметилцеллюлоза и гидроксипропилметилцеллюлоза,карбоксиалкилцеллюлозы, такие как карбоксиметилцеллюлоза,соли щелочных металлов и карбоксиалкилцеллюлоз, такие как натрий карбоксиметилцеллюлоза,карбоксиалкилалкилцеллюлозы, такие как карбоксиметилэтилцеллюлоза,эфиры карбоксиалкилцеллюлоз,крахмалы,пектины, такие как натрий карбоксиметиламилопектин,производные хитина, такие как хитозан,полисахариды, такие как альгиновая кислота, щелочные металлы и их аммониевые соли, полисахариды из съедобных водорослей(ирландского мха), галактоманнаны, трагакант, 21 агар-агар, гуммиарабик, гуаровая (guar) камедь и ксантановая камедь,полиакриловые кислоты и их соли,полиметакриловые кислоты и их соли, сополимеры метакрилата,поливиниловый спирт,поливинилпирролидон, сополимеры поливинилпирролидона с винилацетатом,полиалкиленоксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксида и пропиленоксида. 7. Частица по п.6, в которой водорастворимый полимер представляет собой гидроксипропилметилцеллюлозу НРМС 2910 с вязкостью 5 mPas. (мнс/м 2). 8. Частица по п.7, в которой весовое отношение (а):(b) находится в интервале от 1:1 до 1:17. 9. Частица в соответствии с любым из предшествующих пунктов, полученная путем прессования при плавлении компонентов и измельчения и, необязательно, просеивания. 10. Частица по любому из предшествующих пунктов, состоящая из твердого раствора,включающего две весовые части итраконазола и три весовые части гидроксипропилметилцеллюлозы НРМС 2910 с вязкостью 5 mPas. (мнс/м 2). 11. Частица в соответствии с предшествующими пунктами, дополнительно включающая один или более фармацевтически приемлемых наполнителей. 12. Фармацевтическая лекарственная форма, включающая терапевтически эффективное количество частиц, как указано в любом из предшествующих пунктов. 13. Лекарственная форма по п.12 в виде таблетки для перорального введения. 14. Лекарственная форма по п.12, характеризующаяся немедленным высвобождением итраконазола после приема внутрь, в которой указанные частицы гомогенно распределены в смеси разбавителя или дезинтегратора. 15. Лекарственная форма по п.13 или 14,покрытая оболочкой, включающей полимер,образующий оболочку, пластификатор и, необязательно, краситель. 16. Лекарственная форма по п.14, в которой разбавителем является высушенная при распылении смесь моногидрата лактозы и микрокристаллической целлюлозы (75:25), а дезинтегратор представляет собой кросповидон или кроскармеллозу. 17. Лекарственная форма по любому из пп. 12-16, в которой вес указанных частиц составляет, по крайней мере, 40% от общего веса лекарственной формы. 18. Лекарственная форма по п.12, включающая по весу, исходя из общего веса лекарственной формы: 21,65% итраконазола (200 мг) 32,48% НРМС 2910 с вязкостью 5 mPas. 22 30.57% высушенной при распылении смеси моногидрат лактозы: микрокристаллическая целлюлоза (75:25)(25,8 мг) 0,93% гидрогенизированного растительного масла Типа I (8,6 мг) 0,28% коллоидного безводного кремния(13,57) 0,37% пропиленгликоля (3,39 мг) 0,29% талька (2,71 мг) 0,44% двуокиси титана (4,07 мг), что входит в состав 2,57% оболочки таблетки. 19. Лекарственная форма по любому из пп.12-18, характеризующаяся тем, что, по крайней мере, 85% доступного итраконазола растворяется в течение 60 мин, когда лекарственная форма, эквивалентная 200 мг итраконазола, тестируется, как установлено в USP тесте 711, вUSP-2 аппарате для растворения при следующих условиях: 900 мл фосфатного буфера, рН 6,0, 37 С при скорости вращения мешалки 100 об/мин. 20. Способ приготовления частиц, как заявлено в любом из пп.1-11, отличающийся тем,что смешивают компоненты, прессуют указанную смесь при температуре в интервале 120300 С, измельчают продукт прессования и, необязательно, просеивают полученные частицы. 21.Твердая дисперсия, полученная путем прессования при плавлении(a) итраконазола, или одного из его стереоизомеров, или смеси из двух или трех его стереоизомеров, и(b) одного или более фармацевтически приемлемых водорастворимых полимеров. 22. Способ получения фармацевтической лекарственной формы по пп.12-19, отличающийся тем, что смешивают терапевтически эффективное количество частиц по пп.1-11 с фармацевтически приемлемыми наполнителями и прессуют указанную смесь в таблетки. 23. Применение частиц в соответствии с любым из пп. от 1 до 11 для приготовления фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, которая может вводиться указанному млекопитающему в виде единичной лекарственной формы один раз в день. 24. Применение частиц в соответствии с любым из пп. от 1 до 11, для получения фармацевтической лекарственной формы для перорального введения млекопитающему, страдающему грибковой инфекцией, где указанная лекарственная форма может вводиться в любое время дня независимо от приема пищи указанным млекопитающим. 25. Фармацевтическая упаковка, включающая контейнер, пероральную форму итраконазола по любому из пп.12-19 и прилагаемую 24 к указанной упаковке письменную инструкцию,в которой указывается отсутствие ограничений в применении лекарственной формы до или после еды.
МПК / Метки
МПК: A61K 9/14
Метки: доступностью, антигрибковые, композиции, улучшенной, биологической
Код ссылки
<a href="https://eas.patents.su/13-1219-antigribkovye-kompozicii-s-uluchshennojj-biologicheskojj-dostupnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Антигрибковые композиции с улучшенной биологической доступностью.</a>
Предыдущий патент: Способ отделения кислотных соединений фосфора в присутствии металл-органофосфитного комплексного катализатора.
Следующий патент: Пептид или пептидомиметик, который связывается с рецептором тромбоэтина, фармацевтическая композиция и способ лечения.
Случайный патент: Соединения изоксазола

















