Иммунотерапевтический набор для лечения опухолей
Номер патента: 7381
Опубликовано: 27.10.2006
Авторы: Кромбет Рамос Таня, Босолей Дельгадо Ирене, Гонсалес Маринельо Хисела Мария, Перес Родригес Роландо
Формула / Реферат
1. Иммунотерапевтический набор для лечения опухолей, эффект которого направлен на клетки, рост которых зависит от экспрессии EGF-рецептора (рецептор эпидермального фактора роста), отличающийся тем, что включает в себя компоненты А, В, С и D, которые применяются одновременно или последовательно в комбинациях А+С; или A+D; или В+С; или B+D; где А, В, С и D представляют собой следующее:
A - антитело против EGF-рецептора;
B - антитело против лиганда (лигандов) EGF-рецептора;
C - вакцина, содержащая EGF-рецептор, которая индуцирует образование антител против указанного рецептора;
D - вакцина, содержащая лиганд (лиганды) EGF-рецептора, которая индуцирует антитела против указанного лиганда (лигандов).
2. Иммунотерапевтический набор по п.1, где антитело против EGF-рецептора представляет собой гуманизированное антитело.
3. Иммунотерапевтический набор по п.2, где гуманизированное антитело против EGF-рецептора представляет собой IOR R3, депонированное под номером ЕСАСС 951110101.
4. Иммунотерапевтический набор по п.1, где антитело против лиганда (лигандов) EGF-рецептора представляет собой антитело против EGF.
5. Иммунотерапевтический набор по п.1, где антитело против лиганда (лигандов) EGF-рецептора представляет собой антитело против TGF-a .
6. Иммунотерапевтический набор по п.1, где вакцина содержит EGF в качестве лиганда EGF-рецептора.
7. Иммунотерапевтический набор по п.6, где вакцина дополнительно содержит белок Р64K из Neisseria meningitidis, конъюгированный с EGF в качестве лиганда EGF-рецептора.
8. Иммунотерапевтический набор по п.1, где вакцина содержит TGF-a в качестве лиганда EGF-рецептора.
9. Иммунотерапевтический набор по п.8, где вакцина дополнительно содержит белок Р64K из Neisseria meningitidis, конъюгированный с TGF-a в качестве лиганда EGF-рецептора.
Текст
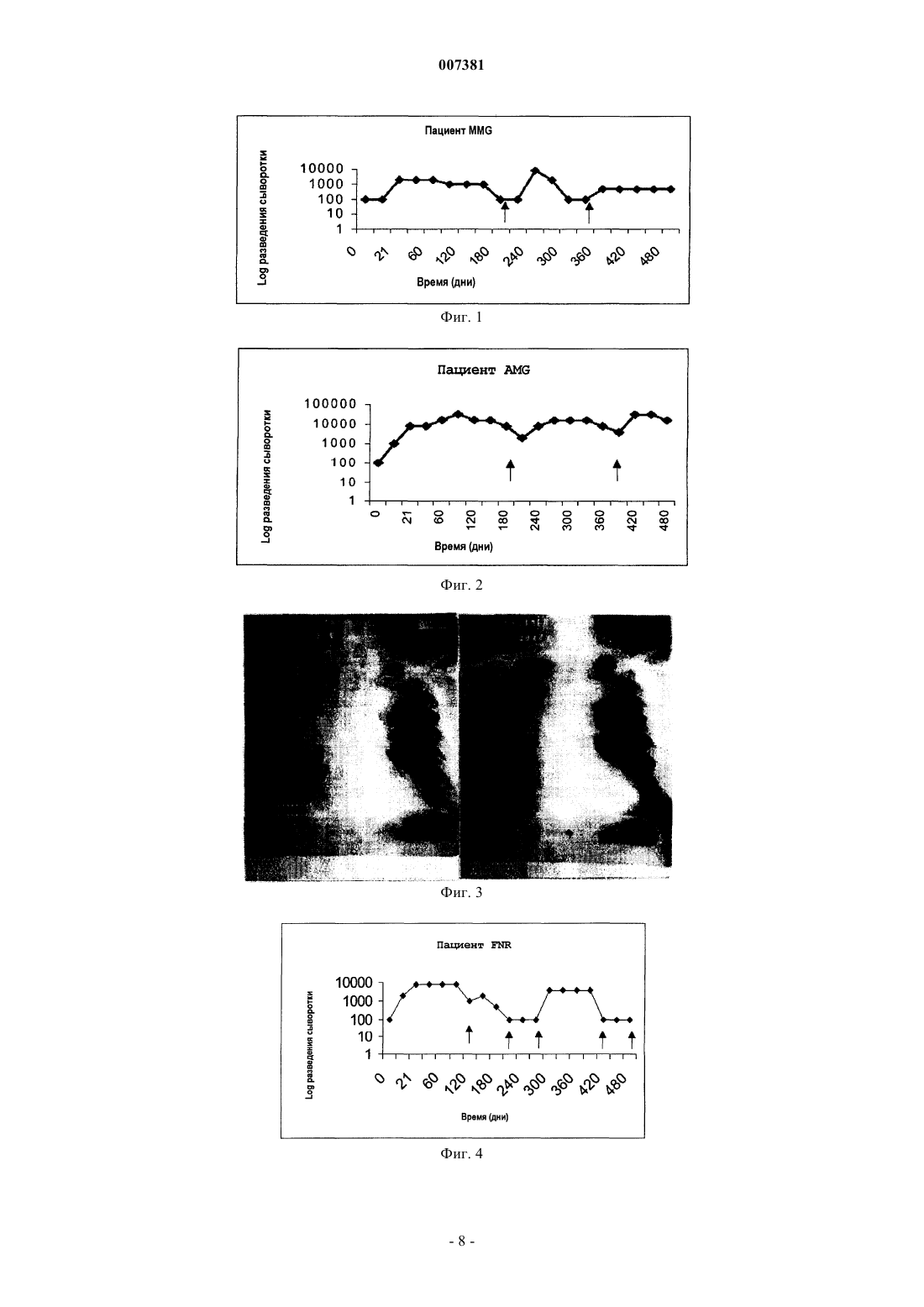
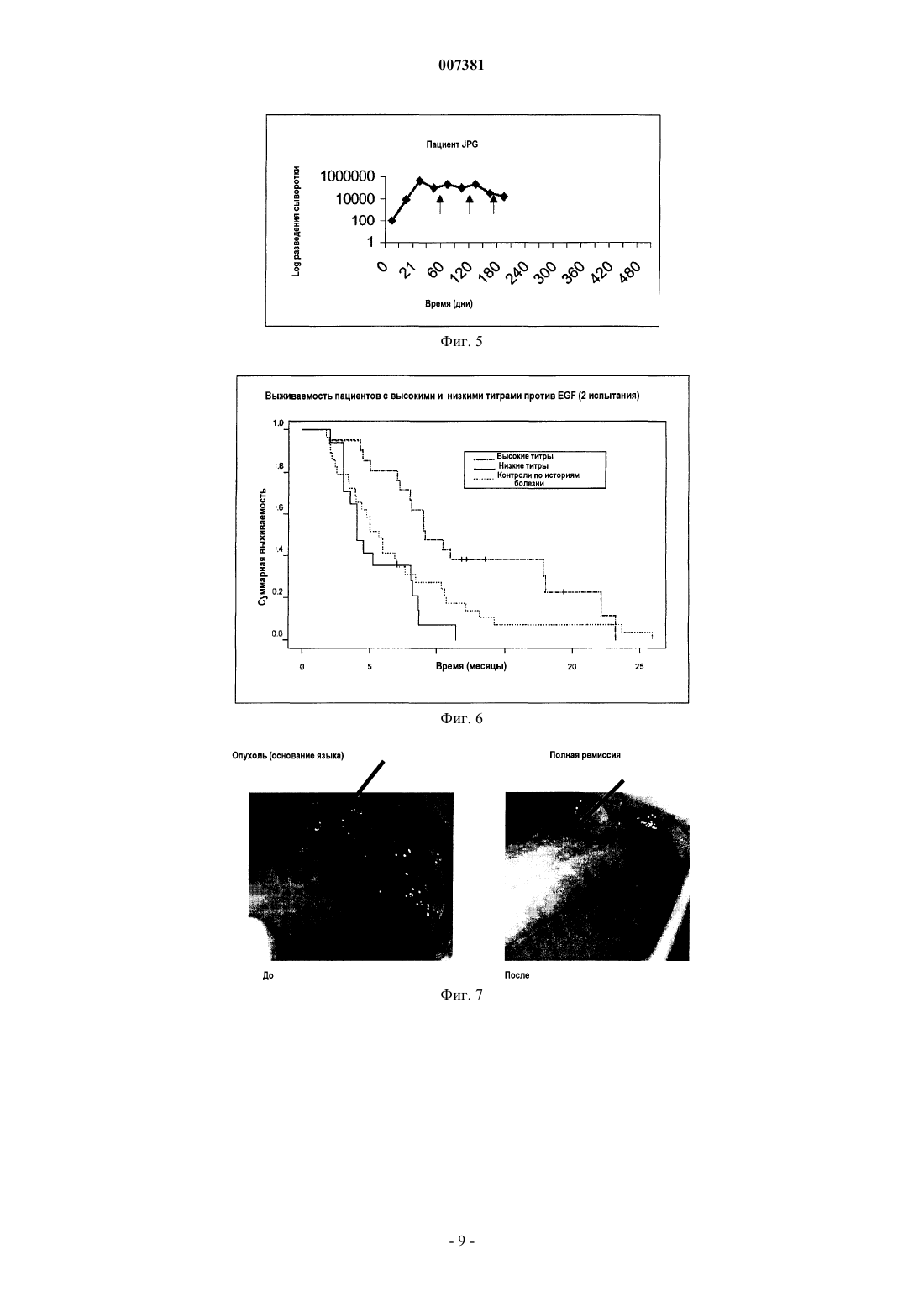
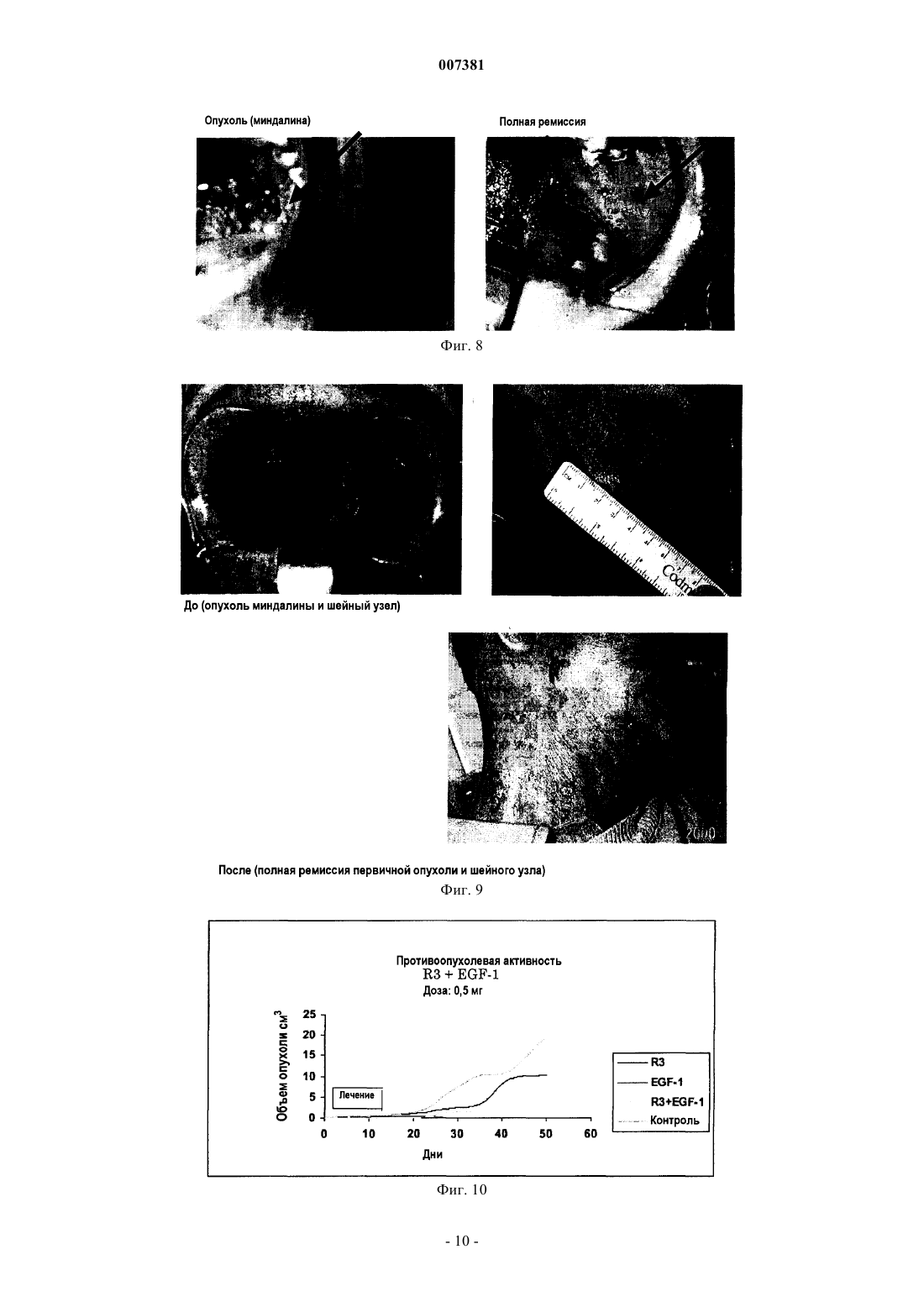
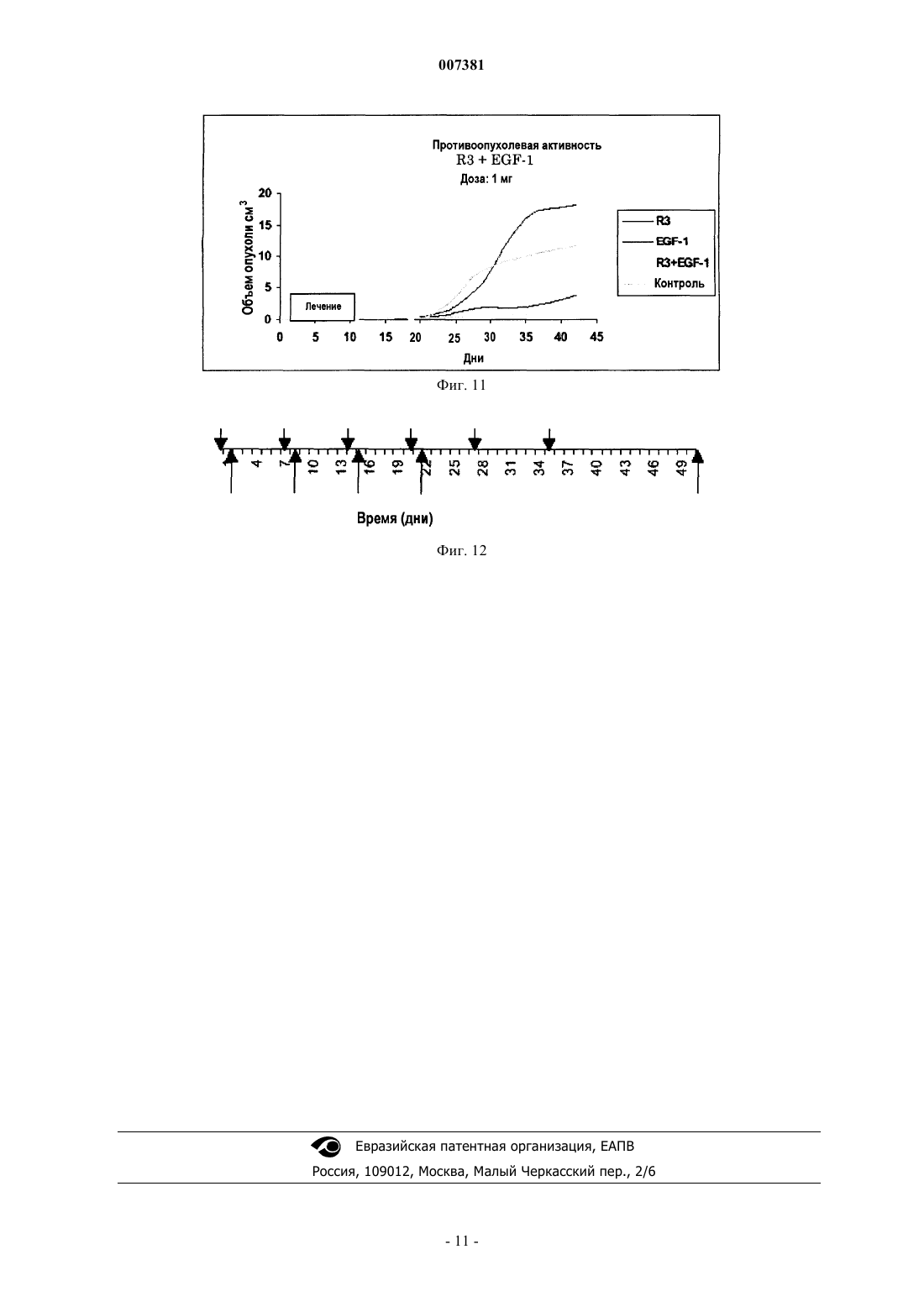
007381 Область техники Настоящее изобретение относится к иммунологии, в частности к иммунотерапии злокачественных опухолей; более конкретно, к иммунотерапевтическому набору, включащему в себя антитела и вакцины,содержащие EGF-рецепторы или лиганды EGF-рецепторов, для индукции малой скорости роста и/или устранения опухолевых клеток. Предпосылки к созданию изобретения Система рецептора EGF (EGF-R) и его лигандов составляет молекулярный комплекс, взаимодействия внутри которого специфическим образом регулируют клеточный рост, а их влияние продемонстрировано в неконтролируемом росте опухолей эпителиального происхождения. Во время онкогенеза паракринный и аутокринный контроль активации EGF-R разрегулирован в силу чрезмерной продукции фактора роста вследствие высокой скорости синтеза и/или мутаций рецептора.EGF-R представляет собой трансмембранный гликопротеин из 118 аминокислот с молекулярной массой 170 кДа, который повсеместно экспрессируется в нормальных тканях. Он участвует в нескольких стадиях эмбрионального развития. Связывание с его специфичными лигандами, EGF или TGF-, индуцирует димеризацию рецептора,а также гетеродимеризацию с другими членами семейства ErbB, такими как HER-2 (Cohen B.D. et al.,(1996), J. Biol. Chem. 217:7620-7629). Связывание лиганда с рецепторами высвобождает каскад внутриклеточных сигналов (Ullrich Т.О. и Schlessinger J. (1990), Cell 61:203-212), который управляет ростом и дифференцировкой клеток. Избыточная экспрессия рецептора наблюдается при некоторых видах злокачественных опухолей, главным образом эпителиального происхождения, которые являются мишенью иммунотерапии злокачественных опухолей. Это происходит при опухолях молочной железы, мочевого пузыря, яичника, матки, толстого кишечника, легкого, головного мозга, предстательной железы и головы и шеи. Экспрессия EGF-R, как было доказано, является показателем неблагоприятного прогноза при раке молочной железы (Perez R. et al. (1984) Breast Cancer and Treatment 4:189-193). В то время как роль EGFR и его лигандов для роста опухолей до настоящего времени неизвестна, существуют предположения о том, что экспрессия EGF-R в опухолевых клетках индуцирует механизм аутокринной стимуляции, которая ведет к неконтролируемой пролиферации указанных клеток (Schlessinger J. et al., (1983) Crit. Rev.Biochem. 14 (2):93-111). Главными лигандами данной системы являются эпидермальный фактор роста (EGF) и трансформирующий фактор роста типа альфа (TGF-). Существуют другие лиганды, принадлежащие к надсемействуEGF, такие как амфирегулин (AR), крипто-I (CR1), гепариновый фактор роста, бетацеллюлин, эпирегулин и другие.EGF представляет собой полипептид из 53 аминокислот с молекулярной массой 6045 Да, который является митогенным для клеток эпителиального происхождения. Его действие является, главным образом, паракринным, через его связывание с EGF-R. TGF- представляет собой полипептид из 50 аминокислот, способный конкурировать с EGF за связывание с EGF-R. Анти-ЕGF-антитела не способны распознавать TGF- (Todaro G.J. et al. (1976), Nature 264:26-31), что означает, что оба данных фактора роста представляют собой две иммунологически различные сущности. Система EGFR - лиганд являлась мишенью пассивной иммунотерапии (PI) с использованием моноклональных антител (Mab) против EGF-R в нативной форме, связанных с лекарственными средствами, токсинами или радиоактивными изотопами(Vollmar A.M. et al. (1987) J. Cell Physiol. 131:418-425), для опухолей с высокой экспрессией данного рецептора. Указанные антитела были выбраны за их способность ингибировать связывание EGF с его рецептором (нейтрализующие антитела). Осуществляется ряд клинических испытаний с использованиемMab, и некоторые из них показали обнадеживающие результаты, как, например, это произошло во времяII фазы клинических испытаний с использованием Mab при раке молочной железы, поджелудочной железы и почки, и, кроме того, во время III фазы клинических испытаний при раке головы и шеи (Mendelsohn, J. et al. (1999) American Society of Clinical Oncology Meeting). Другие клинические испытания во время фазы II, показывающие хорошие результаты, выполнялись с использованием Mab IOR-R3 при опухолях легких (Crombet Т. et al. (2000) Cancer Biotherapy and Biopharmaceutical, рукопись, принятая для публикации). Пассивная иммунотерапия с использованием IOR-R3 Mab (ЕР 586002 В 1), специфичных в отношении EGF-R, показала, что специфичное связывание IOR-R3 с рецептором ингибирует связываниеEGF/EGF-R, с последующим ингибированием аутофосфорилирования EGFR. В свою очередь, пассивная иммунотерапия с использованием IOR-R3 ингибировала рост человеческих опухолевых клеток у бестимусных мышей, и она уменьшала скорость роста опухолей у некоторых пациентов в клинических испытаниях. Данная система также являлась мишенью иммунотерапии злокачественных опухолей со специфичной активностью. Одним примером является применение вакцины, состоящей из одного из основных лигандов EGF-R, EGF, соединенного с белком-носителем (патент США 5894018). Данная вакцина способна индуцировать специфичный антительный ответ против аутологичного EGF для ингибирования связывания EGF/EGF-R, блокируя, таким образом, механизмы пролиферации, индуцированные указанным связыванием. Доклинические исследования показали, что у мышей, иммунизированных аутологич-1 007381 ным EGF, соединенным с белком-носителем и введенным с подходящим адъювантом, повышалась выживаемость после трансплантации мышам клеток асцитной опухоли Enrlich (EAT) (Gonzalez G. et al.(1996), Vaccine Research 5(4):233-243; Gonzalez G. et al. (1996), Vaccine Research 6(2):91-100). Имеется сообщение о результатах фазы I клинических испытаний вакцины, содержащей человеческий рекомбинантный EGF, которая подтверждает иммуногенность и безопасность вакцинации (Gonzalez G. et al. (1998), Annals of Oncology 9:1-5). Описание изобретения Настоящее изобретение относится к применению комбинированных иммунотерапевтических агентов, направленных против рецепторов с активностью тирозинкиназы (RTK) и против их лигандов, с целью потенцировать эффект, который наблюдается при использовании независимо друг от друга различных форм иммунотерапевтических лекарственных средств, описанных ранее, направленных только против одного из компонентов системы рецептор/лиганд. Данное потенцирование подтверждается блокадой обоих - и лиганда, и рецептора - в способе лечения, который включает оба главных активных ингредиента. В частности, настоящее изобретение относится к набору для лечения опухолей, эффект которого направлен на клетки, рост которых зависит от системы рецепторов с активностью тирозинкиназы, который отличается тем, что включает в себя компоненты А, В, С и D, которые применяются одновременно или последовательно в комбинациях А+С; или A+D; или В+С; или B+D; где А, В, С и D представляют собойA - антитело против рецептора RTK;B - антитело против лиганда (лигандов) рецептора RTK;C - вакцину, содержащую рецептор RTK, которая индуцирует антитела против указанного рецептора RTK;D - вакцину, содержащую лиганд (лиганды) рецептора RTK, которая индуцирует антитела против указанного лиганда (лигандов). В предпочтительном варианте осуществления настоящего изобретения моноклональное антитело против рецептора RTK представляет собой антитело против рецептора эпидермального фактора роста, REGF и, более конкретно, представляет собой гуманизированное антитело против EGF-R, hR3, которое хранится в депозитарии ЕСАСС в Англии под номером 951110101. В другом варианте осуществления настоящего изобретения антитело против лиганда рецептораRTK может представлять собой антитело против EGF или против TGF-. Также настоящее изобретение относится к иммунотерапевтическому набору, который включает в себя вакцину, содержащую в качестве активного начала EGF-R, EGF, TGF- или конъюгаты указанных молекул с белком p64K Neisseria meningitis. Иммунотерапевтический набор согласно настоящему изобретению в предложенных комбинациях ингибирует рост опухолевых клеток с целью элиминации указанных клеток на основе блокады рецепторов RTK и их лигандов. Данной блокады можно добиться, помимо других подходов, с использованием комбинации одновременно или последовательно активных иммунотерапевтических агентов (терапевтических вакцин) и пассивных иммунотерапевтических агентов (Mab), направленных против факторов роста (т.е. EGF, TGF) и их рецепторов (т.е. EGF-R). Блокада факторов роста или их рецепторов вызывает ингибирование пролиферации клеток. В настоящем изобретении авторы показали, что одновременная блокада лигандов и/или рецепторов потенцирует ингибирующий эффект в отношении пролиферации клеток. Данная терапевтическая концепция имеет огромное значение для лечения злокачественных опухолей, которые в своей основе появляются вследствие повышения скорости пролиферации клеток. Описанные иммунотерапевтические комбинации компонентов набора вызывают блокаду рецепторов RTK и/или их лигандов с помощью активных и пассивных иммунотерапевтических комбинаций. Описанные процедуры можно применять у пациентов, имеющих опухоли эпителиального происхождения, которые избыточно экспрессируют EGF-R, на различных клинических стадиях. Комбинация активной и пассивной иммунотерапии может быть одновременной или последовательной, независимо от терапевтической процедуры, применяющейся у пациентов на поздних стадиях заболевания, или использоваться в качестве вспомогательного лечения. В случаях заболевания на поздних стадиях предполагаемая терапевтическая комбинация представляет собой пассивную иммунотерапию с использованием Мab, которые распознают рецептор RTK, и/или Маb, которые распознают лиганды указанного рецептора, в комбинации с онкоспецифичной терапией выбора, в качестве первой линии терапии, с последующей активной иммунотерапией с использованием вакцин, направленных против лигандов рецептора и/или против рецептора, для поддержания терапевтического эффекта. В случаях вспомогательного лечения, предполагаемые терапевтические комбинации представляют собой пассивную иммунотерапию с использованием Mab, которые распознают рецептор RTK и/или его лиганды, с активной иммунотерапией, с использованием вакцин, направленных против лигандов рецеп-2 007381 тора или самого рецептора. Или пассивную иммунотерапию с использованием Mab, которые распознают рецептор RTK или его лиганды, в качестве ударной терапии, с последующей активной иммунотерапией,с использованием вакцин, направленных против лигандов рецептора или самого рецептора, в качестве поддерживающего лечения. Способ применения набора согласно настоящему изобретению объясняют процедуры, представленные ниже. Процедура 1. Терапевтическая комбинация, включающая в себя пассивную иммунотерапию с использованием Mab, которые распознают рецептор RTK (т.е. EGF-R) и/или лиганды рецептора (т.е. EGF,TGF-), с последующей активной терапией с использованием вакцин, направленных против рецептора и/или его лигандов, предназначены для пациентов с эпителиальными опухолями на поздних стадиях. Эту процедуру осуществляют пациентам с раком на поздних стадиях, для которых неприемлема любая другая онкоспецифичная терапия. Первым этапом лечения будет пассивная иммунотерапия с использованием Маb, которые распознают рецептор RTK (т.е. EGF-R), со свойством ингибирования данного рецептора, и/или Маb, которые распознают лиганды рецептора (т.е. EGF, TGF-). Это будет острая терапия, целью которой является ремиссия опухоли, и ее можно использовать вместе с установленным онкоспецифичным лечением для данной стадии заболевания. За этим последует активная иммунотерапия с использованием вакцин, которые индуцируют антитела, блокирующие рецепторы (т.е. анти-EGF-R), и/или антитела, блокирующие лиганды (т.е. анти-EGF,анти-TGF-), с целью поддержания стабилизации заболевания на более продолжительные периоды времени с тем, чтобы избежать появления новых метастазов. Процедура состоит из введения пациентам с опухолями эпителиального происхождения на поздних стадиях от 4 до 20 доз, в пределах от 100 до 400 мг Маb, которые распознают и ингибируют EGF-R,и/или Маb, которые распознают лиганды рецептора. Интервал временимежду введением доз будет составлять от 6 до 10 дней. Полностью лечение может длиться от 1 до 24 месяцев, одновременно с установленным онкоспецифичным лечением. Лечение будет продолжаться до частичной или полной регрессии опухоли или до появления неблагоприятных реакций, которые требуют прекращения лечения. Между 1 и 4 неделями после окончания такого лечения будут начаты схемы иммунизации вакцинами, направленными против EGF-R или его лигандов (т.е. EGF, TGF-), соединенными с белкомносителем (т.е. рекомбинантным белком Р 64K Neisseria meningitis) и вводимыми в адекватном адъюванте, т.е. квасцах (от 1 до 2 мг на дозу) или Montanide ISA 51 (от 0,6 до 1,2 мг на дозу). Каждая доза содержит от 50 до 800 мкг активного ингредиента (рецептора или лиганда), соединенного с белком-носителем,в конечном объеме от 0,6 до 5 мл. Схема иммунизации заключается в 5-8 первоначальных иммунизациях для индукции ответа, которые вводят каждые 7-15 дней. Иммунизациям может предшествовать введение циклофосфамида, в дозе от 100 до 500 мг/м 2 поверхности тела, при введении от 2 до 4 дней до 1-й иммунизации. Вакцины можно изготавливать в любом другом носителе для вакцин (т.е. в липосомах, ДНКвакцинах, вирусных векторах). Вакцины можно изготавливать в форме независимых продуктов или в форме уникальной вакцинной композиции. В течение этого периода у пациентов будут брать образцы крови, чтобы определить биохимические маркеры крови и титры специфичных антител против лиганда или рецептора, против которых направлена вакцина. Отбор образцов будут производить еженедельно или ежемесячно. Впоследствии будут производиться реиммунизации, если титры антител уменьшаются, каждые 1-3 месяца в течение периода от 1 до 2 лет. Процедура 2. Иммунотерапевтическая комбинация, предусматривающая пассивную иммунотерапию с использованием Маb, которые распознают рецептор RTK (т.е. EGF-R) и/или его лиганды (т.е. EGF,TGF-), вместе с активной иммунотерапией с использованием вакцин, направленных против рецептора и/или его лигандов, в качестве вспомогательного лечения. Пассивное лечение с использованием Mab, распознающих рецептор RTK (т.е. EGF-R), ингибирующих его активность, и/или Mab, распознающих лиганды рецептора (т.е. EGF, TGF-), вместе с активным лечением вакцинами, которые индуцируют антительный ответ, который блокирует рецептор и/или его лиганды, будет проводиться пациентам немедленно после установления диагноза и/или хирургического лечения. Указанные виды лечения, проводимые вместе, будут оказывать синергическое действие, что делает возможным добиться более высокого процента регрессии и/или клинической стабилизации заболевания. Пациенты с опухолями эпителиального происхождения поддаются указанному лечению, которое состоит из 4-20 доз, в пределах от 100 до 400 мг Маb, распознающих и ингибирующих рецепторы RTK и/или его лиганды. Интервал между дозами будет составлять от 6 до 10 дней, а лечение может продолжаться от 1 до 24 месяцев. Лечение будет продолжаться до достижения частичной или полной регрессии опухоли или же до появления неблагоприятной реакции, которая требует прекращения лечения. Одновременные иммунизации будут осуществляться вакцинами, согласно схеме, описанной в процедуре 1.-3 007381 Процедура 3. Иммунотерапевтическая комбинация, предусматривающая пассивную иммунотерапию с использованием Маb, которые распознают рецепторы RTK (т.е. EGF-R) и/или его лиганды (т.е.EGF, TGF-), с последующей активной иммунотерапией с использованием вакцин, направленных против рецептора и/или его лигандов, в качестве вспомогательного лечения. Указанное лечение будет назначено пациентам немедленно после установления диагноза и/или хирургического лечения. Целью указанного лечения является применение острой терапии для получения ремиссии опухоли посредством первоначальной пассивной иммунотерапии с использованием Маb, распознающих и ингибирующих рецепторы RTK (т.е. EGF-R), и/или Маb, распознающих его лиганды (т.е.EGF, TGF-). Впоследствии будет начата активная иммунотерапия с использованием вакцин, индуцирующих блокирование антител против рецептора (т.е. EGF-R), или его лигандов (т.е. EGF, TGF-). Целью второго лечения является достижение более длительного периода времени, свободного от заболевания, избегание появления новых метастазов. Процедура заключается во введении пациентам на поздних стадиях злокачественной опухоли эпителиального происхождения от 4 до 20 доз в пределах от 100 до 400 мг Маb, которые распознают и ингибируют EGF-R и/или его лиганды. Интервал времени между дозами будет составлять от 6 до 10 дней, а продолжительность лечения может составлять от 1 до 24 месяцев. Лечение будет продолжаться до достижения частичной или полной регрессии опухоли или же до появления любой неблагоприятной реакции, которая требует прекращения лечения. Между 1 и 4 неделями после окончания лечения будут начаты схемы иммунизации вакцинами, направленными против EGF-R или некоторых лигандов EGF-R (т.е. EGF, TGF-), согласно схеме, описанной в процедуре 1. Примеры Пример 1. Схема иммунизации вакциной EGF пациентов со злокачественными опухолями с использованием квасцов в качестве адъюванта. Было проведено клиническое испытание, в котором 10 пациентов были иммунизированы вакцинойEGF (US 5894018) с использованием p64K в качестве белка-носителя и квасцов в качестве адъюванта,основной целью которого была демонстрация иммуногенности и безопасности EGF. Пациент 1.1 (MMG) был включен в испытание с диагнозом метастатическая эпидермоидная карцинома легкого с прогрессирующим заболеванием, и не подходил для любого другого онкоспецифичного лечения. Пациента иммунизировали согласно схеме из 5 первоначальных доз вакцины, содержавших 50 мкгEGF и 2 мг квасцов, которые вводили в дни 1, 7, 14, 21 и 51. Отбор образцов крови осуществляли в дни 0, 15, 30, 45, 60 и далее ежемесячно для определения биохимических показателей крови и антител, специфичных в отношении EGF. Титры антител определяли посредством анализа ELISA, титры антител определяли как максимальное разведение сыворотки крови, которое давало положительный результат в анализе ELISA (величины ОП равны или в 2 раза превышают контроль). Повторную иммунизацию осуществляли с использованием той же самой дозы вакцины, когда выявляли падение титров антител. У пациента MMG наблюдался анти-ЕGF-антительный ответ с максимальными титрами до 1:8000. Кинетика антительного ответа показана на фиг. 1. После начала схемы вакцинации у пациента наблюдалась клиническая и рентгенологическая стабилизация заболевания в течение 15 месяцев. Пациент умер спустя 23,2 месяца после первой вакцинации. Пример 2. Схема иммунизации вакциной EGF пациентов со злокачественными опухолями, с использованием Montanide ISA 51 в качестве адъюванта. Было проведено клиническое испытание, в котором было иммунизировано 10 пациентов, с использованием Р 64K в качестве белка-носителя и Montanide ISA 51 в качестве адъюванта, основной целью которого была демонстрация иммуногенности и безопасности EGF. Пациент 2.1 (AMG) был включен в испытание с диагнозом эпидермоидная карцинома легкого, с прогрессирующим заболеванием и не подходил для любого другого онкоспецифичного лечения. Пациента иммунизировали согласно схеме из 5 первоначальных доз вакцины, содержавших 50 мкгEGF в 0,6 мл общего объема, эмульгированных в 0,6 мл Montanide ISA 51 непосредственно перед использованием, которые вводили в 1, 7, 14, 21 и 51 дни. Отбор образцов крови осуществляли на 0, 15, 30, 45, 60 дни и далее ежемесячно для определения биохимических показателей крови и специфичных анти-ЕGF-антител. Титры антител определяли посредством анализа ELISA, титры антител определяли как максимальное разведение сыворотки крови, которое давало положительный результат в анализе ELISA (величины ОП равны или в 2 раза превышают контроль). Повторную иммунизацию осуществляли с использованием той же самой дозы вакцины, когда выявляли падение титров антител. У пациента AMG наблюдался aнти-EGF-антительный ответ с максимальными титрами до 1:32000; кинетика ответа показана на фиг. 2.-4 007381 После начала схемы вакцинации у пациента наблюдалась стабилизация заболевания в течение 12 месяцев; на указанный момент времени была диагностирована клиническая и рентгенологическая регрессия опухоли. На 14-й месяц после начала вакцинации появилась 2-я первичная опухоль. Пациент умер спустя 18 месяцев после включения в испытание от хирургического осложнения в результате оперативного лечения указанной 2-й опухоли. Пример 3. Схема иммунизации вакциной EGF пациентов со злокачественными опухолями, с использованием квасцов в качестве адъюванта и низкой дозы циклофосфамида в качестве предварительного лечения. Было проведено клиническое испытание, в котором было иммунизировано 10 пациентов, основной целью которого была демонстрация иммуногенности и безопасности вакцины EGF с использованием Р 64K в качестве белка-носителя и квасцов в качестве адъюванта, после предварительного лечения циклофосфамидом. Пациент 3.1, FNR, был включен в испытание с диагнозом эпидермоидная карцинома легкого, с прогрессирующим заболеванием и не подходил для любого другого онкоспецифичного лечения. Пациента предварительно лечили циклофосфамидом (100 мг/м 2 поверхности тела), за 3 дня до первой иммунизации вакциной EGF. Схема вакцинации заключалась в 5 дозах вакцинной композиции, содержавших 50 мкг EGF и 2 мг квасцов, которые вводили на 1, 7, 14, 21 и 51 дни. Отбор образцов крови осуществляли на 0, 15, 30, 45, 60 дни и далее ежемесячно для определения биохимических показателей крови и специфичных анти-EGF-антител. Титры антител определяли посредством анализа ELISA; титры антител определяли как максимальное разведение сыворотки крови, которое давало положительный результат в анализе ELISA (величины ОП равны или в 2 раза превышают контроль). Повторную иммунизацию осуществляли с использованием той же самой дозы вакцины, когда выявляли падение титров антител. У пациента наблюдался анти-EGF-антительный ответ с максимальными титрами до 1:8000, как показано на фиг. 4. После начала схемы вакцинации у пациента наблюдалась стабилизация заболевания в течение 19 месяцев. Пример 4. Схема иммунизации вакциной EGF пациентов со злокачественными опухолями, с использованием Montanide ISA 51 в качестве адъюванта и предварительного лечения циклофосфамидом. Было проведено клиническое испытание, в котором было иммунизировано 10 пациентов, основной целью которого была демонстрация иммуногенности и безопасности вакцины EGF с использованием Р 64 К в качестве белка-носителя и Montanide ISA 51 в качестве адъюванта, после предварительного лечения циклофосфамидом в низких дозах. Пациент 4.1, JPG, был включен в испытание с диагнозом немелкоклеточная аденокарцинома легкого, с прогрессирующим заболеванием и не подходил для любого другого онкоспецифичного лечения. Пациента лечили циклофосфамидом (100 мг/кг веса тела) за 3 дня до первой иммунизации вакциной EGF. Схема вакцинации заключалась в 5 дозах вакцинной композиции, содержавших 50 мкг EGF в 0,6 мл общего объема, эмульгированных в 0,6 мл Montanide ISA 51 непосредственно перед использованием, которые вводили на 1, 7, 14, 21 и 51 дни. Отбор образцов крови осуществляли на 0, 15, 30, 45, 60 дни и далее ежемесячно для определения биохимических показателей крови и специфичных aнти-EGF-антител. Титры антител определяли посредством анализа ELISA; титры антител определяли как максимальное разведение сыворотки крови, которое давало положительный результат в анализе ELISA (величины ОП равны или в 2 раза превышают контроль). Повторную иммунизацию осуществляли с использованием той же самой дозы вакцины, когда выявляли падение титров антител. У пациента JPG наблюдался анти-EGF-антительный ответ с максимальными титрами до 1:400000,как показано на фиг. 5. После начала схемы вакцинации у пациента наблюдалась стабилизация заболевания в течение 6 месяцев. Пример 5. Иммуногенность вакцинации EGF и ее отношение к стабилизации заболевания у пациентов со злокачественной опухолью. В фазе I испытания 10 пациентов со стадиями III или IV немелкоклеточного рака легкого (NSCLC) лечили 5 первоначальными дозами вакцинной композиции, содержавшими 50 мкг EGF и 2 мг квасцов,которые вводили на 1, 7, 14, 21 и 51 дни. Остальных 10 пациентов (NSCLC, стадии III или IV) иммунизировали 5 дозами вакцинной композиции, содержавшими 50 мкг EGF, в общем объеме 0,6 мл, эмульгированных в таком же объеме (0,6 мл)Montanide ISA 51. Титры антител определяли посредством анализа ELISA; титры антител определяли как максимальное разведение сыворотки крови, которое давало положительный результат в анализе ELISA (величины-5 007381 ОП равны или в 2 раза превышают контроль). В данном испытании у 55% пациентов развился анти-EGF-антительный ответ с титрами антител до 1:4000 или выше (пациенты с хорошим антительным ответом - Good Antibody Responders, группа GAR),a 50% титров антител были менее 1:4000 (пациенты с плохим антительным ответом - Bad Antibody Responders, группа BAR). В группе GAR у 87,5% пациентов наблюдалась клиническая и рентгенологическая стабилизация заболевания в течение по меньшей мере 3 месяцев после начала лечения. В группе BAR только у 11,1% пациентов наблюдалась указанная стабилизация (табл. 1). Эти данные демонстрируют взаимосвязь между уровнями aнти-EGF-антител и стабилизацией опухоли. Таблица 1 Взаимосвязь между антительными ответами и клинической и рентгенологической стабилизацией заболевания Стабилизация заболевания в течение по меньшей% пациентов мере 3 месяцев после начала леченияBAR 50% 11,1% Пример 6. Иммуногенность вакцинации EGF и ее отношение к выживаемости пациентов со злокачественной опухолью, прошедших данное лечение. Лечение проходили сорок пациентов со стадиями III/IV NSCLC, в группах по 10 человек, с использованием схем, подробно описанных в примерах 1, 2, 3 и 4. Они были охарактеризованы как GAR и BAR, согласно критериям, представленным в примере 6. Из общего количества пациентов, леченных с использованием ранее описанных схем, 50% оказались GAR и 50% - BAR. При сравнении характера выживаемости между пациентами GAR и BAR наблюдалась статистически достоверная разница, со средней выживаемостью 9,1 месяца для GAR и средней выживаемостью 4,5 месяца для BAR (p0,02). Этот результат показан на фиг. 6. Пример 7. Терапевтический эффект комбинации лучевой терапии и Mab IOR-R3. Пациента RML с диагнозом эпидермоидной карциномы основания языка в стадии IV включили в клиническое испытание с использованием комбинации лучевой терапии (RTP) и IOR-R3. Пациент получал 200 мг Mab один раз в неделю в течение 6 недель. Суммарная доза Mab составила 1200 мг, а суммарная доза облучения составила 60 грей. По окончании комбинированной терапии у пациента наблюдалась полная ремиссия первичной опухоли и ее метастазов (фиг. 7). Данный ответ сохранялся более 13 месяцев. Пример 8. Терапевтический эффект комбинации лучевой терапии и Mab IOR-R3. Пациента EPG с диагнозом эпидермоидной карциномы миндалины в стадии III с шейными аденопатиями включили в клиническое испытание с использованием комбинации лучевой терапии (RTP) иIOR-R3. Пациент получал 200 мг Mab один раз в неделю в течение 6 недель, а суммарная доза облучения составила 64 грея. По окончании лечения у пациента наблюдалась полная ремиссия опухолевого поражения (фиг. 8). Данный ответ сохранялся более 13 месяцев. Пример 9. Терапевтический эффект комбинации лучевой терапии и Mab IOR-R3. Пациента СНА с диагнозом опухоли миндалины на стадии IV, с двусторонними шейными аденопатиями, включили в клиническое испытание с использованием комбинации лучевой терапии (RTP) и IORR3. Пациент получал 400 мг Mab один раз в неделю в течение 6 недель, и суммарная доза составила 2400 мг. Одновременно пациент получал лучевую терапию с суммарной дозой облучения 64 грея. По окончании комбинированной терапии у пациента наблюдалась полная ремиссия первичной опухоли и локо-регионарного метастаза (фиг. 9). Данный ответ сохранялся в течение 12 месяцев. Пример 10. Схема комбинированного лечения пациентов с опухолями на поздних стадиях Mab IORR3/вакциной EGF. Пациент ARP с диагнозом эпидермоидная карцинома головы и шеи получал последовательное лечение Mab IOR-R3 и вакциной EGF. Пациент получал 200 мг Mab один раз в неделю в течение 6 недель в комбинации с 30, в общей сложности, дозами облучения, по 5 доз в неделю в течение 6 недель, суммарной дозой облучения в 60 грей. По окончании лечения у пациента наблюдалась полная ремиссия первичной опухоли. Схему иммунизации вакциной EGF начинали через месяц после окончания лечения Mab. Пациент получал 5 доз по 50 мкг EGF, конъюгированного с белком Р 64K, в общем объеме 0,6 мл Montanide ISA 51 непосредственно перед применением. Иммунизации осуществляли на 1, 7, 14, 21 и 51 дни. Пациент остается в периоде наблюдения.-6 007381 Пример 11. Схема комбинированного лечения пациентов с опухолями на поздних стадиях Маb IOR3/ вакциной EGF. Пациент MRM с диагнозом эпидермоидная карцинома легкого подвергался хирургическому лечению. Спустя один месяц после оперативного вмешательства пациенту назначили комбинированное лечение с использованием пассивной иммунотерапии Mab IOR-R3 и одновременно вакциной EGF. На фиг. 10 представлена подробная схема интервалов доз. Пациент остается в периоде наблюдения. Краткое описание фигур Фиг. 1 - кинетика анти-ЕGF-антительного ответа у пациента MMG, иммунизированного, как подробно описано в примере 1. Стрелки указывают время реиммунизаций; фиг. 2 - кинетика анти-ЕGF-антительного ответа у пациента АМС, иммунизированного, как подробно описано в примере 2. Стрелки указывают время реиммунизаций; фиг. 3 - регрессия опухоли, наблюдавшаяся у пациента АМС. На момент начала лечения слева видна опухолевая масса. Справа на фигуре можно видеть, что спустя 12 месяцев после начала лечения опухолевая масса исчезла; фиг. 4 - кинетика анти-ЕGF-антительного ответа у пациента FNR, иммунизированного, как подробно описано в примере 3. Стрелки указывают время реиммунизаций; фиг. 5 - кинетика анти-ЕGF-антительного ответа у пациента JPG, иммунизированного, как подробно описано в примере 4. Стрелки указывают время реиммунизаций; фиг. 6 - кривые выживаемости Kaplan-Maier в группах пациентов с сильным анти-ЕGFантительным ответом (GAR) и со слабыми анти-ЕGF-антительными ответами (BAR), а также в контрольных группах, по данным историй болезни. Как можно видеть, GAR связан с достоверным повышением выживаемости по сравнению как с BAR, так и с контролями по данным историй болезни; фиг. 7 - графическое изображение ремиссии опухоли у пациента RML, получавшего лечение, как подробно описано в примере 7; фиг. 8 - графическое изображение регрессии опухоли у пациента EPG, получавшего лечение, как подробно описано в примере 8; фиг. 9 - графическое изображение опухоли у пациента СНА, получавшего лечение, как подробно описано в примере 9; фиг. 10 - комбинированное лечение Mab IOR-R3 и вакциной EGF. Стрелки над осью времени показывают день введения Mab (дни 1, 7, 14, 21, 28 и 35), а стрелки ниже оси времени показывают день иммунизации вакциной EGF (дни 2, 8, 15, 22 и 52). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Иммунотерапевтический набор для лечения опухолей, эффект которого направлен на клетки,рост которых зависит от экспрессии EGF-рецептора (рецептор эпидермального фактора роста), отличающийся тем, что включает в себя компоненты А, В, С и D, которые применяются одновременно или последовательно в комбинациях А+С; или A+D; или В+С; или B+D; где А, В, С и D представляют собой следующее:B - антитело против лиганда (лигандов) EGF-рецептора;C - вакцина, содержащая EGF-рецептор, которая индуцирует образование антител против указанного рецептора;D - вакцина, содержащая лиганд (лиганды) EGF-рецептора, которая индуцирует антитела против указанного лиганда (лигандов). 2. Иммунотерапевтический набор по п.1, где антитело против EGF-рецептора представляет собой гуманизированное антитело. 3. Иммунотерапевтический набор по п.2, где гуманизированное антитело против EGF-рецептора представляет собой IOR-R3, депонированное под номером ЕСАСС 951110101. 4. Иммунотерапевтический набор по п.1, где антитело против лиганда (лигандов) EGF-рецептора представляет собой антитело против EGF. 5. Иммунотерапевтический набор по п.1, где антитело против лиганда (лигандов) EGF-рецептора представляет собой антитело против TGF-. 6. Иммунотерапевтический набор по п.1, где вакцина содержит EGF в качестве лиганда EGFрецептора. 7. Иммунотерапевтический набор по п.6, где вакцина дополнительно содержит белок Р 64K из Neisseria meningitidis, конъюгированный с EGF в качестве лиганда EGF-рецептора. 8. Иммунотерапевтический набор по п.1, где вакцина содержит TGF- в качестве лиганда EGFрецептора. 9. Иммунотерапевтический набор по п.8, где вакцина дополнительно содержит белок Р 64K из Neisseria meningitidis, конъюгированный с TGF- в качестве лиганда EGF-рецептора.
МПК / Метки
МПК: A61K 39/395, A61K 39/385, A61P 35/00
Метки: лечения, опухолей, иммунотерапевтический, набор
Код ссылки
<a href="https://eas.patents.su/12-7381-immunoterapevticheskijj-nabor-dlya-lecheniya-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Иммунотерапевтический набор для лечения опухолей</a>
Предыдущий патент: Капсулы с покрытием на поверхности
Следующий патент: Замещенные бензопираны в качестве селективных агонистов бета-рецептора эстрогена
Случайный патент: Способ автоматизированного распространения рекламных сообщений и система для его реализации