Арилзамещенные пиперазины для лечения доброкачественной гиперплазии простаты
Номер патента: 1904
Опубликовано: 22.10.2001
Авторы: Мэрианофф Синтия, Муррей Уильям, Ли Ксиаобинг, Виллани Фрэнк, Рейтц Алан, Малкахи Линда, Пулито Вирджиния, Жоллифф Линда
Формула / Реферат
1. Соединение формулы I

где А представляет собой (СН2)n, где n равно 1-6;
R1 представляет собой C1-6алкил, фенил, замещенный фенил, где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С1-5алкила, С1-5 алкоксильной группы и галогена, фенилС1-5алкила, или замещенный фенилС1-5алкил,
где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из C1-5алкила, C1-5алкоксильной группы и галогена;
R2 представляет собой водород, C1-6алкил, С2-5алкенил, С2-5алкинил, фенилС1-5алкил или замещенный фенилС1-5алкил,
где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из C1-5алкила, C1-5алкоксильной группы и галогена;
Е представляет собой
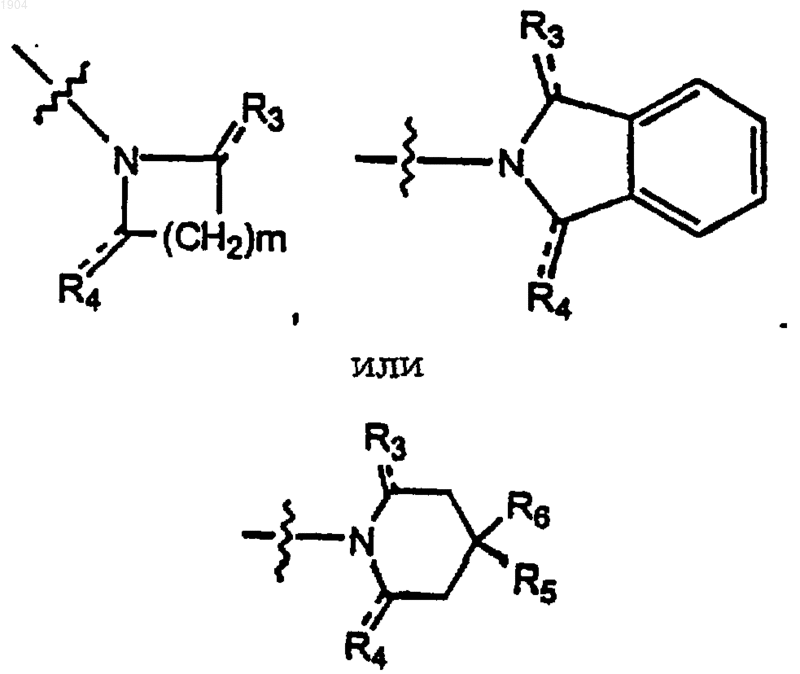
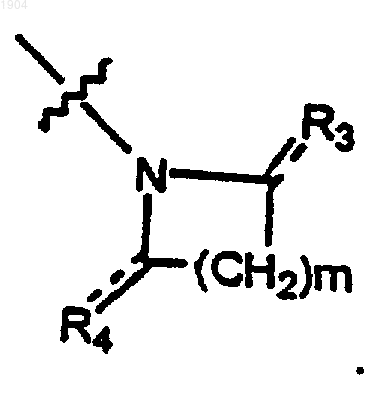
где m равно 1-5;
R3 представляет собой водород, C1-6алкил или кислород, где, если R3 представляет собой кислород, пунктирная линия представляет собой связь, а если R3 представляет собой C1-6алкил, то пунктирная линия отсутствует;
R4 представляет собой кислород, водород, С1-5алкил, формил, карбоксильную группу, С1-5 алкилкарбонильную группу, С1-5алкоксикарбонильную группу, фенилС1-5алкоксильную группу, замещенную фенилС1-5алкоксильную группу,
где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С1-5алкила, С1-5алкоксильной группы и галогена, амидогруппы и замещенной амидогруппы,
где заместители азота независимо выбраны из одного или нескольких из группы, состоящей из водорода, С1-5алкила, С1-5алкоксильной группы и гидроксильной группы, где, если R4 представляет собой кислород, пунктирная линия представляет собой связь, а если R4 является любым другим заместителем, то пунктирная линия отсутствует;
R5 представляет собой водород, С1-5алкил, или, взятый вместе с R6, образует циклогексановый, циклопентановый или циклопропановый цикл;
R6 представляет собой водород, С1-5алкил, или, взятый вместе с R5, образует циклогексановый, циклопентановый или циклопропановый цикл; и их фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 представляет собой C1-6алкил, n равно 2-4, a R2 представляет собой водород, C1-6алкил, С2-6алкенил.
3. Соединения по п.2, где Е представляет собой
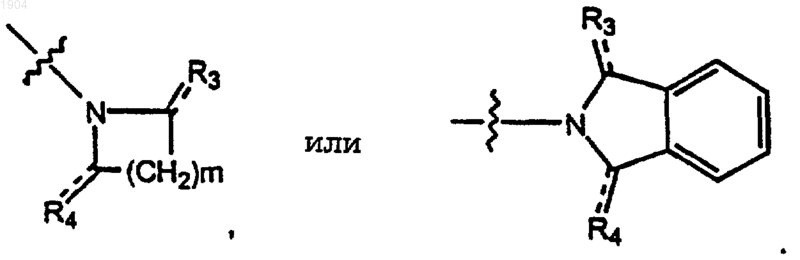
4. Соединения по п.2, где R3 представляет собой кислород, a R4 представляет собой водород, С1-5алкоксикарбонил или кислород.
5. Соединения по п.4, где R4 представляет собой водород, а
Е представляет собой
6. Соединения по п.5, где m равно 2-5.
7. Соединение и его фармацевтически приемлемые соли, выбранное из группы, состоящей из N-[этил-2-(2-изопропилоксифенил)пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамида, N-[этил-2-(2-изопропилоксифенил)пиперазин-4-ил)]-N-метил-[1'-(2-оксипиперидинил)]ацетамида и N-[пропил-3-(2-изо-пропилоксифенил) пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамида.
8. Соединение N-[этил-2-(2-изопропилоксифенил)пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамид и его фармацевтически приемлемые соли.
9. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель или разбавитель.
10. Фармацевтическая композиция, включающая соединение по п.6 и фармацевтически приемлемый носитель или разбавитель.
11. Фармацевтическая композиция, включающая соединение по п.8 и фармацевтически приемлемый носитель или разбавитель.
12. Способ лечения заболевания, опосредованного a-1а адренергическим рецептором, включающий введение пациенту эффективной дозы соединения по п.1.
13. Способ лечения заболевания, опосредованного a-1а адренергическим рецептором, включающий введение пациенту эффективной дозы композиции по п.6.
14. Способ лечения заболевания, опосредованного a-1а адренергическим рецептором, включающий введение пациенту эффективной дозы композиции по п.8.
15. Способ по п.13, где соединение вводят перорально, а эффективная доза составляет 0,01-100 мг/кг в день.
16. Способ по п.15, где доза составляет 0,05-1,0 мг/кг в день.
17. Способ лечения доброкачественной гиперплазии простаты, включающий введение эффективной дозы соединения по п.1.
18. Соединение формулы II
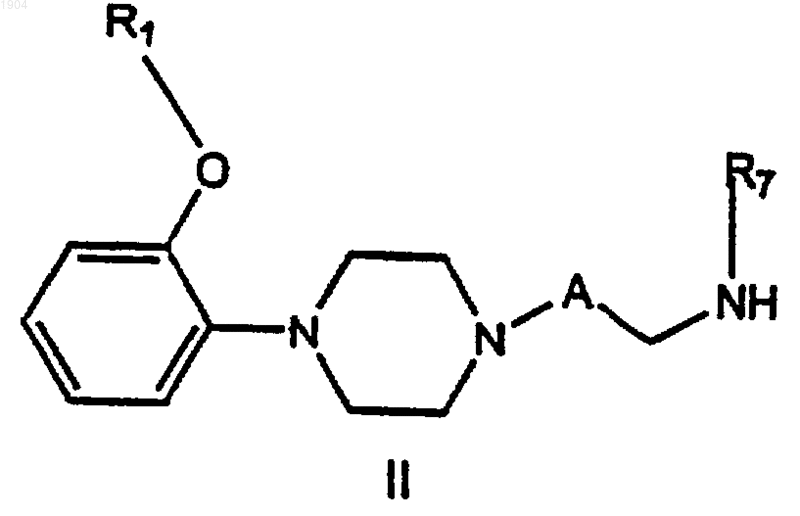
где А представляет собой (СН2)n, где n равно 1-6;
R1 представляет собой разветвленный С2-6 алкил, фенил, замещенный фенил,
где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С1-5алкила, С1-5алкоксильной группы и галогена, фенилС1-5алкила, или замещенный фенилС1-5алкил,
где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С1-5алкила, С1-5алкоксильной группы и галогена;
R7 представляет собой водород, т-бутоксикарбонил или бензилоксикарбонил.
19. Соединениe по п.18, где n равно 2-4, a R1 представляет собой разветвленный С2-6алкил.
20. Соединениe по п.18, где R7 представляет собой водород или т-бутоксикарбонил.
21. Соединение, выбранное из группы, состоящей из 1-(2-аминоэтил)-4-(2-2-изопропилоксифенил)пиперазина, 1-(3-аминопропил)-4-(2-2-изопропилоксифенил)пиперазина и 1-(4-аминобутил)-4-(2-2-изопропилоксифенил)пиперазина.
22. Соединение 1-(аминоэтил)-4-(2-2-изопропилоксифенил)пиперазин.
23. Соединение формулы III
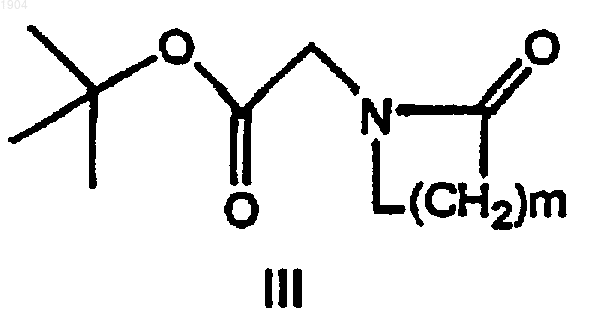
где m равно 1, 3, 4 или 5.
24. Соединение по п.23, где m равно 3-5.
25. Соединение 1-т-бутоксикарбонилметил-2-пиперидон.
Текст
1 Это изобретение относится к ряду арилзамещенных пиперазинов, к фармацевтическим композициям, содержащим их, и к промежуточным соединениям, которые используются в их производстве. Соединения данного изобретения селективно ингибируют связывание с -1 аадренергическим рецептором, рецептором, который участвует в развитии доброкачественной гиперплазии простаты. Кроме того, соединения данного изобретения понижают давление внутри уретры в модели in vivo. Как таковые эти соединения могут использоваться при лечении этого заболевания. Предпосылки создания изобретения Доброкачественная гиперплазия простаты(ДГП), незлокачественное увеличение простаты,является наиболее распространенной доброкачественной опухолью у мужчин. Приблизительно 50% всех мужчин старше 65 лет имеют ДГП разной степени тяжести, и каждый третий из этих мужчин имеет клинические симптомы,включающие закупорку выхода мочевого пузыря (Hieble and Caine, 1986). В США по поводу доброкачественных и злокачественных заболеваний простаты у мужчин старше 50 лет происходит больше хирургических операций, чем по поводу заболеваний любого другого органа. Существуют два компонента ДГП, статический и динамический компонент. Статический компонент обусловлен увеличением предcтательной железы, которое приводит к сдавливанию уретры и к затруднению вытекания мочи из мочевого пузыря. Динамический компонент обусловлен увеличением тонуса гладкой мускулатуры шейки мочевого пузыря и собственно простаты (что препятствует опустошению мочевого пузыря), и регулируется альфа 1 адренергическими рецепторами (1-АРми). Существующие в медицине способы лечения ДГП направлены на эти компоненты в различной степени, и терапевтические альтернативы расширяются. Хирургические средства лечения направлены на статический компонент ДГП и включают трансуретральную резекцию простаты(ТУНП), открытую простатэктомию, расширение пузыря, гипертермию, расширение и лазерную аблацию. ТУРП является предпочтительным лечением для пациентов с ДГП, и в США в 1990 г было проведено приблизительно 320000 ТУРП с оцененной стоимостью в 2,2 биллиона долларов (Weis et al., 1993). Несмотря на эффективное лечение большинства мужчин с симптоматической ДГП, приблизительно 20-25% пациентов не имеют удовлетворительного продолжительного результата (Lepor and Rigaud, 1990). Осложнения включают дегенеративную эякуляцию (70-75% пациентов), импотенцию (5-10%),постоперационную инфекцию мочевых путей(5-10%) и недержание мочи разной степени тяжести (2-4%) (Mebust et al., 1989). Кроме того, 001904 2 частота повторных операций у мужчин составляет приблизительно 15-20% в течение 10 или более лет (Wennberg et al., 1987). В противоположность хирургическим подходам, существуют некоторые лекарственные терапии, направленные на статическую компоненту этого заболевания. Финастерид (Proscar,Merck) является одним из таких лекарственных препаратов, который предназначен для лечения симптоматической ДГП. Этот препарат представляет собой конкурентный ингибитор фермента 5 а-редуктазы, ответственного за превращение тестостерона в дигидротестостерон в предстательной железе (Gormley et al., 1992). Обнаружено, что дегидротестостерон является главным митогеном для роста простаты, и агенты, которые ингибируют 5 а-редуктазу, уменьшают размер простаты и улучшают ток мочи через предстательную уретру. Хотя финастерид является мощным ингибитором 5 а-редуктазы и вызывает значительное снижение концентрации дигидротестостерона в сыворотке и в ткани, он проявляет только умеренную эффективность при лечении симптоматической ДГП (Oesterling,1995). Для проявления эффектов финастерида требуется 6-12 месяцев, и для многих мужчин клинические улучшения минимальны (Barry,1997). Воздействие на динамическую компоненту ДГП происходит путем применения агентов,блокирующих адренергические рецепторы(блокаторы 1-AP), которые действуют, понижая тонус гладкой мускулатуры в самой предстательной железе. Ряд блокаторов 1-АР (теразоцин, празоцин и доксазоцин) был исследован на предмет применения для лечения симптоматической непроходимости выхода мочевого пузыря, возникающей при ДГП, причем наиболее интенсивно изучался теразоцин (Hytrin", Abbott). Хотя блокаторы 1-АР хорошо переносятся, приблизительно у 10-15% пациентов развиваются клинически неблагоприятные эффекты(Lepor, 1995). Нежелательные эффекты всех членов этого класса похожи, причем самым обычным обнаруженным побочным эффектом является постуральная гипотензия (Lepor et al.,1992). По сравнению с ингибиторами 5 аредуктазы агенты, блокирующие 1-АР, начинают действовать гораздо быстрее (Steers, 1995). Однако их терапевтический эффект, который измеряется улучшением показателей симптомов и пиком скорости тока мочи, является средним(Oesterling, 1995). Использование антагонистов 1-AP в лечении ДГП относится к их способности понижать тонус гладкой мускулатуры простаты, что приводит к облегчению обструктивных симптомов. Обнаружено, что во всем организме адренергические рецепторы играют доминантную роль в контролировании кровяного давления,заложенности носа, функции простаты и в дру 3 гих процессах (Harrison et al., 1991). Однако существует ряд клонированных рецепторных подтипов 1-АР: 1a-AP, 1b-АР и 1d-AP (Bruno etRamarao et al., 1992; Schwinn et al., 1995; Weinberg et al., 1994). В ряде лабораторий провели характеристику 1-АРов человеческой простаты с помощью функциональных методов, методов радиолигандного связывания и молекулярнобиологических методов (Forray et al., 1994; Hatano et al., 1994; Marshall et al., 1992; Marshall etal., 1995; Yamada et al., 1994). Эти исследования с очевидностью подтверждают концепцию, что подтип la-AP включает большинство l-АРов гладкой мускулатуры простаты человека и опосредует сокращение этой ткани. Эти данные подтверждают,что разработка подтипселективного антагониста la-AP может привести к созданию терапевтически эффективного агента с большей селективностью для лечения ДГП. Краткое описание изобретения Данное изобретение относится к соединениям формулы IR1 представляет собой C1-6 алкил, фенил,замещенный фенил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкоксильной группы и галогена, фенилС 1-5 алкила, или замещенный фенилС 1-5 алкил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкоксильной группы и галогена;R2 представляет собой водород, C1-6 алкил,С 1-5 алкенил, C1-5 алкинил, фенилС 1-5 алкил или замещенный фенилС 1-5 алкил, где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из C1-5 алкила,С 1-5 алкоксильной группы и галогена; Е представляет собойR4 представляет собой кислород, водород,C1-5 алкил, формил, карбоксильную группу, С 1-5 алкилкарбонильную группу, С 1-5 алкоксикарбонильную группу, фенилС 1-5 алкоксильную группу, замещенную фенилС 1-5 алкоксильную группу,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкоксильной группы и галогена, амидогруппы и замещенной амидогруппы где заместители азота независимо выбраны из одного или нескольких из группы, состоящей из водорода, С 1-5 алкила, С 1-5 алкоксильной группы и гидроксильной группы,где, если R4 представляет собой кислород,пунктирная линия представляет собой связь, а если R4 является любым другим заместителем,то пунктирная линия отсутствует;R5 представляет собой водород, C1-5 алкил,или, взятый вместе с R6, образует циклогексановый, циклопентановый или циклопропановый цикл;R6 представляет собой водород, С 1-5 алкил,или, взятый вместе с R5, образует циклогексановый, циклопентановый или циклопропановый цикл; и их фармацевтически приемлемые соли. Эти соединения применяются в качестве агентов, модулирующих адренергические рецепторы. Соединения данного изобретения селективно связываются с 1a-AP рецепторами,модулируют активность упомянутого рецептора и являются более селективными для ткани простаты, чем для ткани аорты. Как таковые, они обеспечивают надежное лечение заболеваний,модулируемых рецепторами la-AP, которые включают ДГП, но не ограничиваются ею. Кроме того, в данном изобретении рассматриваются фармацевтические композиции,включающие соединения формулы I, и способы лечения заболеваний, опосредованных рецепторами 1a-AP, соединениями формулы I. Кроме соединений формулы I в данном изобретении рассматриваются промежуточные соединения формулы II. Эти соединения используются при получении соединений формулы I, и они представлены следующей формулой:R3 представляет собой водород, C1-6 алкил или кислород,где, если R3 представляет собой кислород,пунктирная линия представляет собой связь, а если R3 представляет собой C1-6 алкил, то пунктирная линия отсутствует;R1 представляет собой С 2-6 алкил, фенил,замещенный фенил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, C1-5 алкоксильной группы 5 и галогена, фенилС 1-5 алкила, или замещенный фенилС 1-5 алкил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из C1-5 алкила, С 1-5 алкоксильной группы и галогена;CBZ. Далее в данном изобретении рассматриваются соединения формулы III. Эти соединения используются как промежуточные соединения при получении соединений формулы I, и они представлены следующей формулой: где m равно 1-5. Подробное описание изобретения В данном изобретении используются обычные термины, известные специалистам в данной области. "HBSS" относится к сбалансированному солевому раствору Хэнкса. "Независимо" обозначает, что, если существуют несколько заместителей, то эти заместители могут быть различными. Термин "алкил" относится к алкильным группам с прямой, циклической и разветвленной цепью, и "алкокси" относится к О-алкилу, где алкил представляет собой известные антагонисты 1a-AP, определенные выше."ВОС" относится к т-бутоксикарбонилу, "РуВrоР" относится к бром-трис-пирролидин-фосфонийгексафторфосфат, "CBZ" относится к бензилоксикарбонилу, а "Тs" относится к толуолсульфонилу. "DCC" относится к 1,3-дициклогексилкарбодиимиду, "DMAP" относится к 4N'N-диметиламинопиридину, "EDCI" относится к гидрохлориду 1-(3-диметиламинолропил)-3 этилкарбодиимида, а "НОВТ" относится к гидрату 1-гидроксибензотриазола. Символ "Ph" относится к фенилу, а "РHТ" относится к фталимидной группе. Термин "эффективная доза" относится к такому количеству соединения формулы I, которое связывается с адренергическим рецептором -1 а, и/или является его антагонистом. Кроме того, термин "эффективная доза" относится к такому количеству соединения формулы I, которое улучшает симптомы заболеваний, связанных с адренергическим рецептором -1a. Соединения данного изобретения могут быть получены с помощью следующих схем,где некоторые схемы относятся более, чем к одному воплощению изобретения. В этих случаях выбор схемы является свободным и зависит от способностей химика-синтетика. Соединения формулы I, где R1 является фенилом, R2 является водородом, R3 является кислородом, А является (СН 2)3, и m равно 4, 001904 6 могут быть получены по схеме 1. В этой схеме молекулы соединения формулы I получают с помощью конвергентного синтеза, где собирают две половинки молекулы и в конечном счете проводят их конденсацию. Исходным материалом для одной половины является моно N-замещенный пиперазин типа 1 а. Обработка 1 а слабым основанием, таким как К 2 СО 3, и алкилирующим агентом, таким как акрилонитрил, в инертном растворителе, таком как МеОН, при комнатной температуре в течение 2-24 ч, дает нитрил 1b. Это промежуточное соединение может быть подвергнуто гидрированию с использованием никеля Ренея в качестве катализатора, с получением пропиламинового промежуточного соединения 1 с. Другую половину молекулы получают, используя в качестве исходных веществ соединения типа 1 с.-Капролактам обрабатывают сильным основанием, таким как NаН, в инертном растворителе при 0 С в течение приблизительно 30 мин. Образовавшийся анион обрабатывают алкилирующим агентом, таким как т-бутилбромацетат, в инертном растворителе, таком как ацетонитрил,при комнатной температуре в течение промежутка времени от двух часов до 2 дней, получая сложный эфир 1 е. Гидролиз 1 е под действием кислоты, такой как трифторуксусная кислота,при комнатной температуре в течение 2-16 ч дает кислоту 1f. Обработка амина 1 с и кислоты 1f пептидным конденсирующим агентом, таким как ВОР, и подходящим амином, таким какDMAP, при комнатной температуре в течение 116 ч дает соединение формулы I, 1g. ВОР может быть заменен другими конденсирующими агентами. Такие агенты включают, не ограничиваясь ими, PyBroP, EDCI, HOBt и т.п. Подходящие заменители DMAP включают, не ограничиваясь ими, N-метилморфолин, имидазол, DABCO и т.п. Схема 1 может использоваться для получения соединений, отличных от соединения 1g. Для получения соединений, в которых m равно 1-5, известные лактамы с соответствующим размером цикла, такие как 2-азациклооктанон,заменяют -капролактам в схеме 1. Схема 1 7 производным фенилпиперазина, таким как N-(2 т-бутоксифенил)пиперазин. Для получения соединений, в которых А является (СН 2)n и n равно 1-6, акрилонитрил может быть заменен алкилирующим агентом,таким как 4 хлорбутиронитрил. Альтернативно, промежуточное соединение 1 с может быть получено другим путем, как показано на схеме 2. Производное пиперазина 1 а обрабатывают слабым основанием и известным фталимидным производным,таким какN-(4-бромбутил)фталимид, получая промежуточное соединение 2 а. Обработка соединения 2 а гидразином,таким как N-метилгидразин, в подходящем растворителе, таком как МеОН или ЕtOН, при кипячении с обратным холодильником, дает промежуточное соединение типа 1 с. Альтернативно, пиперазин 1 а обрабатывают слабым основанием и N-ВОС защищенным амином, таким какN-трет-бутоксикарбонил-4-бромбутиламин, получая соответствующий ВОС-защищенный амин. С этого амина может быть удалена защитная группа путем обработки кислотой, такой как ТФУ, с получением промежуточного соединения типа 1 с. Схема 2 Для получения соединений, в которых R2 отличен от водорода, может быть использована схема 3. Соединения типа 1g обрабатывают сильным основанием, таким как NaH, затем алкилирующим агентом, таким как бензилбромид,в течение 1-5 ч, при температуре приблизительно 0-35 С, получая соединения типа 3 а. Схема 3 Соединения, в которых R4 представляет собой кислород, C1-5 алкил, формил, карбоксильную группу, С 1-5 алкилкарбонильную группу, С 1-5 алкоксикарбонильную группу, фенилС 1-5 алкоксильную группу, замещенную фенилС 1-5 алкоксильную группу, амидогруппу и замещенную амидогруппу, могут быть синтезированы по схеме 4. Например, для получения соединений, в которых R4 является этоксикарбонилом,m равно 2, a R3 является карбонилом, этил-2 пирролидон-5-карбоксилат обрабатывают сильным основанием, таким как NaH, в инертном растворителе при 0 С в течение приблизительно 30 мин. Образовавшийся анион обрабатывают алкилирующим агентом, таким как тбутилбромацетат в инертном растворителе, таком как ацетонитрил при комнатной температуре в течение промежутка времени от 2-х ч до 2 8 дней, получая сложный эфир 4 а. Кислый гидролиз соединения 4 а под действием трифторуксусной кислоты при комнатной температуре в течение 2-16 ч дает кислоту 4b. Конденсация кислоты 4b и промежуточного амина 1 с в присутствии пептидного конденсирующего агента,такого как РrуВОР, дает соединение формулы I,4 с. Этиловый сложный эфир соединения 4 с может быть обработан рядом агентов с получением производных, таких как амиды, карбоновые кислоты, альдегиды и т.д., где реагенты и условия реакций известны специалистам в данной области. Схема 4 Хотя заявленные соединения являются полезными в качестве модуляторов 1-АР, некоторые соединения являются или предпочтительными, или особенно предпочтительными. Предпочтительные соединения данного изобретения включают:(CH2)n, где n равно 2-4. Особенно предпочтительные соединения формулы II включают соединения, в которых А равно 2 или 3, R1 является С 2-6 алкилом, а R7 является водородом. Особенно предпочтительные соединения формулы III включают соединения, в которых m равно 3. Соединения формулы I могут быть использованы в фармацевтических композициях для лечения больных с заболеваниями, связанными с изменением активности 1 адренергических рецепторов. Предпочтительным является пероральное введение, однако соединения данного изобретения могут быть введены другими способами, включающими, не ограничиваясь им,внутривенное вливание. Диапазон доз для перорального введения составляет приблизительно 0,01-100 мг/кг ежедневно. Предпочтительный диапазон доз для перорального введения составляет приблизительно 0,05-1,0 мг/кг ежедневно. При вливании дозы ингибитора могут варьировать приблизительно в интервале 0,001100 мг/кг/мин, с фармацевтическим носителем,в течение периода времени, составляющего от нескольких минут до нескольких дней. Фармацевтические композиции могут быть получены при использовании традиционных фармацевтических эксципиентов и методов смешивания. Дозировочные формы для перорального применения могут представлять собой эликсиры, сиропы, капсулы, таблетки и т.п. В этих формах типичный твердый носитель представляет собой инертное вещество, такое как лактоза, крахмал, глюкоза, метилцеллюлоза,стеарат магния, дикальций фосфат, маннит и т.п.; а типичные жидкие эксципиенты для перорального применения включают этанол, глицерин, воду и т. п. Все эксципиенты при необходимости могут быть смешаны с размельчителями, разбавителями, гранулирующими агентами, смазочными веществами, связующими веществами и т.п., с использованием традиционных методов, известных специалистам в области приготовления дозировочных форм. Парентеральные дозировочные формы могут быть приготовлены с использованием фармацевтически приемлемых носителей или разбавителей, включающих, не ограничиваясь ими,воду или другие стерильные носители. Обычно соединения формулы I выделяют и используют в виде свободных оснований, однако эти соединения могут быть выделены и использованы в виде их фармацевтически приемлемых солей. Примеры таких солей включают, не ограничиваясь ими, соли следующих кислот: бромистоводородной, иодистоводородной,хлористоводородной, перхлорной, серной, малеиновой, фумаровой, яблочной, винной, ли 001904 10 монной, бензойной, миндальной, метансульфоновой, гидроэтансульфоновой, бензолсульфоновой, щавелевой, памоевой, 2-нафталинсульфоновой, п-толуолсульфоновой, циклогексансульфамовой и сахариновой. Следующие примеры включены для иллюстрации изобретения. Эти примеры не ограничивают изобретение. Они предназначены только для того, чтобы предложить способ практического осуществления изобретения. Специалисты в данной области могут найти другие способы практического осуществления изобретения,очевидные для них. Однако считается, что эти способы входят в объем данного изобретения. Примеры получения Пример 1.N-1-(2-изопропоксифенил)пиперазина (6,6 г, 30 ммоль) в ацетонитриле (100 мл), и полученную смесь нагревают с обратным холодильником в течение 2 дней. Смесь концентрируют в вакууме и очищают с помощью колоночной хроматографии на силикагеле, используя в качестве элюента EtOAc/гексаны (30:70), с получением указанного в заголовке соединения в виде твердого вещества: МС m/z 394 (МН+). Пример 2.EtOH (70 мл) перемешивают в течение 10 мин при комнатной температуре. Добавляют метилгидразин (20 мл) и смесь нагревают с обратным холодильником в течение 2,5 ч. Смесь охлаждают до комнатной температуры и полученный твердый осадок удаляют путем фильтрации. Фильтрат концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества, которое используют без очистки: МС m/z 264 (МН+). Пример 3. 1-т-бутоксикарбонилметил-2-пиперидон Соединение 3 95% гидрид натрия (1,67 г, 66 ммоль) добавляют при перемешивании к раствору валеролактама (5,95 г, 60 ммоль) в толуоле (100 11 мл) при 0 С и полученную суспензию перемешивают в течение 1 ч. Добавляют по каплям тбутилбромацетат (8,86 мл, 60 ммоль), реакционную смесь нагревают до комнатной температуры и перемешивают в течение 10 ч. Добавляют насыщенный водн. раствор NH4Cl и полученный органический слой промывают последовательно порциями насыщ. солевого раствора и Н 2 О. Объединенные органические слои высушивают (Na2SO4) и концентрируют в вакууме,получая соединение 3 в виде масла. Пример 4. 1-Карбоксиметил-2-пиперидон Соединение 4 Трифторуксусную кислоту (15 мл) добавляют при перемешивании к раствору соединения 2 (12,93 г, 61 ммоль) в метиленхлориде (30 мл) в атмосфере N2. Смесь перемешивают в течение 4 ч и концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества: МС m/z 158 (МН+). Пример 5.N-[этил-2-(2-изопропилоксифенил)пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамид Соединение 5 Раствор соединения 2 (3,61 г, 23 ммоль) в метиленхлориде (10 мл) добавляют к раствору соединения 4 (5,0 г, 19 ммоль) в метиленхлориде (10 мл). Добавляют РуВrоР (10,72 г, 23 ммоль), DMAP (3,85 г, 31 ммоль) и Nметилморфолин (2,53 мл, 23 ммоль), смесь перемешивают при комнатной температуре в атмосфере N2 в течение 10 ч. Полученную смесь промывают одной порцией водного раствора бикарбоната натрия, насыщ. солевым раствором и H2O. Объединенный органический слой высушивают (Na2SO4) и концентрируют в вакууме. Остаток очищают с помощью жидкостной хроматографии среднего давления на силикагеле с использованием в качестве элюента смесиEtOAc/MeOH/триэтиламин (90:5:5), получая указанное в заголовке соединение в виде масла: МС m/z 403 (МН+). Обработка выделенного соединения эквимолярным количеством лимонной кислоты дает соль лимонной кислоты указанного в заголовке соединения в виде твердого вещества. Пример 6. 12 Соединение 6 Гидрид натрия (95% тех., 10,6 мг, 0,44 ммоль) добавляют при перемешивании к раствору соединения 5 (140,5 мг, 0,35 ммоль) в ТГФ (5 мл) при 0 С, и полученную суспензию перемешивают в течение 30 мин. Добавляют по каплям метилиодид (0,37 ммоль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Остаток концентрируют в вакууме, растворяют в этилацетате и последовательно промывают порциями насыщ. водн. раствора хлорида аммония, насыщ. солевого раствора и воды. Объединенные органические слои высушивают (Na2SO4) и концентрируют в вакууме, получая указанное в заголовке соединение в виде твердого вещества: МС m/z 417(МН+). Биологические примеры Биологическую активность и селективность соединений данного изобретения демонстрируют следующие анализы in vitro. Первый анализ определяет способность соединений формулы I связываться с мембрано-связанными рецепторами 1a-AP, 1b-АР и 1d-AP. Пример 14. Были опубликованы последовательности ДНК трех клонированных подтипов l-AP человека. Более того, клонированные кДНК были экспрессированы как временно в COS-клетках,так и постоянно в ряде клеточных линий млекопитающих (HeLa, LM(tk-), СНО, rat-1 фибропласт), и было продемонстрировано, что они сохраняют активность, связывающую радиомеченные лиганды, и способность сочетаться с фосфоинозитидным гидролизом. Мы использовали опубликованную информацию о последовательности ДНК для конструирования праймеров, использующихся для амплификации путемRT-PCR (полимеразной цепной реакции с обратной транскриптазой) каждого подтипа для получения клонированных кДНК. ПолиА+РНК человека была получена из коммерчески доступных источников и включала образцы из гиппокампуса и простаты, источники, которыe имели место в литературе. Для первичного скрининга использовали анализ связывания радиомеченного лиганда, в котором использовали мембранные препараты из клеток, экспрессирующих индивидуальную кДНК клонированного рецептора. Радиомеченные лиганды со связывающей активностью ко всем трем типам (неселективные) являются коммерчески доступными ([125I]-HEAT, [3H]-празоцин). Каждый подтип 1 рецептора клонировали из полиА+РНК с помощью стандартного способа полимеразной цепной реакции с обратной транскриптазой (RT-PCR). Для клонирования подтипов 1 рецептора использовали следующие источники полиА+РНК: 1a-AP гиппокампуса и простаты человека, 1b-АР гиппокампуса человека, 1d-AP гиппокампуса человека. Полу 13 ченные кДНК клонировали в pcDNA3 человеческом экспрессионном векторе (Invitrogen Corp.,San Diego CA). Проводили сиквенс для каждой ДНК для проверки и для определения какихлибо возможных мутаций, введенных в процессе амплификации. Любые отклонения в последовательности от опубликованной консенсусной последовательности для каждого подтипа рецептора корректировали путем направленного мутагенеза. Три подтипа 1-AP (а, b, d) трансфицировали в COS клетки с помощью стандартной методики с использованием DEAE-декстрана и хлорокинового шока. В этой процедуре в каждую плашку для культуры ткани (100 мм) вносили 3,5 х 106 клеток и трансфицировали 10 мкг ДНК. Приблизительно через 72 ч после трансфекции клетки собирали и получали COS мембраны. Трансфицированные COS клетки из 25 плашек отделяли и суспендировали в 15 мл буфера ТЕ (50 мМ трис-HCl, 5 мМ ЭДТА, рН 7,4). Клетки суспензии разрушают с помощью гомогенизатора. Затем центрифугируют при 1000 хg в течение 10 мин при 4 С. Супернатант центрифугируют при 34500 хg в течение 20 мин при 4 С. Осадок ресуспендируют в 5 мл буфера TNE(50 мМ трис-HCl, 5 мМ ЭДТА, 150 мМ NaCl, рН 7,4). Полученные препараты мембран разделяют на порции и хранят при -70 С. Концентрацию белка определяют после солюбилизации белка под действием тритона Х-100. Способность каждого соединения связываться с каждым из подтипов 1-AP оценивали с помощью анализа рецепторного связывания.[125I]-HEAT, неселективный лиганд 1-АР, использовали как радиомеченый лиганд. В каждую лунку 96-луночного планшета помещали: 140 мкл TNE, 25 мкл [125I]-НЕАТ, растворенного в TNE (50 000 cpm; конечная концентрация 50 пМ), 10 мкл тестируемого соединения, растворенного в ДМСО (конечная концентрация 1 пМ 10 мкМ), 25 мл препарата мембран COS клеток,экспрессирующих один из трех подтипов 1-АР(0,05-0,2 мг мембранного белка). Планшет инкубировали 1 ч при комнатной температуре и реакционные смеси фильтровали через фильтровальный планшет Packard GF/C Unifilter. Фильтровальный планшет высушивали 1 ч в вакуумном сушильном аппарате. К каждой лунке добавляли сцинтилляционную жидкость (25 мл) и радиоактивность на фильтровальном планшете считали на сцинтилляционном счетчике Packard Topcount. Данные анализировали с помощью программы GraphPad Prism. В таблицах А и В перечислены значенияIС 50 для всех подтипов рецептора, выраженные в наномолярной концентрации, для выбора соединений данного изобретения."+" обозначает соль лимонной кислоты (цитрат) Соед. Пример 15. Антагонистическую активность выбранных соединений формулы I демонстрировали с помощью следующего анализа. Связывание антагониста с 1-AP вызывает активацию PLC посредством механизмов, сопряженных с Gбелками (Minneman and Esbenshade, 1994). PLC катализирует гидролиз фосфатидилинозит-4,5 бифосфата (PIP2), вызывая образование двух молекул вторичных мессенджеров, инозит-1,4,5 трифосфата (IP3) и диацилглицерина (DAG), и одновременно приводя к мобилизации кальция из внутриклеточных источников. Соединения,отобранные в процессе первичного анализа,которые демонстрировали селективность при ингибировании связывания радиомеченного лиганда с 1-AP, оценивали на способность проявлять антагонистическую активность по отношению к мобилизации цитозольного кальция в линиях клеток, стабильно экспрессирующих индивидуальные подтипы рецептора. Получение клеточных линий, стабильно экспрессирующих каждый подтип рецептора Подтипы альфа 1 адренергического рецептора(а, b, d) в pcDNA3 векторе были трансфицированы в клетки НЕК 293 s (человеческих эмбриональных почек) для образования стабильных рецептор-экспрессирующих клеточных линий. Трансфекцию проводили, используя катионный липидный реагент DMRIE-C (GibcoBRL), смешанный с 2-3 мкг ДНК и с клеточной средой с пониженным содержанием сыворотки OPTIMEM 1 (GibcoBRL). На клетки в плашках для выращивания культур тканей диаметром 100 мм наносили комплекс липид-ДНК и инкубировали при 37 С, 5% СO2, в течение 5-6 ч. Затем добавляли клеточную среду, содержащую сыворотку, 15 и клетки инкубировали в течение еще 48 ч. После этой инкубации содержимое каждой плашки разводили 1:5 селекционной средой, содержащей 250, 300 или 350 мкг/мл антибиотика G418(генетицина). Каждые 4 дня плашки подпитывали соответствующей селекционной средой. Приблизительно через три недели выбирали колонии для каждого подтипа из селекционных плашек, содержащих 300 мкг/мл G418. Колониям давали подрасти и замораживали их. Двенадцать клеточных линий, экспрессирующих каждый подтип, анализировали на связывание альфа 1 адренергического рецептора, используя анализ рецепторного связывания на целых клетках. Затем позитивные культуры анализировали на мобилизацию кальция. Клетки НЕК 293s, экспрессирующие человеческий 1-АР, собирали с помощью трипсина и промывали один раз HBSS. Клеточный осадок ресуспендировали в HBSS, содержащем 0,05% БСА, до концентрации 1-5 х 106 клеток/мл. К клеточной суспензии добавили 5 мМ растворFluo-3 составляла 5 мкМ. Затем клетки инкубировали при небольшом покачивании при комнатной температуре в течение 1 ч в темноте. После инкубирования клетки трижды промывали HBSS и ресуспендировали в HBSS, содержащей 1,25 мМ CaCl2, с получением конечной концентрации 0,7 х 106 клеток/мл. Клеточные аликвоты (100 мкл) переносили с помощью пипетки в каждую лунку 96-луночного микропланшета. Мобилизацию кальция индуцировали норэпинефрином (10 мкМ) при комнатной температуре. За две минуты до анализа к клеткам добавляли антагонисты,используя 96 канальный дозатор. Потом добавляли антагонист и регистрировали флюоресцентный сигнал в течение 2-3 мин, используя FLIPR (MolecularDevices, USA). Соединение 5 ингибировало мобилизацию цитозольного кальция с IС 50, равной 99 мкМ. Пример 16. Антагонистическая активность и селективность соединений данного изобретения для ткани простаты по сравнению с тканью аорты, а также их антагонисты, была продемонстрирована следующим образом. Контрактильные ответы предстательной ткани крыс и ткани аорты крыс исследовали в присутствии и в отсутствии антагонистических соединений. Для определения селективности антагонизма действие тестируемого соединения на сократительную способность гладкой мускулатуры сосудов (1b-АР и 1d-AP) сравнивали с действием на гладкую мускулатуру простаты (1a-AP) . Полоски предстательной ткани и кольца аорты были получены от самцов крыс весом 275 г, полученных отLong Evans, и умерщвленных путем декапитации. Ткань простаты помещали под растяжени 001904 16 ем в 1 г в баню емкостью 10 мл, содержащую фосфатный буферный раствор рН 7,4 при 32 С,и изометрическое растяжение измеряли с помощью преобразователя силы. Ткань аорты помещали под растяжением в 2 г в баню емкостью 10 мл, содержащую фосфатный буферный раствор рН 7,4 при 37 С. Определяли способность тестируемого соединения понижать вызванный норэпинефрином контрактильный ответ на 50%(IC50). Соединение 5 ингибировало контрактильный ответ в ткани аорты с IС 50, равной 31,9 мкМ, и в ткани простаты с IC50, равной 1,3 мкМ. Пример 17. Выбранные соединения данного изобретения тестировали на способность проявлять антагонистическую активность по отношению к вызванному фенилэфрином (ФЭ) повышению внутриуретального давления у собак. Селективность этих соединений демонстрировали путем сравнения с их влиянием на вызванное ФЭ повышение среднего артериального давления(САД) у собак. Самцов коротконогих гончих собак анестезировали и вводили катетер в уретру простаты для измерения внутриуретального давления(ВУД). Среднее артериальное давление (САД) измеряли при помощи катетера, помещенного в бедренную артерию. Вначале собакам вводили шесть в/в болюсных доз (от 1 до 32 мг/кг) фенилэфрина (ФЭ) для построения контрольной кривой доза агониста-ответ. ВУД и САД записывали после каждой дозы до тех пор, пока ВУД не возвращалось к базовой линии. Затем собакам вводили в/в болюсные дозы соединения-антагониста, после чего в/в вводили увеличивающиеся дозы ФЭ, как в контрольной кривой доза агониста-ответ. Записывали замеры ВУД и САД после каждого введения ФЭ. Соединение-антагонист тестировали в интервале доз от 3 до 300 мкг/кг с полулогарифмическим инкрементом. Интервал между дозами антагониста составлял, по меньшей мере, 45 мин, и на один уровень дозы каждого тестируемого соединения было проведено три эксперимента. Приведенные ниже графики иллюстрируют средний процент уменьшения ВУД и САД для соединений 5 и 12 соответственно.R1 представляет собой C1-6 алкил, фенил,замещенный фенил, где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкок 001904 20 сильной группы и галогена, фенилС 1-5 алкила,или замещенный фенилС 1-5 алкил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из C1-5 алкила, C1-5 алкоксильной группы и галогена;R2 представляет собой водород, C1-6 алкил,С 2-5 алкенил, С 2-5 алкинил, фенилС 1-5 алкил или замещенный фенилС 1-5 алкил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из C1-5 алкила, C1-5 алкоксильной группы и галогена; Е представляет собойR3 представляет собой водород, C1-6 алкил или кислород, где, если R3 представляет собой кислород, пунктирная линия представляет собой связь, а если R3 представляет собой C1-6 алкил, то пунктирная линия отсутствует;R4 представляет собой кислород, водород,С 1-5 алкил, формил, карбоксильную группу, С 1-5 алкилкарбонильную группу, С 1-5 алкоксикарбонильную группу, фенилС 1-5 алкоксильную группу, замещенную фенилС 1-5 алкоксильную группу,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкоксильной группы и галогена, амидогруппы и замещенной амидогруппы,где заместители азота независимо выбраны из одного или нескольких из группы, состоящей из водорода, С 1-5 алкила, С 1-5 алкоксильной группы и гидроксильной группы, где, если R4 представляет собой кислород, пунктирная линия представляет собой связь, а если R4 является любым другим заместителем, то пунктирная линия отсутствует;R5 представляет собой водород, С 1-5 алкил,или, взятый вместе с R6, образует циклогексановый, циклопентановый или циклопропановый цикл;R6 представляет собой водород, С 1-5 алкил,или, взятый вместе с R5, образует циклогексановый, циклопентановый или циклопропановый цикл; и их фармацевтически приемлемые соли. 2. Соединение по п.1, где R1 представляет собой C1-6 алкил, n равно 2-4, a R2 представляет собой водород, C1-6 алкил, С 2-6 алкенил. 3. Соединения по п.2, где Е представляет собой 6. Соединения по п.5, где m равно 2-5. 7. Соединение и его фармацевтически приемлемые соли, выбранное из группы, состоящей изN-[этил-2-(2-изопропилоксифенил)пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамида,N-[этил-2-(2-изопропилоксифенил)пиперазин-4 ил)]-N-метил-[1'-(2-оксипиперидинил)]ацетамида и N-[пропил-3-(2-изопропилоксифенил) пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамида. 8. Соединение N-[этил-2-(2-изопропилоксифенил)пиперазин-4-ил)]-[1'-(2-оксипиперидинил)]ацетамид и его фармацевтически приемлемые соли. 9. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель или разбавитель. 10. Фармацевтическая композиция, включающая соединение по п.6 и фармацевтически приемлемый носитель или разбавитель. 11. Фармацевтическая композиция, включающая соединение по п.8 и фармацевтически приемлемый носитель или разбавитель. 12. Способ лечения заболевания, опосредованного -1 а адренергическим рецептором,включающий введение пациенту эффективной дозы соединения по п.1. 13. Способ лечения заболевания, опосредованного -1 а адренергическим рецептором,включающий введение пациенту эффективной дозы композиции по п.6. 14. Способ лечения заболевания, опосредованного -1 а адренергическим рецептором,включающий введение пациенту эффективной дозы композиции по п.8. 22 15. Способ по п.13, где соединение вводят перорально, а эффективная доза составляет 0,01-100 мг/кг в день. 16. Способ по п.15, где доза составляет 0,05-1,0 мг/кг в день. 17. Способ лечения доброкачественной гиперплазии простаты, включающий введение эффективной дозы соединения по п.1. 18. Соединение формулы IIR1 представляет собой разветвленный С 2-6 алкил, фенил, замещенный фенил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкоксильной группы и галогена, фенилС 1-5 алкила, или замещенный фенилС 1-5 алкил,где заместители фенила независимо выбраны из одного или нескольких из группы, состоящей из С 1-5 алкила, С 1-5 алкоксильной группы и галогена;R1 представляет собой разветвленный С 2-6 алкил. 20. Соединениe по п.18, где R7 представляет собой водород или т-бутоксикарбонил. 21. Соединение, выбранное из группы, состоящей из 1-(2-аминоэтил)-4-(2-2-изопропилоксифенил)пиперазина, 1-(3-аминопропил)-4-(22-изопропилоксифенил)пиперазина и 1-(4 аминобутил)-4-(2-2-изопропилоксифенил)пиперазина. 22. Соединение 1-(аминоэтил)-4-(2-2-изопропилоксифенил)пиперазин. 23. Соединение формулы III
МПК / Метки
МПК: A61K 31/40, A61P 13/08, C07D 205/08
Метки: доброкачественной, пиперазины, арилзамещенные, гиперплазии, простаты, лечения
Код ссылки
<a href="https://eas.patents.su/12-1904-arilzameshhennye-piperaziny-dlya-lecheniya-dobrokachestvennojj-giperplazii-prostaty.html" rel="bookmark" title="База патентов Евразийского Союза">Арилзамещенные пиперазины для лечения доброкачественной гиперплазии простаты</a>
Предыдущий патент: Интраназальные композиции для лечения сексуальных расстройств
Следующий патент: Лекарственная форма сертралина в виде раствора, заключенного в желатиновые капсулы
Случайный патент: Деталь топливной системы и способ изготовления детали топливной системы
















