Композиция пролонгированного высвобождения, содержащая памоат пасиреотида в микрочастицах с полимерной матрицей, способ получения микрочастиц и способ лечения
Номер патента: 18203
Опубликовано: 28.06.2013
Авторы: Ламбер Оливье, Вусеновиц Витомир, Рименшниттер Марк
Формула / Реферат
1. Фармацевтическая композиция пролонгированного высвобождения, включающая микрочастицы с полимерной матрицей, содержащей линейный и разветвленный сополимеры лактида с гликолидом и памоат пасиреотида в качестве активного ингредиента, полученной в процессе суспендирования памоата пасиреотида в растворе полимера, при котором указанный раствор полимера содержит метиленхлорид и полимерную смесь указанных линейного и разветвленного сополимеров лактида с гликолидом, причем концентрация полимерной смеси в метиленхлориде находится между 14,24 и 17,45% массы полимеров на массу раствора полимеров.
2. Фармацевтическая композиция по п.1, в которой активный ингредиент высвобождается в течение периода времени, равного не менее 4 неделям.
3. Фармацевтическая композиция по п.1, в которой полимерная матрица содержит линейный и разветвленный сополимеры лактида с гликолидом, где указанный разветвленный сополимер обладает среднемассовой молекулярной массой, равной от примерно 47000 до примерно 63000 Да.
4. Фармацевтическая композиция по п.1, в которой отношение количества линейного сополимера лактида с гликолидом к количеству разветвленного составляет примерно от 60:40 до 40:60.
5. Фармацевтическая композиция по п.1, в которой концентрация полимерной смеси в метиленхлориде составляет 15,9 мас.% полимеров на массу раствора полимеров.
6. Фармацевтическая композиция по п.1, которая дополнительно включает поверхностно-активное вещество, агент, влияющий на пористость, и/или основную соль.
7. Набор, включающий микрочастицы по любому из пп.1-6 и разбавитель на водной основе.
8. Набор по п.7, в котором разбавитель на водной основе включает смачивающий агент, агент, регулирующий тоничность, и агент, увеличивающий вязкость.
9. Набор по п.8, в котором смачивающий агент выбран из группы, включающей полоксамер и/или полиоксиэтилен-сорбитановый эфир жирной кислоты.
10. Набор по п.8, в котором агент, регулирующий тоничность, выбран из группы, включающей маннит, хлорид натрия, глюкозу, декстрозу, сахарозу и глицерин.
11. Набор по п.8, в котором агент, увеличивающий вязкость, выбран из группы, включающей натриевую соль карбоксиметилцеллюлозы (КМЦ-Na), сорбит, поливинилпирролидон и моностеарат алюминия.
12. Набор по п.7, предназначенный для применения во флаконах, в котором разбавитель на водной основе включает натриевую соль карбоксиметилцеллюлозы, маннит и 2-метилоксиран (Pluronic F68).
13. Способ приготовления микрочастиц, включающий
растворение смеси линейного сополимера лактида с гликолидом и разветвленного сополимера лактида с гликолидом в метиленхлориде, с получением раствора полимера;
прибавление этого раствора полимера к активному ингредиенту - памоату пасиреотида;
приготовление водной дисперсии фосфатов и поливинилового спирта;
смешивание раствора полимер/активный ингредиент с раствором поливиниловый спирт/фосфат;
выпаривание метиленхлорида и отфильтровывание полученных микрочастиц,
причем концентрация смеси полимеров в метиленхлориде составляет от 14,2 до 17,5 мас.% полимеров на массу раствора полимеров.
14. Способ по п.13, в котором концентрация смеси полимеров в метиленхлориде составляет примерно 15,9 мас.% полимеров на массу раствора полимеров.
15. Способ лечения заболевания или нарушения, этиология которого включает избыточную секрецию GH- и/или IGF-1 или связана с ней, у нуждающегося в этом субъекта, включающий введение субъекту фармацевтической композиции по п.1.
Текст
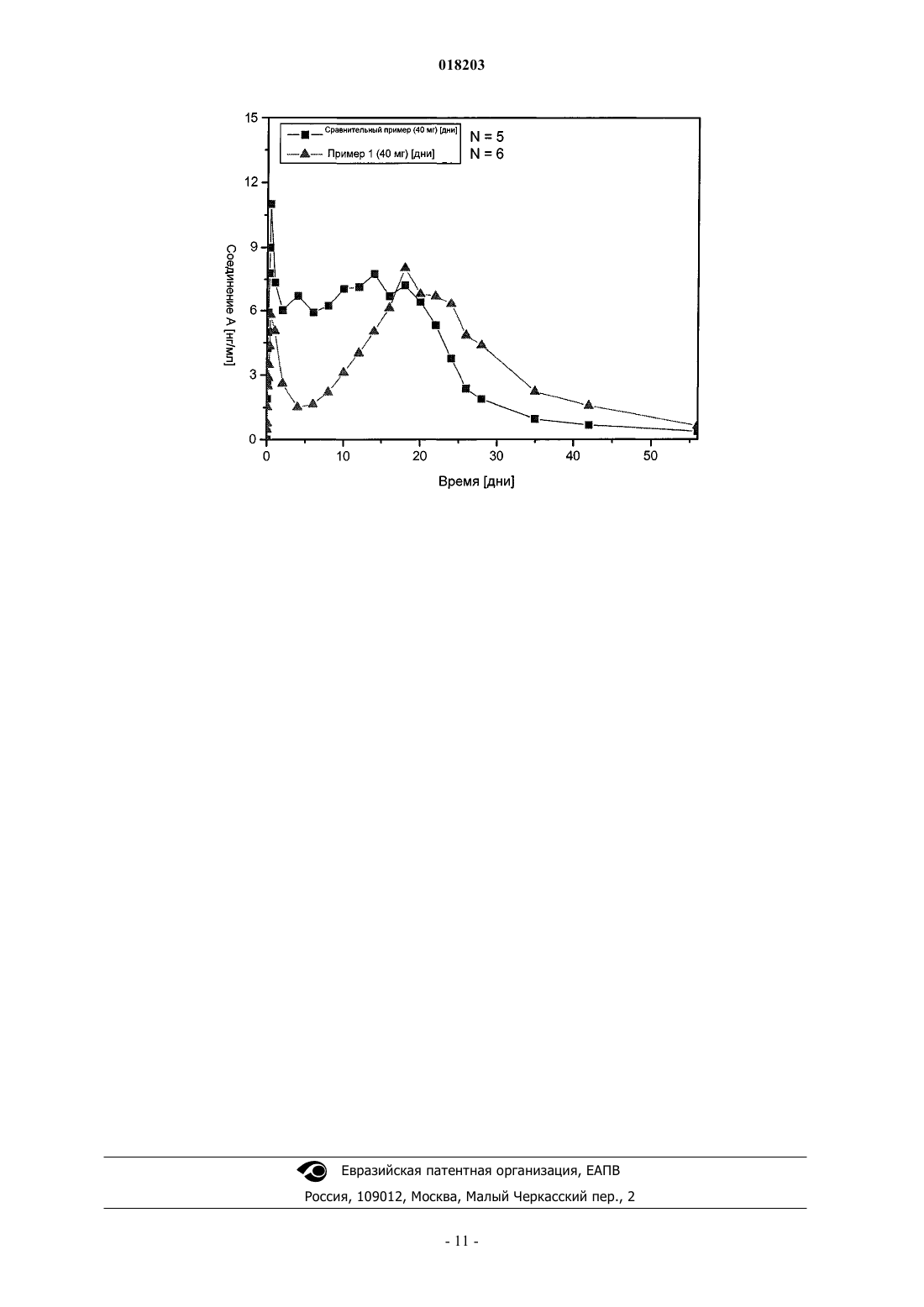
КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ВЫСВОБОЖДЕНИЯ, СОДЕРЖАЩАЯ ПАМОАТ ПАСИРЕОТИДА В МИКРОЧАСТИЦАХ С ПОЛИМЕРНОЙ МАТРИЦЕЙ,СПОСОБ ПОЛУЧЕНИЯ МИКРОЧАСТИЦ И СПОСОБ ЛЕЧЕНИЯ В изобретении описана фармацевтическая композиция пролонгированного высвобождения,включающая улучшенные микрочастицы с полимерной матрицей, содержащие памоат пасиреотида в качестве активного компонента, и способ лечения с использованием указанной композиции. Представлен также способ приготовления микрочастиц, а также набор, включающий упомянутые микрочастицы. Настоящее изобретение относится к улучшенным микрочастицам, содержащим аналог соматостатина, к способу приготовления указанных микрочастиц и к содержащим их фармацевтическим композициям. Предпочтительный аналог соматостатина, предлагаемый в настоящем изобретении, представляет собой соединение А формулы также обладающее названием цикло[4-(NH2-C2H4-NH-CO-O-)Pro-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe],или пасиреотид, а также его диастереоизомеры и смеси в свободной форме, в форме соли или комплекса или в защищенной форме. Phg обозначает -HN-CH(C6H5)-CO- и Bzl обозначает бензил. Предпочтительными солями соединения А являются лактат, аспартат, бензоат, сукцинат и памоат,включая одно- и двузамещенные соли, более предпочтительно двузамещенный аспартат и однозамещенный памоат, наиболее предпочтительно однозамещенный памоат. Соединения, предлагаемые в настоящем изобретении, включая их соли, можно получить по обычным методикам. Соединение А и его синтез подробно описаны, например, в WO 02/10192, содержание которого включено в настоящее изобретение в качестве ссылки. В WO 05/046645, содержание которого включено в настоящее изобретение в качестве ссылки, показано, что введение микрочастиц, содержащих аналог соматостатина, например, соединения А, например,включенного в биологически совместимый фармакологически приемлемый полимер, суспендированный в подходящем разбавителе, приводит к высвобождению всего или в основном всего активного средства в течение длительного периода времени, например в течение от нескольких недель до 6 месяцев, предпочтительно в течение не менее 4 недель. Однако препараты микрочастиц соединения А, описанные в WO 05/046645, иногда обладают менее благоприятным фармакокинетическим профилем высвобождения активного ингредиента (лекарственного средства). Длительность воздействия иногда неудовлетворительна, т.е. недостаточно длительна. Однако относительно особенно значительное начальное высвобождение лекарственного средства в первый день (дни) после введения (скачок высвобождения лекарственного средства) может привести к затруднениям, таким как, например, нежелательные побочные эффекты, включая, например, тошноту или временное слишком высокое содержание глюкозы в крови. Этот скачок высвобождения лекарственного средства в еще большей степени относится к повторяющемуся введению, когда содержание лекарственного средства в плазме достигает стабильно высокого значения. Согласно изобретению неожиданно было установлено, что при сохранении неизменного общего состава препарата, но с изменением концентрации лекарственного средства в полимере во время приготовления микрочастиц, содержащих соединение А, получаются микрочастицы, обладающие улучшенными характеристиками. Фармацевтические композиции, содержащие эти новые микрочастицы, предлагаемые в настоящем изобретении, характеризуются меньшим начальным высвобождением активного ингредиента и/или большей длительностью воздействия, и/или благоприятным фармакокинетическим профилем высвобождения, в особенности при повторяющемся введении, по сравнению с фармацевтическими композициями,содержащими микрочастицы, описанными в WO 05/046645. Улучшенные характеристики фармацевтических композиций, предлагаемых в настоящем изобретении, можно, например, документировать на основании результатов, полученных при клинических исследованиях на людях. На чертеже сопоставлены профили высвобождения соединения А у здоровых добровольцев после введения одной дозы, равной 40 мг, соединения А в микрочастицах, соответствующей примеру 1 или соответствующей сравнительному примеру (пример 8 в WO 05/046645). Микрочастицы суспендировали в разбавителе D и вводили внутримышечно (ВМ). Периодически отбирали пробы крови и содержание в плазме соединения А определяли с помощью радиоиммунологического анализа (РИА). Полученные результаты свидетельствуют о значительном уменьшении скачка высвобождения лекарственного средства на профилях высвобождения микрочастиц, предлагаемых в настоящем изобретении, по сравнению с фармакокинетическим профилем микрочастиц, соответствующих сравнительному примеру. Улучшенные характеристики фармацевтических композиций, предлагаемых в настоящем изобретении, также можно, например, определить с помощью экспериментов in vivo на кроликах. Результаты,-1 018203 полученные на кроликах, можно легко и надежно перенести на соответствующую ситуацию для людей,поскольку фармакологические профили соединения А для кроликов и для людей очень сходны. Профиль высвобождения фармацевтических композиций, предлагаемых в настоящем изобретении,после однократного введения кроликам можно подытожить следующим образом. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции пролонгированного высвобождения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента, в которой максимальная концентрация в плазме (скачок) активного ингредиента у кроликов в течение первых 24 ч после введения 4 мг/кг составляет менее 15, предпочтительно 12 или 10 нг/мл. В предпочтительном варианте осуществления настоящего изобретения фармацевтические композиции пролонгированного высвобождения, предлагаемые в настоящем изобретении, содержат микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции пролонгированного высвобождения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента, в то время как у кроликов отношение максимальной концентрации в плазме(скачка) активного ингредиента в течение первых 24 ч после введения к минимальной концентрации в плазме активного ингредиента между днями 2 и 10 после введения составляет менее 5 или менее 4. Еще более предпочтительным является отношение максимальной концентрации в плазме (скачка) активного ингредиента в течение первых 24 ч после введения к минимальной концентрации в плазме активного ингредиента между днями 2 и 10 после введения, составляющее менее 3,7 или предпочтительно менее 3,6. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции пролонгированного высвобождения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента, в то время как у кроликов максимальная концентрация в плазме (tmax) соединения А устанавливается не ранее 12 дня после введения. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции пролонгированного высвобождения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента, в то время как у кроликов концентрация в плазме соединения А составляет более 2 нг/мл между днем 2 и днем 35 после введения. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции пролонгированного высвобождения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента, в которой активный ингредиент соединение А высвобождается в течение не менее 4 недель. В другом варианте осуществления настоящее изобретение также относится к фармацевтическому препарату-депо, содержащему микрочастицы, предлагаемые в настоящем изобретении. Скачок высвобождения соединения А альтернативно или дополнительно можно определить с помощью исследования растворения in vitro, например, как описано в примере 4 настоящего изобретения. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции пролонгированного высвобождения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и соединение А памоат в качестве активного ингредиента, в которой скачок, измеряемый, как выраженное в % содержание соединения А через 24 ч, составляет менее 1,2%, менее 1,0%, менее 0,9% или менее 0,8%. Скачок, измеряемый как выраженное в % содержание соединения А через 24 ч, предпочтительно составляет от 0,5 до 1,2% или от 0,6 до 1,0%. В другом варианте осуществления настоящее изобретение относится к способу лечения заболевания, поддающегося лечению соединением А у пациента, нуждающегося в таком лечении, включающему введение пациенту дозированной формы, предназначенной для парентерального введения памоата соединения А, указанная дозированная форма содержит микрочастицы, описанные в настоящем изобретении, где указанная дозированная форма высвобождает соединение А у кроликов, так что максимальная концентрация в плазме (скачок) активного ингредиента у кроликов в течение первых 24 ч после введения 4 мг/кг составляет менее 15, предпочтительно - 12 или 10 нг/мл. В одном варианте осуществления способа максимальная концентрация в плазме (tmax) соединения А у кроликов устанавливается не ранее 12 дня после введения. В другом варианте осуществления концентрация в плазме соединения А у кроликов составляет более 2 нг/мл между днями 2 и 35. Альтернативно или дополнительно скачок высвобождения измеряют по методике, описанной в примере 4, и он составляет менее 1,2 или 1% содержания соединения А. Введение можно, например, проводить по меньшей мере один раз в 2 недели, или по меньшей мере один раз в 4 недели (включая например, один раз в месяц), или по меньшей мере один раз в 6 недель, или по меньшей мере один раз в 8 недель (или например, один раз в 2 месяца). Заболевания, поддающегося лечению соединением А, включают заболевания или нарушения, этиология которых включает избыточную секрецию GH- и/или IGF-1 или связана с ней. В одном варианте осуществления настоящее изобретение относится к применению препарата соединения А, получаемого способом приготовления микрочастиц, описанным ниже в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения нарушений, этиология которых включает избыточную секрецию GH- и/или IGF-1 или связана с ней. В другом варианте осуществления настоящее изобретение относится к применению соединения А для приготовления лекарственного средства, предназначенного для лечения заболевания, поддающегося лечению соединением А, в котором соединение А находится в дозированной форме, предназначенной для парентерального введения, содержащей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров и памоат соединения А в качестве активного ингредиента, характеризующейся тем, что микрочастицы высвобождают соединение А у кроликов,так что максимальная концентрация в плазме (скачок) активного ингредиента у кроликов в течение первых 24 ч после введения 4 мг/кг составляет менее 15, предпочтительно 12 или 10 нг/мл. В одном варианте осуществления максимальная концентрация в плазме (tmax) соединения А у кроликов устанавливается не ранее 12 дня после введения. В другом варианте осуществления концентрация в плазме соединения А у кроликов составляет более 2 нг/мл между днями 2 и 35. Скачок высвобождения альтернативно или дополнительно можно определить с помощью исследования растворения, описанного в примере 4, и он и составляет менее 1,2 или 1% содержания соединения А. В другом варианте осуществления настоящее изобретение относится к применению фармацевтической композиции пролонгированного высвобождения, включающей микрочастицы в полимерной матрице, содержащей один или большее количество биологически разлагающихся полимеров, например смесь линейного сополимера лактида с гликолидом и разветвленного сополимера лактида с гликолидом, и памоат соединения А в качестве активного ингредиента, для которой использовали микрочастицы способом приготовления микрочастиц, описанным ниже в настоящем изобретении, характеризующейся тем,что для растворения полимерной смеси используют метиленхлорид в концентрации от 14,24 до 17,45%,предпочтительно от 15,0 до 16,5%, еще более предпочтительно примерно 15,9% (мас./мас). Такие фармацевтические композиции можно, например, использовать для приготовления лекарственного средства,предназначенного для лечения акромегалии, ГЭП (гастроэнтеропанкреатические) опухолей, синдрома Кушинга и таких опухолей, как, например, гепатоцеллюлярная карцинома, рак молочной железы. Такие композиции характеризуются благоприятным профилем высвобождения соединения А и, в частности,уменьшенным начальным скачком, описанным в настоящем изобретении. Соединение А (свободное основание) может содержаться в количестве, составляющем от примерно 1 до примерно 35%, предпочтительно от примерно 10 до примерно 35%, еще более предпочтительно от примерно 20 до примерно 30 мас.% в пересчете на количество микрочастиц в сухом состоянии. Предпочтительно, если соединение, предлагаемое в настоящем изобретении, использующееся для приготовления микрочастиц, находится в форме аморфного порошка. Размер частиц и/или распределение по размерам частиц соединения, предлагаемого в настоящем изобретении, может влиять на профиль высвобождения лекарственного средства из микрочастиц. Обычно чем меньше размер частиц, тем меньше скачок и высвобождение происходит на стадии диффузии, например, в течение первых 20 дней. Предпочтительно, если частицы соединения, предлагаемого в настоящем изобретении, использующиеся для приготовления микрочастиц, обладают размером,равным от примерно 0,1 до примерно 15 мкм, предпочтительно менее примерно 5 мкм, еще более предпочтительно менее примерно 3 мкм. Распределение частиц по размерам предпочтительно характеризуется следующими показателями: 100,8 мкм, т.е. 10% частиц размером меньше чем 0,8 мкм; 503,0 мкм, т.е. 50% частиц размером меньше чем 3,0 мкм или 905,0 мкм, т.е. 90% частиц размером меньше чем 5,0 мкм. Полимерная матрица микрочастиц содержит один или большее количество биологически разлагающихся полимеров. "Полимер" означает гомополимер или сополимер. В предпочтительном варианте осуществления полимерная матрица микрочастиц содержит один или большее количество биологически разлагающихся полимеров. Полимерная матрица приготовлена такой, чтобы разлагаться в степени, достаточной для выведения из участка введения в течение от 1 до 6 месяцев после высвобождения всего или в основном всего активного средства. Предпочтительные полимеры, предлагаемые в настоящем изобретении, представляют собой линейные сложные полиэфиры и разветвленные сложные полиэфиры (т.е. сложные полиэфиры, которые обладают линейными цепями, идущими от полиольного фрагмента, например, глюкоза). Линейные сложные полиэфиры можно получить из -гидроксикарбоновых кислот, например молочной кислоты и/или гликолевой кислоты путем конденсации димеров лактонов, см., например, US 3773919, содержание которо-3 018203 го включено в настоящее изобретение в качестве ссылки. Предпочтительные сложные полиэфирные цепи в линейных или разветвленных (звездообразных) полимерах представляют собой сополимеры фрагментов -гидроксикарбоновых кислот, молочной кислоты и гликолевой кислоты, или димеров лактонов. Молярное отношение лактид:гликолид сополимеров лактида с гликолидом в линейных или разветвленных сложных полиэфирах предпочтительно составляет примерно от 75:25 до 25:75, например от 60:40 до 40:60, и отношение, составляющее от 55:45 до 45:55,например от 52:48 до 48:52, является наиболее предпочтительным. Особенно предпочтительным является отношение, составляющее примерно 50:50. Линейные сложные полиэфиры, линейные сополимеры лактида с гликолидом (ПЛГ), предпочтительно использующиеся в контексте настоящего изобретения, обладают среднемассовой молекулярной массой (Mw), равной от примерно 10000 до примерно 500000 Да, например от примерно 47000 до примерно 63000, например примерно 50000 Да. Такие полимеры обладают показателем полидисперсностиMw/Mn, например, равным от 1,2 до 2. Подходящие примеры включают, например, сополимер D,Lлактида с гликолидом, например, описывающийся общей формулой -[(C6H8O4)x(C4H4O4)y]n- (каждый из х, у и n обладает таким значением, что сумма дает указанные выше значения Mw), например, имеющиеся в продаже, например, Resomers, выпускающийся фирмой Boehringer Ingelheim, в частности, ResomersRG, например, Resomer RG 502, 502 Н, 503, 503 Н, 504, 504 Н. Разветвленные сложные полиэфиры, например разветвленные сополимеры лактида с гликолидом,предпочтительно использующиеся в контексте настоящего изобретения, можно получить с использованием полигидроксисоединений, например полиола, например глюкозы или маннита в качестве инициатора. Эти сложные эфиры полиола известны и описаны, например, в GB 2145422 В, содержание которого включено в настоящее изобретение в качестве ссылки. Полиол содержит по меньшей мере 3 гидроксигруппы и обладает молекулярной массой, равной до 20000 Да, причем по меньшей мере 1, предпочтительно по меньшей мере 2, например по меньшей мере 3 из гидроксигрупп полиола находятся в составе сложноэфирных групп, которые содержат полилактидные или сополимерные лактидные цепи. Обычно для инициирования полимеризации используют 0,2% глюкозы. Разветвленные сложные полиэфиры (GluПЛГ) включают центральный глюкозный фрагмент, содержащий радиальные линейные полилактидные цепи, например, они обладают звездообразной структурой. Разветвленные сложные полиэфиры, включающие центральный глюкозный фрагмент, содержащие радиальные линейные цепи, являющиеся сополимерами лактида с гликолидом (Glu-ПЛГ), можно получить по реакции полиола с лактидом и предпочтительно также с гликолидом при повышенной температуре в присутствии катализатора, который обеспечивает протекание полимеризации с раскрытием цикла. Разветвленные сложные полиэфиры, включающие центральный глюкозный фрагмент, содержащие радиальные линейные цепи, являющиеся сополимерами лактида с гликолидом (Glu-ПЛГ), предпочтительно обладают среднемассовой молекулярной массой Mw, находящейся в диапазоне примерно от 10000 до 200000, предпочтительно от 25000 до 100000, более предпочтительно от 35000 до 60000 или от 47000 до 63000, например примерно 50000 Да, и показателем полидисперсности, например, равным от 1,5 до 3,0, например от 1,7 до 2,5. Характеристические вязкости звездообразных полимеров, обладающих Mw,равной 35000, или Mw, равной 60000, составляют от 0,20 до 0,70 дл/г, такие как, например, 0,36 или 0,51 дл/г соответственно в ацетоне или хлороформе. Звездообразный полимер, обладающий Mw, равной 53800, обладает вязкостью, составляющей от 0,25 до 0,50 дл/г в ацетоне или хлороформе, такой как, например, 0,34 дл/г в ацетоне при комнатной температуре. Предпочтительно, если полимерная матрица содержит линейный и разветвленный сополимеры лактида с гликолидом. Более предпочтительно, если полимерная матрица содержит Resomer RG, звездообразный сополимер лактида с гликолидом, обладающий среднемассовой молекулярной массой, равной от примерно 47000 до примерно 63000, например примерно 50000 Да. Отношение содержаний линейных и разветвленных сополимеров лактида с гликолидом предпочтительно составляет от 50:50 до 25:75. Более предпочтительно, если отношение составляет примерно 50:50. Полимерная матрица может содержаться в полном количестве, составляющем примерно от 40 до 99 мас.% в пересчете на массу микрочастиц. В другом варианте осуществления настоящее изобретение относится к способу приготовления микрочастиц, предлагаемых в настоящем изобретении, включающему:(i) приготовление внутренней органической фазы, включающее:(ia) растворение полимеров в метиленхлориде при концентрации, равной от 14,24 до 17,45%, предпочтительно от 15,0 до 16,5%, еще более предпочтительно примерно 15,9% (мас./мас.) и необязательно растворение/диспергирование агента, влияющего на пористость, в растворе, полученном на стадии(ia), или прибавление основной соли к раствору, полученному на стадии (ia),прибавление поверхностно-активного вещества к раствору, полученному на стадии (ia); полученном на стадии (ia), или растворение соединения, предлагаемого в настоящем изобретении, в растворителе, смешивающимся с растворителем, использующимся на стадии (ia), и смешивание указанного раствора с раствором полимера, или непосредственное растворение соединения, предлагаемого в настоящем изобретении, в растворе полимера, или растворение соединения, предлагаемого в настоящем изобретении, в форме растворимой в воде соли в водной фазе и эмульгирование указанного водного раствора с раствором полимера (ia);(ii) приготовление внешней водной фазы, включающее:(iia) приготовление буфера для установления значения рН, равным 7-7,5, например ацетатного или фосфатного буфера, например Na2HPO4 и KH2PO4, и(iib) растворение стабилизатора в растворе, полученном на стадии (iia);(iii) смешивание внутренней органической фазы с внешней водной фазой, например, с помощью устройства, создающего большие сдвиговые усилия, например с помощью турбинного смесителя или статического смесителя, или путем обработки ультразвуком, или путем ультразвуковой гомогенизации с получением эмульсии; и(iv) отверждение микрочастиц путем выпаривания растворителя или экстракции растворителем,промывка микрочастиц, например, водой, сбор и сушка микрочастиц, например сушка вымораживанием или сушка в вакууме. Органические растворители, подходящие для полимеров, включают галогенированные углеводороды, например метиленхлорид, хлороформ или гексафторизопропанол или этилацетат. Предпочтительным органическим растворителем является метиленхлорид. Концентрация полимерной смеси в метиленхлориде составляет от 14,24 до 17,45% (массы полимера в пересчете на массу раствора полимера), предпочтительно от 15,0 до 16,5%, еще более предпочтительно примерно 15,9% (мас./мас). Примеры стабилизатора, подходящего для стадии (iib), включают:a) поливиниловый спирт (ПВА), предпочтительно обладающий среднемассовой молекулярной массой, равной от примерно 10000 до примерно 150000 Да, например примерно 30000 Да. Предпочтительный поливиниловый спирт обладает низкой вязкостью, динамической вязкостью, равной от примерно 3 до примерно 9 мПас при измерении для 4% водного раствора при 20 С или в соответствии со стандартом DIN 53015. Поливиниловый спирт предпочтительно можно получить путем гидролиза поливинилацетата. Предпочтительно, если содержание поливинилацетата составляет от примерно 10 до примерно 90% в пересчете на массу поливинилового спирта. Обычно степень гидролиза составляет от примерно 85 до примерно 89%. Обычно содержание остаточных ацетильных групп составляет примерно от 10 до 12%. Предпочтительные торговые марки включают Mowiol 4-88, 8-88 и 18-88, выпускающиеся фирмойClariant AG Switzerland. Предпочтительно, если поливиниловый спирт содержится в количестве, составляющем от примерно 0,1 до примерно 5%, например примерно 0,5 мас.% в пересчете на объем внешней водной фазы;b) гидроксиэтилцеллюлозу (ГЭЦ) и/или гидроксипропилцеллюлозу (ГПЦ), например, полученные по реакции целлюлозы с этиленоксидом и пропиленоксидом соответственно. ГЭЦ и ГПЦ выпускаются в широком диапазоне типов вязкости; предпочтительно, если вязкость является средней. Предпочтительные торговые марки включают Natrosol, выпускающийся фирмой Hercules Inc., например, Natrosol 250MR, и Klucel, выпускающийся фирмой Hercules Inc. Предпочтительно, если ГЭЦ и/или ГПЦ содержится в полном количестве, составляющем от примерно 0,01 до примерно 5%, например примерно 0,5 мас.% в пересчете на объем внешней водной фазы;c) поливинилпирролидон, например, подходящим является обладающий молекулярной массой,равной примерно от 2000 до 20000 Да. Подходящие примеры включают общеизвестные, как повидонK12 F, обладающий средней молекулярной массой, равной примерно 2500 Да, повидон K15, обладающий средней молекулярной массой, равной примерно 8000 Да, или повидон K17, обладающий средней молекулярной массой, равной примерно 10000 Да. Предпочтительно, если поливинилпирролидон содержится в количестве, составляющем от примерно 0,1 до примерно 50%, например 10 мас.% в пересчете на объем внешней водной фазы;d) желатин, предпочтительно свиной или рыбий желатин. Предпочтительно, если желатин обладает вязкостью, равной от примерно 25 до примерно 35 сП в 10% растворе при 20 С. Обычно рН 10% раствора составляет от примерно 6 до примерно 7. Подходящая торговая марка обладает высокой молекулярной массой, например, рыбий желатин Norland с высокой молекулярной массой, выпускающийся фирмойNorland Products Inc, Cranbury New Jersey USA. Предпочтительно, если желатин содержится в количестве, составляющем от примерно 0,01 до примерно 5%, например, примерно 0,5 мас.% в пересчете на объем внешней водной фазы. Предпочтительно использовать поливиниловый спирт или желатин. Наиболее предпочтительным является поливиниловый спирт, в особенности ПВА 18-88. В предпочтительном варианте осуществления способ приготовления микрочастиц включает сле-5 018203 дующие стадии: растворение смеси линейного сополимера лактида с гликолидом и разветвленного сополимера лактида с гликолидом в метиленхлориде; прибавление этого раствора полимера к активному ингредиенту - памоату соединения А; приготовление водного раствора фосфатов и поливинилового спирта; смешивание раствора полимер/активный ингредиент с раствором поливиниловый спирт/фосфат; выпаривание метиленхлорида и отфильтровывание полученных микрочастиц, в котором концентрация смеси полимеров в метиленхлориде составляет от 14,2 до 17,5 мас./мас.%. Еще более предпочтительной является концентрация полимерной смеси в метиленхлориде, равная примерно 15,9 мас./мас.%. Полученные микрочастицы могут обладать диаметром, равным от нескольких долей микрометра до нескольких миллиметров; например диаметрами не более примерно 250 мкм, например от 10 до 200 мкм,предпочтительно от 10 до 130 мкм, более предпочтительно от 10 до 90 мкм, еще более предпочтительно,если диаметр составляет от 10 до 60 мкм, например, для облегчения прохождения через иглу для инъекции. Узкое распределение частиц по размерам является предпочтительным. Например, предпочтительное распределение частиц по размерам описывается параметрами 1015 мкм, 5040 мкм и 9070 мкм. Однородность содержащихся микрочастиц и разовой дозы является превосходной. Можно приготовить разовые дозы, содержание в которых меняется от примерно 75 до примерно 125%, например от примерно 85 до примерно 115%, например от примерно 90 до примерно 110% или от примерно 95 до примерно 105% от теоретической дозы. Микрочастицы в сухом состоянии можно, например, смешать, например нанести покрытие из препятствующего агломерации агента, или, например, покрыть слоем препятствующего агломерации агента,например, в предварительно заполненном шприце или флаконе. Подходящие препятствующие агломерации агенты включают, например, маннит, глюкозу, декстрозу, сахарозу, хлорид натрия и растворимые в воде полимеры, такие как поливинилпирролидон или полиэтиленгликоль, например, обладающие описанными выше характеристиками. Предпочтительно, если препятствующий агломерации агент содержится в количестве, составляющем примерно 0,1 до примерно 10%, например примерно 4 мас.% в пересчете на массу микрочастиц. Перед введением микрочастицы суспендируют в разбавителе подходящем для инъекции. В соответствии с этим настоящее изобретение также относится к фармацевтической композиции,содержащей микрочастицы, предлагаемые в настоящем изобретении, в разбавителе. Разбавитель необязательно может дополнительно содержать: а) один или большее количество смачивающих агентов; и/илиb) один или большее количество агентов, регулирующих тоничность; и/или с) один или большее количество агентов, увеличивающих вязкость. Предпочтительным является разбавитель на водной основе, например, он может содержать воду,например деионизированную, и необязательно буфер для установления рН, равного 7-7,5, например фосфатный буфер, такой как смесь Na2HPO4 и KH2PO4, и один или большее количество агентов а), b) и/или с), указанных выше. Однако при использовании воды в качестве разбавителя микрочастицы, предлагаемые в настоящем изобретении, могут не суспендироваться и могут всплывать на поверхность водной фазы. Для улучшения способности микрочастиц, предлагаемых в настоящем изобретении, к суспендированию в водной среде разбавитель предпочтительно включает смачивающий агент а). Смачивающий агент выбирают так, чтобы он обеспечивал быстрое и надлежащее суспендирование микрочастиц в разбавителе. Предпочтительно, если микрочастицы быстро смачиваются разбавителем и быстро образуют в нем суспензию. Смачивающие агенты, подходящие для суспендирования микрочастиц, предлагаемых в настоящем изобретении, в разбавителе на водной основе, включают неионогенные поверхностно-активные вещества, такие как полоксамеры, или полиоксиэтилен-сорбитановые эфиры жирной кислоты, характеристики которых описаны выше. Можно использовать смесь смачивающих агентов. Предпочтительным смачивающим агентом является Pluronic F68, Tween 20 и/или Tween 80. Смачивающий агент или агенты могут содержаться в количестве, составляющем от примерно 0,01 до примерно 1 мас.% в пересчете на вводимую композицию, предпочтительно от 0,01 до 0,5% и могут содержаться в разбавителе в концентрации, равной примерно от 0,01 до 5 мг/мл, например примерно 2 мг/мл. Предпочтительно, если разбавитель дополнительно включает агент, регулирующий тоничность, b),такой как маннит, хлорид натрия, глюкоза, декстроза, сахароза или глицерин. Предпочтительным агентом, регулирующим тоничность, является маннит. Количество агента, регулирующего тоничность, выбирают так, чтобы обеспечить изотоничность вводимой композиции. В случае, если агент, регулирующий тоничность, содержится в микрочастицах,например, для уменьшения агломерации, как это указано выше, количество агента, регулирующего тоничность, следует понимать, как равное сумме обоих агентов. Например, маннит предпочтительно может содержаться в количестве, составляющем от примерно 1 до примерно 5 мас.% в пересчете на вводимую композицию, предпочтительно примерно 4,5%. Предпочтительно, если разбавитель дополнительно включает агент, увеличивающий вязкость, с). Подходящие агенты, увеличивающие вязкость, включают натриевую соль карбоксиметилцеллюлозы(КМЦ-Na), сорбит, поливинилпирролидон и моностеарат алюминия. С успехом можно использовать КМЦ-Na, обладающую низкой вязкостью. Варианты могут быть такими, как описанные выше. Обычно используют КМЦ-Na, обладающий низкой молекулярной массой. Вязкость может составлять от примерно 1 до примерно 30 мПас, например, от примерно 10 до примерно 15 мПас при измерении для 1% (мас./об.) водного раствора при 25 С в вискозиметре Brookfield LVT со шпинделем 1 при 60 об./мин, или вязкость может составлять от 1 до 15 мПас для раствора NaCMC 7LF (с низкой молекулярной массой) в виде от 0,1 до 1% водного раствора. Можно использовать поливинилпирролидон, обладающий описанными выше характеристиками. Агент, увеличивающий вязкость, например, КМЦ-Na, может содержаться в количестве, составляющем от примерно 0,1 до примерно 2%, например примерно 0,7% или примерно 1,75% в пересчете на количество разбавителя (по объему), например, при концентрации, равной от примерно 1 до примерно 30 мг/мл в разбавителе, например примерно 7 или примерно 17,5 мг/мл. В другом варианте осуществления настоящее изобретение относится к набору, содержащему микрочастицы, предлагаемые в настоящем изобретении, и разбавитель, предлагаемый в настоящем изобретении. Например, набор может содержать микрочастицы, содержащие точное количество вводимого соединения, предлагаемого в настоящем изобретении, например, описанного выше, и примерно 1 до примерно 5 мл, например, примерно 2 мл разбавителя, предлагаемого в настоящем изобретении. В одном варианте осуществления сухие микрочастицы, необязательно в смеси с препятствующим агломерации агентом, можно поместить в контейнер, например флакон или шприц, и стерилизовать, например, с помощью -излучения. Перед введением микрочастицы можно суспендировать в контейнере путем прибавления подходящего разбавителя, например разбавителя, описанного выше. Например, микрочастицы, необязательно в смеси с препятствующим агломерации агентом, агентом, увеличивающим вязкость, и/или агентом, регулирующим тоничность, и разбавителем для суспендирования можно держать отдельно в двухкамерном шприце. Смесь микрочастиц в смеси с препятствующим агломерации агентом и/или агентом, увеличивающим вязкость, и/или агентом, регулирующим тоничность, также входит в объем настоящего изобретения. В другом варианте осуществления при стерильных условиях сухие стерилизованные микрочастицы,необязательно в смеси с препятствующим агломерации агентом, можно суспендировать в подходящем разбавителе, например разбавителе, описанном выше, и поместить в контейнер, например флакон или шприц. Растворитель разбавителя, например воду, после этого можно удалить, например, с помощью сушки вымораживанием или выпаривания в вакууме и получить смесь микрочастиц и твердых компонентов разбавителя в контейнере. Перед введением микрочастицы и твердые компоненты разбавителя можно суспендировать в контейнере путем прибавления подходящего разбавителя, например воды, например воды для вливания, или предпочтительно обладающего низкой молярной концентрацией фосфатного буферного раствора. Например, смесь микрочастиц, необязательно препятствующего агломерации агента и твердых компонентов разбавителя и разбавителя для суспендирования, например воды,можно держать отдельно в двухкамерном шприце. Микрочастицы и композиции, предлагаемые в настоящем изобретении, применимы: а) для предупреждения или лечения нарушений, этиология которых включает избыточную секрецию GH- и/или IGF-1 или связана с ней, например, для лечения акромегалии, а также для лечения сахарного диабета типа I или типа II, в особенности его осложнений, например ангиопатии, диабетической пролиферативной ретинопатии, диабетического макулярного отека, нефропатии, невропатии и синдрома Дауна, и других метаболических нарушений, связанных с выработкой инсулина или глюкагона, например ожирения, например патологического ожирения или гипоталамического или гиперинсулинемического ожирения;b) для лечения наружных кишечных свищей и наружных свищей поджелудочной железы, синдрома раздраженной толстой кишки, воспалительных заболеваний, например болезни Грейвса, воспалительной болезни кишечника, псориаза или ревматоидного артрита, поликистозного заболевания почек, синдрома сбрасывания, синдрома водянистого стула, связанной по СПИД (синдром приобретенного иммунодефицита) диареи, вызванной химиотерапией диареи, острого или хронического панкреатита и желудочнокишечных вырабатывающих гормоны опухолей (например, опухолей ГЭП, например випом, глюкагоном, инсулином, карциноидных опухолей и т.п.), лимфоцитарных злокачественных новообразований,например лимфом или лейкозов, гепатоцеллюлярной карциномы, а также желудочно-кишечного кровотечения, например варикозного глоточного кровотечения;c) для предупреждения или лечения ангиогенеза, воспалительных нарушений, указанных выше,включая воспалительные заболевания глаз, макулярный отек, например кистоидный макулярный отек,идиопатический кистоидный макулярный отек, экссудативную возрастную дегенерацию желтого пятна,нарушений, связанных с хориоидальной неоваскуляризацией, и пролиферативной ретинопатии;d) для предупреждения или лечения заболеваний имплантированных сосудов, например васкулопа-7 018203 тий алло- или ксенотрансплантатов, например атеросклероза имплантированных сосудов, например при трансплантации органа, например сердца, комбинации сердца-легких, печени, почек или поджелудочной железы, или для предупреждения или лечения стеноза, рестеноза трансплантата вены и/или окклюзии сосудов после травмы сосудов, например, вызванной процедурами катетеризации или процедурами очистки сосудов, такими как чрескожная транслюминальная ангиопластика, лечение лазером или другими инвазивными процедурами, которые нарушают целостность интимы или эндотелия сосудов; е) для борьбы с опухолями, экспрессирующими или накапливающими соматостатиновый рецептор,такими как опухоли гипофиза, например болезнь или синдром Кушинга, гастроэнтеропанкреатическими,карциноидными опухолями, опухолями центральной нервной системы, молочной железы, предстательной железы (включая запушенный стойкий к гормонам рак предстательной железы), опухолями яичников или ободочной кишки, мелкоклеточным раком легких, злокачественной кишечной непроходимостью, параганглиомами, раком почки, раком кожи, нейробластомами, феохромоцитомами, медуллярными карциномами щитовидной железы, миеломами, лимфомами, ходжкинскими и неходжкинскими лимфомами, опухолями костей и их метастазами, а также аутоиммунными или воспалительными нарушениями, например ревматоидным артритом, болезнью Грейвса или другими воспалительными заболеваниями глаз. Микрочастицы и композиции, предлагаемые в настоящем изобретении, предпочтительно применимы для лечения акромегалии и рака, например болезни или синдрома Кушинга, карциноидных опухолей. Характеристики микрочастиц и композиций, предлагаемых в настоящем изобретении, можно изучить с помощью стандартных исследований на животных или клинических исследований. Микрочастицы и композиции, предлагаемые в настоящем изобретении, хорошо переносятся. Соединения, предлагаемые в настоящем изобретении, высвобождаются из микрочастиц, предлагаемых в настоящем изобретении, и из композиций, предлагаемых в настоящем изобретении, в течение нескольких недель, например от примерно 4 до примерно 8 недель, предпочтительно от примерно 4 до примерно 6 недель. Разумеется, подходящая дозировка композиции, предлагаемой в настоящем изобретении, будет меняться, например, в зависимости от подвергающегося лечению патологического состояния (например,типа заболевания или характера резистентности), использующегося лекарственного средства, необходимого эффекта и режима введения. Обычно удовлетворительные результаты получают при введении, например парентеральном введении, в дозах порядка от примерно 0,2 до примерно 100 мг, например от 0,2 до примерно 35 мг, предпочтительно от примерно 3 до примерно 100 мг соединения А на одну инъекцию в месяц или примерно 0,03 до примерно 1,2 мг, например от 0,03 до 0,3 мг на 1 кг массы тела в месяц. Таким образом, подходящие месячные дозы для пациентов составляют порядка от примерно 0,3 до примерно 100 мг соединения А. Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения без наложения каких-либо ограничений. Пример 1. Микрочастицы. Полимеры растворяют в количестве метиленхлорида, указанном в табл. 1. Затем раствор полимера прибавляют к памоату соединения А. Полученную суспензию обрабатывают с помощью Ultra-Turrax в течение 1 мин. 2 л воды нагревают до 90 С. Во время нагревания один за другим прибавляют фосфаты в количестве, указанном в табл. 1. При 90 С прибавляют ПВА 18-88 в количестве, указанном в табл. 1. Затем полученный раствор охлаждают до 20 С и объем доводят до необходимого значения путем прибавления воды. Суспензию полимер/лекарственное средство и раствор ПВА/фосфат смешивают при постоянных скоростях подачи насосом, равных 90 мл/мин и 1800 мл/мин, при скорости перемешивания, равной 3300 об/мин, метиленхлорид выпаривают в вакууме с использованием программы регулирования температуры, которая обеспечивает нагревание со скоростью 2 С за 20 мин в течение 300 мин. Затем микрочастицы отфильтровывают, промывают водой (WBU) и сушат при пониженном давлении (0,1 мбар) при комнатной температуре. Высушенные микрочастицы помещают во флаконы, откачивают и подвергают термической стерилизации. Термическую стерилизацию проводят с помощью гамма-излучения при дозе, равной от 27,7 до 34,1 кГр. Количества приведены в граммах. Пример 2. Составы разбавителей А-G. КМЦ-Na, маннит и Pluronic F68 в количествах, указанных в табл. 2, при энергичном перемешивании магнитной мешалкой растворяют примерно в 15 мл горячей деионизированной воды при температуре примерно 90 С. Полученный прозрачный раствор охлаждают до 20 С и доводят до 20,0 мл путем прибавления деионизированной воды. Таблица 2 Количества приведены в граммах. Разбавитель D является предпочтительным для использования с микрочастицами во флаконах. Разбавитель Е является предпочтительным для использования в двухкамерном шприце. Пример 3. Высвобождение соединения А из микрочастиц. Микрочастицы примера 1 и сравнительного примера в количестве, соответствующем 4 мг соединения А на 1 кг массы тела кролика, суспендируют 1 мл разбавителя состава D. Суспензию гомогенизируют путем встряхивания в течение примерно 30 с и с помощью иглы 19G путем инъекции вводят в левую икроножную мышцу кроликов (самки кроликов Chinchilla bastard в возрасте примерно 7 месяцев), массой примерно 3 кг до начала исследования. Пробы крови (примерно 1 мл) берут в течение 55 дней. Содержание соединения А в плазме определяют с помощью иммуноферментного анализа (ELISA). Средние концентрации соединения А после введения приведены в табл. 3. Средние ППК (площадь под кривой) (дни 0-55) найдены равными 287 нг/мл/сутки для примера 1 и 227 нг/мл/сутки для сравнительного примера. Таблица 3 Средние концентрации в нг/мл. Пример 4. Скачок высвобождения соединения А из микрочастиц. Исследования растворения проводили в ванне встряхивающего устройства при 37 С, 80 мин-1 (n=3) в течение 24 ч. Образцы отвешивали в пакеты из сложного полиэфира 44 см и герметизировали. Пакеты с образцами помещали во флаконы Schott объемом 50 мл и прибавляли 50 мл предварительно нагретой(37 С) среды. Среду готовили путем растворения, например, 2,98 г дигидрата дигидрофосфата натрия, 8,0 г хло-9 018203 рида натрия, 0,19 г дигидрофосфата калия, 0,01 г бензалконийхлорида и 0,2 г Tween 80 в 1000 мл воды и доведения значения рН до 7,4 с помощью фосфорной кислоты. Через 24 ч среду отсасывали. Данные нормировали на массу образца в каждом пакете. Скачок можно было определить, как выраженное в % содержание лекарственного средства, которое представляет собой выраженное в % отношение количества высвободившегося лекарственного средства к количеству,определенному ранее путем анализа, т.е. если 100 мг МР содержит 25 мг соединения А и 0,25 мг соединения А высвобождается через 24 ч, это означает, что скачок равен 1%. Таблица 4 Скачок в % содержания лекарственного средства. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция пролонгированного высвобождения, включающая микрочастицы с полимерной матрицей, содержащей линейный и разветвленный сополимеры лактида с гликолидом и памоат пасиреотида в качестве активного ингредиента, полученной в процессе суспендирования памоата пасиреотида в растворе полимера, при котором указанный раствор полимера содержит метиленхлорид и полимерную смесь указанных линейного и разветвленного сополимеров лактида с гликолидом, причем концентрация полимерной смеси в метиленхлориде находится между 14,24 и 17,45% массы полимеров на массу раствора полимеров. 2. Фармацевтическая композиция по п.1, в которой активный ингредиент высвобождается в течение периода времени, равного не менее 4 неделям. 3. Фармацевтическая композиция по п.1, в которой полимерная матрица содержит линейный и разветвленный сополимеры лактида с гликолидом, где указанный разветвленный сополимер обладает среднемассовой молекулярной массой, равной от примерно 47000 до примерно 63000 Да. 4. Фармацевтическая композиция по п.1, в которой отношение количества линейного сополимера лактида с гликолидом к количеству разветвленного составляет примерно от 60:40 до 40:60. 5. Фармацевтическая композиция по п.1, в которой концентрация полимерной смеси в метиленхлориде составляет 15,9 мас.% полимеров на массу раствора полимеров. 6. Фармацевтическая композиция по п.1, которая дополнительно включает поверхностно-активное вещество, агент, влияющий на пористость, и/или основную соль. 7. Набор, включающий микрочастицы по любому из пп.1-6 и разбавитель на водной основе. 8. Набор по п.7, в котором разбавитель на водной основе включает смачивающий агент, агент, регулирующий тоничность, и агент, увеличивающий вязкость. 9. Набор по п.8, в котором смачивающий агент выбран из группы, включающей полоксамер и/или полиоксиэтилен-сорбитановый эфир жирной кислоты. 10. Набор по п.8, в котором агент, регулирующий тоничность, выбран из группы, включающей маннит, хлорид натрия, глюкозу, декстрозу, сахарозу и глицерин. 11. Набор по п.8, в котором агент, увеличивающий вязкость, выбран из группы, включающей натриевую соль карбоксиметилцеллюлозы (КМЦ-Na), сорбит, поливинилпирролидон и моностеарат алюминия. 12. Набор по п.7, предназначенный для применения во флаконах, в котором разбавитель на водной основе включает натриевую соль карбоксиметилцеллюлозы, маннит и 2-метилоксиран (Pluronic F68). 13. Способ приготовления микрочастиц, включающий растворение смеси линейного сополимера лактида с гликолидом и разветвленного сополимера лактида с гликолидом в метиленхлориде, с получением раствора полимера; прибавление этого раствора полимера к активному ингредиенту - памоату пасиреотида; приготовление водной дисперсии фосфатов и поливинилового спирта; смешивание раствора полимер/активный ингредиент с раствором поливиниловый спирт/фосфат; выпаривание метиленхлорида и отфильтровывание полученных микрочастиц,причем концентрация смеси полимеров в метиленхлориде составляет от 14,2 до 17,5 мас.% полимеров на массу раствора полимеров. 14. Способ по п.13, в котором концентрация смеси полимеров в метиленхлориде составляет примерно 15,9 мас.% полимеров на массу раствора полимеров. 15. Способ лечения заболевания или нарушения, этиология которого включает избыточную секрецию GH- и/или IGF-1 или связана с ней, у нуждающегося в этом субъекта, включающий введение субъекту фармацевтической композиции по п.1.
МПК / Метки
МПК: A61K 38/00, A61P 35/00, A61K 9/50
Метки: получения, микрочастицах, пасиреотида, полимерной, содержащая, композиция, микрочастиц, способ, пролонгированного, матрицей, памоат, лечения, высвобождения
Код ссылки
<a href="https://eas.patents.su/12-18203-kompoziciya-prolongirovannogo-vysvobozhdeniya-soderzhashhaya-pamoat-pasireotida-v-mikrochasticah-s-polimernojj-matricejj-sposob-polucheniya-mikrochastic-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция пролонгированного высвобождения, содержащая памоат пасиреотида в микрочастицах с полимерной матрицей, способ получения микрочастиц и способ лечения</a>
Предыдущий патент: Офтальмологический гель и способ его приготовления
Следующий патент: Антитела против склеростина
Случайный патент: Способ приготовления готового к употреблению продукта из ячменя или перловой крупы