Слитый белок эритропоэтина
Формула / Реферат
1. Рекомбинантный слитый белок ЕРО, имеющий увеличенный физиологический период полувыведения и пониженную гематопоэтическую активность по сравнению с ЕРО in vivo и дополнительно имеющий нейрорегенеративную активность in vivo, отличающийся тем, что он содержит Fc-фрагмент молекулы человеческого IgG и фрагмент эритропоэтина (ЕРО), предпочтительно фрагмент человеческого эритропоэтина, в котором Fc-фрагмент непосредственно соединен через его N-конец с С-концом фрагмента ЕРО, и где слитый белок модифицирован посредством карбамоилирования.
2. Слитый белок по п.1, в котором по крайней мере один, предпочтительно два или более остатков лизина и/или N-концевая аминокислота указанного слитого белка являются карбамоилированными.
3. Слитый белок по п.1 или 2, в котором Fc-фрагмент содержит шарнирную область, домен СН2 и домен CH3, полученные из человеческого IgG.
4. Слитый белок по любому из пп.1-3, в котором слияние осуществляется в шарнирной области.
5. Слитый белок по любому из пп.1-4, в котором два мономера слитого белка EPO-Fc соединены друг с другом и образуют гомодимер.
6. Способ получения карбамоилированного рекомбинантного слитого белка EPO-Fc, содержащего Fc-фрагмент молекулы человеческого IgG и ЕРО-фрагмент, предпочтительно фрагмент человеческого эритропоэтина, в котором Fc-фрагмент непосредственно соединен через его N-конец с С-концом фрагмента ЕРО, где способ включает:
получение молекулы ДНК, кодирующей слитый белок EPO-Fc;
трансформирование клетки-хозяина указанной молекулой ДНК;
экспрессию указанного слитого белка EPO-Fc, кодируемого упомянутой молекулой ДНК;
получение из культуры указанного слитого белка EPO-Fc;
очистку указанного слитого белка EPO-Fc и
карбамоилирование указанного слитого белка EPO-Fc посредством взаимодействия цианата с указанным слитым белком EPO-Fc,
где по крайней мере один, предпочтительно два или более остатков лизина и/или N-концевая аминокислота слитого белка являются карбамоилированными.
7. Слитый белок по любому из пп.1-5 для применения в качестве лекарственного средства.
8. Применение слитого белка по любому из пп.1-5 для получения фармацевтической композиции для лечения заболевания центральной нервной системы (ЦНС) и/или периферической нервной системы.
9. Применение по п.8, в котором заболевание выбирают из группы, состоящей из инсульта, ишемического явления в ЦНС, отличного от инсульта, закрытой травмы, травмы спинного мозга, травматического повреждения мозга и нейродегенеративного заболевания.
10. Фармацевтическая композиция, содержащая слитый белок по любому из пп.1-5, вместе с фармацевтически приемлемым носителем, предпочтительно для парентерального введения.
11. Фармацевтическая композиция по п.10, применяемая в виде раствора для инъекций.
Текст
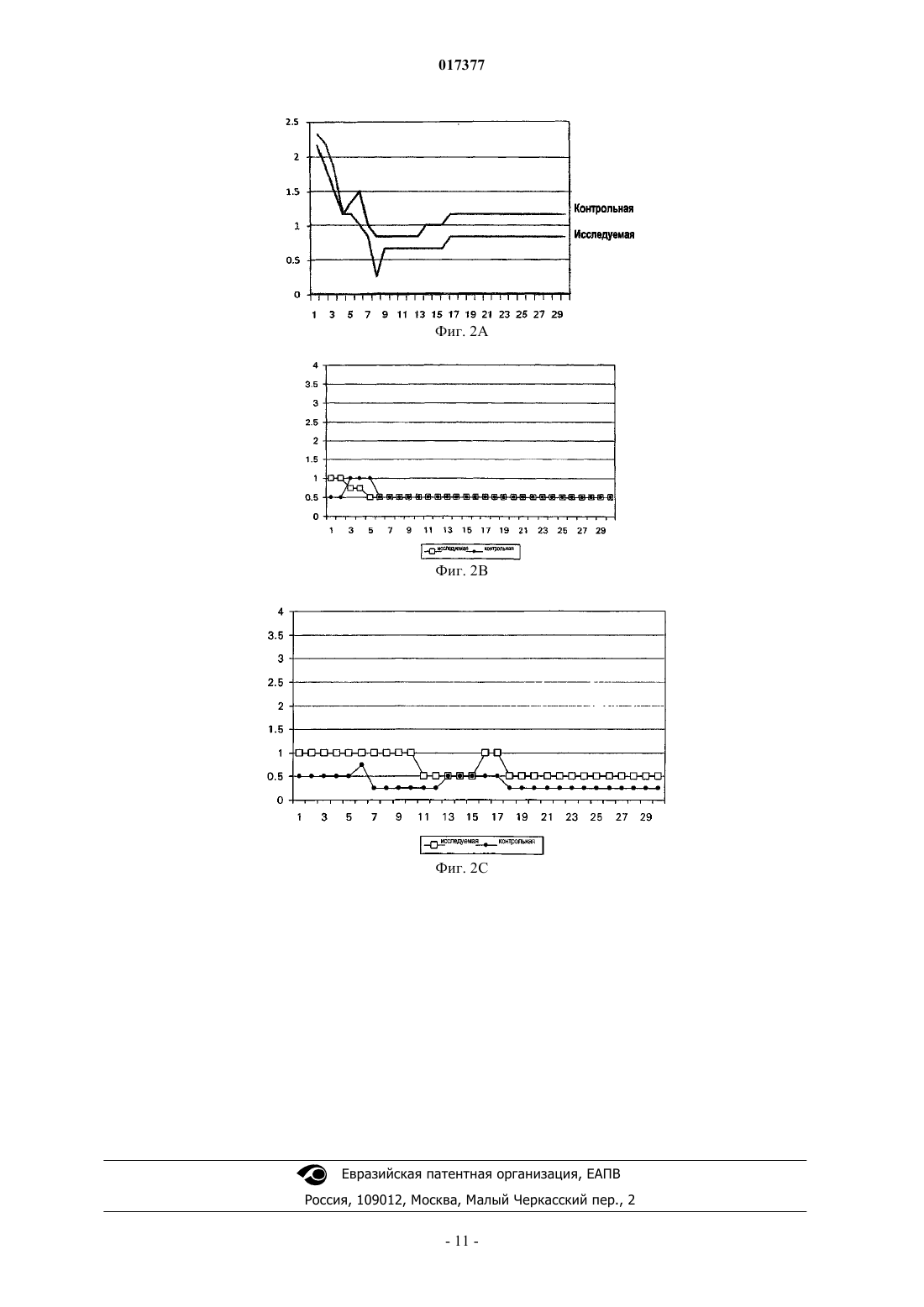
(ЕРО) соединен через его С-конец с Fc-фрагментом, и при этом указанные рекомбинантные слитые белки, дополнительно, являются карбамоилированными по первичным аминам слитого белка. В частности, данное изобретение относится к карбамоилированным слитым белкам EPOFc, в которых по крайней мере один, предпочтительно два или более аминных остатков лизина и/или N-концевой аминокислоты указанного слитого белка являются карбамоилированными. Карбамоилированные слитые белки EPO-Fc настоящего изобретения, имеющие пониженную гематопоэтическую активность, тогда как восстанавливающая активность в ткани, т.е. восстанавливающая активность по отношению к нервным клеткам, остается неизменной или даже увеличивается по сравнению с немодифицированными слитыми белками EPO-Fc. Кроме того, данное изобретение относится к способу получения подобных слитых белков и к фармацевтическим композициям, содержащим их, а также к применению таких слитых белков и фармацевтических композиций для лекарственной терапии.(71)(73) Заявитель и патентовладелец: ПОЛИМУН САЙНТИФИК ИММУНБИОЛОГИШЕ ФОРШУНГ ГМБХ (AT) 017377 Область техники Настоящее изобретение относится к рекомбинантным слитым белкам, в которых эритропоэтин(ЭПО) присоединен к белку-носителю, в частности к антителу или фрагменту антитела, такому как Fcфрагмент, где указанные рекомбинантные слитые белки карбамоилированы. Кроме того, данное изобретение также относится к способу получения подобных слитых белков и к фармацевтическим композициям, содержащим их, а также к применению подобных слитых белков и фармацевтических композиций для лекарственной терапии. Уровень техники Эритропоэтин (ЕРО) - хорошо известный гликопротеин, первоначально идентифицированный по его гормональным эффектам на костный мозг и вовлеченный в рост и развитие зрелых эритроцитов. Помимо этой гематопоэтической активности, недавно было обнаружено, что ЕРО также функционирует как сильнодействующая, локально образующаяся молекула, подавляющая метаболический стресс во многих тканях. Защитные функции ЕРО в ткани опосредованы его взаимодействием с эритропоэтиновым рецептором. В мозгу, например, ЕРО и его рецептор образуются локально, модулируются метаболическими стрессорами и обеспечивают нейропротективные и противовоспалительные функции (Doggrell, S.A.(2004) Expert Opin Investig Drugs; 13 (11): 1517-9). В спинном мозгу ЕРО обеспечивает благоприятные эффекты, в том числе ингибирование апоптоза и некроза нейронов, олигодендроцитов и эндотелиальных клеток, наименьшее образование каверн, уменьшение перекисного окисления липидов, мобилизация эндотелиальных клеток-предшественников, стимулирование ангиогенеза и восстановление сосудистой ауторегуляции (Gorio, A. et al. (2002), Proc. Natl. Acad. Sci. USA; 99(14): 9450-5; Leist M. (2004), Science; 305(5681): 239-42). Было показано, что ЭПО передает сигнал по пути модуляции элементов ядерного фактора (NF)-kappaB, а также посредством янус-киназа 2/переносчиков сигнала и системы активаторов транскрипции-5 (Gorio A. (2005), Neurosurgery; 56(4):821-7; Grasso G. (2005), Neurosurgery; 56 (4):821-7). При химической модификации, т.е. карбамоилировании, по крайней мере одной первичной аминогруппы лизинов и/или N-концевой аминокислоты ЕРО, гематопоэтическая активность данного цитокина значительно снижается, в то время как его защитная активность в ткани, т.е. его восстанавливающая активность по отношению к нервным клеткам, остается, по существу, неизменной или даже увеличивается по сравнению с некарбамоилированным ЕРО.WO 2006/014466 и WO 2006/002646 раскрывают способ получения и применение карбамоилированного ЕРО при различных медицинских показаниях. Так как ЕРО имеет относительно короткий период полувыведения из сыворотки крови и поскольку из уровня техники хорошо известно, что слияние константной области иммуноглобулина с неиммуноглобулиновым белком может заметно продлить период полувыведения из сыворотки крови указанного неиммуноглобулинового белка, были сделаны некоторые попытки связать иммуноглобулиновый фрагмент с ЕРО. Например, WO 99/02709 раскрывает способ получения и применение слитых белков, содержащих ЕРО и Fc-фрагмент иммуноглобулина, при этом слитые белки EPO-Fc имеют увеличенный период полувыведения in vivo относительно природного ЕРО. Из WO 2005/063808 известно, что дополнительного улучшения фармакокинетики, т.е. увеличенных периодов полувыведения из сыворотки крови и повышенной in vivo активности слитых белков EPO-Fc можно добиться посредством мутаций, делеций или вставок специфических аминокислот. Соответственно существует необходимость в упрощенной и более дешевой ЕРО терапии, т.е. требующей менее частое введение ЕРО, для лечения заболеваний, при которых желательна неизменная или даже повышенная восстанавливающая активность в ткани, т.е. восстанавливающая активность ЕРО по отношению к нервным клеткам, в то время как гематопоэтическая активность ЕРО менее желательна или даже не желательна и поэтому ее следует уменьшить. Подобные заболевания включают, но не ограничиваются, дисфункции или нарушения любой из двух или обеих центральной (ЦНС) и периферической(ПНС) нервных систем, и, в частности, включают заболевания, которые связаны или вызываются нервными повреждениями, такими как физические нервные поражения в результате, например, механического воздействия. Сущность изобретения Таким образом, цель настоящего изобретения заключается в том, чтобы улучшить известные слитые белки EPO-Fc, которые имеют увеличенный период полувыведения из сыворотки крови по сравнению с неслитыми белками ЕРО, посредством химической модификации, т.е. карбамоилирования, с получением модифицированных слитых белков EPO-Fc, которые имеют, кроме увеличенного периода полувыведения из сыворотки крови, пониженную гематопоэтическую активность, но, несмотря на это, неизменную или увеличенную восстанавливающую активность по сравнению с немодифицированными слитыми белками EPO-Fc. Модифицированные слитые белки EPO-Fc в соответствии с настоящим изобретением являются пригодными для лечения заболеваний или дисфункций любой из двух или обеих центральной (ЦНС) и периферической (ПНС) нервных систем, в том числе заболеваний, которые вызываются или связаны с физическим повреждением нервов, вызванным, например, механическим воздействием, теплом или излучением. Одним из предпочтительных свойств модифицированных слитых белков EPO-Fc по настоя-1 017377 щему изобретению является то, что их можно вводить в более высоких терапевтических дозах по сравнению с традиционными ЕРО или EPO-Fc для той же цели, и, по существу, без увеличения неблагоприятных побочных эффектов на гематопоэтическую систему, т.е. картину крови. Соответственно цель настоящего изобретения заключается в том, чтобы обеспечить модифицированный рекомбинантный слитый белок ЕРО, в котором ЕРО присоединен к белку-носителю, в частности к иммуноглобулину или иммуноглобулиновому фрагменту, такому как Fc-фрагмент, конкретнее к Fcфрагменту молекулы IgG, и при этом указанный рекомбинантный слитый белок дополнительно модифицирован посредством карбамоилирования. Еще одна цель данного изобретения заключается в том, чтобы обеспечить способ получения подобного карбамоилированного рекомбинантного слитого белка EPO-Fc. Еще одна цель данного изобретения заключается в том, чтобы обеспечить фармацевтические композиции, содержащие подобный карбамоилированный рекомбинантный слитый белок EPO-Fc. В еще одном аспекте данное изобретение относится к применению подобного карбамоилированного рекомбинантного слитого белка EPO-Fc для лекарственной терапии. В еще одном аспекте данное изобретение относится к применению фармацевтических композиций,содержащих подобный карбамоилированный рекомбинантный слитый белок EPO-Fc для лекарственной терапии. Принцип данного изобретения дополнительно описывается в независимых пунктах формулы изобретения, тогда как содержание зависимых пунктов формулы изобретения представляет собой различные варианты осуществления данного изобретения. Краткое описание фигур Фиг. 1 показывает результаты исследования восстановления опорно-двигательного аппарата (ОДА) у крыс после закрытой травмы, при последовательном введении карбамоилированного слитого белкаEPO-Fc в соответствии с настоящим изобретением. Ось ординат = шкала Beattie-Bresnahan-Basso (BBB); ось абсцисс = избранные моменты времени до и после закрытой травмы; praeOP = до закрытой травмы; группа 1 = животные, получавшие белок rhEPO(контроль); группа 2 = ничего не получавшие животные (плацебо группа); группа 3 = животные, получавшие некарбамоилированный слитый белок EPO-Fc (сравнительная группа); группа 4 = животные, получавшие карбамоилированный слитый белок EPO-Fc (экспериментальная группа); группа 5 = животные, получавшие метилпреднизолон (сравнительная группа). Фиг. 2 показывает результаты оценки эффекта карбамоилированного слитого белка EPO-Fc на мышиную модель экспериментального аутоиммунного энцефаломиелита (ЭАЭ) на различных стадиях развития ЭАЭ посредством определения показателя ЭАЭ. Ось ординат = шкала показателя экспериментального аутоиммунного энцефаломиелита (ЭАЭ); ось абсцисс = дни после начала введения; фиг. 2 А = ранняя обработка: животные, получавшие либо карбамоилированный слитый белок EPOFc (исследуемая группа 1), либо ФБР (контрольная группа 2), введение начинали на 18 день после индукции ЭАЭ; фиг. 2 В = промежуточная обработка: животные, получавшие либо карбамоилированный слитый белок EPO-Fc (исследуемая группа 3), либо ФБР (контрольная группа 4), введение начинали на 28 день после индукции ЭАЭ; фиг. 2 С = поздняя обработка: животные, получавшие либо карбамоилированный слитый белокEPO-Fc (исследуемая группа 5), либо ФБР (контрольная группа 6), введение начинали на 52 день после индукции ЭАЭ. Систематизация подробной информации о группах мышей находится в табл. 2. Фиг. 2 А-2 С показывают средний показатель ЭАЭ животных из каждой группы. Подробное описание изобретения В своем первом варианте осуществления настоящее изобретение обеспечивает химически модифицированные, т.е. карбамоилированные, рекомбинантные слитые белки EPO-Fc, имеющие существенно увеличенный период полувыведения из сыворотки крови по сравнению с неслитыми белками ЕРО и одновременно имеющие пониженную гематопоэтическую активность по отношению к немодифицированным слитым белкам EPO-Fc плюс восстанавливающую активность по отношению к нервным клеткам,которая неизменна или даже больше, чем соответствующая активность немодифицированных белков ЕРО или слитых белков EPO-Fc. Понятие "слитый белок EPO-Fc", используемое в контексте данного документа, относится к белку,содержащему фрагмент ЕРО и Fc-фрагмент. Понятие "фрагмент ЕРО", используемое в контексте данного документа, охватывает человеческий полноразмерный эритропоэтин дикого типа или природный эритропоэтин человека или из других источников, а также эритропоэтиноподобные молекулы, в том числе биологически активные фрагменты эритропоэтина, аналоги, модификации, мутанты и производные эритропоэтина. Понятие "Fc-фрагмент", используемое в контексте данного документа, охватывает домены,происходящие из константной области иммуноглобулина, предпочтительно из человеческого иммуноглобулина, в том числе фрагмент, аналог, модификация, мутант или производное константной области.-2 017377 Соответствующие иммуноглобулины включают IgG, т.е. подклассы IgG1, IgG2, IgG3 и IgG4 и другие классы. Понятие "биологическая активность" эритропоэтина, на которое ссылаются в контексте данного документа, следует понимать как способность ЕРО или ЕРО-подобных молекул взаимодействовать с эритропоэтиновым рецептором. Биологически активная ЕРО-подобная молекула обычно имеет значительную схожесть или идентичность аминокислотной последовательности (например, лежащую в диапазоне по крайней мере от 55% до около 65, 75, 80% и даже вплоть до около 90-95% идентичности) с соответствующей последовательностью ЕРО дикого типа или природного ЕРО и обладает одной или более функциями ЕРО дикого типа. Используемое в контексте данного документа понятие "биологически активный фрагмент" означает фрагмент, который может оказывать биологический эффект, схожий с полноразмерным белком. Подобные фрагменты могут образовываться в результате амино- и карбоксиконцевых делеций, а также в результате внутренних делеций. Они также включают усеченные и гибридные формы эритропоэтина."Усеченные" формы представляют собой более короткие модификации эритропоэтина, в которых отсутствует один или более N-концевых и/или С-концевых остатков. Слитый белок EPO-Fc по настоящему изобретению может быть соединен различными способами. Либо Fc-фрагмент присоединен через его С-конец к N-концу фрагмента ЕРО, т.е. слитый белок EPO-Fc сFc-фрагментом к N-концу слитого белка EPO-Fc, либо, что является предпочтительным в настоящем изобретении, Fc-фрагмент присоединен через его N-конец к С-концу фрагмента ЕРО. Кроме того, ЕРО-фрагмент и Fc-фрагмент могут быть соединены либо непосредственно конец к концу, либо опосредованно через линкер, например пептидный линкер, вставленный между ЕРОфрагментом и Fc-фрагментом. Соответственно настоящее изобретение в первом аспекте относится к рекомбинантному слитому белку ЕРО, имеющему увеличенный физиологический период полувыведения и пониженную гематопоэтическую активность по сравнению с ЕРО in vivo и, кроме того, имеющему нейрорегенеративную активность in vivo, отличающемуся тем, что он содержит Fc-фрагмент молекулы человеческого IgG и фрагмент эритропоэтина (ЕРО), предпочтительно фрагмент человеческого эритропоэтина, в котором Fcфрагмент непосредственно соединен через его N-конец с С-концом фрагмента ЕРО, где слитый белок модифицирован посредством карбамоилирования. Обычно карбамоилирование белков часто встречается в виде побочного эффекта применения мочевины при очистке белков и в результате высоких уровней мочевины в сыворотке крови вследствие спонтанного разложения мочевины до цианата. Цианат является инициатором карбамоилирования первичных аминов, в том числе первичных аминов в белках, и легко реагирует со свободным аминоостатком лизина и N-концевой аминокислотой белка, например гликопротеина ЕРО. Процесс карбамоилирования посредством цианата является рН-зависимым и может также протекать, хотя и в меньшей степени, с другими аминокислотами белка, в том числе аргинином, цистеином, тирозином, аспарагиновой кислотой, глутаминовой кислотой и гистидином. Препаративное карбамоилирование проводят посредством реакции предварительно определенного количества цианата с предварительно определенным количеством белка. Степень карбамоилирования зависит от времени реакции между цианатом и белком и от концентрации цианата и/или целевого белка. В дополнительном аспекте данное изобретение относится к такому слитому белку EPO-Fc, в котором по крайней мере один, предпочтительно два или более остатка лизина и/или N-концевой аминокислоты указанного слитого белка карбамоилированы. Карбамоилированный слитый белок EPO-Fc по настоящему изобретению может содержать дополнительные модификации в Fc-фрагменте, такие как аминокислотные мутации, как, например, аминокислотные вставки, аминокислотные делеции или консервативные или неконсервативные аминокислотные замещения. В частности, в уровне техники широко описаны аминокислотные замещения в Fc-фрагменте с целью дополнительного увеличения периода полувыведения из сыворотки крови слитых белков, например слитых белков EPO-Fc, посредством уменьшения или исключения Fc рецепторного связывания или комплементсвязывающей активности. Слитый белок EPO-Fc может также иметь дополнительные модификации в эритропоэтиновом фрагменте, такие как аминокислотные мутации, как, например, аминокислотные вставки, аминокислотные делеции, консервативные или неконсервативные аминокислотные замещения или аминокислотные дегликозилирования, которые понижают способность связывания с ЕРО рецептором и/или повышают биологическую активность эритропоэтина. Обычно константной областью иммуноглобулина является природный или полученный синтетически полипептид, гомологичный С-концевому домену иммуноглобулина, который получается при расщеплении папаином. Константная область тяжелой цепи иммуноглобулина может включать 1 домен (CH1) константной области тяжелой цепи, шарнирную область, 2 домен (CH2) константной области тяжелой цепи и 3 домен (CH3) константной области тяжелой цепи. Соответственно Fc-фрагмент по настоящему изобретению может включать шарнирную область,СН 2 и/или CH3 домен. Fc-фрагмент может, кроме того, включать целую или часть шарнирной области,СН 2 и/или CH3 домен.-3 017377 В дополнительном аспекте данное изобретение относится к такому слитому белку EPO-Fc, который имеет Fc-фрагмент, содержащий шарнирную область, СН 2 домен и CH3 домен, взятый из человеческогоIgG. В дополнительном аспекте данное изобретение относится к такому слитому белку EPO-Fc, в котором соединение между ЕРО-фрагментом и Fc-фрагментом осуществляется в шарнирной области. Обычно слитый белок EPO-Fc по настоящему изобретению получают способами рекомбинантной экспрессии, используя методики, хорошо известные специалистам в данной области техники. Для того чтобы получить гликозилированный рекомбинантный слитый белок EPO-Fc с характером гликозилирования, который, по существу, является таким же, как и у природных ЕРО и иммуноглобулинов, предпочтительным является применение эукариотических клеток для рекомбинантной экспрессии слитых белковEPO-Fc. Рекомбинантно экспрессированные белки секретируются в среде для культивирования в виде отдельных полипептидных цепей с образованием мономеров слитого белка EPO-Fc, но они могут также секретироваться в среде для культивирования в димерной или мультимерной форме, при этом полипептидные цепи соединяются друг с другом посредством дисульфидных связей. В дополнительном аспекте данное изобретение относится к такому слитому белку EPO-Fc, в котором два мономера слитого белка EPO-Fc соединяются друг с другом с образованием гомодимера. Секретируемые рекомбинантно полученные белки можно выделить из клеточной среды для культивирования и далее очистить при помощи хорошо известных в уровне техники методик. В дополнительном аспекте данное изобретение относится к способу получения карбамоилированного рекомбинантного слитого белка EPO-Fc, содержащего Fc-фрагмент молекулы человеческого IgG и ЕРО-фрагмент, предпочтительно человеческий ЕРО-фрагмент, в котором Fc-фрагмент непосредственно присоединен через его N-конец к С-концу ЕРО фрагмента, где способ включает: получение молекулы ДНК, кодирующей слитый белок EPO-Fc; трансформирование клетки-хозяина указанной молекулой ДНК; экспрессию указанного слитого белка EPO-Fc, кодируемого указанной молекулой ДНК; получение из культуры указанного слитого белка EPO-Fc; очистку указанного слитого белка EPO-Fc и карбамоилирование указанного слитого белка EPO-Fc посредством взаимодействия указанного слитого белка EPO-Fc с цианатом, где по крайней мере один, предпочтительно два или более остатков лизина и/или N-концевая аминокислота слитого белка являются карбамоилированными. Слитые белки EPO-Fc по настоящему изобретению сочетают предпочтительный увеличенный период полувыведения из сыворотки крови, полученный посредством соединения ЕРО-фрагмента с Fcфрагментом иммуноглобулина, с пониженной гематопоэтической активностью при одновременном поддержании неизменной или даже повышенной восстанавливающей активности по отношению к нервным клеткам за счет карбамоилирования по крайней мере одного первичного амина белка. В дополнительном аспекте данное изобретение относится к подобному слитому белку EPO-Fc для применения в качестве лекарственного средства. Обычно подобный слитый белок EPO-Fc можно применять вместо карбамоилированного ЕРОбелка во всех случаях, когда требуется лечение карбамоилированным ЕРО. В частности, такой слитый белок EPO-Fc применяют для получения фармацевтической композиции для лечения заболевания центральной нервной системы (ЦНС) и/или периферической нервной системы. Например, подобный слитый белок EPO-Fc можно применять для получения фармацевтической композиции для лечения заболевания, выбранного из группы, состоящей из инсульта, ишемического явления в ЦНС помимо инсульта, закрытой травмы, травмы спинного мозга, травматического повреждения мозга и нейродегенеративного заболевания. Благодаря увеличенному периоду полувыведения из сыворотки крови слитых белков EPO-Fc по изобретению по сравнению с карбамоилированными неслитыми белками ЕРО, фармацевтические композиции, содержащие подобные слитые белки EPO-Fc требуют менее частого введения по сравнению с фармацевтическими композициями, содержащими карбамоилированные неслитые белки ЕРО. Следовательно, лечение по настоящему изобретению слитыми белками EPO-Fc является намного более благотворным для пациента, нуждающегося в подобном лечении. В дополнительном аспекте данное изобретение относится к фармацевтической композиции, содержащей подобный слитый белок EPO-Fc, необязательно вместе с фармацевтически приемлемым носителем. В дополнительном аспекте данное изобретение относится, но не ограничивается, к подобной фармацевтической композиции, подходящей для парентерального введения. Поскольку эффективная ЕРОтерапия требует терапевтических уровней ЕРО в сыворотке крови, то желательно, чтобы подобные фармацевтические композиции применялись в виде раствора для инъекций, в котором слитый белок EPO-Fc по настоящему изобретению присутствует в смеси с веществами фармацевтически приемлемых носителей. В предпочтительном варианте осуществления настоящего изобретения подобные фармацевтические композиции обеспечиваются в галеновой форме подходящей для внутривенной или подкожной инъекции.-4 017377 В дополнительном аспекте данное изобретение относится к применению подобных фармацевтических композиций для лечения заболевания центральной нервной системы (ЦНС) и/или периферической нервной системы. В дополнительном аспекте данное изобретение относится к применению подобных фармацевтических композиций для лечения заболевания, выбранного из группы, состоящей из инсульта, ишемического явления в ЦНС, отличного от инсульта, закрытой травмы, травмы спинного мозга, травматического повреждения мозга и нейродегенеративного заболевания. Для более полного понимания данного изобретения, описанного в контексте данного документа,изложены следующие примеры. Данные примеры служат только для иллюстративных целей и не следует считать, что они ограничивают данное изобретение в каком-либо отношении. Примеры Пример 1. Получение и исследование карбамоилированных слитых белков EPO-Fc. а) Конструирование вектора экспрессии, кодирующего слитый белок EPO-Fc. Слитый белок Epo-Fc создавали посредством ПЦР синтеза человеческого гена ЕРО и фрагмента шарнир-СН 2-CH3 человеческого IgG1. EPO устанавливался на N-конце структуры и присоединялся к шарнирной области человеческого IgG1. Для секреции белка в культуральный супернатант использовали сигнальную последовательность эритропоэтина, которая амплифицировалась вместе с кДНК ЕРО. Такая структура делает возможной секрецию гомодимерной молекулы EPO-Fc. кДНК человеческого ЕРО амплифицировали из плазмиды phEpo посредством ПЦР с применением олигонуклеотидов еро back BamHI (предназначенных для того, чтобы присоединяться к специфическому сайту рестрикции BamHI на 5'-конце фрагмента ДНК) и еро hyb hinge for, давая в результате фрагмент ДНК длиной в 576 пар оснований (еро back BamHI: 5' GGGGGATCCGCCATGGGGGTGCACGAATGTCC 3' [SEQ ID NO: 1]; epo hyb hinge for: 5' AGATTTGGGCTCTCTGTCCCCTGTCCTGCAGG 3' [SEQ ID NO: 2]). Фрагмент шарнир-СН 2-CH3 человеческого IgG1 амплифицировали из плазмиды p2G12HC посредством ПЦР с применением олигонуклеотидов CH3 для NotI (предназначенных для того, чтобы присоединяться к специфическому сайту рестрикции NotI на 3'-конце фрагмента ДНК) и hinge hyb epo back, давая в результате фрагмент ДНК длиной в 671 пар оснований (CH3 for NotI: 5'ACAGGGGACAGAGAGCCCAAATCTTGTGAC 3' [SEQ ID NO: 4]). Амплификацию проводили в общем объеме 50 мкл, применяя 20 нг плазмидной матрицы, 10 пмоль каждого олигонуклеотида, 250 мкМ нуклеотидов, 1 буфер для ПЦР и 5 единиц термостабильной ДНК-полимеразы Taq. Обе реакции ПЦР осуществляли за 25 циклов при 94C в течение 20 с, 56C в течение 30 с и 72C в течение 1 мин. После очистки двух фрагментов при помощи набора для очистки Qiaquick (Qiagen) проводили синтез ПЦР в объеме 50 мкл, используя 50 нг кДНК шарнир-СН 2-CH3 IgG1, 50 нг кДНК ЕРО, 250 мкМ нуклеотидов, 1 буфер для ПЦР и 5 единиц ДНК-полимеразы Taq. На первой стадии провели 6 циклов при 94C в течение 20 с, 60C в течение 30 с и 72C в течение 1 мин. После добавления 10 пмоль каждого из внешних праймеров (еро back BamHI и CH3 для NotI) продолжали ПЦР еще на 25 циклов при 94C в течение 20 с, 56C в течение 30 с и 72C в течение 1,5 мин. После этого продукт ПЦР очищали посредством препаративной гель-экстракции и набора для гельэкстракции из Qiagen. Полученную кДНК EPO-Fc включали в BamHI/NotI открытый эукариотический вектор экспрессии, содержащий промотор человеческого CMV (цитомегаловирус) и трансформировали вTG1 штамме E.coli. 10 нг EPO-Fc-фрагмента и 5 нг вектора pECMV, 1 единицу ДНК лигазы Т 4 и 1 буфер для лигирования (New England Biolabs) применяли для лигирования в общем объеме 10 мкл в течение 1 ч при 37C. Положительные клоны распознавали посредством ПЦР-скрининга при помощи внешних праймеров. Правильность кДНК Epo-Fc в конечной плазмиде pCMVEpoFc проверяли посредством анализа последовательности и рестрикционного анализа.b) Экспрессия и очистка слитого белка EPO-Fc. Препаративный синтез плазмиды (pCMV EpoFc) на стадии а) применяли для трансфекции негативных клеток СНО дигидрофолатредуктазы. Для трансфекции клеток липофектином использовали две плазмиды pCMVEpoFc и p2dhfr в соотношении 20:1. Отбор трансфицированных клеток начинали через 24 ч после трансфекции (DMEM 4 мМ L-Глутамин и 10% диализованная фетальная телячья сыворотка (ФТС, а когда клоны начинали расти оказывали воздействие метотрексатом (МТХ) (0,05 мкМ и 0,1 мкМ МТХ). После отбора и выделения лучшего из полученных клонов культивирование переводили в безбелковые условия. Клеточный супернатант получают в результате периодической ферментации с добавлением субстрата, при этом жизнеспособность клетки составляет 80%. Супернатант подвергают гель-фильтрации (размер поры 0,2 мкм) и добавляют 1 М ТРИС до конечного показателя рН 8,5, а затем пропускают через колонку с протеин А-сефарозой, уравновешенную 0,025 М ТРИС буферной солью, рН 8,5 и элюируют 0,1 М глицином, рН 3,5. Показатель рН элюируемой фракции продукта представлял собой измеряемый показатель рН и при необходимости его доводили до рН 7,0-7,5 при помощи 1 М ТРИС, рН 8,0.-5 017377 с) Получение карбамоилированного слитого белка EPO-Fc. Исходное вещество для данного процесса очищали, в супернатанте культуры присутствует рекомбинантный человеческий слитый белок EPO-Fc, описанный выше, обычно включающий все изоформы слитого белка, что обеспечивает высокий выход необходимого конечного продукта. Сначала белковую концентрацию рекомбинантного слитого белка человеческого EPO-Fc доводили до 4-7 мг/мл посредством ультрафильтрации (например, мембрана, отсекающая 10 кД). Готовили растворKOCN-бората посредством растворения 60 мг/мгслитого белка EPO-FC в 0,6 М Na-боратном буферном растворе,рН 8. Затем раствор слитого белка EPO-Fc смешивали с раствором KOCN-бората в соотношении 1:1 и полученный раствор инкубировали в течение 48 ч при 37C. Окончательный карбамоилированный слитый белок EPO-Fc получили посредством гель-фильтрации (например, Сефадекс G25) в ФБР. Концентрацию карбамоилированного слитого белка EPO-Fc определяли по OD 280 нм согласно калибровочной кривой слитого белка EPO-Fc, которую получали посредством анализа ELISA. Последующее определение степени карбамоилирования подтвердило, что все свободные аминогруппы, по существу, были карбамоилированы. Пример 2. Исследование восстановления опорно-двигательного аппарата у крыс после закрытой травмы. В эксперименте на животных in vivo исследовали восстанавливающую активность по отношению к нервным клеткам карбамоилированного слитого белка EPO-Fc по сравнению с немодифицированным слитым белком EPO-Fc. Карбамоилированный слитый белок EPO-Fc и немодифицированный слитый белок EPO-Fc получали, как описано в примере 1. 35 крыс линии Спраг Доули с весом 240-260 г разделили на пять групп, содержащих шесть животных (группа 1), семь животных (группы 2, 4 и 5) или восемь животных (группа 3). Животных анестезировали смесью Кетавета (110 мг/кг) и Ромпуна (12 мг/кг), вводимой внутрибрюшинно, после чего следовала ламинэктомия на уровне Т-11. После того как спинной мозг подвергли воздействию (ламинэктомия), животные получают закрытую травму спинного мозга 150 кдин посредством применения Импактора IH 400 (Precxsion SystemsInstrumentation, Lexington, KY, USA). Через 1 ч после повреждения животные получали инъекцию однократной дозы соответствующего белка (см. табл. 1). Восстановление опорно-двигательного аппарата оценивали по шкале оценок Basso-Beattie-Bresnahan через три дня, одну неделю, две недели, три недели, четыре недели, пять недель и шесть недель после получения закрытой травмы. Шкала оценок Basso-Beattie-Bresnahan представляет собой 21-балльную шкалу, которая систематически детализирует функционирование движений в суставе задней конечности, способность передвигаться, степень точного регулирования координированного передвижения и устойчивость торса. Таблица 1 Классификация групп в исследовании мышей Животных подвергали воздействию в открытом поле и наблюдали в течение пятиминутного периода через три дня, одну неделю, две недели, три недели, четыре недели, пять недель и шесть недель после получения закрытой травмы. Фиг. 1 показывает значения по шкале Basso-Beattie-Bresnahan, полученные в данном эксперименте. Было обнаружено, что введение карбамоилированного rhEPO-Fc (группа 4) и rhEPO-Fc (группа 3) значительно улучшает восстановление опорно-двигательного аппарата по сравнению с контрольными группами (группы 1 и 2). Напротив, животные, получавшие метилпреднизолон (группа 5), почти не проявляли какого-либо отличия от контрольных животных. В то время как контрольные животные достигают стационарного состояния приблизительно через четыре недели и далее не проявляют никакого восстановительного улучшения, животные групп 3 и 4 (слитый белок EPO-Fc и карбамоилированный слитый белок EPO-Fc соответственно) показывают непрерывные и значительные улучшения в течение периода восстановления свыше шести недель. Также было обнаружено, что введение карбамоилированного rhEPO-Fc (группа 4) значительно улучшает восстановление опорно-двигательного аппарата по сравнению с rhEPO-Fc (группа 3), в частности непосредственно после закрытой травмы. На третий день животные, обработанные rhEPO-Fc, показали лишь экстенсивное движение одного сустава или двух суставов (значение 2 или 3 по шкале оценокBasso-Beattie-Bresnahan, соответственно), в то время как животные, получавшие карбамоилированныйrhEPO-Fc, показали экстенсивное движение по крайней мере двух суставов и слабое движение третьего-6 017377 сустава или экстенсивное движение всех трех суставов задней конечности (значение 6 или 7 по шкале оценок Basso-Beattie-Bresnahan соответственно). Пример 3. Оценка эффекта карбамоилированного слитого белка EPO-Fc на мышиную модель рассеянного склероза. В эксперименте на животных in vivo исследовали эффект карбамоилированного слитого белка EPOFc на ранней, промежуточной и поздней фазе развития экспериментального аутоиммунного энцефаломиелита (ЭАЭ). ЭАЭ можно моделировать у грызунов, например у мышей, и он является общепринятой животной моделью для демиелинизирующих расстройств, таких как рассеянный склероз (МС). Мышиная модель ЭАЭ имитирует рецидивирующее и ремиттирующее течение болезни, характерное для МС. Карбамоилированный слитый белок EPO-Fc, используемый в данном эксперименте, получали, как описано в примере 1. ЭАЭ моделировали у 11 женских особей мышей C57BL/6 посредством иммунизации миелинолигодендроцитарным гликопротеином (МОГ 35-55) (Savino, С. et al. (2006), J. Neuroimmunol 172 (1-2): 2737). Кратко, готовили раствор МОГ 35-55 с концентрацией 4 мг/мл в ФБР. Термоинактивированные бактерии Mycobacterium tuberculosis суспендировали в неполном адъюванте Фрейнда (НАФ) до концентрации 8 мг/мл. Полученную суспензию эмульгировали с раствором МОГ 35-55. Затем каждой мыши вводили подкожно 100 мкл полученной эмульсии, по 50 мкл в каждый бок. В заключение каждому животному дважды вводили внутривенно 250 нг коклюшного токсина, растворенного в ФБР, один раз непосредственно после иммунизации и еще раз через 48 ч после иммунизации. Для того чтобы исследовать эффект карбамоилированного слитого белка EPO-Fc на различных стадиях развития ЭАЭ, животных с модельным ЭАЭ разделили на исследуемую группу (пять животных) и контрольную группу (шесть животных). Животные в исследуемой группе получали карбамоилированный слитый белок EPO-Fc в дозе 50 мкг/кг массы тела, тогда как контрольная группа получала только ФБР. Введение посредством внутрибрюшинной инъекции либо карбамоилированного слитого белкаEPO-Fc, либо ФБР начинали через 18 дней (ранняя обработка), 28 дней (промежуточная обработка) или 52 дня (поздняя обработка) после иммунизации. Кроме того, каждую исследуемую группу и контрольную группу дополнительно разделили на три подгруппы (см. табл. 2). Обработку осуществляли в течение 30 дней и животные получали дозу каждый второй день. Таблица 2 Классификация групп в исследовании мышей Контролировали клиническое состояние животных и развитие заболевания. Кроме того, неврологические расстройства, проявляемые животными, оценивали количественно по показателю ЭАЭ каждый день в течение лечения в соответствии с системой оценок, показанной в табл. 3 (Buddeberg, В.S. et al. Фиг. 2 А-2 С представляют показатели ЭАЭ, полученные в данных экспериментах на животных, при этом каждая фигура показывает средний показатель животных из каждой группы. Было обнаружено, что введение карбамоилированного слитого белка EPO-Fc (группы 1, 3 и 5) уменьшает частоту рецидивов на ранней (фиг. 2 А), промежуточной (фиг. 2 В) и поздней фазе (фиг. 2 С) развития ЭАЭ по сравнению с контролем (группы 2, 4 и 6). В то время как показатели ЭАЭ контрольных животных колебались вверх-вниз, у животных, получавших карбамоилированный слитый белок EPO-Fc,наблюдали, что показатель ЭАЭ, т.е. интенсивность заболевания, никогда не превышал показатель в начале обработки. Также было обнаружено, что раннее введение карбамоилированного слитого белка EPO-Fc (фиг. 2 А) оказывает лучший эффект на развитие ЭАЭ, чем позднее введение карбамоилированного слитого белка EPO-Fc (фиг. 2 С) по сравнению с соответствующим контролем. В частности, на фиг. 2 А можно увидеть, что на 30 день после начала введения средний показатель животных, получавших карбамоилированный слитый белок EPO-Fc (исследуемая группа), уменьшился на 65,2%, тогда как средний показатель контрольных животных уменьшился лишь на 46,1%. Результаты данных экспериментов наводят на мысль о положительном эффекте карбамоилированного слитого белка EPO-Fc на развитие ЭАЭ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантный слитый белок ЕРО, имеющий увеличенный физиологический период полувыведения и пониженную гематопоэтическую активность по сравнению с ЕРО in vivo и дополнительно имеющий нейрорегенеративную активность in vivo, отличающийся тем, что он содержит Fc-фрагмент молекулы человеческого IgG и фрагмент эритропоэтина (ЕРО), предпочтительно фрагмент человеческого эритропоэтина, в котором Fc-фрагмент непосредственно соединен через его N-конец с С-концом фрагмента ЕРО, и где слитый белок модифицирован посредством карбамоилирования. 2. Слитый белок по п.1, в котором по крайней мере один, предпочтительно два или более остатков лизина и/или N-концевая аминокислота указанного слитого белка являются карбамоилированными. 3. Слитый белок по п.1 или 2, в котором Fc-фрагмент содержит шарнирную область, домен СН 2 и домен CH3, полученные из человеческого IgG. 4. Слитый белок по любому из пп.1-3, в котором слияние осуществляется в шарнирной области. 5. Слитый белок по любому из пп.1-4, в котором два мономера слитого белка EPO-Fc соединены друг с другом и образуют гомодимер. 6. Способ получения карбамоилированного рекомбинантного слитого белка EPO-Fc, содержащегоFc-фрагмент молекулы человеческого IgG и ЕРО-фрагмент, предпочтительно фрагмент человеческого эритропоэтина, в котором Fc-фрагмент непосредственно соединен через его N-конец с С-концом фрагмента ЕРО, где способ включает: получение молекулы ДНК, кодирующей слитый белок EPO-Fc; трансформирование клетки-хозяина указанной молекулой ДНК; экспрессию указанного слитого белка EPO-Fc, кодируемого упомянутой молекулой ДНК; получение из культуры указанного слитого белка EPO-Fc; очистку указанного слитого белка EPO-Fc и карбамоилирование указанного слитого белка EPO-Fc посредством взаимодействия цианата с указанным слитым белком EPO-Fc,где по крайней мере один, предпочтительно два или более остатков лизина и/или N-концевая аминокислота слитого белка являются карбамоилированными. 7. Слитый белок по любому из пп.1-5 для применения в качестве лекарственного средства. 8. Применение слитого белка по любому из пп.1-5 для получения фармацевтической композиции для лечения заболевания центральной нервной системы (ЦНС) и/или периферической нервной системы. 9. Применение по п.8, в котором заболевание выбирают из группы, состоящей из инсульта, ишемического явления в ЦНС, отличного от инсульта, закрытой травмы, травмы спинного мозга, травматического повреждения мозга и нейродегенеративного заболевания. 10. Фармацевтическая композиция, содержащая слитый белок по любому из пп.1-5, вместе с фармацевтически приемлемым носителем, предпочтительно для парентерального введения. 11. Фармацевтическая композиция по п.10, применяемая в виде раствора для инъекций.
МПК / Метки
МПК: C07K 14/505, A61K 38/18, C12N 15/62
Метки: слитый, белок, эритропоэтина
Код ссылки
<a href="https://eas.patents.su/12-17377-slityjj-belok-eritropoetina.html" rel="bookmark" title="База патентов Евразийского Союза">Слитый белок эритропоэтина</a>
Предыдущий патент: Производные тетрагидронафталин-1-карбоновой кислоты, ингибирующие мтр
Следующий патент: Элемент кровельного покрытия
Случайный патент: Ловушка для улавливания лесных, садовых и сельскохозяйственных вредных насекомых и способ удерживания и хранения таких вредителей