Адъювантная композиция, содержащая фосфат алюминия и 3d-mpl
Формула / Реферат
1. Применение (i) антигена; (ii) адъюванта фосфата алюминия и (iii) адъюванта 3-O-деацилированного монофосфорилированного липида А в производстве вакцины для введения пациенту, в которой по меньшей мере 50% 3-О-деацилированного монофосфорилированного липида А адсорбировано на адъюванте фосфата алюминия, причем вакцина предназначена для внутримышечной инъекции, антиген представляет собой HBsAg и вакцина предназначена для введения посредством плана иммунизации с дозами в 0, 1, 2 и 6 месяцев, где 0 является временем первой дозы.
2. Применение по п.1, где вакцина предназначена для защиты от и/или лечения инфекции, вызываемой вирусом гепатита В.
3. Применение по п.1 или 2, где пациентом является пациент перед гемодиализом.
4. Применение по любому из предшествующих пунктов, где HBsAg является неглюкозилированным и в форме, по существу, сферических частиц со средним диаметром приблизительно 20 нм, включающих липидный матрикс, содержащий фосфолипиды.
5. Применение по любому из предшествующих пунктов, где вакцина предназначена для применения в 0,5 мл дозе.
6. Применение по любому из предшествующих пунктов, где вакцина содержит приблизительно 20 мкг HBsAg в дозе.
7. Применение по любому из предшествующих пунктов, где вакцина содержит приблизительно 50 мкг 3-О-деацилированного монофосфорилированного липида А и приблизительно 0,5 мг фосфата алюминия (выраженного термином Al3+) в дозе.
8. Применение по любому из предшествующих пунктов, где по меньшей мере 50% HBsAg адсорбировано на адъюванте из фосфата алюминия.
9. Применение по любому из предшествующих пунктов, где антиген HBsAg экспрессирован на дрожжах.
10. Применение по п.9, где дрожжи являются Saccharomyces cerevisiae.
11. Применение по любому из предшествующих пунктов, где 0,5 мл дозы вакцины содержит приблизительно 50 мкг 3-O-деацилированного монофосфорилированного липида А, приблизительно 0,5 мг фосфата алюминия (выраженного термином Al3+) и приблизительно 20 мкг/мл HBsAg.
12. Применение по п.1 или 2, где пациент является взрослым человеком, которому проводят гемодиализ.
13. Применение по любому из предшествующих пунктов, где композиция упакована в шприц, причем шприц изготовлен из боросиликатного стекла.
14. Применение по любому из предшествующих пунктов, где адъювант 3-O-деацилированного монофосфорилированного липида А содержит смесь ацилированных дисахаридов, где каждый дисахарид: (а) имеет две b-1',6-связанные 2-деокси-2-аминоглюкозные моносахаридные субъединицы; (b) является фосфорилированным по 4' положению; (с) является незамещенным по 1, 3 и 6' положениям, (d) является О-ацилированным по 3' положению и (е) является N-ацилированным по 2 и 2' положениям, и где смесь ацилированных дисахаридов включает по меньшей мере 10 мас.% компонента, в котором каждая из ацильных групп во 2, 2' и 3' положениях является самостоятельно замещенной по алифатическому углеродному атому О-ацильной группой.
15. Применение по любому из предшествующих пунктов, где вакцина дополнительно содержит ион триэтиламмония.
16. Применение по любому из предшествующих пунктов, где по меньшей мере 95% 3-О-деацилированного монофосфорилированного липида А адсорбировано на адъюванте фосфата алюминия.
17. Применение по любому из предшествующих пунктов, где адъювант фосфата алюминия является аморфным.
Текст
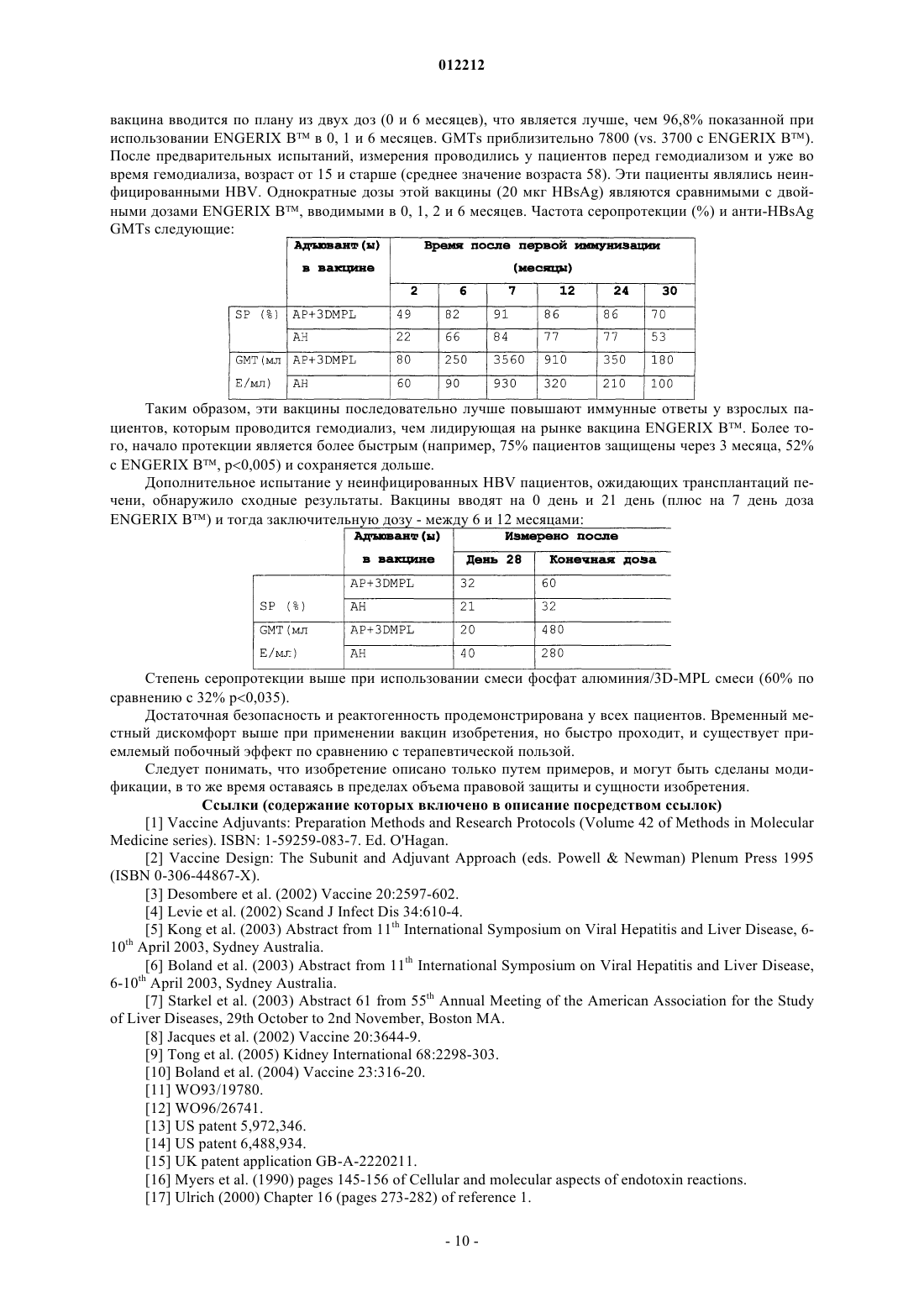
012212 Все документы, цитируемые в данном описании, включены посредством ссылок во всей своей полноте. Область техники, к которой относится изобретение Настоящее изобретение относится к области адъювантов в вакцинах. Предшествующий уровень техники Соли алюминия, часто упоминаемые в общем случае как квасцы, являются классическим адъювантом в вакцинах. Различные дополнительные адъюванты описаны, и подробности могут быть найдены в текстах, таких как ссылки 1 и 2. Один из этих адъювантов представляет собой 3'-деацилированный монофосфорилированный липид А (или 3D-MPL). Ссылки с 3-й по 10-ю сообщают об успехе применения у толерантных страдающих гепатитом пациентов адъювантной системы, упоминаемой как AS04, вышеупомянутая [система] включает как 3D-MPL,так и квасцы [11-14]. Цель изобретения состоит в представлении модификаций и улучшений этой адъювантной системы. Раскрытие изобретения Композиции изобретения включают фосфат алюминия в виде адъюванта и 3D-MPL в виде адъюванта. Такое двойное адъювантное сочетание уже было описано в ссылках 12-14, однако изобретение раскрывает количество возможных типов комбинаций:(a) композиция должна иметь осмоляльность между 200 и 400 мОсм/кг.(b) композиция должна иметь рН между 5 и 7,5.(c) композиция должна быть буферированной.(d) по меньшей мере 50% 3D-MPL в вакцине должны быть адсорбированными на фосфате алюминия.(e) 3D-MPL в вакцине должны принимать форму мицеллярных структур с диаметром меньше, чем 150 нм.(f) 3D-MPL в вакцине должен представлять собой смесь различных ацилированных форм, предпочтительно включающих по меньшей мере 10% 6-ацил-цепочечной формы.(g) композиция может включать одно или более из: моноолеат полиоксиэтиленсорбитана; сорбит; триэтаноламин; ион триэтиламмония; лактозу; сахарозу; трегалозу; маннит. Эти модификации могут использоваться независимо или в сочетании. Таким образом, изобретение предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, отличающуюся тем, что композиция имеет осмоляльность между 200 и 400 мОсм/кг. Изобретение также предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия и (ii) адъювант 3-О-деацилированного монофосфорилированного липида А, отличающуюся тем, что композиция имеет рН между 5 и 7,5. Изобретение также предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия; и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, отличающуюся тем, что композиция является буферированной, т.е. с рН между 5 и 7,5. Изобретение также предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия; и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, отличающуюся тем, что по меньшей мере 50% 3-O-деацилированного монофосфорилированного липида А адсорбировано на фосфате алюминия. Изобретение также предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия; и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, отличающуюся тем, что композиция содержит менее чем 50 мкг/мл неадсорбированного 3-O-деацилированного монофосфорилированного липида А. Изобретение также предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, отличающуюся тем, что адъювант 3-O-деацилированного монофосфорилированного липида А находится в форме частиц, имеющих диаметр менее чем 150 нм. Изобретение также предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, содержащий смесь ацилированных дисахаридов, где каждый дисахарид: (а) имеет две -1',6-связанные 2-деокси-2 аминоглюкозные моносахаридные субъединицы; (b) является фосфорилированным по 4'-положению; (с) является незамещенным в 1-, 3- и 6'-положениях, (d) является О-ацилированным в 3'-положении и (е) Nацилированным во 2- и 2'-положениях, и где смесь ацилированных дисахаридов включает по меньшей мере 10 мас.% компонента, в котором каждая из ацильных групп в 2-, 2'- и 3'-положениях является самозамещенной по алифатическому углеродному атому с O-ацильной группой. Изобретение также предоставляет композицию, содержащую: (i) адъювант фосфата алюминия и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А и по меньшей мере одно вещество,выбранное из группы, включающей сорбит; триэтаноламин; ион триэтаноламина; лактозу; сахарозу; трегалозу и маннит.-1 012212 Эти различные признаки могут быть использованы в комбинации. Таким образом, изобретение предоставляет адъювантную композицию, содержащую: (i) адъювант фосфата алюминия и (ii) адъювант 3-O-деацилированного монофосфорилированного липида А, отличающуюся тем, что композиция имеет одно или более следующих свойств:(4) по меньшей мере 50% 3-O-деацилированного монофосфорилированного липида А адсорбировано на фосфате алюминия;(6) адъювант 3-O-деацилированного монофосфорилированного липида А находится в форме частиц, имеющих диаметр менее чем 150 нм.(7) адъювант 3-О-деацилированного монофосфорилированного липида А содержит смесь ацилированных дисахаридов, где каждый дисахарид: (а) имеет две -1',6-связанные 2-деокси-2-аминоглюкозные моносахаридные субъединицы; (b) является фосфорилированным по 4'-положению; (с) является незамещенным в 1-, 3- и 6'-положениях, (d) является О-ацилированным по 3'-положению и (е) является Nацилированным во 2- и 2'-положениях, и где смесь ацилированных дисахаридов включает по меньшей мере 10 мас.% компонента, в котором каждая из ацильных групп в 2-, 2'- и 3'-положениях является самозамещенной по алифатическому углеродному атому О-ацильной группой; и/или(8) содержит по меньшей мере одно вещество, выбранное из группы, состоящей из сорбита; триэтаноламина; иона триэтаноламина; лактозы; сахарозы; трегалозы и маннита. Изобретение также предоставляет иммуногенную композицию, содержащую адъювантную композицию изобретения и дополнительно содержащую (iii) антиген. Фосфат алюминия в виде адъюванта. Композиции изобретения включают фосфат алюминия в виде адъюванта и 3D-MPL в виде адъюванта. Термин фосфат алюминия является общепринятым в данной области, но не является точным описанием действительного химического соединения, которое представлено [например, см. главу 9 ссылки 2]. В изобретении можно использовать любые адъюванты фосфата алюминия, которые в целом используются как адъюванты, которые являются типичными гидроксифосфатами алюминия, часто также содержащими небольшое количество сульфата (т.е. гидроксифосфат сульфат алюминия). Они могут быть получены посредством осаждения, причем условия реакции и концентрация во время осаждения влияют на степень замещения фосфата на гидроксильную группу в соли. Гидроксифосфаты обычно имеют PO4/Al молярное соотношение между 0,3 и 1,2. Гидроксифосфаты могут различаться от AlPO4 посредством наличия гидроксильных групп. Например, IR спектральная полоса частот 3164 см-1 (при нагревании до 200C) указывает на присутствие структурных гидроксилов [глава 9 ссылки 2]. Соль алюминия может принимать любую подходящую физическую форму, но, как правило, является аморфной.PO4/Al3+ молярное соотношение адъюванта фосфата алюминия в общем случае будет между 0,3 и 1,2, более предпочтительно между 0,8 и 1,2, и еще предпочтительнее 0,95+0,1. Фосфат алюминия в общем случае будет аморфным, особенно для гидроксифосфатных солей. Типичный адъювант является аморфным гидроксифосфатом алюминия с PO4/Al молярным соотношением между 0,84 и 0,92, содержащим 0,6 мг Al3+/мл. Фосфат алюминия в общем случае будет находиться в виде частиц. Типичные диаметры частиц находятся в интервале 0,5-20 мкм (т.е. приблизительно 5-10 мкм) после адсорбции антигена и/или 3D-MPL.PZC фосфата алюминия является обратно пропорциональным степени замещения фосфата на гидроксил, и эта степень замещения может различаться в зависимости от условий реакции и концентрации реагентов, использованных для получения соли посредством осаждения. PZC может меняться посредством изменения концентрации свободных фосфатных ионов в растворе (больше фосфата = больше кислого PZC) или посредством добавления буфера, такого как гистидиновый буфер (делает PZC более основным). Фосфаты алюминия, использующиеся в соответствии с изобретением, в общем случае будут иметьPZC между 4,0 и 7,0, более предпочтительно между 5,0 и 6,5, например приблизительно 5,7. Фосфат алюминия предпочтительно используют в форме водного раствора, к которому добавлены 3D-MPL (и, необязательно, антиген) (NB: несмотря на стандартно упоминающийся водный фосфат алюминия как раствор, с точки зрения физической химии, соль является нерастворимой и образуют суспензию). Предпочтительно разводить фосфат алюминия до требуемой концентрации и обеспечивать гомогенный раствор перед добавлением 3D-MPL и/или антигена. Концентрация Al3+, предшествующая добавлению 3D-MPL и/или антигена, находится в общем случае между 0 и 10 мг/мл. Предпочтительной концентрацией является находящаяся между 0,5 и 3 мг/мл.-2 012212 Раствор фосфата алюминия, использующийся для приготовления композиции изобретения, может содержать буфер (например, фосфатный или гистидиновый или Tris буфер), но это не является всегда необходимым. Раствор фосфата алюминия предпочтительно является стерильным и апирогенным. Раствор фосфата алюминия может включать свободные водные фосфатные ионы, например представленные в концентрации между 1,0 и 2 0 мМ, предпочтительно между 5 и 15 мМ и еще предпочтительнее приблизительно 10 мМ. Раствор фосфата алюминия может также содержать хлорид натрия. Концентрация натрия хлорида предпочтительна в интервале 0,1-100 мг/мл (например, 0,5-50 мг/мл, 1-20 мг/мл, 2-10 мг/мл) и более предпочтительной является приблизительно 31 мг/мл. Наличие NaCl способствует правильному измерению рН перед адсорбцией других компонентов и также влияет на осмоляльность. 3D-MPL в виде адъюванта Композиции изобретения включают фосфат алюминия в виде адъюванта и 3D-MPL адъювант. 3-О-деацилированный монофосфорилированный липид A (3D-MPL) также упоминается как 3-де-Оацилированный монофосфорилированный липид А или как 3-О-дезацил-4'-монофосфорилированный липид А. Наименование указывает, что положение 3 восстанавливающего конца глюкозамина в монофосфорилированном липиде А является деацилированным. Его получали из свободного от гептозы мутанта Salmonella Minnesota, и он является химически сходным с липидом А, но не имеет кислотолабильной фосфорильной группы и основнолабильной ацильной группы. Это активирует клетки моноцитарно/макрофагоцитарного происхождения и стимулирует высвобождение различных цитокинов, включаяIL-1, IL-12, TNF- и GM-CSF. Получение 3D-MPL было первоначально описано в ссылке 15, и продукт был произведен и продан Corixa Corporation под торговым названием MPL. Другие детали могут быть найдены в ссылках 16 и 19. Типичная композиция включает 3D-MPL в концентрации между 25 мкг/мл и 200 мкг/мл, например в интервале 50-150 мкг/мл, 75-125 мкг/мл, 90-110 мкг/мл или приблизительно 100 мкг/мл. Обычно вводят между 25-75 мкг 3D-MPL на дозу, например между 45-55 мкг или приблизительно 50 мкг 3D-MPL на дозу. Преимущественно 3D-MPL является адсорбированным на фосфате алюминия. Предпочтительно по меньшей мере 50% (мас.) 3D-MPL являются адсорбированными, например 60%, 70%, 80%, 90%,95%, 98% и т.д. Процент адсорбированного может быть измерен несколькими путями как антиген (см. ниже). В композиции, имеющей общую концентрацию 3D-MPL 100 мкг/мл, концентрация неадсорбированного 3D-MPL должна быть менее 50 мкг/мл, например 40 мкг/мл, 35 мкг/мл, 30 мкг/мл, 25 мкг/мл, 20 мкг/мл, 15 мкг/мл, 10 мкг/мл, 5 мкг/мл, 2 мкг/мл, l мкг/мл и т.д. 3D-MPL может принимать форму смеси родственных молекул, различающихся своим ацилированием (например, имеющих 3, 4, 5 или 6 ацильных цепей, которые могут быть различной длины). Два глюкозаминовых (также известных как 2-деокси-2-аминоглюкоза) моносахарида являются Nацилированными по углеродным атомам в положении 2 (т.е. в положениях 2 и 2') и также Оацилированными в 3'-положении. Группа, присоединенная к атому углерода 2, имеет формулу -NH-COCH2-CR1R1'. Группа, присоединенная к атому углерода 2', имеет формулу -NH-CO-CH2-CR2R2'. Группа,присоединенная к атому углерода 3', имеет формулу -NH-CO-CH2-CR3R3'. Представленная структура представляет собой: Группы R1, R2 и R3, каждая независимо, представляют собой -(СН 2)n-СН 3. Значение n предпочтительно находится между 8 и 16, более предпочтительно между 9 и 12 и еще более предпочтительно равно 10. Группы R1, R2 и R3 могут, каждая независимо, представлять собой: (a) -H; (b) -OH; или (с) -O-CO4R , где R4 является или -H, или -(CH2)m-CH3, где значение m предпочтительно находится между 8 и 16 и более предпочтительно равно 10, 12 и 14. Во 2'-положении m предпочтительно равно 14. Во 2'положении m предпочтительно равно 10. В положении 3' m предпочтительно равно 12. Группы R1', R2' иR3', таким образом, предпочтительно представляют собой -О-ацильные группы из додекановой кислоты,тетрадекановой кислоты или гексадекановой кислоты. Когда все R1', R2' и R3' являются -H, тогда 3D-MPL имеет только 3 ацильные цепочки (по одной в-3 012212 каждом из положений 2, 2' и 3'). Когда только два из R1', R2' и R3' являются -H, тогда 3D-MPL может иметь 4 ацильные цепочки. Когда только один из R1', R2' и R3' является -H, тогда 3D-MPL может иметь 5 ацильных цепочек. Когда ни один из R1', R2' и R3' не является -H, тогда 3D-MPL может иметь 6 ацильных цепочек. 3D-MPL в виде адъюванта, применяемый в соответствии с изобретением, может быть смесью этих форм с 3-6 ацильными цепочками, но предпочтительнее включать 3D-MPL с 6 ацильными цепочками в смесь и, в частности, обеспечивать, чтобы форма, содержащая 6 ацильных цепочек, составляла по меньшей мере 10% (мас.) общего 3D-MPL, например, 20%, 30%, 40%, 50% или более. Найдено, что 3D-MPL с 6 ацильными цепочками является наиболее адъювант-активной формой. Таким образом, наиболее предпочтительной формой 3D-MPL для включения в композиции изобретения является Когда 3D-MPL используется в форме смеси, тогда ссылки на количества или концентрации 3D-MPL в композиции изобретения относятся к комбинированным разновидностям 3D-MPL в смеси. В водных условиях 3D-MPL может формировать мицеллярные агрегаты или частицы различного размера, например, с диаметром 150 нм или 500 нм. Тот или другой, или оба могут использоваться в изобретении, и лучшие частицы могут быть выбраны с помощью обычного анализа. Более мелкие частицы (например, достаточно маленькие, чтобы давать чистую водную суспензию 3D-MPL) являются предпочтительными для применения в соответствии с изобретением, потому что их активность выше [20]. Предпочтительные частицы имеют среднее значение диаметра меньше чем 150 нм, более предпочтительно менее, чем 120 нм и могут даже иметь средний диаметр менее чем 100 нм. В большинстве случаев, однако, значение диаметра не будет ниже, чем 50 нм. Когда 3D-MPL адсорбирован фосфатом алюминия, тогда невозможно измерить размер частиц 3DMPL непосредственно, но размер частиц может быть измерен перед адсорбцией. Диаметр частиц может быть оценен с помощью общепринятого метода динамического светового рассеивания, который показывает средний диаметр частиц. Когда указано, что частица имеет диаметр х нм, то по большей части распределение частиц будет приблизительно этого значения, но по меньшей мере 50% числа (например 60%, 70%, 80%, 90% или больше) частиц будут иметь диаметр в пределах интервала х 25%. Необязательный антиген Адъювантная система изобретения является предпочтительно использующейся в сочетании с антигеном для того, чтобы повысить иммунные ответы, что достигается введением антигена. Предпочтительными антигенами для применения с адъювантной системой изобретения являются вирусные антигены, такие как выбранные из антигенов вируса гепатита В (HBV), вируса папилломы человека (HPV) или вируса простого герпеса (HSV). Адъювантная система является также подходящей для использования вместе с паразитарными антигенами, такими как из Plasmodium falciparum. Антигенная концентрация между 5 50 мкг/мл является типичной, например между 10-30 мкг/мл,между 15-25 мкг/мл или приблизительно 20 мкг/мл. Количество антигена на дозу между 5 мкг/доза и 50 мкг/доза также типично, например между 10-30 мкг/доза, между 15-25 мкг/доза или приблизительно 20-4 012212 мкг/доза. Антиген является предпочтительно адсорбированным фосфатом алюминия в виде адъюванта. Процентное содержание конкретного антигена в композиции, который адсорбирован, составляет предпочтительно по меньшей мере 50% (мас.), например 60%, 70%, 80%, 90%, 95%, 98% или выше, например до 100%. Процентное содержание адсорбированного антигена в композиции может быть легко измерено посредством отделения адсорбированного вещества от неадсорбированного, например посредством центрифугирования, в котором адсорбированный алюминием антиген будет легко образовывать шарики,в то время как неадсорбированный антиген останется в супернатанте. Количество антигена в супернатанте (например, измеренное с помощью ELISA) может быть вычтено из общего количества антигена в композиции и тогда процентное содержание адсорбированного может быть рассчитано. Предпочтительно, чтобы весь антиген был адсорбирован, т.е. в супернатанте ничего не определяется. Вирус гепатита В является одним из известных агентов, которые вызывают вирусные гепатиты. Вирусная частица HBV состоит из внутреннего ядра, окруженного внешней оболочкой или капсидом, и вирусное ядро содержит вирусную геномную ДНК. Главный компонент капсида представляет собой белок, известный как HBV поверхностный антиген, или, более широко, HBsAg, является 226 аминокислотным полипептидом с молекулярной массой 24 кДа. Все существующие вакцины против гепатита В содержат HbsAg, и когда этот антиген введен в нормальную вакцину, это стимулирует выработку анти-HBsAg антител, которые защищают от заражения HBV. Таким образом, предпочтительным HBV антигеном является HBsAg. HBsAg может быть адсорбирован на фосфате алюминия с использованием способов, описанных в ссылке 12. Адсорбция на фосфат алюминия отличается от хорошо известного продукта ENGERIX (где HBsAg является адсорбированным на гидроксиде алюминия), но является схожей с продуктами HEPACCINE и RECOMBIVAX. Как упомянуто в ссылке 22, фосфат алюминия может быть лучшим адъювантом для HBsAg, чем гидроксид алюминия. Для производства вакцины HBsAg может быть получен двумя путями. Первый способ включает в себя очистку антигена в форме частиц из плазмы хронических носителей гепатита В, так как большое количество HBsAg синтезируется в печени и выбрасывается в кровоток во время HBV инфекции. Второй путь включает экспрессию белка посредством способов рекомбинации ДНК. HBsAg, применяемый в настоящем изобретении, может быть получен любым путем, но предпочтительным является использование HBsAg, который был рекомбинантно экспрессирован. В частности, предпочтительнее полученныйHBsAg посредством экспрессии на дрожжах Saccharomyces cerevisiae. B отличие от нативного HBsAg(например, как в выделенном из плазмы) экспрессированный на дрожжах HBsAg является в общем случае неглюкозилированным, и это более предпочтительная форма HBsAg для использования в изобретении, потому что она обладает более высокой иммуногенностью и может быть получена без риска контаминации продуктами крови. Экспрессированный на дрожжах HBsAg является предпочтительным в форме по существу сферических частиц (средний диаметр приблизительно 20 нм), включающих липидный матрикс, содержащий фосфолипиды. После очистки HBsAg может быть подвергнут диализу (например, с цистеином), который можно использовать для удаления любых ртутных консервантов, таких как тимерозал, который может применяться при получении HBsAg [23]. В добавление к S последовательности, поверхностный антиген может включать все или часть пре-S последовательностей, таких как все или часть пре-S1 и/или пре-S2 последовательностей. Предпочтительным HPV антигеном для использования с изобретением является L1 белок капсида,который может быть собран в форме структур, известных как вирусоподобные частицы (VLPs). VLPs могут быть произведены посредством рекомбинантной экспрессии L1 в дрожжевых клетках (например,S. Cerevisiae) или в клетках насекомых (например, в клетках Spodoptera, таких как S. Frugiperda, или в клетках Drosophila). Для дрожжевых клеток плазмидные переносчики могут нести L1 ген (гены); для клеток насекомых бацилловирусные переносчики могут нести L1 ген (гены). Более предпочтительно композиция включает L1 VLPs из обоих HPV-16 и HPV-18 штаммов. Эта бивалентная комбинация показала высокую эффективность [24]. В добавление к HPV-16 и HPV-18 штаммам также возможно включение L1 VLPs из HPV-6 и HPV-11 штаммов. Использование онкогенной HPV является также возможной. Вакцина может включать 20-60 мкг/мл (например приблизительно 40 мкг/мл) L1 на HPV штамм. Предпочтительным HSV антигеном для использования в изобретении является мембранный гликопротеин gD. Предпочтительно получение gD из HSV-2 штамма (gD антиген). В композиции может использоваться форма gD, в которой С-конечный мембранный якорный участок удален [25], например, усеченныйgD содержит аминокислоты 1-306 природного белка с добавлением аспарагина и глютамина к С-концу. Эта форма белка содержит сигнальный пептид, который расщепляется с получением зрелого белка из 28 3 аминокислот. Удаление якоря позволяет получить белок в растворимой форме. Предпочтительным антигеном P.falciparum для использования с изобретением является основанный на белке циркумспорозоита (CS). Он может принимать форму рекомбинантного белка, представляющего-5 012212 объединение части CS белка с HBsAg, известным как RTS,S или TRAP. RTS является гибридным белком,включающим в себя в основном все С-конец части CS, соединенные через четыре аминокислоты пре-S2 части HBV поверхностного антигена с антигеном HBsAg [26]. Когда экспрессирован на дрожжах (в частности, в S. Cerevisiae) , RTS получают как липопротеиновую частицу (включающую, в частности, фосфолипиды), и когда имеется ко-экспрессия с S антигеном HBV, получается смешанная частица, известная как RTS,S. Соотношение RTS:S приблизительно 1:4 является применимым. TRAP антигены описаны в ссылке 27. Фармацевтические композиции В добавление к адъювантным и антигенным компонентам композиции изобретения могут включать другие компоненты. Эти компоненты могут иметь различные источники. Например, они могут быть представлены в одном из антигенных или адъювантных компонентов, что является применяемым во время производства, или могут быть добавленными раздельно через антигенные компоненты. Предпочтительные композиции изобретения включают в себя один или более фармацевтический носитель (носители) и/или эксципиент (эксципиенты). Контроль тоничности предпочтительно включает в себя физиологическую соль, такую как минеральная соль, например натриевая соль. Хлорид натрия (NaCl) является предпочтительным, который может присутствовать в количестве между 1 и 20 мг/мл. Это может быть представлено во время смешивания адъювантов и во время смешивания антигена с адъювантом(ми). Композиции в общем случае будут иметь осмоляльность между 200 мОсм/кг и 400 мОсм/кг, предпочтительно между 240-360 мОсм/кг, и будет еще более предпочтительно сужение интервала до 290-300 мОсм/кг. Осмоляльность, по предварительным сообщениям, не имеет влияния на возникновение боли при вакцинации [28], но сохранение осмоляльности в этом интервале является, тем не менее, предпочтительным. Композиции изобретения могут содержать один или более буферов. Типичные буферы включают в себя: фосфатный буфер, Трис-буфер, боратный буфер, сукцинатный буфер или цитратный буфер. С целью избежать конкуренции между фосфатными группами в буфере и в 3D-MPL, другие буферы могут быть предпочтительнее фосфатного. Буферы будут включаться в интервале 5-29 мМ. рН композиции изобретения в общем случае будет между 5,0 и 7,5 и чаще всего между 5,0 и 6,0 для оптимальной стабильности или между 6,0 и 7,0. Соответствующие адсорбированные типы антигенов, конечные вакцинные продукты могут быть суспензией с появлением мутности. Это означает, что микробная контаминация не является легко определяемой и, таким образом, предпочтительно включение в вакцину антимикробного вещества. Это особенно важно, когда вакцина является упакованной в мультидозовые контейнеры. Предпочтительными антимикробными веществами для включения являются 2-феноксиэтанол и тимерозал. Предпочтительно,тем не менее, не использовать ртутные консерванты (например, тимерозал) в осуществлении способа изобретения. Однако присутствие следовых количеств может быть неизбежным, если антиген был подвергнут воздействию таких консервантов до использования в получении композиции изобретения. Для безопасности, как бы то ни было, предпочтительно, чтобы конечная композиция содержала менее чем приблизительно 25 нг/мл ртути. Предпочтительнее, чтобы конечный вакцинный продукт не содержал определяемый тимерозал. Это, в общем случае, может быть достигнуто посредством удаления ртутного консерванта из антигенного препарата перед их добавлением в способе изобретения или посредством избегания добавления тимерозала во время получения компонентов, использующихся для получения композиции. Во время производства разведение компонентов дает желаемую конечную концентрацию, обычно будет использоваться WFI (вода для инъекций). Концентрация фосфата алюминия в композиции изобретения, выраженного термином Al3+, является предпочтительной менее чем 5 мг/мл, например 4 мг/мл, 3 мг/мл, 2 мг/мл, 1 мг/мл и т.д. Концентрация 3D-MPL в композиции изобретения является предпочтительно менее чем 200 мкг/мл,например 150 мкг/мл, 125 мкг/мл, 110 мкг/мл, 100 мкг/мл и т.д. Концентрация индивидуального антигена в композиции изобретения предпочтительно составляет менее чем 60 мкг/мл, например 55 мкг/мл, 50 мкг/мл, 45 мкг/мл, 40 мкг/мл и т.д. Композиции изобретения являются предпочтительно вводимыми пациентам в 0,5 мл дозах. Рекомендации 0,5 мл доз будут подразумевать включение обычного различия, например 0,5 мл 0,1 мл, 0,5 мл 0,05 мл и т.д. Предпочтительные композиции имеют приблизительно 50 мкг 3D-MPL и приблизительно 0,5 мг алюминиевого адъюванта на дозу. Изобретение может представлять объем вещества, который пригоден для упаковывания в индивидуальные дозы, которые могут затем распределяться для введения пациентам. Концентрации, упомянутые выше, являются, как правило, концентрациями конечных упакованных доз и,таким образом, концентрация цельной вакцины может быть выше (например, будет уменьшена до конечной концентрации посредством разведения). Композиции изобретения в общем случае будут находиться в водной форме.-6 012212 Другие компоненты, которые могут присутствовать в композициях изобретения, включают: моноолеат полиоксиэтиленсорбитана (Tween 80), который может быть использован для предотвращения агрегации 3D-MPL [20]; сорбит, который также может быть использован для предотвращения агрегации 3DMPL [20]; триэтаноламин, который может быть использован для растворения 3D-MPL; ион триэтиламмония, который также может быть использован для растворения 3D-MPL; лактозу; сахарозу; трегалозу; и/или маннит. Способы изобретения Изобретение предоставляет способ для производства адъювантной композиции изобретения, включающий стадию сочетания: (i) адъюванта фосфата алюминия и (ii) адъюванта 3-О-деацилированного монофосфорилированного липида А. Изобретение также предоставляет способ для производства композиции изобретения, включающий стадию сочетания (i) антигена; (ii) адъюванта фосфата алюминия и (iii) адъюванта 3-О-деацилированного монофосфорилированного липида А. Компоненты (i) , (ii) и (iii) могут быть скомбинированы в любом порядке, но антиген и фосфат алюминия предпочтительно смешивать первыми, затем добавлять 3D-MPL к смеси антиген/фосфат алюминия. В качестве альтернативы, 3D-MPL и фосфат алюминия могут смешиваться первыми и затем антиген добавляется к адъювантной смеси. Изобретение предоставляет способ производства композиции изобретения, включающий стадии: (а) экспрессия антигена в рекомбинантном хозяине; (b) очистка антигена и (с) объединение очищенного антигена с (i) адъювантом фосфата алюминия и (ii) адъюванта 3-O-деацилированного монофосфорилированного липида А. Три компонента, соединенные в стадии (с), могут быть соединены в любом порядке,как описано выше. Предпочтительными рекомбинантными хозяевами являются дрожжи и клетки насекомых, как описано выше. Изобретение представляет способ для производства композиции изобретения, включающий стадии:(а) соединение антигена, адъюванта фосфата алюминия и адъюванта 3-O-деацилированного монофосфорилированного липида А; (b) измерение осмоляльности композиции и, если осмоляльность выходит за пределы интервала 200-400 мОсм/кг, (с) регулирование осмоляльности в пределах 200-400 мОсм/кг. Регулирование может включать добавление физиологической соли, такой как натриевая соль, например натрия хлорид. Изобретение представляет способ для производства композиции изобретения, включающий стадии:(а) соединение антигена, адъюванта фосфата алюминия и адъюванта 3-O-деацилированного монофосфорилированного липида А; (b) измерение рН композиции и, если рН выходит за пределы интервала 5,07,0, (с) регулирование в пределах 5,0-7,0. Регулирование может включать добавление кислоты или основания. Изобретение также представляет способ для производства композиции изобретения, включающий стадии сочетания (i) антигена; (ii) адъюванта фосфата алюминия и (iii) адъюванта 3-О-деацилированного монофосфорилированного липида А, где адъювант 3-О-деацилированного монофосфорилированного липида А в компоненте (iii) представляет собой форму частиц, имеющих диаметр менее чем 150 нм. Компоненты (i), (ii) и (iii) могут быть смешаны в любом порядке. Компонент (iii) может дополнительно содержать моноолеат полиоксиэтиленсорбитана и/или сорбит. После соединения антигена и адъювантов способ изобретения может включать стадию экстракции и упаковывания 0,5 мл образцов смеси в контейнеры. В мультидозовых ситуациях мультидозовые количества будут экстрагированы и упакованы вместе в один контейнер. Способы изобретения могут включать в себя дополнительную стадию упаковывания вакцины в контейнеры для использования. Подходящие контейнеры включают в себя флаконы и одноразовые шприцы (предпочтительно стерильные). Упаковка композиций изобретения Композицию изобретения упаковывают во флаконы, которые предпочтительно изготавливать из стекла или пластика. Флакон предпочтительно стерилизуется перед добавлением в него композиции. Чтобы избежать проблем с чувствительными к латексу пациентами, флаконы предпочтительно запечатаны не содержащими латекс пробками. Флакон может содержать единичную дозу вакцины или может содержать более чем одну дозу (мультидозовый флакон), например 10 доз. Когда используется мультидозовый флакон, каждая доза должна быть извлечена стерильной иглой и шприцом в строго асептических условиях, при этом следует избегать контаминации содержимого флакона. Предпочтительными флаконами являются изготовленные из прозрачного стекла. Когда композиция является упакованной в шприц, шприц не будет иметь иглу, скрепленную с ним,хотя отдельная игла может прилагаться и использоваться в комплекте со шприцом. Предпочтительна безопасность игл. Типичны иглы 1-дюймовые 23-размера, 1-дюймовые 25-размера и 5/8-дюймовые 25 размера. Шприцы могут быть представлены с безупаковочными ярлыками, на которых отпечатан номер партии и срок действия содержимого, облегчающими запись хранения. Поршень в шприце предпочтительно имеет пробку, предотвращающую случайное удаление поршня во время аспирации. Шприцы могут иметь латексный каучуковый колпачок и/или поршень. Одноразовые шприцы содержат однократную дозу вакцины. Шприц в общем случае будет иметь колпачок для наконечника, изолирующий наконечник-7 012212 от несвоевременного прикрепления к игле, и колпачок для наконечника является предпочтительно изготовленным из бутилового каучука. Если шприц и игла упакованы раздельно, тогда игла предпочтительно вставляется в колпачок из бутилового каучука. Предпочтителен серый бутиловый каучук. Предпочтительны шприцы, выпускаемые под товарным знаком Tip-Lok. Упаковка в шприцы предпочтительна, так как врач или пациент получают уже наполненные шприцы. Когда используются стеклянные контейнеры (например, шприц или флакон), предпочтительнее использовать контейнеры, изготовленные из боросиликатного стекла, чем из стекла с добавлением натриевой извести. После того, как композиция упакована в контейнер, контейнер может быть помещен в коробки для распространения, например в картонную коробку, и коробка маркируется с указанием деталей вакцины,например торговая марка, перечень антигенов в вакцине (например, гепатит В рекомбинантная и т.д.),хранение контейнера (например одноразовые, заполненные Tip-Lok шприцы или 100,5 мл однократных доз флаконы), доза (например каждый содержит одну 0,5 мл дозу), предупреждения (например,только для употребления взрослыми), дату истечения срока действия, указания и т.д. Каждая коробка может содержать более чем одну упакованную вакцину, например пять или 10 упакованных вакцин(особенно во флаконах). Если вакцина содержится в шприце, тогда на упаковке может быть рисунок шприца. Вакцина может быть упакована вместе (например, в одной коробке) с брошюрой, содержащей подробности относительно вакцины, например инструкцию по применению, подробности антигенов вакцины и т.д. Инструкции могут также содержать предупреждения, например хранить раствор адреналина легко доступным в случае анафилактической реакции вследствие вакцинации и т.д. Упаковочные материалы для вакцин являются предпочтительно стерильными. Упаковочные материалы для вакцин являются предпочтительно апирогенными, например содержат 1 EU (эндотоксиновая единица, стандартное значение) на дозу, предпочтительно 0,1 EU на дозу. Упаковочные материалы для вакцин предпочтительно не содержат глютен. рН любых водных упакованных вакцинных веществ является предпочтительно между 5 и 8, например между 5,5 и 6,5. Способ изобретения может, следовательно, включать этап регулирования рН цельной вакцины до упаковки. Упакованная вакцина предпочтительно хранится при температуре между 2 и 8C. Ее нельзя замораживать. Способы лечения и введения вакцины Композиции изобретения являются пригодными для введения людям, и изобретение предоставляет способ повышения иммунного ответа у пациента, включающий этап введения композиции изобретения пациенту. Изобретение предлагает композицию для применения в медицине. Изобретение предполагает применение (i) антигена; (ii) адъюванта фосфата алюминия; (iii) адъюванта 3-О-деацилированного монофосфорилированного липида А в производстве лекарственного средства для введения пациенту. Способы и применения изобретения особенно подходят для вызывания иммунных ответов после введения пациентам, для защиты против и/или лечения: HBV инфекции, HBS инфекции, генитального герпеса, вызванного HSV, HPV инфекции, генитальных бородавок, вызванных HPV, рака шейки матки,вызванного HPV; и/или малярии. Иммуногенные композиции изобретения являются предпочтительно вакцинами для применения с целью профилактики и/или лечения инфекций. С целью достижения полного эффекта типичный план иммунизации включает введение более чем одной дозы. Например, дозы могут вводиться: в 0 и 6 месяцев (0 время, когда была первая доза); в 0, 1, 2 и 6 месяцев; на 0 день, 21 день, и тогда третья доза - между 6 и 12 месяцем или в 0, 1, 2, 6 и 12 месяцев. Композиции изобретения могут быть введены посредством внутримышечной инъекции, например,в предплечье или ногу. Поскольку композиции изобретения включают основанный на алюминии адъювант, изменение компонентов может происходить во время хранения. Композиция должна быть, следовательно, смешана до введения пациенту. Смешанная композиция будет непрозрачной белой суспензией. Дополнительные антигенные компоненты Кроме HBsAg, HPV L1, HSV gD и/или малярийный антиген, композиции изобретения могут включать один или более других антигенов. Например, они могут включать один или более из: антигена вируса гепатита А; токсина дифтерии; токсина столбняка; инактивированного антигена вируса полимиелита; клеточный антиген коклюша; неклеточный антиген коклюша, содержащий обезвреженный токсин коклюша; волокнистый гемагглютинирующий и, необязательный, 69 кДа антиген; конъюгированный капсульный сахарид H.influenzae типа В, обычно, с токсином столбняка как носителем белка; конъюгированный капсульный сахарид N.meningitidis серогруппы А; конъюгированный капсульный сахаридN.meningitidis серогруппы С; конъюгированный капсульный сахарид N.meningitidis серогруппы Y;-8 012212 конъюгированный капсульный сахарид N.meningitidis серогруппы W135; конъюгированный капсульный сахарид S.pneumoniae. Альтернатива фосфату алюминия Для некоторых случаев применения может быть полезным заменить адъювант фосфата алюминия на адъювант гидроксида алюминия или сочетать адъюванты из гидроксида и фосфата алюминия. В HPV и HSV вакцинах, например, гидроксид алюминия может быть предпочтительнее фосфата алюминия. Вышеперечисленные определения изобретения могут быть изменены соответственно. Термин гидроксид алюминия является общепринятым в данной области, но не исчерпывающе описывает представленное химическое соединение [например, см. главу 9 ссылки 2]. В изобретении можно использовать любые гидроксиды алюминия для адъювантов, которые в общем случае используются как адъюванты, которые являются обычно солями оксигидроксида алюминия, которые обычно,по меньшей мере, частично кристаллические. Оксигидроксид алюминия, который может быть представлен формулой AlO(OH), может быть различен среди других соединений алюминия, таких как гидроксид алюминия Al(OH)3, с помощью инфракрасной (IR) спектроскопии, в частности, наличия полосы поглощения при 1070 см-1 и выраженного плеча при 3090-3100 см-1 [глава 9 ссылки 2]. Степень кристаллизации алюминия гидроксильного адъюванта является отражаемой посредством полосы дифракции пучка на половине высоты (WHH), слабо кристаллизованные части показывают большее уширение линий, обусловленное меньшим размером кристаллов. Площадь поверхности увеличивается с увеличением WHH, и адъюванты с более высоким значениями WHH имеют более высокую способность к адсорбции антигена. Волокнистое строение (например, как видно при трансмиссионной электронной микрографии) является обычным для адъювантов гидроксида алюминия. pI адъювантов гидроксида алюминия обычно приблизительно равно 11, то есть адъювант сам имеет положительный поверхностный заряд при физиологической рН. Сообщается об адсорбционных способностях между 1,8-2,6 мг белка на мг Al при рН 7,4 для адъюванта гидроксида алюминия. Общее Термин содержит включает включает в себя, также как заключает, например, композиция,содержащая X, может заключать в себе только X или может включать в себя что-либо добавочное,например X+Y. Слово по существу не исключает полностью, например, композиция, которая по существу свободна от Y, может быть полностью свободна от Y. Где необходимо, слово по существу может быть не включено в определение изобретения. Термин приблизительно в отношении численных значений означает, например, х 10%. Если специально не оговаривается, способ, включающий этап смешивания двух или более компонентов, не требует какого-либо специфического порядка смешивания. Таким образом, компоненты могут быть смешаны в любом порядке. Где присутствуют три компонента, там два компонента могут объединяться друг с другом, и тогда комбинация может быть объединена с третьим компонентом и т.д. Принимается во внимание, что способные к ионизации группы могут существовать в нейтральной форме, показанной здесь формулой, или могут существовать в заряженной форме, например, зависящей от рН. Таким образом, фосфатная группа может быть изображена как -P-O-(ОН)2, эта формула является единственно отображающей нейтральную фосфатную группу, и другие заряженные формы охватываются изобретением. Подобным образом, сахарные кольца могут существовать в открытой и закрытой формах, и в то время как закрытая форма показана здесь в структурной формуле, открытые формы также включены посредством изобретения. Способы осуществления изобретенияHBsAg, экспрессированный в рекомбинантной S.cerevisiae, является очищенным посредством способа, включающего клеточное восстановление, преципитацию, ультрафильтрацию, гель-проникающую хроматографию, ионный обмен, ультрацентрифугирование и обессоливание. Очищенный антиген является не глюкозилированным и может быть в форме, по существу, сферических частиц (средний диаметр 20 нм). Антиген хранится в фосфатном буферном растворе и адсорбируется на аморфный адъювант фосфата алюминия (между 3-6 мг/мл Al) в течение одного часа при комнатной температуре, при перемешивании. Смесь хранится при комнатной температуре в течение двух недель и затем хранится в холодильнике. Добавляют 3D-MPL в виде адъюванта из Corixa, что обеспечивает адсорбцию адъюванта алюминия фосфата, и любое необходимое разведение до желаемой конечной концентрации антигена достигается использованием воды для инъекций и стерильного физиологического раствора. Цельная вакцина упаковывается в индивидуальные дозы в одноразовые шприцы. Вакцина, произведенная по этому способу, первоначально испытана на здоровых подростках и взрослых. Вакцина вызывает более сильный иммунный ответ (частота серопротекциии 100%, высокое значение GMT), чем ENGERIX В продукт во всех возрастных группах. Для адъювантной смеси алюминия фосфата/3D-MPL показана частота серопротекции 98,6%, когда-9 012212 вакцина вводится по плану из двух доз (0 и 6 месяцев), что является лучше, чем 96,8% показанной при использовании ENGERIX В в 0, 1 и 6 месяцев. GMTs приблизительно 7800 (vs. 3700 с ENGERIX В). После предварительных испытаний, измерения проводились у пациентов перед гемодиализом и уже во время гемодиализа, возраст от 15 и старше (среднее значение возраста 58). Эти пациенты являлись неинфицированными HBV. Однократные дозы этой вакцины (20 мкг HBsAg) являются сравнимыми с двойными дозами ENGERIX В, вводимыми в 0, 1, 2 и 6 месяцев. Частота серопротекции (%) и анти-HBsAg Таким образом, эти вакцины последовательно лучше повышают иммунные ответы у взрослых пациентов, которым проводится гемодиализ, чем лидирующая на рынке вакцина ENGERIX В. Более того, начало протекции является более быстрым (например, 75% пациентов защищены через 3 месяца, 52% с ENGERIX В, р 0,005) и сохраняется дольше. Дополнительное испытание у неинфицированных HBV пациентов, ожидающих трансплантаций печени, обнаружило сходные результаты. Вакцины вводят на 0 день и 21 день (плюс на 7 день дозаENGERIX В) и тогда заключительную дозу - между 6 и 12 месяцами: Степень серопротекции выше при использовании смеси фосфат алюминия/3D-MPL смеси (60% по сравнению с 32% р 0,035). Достаточная безопасность и реактогенность продемонстрирована у всех пациентов. Временный местный дискомфорт выше при применении вакцин изобретения, но быстро проходит, и существует приемлемый побочный эффект по сравнению с терапевтической пользой. Следует понимать, что изобретение описано только путем примеров, и могут быть сделаны модификации, в то же время оставаясь в пределах объема правовой защиты и сущности изобретения. Ссылки (содержание которых включено в описание посредством ссылок)[28] Nony et al. (2001) Vaccine 27:3645-51.-17 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение (i) антигена; (ii) адъюванта фосфата алюминия и (iii) адъюванта 3-Oдеацилированного монофосфорилированного липида А в производстве вакцины для введения пациенту,в которой по меньшей мере 50% 3-О-деацилированного монофосфорилированного липида А адсорбировано на адъюванте фосфата алюминия, причем вакцина предназначена для внутримышечной инъекции,антиген представляет собой HBsAg и вакцина предназначена для введения посредством плана иммунизации с дозами в 0, 1, 2 и 6 месяцев, где 0 является временем первой дозы. 2. Применение по п.1, где вакцина предназначена для защиты от и/или лечения инфекции, вызываемой вирусом гепатита В. 3. Применение по п.1 или 2, где пациентом является пациент перед гемодиализом. 4. Применение по любому из предшествующих пунктов, где HBsAg является неглюкозилированным и в форме, по существу, сферических частиц со средним диаметром приблизительно 20 нм, включающих липидный матрикс, содержащий фосфолипиды. 5. Применение по любому из предшествующих пунктов, где вакцина предназначена для применения в 0,5 мл дозе. 6. Применение по любому из предшествующих пунктов, где вакцина содержит приблизительно 20 мкг HBsAg в дозе. 7. Применение по любому из предшествующих пунктов, где вакцина содержит приблизительно 50 мкг 3-О-деацилированного монофосфорилированного липида А и приблизительно 0,5 мг фосфата алюминия (выраженного термином Al3+) в дозе. 8. Применение по любому из предшествующих пунктов, где по меньшей мере 50% HBsAg адсорбировано на адъюванте из фосфата алюминия. 9. Применение по любому из предшествующих пунктов, где антиген HBsAg экспрессирован на дрожжах. 10. Применение по п.9, где дрожжи являются Saccharomyces cerevisiae. 11. Применение по любому из предшествующих пунктов, где 0,5 мл дозы вакцины содержит приблизительно 50 мкг 3-O-деацилированного монофосфорилированного липида А, приблизительно 0,5 мг фосфата алюминия (выраженного термином Al3+) и приблизительно 20 мкг/мл HBsAg. 12. Применение по п.1 или 2, где пациент является взрослым человеком, которому проводят гемодиализ. 13. Применение по любому из предшествующих пунктов, где композиция упакована в шприц, причем шприц изготовлен из боросиликатного стекла. 14. Применение по любому из предшествующих пунктов, где адъювант 3-O-деацилированного монофосфорилированного липида А содержит смесь ацилированных дисахаридов, где каждый дисахарид:(а) имеет две -1',6-связанные 2-деокси-2-аминоглюкозные моносахаридные субъединицы; (b) является фосфорилированным по 4' положению; (с) является незамещенным по 1, 3 и 6' положениям, (d) является О-ацилированным по 3' положению и (е) является N-ацилированным по 2 и 2' положениям, и где смесь ацилированных дисахаридов включает по меньшей мере 10 мас.% компонента, в котором каждая из ацильных групп во 2, 2' и 3' положениях является самостоятельно замещенной по алифатическому углеродному атому О-ацильной группой. 15. Применение по любому из предшествующих пунктов, где вакцина дополнительно содержит ион триэтиламмония. 16. Применение по любому из предшествующих пунктов, где по меньшей мере 95% 3-Одеацилированного монофосфорилированного липида А адсорбировано на адъюванте фосфата алюминия. 17. Применение по любому из предшествующих пунктов, где адъювант фосфата алюминия является аморфным. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 39/39, A61P 31/00
Метки: алюминия, композиция, фосфат, адъювантная, содержащая, 3d-mpl
Код ссылки
<a href="https://eas.patents.su/12-12212-adyuvantnaya-kompoziciya-soderzhashhaya-fosfat-alyuminiya-i-3d-mpl.html" rel="bookmark" title="База патентов Евразийского Союза">Адъювантная композиция, содержащая фосфат алюминия и 3d-mpl</a>
Предыдущий патент: Гетероароматические соединения хинолинов и их применение в качестве ингибиторов pde10
Следующий патент: Способ получения si путем восстановления sicl4 жидким zn
Случайный патент: Ректальные и вагинальные суппозитории