Аттенуированный рекомбинантный вирус герпеса крупного рогатого скота типа i, вакцина на его основе и способ выявления животных, которым была введена такая вакцина
Формула / Реферат
1. Аттенуированный рекомбинантный вирус герпеса крупного рогатого скота типа I, представляющий собой вирус герпеса крупного рогатого скота типа I, в котором часть нативной кодирующей области гликопротеина E удалена и заменена генетической вставкой, включающей кодирующую область чужеродного гена b-галактозидазы и немедленный ранний промотор цитомегаловируса человека, при этом данный рекомбинантный вирус способен экспрессировать b-галактозидазу в клетке-хозяине.
2. Вирус по п.1, в котором генетическая вставка дополнительно включает энхансерные последовательности указанного немедленного раннего промотора цитомегаловируса человека.
3. Вирус по п.2, в котором удалено приблизительно две трети нативной кодирующей области гликопротеина E.
4. Вирус по п.2, в котором генетическая вставка связана с сайтами полиаденилирования SV40.
5. Вирус по п.1, в котором чужеродный ген b-галактозидазы экспрессируется как аутентичный ген, кодируемый вирусом герпеса крупного рогатого скота типа I.
6. Вирус по п.1, в котором отсутствие части нативной кодирующей области гликопротеина E служит в качестве генотипического маркера.
7. Вирус по п.1, в котором экспрессированная в клетке-хозяине b-галактозидаза служит в качестве фенотипического маркера.
8. Вирус по п.1, в котором отсутствие части нативной кодирующей области гликопротеина E служит в качестве иммунологического маркера.
9. Вирус по п.1, в котором кодирующая область гена b-галактозидазы экспрессируется в клетке-хозяине как на ранней, так и на поздней стадиях инфекции.
10. Вирус по п.1, депонированный под номером ATCC VR-2637.
11. Рекомбинантная вакцина, обладающая активностью в отношении индуцирования антител, нейтрализующих вирус герпеса крупного рогатого скота типа I, включающая аттенуированный рекомбинантный вирус по любому из пп.1-10.
12. Способ выявления животных, которым была введена рекомбинантная вирусная вакцина по п.11, включающий следующие стадии:
(а) получение образца жидкости или образца ткани от животного;
(б) анализ образца;
(в) обнаружение в образце аттенуированного рекомбинантного вируса и
(г) определение данного животного как вакцинированного - по результатам упомянутой стадии обнаружения.
13. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает анализ на присутствие b-галактозидазы.
14. Способ по п.13, отличающийся тем, что обнаружение на стадии (в) основывается на наличии экспрессии b-галактозидазы.
15. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает анализ на гуморальный иммунный ответ, специфичный для гликопротеина E указанной рекомбинантной вирусной вакцины.
16. Способ по п.15, отличающийся тем, что определение на стадии (г) основывается на наличии гуморального иммунного ответа, специфичного для гликопротеина E указанной рекомбинантной вирусной вакцины.
17. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает in situ гистохимические методы обнаружения активности фермента b-галактозидазы.
18. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает in situ иммуно-гистохимические методы обнаружения белка b-галактозидазы.
19. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает иммуноблоттинг для обнаружения белка b-галактозидазы.
20. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает in situ гистохимические методы обнаружения гликопротеина E указанного аттенуированного рекомбинантного вируса.
21. Способ по п.12, отличающийся тем, что выявляют животных, которым была введена рекомбинантная вирусная вакцина, содержащая аттенуированный вирус по п.10.
22. Плазмида, депонированная под номером ATCC 203607, которая может быть использована для получения рекомбинантного вируса по п.10.
23. Способ иммунизации крупного рогатого скота против вируса герпеса крупного рогатого скота типа I, включающий вакцинацию упомянутого крупного рогатого скота рекомбинантной вирусной вакциной по п.11.
24. Способ по п.12, отличающийся тем, что рекомбинантная вирусная вакцина содержит аттенуированный вирус по п.10.
Текст
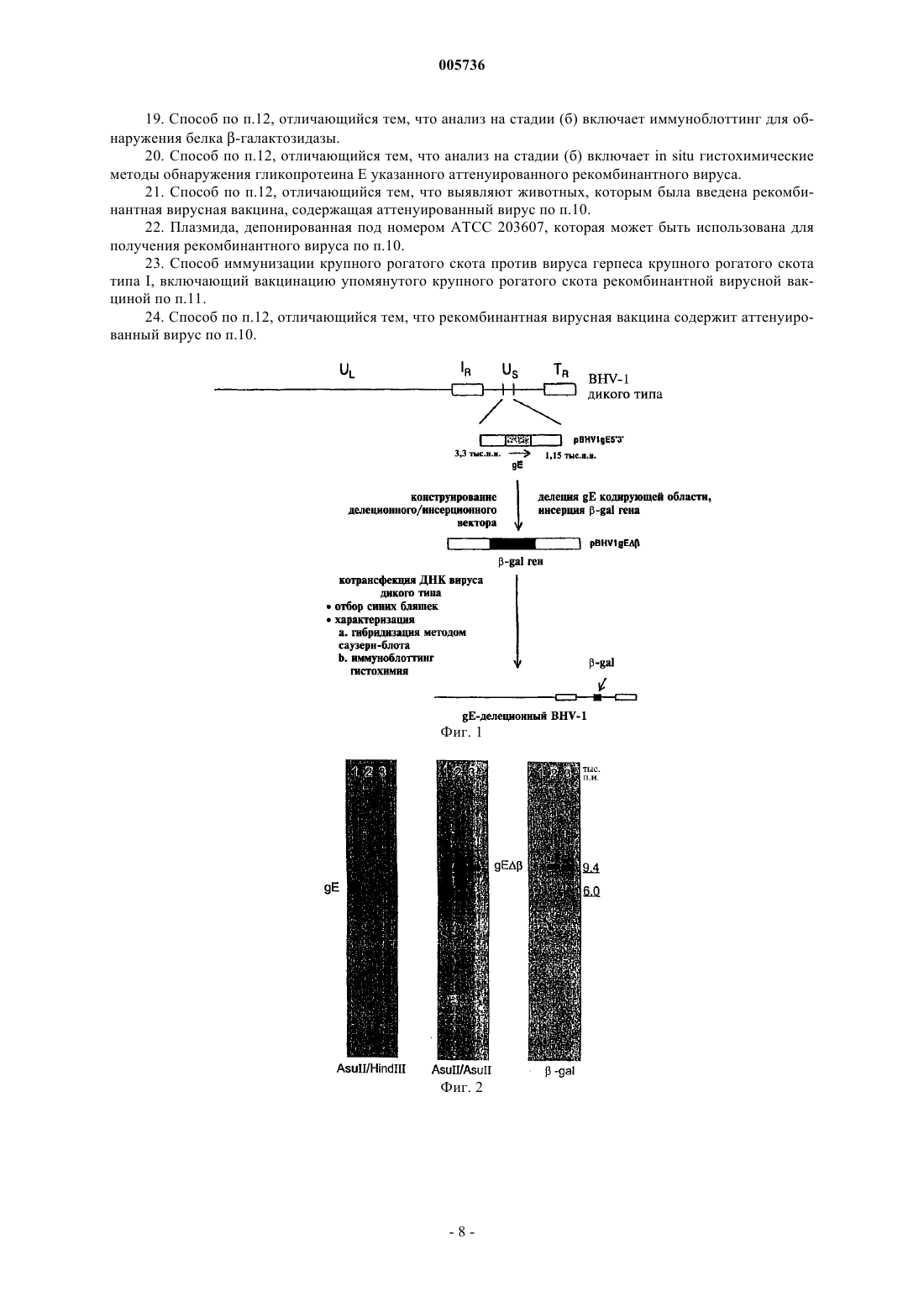
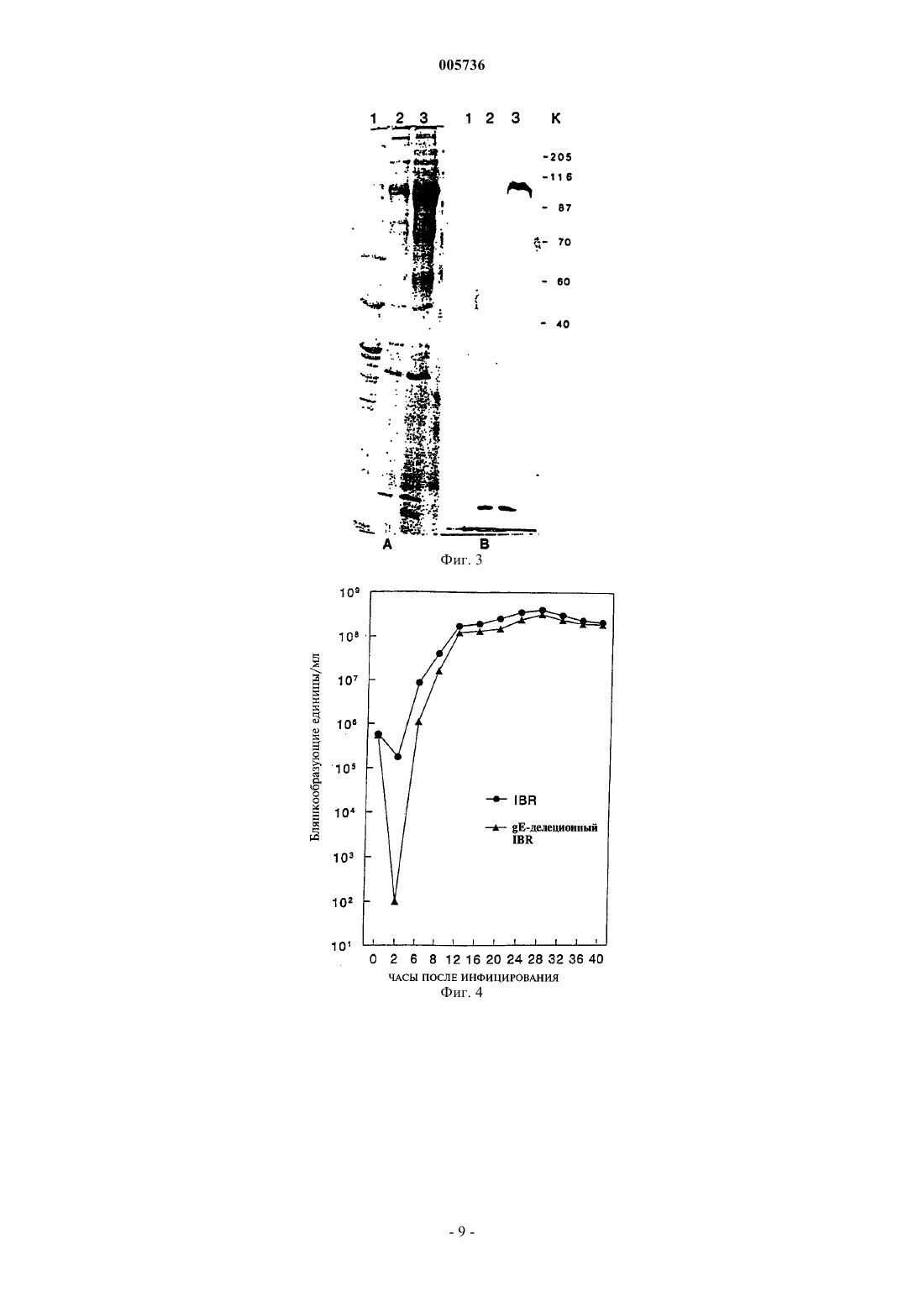
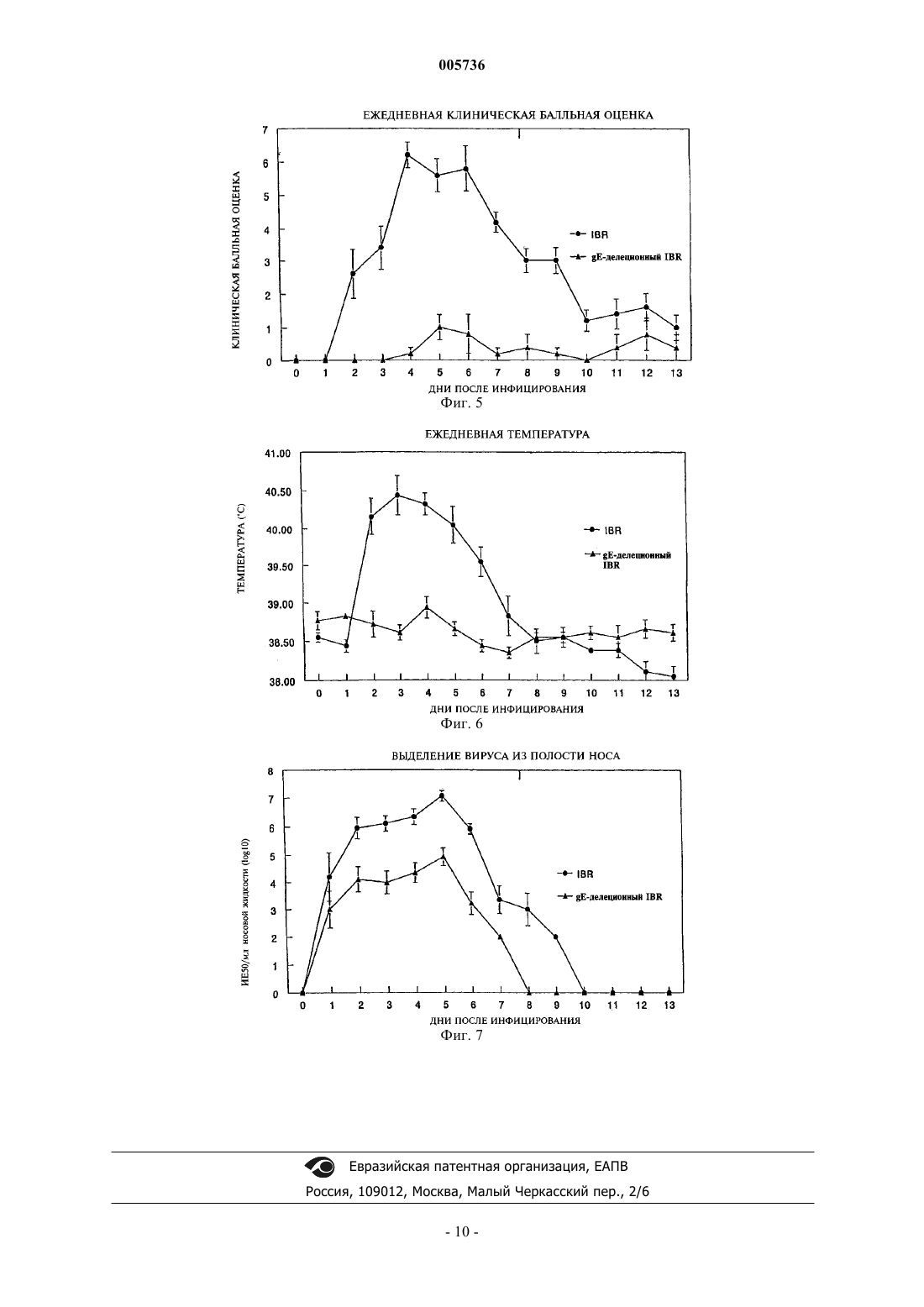
005736 Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение в широком смысле относится к вакцинам на основе рекомбинантного вируса герпеса крупного рогатого скота и соответствующим способам. В частности, настоящее изобретение в соответствии с предпочтительным вариантом относится к конструированию аттенуированного рекомбинантного вируса герпеса крупного рогатого скота типа 1 (BHV-1), в котором часть нативной кодирующей области гликопротеина Е (gE) удалена и на ее место вставлен функциональный ген -галактозидазы(-gal). Делеция нативной кодирующей области gE вызывает ослабление вирулентности упомянутого вируса и служит в качестве генотипического или иммунологического маркера, который позволяет отличить инфекцию gE-делеционного рекомбинантного вируса от инфекции, вызванной вирусом дикого типа. В дополнение к этому, инсерция упомянутого -gal гена обеспечивает получение фенотипического метода анализа на присутствие инфекции, обусловленной gE-делеционным рекомбинантным вирусом,посредством экспрессии -gal активности в клетках-хозяевах. Описание известного уровня техники Вирус герпеса крупного рогатого скота типа 1 (BHV-1), известный также как вирус инфекционного ринотрахеита крупного рогатого скота (IBRV), связан с различными клиническими заболеваниями, в том числе с ринотрахеитом, конъюнктивитом, инфекциями половых путей и, иногда, абортами, энтеритами,энцефалитами и генерализованными инфекциями крупного рогатого скота. Геном BHV-1 включает линейную двухцепочечную молекулу ДНК длиной около 140 тыс.п.н. Она состоит из уникального длинного (UL) участка и уникального короткого (US) участка, которые фланкируются внутренним и концевым инвертированным повторами (IR и TR, соответственно). Геном BHV-1 кодирует приблизительно 70 белков (Мисра(Misra) и другие, Proteins Specified Bovine Herpesvirus 1 (Infectious Bovine Rhinotracheitis, 40 J. Virol. 367378 (1981. Подобно некоторым другим вирусам герпеса животных, геном BHV-1 кодирует ген гликопротеина (g) gE. Имеется сообщение о последовательностях гена gE BHV-1, который кодирует 575 аминокислотных остатков, для двух различных штаммов (Ланг-Тек П. (Leung-Taek P.) и другие, The CompleteGene From HSV-1, 149 Gene 203-209 (1994. Предсказанные gE аминокислоты включают участки гидрофобных аминокислот на N-концевой области (предполагаемая сигнальная последовательность) и возле С-концевой области (трансмембранная последовательность), что является типичным для интегральных белков мембраны класса I. Было показано, что gE BHV-1 и его гомологи у других вирусов герпеса не являются обязательными для репликации in vitro, однако, следствием делеции всей кодирующей последовательности gE генома вируса псевдобешенства (PRV) является как сниженная вирулентность живых вакцинных штаммов Norden и Bartha (Петровскиc Е.А. (Petrovskis E.A.) и другие, Deletion in VaccineVirol. 3032-3041 (1992. Таким образом, экспрессия упомянутого гена gE необходима для полного патогенного потенциала вирусов у животных, но не нужна для роста в культуре клеток ткани (Критас (Kritas) и другие, Invasion and Spread of Single Glycoprotein Deleted Mutants of Aujeszky's Disease Virus (ADV) inDisease Virus in the Olfactory Nervous Pathway of the Pig, 75 J. General Virol. 2319-2327 (1994. Недавно мутанты PRV и IBR, делеционные по гену gE, вызвали интерес благодаря своей пригодности в качестве дифференциальных маркерных вакцин. В настоящее время gE-делеционная маркерная вакцина используется при искоренении IBR в Европе. Однако у упомянутого gE-делеционного вакцинного штамма в Европе отсутствует -gal маркер, который обеспечивает возможность применения in situ гистохимических методов для обнаружения активности -gal фермента и in situ гистохимических методов либо методов иммуноблоттинга для обнаружения -gal белка. Упомянутая кодирующая область -gal служит также в качестве генотипического маркера упомянутого рекомбинантного вируса. Упомянутый вирус может легко обнаруживаться саузерн-блот-гибридизацией, и с помощью полимеразно-цепной реакции (PCR) также можно легко отличить генетически чистый вакцинный вирус от вируса дикого типа. Таким образом, необходим авирулентный gE-делеционный штамм IBRV, в состав которого входил бы подходящий фенотипический/гистохимический/генотипический -gal маркер. Краткое изложение сущности изобретения Сконструировали рекомбинантный вирус BHV-1 (gE3.1IBR), у которого открытые рамки считывания (ORF's), включающие часть последовательностей, кодирующих ген gE, были удалены и на их место вставлен химерный (рекомбинантный) репортерный/маркерный ген. Упомянутый вставленный ген галактозидазы (-gal) не играет регуляторной роли в репликации упомянутого вируса, однако, служит в качестве фенотипического маркера для вируса gE3.1IBR.-1 005736 Для конструирования упомянутого рекомбинантного BHV-1 клонировали кодирующую область гена gE BHV-1 и фланкирующие последовательности 3'-5' и 5'-3' дирекционного типа. Для создания делеции в упомянутой кодирующей области гена gE вышеупомянутую клонированную ДНК расщепляли с помощью подходящих ферментов для выделения двух третей аминоконцевой последовательности этой области и лигирования с упомянутым -gal геном. Полученную плазмидную ДНК котрансфектировали с ДНК первичного вируса IBR дикого типа (штамм Cooper) в клетки MDBK (культура клеток почек крупного рогатого скота линии Madin-Darby). Рекомбинантные вирусы, экспрессирующие -gal (синие бляшки), очищали с вирусными нуклеиновыми кислотами в бляшках и подвергали дополнительному анализу посредством блот-гибридизации для определения генетических характеристик и посредством иммуноблоттинга для определения реакционной способности против BHV-1 gE-специфичных кроличьих поликлональных антител. Один из рекомбинантных вирусов, gE3.1IBR, характеризовали in vitro в отношении его ростовых свойств и in vivo на телятах в отношении его патогенных свойств. Способность упомянутого рекомбинантного вируса к индуцированию BHV-1 нейтрализующих антител у вакцинированных телят исследовали посредством реакции подавления бляшкообразования. Регуляция и экспрессия упомянутого химерного гена -gal уникальна для этого рекомбинантного вируса BHV-1 в двух отношениях. Первый уникальный аспект этого рекомбинантного вируса заключается в том, что упомянутый -gal ген регулируется активным немедленным ранним промотором цитомегаловируса человека (HCMV-IE) (а не регуляторной последовательностью, полученной от BHV-1). Второй уникальный аспект заключается в том, что упомянутый ген экспрессируется как BHV-1-кодируемый ген как на ранней, так и на поздней стадиях инфекции. Свойства in vitro и in vivo упомянутого gEделеционного рекомбинантного вируса анализировались посредством сравнения его с родительским штаммом IBRV Cooper. В экспериментах с культивированием на клетках тканей вирус gE3.1IBR на начальной стадии после вакцинации рос с более низким титром, чем вирус дикого типа (родительский штамм Cooper), однако, на более поздних стадиях после вакцинации упомянутый рекомбинантный вирус рос почти с таким же титром, что и штамм дикого типа. Упомянутый рекомбинантный вирус, как правило, образовывал значительно меньшие бляшки по сравнению с бляшками родительского штамма дикого типа Cooper. Это может объясняться отсутствием межклеточного распространения вируса и соответствует результатам,полученным для других вирусов герпеса. В экспериментах на животных телята, которым был введен gE3.1IBR, в течение периода выделения вируса выделяли приблизительно в 100 раз меньше вируса по сравнению с телятами, инфицированными родительским штаммом Cooper. Продолжительность выделения вируса была также на 2 дня короче у телят, которым был введен gE3.1IBR. В то время как телята, которым был введен вирус gE3.1IBR,оставались здоровыми, у телят, инфицированных родительским штаммом Cooper, наблюдались типичные для IBR симптомы и поражения. Результаты реакции сывороточной нейтрализации показали, что как у телят, инфицированных вирусом дикого типа, так и у телят, которым был введен gE-делеционный вирусIBR, развивались сопоставимые сывороточные титры BHV-1 нейтрализующих антител. Ранее сообщалось, что IBRV, делеционный по гену тимидинкиназы (ТК), рос как in vitro, так и in vivo со значительно более низким титром (Чоудхари С.И. (Chowdhury S.I.), Construction and Characterization of an AttenuatedBovine Herpesvirus Type 1 (BHV-1) Recombinant Virus, 52 Vet. Microbiol. 13-23 (1996. Эти результаты в обобщенном виде указывают на то, что, даже несмотря на то, что упомянутый рекомбинантный вирусgE3.1IBR растет относительно хорошо по сравнению с ТК-делеционным вирусом IBR, вирусgE3.1IBR был фактически авирулентным для телят. Аттенуированные свойства, демонстрируемые рекомбинантным вирусом gE3.1IBR, напоминают свойства, полученные 1) делецией ТК у BHV-1, как было показано Чоудхари С.И. (Chowdhury S.I.) в статье "ConstructionMicrobiol. 13-23 (1996; 2) делецией gE у PRV, как было показано Критас (Kritas) и другими в статье "Invasion and Spread ofOlfactory Nervous Pathway of the Pig" (75 J. General Virol. 2319-2327 (1994; и 3) европейским gE-делеционным IBRV вакцинным изолятом, как показали Каашек (Kaashoek) и другие в статье "An Inactivated Vaccine Based on a Glycoprotein E-Negative Strain of Bovine Herpesvirus 1Virol. 2387-2392 (1994. Результаты этого исследования также показали, что делеция упомянутых gE ORF последовательностей и инсерция функционального -gal гена в gE локус упомянутого вируса стабильно аттенуировала этот вирус. Практическое применение этого вируса заключается в его использовании в качестве безопас-2 005736 ной живой вакцины, направленной против IBR. Делеция упомянутого gE гена будет служить в качестве иммунологического маркера для различения вакцинированных и инфицированных животных. В дополнение к этому, продуцирование -gal обеспечивало бы возможность легкой оценки репликации вирусаgE3.1IBR в эпителии полости носа вакцинированных животных по сравнению с используемым в настоящее время в Европе gE-делеционным вакцинным штаммом, у которого отсутствует этот фенотипический -gal маркер, а также для отличения ее от инфекции, вызванной вирусом IBR дикого типа. Краткое описание фигур На фиг. 1 представлена схема последовательности операций конструирования gE-делеционного вируса BHV-1 (gE3.1IBR) и инсерционной/делеционной векторной плазмиды, включающей функциональный -gal ген, замещающий две трети аминоконцевого участка упомянутой кодирующей области gE; на фиг. 2 представлено воспроизведение саузерн-блот-гибридизации для предназначенной делеции кодирующей области gE и инсерции -gal последовательностей в gE локус; на фиг. 3 показан BHV-1 gE белок, обнаруженный у родительского штамма дикого типа Cooper, но не обнаруженный у gE-делеционного рекомбинантного вируса (gE3.1IBR); фиг. 4 представляет собой график, иллюстрирующий результаты одноэтапного эксперимента с выращиванием, на котором сравнивается скорость роста gE-делеционного вируса IBR со скоростью роста вируса IBR дикого типа в клетках MDBK; каждая экспериментальная точка представляет среднее значение результатов, полученных в каждой группе телят; фиг. 5 представляет собой график, на котором сравниваются ежедневные клинические балльные показатели телят, которым был введен gE-делеционный вирус IBR, с ежедневными клиническими балльными показателями телят, инфицированных вирусом IBR дикого типа; каждая экспериментальная точка представляет среднее значение результатов, полученных в каждой группе телят; фиг. 6 представляет собой график, на котором сравниваются ежедневные ректальные температуры телят, которым был введен gE-делеционный вирус IBR, с ежедневными ректальными температурами телят, инфицированных вирусом IBR дикого типа; каждая экспериментальная точка представляет среднее значение результатов, полученных в каждой группе телят; и фиг. 7 представляет собой график, на котором сравнивается выделение из полости носа в случае gEделеционного вируса IBR с выделением из полости носа в случае вируса IBR дикого типа; каждая экспериментальная точка представляет среднее значение результатов, полученных в каждой группе телят. Подробное описание предпочтительного варианта осуществления изобретения В представленных далее примерах приведено описание конструирования инфекционного рекомбинантного BHV-1, имеющего удаленную нативную кодирующую область gE, что ослабляет вирулентность упомянутого вируса, и имеющего функциональный -gal ген, вставленный в локус gE, способа иммунизации животных против заболеваний, вызываемых BHV-1, с использованием упомянутого рекомбинантного BHV-1 в качестве вакцины, а также способов обнаружения и различения как генотипически, так и фенотипически инфекции, вызванной у животных упомянутым рекомбинантным вирусом и вирусом дикого типа. Эти примеры приведены лишь с иллюстративными целями, и их не следует принимать в качестве ограничения общего объема настоящего изобретения. Пример 1. Материалы и методы. В этом примере приведено описание получения и характеризации рекомбинантного IBRV, делеционного по гену gE и экспрессирующего -галактозидазу. В состав упомянутого сконструированного рекомбинантного вируса входит химерный ген (длиной 4,5 тыс.п.н.), замещающий gE кодирующую область BHV-1. Упомянутый химерный ген в предпочтительном варианте включает HCMV-IE промотор и его энхансерные последовательности, связанные с кодирующими последовательностями гена -gal, которые связаны с сайтами полиаденилирования SV40. Упомянутые -gal кодирующие последовательности в предпочтительном варианте являются бактериальными, полагают, однако, что пригодными будут любые кодирующие последовательности -gal гена. Для конструирования и характеризации рекомбинантного BHV-1 из Американской коллекции типовых культур (American Type Culture Collection) был получен штамм IBRV Cooper (Colorado-1). Вирусы размножали и титровали в клетках почек крупного рогатого скота линии Madin-Darby по методу Чоудхари С.И. (Chowdhury S.I.), Molecular Basis of Antigenic Variation Between Glycoprotein С (gC) of RespiratoryBovine Herpesvirus 1 (BHV-1) and Neurovirulent BHV-5, 213 Virology 558-568 (1995), который включен в настоящее описание как ссылка. Вирусную ДНК выделяли с помощью додецилсульфата натрия и лизиса белка К, экстрагирования смесью фенола/хлороформа и осаждения этанолом согласно описанию метода,приведенному в статье Чоудхари (Chowdhury) и других, Equine Herpesvirus Type 1 (EHV-1) Induced Abortionsand Paralysis in a Lipizzanner Stud: A Contribution to the Classification of Equine Herpesviruses, 90 Arch. Virol. 273-288 (1986), который включен в настоящее описание как ссылка.BHV-1 gE-специфичную антипептидную кроличью поликлональную сыворотку синтезировали, исходя из предсказанной региональной гидропатичности и антигенности. Синтезировали упомянутый пептид gE, включающий остатки 378-398, как описали Ланг-Тек П. (Leung-Taek P.) и другие, The CompleteDNA Sequence and the Genetic Organization of the Short Unique Region (US) of the Bovine Herpesvirus Type 1 Strain (ST strain), 199 Virology 409-421 (1994), последовательность и генетическая организация которого включена в настоящее описание как ссылка. Синтезирование упомянутого пептида gE было осуществлено по методу с использованием 9-флуоренилметоксикарбонила (FMOC), описание которого приведено в статье Абдельмагид (Abdelmagid) и других, Fine Mapping of Bovine Herpesvirus-1 (BHV-1) GlycoproteingD, 206 Virology 242-253 (1995), и включено в настоящее описание как ссылка. Для облегчения конъюгации с гемоцианином лимфы улитки (KLH) к С-концевой области упомянутого пептида был добавлен дополнительный посторонний цистеин (С) (помеченный значком ). Упомянутый 17-членный пептид[H]-TSDRLVRAVTDHTRPEC-[OH] присоединяли к гемоцианину лимфы улитки и антисыворотки получали по описанию метода, которое было приведено в статье Кайт Дж. (Kyte J.), Дулитл Р.Ф. (DoolittleR.F.), A Simple Method for Displaying the Hydropathic Character of Protein, 157 J. Mol. Biol. 105-132 (1982),и которое включено в настоящее описание как ссылка. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия и вестерн-блот псевдо- и вирус-инфицированных клеточных белков осуществляли в восстанавливающих условиях, как описано в статьях Чоудхари С.И. (Chowdhury S.I.), Molecular Basis of Antigenic Variation Between Glycoprotein СT4, 227 Nature (London) 680-685 (1970); оба упомянутых метода включены в настоящее описание как ссылка. Конструирование рекомбинантных плазмид было осуществлено с помощью плазмид pBHV1HK иpBHV1HF, полученных от доктора В. Лоуренса (W. Lawrence) (U. Pennsylvania, Филадельфия, США). Упомянутые плазмиды включали, соответственно, фрагменты HindIII-K и HindIII-F ДНК BHV-1. Субфрагмент XhoI/HindIII (4,4 тыс.п.н.) плазмиды pBHV1HK, содержащий gD, gI в полном объеме, и часть, в предпочтительном варианте две трети, аминоконцевого участка gE-кодирующей области, субклонировали на сайтах XhoI/HindIII плазмиды pGEM7Z (pBHV1gE5'). Далее, фрагмент HindIII/Bsu36I (1,15 тыс.п.н.) (с"тупыми" (дефосфорилированными) концами) pBHV1HF, включающий карбоксиконцевую треть gEкодирующей области и кодирующую последовательность US9 ORF в полном объеме, субклонировали на сайтах HindIII/HincII плазмиды pBluescript KS (pBHV1gE3'). И, наконец, для сборки кодирующей области гена gE в полном объеме и фланкирующих последовательностей фрагмент (4,4 тыс.п.н.) векторного сайта HindIII/XbaI pBHV1gE5', включающий фрагмент HindIII/XhoI, клонировали на сайтах HindIII/XbaI плазмиды pBHV1gE3'. Полученный клон получил обозначение pBHV1gE5'3'. Для удаления gE-кодирующей области ДНК pBHV1gE5'3' частично гидролизовали AsuII с последующим повторным гидролизом до завершения с помощью HindIII. Более крупный фрагмент очищали методом иммуносорбции в лунках с гелем и лигировали с фрагментом PstI (4,5 тыс.п.н.) (с "тупыми"(дефосфорилированными) концами, полученным с помощью Т 4 полимеразы) pCMV (полученной от компании Clontech, Palo Alto, штат Калифорния, США), в состав которой входили -gal последовательности, регулируемые ранним промотором CMV. Полученная gE-дeлeциoннaя/-gal-инcepциoннaя плазмида, pBHV1gE, имела делецию последовательностей ДНК (1 тыс.п.н.) BHV-1, включающих последовательности гена, кодирующие первые 372 аминокислоты, и инсерцию -gal гена под регуляцией CMV промотора. Упомянутый -gal ген фланкирован вирусспецифичными последовательностями 3'-5' дирекционного типа (3,32 тыс.п.н.) (включающими последовательности генов gD и gI в полном объеме и gEпромоторные последовательности) и последовательностями 5'-3' дирекционного типа (включающими карбоксиконцевую треть gE-кодирующей области и последовательности гена US9 в полном объеме),которые необходимы для рекомбинации с вирусной ДНК. Для получения gE-делеционного рекомбинантного вируса IBR ДНК линеаризованного pBHV1gE(инвентарный номер американской коллекции типовых культур (АТСС) VR-2637) и первичную ДНКIBRV дикого типа (штамм Cooper) котрансфектировали в культуру клеток почек крупного рогатого скота линии Madin-Darby (MDBK). Корректная инсерция -gal в локус gE первичного IBRV и последующая делеция части gE-кодирующей области IBRV дикого типа обусловлены гомологичной рекомбинацией специфичных фланкирующих последовательностей BHV-1 в плазмиде с репликацией вирусной ДНК. Упомянутая вирусспецифичная фланкирующая последовательность включается в новосинтезированную вирусную ДНК, создавая делецию в кодирующей области, а также инсерцию в той же самой области. Рекомбинантные вирусы, экспрессирующие -gal, трижды подвергались очистке с вирусными нуклеиновыми кислотами в бляшках посредством отбора синих бляшек под покровным слоем Bluo-Gal по методу,описанному в статье Чоудхари С.И. (Chowdhury S.I.), Construction and Characterization of an AttenuatedBovine Herpesvirus Type 1 (BHV-1) Recombinant Virus, 52 Vet. Microbiol. 13-23 (1996), который включен в настоящее описание как ссылка. Несколько рекомбинантных изолятов были дополнительно характеризованы посредством блот-гибридизации и иммуноблоттинга с анти-BHV-1 gE-специфичной антипептидной кроличьей поликлональной сывороткой. Был использован метод блот-гибридизации Чоудхари С.И. (Chowdhury S.I.), Construction and Characterization of an Attenuated Bovine Herpesvirus Type 1(BHV-1) Recombinant Virus, 52 Vet. Microbiol. 13-23 (1996), который включен в настоящее описание как ссылка. Был использован метод иммуноблоттинга Чоудхари С.И. (Chowdhury S.I.), Molecular Basis ofAntigenic Variation Between Glycoprotein С (gC) of Respiratory Bovine Herpesvirus 1 (BHV-1) and Neurovirulent BHV-5, 213 Virology 558-568 (1995), который включен в настоящее описание как ссылка. Результаты. Результаты анализа ДНК двух рекомбинантных вирусов, gE3.1IBR (инвентарный номер АТССVR-2367) и gE3.5IBR, посредством саузерн-блот-гибридизации на предназначенную делецию и инсерцию -gal последовательностей в gE локусе, представлены на фиг. 2. Отсутствие последовательностей фрагмента AsuII-HindIII (1 тыс.п.н.), кодирующих первые 372 аминокислоты на аминоконцевом участке упомянутого gE гена, и присутствие -gal последовательностей в изолятах gE3.1IBR иgE3.5IBR демонстрируют, что предназначенная рекомбинация в этих изолятах осуществилась сайтспецифичным образом. В соответствии с упомянутым у родительского штамма Cooper дикого типа с помощью BHV-1 gE-специфичной антипептидной кроличьей поликлональной сыворотки был обнаруженgE3.1IBR. Полученный результат показан на фиг. 3, и упомянутый изолят был использован для дополнительных исследований. В дополнение к этому, gE3.1IBR может реверсироваться в вирус IBR дикого типа посредством котрансфекции плазмидой, включающей фланкирующие последовательности и исходную gE-последовательность IBRV дикого типа. Это, по существу, реверсирует процесс котрансфекции, использованный для получения gE3.1IBR. Кинетику экспрессии -gal в инфицированных вирусом клетках MDBK определяли гистохимическими средствами через 3 ч, 6 ч, 12 ч и 24 ч после инфицирования. -gal активность выявляли уже через 3 ч и еще через 24 ч после инфицирования. Это свидетельствует о том, что регулируемый CMV-IE промотором ген -галактозидазы вируса gE3.1IBR экспрессируется как на ранних, так и на поздних этапах. Более того, несмотря на то, что упомянутый химерный ген регулируется чужеродным HCMV-IE промотором вируса герпеса человека и включает невирусные -gal последовательности, а также энхансеры, чужеродные как для -gal, так и для BHV-1, он регулируется и экспрессируется как аутентичный генBHV-1 и HCMV-IE, и его энхансерные последовательности являются чужеродными как для BHV-1, так и для -gal, которые ими регулируются/стимулируются. Делеция упомянутого gE гена будет служить в качестве иммунологического маркера для отличения вакцинированных и инфицированных животных. При антителогенезе, индуцированном вакцинным штаммом, будут отсутствовать gE-специфичные антитела, вследствие чего он будет отличаться от антителогенеза, индуцированного инфекцией BHV-1 дикого типа, при котором будут присутствовать gEспецифичные антитела. Благодаря этому в вакцинированном стаде можно будет идентифицировать и отделять инфицированных животных. Этот серологический маркер важен для ликвидации BHV-1 в стаде. Упомянутая плазмида (pBHV1gE), использованная для получения рекомбинантного вируса, и полученный рекомбинантный вирус, gE3.1IBR, были депонированы в Американской коллекции типовых культур (АТСС). Упомянутой плазмиде (pBHV1gE) был присвоен инвентарный номер АТСС 203607; упомянутому рекомбинантному вирусу (gE3.1IBR) был присвоен инвентарный номер АТССVR-2637. Пример 2. Материалы и методы. В этом эксперименте определяли патогенность вируса gE3.1IBR на телятах и сравнивали полученные результаты с патогенностью родительского штамма IBRV Cooper. Десять шестимесячных телят голштинской породы, свободных от IBRV и вируса вирусной диареи крупного рогатого скота, произвольно разделили на группы (А и В) по пять голов в каждой. Обе упомянутые группы содержали в отдельных стойлах в одинаковых условиях. Все телята перед проведением эксперимента были здоровыми и до начала эксперимента имели серонегативную реакцию. Каждому теленку в группе А интраназально вводили рекомбинантный gE-делеционный IBRV. Каждому теленку в группе В интраназально вводили родительский штамм IBRV Cooper. Инокулят включал 1x107TCID50 (ИE50) соответствующего вируса на теленка. Инокуляцию осуществляли посредством аэрозолирования с помощью аэрозольного ингалятора DEVILBIS 50 модели компании Delvis Co., Somerset,штат Пенсильвания (2 мл инокуляты на ноздрю в течение от 30 с до 1 мин). Интенсивные клинические наблюдения за всеми телятами осуществлялись ежедневно в течение 14 дней после воздействия вируса (инокуляции). Ежедневно регистрировалась ректальная температура. Особое внимание уделяли следующим параметрам: поведение (депрессия), аппетит, кашель, выделения из глаз и полости носа, гиперемия либо поражения слизистой оболочки полости носа и рта, конъюнктивит и нарушение дыхания. Каждый упомянутый параметр индивидуально оценивали в баллах, и ежедневная клиническая балльная оценка для каждого теленка, а также средняя ежедневная клиническая-5 005736 балльная оценка для каждой группы вычислялись путем сложения всех балльных оценок по каждому параметру. В баллах оценивались следующие параметры: Выделения из полости носа: норма=0; умеренно серозные=1; сильно серозные=2; слабо микропурулентные=2; умеренно микропурулентные=3; сильно микропурулентные=4. Поведение (депрессия): отсутствие=0; слабая степень==1; умеренная степень=2; тяжелая степень=3. Гиперемированность/покраснение слизистой оболочки полости носа=1. Изъязвление слизистой оболочки полости носа=2. Конъюнктивит= 2. Кашель=2. Одышка=2. Ежедневная ректальная температура: 39,7-39,99 С=1; 40,0-40,5 С=2; 40,6-41,0 С=3; более 41,0 С=4. Результаты. У телят группы В, инфицированных родительским штаммом IBRV Cooper (IBRV дикого типа), наблюдались типичные симптомы инфекции: депрессия, ухудшение аппетита, выделения из глаз и полости носа, изъязвление слизистой оболочки полости носа/бляшки в полости носа и кашель. Следствием этих клинических симптомов была высокая ежедневная клиническая балльная оценка в течение нескольких дней, как показано на фиг. 5. Однако у телят, которым был введен рекомбинантный вирус gE3.1IBR(группа А), полностью отсутствовали обнаружимые клинические симптомы (что также показано на фиг. 5), и их поведение и аппетит оставались в пределах нормы. На фиг. 6 сравниваются средние ректальные температуры телят каждой группы (А и В). Высокие ректальные температуры в пределах от 39,7 до 40,5 С регистрировались в течение нескольких дней у телят, инфицированных родительским штаммомCooper (группа В). Ректальные температуры телят, которым был введен gE3.1IBR, не превышали 38,9 С (группа А). Пример 3. Материалы и методы. В этом эксперименте производили сравнение кинетики роста вируса gE3.1IBR в клетках MDBK и родительского штамма вируса IBR Cooper в клетках MDBK. Ряд реплицированных культур клетокMDBK раздельно инфицировали 5 бляшкообразующими единицами (РFU)/клетку рекомбинантного вируса gE3.1IBR либо родительского штамма Cooper. Инфицированные культуры собирали через последовательные промежутки времени после инфицирования и штаммы вируса готовили для титрования. Результаты. Результаты одноэтапных экспериментов с выращиванием представлены на фиг. 4. Кривые роста вируса показывают, что рост потомства был одинаковым как у gE3.1IBR, так и у родительского штамма Cooper. Однако урожай рекомбинантного вируса на ранних стадиях после инфицирования был меньшим. Пример 4. Материалы и методы. В этом эксперименте выделяли и производили количественную оценку вируса от каждого животного в группах А и В (из вышеприведенного примера 3). В каждую носовую полость вводили простой ватный тампон на палочке. Тампон прижимали к слизистой оболочке и трижды проворачивали. Вирус элюировали в 3 мл среды для образца (минимальная поддерживающая среда, в состав которой включали 100 мкг/мл гентамицина, 3% (в объемном отношении) забуференного фосфатом физиологического раствора, амфотерицин В в дозе 25 мкг/мл) в течение 1 ч при комнатной температуре. Образцы осветляли центрифугированием при 1000gx в течение 5 мин и хранили при температуре -70 С. Выделение вируса на клетках MDBK осуществляли с помощью 100 мкл тампонной суспензии в разведении 1:10. Вируспозитивные образцы титровали на титрационных микропланшетах. Готовили серийные десятикратные разведения в культуральной среде и по 50 мкл каждого разведения добавляли в каждую из восьми лунок 96 луночного планшета, в которых находилось 1,5 х 105 клеток MDBK. Через 5 дней при температуре 37 С планшеты с помощью микроскопа считывали на цитопатическое действие (СРЕ). Титры вируса вычисляли в TCID50 (ИE50) по методу Рида Л.Дж. (Reed L.J.) и Менша Г. (Muench Н.), 27 Am. J. Hyg. 493 (1938),который включен в настоящее описание как ссылка. Результаты. Количество вируса, выделенное из носовых тампонов, показало, что вирус gE3.1IBR в клетках эпителия полости носа рос с меньшей эффективностью, чем родительский штамм Cooper. Выделение вируса из полости носа представлено на фиг. 7. Выделение вируса gE3.1IBR было ниже выделенияBHV-1 (родительский штамм Cooper) дикого типа приблизительно в (15-550) раз. Продолжительность выделения вируса у телят, которым был введен вирус gE3.1IBR, также была на 2 дня короче, чем продолжительность выделения вируса у телят, инфицированных вирусом дикого типа.-6 005736 Пример 5. Материалы и методы. В этом примере определяли титры нейтрализующих антител BHV-1 в сыворотке, отбиравшейся у телят в группах А и В (из вышеприведенных примеров 3 и 4). У каждого теленка из обеих групп А и В через 13 дней после вакцинации/инфицирования отбирали пробы крови. Сывороточный титр BHV-1 нейтрализующих антител определяли методом редукции бляшек на 12-луночных планшетах по методу, описанному Чоудхари С.И. (Chowdhury S.I.) и другими, Molecular Biological Characterization of Equine Herpesvirus 1 (EHV-1) Isolated From Ruminant Hosts, 11 Virus Res. 127-139 (1988), который включен в настоящее описание как ссылка. Результаты. Как вирус дикого типа (родительский штамм Cooper), так и gE-делеционный IBRV (gE3.1IBR) индуцировали BHV-1 нейтрализующие антитела у телят. Однако телята, инфицированные вирусом дикого типа, имели несколько более высокие сывороточные титры нейтрализующих антител (1:20-1:35 со средним титром 1:30) по сравнению с титрами нейтрализующих антител gE-делеционного вируса (1:111:30 со средним титром 1:16). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Аттенуированный рекомбинантный вирус герпеса крупного рогатого скота типа I, представляющий собой вирус герпеса крупного рогатого скота типа I, в котором часть нативной кодирующей области гликопротеина Е удалена и заменена генетической вставкой, включающей кодирующую область чужеродного гена -галактозидазы и немедленный ранний промотор цитомегаловируса человека, при этом данный рекомбинантный вирус способен экспрессировать -галактозидазу в клетке-хозяине. 2. Вирус по п.1, в котором генетическая вставка дополнительно включает энхансерные последовательности указанного немедленного раннего промотора цитомегаловируса человека. 3. Вирус по п.2, в котором удалено приблизительно две трети нативной кодирующей области гликопротеина Е. 4. Вирус по п.2, в котором генетическая вставка связана с сайтами полиаденилирования SV40. 5. Вирус по п.1, в котором чужеродный ген -галактозидазы экспрессируется как аутентичный ген,кодируемый вирусом герпеса крупного рогатого скота типа I. 6. Вирус по п.1, в котором отсутствие части нативной кодирующей области гликопротеина Е служит в качестве генотипического маркера. 7. Вирус по п.1, в котором экспрессированная в клетке-хозяине -галактозидаза служит в качестве фенотипического маркера. 8. Вирус по п.1, в котором отсутствие части нативной кодирующей области гликопротеина Е служит в качестве иммунологического маркера. 9. Вирус по п.1, в котором кодирующая область гена -галактозидазы экспрессируется в клеткехозяине как на ранней, так и на поздней стадиях инфекции. 10. Вирус по п.1, депонированный под номером АТСС VR-2637. 11. Рекомбинантная вакцина, обладающая активностью в отношении индуцирования антител, нейтрализующих вирус герпеса крупного рогатого скота типа I, включающая аттенуированный рекомбинантный вирус по любому из пп.1-10. 12. Способ выявления животных, которым была введена рекомбинантная вирусная вакцина по п.11,включающий следующие стадии:(а) получение образца жидкости или образца ткани от животного;(в) обнаружение в образце аттенуированного рекомбинантного вируса и(г) определение данного животного как вакцинированного - по результатам упомянутой стадии обнаружения. 13. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает анализ на присутствие галактозидазы. 14. Способ по п.13, отличающийся тем, что обнаружение на стадии (в) основывается на наличии экспрессии -галактозидазы. 15. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает анализ на гуморальный иммунный ответ, специфичный для гликопротеина Е указанной рекомбинантной вирусной вакцины. 16. Способ по п.15, отличающийся тем, что определение на стадии (г) основывается на наличии гуморального иммунного ответа, специфичного для гликопротеина Е указанной рекомбинантной вирусной вакцины. 17. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает in situ гистохимические методы обнаружения активности фермента -галактозидазы. 18. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает in situ иммуногистохимические методы обнаружения белка -галактозидазы.-7 005736 19. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает иммуноблоттинг для обнаружения белка -галактозидазы. 20. Способ по п.12, отличающийся тем, что анализ на стадии (б) включает in situ гистохимические методы обнаружения гликопротеина Е указанного аттенуированного рекомбинантного вируса. 21. Способ по п.12, отличающийся тем, что выявляют животных, которым была введена рекомбинантная вирусная вакцина, содержащая аттенуированный вирус по п.10. 22. Плазмида, депонированная под номером АТСС 203607, которая может быть использована для получения рекомбинантного вируса по п.10. 23. Способ иммунизации крупного рогатого скота против вируса герпеса крупного рогатого скота типа I, включающий вакцинацию упомянутого крупного рогатого скота рекомбинантной вирусной вакциной по п.11. 24. Способ по п.12, отличающийся тем, что рекомбинантная вирусная вакцина содержит аттенуированный вирус по п.10.
МПК / Метки
МПК: C12N 7/01, A61K 39/265, C12Q 1/70
Метки: аттенуированный, которым, такая, была, введена, рекомбинантный, основе, способ, выявления, вакцина, вирус, скота, типа, крупного, животных, герпеса, рогатого
Код ссылки
<a href="https://eas.patents.su/11-5736-attenuirovannyjj-rekombinantnyjj-virus-gerpesa-krupnogo-rogatogo-skota-tipa-i-vakcina-na-ego-osnove-i-sposob-vyyavleniya-zhivotnyh-kotorym-byla-vvedena-takaya-vakcina.html" rel="bookmark" title="База патентов Евразийского Союза">Аттенуированный рекомбинантный вирус герпеса крупного рогатого скота типа i, вакцина на его основе и способ выявления животных, которым была введена такая вакцина</a>
Предыдущий патент: Получение сверхчистого висмута-213 для использования в терапевтической ядерной медицине
Следующий патент: Терапевтический препарат для лечения невроза страха (тревоги) или депрессии
Случайный патент: Композиция ингредиентов для горькой настойки-бальзама