Способ получения лигнинсодержащего фармацевтического препарата, обладающего антиоксидантным, антигипоксическим, радиопротекторным и противоопухолевым действием
Номер патента: 4230
Опубликовано: 26.02.2004
Авторы: Жариков Владимир Юрьевич, Сенчук Вадим Викторович, Жаврид Эдвард Антонович, Истомин Юрий Петрович, Курченко Владимир Петрович, Пленина Людмила Васильевна, Зильберглейт Марк Аронович, Хлюстов Станислав Валентинович, Федулов Александр Сергеевич
Формула / Реферат
Способ получения лигнинсодержащего фармацевтического препарата, обладающего антиоксидантным, антигипоксическим, радиопротекторным и противоопухолевым действием, представляющего растворимый лигниноуглеводный комплекс с полисахаридами, путем экстракции сырья из древесины лиственных пород, упаривания и фильтрации экстракта, осаждения целевого продукта в ацетоне, его очистки, фильтрации и сушки, отличающийся тем, что в качестве сырья используют сухую осиновую соломку, экстракцию проводят смесью концентрированной перекиси водорода и ледяной уксусной кислоты при соотношении объемов 1:5:5 на водяной бане при температуре 100шC в течение часа, а осажденный целевой продукт после фильтрации промывают смесью ацетона и диэтилового эфира в соотношении 1:0,2 и высушивают его при комнатной температуре.
Текст
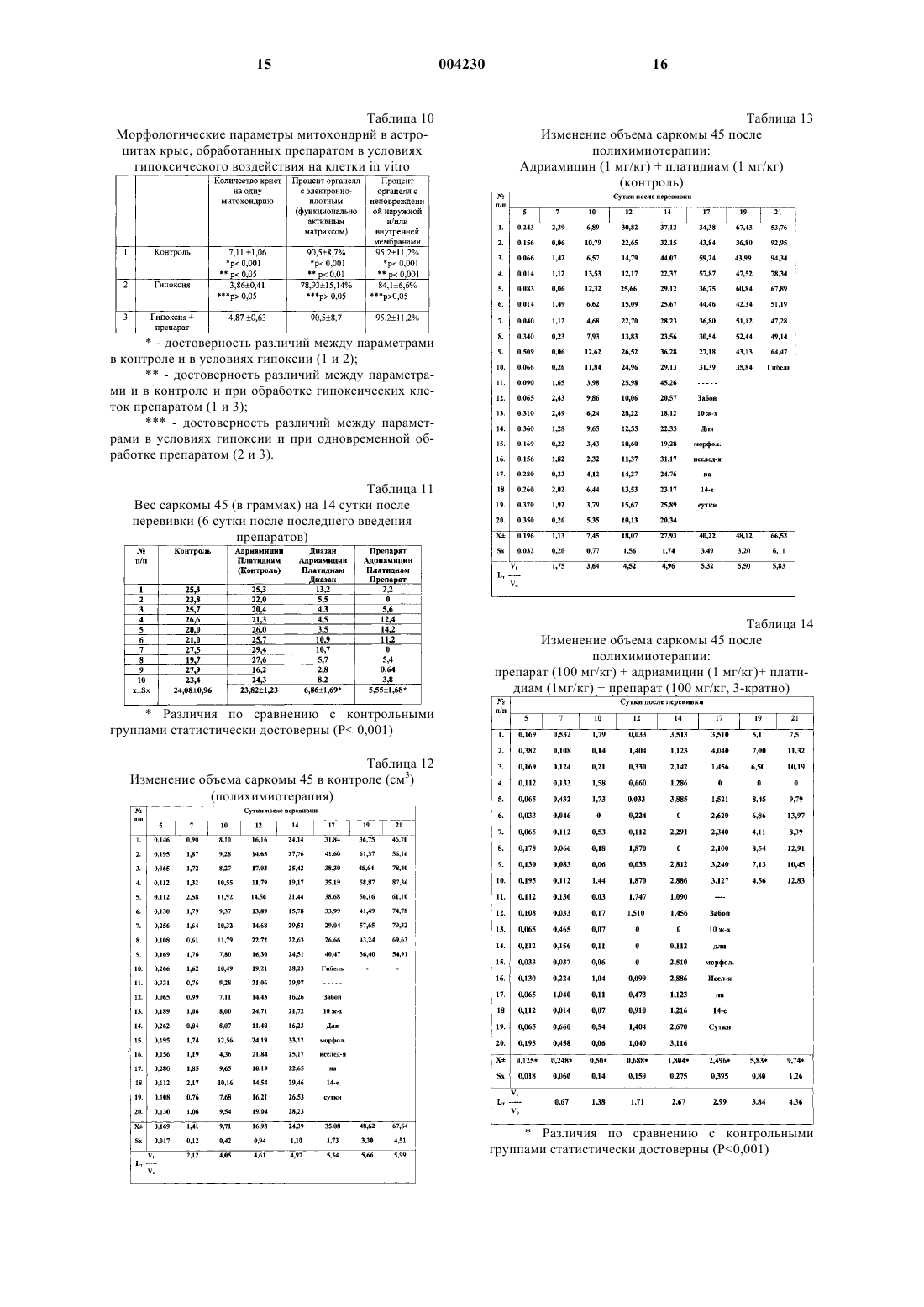
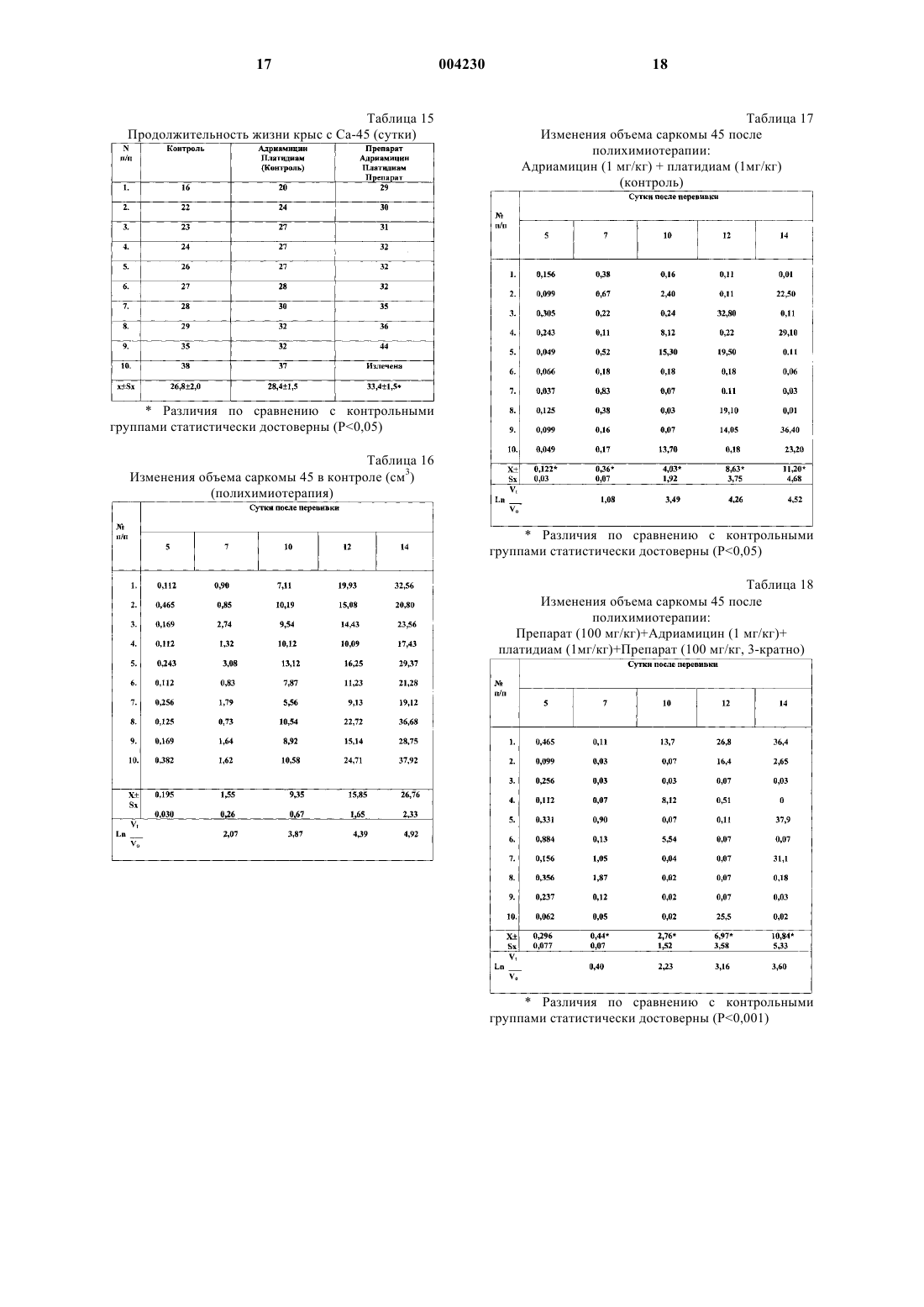
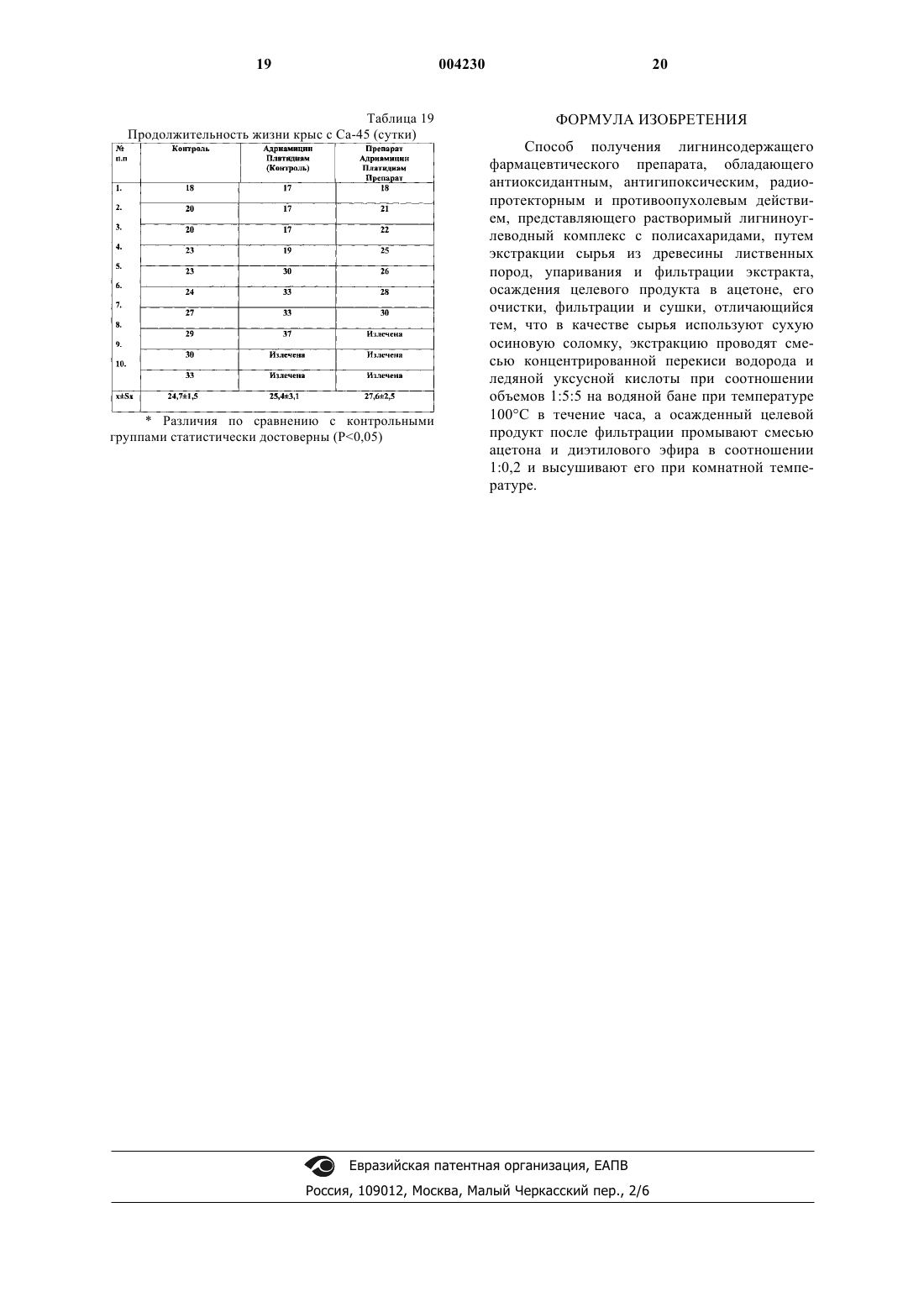
1 Изобретение относится к фармацевтической промышленности, а именно к способам получения лигнинсодержащих лекарственных препаратов, на основе фенольных соединений,полученных из растительного сырья. Изучение структуры и свойств растительных фенольных соединений позволяет утверждать, что главными функциональными группами фенолов, определяющими их поведение,химическую активность, биохимическое и фармакологическое действие, являются фенольные гидроксилы. Из числа реакций, обусловленных активностью гидроксильных групп, наибольший интерес и практическую важность представляют реакции окисления. Фенольные соединения это полностью восстановленные гидрохинонные структуры, определяющим химическим свойством которых, очевидно, является склонность к легкой отдаче протона - к окислению. Легко окисляясь сами, фенольные соединения в силу сопряженности окислительно-восстановительных реакций способствуют восстановлению других веществ в реакционной смеси, либо препятствуют окислению. Такое действие фенольных соединений может быть охарактеризовано как восстановительное, или точнее, как антиоксидантное. Истощение запасов естественных антиоксидантов при воздействии на организм ионизирующей радиации в большой дозе, обуславливает резкое возрастание темпа окислительных процессов, быстрое накопление токсических продуктов (липидных и хиноидных радиотоксинов) и, в итоге, развитие тяжелой формы лучевой болезни. Кинетика свободнорадикальных реакций окисления жиров и ингибиторного действия антиоксидантов послужила основой для использования фенольных антиоксидантов в качестве противолучевых и противоопухолевых средств. Известны полифенольные соединения, выделенные из растительного сырья, среди которых наиболее распространены лигнины и танины, обладающие антиоксидантным действием,что позволяет использовать некоторые из них в качестве противоопухолевых препаратов. Известно применение в качестве цитостатического средства экстракта коры дуба, содержащего в сухом остатке около 55% дубящих веществ, и лигнина, полученного из листьев бамбука [I]. Известен способ получения фармацевтического препарата, содержащего лигнин, из лигнинсодержащего сырья путем гидролиза лигнина щелочью с получением щелочной суспензии лигнина, разделение щелочной суспензии на статическом электроосмотическом фильтре под действием воздуха, подаваемого с давлением 380-500 кПа в поле постоянного электрического тока, при температуре 60-70 С, отмывку лигнина водой с отделением промывной воды, его нейтрализацию кислотой с отделением кислого фильтрата, отмывку лигнина водой от избытка 2 кислоты с отделением промывной воды и его измельчение [2]. Недостатками способа являются повышенные затраты тепла и электроэнергии, продолжительность технологического процесса, а также потери лигнина в процессе его обработки. Известен способ получения лигнинсодержащего лекарственного препарата путем экстракции опилок древесины лиственницы водным раствором, упаривания и фильтрации экстракта, осаждение его в ацетоне, очистку готового продукта ацетоном, фильтрацию и сушку,отделения экстракта, упаривания [3]. Недостатком данного способа является низкий выход продукта, большая длительность процесса, а также потеря и снижение качества продукта при его очистке и сушке. Задача изобретения - изыскание новых лигнинсодержащих лекарственных препаратов,обладающих антиоксидантными, антигипоксическими, радиопротекторными и противоопухолевыми свойствами, повышение эффективности и качества препарата, снижение потерь готового продукта при его получении. Поставленная задача решается предлагаемым способом получения фармацевтического препарата, который представляет собой лигнинуглеводный комплекс в соединении с полисахаридами, обладающего антиоксидантным, антигипоксическим, радиопротекторным и противоопухолевым действием, включающим экстракцию сырья из древесины лиственных пород водным раствором, упаривания и фильтрацию экстракта, осаждение его в ацетоне, очистку готового продукта ацетоном, фильтрацию и сушку, при этом в качестве сырья используют сухую осиновую соломку, а экстракцию проводят смесью концентрированной перекиси водорода и ледяной уксусной кислоты, при соотношении объемов соломки, перекиси водорода и ледяной уксусной кислоты 1:5:5 при температуре 100 С в течение часа. Затем раствор обрабатывают ацетоном. Осадок фильтруют и промывают смесью ацетона и диэтилового эфира в соотношении 1:0,2 и сушат при комнатной температуре. Способ осуществляется следующим образом. В емкость, снабженную обратным холодильником и водяной рубашкой для обогрева,загружают сухую осиновую соломку. Заливают в емкость с сырьем концентрированную перекись водорода и ледяную уксусную кислоту при соотношении соломки, перекиси водорода и ледяной уксусной кислоты 1:5:5 при комнатной температуре, смесь нагревают до 100 С. Процесс экстракции осуществляют в течение часа. Затем в водяную рубашку подают холодную воду и охлаждают смесь до комнатной температуры. Полученную суспензию подают на фильтр и отделяют жидкую фазу. 3 Затем раствор выливают тонкой струй в 5-кратный объем ацетона при энергичном перемешивании. Надосадочную жидкость декантируют, осадок промывают ацетоном и диэтиловым эфиром, при объемном соотношении 1:0,2 и высушивают при комнатной температуре. Получают конечный продукт в виде белого порошка. По своей химической природе полученный продукт представляет собой смесь лигнина и полисахаридов. Полученный данным способом препарат обладает заданными свойствами. Он очень активно реагирует со свободными радикалами, в том числе и возникающими при облучении. Препарат обладает антигипоксическим действием, а также способен связывать ионы тяжелых металлов. Заявленный способ иллюстрирует следующий пример лабораторного получения лигнинуглеводного комплекса. Пример. В круглодонную колбу, снабженную обратным холодильником, помещали 100 г сухой осиновой соломки. Заливали в колбу 500 мл концентрированной перекиси водорода и 500 мл ледяной уксусной кислоты и помещали на водяную баню при комнатной температуре. Смесь нагревали до температуры 100 С. Колбу выдерживали при данной температуре в течение часа. Затем колбу помещали в проточную холодную воду и охлаждали содержимое до комнатной температуры. Отделяли фильтрацией через стеклянный фильтр жидкую фазу. Таким образом получили около 800 мл раствора, который содержал требуемое вещество. Осаждение вещества проводили в ацетоне,при соотношении объемов раствора и ацетона 1:5 соответственно. Раствор вливали в ацетон тонкой струйкой, осаждение проводили при энергичном перемешивании. Осадок отделяли фильтрацией через фильтр Шотта. Полученное вещество промывали многократно ацетоном(расходовали примерно 1 л ацетона) и диэтиловым эфиром (расходовали около 200 мл эфира). Полученный осадок высушили при комнатной температуре. Получили 12-14 г белого порошкообразного продукта. В результате осуществления заявленного способа получили медицинский препарат, представляющий собой смесь лигнина и полисахаридов, анализ и контроль качества которого осуществляли в соответствии с фармакопейной статьей. Предлагаемый способ получения препарата по сравнению со способом-прототипом позволяет более полно извлечь действующие вещества, увеличить выход по конечному продукту и снизить расход энергии на его получение. 4 В основе многих патологических процессов, возникающих в организме, лежит дисбаланс, наступающий в функционировании системы свободнорадикального окисления и системы антиоксидантной защиты, поэтому в современной системе оценки свойств новых лекарственных препаратов оценка уровня их антиокислительных свойств и степени влияния их на свободнорадикальное окисление является показательной. Изучение антиоксидантной и антигипоксической активности Проводили исследование по влиянию препарата на процессы перекисного окисления липидов, состояние системы антиоксидантной защиты в гомогенатах органов здоровых мышей, а также на фоне бензидиновой интоксикации. Эксперименты выполнены на 50 белых беспородных мышах (самцы) массой 20 г, которых разделили на 6 групп. 1-я группа (10 животных) являлась контрольной. Мышам 2-й и 3-й групп внутримышечно вводили препарат в дозах 2,5 и 5,0 г/кг соответственно. Животным 4-й группы внутримышечно вводили сильный окислитель - бензидин(4,4-диаминобифенил) животным 5 и 6 групп в такой же дозе вводили бензидин, но через 5 дней бензидиновой интоксикации мышам этих групп вводили препарат в дозах 2,5 и 5,0 соответственно. Через 1 ч после введения препарата (животным контрольной группы вводили плацебо 0,9% раствор NaCl) животных декапитировали и выделяли мозг,легкие, сердце, печень, почки, селезенку. Из свежевыделенных органов на холоду изготавливали 10% гомогенаты. Белок определяли биуретовым методом. Скорость перекисного окисления липидов определяли методом,основанным на реакции малонового диальдегида и тиобарбитуровой кислоты. Расчет содержания малонового диальдегида проводили по формуле А = ЕБ 100,где А - количество перекисей липидов (МДА) в условных единицах - ед.; Е - разница оптической плотности опыта и контроля; Б - величина конечного разведения гомогената; 100 - коэффициент перевода величины оптической плотности в условные единицы - ед. Окончательный расчет проводили с привлечением молярного коэффициента экстинкции малонового диальдегида 1,56105 М-1 см-1 по общепринятым правилам. Супероксиддисмутазную активность оценивали методом, основанным на способности СОД тормозить аэробное восстановление нитросинего тетразолия (НСТ) с образованием формазана, поглощающего свет в области 560 нм. 5 Реакционную смесь для определения активности СОД готовили перед опытом следующего состава: 59 мМ - фосфатный буфер Na фосфатный буфер, рН - 7,8; 5,710-5 М НСТ; 1,9 мМ D,L - метионин; 2,510-2% (мас./об.) тритон Х-100. 1,950 мл этой смеси помещали в пластиковые пробирки, добавляли 50 мкл разведенного 1:10 исходного гомогената, затем вносили раствор рибофлавина для инициации фотохимической реакции до конечной концентрации 0,9 мкМ. Тщательно перемешивали содержимое пробирок и облучали в течение 7 мин флуоресцентной лампой. Контрольный образец содержал равный объем буфера. После УФ-облучения опытный и контрольный образцы фотометрировали на СФ-46 при 560 нм. Активность СОД рассчитывали по формуле где А - активность фермента (в усл. ед.), рассчитанная на 1 мг белка в 1% гомогенате; Т% - процент торможения реакции восстановления нитросинего тетразолиевого в пробе(5%-ное ингибирование этой реакции соответствует 1 усл. ед. активности. Анализ результатов по содержанию малонового диальдегида (табл. 1-6) показывает, что на фоне бензидиновой интоксикации исследуемый препарат вызывает достоверное снижение ТБК-активного продукта малонового диальдегида (МД). Введение препарата и в дозе 2,5 и 5 мг/кг во всех исследуемых органах (печень, почки,сердце, селезенка, мозг, легкое) приводит к снижению содержания МД (табл. 1-6) по отношению к контролю. Бензидиновая интоксикация приводит к достоверному (Р 0,05) росту содержания малонового диальдегида, что свидетельствует об активации процессов ПОЛ: в мозге на 12%, в печени на 167%, в селезенке на 131%, в почках на 125%, в сердце на 211%, в легком на 134% по отношению к контролю. В результате введения препарата на фоне бензидиновой интоксикации в дозе 2,5 и 5 мг/кг происходило достоверное снижение уровня малонового диальдегида во всех исследуемых образцах. Анализ изменений активности супероксиддисмутазы (СОД) показал, что изолированное введение препарата приводит к увеличению активности СОД с учетом органоспецифичности. Следует отметить, что в печени, единственном среди исследуемых органов, препарат не вызывал изменения в активности СОД ни при 6 изолированном введении препарата, ни при бензидиновой интоксикации (табл. 7). В сердце введение препарата здоровым мышам приводило к достоверному (Р 0,05) повышению по отношению к контролю активности СОД (табл. 8). Бензидиновая интоксикация снижает активность СОД в сердце, однако, в дозе 5 мг/кг препарат возвращает активность СОД к исходному контрольному уровню активности фермента у здоровых мышей. Изучение протективного действия препарата при гипоксическом состоянии проводили путем изучения механизмов нарушения функции астроцитов при моделировании гипоксического состояния. Проводили электронно-микроскопический анализ первичных монослойных культур астроцитов новорожденных крыс (3-й пассаж, 4-е сутки культивирования) в условиях 20-часового гипоксического воздействия и при одновременном внесении в культуры в условиях гипоксии исследуемого препарата (концентрация 20 мкг/мл ростовой среды). Для приготовления культур использовали головной мозг новорожденных крыс. Гипоксическое воздействие на культуры осуществляли в герметичной камере с газовой смесью (95% азота и 5% углекислого газа), которую помещали в термостат при 37 С. Анализ морфофункционального состояния астроцитов и их энергетического аппарата проводили морфометрически и методом ультратонких срезов, которые исследовали на электронном микроскопе JEM-100 СХ-11 (Япония). Всего было проанализировано 300 клеток, с которых были получены 1500 срезов. Количественное изучение морфометрических параметров митохондрий (фактор формы,площадь, периметр) было проведено на системе компьютерного анализа изображения BioscanAT+. Кроме того, определяли среднее количество крист на одну органеллу, % митохондрий с функционально активным(электронноплотным) матриксом и неповрежденной мембраной. Показано, что в контрольных культурах 90% клеток представлено астроцитами округлой или вытянутой формы (диаметром 8-15 мкм). Ядра клеток овальной или округлой формы,большая часть ядерного хроматина деконденсирована по всему объему ядра, наблюдается лишь тонкий слой конденсированного хроматина у внутреннего листка ядерной оболочки, в плоскость среза обычно попадают два или три ядрышка: в цитоплазме умеренное количество органелл: филаментозные, часто разветвленные митохондрии нормальной морфологии с различными кристами и матриксом умеренной электронной плотности, первичные и вторичные лизосомы, слабо выраженный ШЭР с нерасширенными цистернами, большое количество микротрубочек и промежуточных филаментов, соб 7 ранных в крупные пучки, многочисленные свободные рибосомы, часто в розетках, гладкие пиноцитозные и окаймленные везикулы, небольшое количество микроворсинок. В астроцитах, подвергшихся гипоксическому воздействию, отмечены следующие ультраструктурные сдвиги:- в ядрах некоторых клеток (до 15-20%) наблюдается возрастание количества глыбок гетерохроматина на 5-9% (р 0,05); в плоскость среза обычно попадают 3 или 4 ядрышка, часто имеющих нуклеолоненмную организацию; перинуклеарное пространство местами расширено;- в цитоплазме наблюдаются митохондрии различных размеров и формы - уменьшается количество филаментозных форм с сохранившимися обеими мембранами, кристами и матриксом умеренной электронной плотности(функциональное состояние) и появляются более мелкие разбухшие округлые или овальные митохондрии с деструкцией крист и разреженным матриксом (нефункциональное состояние),в котором иногда наблюдаются небольшие скопления мембранных образований; наблюдается слабое расширение цистерн ШЭР, мелкогранулярным материалом; а также уменьшение количества свободных рибосом, микротрубочек и диаметра пучков промежуточных филаментов на 27% (р 0,05). Культуры астроцитов, подвергшихся гипоксическому воздействию с предварительным введением исследуемого препарата, имели ультраструктуру, отличную от описанной для контрольных клеток по следующим ультраструктурным параметрам: в ядре - увеличение количества глыбок конденсированного хроматина и локальные расширения перинуклеарного пространства; в цитоплазме - уменьшение количества органелл, представленных, в основном,овальными или филаментозными митохондриями, цистернами ШЭР, иногда расширенными,фаголизосомами, заполненными электронноплотным или гранулярным содержимым, микрофиламенты, собранные в небольшие пучки. В ходе ультраструктурных исследований были выявлены существенные изменения в митохондриальном аппарате астроцитов (появление органеллы с локальным лизисом матрикса и увеличение количества разрывов митохондриальной оболочки) при гипоксии с и без применения препарата, было проведено количественное изучение некоторых морфометрических параметров митохондрий (фактор формы, площадь, периметр) на системе компьютерного анализа изображения Bioscan AT+, а также определено среднее количество крист на одну органеллу, % митохондрий с функционально активным (электронно-плотным) матриксом и неповрежденной мембраной. Результаты этих исследований приведены в табл. 9-10. 8 Исследования показали, что фактор формы достоверно повышался с 0,520,05 до 0,720,04 в условиях гипоксии, т.е. происходило набухание митохондрий, в то время как в условиях применения препарата он достоверно снижался (0,640,05, р 0,01) (табл. 9). При этом значении площади и периметра при гипоксии снижались, что отражает появление класса более мелких митохондрий, а применение препарата в небольшой мере замедляло этот процесс(табл. 9). Гипоксическое воздействие приводило к снижению среднего числа крист с 7,111,06 до 3,860,41 (р 0,01), а присутствие препарата тормозило этот процесс (4,870,63) (табл. 10). На улучшение таких морфологических характеристик митохондрий, как % органелл с функционально активным матриксом и неповрежденными мембранами, препарат не оказывал никакого влияния. Эти показатели падали с 90,58,7 и 95,211,2% в контроле до 78,9315,14 и 84,16,6% при гипоксии и не изменялись в присутствии препарата (р 0,05). Таким образом, ультраструктурные и морфометрические исследования показывают, что препарат в концентрации 20 мкг/мл ростовой среды в условиях гипоксии оказывает протективное действие на клетки астроглии новорожденных крыс в первичной монослойной культуре. Таким образом, проведенными исследованиями установлены антиоксидантное и антигипоксическое действие препарата, а также наличие у него хорошего протекторного эффекта при радио- и химиотерапии. Антигипоксическое действие препарата на модели гипоксической гипоксии В качестве препарата сравнения применяли актовегин. При внутрибрюшинном введении препарата в дозе 10 мг/кг веса одномесячным крысам выживаемость животных по сравнению с контролем увеличилась в 1,4 раза. При введении актовегина в дозе 30 мг/кг веса наблюдался аналогичный эффект. Продолжительность жизни животных увеличилась в 1,4 раза. Таким образом, препарат в дозе 10 мг/кг веса оказывает аналогичное актовегину в дозе 30 мг/кг веса протективное действие на устойчивость молодых крыс к гипоксической гипоксии. Однако при введении препаратов в данных дозах 6 месячным крысам подобного эффекта не наблюдалось. В связи с тем, что токсичность препарата весьма низкая, провели испытания по введению более высоких доз препарата. При внутрибрюшинном введении препарата в дозе 20 мг/кг веса крысы защитный эффект препарата не выявился. 9 При увеличении дозы еще в 2 раза (40 мг/кг) выживаемость животных в опытной группе возросла в 1,4 раза (Р 0,05). При дальнейшем увеличении дозы препарата до 80 мг/кг выживаемость животных в опытной группе возросла в 1,46 раза. По сравнению с предыдущей серией выживаемость животных возросла не намного, что позволяет считать дозу 60-80 мг/кг веса оптимальной для данной возрастной категории. Таким образом, в результате проведенных исследований установлена антиоксидантная и антигипоксическая активность диафена. Радиопротекторное и противоопухолевое действия препарата в эксперименте В эксперименте на 700 белых беспородных крысах выполнены исследования по изучению радиопротекторного и противоопухолевого действия препарата. При изучении радиопротекторных свойств препарата последний вводился здоровым животным в дозах 10, 100 мг/кг за 24, 1 ч или спустя 5 мин после тотального гамма-облучения в дозе 5 Гр. Известно, что при облучении в дозе 5 Гр у животных уже с первых часов возникает острая лучевая болезнь с основными клиническими синдромами. Доказано, что выживаемость животных при дозе 5 Гр возможна только при проведении специального лечения. Одна из реальных возможностей повышения радиорезистентности организма в использовании средств фармакологической защиты - протекторов, существенно уменьшающих поражение действия облучения. Под влиянием защитных агентов снижается степень проявления всех типов первичного лучевого поражения клеток, а также интенсифицируются процессы клеточного деления, что,в свою очередь, способствует увеличению у защищенных животных клеточного фонда - источника последующей регенерации. При изучении радиопротекторных свойств оценивали: клиническое течение острой лучевой болезни, массу тела животных, данные показателей периферической крови в динамике. На 10 сутки после воздействия все животные были забиты методом декапитации (под наркозом), проведен забор крови и внутренних органов для их биохимического и морфологического исследования. Животные опытных групп меньше теряли в весе во все сроки наблюдения по сравнению с облученным контролем. При этом важно отметить, что препарат, введенный за 24 ч до облучения в дозе 10 мг/кг, защищал животных от действия ионизирующего излучения - потеря массы тела в этих группах была весьма незначительной. У животных из облученного контроля признаки острой лучевой болезни были более выраженными - полное отсутствие аппетита, понос, жажда, саливация, вялость. В результате 10 потеря веса к 5 суткам составила 17% по сравнению с исходным. Клинические признаки острой лучевой болезни у крыс, которым вводили препарат в дозе 100 мг/кг были менее выраженными. Уже начиная с 3 суток послеоблучения, животные начинали есть корм, становились активнее, прекращался понос, уменьшалась жажда, шерсть приобретала блеск, потеря веса была минимальной. Характерно, что прирост массы тела в 1 сутки,когда наиболее выражена питьевая модификация, был незначителен в опытных группах по сравнению с контролем. Одними из наиболее надежных диагностических и прогностических признаков являются количественные показатели кроветворения. Однократное воздействие радиации в большой дозе дает четкую картину изменения нормального гемопоэза, развивающуюся поэтапно с полным угнетением кроветворных центров. Поэтому представлялось важным изучение наличия взаимосвязи между повышением радиорезистентности организма и защитой системы кроветворения. При всех видах и условиях действия на организм ионизирующей радиации в синдроме лучевой болезни общим является поражение всей системы крови - костного мозга,лимфоидной ткани, ретикуло-эндотелия. Основным способом оценки развивающегося процесса лучевого поражения является динамическое наблюдение за состоянием периферической крови. Оценивали основные гематологические показатели: количество эритроцитов, гемоглобина, тромбоцитов, лейкоцитов и лейкоцитарную формулу. Облучение животных в дозе 5 Гр сопровождалось наиболее ранними, выраженными и стойкими изменениями в клеточном составе красного и белого ростков периферической крови: уменьшении содержания эритроцитов, гемоглобина, тромбоцитов, стойкой лейкопении с лимфо- и моноцитозом. Сравнительный анализ динамических показателей периферической крови животных после введения препарата в дозах 10, 100 мг/кг за 24, 1 ч до или спустя 5 мин после облучения показал, что статистически достоверные результаты по сравнению с облученным контролем получены в следующие моменты исследований и по нижеперечисленным параметрам:- при введении крысам препарата в дозе 10 мг/кг за 24 ч до облучения отмечено более высокое сохранение уровня тромбоцитов и лимфоцитов при выраженной лейко- и моноцитопении во все сроки наблюдения и введения препарата;- при введении препарата в дозе 100 мг/кг за 24 ч до воздействия отмечено повышение уровня гемоглобина, процент лимфоцитов (во все сроки наблюдения) на фоне снижения сегментоядерных и моноцитов. При введении за 1 ч 11 обнаружена прямая защита эритропоэза с выраженным лимфоцитозом. Еще более значимый противолучевой эффект зарегистрирован при введении препарата сразу после облучения как со стороны красного, так и белого ростков. Это подтверждает, что препарат в дозах 10 и 100 мг/кг обладает радиопротекторным действием. Исследования противоопухолевых свойств препарата выполнены на экспериментальных модельных системах перевиваемых опухолей крыс: саркома 45, карцинома Уокера, карцинома Герена, гепатома 27, различающихся между собой по гистогенезу, скорости роста, степени оксигенации, строению микрососудистого русла, доле гипоксических клеток, величине спонтанного некроза и т.д. Препараты животным вводили в/брюшинно, 5-кратно, в дозе 100 мг/кг на 3, 4,5, 6 и 7 сутки после перевивки саркомы 45, карциномы Герена, гепатомы 27 и, начиная со 2 суток после перевивки карциносаркомы Уокер 256. Оценивали динамику роста опухолей,среднюю продолжительность жизни павших животных, процент излеченных животных, торможение роста опухоли по массе (табл. 12-19). Анализ выполненных исследований по изучению противоопухолевого действия заявляемого препарата позволил сделать следующие выводы:- препарат оказывал достоверное торможение роста только саркомы 45 во все сроки наблюдения (до 21 суток после перевивки). Излеченность животных саркомой 45, леченых препаратом, составила 20-70%. Значительный противоопухолевый эффект у крыс с саркомой 45 зарегистрирован при сочетании препарата с адриамицином и платидиамом по следующим параметрам: торможение роста опухоли по массе (77,0%), достоверному торможению роста саркомы 45 во все сроки наблюдения, средней продолжительности жизни. При повторении данного эксперимента, помимо достоверного уменьшения объема опухолей после лечения крыс с саркомой 45 адриамицином и платидиамом, вновь обнаружено достоверное торможение динамики роста саркомы 45 при сочетании препарата с полихимиотерапией. Таким образом, заявляемый препарат обладает определенным модулирующим воздействием на системы клеточного воспроизводства критических тканей. Прослеживается четкая зависимость радиозащитного влияния препарата в зависимости от дозы и сроков его применения. При изучении противоопухолевых свойств препарата выявлено, что он обладает существенным биологическим действием на организм животных опухоленосителей. Таким образом, изучение специфических и фармакологических свойств препарата выявило его антиоксидантное, антигипоксическое, радиопротекторное и противоопухолевое свойства. 12 Исследования, проведенные с целью установления характера и выраженности повреждающего действия препарата на организм экспериментальных животных и оценки его безопасности, показали следующее. Изучение острой токсичности препарата Изучение острой токсичности препарата проводили на 3 видах лабораторных животных: белых аутобредных мышах массой 20-30 г (по 10 самок и 10 самцов в каждой группе), крысах линии Вистар массой 240-260 г (по 10 самцов и 10 самок в каждой группе) и беспородных собаках массой 10-12 кг (по 6 особей в группе). Препарат вводили однократно в дозах мышам: в/бр - от 15,62 до 500 мг/кгper os - от 10 до 200 мг/кг Наблюдение за состоянием и поведением лабораторных животных проводили в течение двух недель после введения препарата. Результаты изучения острой токсичности отражены в табл. 11. Полученные результаты свидетельствуют об отсутствии токсического действия препарата на мышей, крыс и собак при однократном введении как в желудок, так и внутрибрюшинно. Из-за низкой токсичности ЛД 50 препарата установить не удалось. Наблюдения за мышами и крысами в течение всего эксперимента не выявили каких-либо отклонений в общем состоянии и поведении животных по сравнению с контрольной группой. Все животные выжили, были активны и подвижны, имели нормальную реакцию на тактильные, болевые и звуковые раздражители, охотно поедали корм и имели гладкий шерстяной покров. Результаты изучения острой токсичности препарата свидетельствуют о его низкой токсичности и в изученных концентрациях является безвредным для организма подопытных животных на введение препарата. При изучении ряда специфических видов токсичности установлено: препарат не обладает мутагенным, кожно-раздражающим, кожнорезорбтивным, аллергенным и анафилактогенным действием, эмбриотоксичность и тератогенностью, а также не оказывает токсического влияния на гуморальный иммунный ответ, что позволяет расширить круг больных, нуждающихся в препаратах аналогичного действия. Изучение общетоксического действия препарата показало его низкую токсичность, отсутствие значимых побочных эффектов. Использованная литература 1. Yamafuj K., Murakami H. - Enzimologia,35,3,139, (1968). 2. Способ получения медицинского лигнина. Патент РФ 2110273, Бюл.13, 10.05.98 г. 13 3. Способ выделения арабиногалактана. Заявка 94007316, Бюл.19, 10.07.96 г. Таблица 1 Содержание малонового диальдегида (нМ/мг белка в 10% гомогенате) в мозге белых мышей (самцы) через 1 ч изолированного введения препарата и при сочетанном введении бензидина и препарата Таблица 2 Содержание малонового диальдегида (нМ/мг белка в 10% гомогенате) в печени белых мышей (самцы) через 1 ч изолированного введения препарата и при сочетанном введении бензидина и препарата Таблица 3 Содержание малонового диальдегида (нМ/мг белка в 10% гомогенате) в селезенке белых мышей (самцы) через 1 ч изолированного введения препарата и при сочетанном введении бензидина и препарата Таблица 4 Содержание малонового диальдегида (нМ/мг белка в 10% гомогенате) в почках белых мышей (самцы) через 1 ч изолированного введения препарата и при сочетанном введении бензидина и препарата Таблица 5 Содержание малонового диальдегида (нМ/мг белка в 10% гомогенате) в сердце белых мышей (самцы) через 1 ч изолированного введения препарата и при сочетанном введении бензидина и препарата 14 Таблица 6 Содержание малонового диальдегида (нМ/мг белка в 10% гомогенате) в легком белых мышей (самцы) через 1 ч изолированного введения препарата и при сочетанном введении бензидина и препарата Таблица 7 Активность супероксиддисмутазы (в усл. ед/мг) в печени белых беспородных мышей при изолированном введении препарата и на фоне бензидиновой интоксикации Таблица 8 Активность супероксиддисмутазы (в усл. ед/мг) в сердце белых беспородных мышей при изолированном введении препарата и на фоне бензидиновой интоксикации Таблица 9 Морфометрические параметры митохондрий в астроцитах крыс, обработанных препаратом в условиях гипоксического воздействия на клетки in vitro- достоверность различий между параметрами в контроле и в условиях гипоксии (1 и 2);- достоверность различий между параметрами и в контроле и при обработке гипоксических клеток препаратом (1 и 3);- достоверность различий между параметрами в условиях гипоксии и при одновременной обработке препаратом (2 и 3). 15 Таблица 10 Морфологические параметры митохондрий в астроцитах крыс, обработанных препаратом в условиях гипоксического воздействия на клетки in vitro 16 Таблица 13 Изменение объема саркомы 45 после полихимиотерапии: Адриамицин (1 мг/кг) + платидиам (1 мг/кг)- достоверность различий между параметрами в контроле и в условиях гипоксии (1 и 2);- достоверность различий между параметрами и в контроле и при обработке гипоксических клеток препаратом (1 и 3);- достоверность различий между параметрами в условиях гипоксии и при одновременной обработке препаратом (2 и 3). Таблица 11 Вес саркомы 45 (в граммах) на 14 сутки после перевивки (6 сутки после последнего введения препаратов) Таблица 14 Изменение объема саркомы 45 после полихимиотерапии: препарат (100 мг/кг) + адриамицин (1 мг/кг)+ платидиам (1 мг/кг) + препарат (100 мг/кг, 3-кратно)Различия по сравнению с контрольными группами статистически достоверны (Р 0,001) Таблица 12 Изменение объема саркомы 45 в контроле (см 3) Различия по сравнению с контрольными группами статистически достоверны (Р 0,001) 17 Таблица 15 Продолжительность жизни крыс с Са-45 (сутки) 18 Таблица 17 Изменения объема саркомы 45 после полихимиотерапии: Адриамицин (1 мг/кг) + платидиам (1 мг/кг) Различия по сравнению с контрольными группами статистически достоверны (Р 0,05) Таблица 16 Изменения объема саркомы 45 в контроле (см 3)(полихимиотерапия)Различия по сравнению с контрольными группами статистически достоверны (Р 0,05) Таблица 18 Изменения объема саркомы 45 после полихимиотерапии: Препарат (100 мг/кг)+Адриамицин (1 мг/кг)+ платидиам (1 мг/кг)+Препарат (100 мг/кг, 3-кратно) Различия по сравнению с контрольными группами статистически достоверны (Р 0,001) Таблица 19 Продолжительность жизни крыс с Са-45 (сутки) Различия по сравнению с контрольными группами статистически достоверны (Р 0,05) 20 ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения лигнинсодержащего фармацевтического препарата, обладающего антиоксидантным, антигипоксическим, радиопротекторным и противоопухолевым действием, представляющего растворимый лигниноуглеводный комплекс с полисахаридами, путем экстракции сырья из древесины лиственных пород, упаривания и фильтрации экстракта,осаждения целевого продукта в ацетоне, его очистки, фильтрации и сушки, отличающийся тем, что в качестве сырья используют сухую осиновую соломку, экстракцию проводят смесью концентрированной перекиси водорода и ледяной уксусной кислоты при соотношении объемов 1:5:5 на водяной бане при температуре 100 С в течение часа, а осажденный целевой продукт после фильтрации промывают смесью ацетона и диэтилового эфира в соотношении 1:0,2 и высушивают его при комнатной температуре.
МПК / Метки
МПК: A61P 39/06, A61P 35/00, A61K 36/00
Метки: фармацевтического, препарата, получения, обладающего, противоопухолевым, действием, способ, лигнинсодержащего, радиопротекторным, антиоксидантным, антигипоксическим
Код ссылки
<a href="https://eas.patents.su/11-4230-sposob-polucheniya-ligninsoderzhashhego-farmacevticheskogo-preparata-obladayushhego-antioksidantnym-antigipoksicheskim-radioprotektornym-i-protivoopuholevym-dejjstviem.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения лигнинсодержащего фармацевтического препарата, обладающего антиоксидантным, антигипоксическим, радиопротекторным и противоопухолевым действием</a>
Предыдущий патент: Оксаминовые кислоты и их производные в качестве лигандов тиреоидных рецепторов
Следующий патент: Сочетание ингибиторов белка, переносящего эфир холестерила, и производных фибриновой кислоты для сердечно-сосудистых показаний
Случайный патент: Новое применение производного азабициклогексана