Производные аминоантрациклинона и их применение в лечении амилоидоза
Номер патента: 3333
Опубликовано: 24.04.2003
Авторы: Карузо Микеле, Сварато Антонино, Бандьера Тициано, Фанчелли Даньеле, Лансен Жаклин, Варази Марио
Формула / Реферат
1. Соединение формулы 1

в которой R1 представляет собой водород, гидрокси, группу формулы OR7, где R7 означает C1-C6-алкил, C2-C6-алкенил;
R2 представляет собой водород, гидрокси, диэтиламино, пиперидино, тетрагидропиридино или морфолино;
и либо R3, взятый в отдельности, означает водород или гидрокси и R4 и R5, взятые в отдельности, независимо означают водород, гидрокси или, взятые вместе с углеродным атомом, означают карбонильную группу;
либо R3 и R4, взятые вместе, означают группу формулы
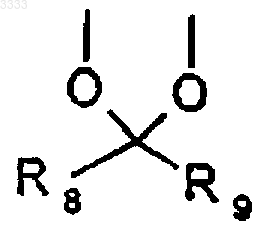
где R8 и R9 представляют собой C1-C6-алкил, a R5 означает водород;
R6 представляет собой водород или фенильную группу, необязательно замещённую метилом, метокси или галогеном,
и его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что R1 представляет собой водород, гидрокси или метокси;
R2 представляет собой водород, гидрокси или морфолино;
R3 представляет собой гидрокси;
R4, взятый в отдельности, означает гидрокси;
R5, взятый в отдельности, означает водород,
или R4 и R5, взятые вместе с атомом углерода, означают карбонильную группу;
R6 означает водород,
и его фармацевтически приемлемая соль.
3. Соединение по п.1, которое является 14-(1,2,3,6-тетрагидропиридин-1-ил)дауномициноном или его фармацевтически приемлемой солью.
4. Способ получения соединения формулы 1, как определено в п.1, который заключает в себе
(a) взаимодействие соединения формулы 2
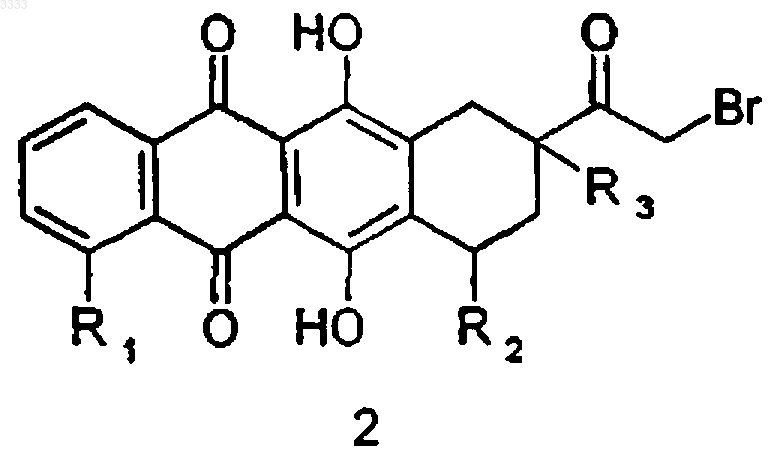
где R1 и R3 являются такими, как определено в п.1, и R2 означает водород или гидрокси,
с соединением формулы 3
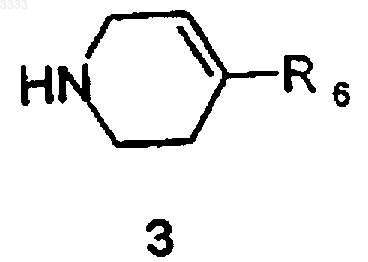
где R6 является таким, как определено в п.1, и
(b) превращение соединения формулы 1, как определено выше, в другое соединение формулы 1 путем реакции замещения гидроксильной группы в положении 7, реакции восстановления по положению 7 и положению 13 и/или при необходимости превращение полученного соединения формулы 1 в его фармацевтически приемлемую соль.
5. Способ по п.4, где на стадии (a) соединение формулы 2, как определено в п.4, взаимодействует с соединением формулы 3, как определено в п.4, в полярном апротонном органическом растворителе при температуре, варьирующейся от -10шC до комнатной температуры, и в течение периода времени от 6 до 48 ч.
6. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение формулы 1, как определено в любом из пп.1-3, или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым носителем или разбавителем.
7. Применение соединения формулы 1, как определено в любом из пп.1-3, или его фармацевтически приемлемой соли для лечения человека или животного.
8. Применение соединения формулы 1, как определено в любом из пп.1-3, или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения AL-амилоидоза, болезни Альцгеймера или синдрома Дауна.
9. Способ лечения человека или животного, страдающего от амилоидного заболевания или предрасположенного к нему, который включает в себя введение человеку или животному нетоксичного и эффективного количества соединения формулы (1), как определено в любом из пп.1-3, или его фармацевтически приемлемой соли.
Текст
1 Настоящее изобретение относится к производным антрациклинона, к их применению в лечении амилоидоза, к способам их получения и к фармацевтическим композициям, содержащим эти производные. Предыдущая патентная международная заявка WO 96/04895 этих же заявителей относится к применению в настоящее время производных антрациклинона в лечении амилоидоза, к нескольким новым соединениям, к способам их получения и к фармацевтическим композициям,содержащим эти производные. Неожиданно заявителями было обнаружено, что присутствие специфического гетероциклического остатка в скелете молекулы антрациклинона приводит к улучшенной активности этого класса соединений в качестве ингибиторов процесса агрегации амилоидных пептидов. Настоящее изобретение относится к производным антрациклинона формулы 1R2 представляет собой водород, гидрокси,диэтиламин, пиперидин, тетрагидропиридин или морфолин; либо R3, взятый в отдельности, означает водород или гидрокси; иR4 и R5, взятые в отдельности, независимо обозначают водород, гидрокси или взятые вместе с углеродным атомом, обозначают карбонильную группу; либо R3 и R4, вместе взятые, означают группу формулыR6 представляет собой водород или фенильную группу, необязательно замещенную метилом, метокси или галогеном,и к их фармацевтически приемлемой соли. Предпочтительными соединениями формулы 1 являются такие, где R представляет собой водород, гидрокси или метокси; 2 или их фармацевтически приемлемая соль. Используемый в данном тексте термин С 1 С 6 алкил включает в себя как линейные, так и разветвленные цепи из алкильных групп или фрагментов, таких, например, как метил, этил,пропил, изопропил, бутил, изобутил, третбутил, пентил, гексил и, в случае пентила или гексила, разветвленные цепи из их изомеров. Используемый в данном тексте термин С 1 С 6 алкенил включает в себя как линейные, так и разветвленные цепи из радикалов, состоящих из вплоть до 6 углеродов, таких, например, как винил, аллил, бутенил, пентенил и гексенил. Используемый в данном тексте термин галоген означает фтор, хлор, бром или йод. Это изобретение также включает в себя все возможные изомеры соединений формулы 1 и их смеси, например диастереоизомерные смеси и рацемические смеси. Таким образом, стереоцентр у положения 9 и возможные стереоцентры у положений 7 и 13 могут иметь (R)конфигурацию, или (S)-конфигурацию, или обе конфигурации, т.е. имеет место смесь стереоизомеров. Настоящее изобретение также относится к солям соединений формулы 1. Соли являются физиологически удовлетворительными или фармацевтически приемлемыми солями, образованными с участием подходящих неорганических или органических кислот. Примерами неорганических кислот являются, например, соляная и серная кислота, в то время как органическими кислотами могут быть моно-, ди- и трикарбоновые кислоты, например уксусная, трифторуксусная, винная или лимонная кислота, и сульфокислоты, например метансульфокислота или п-толуолсульфокислота. Соединения формулы 1, в которой R1, R3,R4, R5 и R6 являются такими, как определено выше, и R2 является водородом или гидрокси,могут быть получены с помощью следующих процедур:(а) взаимодействия соединения формулы 2, в которой R1 и R3 являются такими, как определено выше, и R2 является водородом или гидрокси, с соединением формулы 3(b) превращения соединения формулы 1,как определено выше, в другое соединение формулы 1 с помощью соответствующих химических реакций, таких, например, как реакции восстановления, замещения или конденсации. 3 Соединения формулы 1, полученные согласно процедурам а) и b), могут быть превращены в их фармацевтически приемлемые соли. Соединения формулы 1, в которой R1, R3 иR6 являются такими, как определено выше, R2 представляет собой водород или гидрокси и R4 и R5, взятые вместе, означают карбонильную группу, получают согласно процедуре а) путем взаимодействия соединения формулы 2 с соединением формулы 3 в подходящем органическом растворителе, например, дихлорметане, хлороформе, ацетоне, диоксане или диметилформамиде при температуре, колеблющейся от -10 С до комнатной температуры, и в течение периода от 6 до 48 ч. Органическое основание, такое как диэтиламин или этилдиизопропиламин, может присутствовать в реакционной среде. Предпочтительные условия реакции предусматривают использование эквимолярных количеств соединения 2 и 3 и этилдиизопропиламина в дихлорметане при комнатной температуре в течение периода от 6 до 24 ч. Соединения формулы 2, в которой R1 и R3 являются такими, как определено выше, и R2 представляет собой водород или гидрокси, могут быть получены путем бромирования соединения формулы 4 в которой R1 и R3 являются такими, как определено выше, и R2 представляет собой водород или гидрокси, аналогично известным процедурам, описанным в литературе (см., например,Т.Н.Smith et al., J.Org.Chem. 1977, vol. 42,р.3653). Соединения формулы 4, в которой R1 и R3 являются такими, как определено выше, и R2 представляет собой водород или гидрокси, могут быть получены, в зависимости от природы заместителей, начиная от известных антрациклинов, путем соответствующих химических модификаций (см. F.Arcamone in Doxorubicin Anticancer Antibiotics, Medical Chemistry, серия монографий, vol. 17, Academic Press, 1981). Согласно процедуре b) соединения формулы 1, как определено выше, можно превратить в другое соединение формулы 1 с помощью соответствующих методов синтеза, описанных для антрациклинов или антрациклинонов (см.F.Arcamone in Doxorubicin Anticancer Antibiotics,Medical Chemistry, серия монографий, vol. 17,Academic Press, 1981) или с помощью стандартных методов синтеза (см. J.March, AdvancedOrganic Chemistry, IV Ed., J. Wiley and Sons,1992). В качестве примера, соединение формулы 1, в которой R1, R2, R3 и R6 являются такими, как определено выше, и R4 и R5, вместе взятые, означают карбонильную группу, может быть пре 003333 4 вращено в соединение формулы 1, в которой R1,R2, R3 и R6 являются такими, как определено выше, R4 представляет собой гидрокси и R5 означает водород, путем восстановления боргидридом натрия или цианоборгидридом натрия. В другом примере соединение формулы 1,в которой R1, R3 и R6 являются такими, как определено выше, и либо R2 представляет собой гидрокси и R4 и R5, взятые вместе, означают карбонильную группу,либо R2 и R4 представляют собой гидрокси и R5 означает водород,может быть превращено в соединение формулы 1, в которой R1, R3 и R6 являются такими, как определено выше, и либо R2 представляет собой водород и R4 иR5, взятые вместе, означают карбонильную группу,либо R4 представляет собой гидрокси и R2 и R5 означают водород, путем обработки дитионитом натрия. В следующем примере соединение формулы 1, в которой R1 и R6 являются такими, как определено выше, и R2 и R5 представляют собой водород и R3 и R4 означают гидрокси, может быть превращено в соединение формулы 1, в которой R1 и R6 являются такими, как определено выше, и R2 и R5 представляют собой водород и R3 и R4, представленные вместе, означают группу формулы в которой R8 и R9 являются такими, как определено выше, путем конденсации с соединением формулы R8 СОR9 или R8C(ОCH3)2R9, где R8 и R9 являются такими, как определено выше, например, ацетоном или 2,2-диметоксипропаном, в присутствии кислого катализатора. В следующем примере соединение формулы 1, в которой R1, R3 и R6 являются такими, как определено выше, R4 и R5, взятые вместе, означают карбонильную группу и R2 означает диэтиламино, пиперидино, тетрагидропиридино или морфолино, может быть получено путем взаимодействия соединения формулы 1, в которой R1, R3 и R6 являются такими, как определено выше, R2 означает гидрокси, R4 и R5, взятые вместе, означают карбонильную группу, с этиловым эфиром хлоругольной кислоты с получением промежуточного соединения формулы 5Ed.Sc. 1979, vol. 34, p. 884), с последующим замещением с помощью избытка диэтиламина,пиперидина, тетрагидропиридина или морфолина. Соединения формулы 1, полученные согласно процедурам а) и b), могут быть превращены в их фармацевтически приемлемые соли путем растворения свободного основания в соответствующем органическом растворителе,как, например, дихлорметане, метаноле, этаноле или диоксане и добавления раствора фармацевтически приемлемой неорганической или органической кислоты в метаноле, этаноле или диоксане. Полученную соль соединения 1 извлекают путем упаривания или концентрирования солевого раствора, или эту соль осаждают путем добавления диэтилового эфира к солевому раствору. Соединения настоящего изобретения можно применять в лечении амилоидозов, поскольку они отличаются высокой ингибиторной активностью по отношению к процессу образования амилоидных отложений за счет амилоидных белков и способны вызывать деградацию имеющихся амилоидных отложений. Термин амилоидозы указывает на группу заболеваний, общей характеристикой которых является присутствие амилоидных отложений во внеклеточном пространстве. Амилоидные белки являются белками, которые проявляют склонность к агрегации и осаждению в виде амилоида. Белки, которые осаждаются как амилоид, представляют собой как нормальные белки или формы их процессинга, так и мутированные белки, в которых один или более аминокислотных остатков, находящихся в определенных положениях последовательности нормального белка, замещается на другую аминокислоту. Амилоидные отложения состоят из нерастворимых фибрилл, называемых также амилоидными фибриллами. Амилоидные фибриллы вызывают клеточную деградацию и повреждение органа,что, в свою очередь, приводит к различным патологиям, зависящим от затронутых тканей и органов. Основанием для активности соединений настоящего изобретения в случаях различных типов амилоидоза является общность ультраструктурной организации амилоидных фибрилл,несмотря на тот факт, что они могут быть образованы из ряда очень отличающихся белков(см.: Glenner G.G., New England J. Med. 1980,vol, 302, p. 1283 and p. 1333). Соединения настоящего изобретения отличаются приемлемой токсичностью и могут быть использованы для приготовления лекарственных средств, способных предупредить, подавить или замедлить образование амилоидных отложений, образованных различными амилоидными белками, или вызвать их деградацию. Поэтому соединения настоящего изобретения могут быть использованы в профилактике и в ле 003333 6 чении различных типов амилоидных заболеваний, таких, например, как системные амилоидозы и амилоидозы периферической и центральной нервной системы. Амилоидозы центральной нервной системы включают в себя, например,болезнь Альцгеймера, синдром Дауна, губчатые энцефалопатии, например, такие как болезнь Крейтцфельд-Якоба и тому подобное. В случае болезни Альцгеймера обнаруженный в амилоидных отложениях белок называется амилоидным или-белком,амилоидным белком, и его обычно обозначают как А-белок. Термин А-белок охватывает белки различной длины. В амилоидных отложениях мозга обычно обнаруживают А-белки,состоящие из 39-43 аминокислот. Нейродегенеративные расстройства, такие как губчатые энцефалопатии, характеризуются внеклеточным отложением амилоида, образованного из белка,названного белком приона (PrP). Соединения, описанные в настоящем изобретении, препятствуют агрегации мономерного пептида A-1-40, которая стимулируется обсеменением амилоидных фибрилл А-1-40. Активность соединений была определена согласно процедуре, описанной ниже. Основной раствор пептидного мономера А-1-40 получали путем растворения пептида в диметилсульфоксиде в концентрации 33,33 мг/мл. Далее основной раствор разбавляли в 11,5 раза диметилсульфоксидом. Затем этот раствор разбавляли 10 мМ фосфатным буфером, рН 7,4, содержащим 150 мМ хлорида натрия, для получения испытуемого раствора. В эппендорфовскую пробирку, содержащую 47 мкл раствора пептидного мономера А 1-40, добавляли 3 мкл 830 мкМ-го водного раствора испытуемого соединения, в котором находится 66,4 мкМ предварительно обработанных ультразвуком фибрилл А-1-40 (что определено по содержанию мономера А-1-40), полученный раствор содержал 20 мкМ мономера А-1-40, 50 мкМ испытуемого соединения и 4 мкМ (что определено по содержанию мономера А-1-40) предварительно образованных, обработанных ультразвуком, фибрилл А-1-40. Агрегация протекала в течение 2 ч при 37 С. Затем суспензию центрифугировали при 15000 об./мин в течение 15 мин при +4 С, супернатант собирали и содержание мономера A-1-40 оценивали с помощью ВЭЖХ. Активность некоторых представительных соединений представлена в табл. 1. Активность выражена в процентах ингибирования агрегации 20 мкМ раствора мономера А-1-40, которая стимулируется предварительно обработанными ультразвуком фибриллами в количестве 4 мкМ, определяемом по содержанию мономера A-1-40. Как показано в указанной выше таблице,соединения формулы 1 настоящего изобретения отличаются лучшей активностью по сравнению с соединениями, описанными этими же заявителями в предварительной международной патентной заявке РСТ WO 96/0489. В качестве сравнения, заявители испытывали соединение А 17 из их патентной международной заявки РСТ(7-деокси-14-(4 морфолинил)-дауномицинон), который оказывал ингибирование только на 11,4%. Настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы 1 или его фармацевтически приемлемую соль в качестве активного ингредиента, в сочетании с фармацевтически приемлемым носителем, наполнителем или, по необходимости, с другими добавками. Также изобретение относится к соединению формулы 1, как сказано выше, или к его фармацевтически приемлемой соли для применения в лечении человека или животного. Кроме того, настоящее изобретение относится к применению соединения формулы 1 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения амилоидных заболеваний. Фармацевтические композиции, содержащие соединение формулы 1 или его соли, могут быть получены стандартным путем с использованием стандартных нетоксичных фармацевтических носителей или разбавителей в разных дозированных формах и с помощью разных способов введения. В частности, соединения формулы 1 могут быть введены А) перорально, например, в виде таблеток,пастилок, лепешек, водной или масляной суспензии, дисперсных порошков или гранул,эмульсий, твердых и мягких капсул или сиропов или эликсиров. Предназначенные для перорального использования композиции могут быть получены любым методом, известным в данной области, для производства фармацевтических композиций, и подобные композиции могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов, чтобы препараты имели фармацевтически элегантный вид и были вкусными. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые являются подходящими для производства таблеток. Этими 8 наполнителями могут быть, например, инертные разбавители, такие, например, как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, маисовый крахмал или альгиновая кислота, связующие агенты, например маисовый крахмал, желатин или гуммиарабик, и смазки, например стеарат магния или стеариновая кислота или тальк. Таблетки могут быть не покрытыми оболочкой, или их можно покрывать оболочкой по известной технологии, чтобы задержать разрушение и абсорбцию в желудочно-кишечном тракте и тем самым обеспечить пролонгированное действие в течение длительного периода. Например, моностеарат глицерина и дистеарат глицерина могут быть использованы в качестве материала, задерживающего время разрушения. Композиция для перорального применения также может быть представлена в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии содержат активные материалы в смеси с наполнителями, подходящими для производства водных суспензий. Такими наполнителями являются суспендирующие агенты, например натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, пропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагант и аравийская камедь; диспергирующими или смачивающими агентами могут быть природные фосфатиды, например, лецитин или продукты конденсации спиртоокиси с жирными кислотами, например, стеарат полиоксиэтилена, или продукты конденсации окиси этилена с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанол, или продукты конденсации окиси этилена с неполными эфирами многоатомного спирта, полученными из жирных кислот и гексита, как например, моноолеат полиоксиэтиленсорбита, или продукты конденсации окиси этилена с неполными эфирами многоатомного спирта, полученными из жирных кислот и ангидридов гексита, например моноолеат полиоксиэтиленсорбитана. Вышеуказанные водные суспензии также могут содержать один консервант или более,например этил или н-пропил-п-гидроксибензоат, один краситель или более, один ароматизатор или более, один подсластитель или более,такой, например, как сахароза или сахарин. Масляные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или 9 кокосовом масле, или в минеральном масле,таком, например, как жидкий парафин. Масляные суспензии могут содержать загуститель,например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как перечисленные выше, и ароматизаторы могут быть добавлены для приготовления вкусного препарата. Эти композиции могут быть защищены путем добавления антиоксиданта, такого, например, как аскорбиновая кислота. Дисперсные порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, позволяют смешивать активный ингредиент с диспергирующим или смачивающим агентом,суспендирующим агентом и с одним консервантом или более. Подходящими диспергирующими или смачивающими агентами и суспендирующими агентами являются такие, которые уже были упомянуты выше. Дополнительные наполнители, например, подсластители и ароматизаторы, также могут присутствовать. Фармацевтические композиции согласно изобретению также могут быть в виде эмульсий масла в воде. Масляной фазой может быть растительное масло, например оливковое масло или арахисовое масло, или минеральное масло,например жидкий парафин, или их смеси. Подходящими эмульгаторами могут быть природные камеди, например аравийская камедь или трагант, природные фосфатиды, например лецитин из соевых бобов, и эфиры или неполные эфиры многоатомного спирта, полученные из жирных кислот и ангидридов гексита, например моноолеат сорбитана, и продукты конденсации вышеуказанных неполных эфиров многоатомного спирта с окисью этилена, например моноолеат полиоксиэтиленсорбитана. Также эмульсия может содержать подсластители и ароматизаторы. Сиропы и эликсиры могут быть приготовлены с подсластителями, например глицерином, сорбитом или сахарозой. Кроме того, подобные композиции могут содержать смягчающие агенты, консерванты и ароматизаторы и красители. В) Парентерально либо подкожно, либо внутривенно или внутримышечно или внутригрудинно, или с помощью инфузии в виде стерильной, инъецируемой, водной или масляной суспензии. Фармацевтические композиции могут быть в виде стерильных водных или масляных суспензий. Эта суспензия может быть приготовлена известным в данной области способом с использованием таких подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были описаны выше. Также стерильным инъецируемым препаратом может быть стерильный инъецируемый раствор или суспензия в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3 003333 10 бутандиоле. К приемлемым разбавителям и растворителям, которые могут быть использованы,относятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве среды для растворения или суспендирования. С этой целью обычно используют любые мягкие нелетучие масла, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят использование в приготовлении инъецируемых препаратов. Кроме того, настоящее изобретение относится к способу лечения человека или животного, например, млекопитающего, страдающего от амилоидной дистрофии или предрасположенного к ней, который заключает в себе введение человеку или животному нетоксичное и терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли. Стандартная ежедневная доза составляет приблизительно от 0,1 до 50 мг на кг веса тела, соответственно активности специфического соединения, возрасту, весу и состоянию субъекта, который принимает лечение, типу и тяжести заболевания, и частоте и способу введения; предпочтительно, когда ежедневные дозы находятся в интервале от 5 мг до 2 г. Количество активного ингредиента, который можно комбинировать с носителями с получением стандартной лекарственной формы, будет изменяться в зависимости от хозяина, который принимает лечение, и способа введения. Например, композиция, предназначенная для перорального введения, может содержать от 5 мг до 2 г активного агента, смешанного с соответствующим и подходящим количеством носителя, которое может варьировать приблизительно от 5 до 95% от общей композиции. Стандартные лекарственные формы обычно содержат приблизительно от 5 до 500 мг активного ингредиента. Следующие примеры иллюстрируют изобретение без его ограничений. Принятая аббревиатура, используемая в примерах данного изобретения:NMR - ядерный магнитный резонанс (ЯМР),MHz - мегагерц,Hz - герц,s - синглет,d - дублет,t - триплет,m - мультиплет. Пример 1. 14-(1,2,3,6-Тетрагидропиридин-1 ил)дауномицинон (1a). 11 в Т.Н.Smith et al., J.Org.Chem. 1977, vol. 42, р. 3653) в 510 мл дихлорметана добавляли N,Nдиизопропилэтиламин (3,49 мл, 0,02039 моль) и 1,2,3,6-тетрагидропиридин (1,85 мл, 0,02039 моль). Реакционную смесь перемешивали 6 ч при комнатной температуре. Затем реакционную смесь разбавляли дихлорметаном, промывали водой и органический слой высушивали над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении, и продукт извлекали с помощью колоночной хроматографии на силикагеле, используя смесь хлороформа и метанола 98:2 (по объему) в качестве элюента. Сырой продукт растирали в порошок с диэтиловым эфиром, фильтровали и промывали диэтиловым эфиром с получением 5,30 г (65% выхода) соединения 1 а, указанного в заголовке,т. пл. 177-180 С (с разложением).Hz, 1H, H-1); 13,30, 13,97 (широкие сигналы,2H, ОН-6 + ОН-11). Соединение 1 а превращали в его хлористоводородную соль согласно следующей процедуре. Раствор 1,08 г 1a в 20 мл дихлорметана обрабатывали при перемешивании посредством 1,25 мл 2N НСl в изопропаноле. Затем добавляли по каплям диэтиловый эфир и перемешивание продолжали в течение 15 мин. Осажденную соль фильтровали, промывали диэтиловым эфиром и высушивали под вакуумом при 30 С с получением 1,13 г твердого продукта красного цвета, т. пл. 188-190 С (с разложением). Пример 2. 13-Дигидро-14-(1,2,3,6-тетрагидропиридин-1-ил)дауномицинон (1b). К раствору соединения 1 а (1,8 г, 0,00375 моль) в 36 мл метанола добавляли 36 мл раствора уксусной кислоты в метаноле (приготовленного разбавлением 3 мл ледяной уксусной кислоты с 50 мл метанола) и раствор цианоборгидрида натрия (1,17 г, 0,01876 моль) в 18 мл метанола. Реакционную смесь перемешивали 3 ч при комнатной температуре. Вторую порцию цианоборгидрида натрия (0,6 г, 0,00938 моль) добавляли и реакционную смесь перемешивали 2 ч; по истечении этого времени добавляли тре 003333 12 тью порцию цианоборгидрида натрия (0,3 г,0,00469 моль) и реакционную смесь перемешивали в течение еще 1 ч. Реакционную смесь прибавляли к 8,82 г бикарбоната натрия и растворитель упаривали при пониженном давлении. Остаток вместе с 1 л воды экстрагировали дихлорметаном. Органические экстракты объединяли, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток растирали в порошок с диэтиловым эфиром и фильтровали с получением 1,52 г сырого 1b. Часть сырого продукта (0,3 г) очищали с помощью колоночной хроматографии на силикагеле, используя смесь хлороформа и метанола (47:3 по объему) в качестве элюента, и получали 0,13 г чистого 1b в виде смеси диастереоизомеров, т. пл. 105-107 С (с разложением). К раствору 1b (5,9 г, 0,01225 моль) в 100 мл диметилформамида в атмосфере азота добавляли при перемешивании по каплям дитионит натрия (6,26 г, 0,0306 моль) в 50 мл воды. Реакционную смесь перемешивали 2 ч при комнатной температуре, вливали в 1,5 л воды и экстрагировали хлороформом. Органический слой промывали рассолом, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток разделяли с помощью колоночной хроматографии на силикагеле,используя смесь хлороформа и метанола (47:3 по объему) в качестве элюента. После первой хроматографии была получена чистая фракция менее полярного изомера 1 с в количестве 0,69 г,т. пл. 215-218 С (с разложением).Hz, 1H, H-2); 8,02 (d, J=7,7 Hz, 1H, H-1); 13,55,13,87 (два синглета, 2 Н, ОН-6 + ОН-11). Действуя так, как описано в примере 1, соединение,название которого указано в заголовке, превращали в его хлористо-водородную соль, т. пл. 248-251 С (с разложением). Фракции, обогащенные другим изомером, объединяли и разделяли колоночной хроматографией с получением чистой фракции более полярного изомера Id в количестве 0,1 г, т. пл. 194-196 С (с разложением).(два синглета, 2H, ОН-6 + ОН-11). Действуя так,как описано в примере 1, соединение, название которого указано в заголовке, превращали в его хлористо-водородную соль, т. пл. 270 С. Пример 4. 9,13-Изопропилиденкеталь К раствору 1 с (0,24 г, 0,00051 моль) в 9 мл диметилформамида добавляли 25 мл 2,2 диметоксипропана и 0,8 мл трифторметансульфоновой кислоты. Реакционную смесь нагревали при температуре 90 С в течение 3 ч, затем добавляли вторую порцию 2,2-диметоксипропана (10 мл) и трифторметансульфоновой кислоты (0,4 мл) и реакционную смесь нагревали в течение еще 2 ч. Реакционную смесь выливали в 500 мл насыщенного раствора бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали водой, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь хлороформа и метанола (50:1 по объему) в качестве элюента, и получали 0,14 г (53% вы 003333 Начиная от исходного соединения 1d и действуя так, как описано в примере 4, получали соединение 1f, название которого указано в заглавии, с выходом 45%, т. пл. 133-135 С (с разложением). К раствору 1 а (0,5 г, 0,001 моль) в 8 мл диметилформамида в атмосфере азота при перемешивании добавляли по каплям дитионит натрия (0,53 г, 0,026 моль) в 4 мл воды. Реакционную смесь перемешивали 3 ч при комнатной температуре, выливали в 100 мл воды и экстрагировали хлороформом. Органический слой промывали рассолом, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток разделяли колоночной хроматографией на силикагеле, используя смесь хлороформа и метанола (48:2 по объему) Указанное в заголовке соединение получали так, как описано в примере 1, начиная от исходного соединения 4-деметил-14-бромдауномицинона, которое было получено путем бромирования 4-деметилдауномицинона, согласно описанной в литературе процедуре (см.: Т.Н.Smith et al., J.Org.Chem. 1977, vol. 42, р. 3653). 4-деметилдауномицинон получали так,как описано в G.Cassinelli et al., J. Antibiotics 1978, vol. 31, р. 178.H-ЯМР (400 MHz, DMSO-d6),: 2,0-2,2 (m, 2H, CH2-8); 2,08 (m, 2H, CH23 тетрагидропиридин); 2,57 (m, 2H, CH2-2 тетрагидропиридин); 2,9-3,1 (m, 4H, CH2-10 + CH2-6 тетрагидропиридин); 3,75, 3,81 (два дублета,J=18,8 Hz, 2H, CH2-14); 5,04 (m, 1H, Н-7); 5,61,5,68 (два мультиплета, 2H, CH=CH тетрагидропиридин); 6,10 (широкий сигнал, 2H, ОН-7 + ОН-9); 7,39 (m, 1H, Н-3); 7,80 (m, 2H, Н-1 + Н 2); 11,9, 12,8 (широкие сигналы, 2H, ОН-11 + ОН-4); 14,40 (широкий сигнал, 1H, ОН-6). Действуя так, как описано в примере 1, соединение, название которого указано в заголовке, превращали в его хлористо-водородную соль. Пример 8. (9S)-4-деметокси-7-деокси-14(1,2,3,6-тетрагидропиридин-1-ил)дауномицинон Указанное в заголовке соединение получали так, как описано в примере 1, начиная от исходного соединения (9S) -4-деметокси-7-деокси 14-бромдауномицинона, которое было получено(9S)-4-деметокси-7-деоксидауномицинона согласно описанной в литературе процедуре (см. Т.Н.Smith et al., J.Org.Chem. 1977, vol. 42, р. 3653). Указанное в заголовке соединение имеет т.пл. 150-153 С (с разложением).+Н-3); 8,33 (m, 2H, Н-1 + Н-4); 13,48 (s, 2H, ОН 6 + ОН-11). Действуя так, как описано в примере 1, указанное в заголовке соединение превращали в его хлористо-водородную соль. Пример 9. (9R)-4-деметокси-7-деокси-14(1,2,3,6-тетрагидропиридин-1-ил)дауномицинон Указанное в заголовке соединение получали так, как описано в примере 1, начиная от исходного соединения (9R)-4-деметокси-7-деокси-14-бромдауномицинона, которое было получено бромированием (9R)-4-деметокси-7-деоксидауномицинона согласно описанной в литературе процедуре (см. Т.Н.Smith et al., J.Org.Chem. 1977, vol. 42, р. 3653). Исходное соединение (9R)-4-деметокси-7-деоксидауномицинон было получено по методу, описанному в С.М. Wong et al Can. J. Chem. 1971, vol. 49,р. 2712.(два мультиплета, 2H, CH=CH тетрагидропиридин); 7,80 (m, 2H, Н-2 + Н-3); 8,33 (m, 2H, Н-1 + Н-4); 13,48 (S, 2H, ОН-6 + ОН-11). Действуя так, как описано в примере 1, указанное в заголовке соединение превращали в его хлористо-водородную соль. Пример 10. 7-Деокси-7-(4-морфолинил)-14(1,2,3,6-тетрагидропиридин-1-ил)дауномицинон 17 К раствору соединения 1 а (1 г, 0,00208 моль) и триэтиламина (3 мл, 0,0208 моль) в 65 мл дихлорметана при перемешивании и охлаждении до 0 С в бане со льдом добавляли по каплям этиловый эфир хлоругольной кислоты (1,52 мл, 0,01589 моль) в 10 мл дихлорметана. Реакционную смесь перемешивали 2 ч при комнатной температуре, затем разбавляли дихлорметаном, промывали водой и высушивали над безводным сульфатом натрия. Полученный раствор упаривали при пониженном давлении с получением 1,65 г остатка желтого цвета сырого 6,7,11-триэтоксикарбонил-14-(1,2,3,6-тетрагидропиридин-1-ил)дауномицинона, который использовали как таковой в следующей стадии. Сырой 6,7,11-триэтоксикарбонил-14-(1,2,3,6 тетрагидропиридин-1-ил)дауномицинон перемешивали 15 мин в 10 мл морфолина. Реакционную смесь разбавляли хлороформом и промывали водой и затем буфером рН 7. Органический слой высушивали над безводным сульфатом натрия, упаривали при пониженном давлении и продукт извлекали с помощью колоночной хроматографии на силикагеле, используя смесь хлороформа и метанола (48:2 по объему) в качестве элюента. Указанное в заголовке соединение 1k (0,28 г) получали с общим выходом 24%, т. пл. 137-138 С.(dd, J=2,6, 14,5 Hz, 1H, CH (H)-8); 2,50, 3,00 (два мультиплета, 4 Н, N (CH2)2 (CH2) 20); 2,70 (m,2 Н, CH2-2 тетрагидропиридин); 3,15 (m, 2H,CH2-6 тетрагидропиридин); 3,19 (s, 2H, CH2-10); 3,65 (m, 4H, N (CH2)2 (CH2)2O); 3,82, 3,99 (два дублета, J=19,4 Hz, 2H, CH2-14); 4,09 (s, 3 Н,ОCH3); 4,35 (dd, J=2,6, 3,4 Hz, 1H, H-7); 5,65,5,78 (два мультиплета, 2H, CH=CH тетрагидропиридин); 7,40 (d, J=7,7 Hz, 1H, H-3); 7,79 (dd,J=7,7 Hz, 1H, H-2); 8,04 (d, J=7,7 Hz, 1H, H-1); 13,30, 14,12 (широкие сигналы, 2H, ОН-6 + ОН 11). Действуя так, как описано в примере 1,указанное в заголовке соединение превращали в его хлористо-водородную соль. Пример 11. Таблетки, содержащие следующие ингредиенты, могут быть получены стандартным способом: Ингредиент На таблетку Соединение 1 25,0 мг Лактоза 125,0 мг Маисовый крахмал 75,0 мг Тальк 4,0 мг Стеарат магния 1,0 мг Общий вес 230,0 мг Пример 12. Капсулы, содержащие следующие ингредиенты, могут быть получены стандартным способом: 18 Ингредиент Соединение 1 Лактоза Маисовый крахмал Тальк Вес капсулыR2 представляет собой водород, гидрокси,диэтиламино, пиперидино, тетрагидропиридино или морфолино; и либо R3, взятый в отдельности, означает водород или гидрокси и R4 и R5, взятые в отдельности, независимо означают водород, гидрокси или, взятые вместе с углеродным атомом,означают карбонильную группу; либо R3 и R4, взятые вместе, означают группу формулыR6 представляет собой водород или фенильную группу, необязательно замещнную метилом, метокси или галогеном,и его фармацевтически приемлемая соль. 2. Соединение по п.1, отличающееся тем,что R1 представляет собой водород, гидрокси или метокси;R6 означает водород,и его фармацевтически приемлемая соль. 3. Соединение по п.1, которое является 14(1,2,3,6-тетрагидропиридин-1-ил)дауномициноном или его фармацевтически приемлемой солью. 4. Способ получения соединения формулы 1, как определено в п.1, который заключает в себе(а) взаимодействие соединения формулы 2 где R1 и R3 являются такими, как определено в п.1, и R2 означает водород или гидрокси,с соединением формулы 3(b) превращение соединения формулы 1,как определено выше, в другое соединение формулы 1 путем реакции замещения гидроксильной группы в положении 7, реакции восстановления по положению 7 и положению 13 и/или при необходимости превращение полученного соединения формулы 1 в его фармацевтически приемлемую соль. 5. Способ по п.4, где на стадии (а) соединение формулы 2, как определено в п.4, взаимодействует с соединением формулы 3, как определено в п.4, в полярном апротонном органическом растворителе при температуре, варьирую 20 щейся от -10 С до комнатной температуры, и в течение периода времени от 6 до 48 ч. 6. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение формулы 1, как определено в любом из пп.1-3, или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым носителем или разбавителем. 7. Применение соединения формулы 1, как определено в любом из пп.1-3, или его фармацевтически приемлемой соли для лечения человека или животного. 8. Применение соединения формулы 1, как определено в любом из пп.1-3, или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения ALамилоидоза, болезни Альцгеймера или синдрома Дауна. 9. Способ лечения человека или животного, страдающего от амилоидного заболевания или предрасположенного к нему, который включает в себя введение человеку или животному нетоксичного и эффективного количества соединения формулы (1), как определено в любом из пп.1-3, или его фармацевтически приемлемой соли.
МПК / Метки
МПК: C07D 211/70, A61K 31/65, A61P 25/28
Метки: аминоантрациклинона, лечении, производные, амилоидоза, применение
Код ссылки
<a href="https://eas.patents.su/11-3333-proizvodnye-aminoantraciklinona-i-ih-primenenie-v-lechenii-amiloidoza.html" rel="bookmark" title="База патентов Евразийского Союза">Производные аминоантрациклинона и их применение в лечении амилоидоза</a>
Предыдущий патент: Замещенное производное триазолопиридазина, фармацевтические композиции, приготовленные на его основе
Следующий патент: Производные пиридонкарбоновой кислоты и антибактериальная композиция на их основе
Случайный патент: Система дезактивации активного вещества в трансдермальном средстве















