Ферментированный высушенный материал, способ его получения и его применение для получения фармацевтической композиции и диетической добавки, а также фармацевтическая композиция и диетическая добавка,содержащие указанный материал
Номер патента: 3090
Опубликовано: 26.12.2002
Авторы: Рашо Эржебет, Лапиш Карой, Сенде Бела, Хидвеги Мате, Темешкезине Фаркаш Рита
Формула / Реферат
1. Ферментированный высушенный материал, являющийся иммуностимулятором и ингибирующий метастазы, который получают из сбраживаемой жидкости посредством ферментации пшеничного зерна с применением Saccharomyces cerevisiae в водной среде, который имеет ВЭЖХ-хроматограмму, по существу соответствующую представленной на фиг. 3, и содержание в нем 2,6-диметоксипарабензохинона составляет 0,12-0,52 мг/г сухого материала, а содержание 2-метоксипарабензохинона составляет 0,05-0,28 мг/г сухого материала, определяемого путем ВЭЖХ.
2. Материал по п.1, отличающийся тем, что содержание в нем 2,6-диметоксипарабензохинона составляет 0,4 мг/г сухого материала.
3. Способ получения ферментированного высушенного материала по любому из пп.1-2, являющегося иммуностимулятором и ингибирующего метастазы, отличающийся тем, что размолотое пшеничное зерно ферментируют в водной среде в присутствии Saccharomyces cerevisiae и сбраживаемую жидкость отделяют, тщательно фильтруют, выпаривают, кипятят и сушат как есть или в присутствии вспомогательных осушающих материалов.
4. Способ по п.3, отличающийся тем, что ферментацию проводят при температуре 30шС примерно в течение 18 ч в условиях аэрации и перемешивания.
5. Способ по п.4, отличающийся тем, что сушку проводят в присутствии мальтодекстрина.
6. Фармацевтический продукт, являющийся иммуностимулятором и ингибирующий метастазы, отличающийся тем, что содержит в качестве активного агента высушенный материал по любому из пп.1-2, полученный из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствии Saccharomyces cerevisiae.
7. Диетическая добавка для млекопитающих, отличающаяся тем, что содержит высушенный материал по любому из пп.1-2, полученный из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствии Saccharomyces cerevisiae.
8. Диетическая добавка по п.7, отличающаяся тем, что содержит ферментированный высушенный материал в количестве 60 вес.% и дополнительно мальтодекстрин в количестве 40 вес.%.
9. Применение высушенного материала по любому из пп.1-2, полученного из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствии Saccharomyces cerevisiae, для получения иммуностимуляторной и ингибирующей метастазы фармацевтической композиции.
10. Применение высушенного материала по любому из пп.1-2, полученного из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствии Saccharomyces cerevisiae, для получения диетической добавки для млекопитающих.
Текст
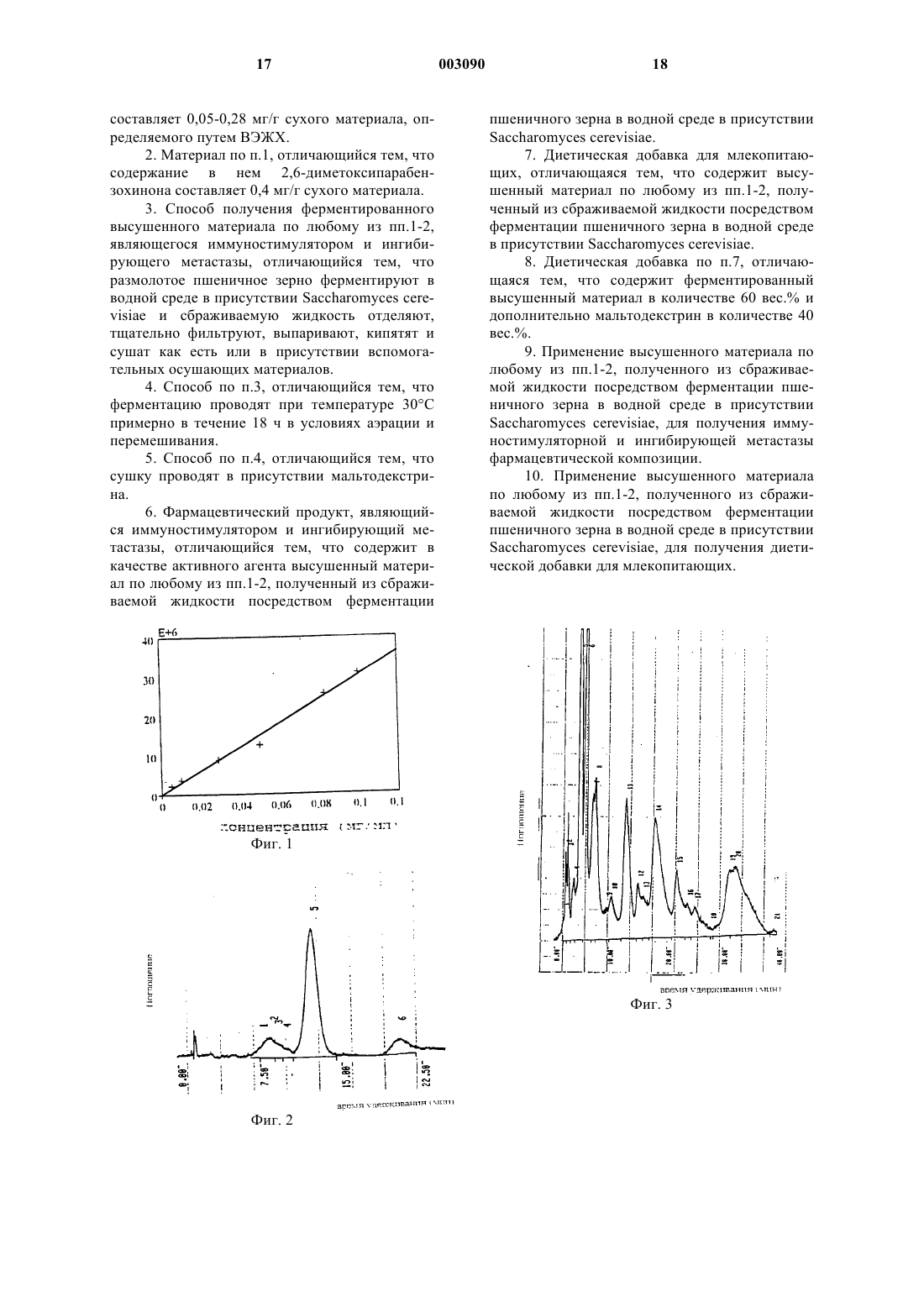
1 Данное изобретение касается ферментированного и высушенного вегетативного материала, являющегося иммуностимулятором и ингибирующего метастазы, содержащих его фармацевтических композиций, способа получения этого материала и применения сухого вегетативного материала в качестве диетической добавки и в производстве иммуностимуляторных фармацевтических композиций, в особенности фармацевтических композиций, ингибирующих метастазы. Одной из основных целей лечения опухолей является ингибирование метастазов, так как первичная опухоль, вызванная злокачественным ростом клеток, распространяется посредством метастазов в соседние клетки и органы и вызывает впоследствии вторичные опухоли, которые не могут быть удалены хирургически и могут быть невосприимчивы к химиотерапии. Все более и более исследователи концентрируются на разработке иммуномодуляторных материалов и интенсивно исследуют материалы природного, в основном растительного, происхождения. Хорошо известен факт, что соединения со структурой хинона играют важную биологическую роль. В растениях обнаружены некоторые производные хинона, такие как убихиноны,пластохиноны, менахиноны, которые играют определенную роль в фотосинтезе, а также в клеточной дыхательной системе позвоночных животных, в том числе человека, и при коагуляции крови и др. Для медицинских целей применяют также некоторые производные бензохинона. Адриамицин, даунорубицин и митомицин С представляют собой производные хинона с цитостатическим действием, тогда как бензо- и гидрохиноны оказывают противомикробное действие и являются активными компонентами антибиотиков, подходящих для лечения бактериальных инфекций, таких как Тетран-В(Tetran-B), метациклин (Metacyclin) и доксициклин (Doxycyclin). В литературе сообщается, что 2,6 диметоксипарабензохинон (2,6-DMBQ) и 2 метоксипарабензохинон (2-MBQ) обладают фунгицидным и бактериостатическим эффектом, а также являются цитотоксичными для злокачественных опухолевых клеток [Int. Quant.(1991)]. Показано, что смесь 2,6-диметоксипара-бензохинона и аскорбиновой кислоты ингибирует рост асцитных опухолевых клеток Эрлиха (Ehrlich ascites tumor cells) у мышей [Ргос.Natl. Acad. Sci. USA 81, 2088-2091 (1984) и 82,1439-1442 (1985)]. 2,6-Диметоксипарабензохинон и 2-метоксипарабензохинон найдены и выделены из некоторых растений [Magy. Kern.Folyoirat 103/7, 320-325 (1996)]. Эти два соединения в глюкозидной форме можно найти в 2 больших количествах в пшенице (Tricitum vulgaris), точнее, в пшеничном зерне. Соединение выделяли в пятидесятых годах из пшеничного зерна, ферментированного при помощи дрожжей и идентифицированного с целью проверки ухудшения качества хлеба, к которому это пшеничное зерно добавляли [Helv. Him. Acta. 33,433 (1950); J. Chem. Soc. London 1952, 48214823]. Согласно литературе, в пшеничном зерне количество 2-MBQ составляет около 0,05 вес.%,a 2,6-DMBQ - около 0,01 вес.% (в виде глюкозида). Присутствие хинонов в виде глюкозидов объясняется тем фактом, что хиноны, в особенности метоксизамещенные пара-бензохиноны реактивны, тогда как их гидрохинон-глюкозиды более стабильны и инертны. Во время экспериментов, касающихся исследования ферментации пшеничного зерна,авторы сделали вывод, что сухой экстракт из сбраживаемой жидкости, полученной при ферментации пшеничного зерна с использованием пекарных дрожжей (Saccharomices cerevisiae),оказывает удивительное иммуностимулирующее действие и действие, ингибирующее метастазы, и может успешно использоваться в качестве активного агента фармацевтических композиций, являющихся иммуностимуляторами и ингибирующих метастазы. Этот вывод удивителен, так как, хотя в литературе и сообщается [Ргос. Natl. Acad. Sci.USA 80, 129 (1983)] о том, что смесь 2,6-DMBQ и аскорбиновой кислоты ингибирует рост асцитных опухолевых клеток Эрлиха (Ehrlich ascites tumor cells) - она замечательным образом подходит для количественного анализа роста опухолей и для изучения их биохимических функций - доказано, что экстракт, описанный в данном изобретении, который, кроме неопределимых компонентов, содержит 2,6-DMBQ и 2MBQ, практически неэффективен относительно клеток этой первичной опухоли, даже при соединении с аскорбиновой кислотой (как правило, относительно всех первичных опухолей) и доказано, что он эффективен только при лечении метастазов. Аспекты лечения первичных опухолей и развивающихся из них метастазов в основном различны, таким образом, для исследователя не очевидно, что растительный экстракт, содержащий компоненты, которые, как известно, эффективны при лечении первичных опухолей и пока не полностью идентифицируемы по своему химическому составу, должен оказывать иммуностимуляторное действие и ингибировать метастазы [Cancer. Principles andCompany, Philadelphia, 1993]. Таким образом, настоящее изобретение касается ферментированного и высушенного вегетативного материала, являющегося иммуностимулятором и ингибирующего метастазы, который можно получить посредством ферментации 3 пшеничного зерна в водной среде с использованием пекарных дрожжей, фильтрования сбраживаемой жидкости, не содержащей клеток, и ее сушки. Настоящее изобретение касается также фармацевтической композиции, являющейся иммуностимулятором и ингибирующей метастазы, активный агент которой содержит ферментированный, высушенный вегетативный материал, описанный в данном изобретении. Настоящее изобретение касается также применения указанного выше ферментированного и высушенного вегетативного материала в получении фармацевтических композиций, являющихся иммуностимуляторами и ингибирующих метастазы. Настоящее изобретение касается также способа лечения млекопитающих с целью стимуляции иммунной системы и ингибирования метастазов при помощи фармацевтической композиции, описанной в данном изобретении. Кроме того, данное изобретение касается диетической добавки, включающей в себя ферментированный сухой вегетативный материал,описанный в данном изобретении, и мальтодекстрин. Ферментированный сухой вегетативный материал согласно изобретению идентифицируют и исследуют на основе содержания в нем 2,6-DMBQ. Здесь нам хотелось бы отметить, что полная идентификация химического состава этого экстракта доступными методами невозможна, таким образом, все данные касаются содержания 2,6-DMBQ как основы. Доказано, что для получения ферментированного сухого вегетативного материала, описанного в настоящем изобретении, удобно использовать пшеничное зерно (которое является побочным продуктом мукомольного производства и имеется в больших количествах), размолотое до муки, в его исходном состоянии либо обезжиренное. Использование обезжиренного пшеничного зерна не имеет особых преимуществ. Ферментацию проводят с использованием пекарных дрожжейcerevisiae). Этот тип дрожжей доступен коммерчески. Период ферментации составляет примерно 10-24 ч, предпочтительно 15-20 ч или около 18 ч. Температура ферментации составляет примерно 25-35 С, предпочтительно около 30 С. Весовое соотношение пшеничного зерна и дрожжей составляет 4:1 - 2:1, предпочтительно примерно 3:1, весовое соотношение сухого вещества и воды составляет 1:6 -1:12, предпочтительно 1:9. Ферментацию (в лабораторном масштабе) можно проводить, например, добавляя в стеклянный бродильный аппарат к свежемолотому пшеничному зерну суспензию дрожжей в воде и перемешивая или встряхивая эту смесь. Сбраживаемая жидкость дает пену. 4 После ферментации смесь центрифугируют в течение 5-15 мин при 2000-4500 об./мин.,предпочтительно примерно 3000 об./мин. Супернатант кипятят, охлаждают и сушат подходящим способом, например, посредством лиофилизации или распыления. Продукт, красно-коричневый порошок,представляет собой материал согласно изобретению. Целесообразно хранить этот материал до следующего использования охлажденным и в закупоренном контейнере вследствие его гигроскопичности. Содержание 2,6-DMBQ в полученном сухом материале составляет примерно 0,4 мг/г. В случае ферментации в большом масштабе (например, 4 м 3) удобно применять непрерывную аэрацию, например, 0,5 л воздуха/л сбраживаемой жидкости/в минуту, и медленное перемешивание. Время ферментации составляет примерно 18 ч. Для ингибирования пенообразования можно применять обычные добавки(предпочтительно использовать подсолнечное масло). В конце процесса ферментации прекращают аэрацию и перемешивание и обычным образом отделяют сбраживаемую жидкость от пшеничного зерна - суспензии дрожжей, например, в шнековом отстойнике, затем в сепараторе и фильтр-прессе. Если необходимо, можно добавить вспомогательный фильтровальный материал. Удобно использовать 5-10 кг фильтрующего перлита на кубический метр сбраживаемой жидкости. Сброженную жидкость тщательно фильтруют и проверяют качество фильтрования при помощи микроскопа. Отфильтрованная сброженная жидкость практически не содержит клеток, это означает, что обнаруживают не более 1 клетки дрожжей на 10 полей зрения под микроскопом. Полученную сброженную жидкость, которая содержит примерно 1,5 вес.% сухого продукта, выпаривают в вакуумном конденсоре, предпочтительно при температуре около 40-50 С, и после снятия вакуума кипятят при атмосферном давлении примерно в течение 15 мин. В результате этого снижаются вредные активности фермента. Затем смесь сушат посредством распыления, например, во вращающемся аппарате для распыления. Если применяют описанный выше способ ферментации,содержание 2,6-DMBQ в полученном сухом вегетативном материале составляет 0,12-0,52 мг/г сухого материала, а содержание 2-MBQ составляет 0,05-0,28 мг/г сухого материала (в зависимости от содержания бензохинона в использованном пшеничном зерне). Так как конечный продукт гигроскопичен,для повышения эффективности распылительной сушки и применения конечного продукта можно использовать при распылительной сушке одну из обычных добавок, например, мальтодекстрин, аравийскую камедь, кизельгуровую смолу,ксантан, муку из плодов робинии (locust bean) и др. Предпочтительно использовать мальтодек 5 стрин. Удобно определить содержание сухого материала в выпаренной в вакуумном конденсаторе и прокипяченной смеси и добавить мальтодекстрин в таком количестве, чтобы содержание сухого материала в подлежащей высушиванию смеси составляло примерно 30 вес.%. Удобно растворить мальтодекстрин в горячей воде и добавлять его к выпаренной смеси охлажденным. После сушки конечный продукт (порошок) содержит примерно 60 вес.% ферментированного сухого вегетативного материала и примерно 40 вес.% мальтодекстрина. Стабильность полученного материала можно проверить, следя за изменениями концентрации 2,6-DMBQ. Количественный анализ можно выполнить методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Полученный в соответствии с описанным выше способом порошок остается стабильным примерно в течение 3 лет при комнатной температуре. Ферментированный высушенный вегетативный материал согласно изобретению можно применять в качестве активного агента фармацевтических композиций, являющихся иммуностимуляторами и ингибирующих метастазы. Кроме указанного активного агента, эти фармацевтические композиции могут также содержать аскорбиновую кислоту или другие цитостатические материалы. Ферментированный сухой вегетативный материал можно перерабатывать в обычные твердые или жидкие фармацевтические композиции для перорального или парентерального использования. При получении фармацевтических композиций необходимо принимать во внимание гигроскопичность ферментированного сухого вегетативного материала. Подходящей формой является капсула, которая защищает активный агент от влажности воздуха. При получении фармацевтических композиций можно использовать вспомогательные вещества, обычно применяемые в фармацевтической практике. Так как такие вещества и их возможные применения подробно описаны в фармацевтической литературе, выбор и получение подходящих форм представляет собой рутинную задачу. Разовую дозу активного агента можно варьировать в широких пределах, в зависимости от состояния пациента, а ответственность за выбор подходящей эффективной дозировки всегда несет лечащий врач. Как правило,хорошие результаты можно получить при дозировке 0,001-100 г, предпочтительно 0,01-50 г, более предпочтительно 0,1-40 г на кг веса тела, например, при дозировках 0,1-10, 1-25 или 10-30 г. Ферментированный высушенный вегетативный материал согласно изобретению можно также смешать с аскорбиновой кислотой (Витамин С). Согласно опыту авторов, аскорбиновая кислота может усиливать эффект ингибирования метастазов материала согласно изобретению. 6 Весовое соотношение ферментированного высушенного вегетативного материала и аскорбиновой кислоты может составлять, например,10:1 - 1:1, предпочтительно 6:1 - 2:1, более предпочтительно 3:1, 4:1 или 5:1. Данное изобретение касается также лечения в плане иммуностимуляции и/или ингибирования метастазов при помощи ферментированного высушенного вегетативного материала согласно изобретению. Главным в таком лечении является прием пациентом эффективной дозы ферментированного высушенного вегетативного материала. Ферментированный высушенный вегетативный материал можно также использовать в качестве диетической добавки для млекопитающих. В этом случае предпочтительно применять смесь, содержащую мальтодекстрин и обычные вспомогательные вещества, применяемые в пищевой промышленности, например,ароматические вещества, подслащивающие агенты, красители и др. Диетическую добавку можно, например, получить посредством гранулирования смеси, содержащей 60 вес.% сухого продукта и 40 вес.% мальтодекстрина плюс ароматические вещества и подслащивающие агенты в жидком носителе, и упаковки гранулята быстрого применения, например, в пакетики. Ниже описаны приложенные фигуры. Фиг. 1 - калибровочный график определения 2,6-DMBQ методом высокоэффективной жидкостной хроматографии (ВЭЖХ); фиг. 2 - ВЭЖХ-хроматограмма хлороформного экстракта данного материала; фиг. 3 - ВЭЖХ-хроматограмма этанольного экстракта данного материала; фиг. 4 - связывание опухолевых клеток В 16 в присутствии лиофилизатов разных концентраций через 60 и 90 мин после посева (каждое значение представляет собой среднее из 8 параллельных определенийстандартное отклонение, оценка по спектрофотометрическим данным); фиг. 5 - эффект различных доз лиофилизата на пролиферацию клеток В 16 через 24 и 48 ч после начала обработки (каждое значение представляет собой среднее из 8 параллельных определенийстандартное отклонение, оценка по спектрофотометрическим данным); фиг. 6 - развитие меланомы человека А 2058 в присутствии различных доз лиофилизата через 24 ч после начала обработки. Оценку культур проводили на основе белковой (SRB) и дегидрогеназной активности (МТТ) путем параллельных спектрофотометрических измерений (каждое значение представляет собой среднее из 8 параллельных определенийстандартное отклонение); фиг. 7 - соотношение апоптотических клеток (FACS - анализ с применением клеточного сортера с возбуждением флуоресценции) in vitro в культурах клеток меланомы человека А 2058 7 после обработки различными дозами лиофилизата. Следующие далее примеры приведены с целью иллюстрации ферментированного высушенного вегетативного материала согласно изобретению, его получения и фармакологических эффектов. Пример 1. Ферментация пшеничного зерна в лабораторном масштабе. Суспензию 33,3 г дрожжей (Saccharomycescerevisiae) и 1000 мл питьевой воды добавляют к 100 г свежего пшеничного зерна (в соответствии со стандартом Венгрии MSZ-081361-80), размолотого до состояния муки. Смесь встряхивают в шейкере в течение 18 ч при 30 С. В это время сбраживаемая жидкость дает пену и увеличивает исходный объем в три раза. После ферментации смесь центрифугируют в течение 15 мин при 3000 об./мин. После кипячения и охлаждения супернатант сушат посредством лиофилизации и полученный лиофилизованный продукт хранят до следующего применения в морозильной камере (-10 С). Содержание 2,6-DMBQ в полученном лиофилизате составляет 0,4 мг/г сухого материала (0,04% по весу). Пример 2. Ферментация пшеничного зерна в большом масштабе. 300 кг пшеничного зерна, размолотого до состояния муки (в соответствии со стандартом Венгрии), и 100 кг дрожжей помещают в бродильный чан на 5 м 3 и добавляют питьевую воду до объема 4000 л. Время ферментации составляет 18 ч, при этом применяют непрерывную аэрацию (0,5 л воздуха/л сбраживаемой жидкости/мин.) и медленное перемешивание (30 об./мин). Для ингибирования пенообразования к смеси добавляют подсолнечное масло, 1 л/м 3. После ферментации прекращают аэрацию и перемешивание и сбраживаемую жидкость отделяют сначала в шнековом осадителе, затем в сепараторе и в заключение на фильтр-прессе с текстильным фильтром. Добавляют 10 кг фильтрующего перлита/м 3. Сбраживаемую жидкость четко фильтруют и проверяют точность фильтрования при помощи микроскопа. Отфильтрованная сброженная жидкость практически не содержит клеток, это означает, что обнаруживают не более 1 клетки дрожжей на 10 полей зрения под микроскопом. Полученную сброженную жидкость, которая содержит примерно 1,5 вес.% сухого материала, выпаривают в вакуумном конденсаторе при температуре 4050 С, и после снятия вакуума кипятят при атмосферном давлении примерно в течение 15 мин. После этого определяют содержание в растворе сухого материала и добавляют такое количество мальтодекстрина (который сначала растворяют в горячей воде и затем охлаждают), что содержание в растворе сухого материала становится примерно 30 мас.%. После этого раствор сушат распылением во вращающемся распылительном сушительном аппарате, снабженном сдвигаю 003090drier), в котором температура выходящего воздуха составляет 90 С. Полученный конечный продукт (порошок) содержит 60 вес.% ферментированного вегетативного материала согласно изобретению и 40 вес.% мальтодекстрина. Содержание 2,6-DMBQ (определяемое методом высокоэффективной жидкостной хроматографии в соответствии со способом, описанным в следующем примере) составляет 0,4 мг/г сухого материала. Пример 3. Характеристики материала данного изобретения. Материал согласно изобретению можно охарактеризовать двумя способами, либо определяя в нем содержание 2,6-DMBQ, либо посредством так называемой характеристической хроматограммы (пептидная карта, фингерпринт). В обоих случаях используют метод высокоэффективной жидкостной хроматографии(ВЭЖХ). Проводят исследование на обоих материалах: полученном, как описано в примере 1, и полученном, как описано в примере 2. В обоих случаях результаты идентичны. А. Количественный и качественный анализ производных бензохинона. Получение образцов Перед проведением анализа необходимо увеличить концентрацию бензохинонов в лиофилизате. Для достижения этой цели лиофилизат разбавляют дистиллированной водой до исходной концентрации (содержание сухого материала 1 вес.%) - (0,5 г лиофилизата, 50 мл дистиллированной воды). Раствор три раза экстрагируют хлороформом 3 х 25 мл. Возможную влагу, остающуюся в хлороформной фазе, удаляют при помощи безводного сульфата натрия. После фильтрования хлороформную фазу выпаривают, к остатку добавляют хлороформ до общего объема 5 мл. Этот образец вводят при проведении анализа ВЭЖХ. Качественный и количественный анализ производных бензохинона проводят методом ВЭЖХ. Описание метода высокоэффективной жидкостной хроматографии (ВЭЖХ). Применяемое оборудование ВЭЖХ состоит из помпы (Beckman model 114M pump), УФдетектора (LaborMim UV, a Merck-Hitachi-DADmod. 4500 diod array detector) и блока интегратора (Waters 740 type integrator unit). Для определений используют колонку Chromsil C18 (250 х 4 мм) 10 . УФ-детектирование осуществляют на частоте 290 нм, скорость потока составляет 2 мл/мин. Состав применяемого элюента следующий: Na2HPO4 25 ммоль, NaH2PO4 25 ммоль, Na2EDTA 25 ммоль, NH2OHHCl 20 ммоль, 10 об.% метанола, рН = 6,05. Описанным выше способом анализируют три различных бензо- и гидрохинона. Различие 9 между временами удерживания этих соединений существует, но оно мало. Уменьшая силу элюента (органическая фаза до 10%), увеличивают селективность до более высокой степени. Анализ данных по удерживанию показывает,что пара-бензохиноны демонстрируют большее удерживание, чем соответствующие гидрохиноны, и удерживание увеличивается с количеством метоксигрупп. Концентрация трех стандартов составляет 0,1 мг/мл. В табл. 2 показаны данные по временам удерживания (ТR) и коэффициентам производительности (k'). Целью измерений является детектирование и количественное определение 2,6-диметоксипарабензохинона, поэтому после этой части определения будут обсуждены подробно. Определяют,подходит ли разработанный способ для количественного анализа 2,6-диметоксипарабензохинона. Используемый калибровочный график показан на фиг. 1. Результаты ложатся на прямую линию с коэффициентом корреляции 0,99. Проверяют также, можно ли воспроизвести измерения, на каждом образце проводят по три параллельных определения и рассчитывают разброс результатов. В табл. 1 показаны параллельные результаты определений, проведенных на образцах за период в шесть месяцев, и их разброс. Результаты авторов показывают, что способ определения подходит для точного и воспроизводимого определения 2,6-диметоксипара-бензохинона. Таблица 1. Параллельные значения количественного анализа 2,6DMBQ и разброс результатов Дата Содержание 2,6-DMBQ (мг/50 г образца)(-%) 04.27 3,45 3,54 3,66 0,08-2 04.28 3,27 3,68 3,31 0,18-5 05.10 1,56 1,49 1,48 0,03-1,9 05.10 3,65 3,42 0,12-3 06.08 3,00 2,98 2,86 0,06-2 06.09 2,92 3,06 2,87 0,08-2,3 06.10 3,34 3,23 3,36 0,05-1,5 Таблица 2. Значения времен удерживания (tR) и коэффициентов производительности (k') исследованных материалов Стандарт На фиг. 2 показана ВЭЖХ-хроматограмма образца в хлороформе, приготовленного, как описано выше. Хроматограмма дает только один пик, характерный для 2,6-DMBQ. Содержание 2,6-DMBQ в образце определяют на основе последнего. В. Характеристическая хроматограмма (фингерпринт) Получение образца 50 мл 96% (по объему) этанола добавляют к 5 г высушенного распылением материала (полученного, как описано в примере 2). Смесь встряхивают в течение 30 мин при температуре 50 С и 200 раз/мин. После этого смесь фильт 003090 10 руют, выпаривают досуха, и оставшийся материал растворяют в 10 мл метанола. Профильтрованный раствор вводят в колонку. Метод ВЭЖХ Здесь тоже используют колонку и условия ВЭЖХ, описанные выше, но состав элюента следующий: Na2HPO4 1,25 ммоль, NaH2PO4 1,25 ммоль, Na2EDTA 1,25 ммоль, NH4OHHCl 2,50 ммоль, 5 объемных % метанола. На фиг. 3 приведена ВЭЖХ-хроматограмма. Показано, что в этих условиях появляются два характеристических пика, один около 4,7 мин (5) и другой при 5,8 мин (6). Быстро,друг за другом выходят два пика (7,8) с временами удерживания 7,3 и 7,7 мин, соответственно, которые нельзя полностью разделить. Пик меньшей интенсивности появляется при 9,8 мин(9), а за ним характеристический интенсивный пик (11) около 13,1 мин. При 15 мин появляется меньший пик (12) и другой интенсивный пик(14) при 18 мин. При 21,8 мин хроматограф показывает меньший пик (15) и около 31 мин широкий пик, содержащий несколько материалов. С. Исследование стабильности Разложение материала данного изобретения проверяют путем проверки изменения концентрации 2,6-диметоксипарабензохинона. Авторы проводят эксперименты по исследованию хранения при трех различных температурах(комнатной температуре 20, 40 и 60 С). Лиофилизат (около 1 г) хранят в плотно закупоренных пробирках для исследования. Продолжительность экспериментов составляет 8 недель, каждую неделю проводят три параллельных определения на образцах, взятых из всех трех серий,хранящихся при разных температурах. Количественный анализ производных бензохинона осуществляют методом ВЭЖХ. Исследования показывают, что сухой материал данного изобретения остается стабильным даже через три года хранения при комнатной температуре, то есть содержание 2,6-DMBQ остается практически неизменным. В то же время материал нестабилен при 40 С (2,6-DMBQ разлагается через несколько недель), а при 60 С(2,6-DMBQ разлагается через несколько недель), а при 60 С содержание 2,6-DMBQ быстро снижается за несколько дней. В обоих последних сериях экспериментов исследуют разложение 2-метокси-парабензохинона. Это соединение более нестабильно, чем 2,6-диметоксипарабензохинон, и, как следствие этого, его присутствие в образцах не обнаруживают через одну неделю хранения при 40 или 60 С. При комнатной температуре концентрация этого соединения также остается неизменной. Пример 4. Исследование эффективности. Лиофилизат, полученный, как описано в примере 1, и высушенный распылением материал,полученный, как описано в примере 2, исследуют на эффективность. Используют стандартизиро 11 ванные образцы сухого материала с содержанием 2,6-DMBQ 0,4 мг/г сухого материала и хроматограмму ВЭЖХ, представленную на фиг. 2. Оба материала дают одинаковые результаты, поэтому материал данного изобретения далее будем называть просто лиофилизатом. Далее будут обсуждаться результаты биологических и токсикологических исследований, касающиеся этого лиофилизата, со специальным упором на эффекты восстановления иммунной системы и ингибирования роста опухоли и метастазов. 1. Эффект ингибирования роста опухолей и метастазов (исследования in vivo). Для исследований используют следующие типы вводимых опухолевых клеток, способствующих развитию опухолей у мышей или крыс: вариант легочной карциномы Льюиса (рак легкого мыши) с сильным образованием метастазов (3LLHH), меланома мыши В 16 и ксенотрансплантат карциномы толстой кишки человека HCR-25. Подтверждают наличие опухолей 3LL-HH(LLT-HH) и В 16 у инбредных мышей С 57 В 1/6. Вводят ксенотрансплантат HCR-25 мышам СВА/СА, у которых заранее подавляют иммунитет посредством тимэктомии и полного облучения тела. В случае опухолей 3LL-HH и HCR-25 трансплантируют опухолевые клетки в селезенку, в случае меланомы В 16 - в мышцы левой нижней конечности. Животным обработанной и контрольной групп с введенной опухолью HCR-25 на 21 день после трансплантации опухоли делают спленэктомию. Обработку описанным в данном изобретении лиофилизатом начинают через 24 ч после введения опухоли. Ежедневно вводят через рот при помощи желудочного зонда дозы 3 г/кг веса тела в виде водной суспензии 0,6 г/мл. Исследования заканчивают, умерщвляя животных под наркозом путем кровопускания, через 14 дней после трансплантации в случае опухоли 3LL-HH, через 21 день после трансплантации в случае опухоли В 16 и через 51 день после трансплантации в случае опухоли HCR-25. В табл. 3, 4 и 5 суммированы результаты этих исследований. Таблица 3. Влияние обработки лиофилизатом согласно изобретению на количество метастазов в печени для случая введенных в селезенку клеток рака легкого мышей 3LL-HH Обработка Количество введенных Количество метастаклеток зов в печени Контроль 3 х 103 104,028,2 Лиофилизат 3 х 103 29,816,4 р 0,01 Каждая исследованная группа содержит 10 животных. Таблица 4. Влияние обработки лиофилизатом согласно изобретению на количество метастазов в печени через 51 день после введения клеток карциномы толстой кишки человека в селезенку мышей СВА/СА с подавленным иммунитетом Обработка Вес селезенки с Количество метаопухолью (г) стазов в печени Контроль, спленэк 1,020,59 42,025,8 томию не делают Лиофилизат, спле 0,620,47 19,519,0 нэктомию не делают 12 Контроль, делают 0,100,02 19,113,5 спленэктомию Лиофилизат, делают 0,080,02 10,611,6 спленэктомиюСпленэктомию делают через 21 день после введения в селезенку опухоли. Каждая исследованная группа содержит 12 животных. Таблица 5. Влияние обработки лиофилизатом согласно изобретению на вес конечности с введенной опухолью и количество метастазов в легких через 21 день после введения в мышцы конечности клеток меланомы В 16 Обработка Вес конечности с Количество метастаопухолью (среднее зов в легких (среднее значение) значение) Контроль 7,60,43 42,410,2 Лиофилизат 7,20,43 6,23,7 р 0,01 Каждая исследованная группа содержит 10 животных. Представленные выше результаты показывают, что обработка лиофилизатом, описанным в данном изобретении, существенно снижает (на 71%) количество метастазов в легких при введении в селезенку клеток опухоли 3LL-HH (табл. 3). В случае карциномы толстой кишки человека HCR-25 лечение в течение 50 дней снижает и вес селезенки с опухолью, и количество метастазов в печени. Количество метастазов по сравнению с контрольной группой составляет примерно 50% и в группе, где делали спленэктомию, и в группе, где спленэктомию не делали(табл. 4). В случае введенных в мышцу клеток меланомы В 16 вес растущей в мышце опухоли не изменяется в результате обработки, но количество метастазов в легких снижается очень значительно, на 85% по сравнению с контрольной группой (табл. 5).II. Исследование in vitro Как недвусмысленно показано в представленных выше исследованиях, описанный в данном изобретении лиофилизат может существенно снижать образование метастазов злокачественных опухолей, исследованы также эффекты этих продуктов на различные фазы образования метастазов. Образование метастазов включает в себя несколько фаз, в которых, кроме пролиферации клеток и апоптотической активности первичной опухоли, играет роль адгезивный потенциал опухолевых клеток и защитные механизмы организма против опухолевых клеток. В исследованиях in vivo исследуют влияние лиофилизата на пролиферацию и апоптоз клеток. Большую часть исследований in vitro проводят на клетках меланомы мышей В 16, для исследования лиофилизата используют эту опухоль на первой стадии. 1. Исследование адгезии Адгезию опухолевых клеток изучают на микропластине с 96 ячейками. Дозы лиофилиза 13 та составляют 300, 3000 и 30000 мкг/мл. Используют питательную среду RPM1, без сыворотки и при наличии 10% бычьей эмбриональной сыворотки (FCS). Адгезию исследуют через 10, 30, 60, 90 и 120 мин инкубации в обычных условиях. Определения производят колориметрически на основе SRB-исследования (Mossmann, Т., J. Immunol. Neth. 65, 55-63 /1983/). Исследование основано на окрашивании сульфородамином В всего белка культуры, поглощение определяют спектрофотометрически при 570 нм. На фиг. 4 показаны только два момента времени, которые, однако, адекватно представляют эффект лиофилизата. Показано, что если доза лиофилизата составляет 3000 мкг/мл или в десять раз больше, он драматическим образом снижает адгезию опухолевых клеток при наличии и в отсутствие сыворотки. Если доза составляет 300 мкг/мл, такого эффекта не наблюдают. 2. Исследование пролиферации В этом исследовании опухолевые клетки высевают на микропластину с 96-ячейками за 24 ч до обработки. После обработки подходящими дозами лиофилизата также проверяют пролиферативную активность посредством SRBисследования через 24, 48 и 72 ч после обработки. Результаты повторных исследований показывают, что в результате обработки дозами в диапазоне 900-15000 мкг/мл опухолевые клетки выходят к поверхности монослоя и, как показано методом исключения с красителем трипановым-синим, гибнут (Raltenbach, J.P. и др., Exp.Cell. Res. 15, 112-117 /1985/) (фиг. 5). Исследования на беспигментной меланоме человека (клетки опухоли А 2058 - Todaro, G.J. и др., Proc. Natl. Acad. Sci. USA 77, 5258-5262/1980/) показывают такие же результаты, как исследования на меланотической меланоме мыши (фиг. 6). В случае этой опухоли параллельно SRB-исследованию проводят МТТисследование, представляющее метаболическую активность клеток (Cole, S.P.C.: Cancer Chemother. Pharmacol. 17, 259-263 /1986/). Это исследование основано на явлении, что метаболически активная клетка трансформирует соль тетразолия в окрашенный фармазановый продукт,главным образом, посредством своей дегидрогеназной активности. Цветную реакцию, которая пропорциональна этой активности, можно фиксировать спектрофотометрически при 570 нм, МТТ-исследование ясно показывает, что функциональная активность опухолевых клеток снижается даже при дозе 300 мкг/мл (фиг. 4). Как и в случае, когда клетки подходят к поверхности, причина апоптоза неизвестна, активность по утрате клеток всей клеточной популяции исследуют посредством проточной цитометрии(FACS) (фиг. 7). Как показано на фиг. 7, опухолевые клетки утрачиваются (в зависимости от дозы) в необычайно большой степени.III. Исследование влияний на иммунную реакцию. Эффект описанного в данном изобретении лиофилизата изучают на двух различных моделях. В одной серии экспериментов исследуют бласттрансформацию моноядерных клеток, выделенных из селезенки животных, обработанных лиофилизатом, тогда как в другой серии на модели трансплантации аллотрансплантата кожи исследуют общее связывание трансплантированной кожи в области спины у мышей. 1. Исследование бласттрансформации Тлимфоцитов. Обработка описанным в данном изобретении лиофилизатом значительно повышает бласттрансформацию Т-лимфоцитов, играющих важную роль в иммунной реакции. Это показано в следующем эксперименте. Мышей C57Bl16 обрабатывают описанным в данном изобретении лиофилизатом в течение шести недель пять раз в неделю при дозе 3 г/кг(водная суспензия 0,6 г/мл) через рот при помощи желудочного зонда. По завершении обработки лимфоциты, выделенные путем перфузии из селезенки животных, пересевают на клеточную культуру, обработанную 1 мкг/мл СоnА. Через 48 ч клетки, производящие синтез DNS,метят 0,4 мкСi (микроКюри) 3H-тимидином. Степень маркировки определяют при помощи жидкостного сцинтилляционного счетчикаCon А значительно увеличивает (по сравнению с контролем) включение 3H-TdR, то есть бласттрансформацию. Таблица 6. Включение 3H-тимидина в лимфоциты селезенки контрольных и обработанных лиофилизатом мышей 1 мкг/мл СоnA Обработка Среднее (имп./мин) Среднеквадратичн. откл. Контроль 3760,6 583,3 Лиофилизат 8041,8 957,1 2. Исследование иммуностимулирующего эффекта на модели трансплантации аллотрансплантата кожи. Лучшей моделью для иллюстрации восстановления нарушенной иммунной реакции является исследование трансплантации аллотрансплантата кожи у мышей, которым сообщают частичную иммунную недостаточность посредством тимэктомии (хирургическое удаление тимуса). Группы мышей C57Bl10 и В 10LР различаются только локусом Н-3, поэтому кожа,трансплантированная от представителя одной группы представителю другой группы, не отторгается на протяжении 7 дней, а только примерно через 3 недели. Если реципиенту делают тимэктомию, отторжение происходит в среднем через 50 дней. Все материалы, которые ускоряют созревание и дифференцировку лимфоцитов костного мозга (как гормоны тимуса), уменьшают время, необходимое для отторжения трансплантированной кожи (J. Immunpharma 15cology 7, 67-78 /1985/). Такой же эффект можно наблюдать в исследованиях, когда применяют обработку описанным в данном изобретении лиофилизатом. В качестве реципиентов используют мышей C57Bl10, а в качестве доноров-мышей B10LP. Мышам-реципиентам делают тимэктомию и через 7 недель трансплантацию кожи. Через одну неделю после тимэктомии начинают обработку лиофилизатом (через рот, 5 раз в неделю,30 мг/кг). Обработку завершают через 70 дней после трансплантации кожи. Ежедневно следят за возможным отторжением кожи. В табл. 7 показано, что время отторжения у мышей без тимэктомии составляет 21 день (самцы) и 28,7(самки), соответственно. У мышей с тимэктомией время отторжения увеличивается до 52,4 и 41,6 дней, соответственно. Обработка лиофилизатом согласно изобретению существенно укорачивает продолжительность существования трансплантатов кожи у мышей с тимэктомией и обработанных. Это показывает, что иммунная недостаточность, вызванная тимэктомией, восстанавливается в значительной степени в результате обработки, это означает, что лиофилизат оказывает иммуностимулирующее действие. Таблица 7. Влияние обработки лиофилизатом согласно изобретению на отторжение трансплантатов кожи (реципиенты- мыши C57Bl10, доноры - мыши B10LP) Время отторжения Обработка Самцы Самки Средн. Среднеквад- Средн. Среднеквадзначение ратичн. откл. значение ратичн. откл(30 мг/кг)0,001 р 0,01 относительно контроля с тимэктомией 0,01 р 0,05 относительно контроля без тимэктомии Исследования in vivo и in vitro с лиофилизатом согласно изобретению на нескольких исследованных моделях животных показывают,что этот продукт оказывает существенное антиметастатическое действие. Этот эффект, повидимому, связан с иммуностимулирующим действием, наблюдаемым в исследованиях invivo и in vitro, но возможно, что на снижение количества метастазов влияют также антипролиферативные эффекты, являющиеся причиной апоптоза, эффект исследованного материала на адгезию и эффект, вызывающий образование свободных радикалов.IV. Исследование активности по связыванию радикалов. Так как бензохиноны оказывают хорошо известный эффект на образование свободных радикалов, исследовали также активность описанного в данном изобретении лиофилизата по связыванию радикалов. При помощи метода 16 электронного парамагнитного резонанса определяли связывание супероксида (SSA) и связывание гидроксильного радикала (OH-SA). Лиофилизат обладает существенной активностьюSSA, активность связывания 1 мг чистого радикала соответствует активности 5,64 мкг супероксиддисмутазы (SOD). Лиофилизат не обладает активностью OH-SA, но он разрушает систему перекиси водорода/Fe, образующую гидроксильный радикал, таким образом, можно предположить, что он обладает так называемой нехелатирующей активностью.V. Токсикологические исследования (подострые). Согласно рекомендациям Registry of Industrial Toxicology Animal-data (RITA), проводили 77-дневные токсикологические исследования (Exp. Toxic. Pathol. 47, 247-266 /1995/) на крысах F344 и мышах C57Bl16. Животных ежедневно обрабатывали дозой 3 г/кг (водная суспензия 0,6 г/мл). Во время обработки наблюдали за изменением веса животных, возможными патологическими физическими изменениями,спонтанной гибелью животных. По завершении исследования определяли вес сердца, легких,тимуса, селезенки, печени, почек и яичек и исследовали 34 органа на предмет возможных патологических изменений, предписанных RITA. Спонтанной гибели не наблюдали, вес животных изменялся так же, как и в контрольной группе. В результате исследования вес различных органов не показал изменений по сравнению с контрольной группой. При патологическом исследовании обработанных животных не наблюдали изменений, которые могли бы быть вызваны лиофилизатом. Представленные выше результаты показывают, что ферментированный вегетативный материал согласно изобретению не является токсичным, и вследствие своего иммуностимулирующего действия он показан при всех состояниях, когда поражена иммунная система. Вследствие своих описанных выше биологических характеристик он может иметь дополнительные применения при лечении злокачественных опухолей, в основном при ингибировании метастазов. ФОРМУЛА ИЗОБРЕТЕНИЯ. 1. Ферментированный высушенный материал, являющийся иммуностимулятором и ингибирующий метастазы, который получают из сбраживаемой жидкости посредством ферментации пшеничного зерна с применением Saccharomyces cerevisiae в водной среде, который имеет ВЭЖХ-хроматограмму, по существу соответствующую представленной на фиг. 3, и содержание в нем 2,6-диметоксипарабензохинона составляет 0,12-0,52 мг/г сухого материала, а содержание 2-метоксипарабензохинона 17 составляет 0,05-0,28 мг/г сухого материала, определяемого путем ВЭЖХ. 2. Материал по п.1, отличающийся тем, что содержание в нем 2,6-диметоксипарабензохинона составляет 0,4 мг/г сухого материала. 3. Способ получения ферментированного высушенного материала по любому из пп.1-2,являющегося иммуностимулятором и ингибирующего метастазы, отличающийся тем, что размолотое пшеничное зерно ферментируют в водной среде в присутствии Saccharomyces cerevisiae и сбраживаемую жидкость отделяют,тщательно фильтруют, выпаривают, кипятят и сушат как есть или в присутствии вспомогательных осушающих материалов. 4. Способ по п.3, отличающийся тем, что ферментацию проводят при температуре 30 С примерно в течение 18 ч в условиях аэрации и перемешивания. 5. Способ по п.4, отличающийся тем, что сушку проводят в присутствии мальтодекстрина. 6. Фармацевтический продукт, являющийся иммуностимулятором и ингибирующий метастазы, отличающийся тем, что содержит в качестве активного агента высушенный материал по любому из пп.1-2, полученный из сбраживаемой жидкости посредством ферментацииSaccharomyces cerevisiae. 7. Диетическая добавка для млекопитающих, отличающаяся тем, что содержит высушенный материал по любому из пп.1-2, полученный из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствии Saccharomyces cerevisiae. 8. Диетическая добавка по п.7, отличающаяся тем, что содержит ферментированный высушенный материал в количестве 60 вес.% и дополнительно мальтодекстрин в количестве 40 вес.%. 9. Применение высушенного материала по любому из пп.1-2, полученного из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствииSaccharomyces cerevisiae, для получения иммуностимуляторной и ингибирующей метастазы фармацевтической композиции. 10. Применение высушенного материала по любому из пп.1-2, полученного из сбраживаемой жидкости посредством ферментации пшеничного зерна в водной среде в присутствииSaccharomyces cerevisiae, для получения диетической добавки для млекопитающих.
МПК / Метки
МПК: A61P 37/04, A23L 1/172, A61K 35/78
Метки: диетическая, добавка,содержащие, фармацевтической, также, добавки, высушенный, получения, ферментированный, композиция, способ, диетической, указанный, фармацевтическая, применение, материал, композиции
Код ссылки
<a href="https://eas.patents.su/11-3090-fermentirovannyjj-vysushennyjj-material-sposob-ego-polucheniya-i-ego-primenenie-dlya-polucheniya-farmacevticheskojj-kompozicii-i-dieticheskojj-dobavki-a-takzhe-farmacevticheskaya-k.html" rel="bookmark" title="База патентов Евразийского Союза">Ферментированный высушенный материал, способ его получения и его применение для получения фармацевтической композиции и диетической добавки, а также фармацевтическая композиция и диетическая добавка,содержащие указанный материал</a>
Предыдущий патент: Синтетические фунгицидные смеси на основе производных n-фенилникотинамида и бензимидазолов или высвобождающих их предшественников
Следующий патент: Синтез олигонуклеотидов в жидкой фазе
Случайный патент: Дозатор лекарственных средств и его применение