Применение замещенных 2-аминотетралинов для изготовления лекарственного средства для предупреждения, облегчения и/или лечения разных видов боли
Номер патента: 17746
Опубликовано: 28.02.2013
Авторы: Бьяншин Джозеф, Шеллер Дитер, Бейройтер Беттина, Фрайтаг Йоахим
Формула / Реферат
1. Применение соединения, имеющего формулу (I)
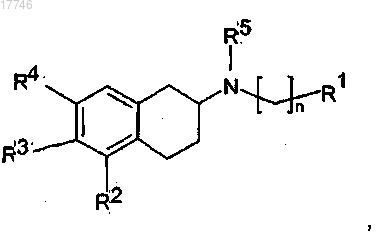
где n равен числу от 1 до 5;
R1 выбран из
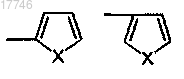
где X представляет собой S;
R2 представляет собой группу -ОА;
каждый из R3 и R4 независимо представляет собой водород или группу -ОА;
А представляет собой водород;
R5 представляет собой С1-3алкил;
где соединения формулы (I) могут присутствовать в виде чистых энантиомеров (R или S) или их любой смеси, включая рацематы, или их фармацевтически приемлемых солей, для изготовления фармацевтической композиции для предупреждения, облегчения и/или лечения хронической и/или острой боли, где боль выбрана из мышечно-скелетной боли, включая боль в спине, фибромиалгию, миофасциальную боль, боли при менструации, боли при остеоартрите, боли при ревматоидном артрите, боли при желудочно-кишечном воспалении, боли при воспалении сердечной мышцы, боли при рассеянном склерозе, боли при неврите, боли при СПИДе, боли при химиотерапии, онкологической боли, головной боли, ХБС (хронического болевого синдрома), центральной боли, невропатической боли, такой как невралгия тройничного нерва, боль при опоясывающем лишае, боль от ушиба, фантомная боль, боль при нарушении в височно-нижнечелюстном суставе, повреждение нерва, постгерпетическая невралгия или невропатическая боль, имеющая место вследствие повреждений, ампутаций, инфекций, метаболических расстройств, невропатической боли, ассоциированной с диабетом, нарушением осязания, гипотиреозом, уремией, недостаточностью витаминов или алкоголизмом и острой боли, такой как боль после повреждений, послеоперационная боль, боль при острой подагре или боль во время операций, таких как челюстная хирургия.
2. Применение соединения по п.1, где фармацевтическую композицию дают при невоспалительной мышечно-скелетной боли.
3. Применение соединения по п.2, где фармацевтическую композицию дают при фибромиалгии, миофасциальной боли или боли в спине.
4. Применение соединения по п.3, где фармацевтическую композицию дают при фибромиалгии.
5. Применение соединения по любому из пп.1-4, где фармацевтическую композицию дают для ослабления мышечной гипералгезии или мышечной аллодинии.
6. Применение по любому из пп.1-5, где n равен 1, 2 или 3.
7. Применение по любому из пп.1-6, где R5 представляет собой С3алкил.
8. Применение по любому из пп.1-7, где R1 представляет собой 2-тиенил, R3 и R4, оба, представляют собой водород, R5 представляет собой С3алкил и n равен 2.
9. Применение по любому из пп.1-8, где соединение представляет собой (+/-)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтол или его фармацевтически приемлемую соль.
10. Применение по п.9, где соединение представляет собой чистый S-энантиомер (ротиготин) или гидрохлорид ротиготина.
11. Применение по любому из пп.1-10, где фармацевтическую композицию дают для парентерального, трансдермального или трансмукозального введения.
12. Применение по п.11, где фармацевтическую композицию дают для трансдермального введения.
13. Применение по любому из пп.1-12, где соединение общей формулы (I) вводят в дозе от 0,05 до 50 мг в сутки.
Текст
ПРИМЕНЕНИЕ ЗАМЕЩЕННЫХ 2-АМИНОТЕТРАЛИНОВ ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ПРЕДУПРЕЖДЕНИЯ, ОБЛЕГЧЕНИЯ И/ИЛИ ЛЕЧЕНИЯ РАЗНЫХ ВИДОВ БОЛИ Изобретение относится к применению соединений формулы (I), в которых R1, R2, R3, R4, R5 и n имеют значения, указанные в описании изобретения, для изготовления фармацевтической композиции для предупреждения, облегчения и/или лечения хронической и/или острой боли.(71)(73) Заявитель и патентовладелец: УЦБ ФАРМА ГМБХ (DE) 017746 Область изобретения Настоящее изобретение относится к применению соединений формулы (I) в которых R1, R2, R3, R4, R5 и n имеют значения, указанные ниже, для изготовления фармацевтической композиции для предупреждения, облегчения и/или лечения разных видов боли. Предшествующий уровень техники Боль представляет собой сложный физиологический процесс, который включает множество сенсорных и нервных механизмов. Острая боль в типичных случаях представляет собой физиологический сигнал, указывающий на потенциальное или действительное повреждение. Хроническая боль может быть соматогенной (органической) или психогенной. Хроническую боль часто сопровождают или ей сопутствуют вегетативные признаки, такие как, например, утомление или расстройство сна. Соматогенная боль может быть ноцицептивного, воспалительного или невропатического происхождения. Ноцицептивная боль связана с активацией соматических или висцеральных чувствительных к боли нервных волокон, в типичных случаях, физическим или химическим повреждением тканей. Воспалительная боль является результатом воспаления, например воспалительного ответа живых тканей на любой стимул, включая повреждение, инфекцию или раздражение. Невропатическая боль является результатом дисфункции в нервной системе. Считают, что невропатическую боль поддерживают аберрантные соматосенсорные механизмы в периферической нервной системе, центральной нервной системе(ЦНС) или в обеих. Невоспалительная мышечно-скелетная боль представляет собой специфическую форму хронической боли, которая обычно не прослеживается до конкретных структурных или воспалительных причин и которая обычно не оказывается индуцированной повреждением ткани и инфильтрацией макрофагами(приводящей к отеку), как это происходит в классическом ответе иммунной системы. Хотя невоспалительную мышечно-скелетную боль считают результатом периферической и/или центральной сенсибилизации, ее причины в настоящее время не вполне понятны. Ее часто ассоциируют с физическим или психическим стрессом, с отсутствием адекватного или успокаивающего сна или с воздействием холода или сырости. Невоспалительную мышечно-скелетную боль также считают вызываемой или ассоциированной с системными расстройствами, такими как вирусные или другие инфекции. Примеры невоспалительной мышечно-скелетной боли включают боль и спазмы в шее и плечах, боль в нижней части спины и больную грудную клетку или бедренные мышцы. Невоспалительная мышечноскелетная боль может быть генерализованной или локализованной. Понимание базовых причин и механизмов, модели на животных и другие модели для исследования невоспалительной мышечно-скелетной боли, режимы лечения, все это представляет собой области, где существует необходимость в улучшении. Фибромиалгический синдром (ФМС) и миофасциальный болевой синдром (МБС) представляют собой медицинские состояния, характеризующиеся фибромиалгией и мышечно-лицевой болью, соответственно которые представляют собой два типа невоспалительной мышечно-скелетной боли. ФМС представляет собой сложный синдром, ассоциированный со значительным нарушением качества жизни, и может приводить к значительным финансовым издержкам. Фибромиалгия представляет собой системный процесс, который в типичных случаях вызывает болезненные точки (локальные болезненные области в нормальных по виду тканях) в конкретных частях организма и часто ассоциирован с плохим режимом сна и/или с напряженной средой. Диагноз фибромиалгии в типичных случаях основан на распространенной боли (например, билатеральной, в верхней и нижней части тела, и/или позвоночника) в анамнезе и на присутствии избыточной болезненности при надавливании на ряд (иногда более точно определенное как по меньшей мере 11 из 18) специфических болезненных мышечных точек. ФМС в типичных случаях представляет собой хронический синдром, который вызывает боль и тугоподвижность в тканях, которые поддерживают и способствуют перемещению костей и суставов. Лечение фибромиалгии традиционно основано на средствах облегчения боли, нестероидных противовоспалительных препаратах (НПВП), миорелаксантах, транквилизаторах и антидепрессантах, ни одно из которых не является универсально эффективным. Пациенты с фибромиалгией часто плохо спят и могут испытывать некоторое облегчение, принимая антидепрессант, такой как амитриптилин, на время сна; см. Goldenberg D.L., Burckhardt С., Crofford L., et al., JAMA, 292(19):2388-95 (2004). Целью в лечении фибромиалгии является снижение боли и усиление функции. Обзор по фибромиалгии приведен, например, в NampiaparampilShmerling, Am. J. Manaq. Care, 10(11 Pt 1):794-800 (2004). Миофасциальный болевой синдром (МБС) представляет собой хроническое недегенеративное невоспалительное мышечно-скелетное болевое состояние, часто ассоциированное со спазмом или болью в жевательных мышцах. Отдельные области в пределах мышц или их тонких покровов из соединительной ткани (фасциях) становятся аномально утолщенными или плотными. Когда миофасциальные ткани уп-1 017746 лотняются и теряют свою эластичность, способность нейротрансмиттеров отправлять и получать информацию между головным мозгом и организмом нарушается. Специфические дискретные области мышцы могут быть болезненными при приложении давления жестким кончиком пальца; эти области обычно называют либо болезненными, либо триггерными точками (обе точки являются болезненными, но "триггерные" точки дополнительно распространяют боль на отдаленные точки.) Симптомы МБС включают тугоподвижность и боль в мышцах и острые стреляющие боли или покалывание и онемение в областях,отдаленных от триггерной точки. Этот дискомфорт может вызывать расстройство сна, утомление и депрессию. Наиболее типичные триггерные точки находятся в челюсти (височно-челюстная область), шее,спине или ягодицах. Миофасциальная боль отличается от фибромиалгии: МБС и ФМС представляют собой два отдельных синдрома, имеющих каждый свою собственную патологию, но совместно использующих мышцу в качестве общего пути проведения боли. Миофасциальная боль в типичных случаях представляет собой более локализованный или региональный (вдоль мышцы и окружающих ее фасциальных тканей) болевой процесс, который часто ассоциирован с болезненностью триггерной точки. Миофасциальную боль можно лечить множеством разных способов (иногда в комбинации), в том числе растяжкой, ультразвуком, замораживающими спреями с растяжкой, упражнениями и инъекциями анестетика. Еще одним невоспалительным мышечно-скелетным болевым состоянием является боль в спине,особенно боль в нижней части спины. Боль в спине представляет собой распространенный мышечноскелетный симптом, который может быть либо острым, либо хроническим. Ее может вызвать ряд заболеваний и расстройств, которые влияют на поясничный отдел позвоночника. Боль в нижней части спины часто сопровождается ишиасом, который представляет собой боль, вовлекающую седалищный нерв, и ощущается в нижней части спины, ягодицах и задних частях бедер. Невоспалительная мышечно-скелетная боль, такая как фибромиалгия, миофасциальная боль и боль в спине, включают в качестве важного проявления повышенную мышечную чувствительность. Повышенная мышечная чувствительность характеризуется болью, которую вызывает неноцицептивный в норме стимул (аллодиния), или повышенной интенсивностью боли, которую вызывают ноцицептивные стимулы (гипералгезия). Термин "аллодиния" относится к обычно безвредной соматосенсорной стимуляции, которая вызывает аномально интенсивное болевое ощущение взрывного, иррадиирующего характера, часто превосходящее по длительности стимул или триггер (то есть боль из-за стимула, который в норме не вызывает боль). Термин "гипералгезия" относится к вредной стимуляции, которая вызывает более интенсивные и длительные болевые ощущения (то есть повышенный ответ на стимул, который в норме является болевым). Для лечения разных видов боли обычно используют два класса лекарственных средств: неопиоидные анальгетики, в том числе ацетаминофен и НПВП, и опиоидные (наркотические) анальгетики. Как опиоиды, так и неопиоиды имеют несколько нежелательных побочных эффектов. Наиболее серьезными эффектами опиоидов являются возможность подавления дыхательной системы и после длительного лечения возможность привыкания. С другой стороны, НПВП могут индуцировать ряд желудочнокишечных осложнений, таких как язвы и кровотечения, а также повреждение почек. Отчасти по причине таких побочных эффектов для лечения боли были предложены альтернативные лекарственные терапии. Такие лекарственные средства включают противосудорожные средства, антидепрессанты, модуляторы серотонина, ингибиторы обратного захвата норэпинефрина, агонисты дофамина и их комбинации. Например, в патенте США 5658955 предложено применение комбинации агониста серотонина и агониста дофамина для лечения фибромиалгии среди прочих состояний. В качестве предпочтительного агониста дофамина там описан фентермин. В патенте США 5872127 предложено лечение ряда заболеваний, включая фибромиалгию, посредством контролирования уровней пролактина с использованием агониста серотонина и агониста дофамина. В патенте США 6448258 (McCall et al.) предложено лечение фибромиалгического синдрома или синдрома хронической усталости соединениями, указанными как имеющие активность в отношении рецептора дофамина, в том числе каберголином. В каждой из публикаций, индивидуально цитированных ниже, предложен способ лечения пациентов-людей, страдающих фибромиалгией, с использованием агонистов рецепторов дофамина, не происходящих из спорыньи, которые представляют собой соединения тетрагидробензотиазола и 3(Н)-индолона,иллюстрируемые прамипексолом и ропиниролом соответственно: публикация международной заявкиWO 02/05797; патент США 6277875; патент США 6300365;Holman, J. Muscoloskeletal Pain, 12(1):69-74 (2004). Прамипексол и ропинирол представляют собой не являющиеся алкалоидами спорыньи агонисты подсемейства D2 рецепторов дофамина (D2, D3 и D4), имеющие самую сильную аффинность к D3. Они показывают только слабую аффинность, или ее отсутствие, к D1, к рецепторам 5-гидрокситриптамина (5-2 017746 НТ), таким как 5-HT1A И 5-НТ 7, или к альфа-адренергическим рецепторам, таким как 2 В или 2 С. В предварительных клинических исследованиях на пациентах с фибромиалгией показано, что прамипексол и ропинирол ослабляют боль (Holman, ArthritisRheumatism, 52(8):2495-2505 (2005); Holman, ArthritisRheumatism, 50 (2004) Suppl. 9:S698). Эти агонисты дофамина известны тем, что обычно приводят, как правило, в начале лечения и в зависимости от введенной дозы к различным побочным эффектам, включая, например, психиатрические,неврологические, сосудистые и желудочно-кишечные эффекты. Психиатрические эффекты, о которых сообщали в связи с прамипексолом или ропиниролом, включают бессонницу, галлюцинации и спутанность сознания. Неврологические эффекты включают обмороки, сонливость, головокружение, или вертиго, и дискинезию. Желудочно-кишечные эффекты включают рвоту, тошноту, боли в животе, запор и изжогу. Приступы сонливости описаны в качестве серьезного побочного эффекта прамипексола. Побочные эффекты прамипексола см., например, в Scientific Discussion, помещенном Европейским Медицинским Агентством на http.7/www.emea.eu.int/humandocs/PDFs/EPAR/Sifrol/059197EN6.pdf. Сохраняется необходимость в предложении альтернативных средств лечения, имеющих терапевтическую эффективность в лечении хронической и/или острой боли, в частности системном лечении невоспалительной мышечно-скелетной боли, включая фибромиалгию, миофасциальную боль или боль в спине и ассоциированные с ними мышечную гипералгезию и аллодинию. Таким образом, задача настоящего изобретения состоит в том, чтобы предложить альтернативные лекарственные средства для лечения хронической и/или острой боли и особенно невоспалительной мышечно-скелетной боли, в частности фибромиалгии, миофасциальной боли или боли в спине. Конкретно,задача данного изобретения состоит в том, чтобы предложить средство лечения, предпочтительно системного лечения, невоспалительной мышечно-скелетной боли, включая фибромиалгию, миофасциальную боль или боль в спине, которая характеризуется повышенной интенсивностью боли, вызываемой ноцицептивными стимулами (гипералгезия) и/или повышенной интенсивностью боли, вызываемой неноцицептивными в норме стимулами (аллодиния), в отсутствие физиологических причин, таких как воспалительный отек. Неожиданно было обнаружено, что ротиготин, представитель соединений формулы (I) ниже, имеет анальгетическую эффективность и может быть использован для лечения (включая предупреждение и/или облегчение) разных видов боли. В частности, соединения по настоящему изобретению способны ослаблять антиноцицептивное поведение у пациентов, испытывающих или страдающих невоспалительной мышечно-скелетной болью, такой как боль в спине, фибромиалгия, миофасциальная боль и, в частности,ослаблять ассоциированные с ними мышечную гипералгезию или мышечную аллодинию. Краткое изложение сущности изобретения В одном из аспектов изобретения предложено применение соединения, имеющего формулу (I) где n равен числу от 1 до 5;R1 выбран из где X представляет собой S;R2 представляет собой группу -ОА; каждый из R3 и R4 независимо представляет собой водород или группу -ОА; А представляет собой водород;R5 представляет собой С 1-3 алкил; где соединения формулы (I) могут присутствовать в виде чистых энантиомеров (R или S) или их любой смеси, включая рацематы, или их фармацевтически приемлемых солей для изготовления фармацевтической композиции для предупреждения, облегчения и/или лечения хронической и/или острой боли, где боль выбрана из мышечно-скелетной боли, включая боль в спине, фибромиалгию, миофасциальную боль, боли при менструации, боли при остеоартрите, боли при ревматоидном артрите, боли при желудочно-кишечном воспалении, боли при воспалении сердечной мышцы, боли при рассеянном склерозе,боли при неврите, боли при СПИДе, боли при химиотерапии, онкологической боли, головной боли, ХБС(хронического болевого синдрома), центральной боли, невропатической боли, такой как невралгия тройничного нерва, боль при опоясывающем лишае, боль от ушиба, фантомная боль, боль при нарушении в височно-нижнечелюстном суставе, повреждение нерва, постгерпетическая невралгия или невропатическая боль, имеющая место вследствие повреждений, ампутаций, инфекций, метаболических расстройств,-3 017746 невропатической боли, ассоциированной с диабетом, нарушением осязания, гипотиреозом, уремией, недостаточностью витаминов или алкоголизмом; и острой боли, такой как боль после повреждений, послеоперационная боль, боль при острой подагре или боль во время операций, таких как челюстная хирургия. В предпочтительном воплощении фармацевтическую композицию дают при невоспалительной мышечно-скелетной боли. В еще одном предпочтительном воплощении фармацевтическую композицию дают при фибромиалгии, миофасциальной боли или боли в спине. В еще одном предпочтительном воплощении фармацевтическую композицию дают при фибромиалгии. В еще одном предпочтительном воплощении фармацевтическую композицию дают для ослабления мышечной гипералгезии или мышечной аллодинии. В предпочтительном воплощении n равен 1, 2 или 3. В еще одном предпочтительном воплощении R5 представляет собой С 3 алкил. В еще одном предпочтительном воплощении R1 представляет собой 2-тиенил, R3 и R4, оба, представляют собой водород, R5 представляет собой С 3 алкил и n равен 2. В еще одном предпочтительном воплощении соединение представляет собой (+/-)-5,6,7,8 тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтол или его фармацевтически приемлемую соль. В еще одном предпочтительном воплощении соединение представляет собой чистый S-энантиомер(ротиготин) или гидрохлорид ротиготина. В еще одном предпочтительном воплощении фармацевтическую композицию дают для парентерального, трансдермального или трансмукозального введения. В еще одном предпочтительном воплощении фармацевтическую композицию дают для трансдермального введения. В еще одном предпочтительном воплощении соединение общей формулы (I) вводят в дозе от 0,05 до 50 мг в сутки. Соединения формулы (I), если они оптически активны, как в случае 5,6,7,8-тетрагидро-6-[пропил[2(2-тиенил)этил]амино]-1-нафтола, могут присутствовать в виде смесей энантиомеров, например рацематов, или в виде чистых (R)- или (S)-энантиомеров. Термин "чистый энантиомер" здесь означает, что по меньшей мере около 90 мол.% данного соединения присутствуют в форме одного энантиомера, например в (S)-форме, в то время как доля соответствующего другого энантиомера, например (R)-формы, является соответственно низкой. Ротиготин (SPM962) представляет собой (S)-(-)-энантиомер 5,6,7,8-тетрагидро-6-[пропил[2-(2 тиенил)этил]амино]-1-нафтола. Ротиготин, используемый в соответствии с настоящим изобретением, в типичных случаях представляет собой чистый (S)-(-)-энантиомер, причем соответствующий (R)-(+)энантиомер в типичных случаях присутствует в соотношении менее чем около 10 мол.%, более конкретно менее чем около 2 мол.%, например менее чем около 1 мол.%, от суммарного количества 5,6,7,8 тетрагидро-6-[пропил[2-(2-тиенил)этил]амино]-1-нафтола в фармацевтической композиции. Соединения формулы (I) могут присутствовать в виде свободных оснований и/или в форме фармацевтически приемлемых солей, например ротиготин в форме гидрохлорида ротиготина. Фармацевтически приемлемые соли включают нетоксичные соли присоединения соединения формулы (I) с органическими или неорганическими кислотами. Примеры неорганических кислот включают HCl. Термины "С 1-20 алкил", "С 1-12 алкил", "С 1-3 алкил" и "C1-3 алкил", как они использованы здесь, означают независимо друг от друга разветвленные или неразветвленные алкильные группы с общим числом атомов углерода в соответствующем диапазоне. Например, группа "С 1-20 алкил" имеет от 1 до 20 атомов углерода (при любом появлении здесь численный диапазон, такой как "от 1 до 20" относится к каждому целому числу в данном диапазоне; например, "от 1 до 20 атомов углерода" означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и так далее, вплоть до 20 атомов углерода включительно). Алкильные группы могут быть, возможно, замещены, например, галогеном. В конкретном предпочтительном воплощении алкильные группы являются незамещенными. Термин "циклоалкил", при использовании в отдельности или в комбинации, представляет собой циклоалкильную группу, содержащую от 3 до 18 кольцевых атомов углерода и вплоть до 25 атомов углерода в сумме. Циклоалкильные группы могут быть моноциклическими, бициклическими, трициклическими или полициклическими, и кольца могут быть конденсированными. Циклоалкил может быть полностью или частично насыщенным. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, циклогексенил, циклопентенил, циклооктенил, циклогептенил, декалинил, гидроинданил, инданил, фенхил, пиненил, адамантил и тому подобное. Циклоалкил включает цис- или транс-формы. Циклоалкильные группы могут быть незамещенными или моно- или полизамещенными электроноакцепторными и/или электронодонорными группами, как описано ниже. Более того, такие заместители, если они присутствуют, могут быть в эндо- или экзоположениях в мостиковых бициклических системах. Иллюстративные циклоалкилы по изобретению включают циклоалкилы с 3-10 кольцевыми атомами углерода, особо предпочтительными являются кольца с 4-8 кольцевыми атомами углерода, даже еще более предпочтительными являются кольца с 4-6 кольцевыми атомами углеро-4 017746 да. Термин "алкокси" здесь означает низший алкокси, содержащий от 1 до 6 атомов углерода, особенно от 1 до 3 атомов углерода, который может быть с прямой или разветвленной цепью. Эти группы включают метокси, этокси, пропокси, бутокси, изобутокси, трет-бутокси, пентокси, гексокси и тому подобное. Термин "арил", при использовании в отдельности или в комбинации, относится к ароматической группе, которая содержит от 6 вплоть до 18 кольцевых атомов углерода и до 25 атомов углерода в сумме,и включает полициклические ароматические соединения. Арильные группы могут быть моноциклическими, бициклическими, трициклическими или полициклическими и могут содержать конденсированные кольца. Полициклические ароматические группы здесь охватывают бициклические и трициклические конденсированные ароматические кольцевые системы, содержащие от 10 до 18 кольцевых атомов углерода и до 25 атомов углерода в сумме. Арильные группы включают фенил и полициклические ароматические группы, такие как нафтил, антраценил, фенантренил, азуленил и тому подобное, а также включают такие группы, как ферроценил. Арильные группы могут быть незамещенными или моно- или полизамещенными электроноакцепторными и/или электронодонорными группами, как описано ниже. В одном из воплощений арильная группа представляет собой незамещенную или моно- или полизамещенную фенильную группу. В предпочтительном воплощении арильная группа представляет собой фенильную группу. Термин "электроноакцепторный" и "электронодонорный" относится к способности заместителя принимать или отдавать электроны соответственно относительно таковой у водорода, если атом водорода занимает ту же позицию в молекуле. Эти термины являются хорошо понятными специалисту и обсуждены в Advanced Organic Chemistry, New York John Wiley and Sons, (1985), p. 16-18, описание которой включено посредством ссылки. Электроноакцепторные группы включают галогено (включая бромо,фторо, хлоро, йодо), нитро, карбокси, низший алкенил, низший алкинил, формил, карбоксиамидо, арил,четвертичный аммоний, галогеноалкил (такой как трифторметил), арил(низший)алканоил, карбалкокси и тому подобное. Электронодонорные группы включают гидрокси, низший алкокси (включая метокси,этокси и тому подобное), низший алкил (включая метил, этил и тому подобное), амино, низший алкиламино, ди(низший алкил)амино, арилокси (такой как фенокси), меркапто, низший алкилтио, низший алкилмеркапто, дисульфид (низший алкилдитио) и тому подобное. Обычный специалист в данной области техники должен понимать, что некоторые из вышеуказанных заместителей можно считать электронодонорными или электроноакцепторными в различных химических условиях. Более того, в настоящем изобретении предусмотрена любая комбинация заместителей, выбранных из вышеуказанных групп. Иллюстративными электронодонорными заместителями и/или электроноакцепторными заместителями являются галогено, нитро, алканоил, формил, арилалканоил, арилоил, карбоксил, карбалкокси, карбоксамидо, циано, сульфонил, сульфоксид, гетероцикл, гуанидин, четвертичный аммоний, низший алкенил, низший алкинил, сульфониевые соли, гидрокси, низший алкокси, низший алкил, амино, низший алкиламино, ди(низший алкил)амино, амино(низший)алкил, меркапто, меркаптоалкил, алкилтио и алкилдитио. Термин "сульфид" охватывает меркапто, меркаптоалкил и алкилтио, в то время как термин"дисульфид" охватывает алкилдитио. Конкретными примерами электронодонорных и/или электроноакцепторных групп являются галогено и низший алкокси, такой как фторо или метокси. В дополнительном воплощении вводимое соединение представляет собой пролекарство активного соединения формулы (I), например, такое соединение, где R1 представляет собой 2-тиенил, каждый из R3 и R4 представляет собой водород, R5 представляет собой С 3 алкил, n равен 2 и R2 представляет собой -ОА,где А представляет собой химическую группировку, как она определена выше, более конкретно, где активное соединение представляет собой ротиготин. Пролекарство является агентом, который сам по себе обычно имеет слабую фармацевтическую активность или не имеет ее, но превращается в фармацевтически активное соединение in vivo. Пролекарства часто полезны, так как в некоторых ситуациях их можно вводить проще, чем соответствующее активное соединение. Пролекарство может, к примеру, быть биодоступным при пероральном введении, когда активное соединение таковым не является. Пролекарство может быть легче изготавливать, например,благодаря улучшенной растворимости в фармацевтической композиции, чем активное соединение. Общепринятые способы выбора и получения подходящих пролекарственных производных раскрыты, например, в Н. Bundgaard, ed. Design of Prodrugs, Elsevier, (1985), Higuchi und Stella; Prodrugs as novel druganalogs, Washington, DC (1977). В качестве неограничивающего примера полезными пролекарствами здесь могут быть производные соединения формулы (I), такого как, например, ротиготин, по его фенольной гидроксигруппе. Иллюстративными пролекарствами ротиготина являются, например, описанные в публикациях, индивидуально цитированных ниже и включенных в данное описание посредством ссылки: Den Daas et al.,Naunyn Schiedebergs Arch. Pharmaco. 341:186-191 (1990); Den Daas et al., J. Pharm. Pharmacol. 43:11-16(1991). Пригодность пролекарства соединения формулы (I), например ротиготина, можно, например, опре-5 017746 делять инкубированием конкретного пролекарства-кандидата в определенных условиях с использованием ферментного коктейля и клеточного гомогенизата или ферментсодержащей клеточной фракции и измерением активного соединения, такого как ротиготин. Подходящей смесью ферментов является, например, S9 препарат печени, продаваемый Gentext of Woburn, MA, USA. Другие способы тестирования пригодности пролекарства соединения формулы (I), например ротиготина, известны специалисту в данной области техники. Например, превращение пролекарства в активное вещество in vitro можно анализировать следующим способом. Микросомальную фракцию, содержащую необходимые метаболические ферменты, получают из гомогенизатов клеток печени людей, обезьян, собак, крыс и/или мышей дифференциальным центрифугированием; альтернативно, можно получить цитоплазматическую фракцию. Субклеточную фракцию суспендируют с буфером так, чтобы получить раствор с определенным содержанием белка. После добавления 1 мкМ пролекарства, подлежащего тестированию, ее инкубируют при 37 С в течение 60 мин. Затем ротиготин количественно определяют посредством высокоэффективной жидкостной хроматографии с детекцией в ультрафиолетовой области (ВЭЖХ/УФ) или высокоэффективной жидкостной хроматографии с масс-спектроскопией (ВЭЖХ/МС) в зависимости от используемого количества. Для более подробных анализов исследуют концентрацию или временные серии. В дополнительном воплощении вводимое соединение представляет собой метаболит соединения формулы (I), например такое соединение, где R1 представляет собой 2-тиенил, каждый из R3 и R4 представляет собой водород, R5 представляет собой С 3 алкил, n равен 2 и R2 представляет собой -ОА, где А представляет собой химическую группировку, как она определена выше, более конкретно, где активное соединение представляет собой ротиготин. Примером такого метаболита ротиготина является (S)-2-Nпропиламино-5-гидрокситетралин, как раскрыто, например, в публикации международной заявкиWO 2005/058296, включенной в данное описание посредством ссылки. Полезные замещенные 2-аминотетралиновые соединения здесь, такие как ротиготин, могут быть получены общепринятым способом, например, как описано в Европейском патентеЕР 0168505, включенном в данное описание посредством ссылки. Анальгетические свойства соединений формулы (I), таких как ротиготин и тому подобные, можно,например, продемонстрировать на следующих двух утвержденных животных моделях. Формалиновая модель боли. Формалиновый тест на мышах представляет собой модель химически индуцированной продолжительной боли с двухфазными изменениями ноцицептивного поведения. У мышей этот тест определяет длительность облизывания задней лапы после инъекции формалина в подошву. Формалин вызывает характерный двухфазный болевой ответ. Ранняя фаза отражает острую боль, а поздняя фаза отражает хроническую боль, в которой молекулярной основой считают спинальную/супраспинальную пластичность ноцицепции. Эти признаки приводят к тому, что формалиновый тест принят в качестве признанной модели персистирующей клинической боли типа невропатической, ноцицептивной и воспалительной боли(см., например, Hunskaar, S., et al., J. Neuroscience Meth. 14:69-76, (1985. Модель мышечной механической гипералгезии при использовании фактора некроза опухолей альфа(TNF). Внутримышечную инъекцию фактора некроза опухолей альфа (TNF) используют в качестве модели мышечной механической гипералгезии, которая возникает при фибромиалгии, миофасциальной боли или боли в спине у человека. Внутримышечная инъекция TNF индуцирует механическую мышечную гипералгезию у крыс. Ее количественно определяют измерением порога отдергивания при давлении на мышцу и силы хватки. Механические пороги отдергивания при давлении на мышцу измеряют при использовании аналгезиметра, оказывающего давление на икроножную мышцу, в которую предварительно введен TNF. Силу хватки передних конечностей измеряют цифровым измерителем хватки после инъекции TNF в двуглавые мышцы плеча. Инъекции TNF не приводят к морфологическому повреждению мышцы (Schafers et al., Pain 104(3):579-588, (2003. Боль при пальпации мышц без морфологических аномалий является типичной для фибромиалгии,миофасциальной боли или боли в спине у людей (Pongratz D.E., et al., Z. Rheumatol 57 Suppl. 2:47-51,(1998. Таким образом, модель внутримышечной инъекции TNF используют в качестве модели мышечной боли, связанной с фибромиалгией, миофасциальной болью или болью в спине. В этой модели антиноцицептивное действие тестируемого соединения может быть определено в сравнении с контрольным лекарственным средством, например неопиоидным анальгетиком, таким как, например, метамизол, или противосудорожными средствами, такими как прегабалин и габапентин. Неожиданно было показано, что соединения, используемые по этому описанию (соединения формулы (I, такие как ротиготин и тому подобное, имеют анальгетические свойства, делающие их подходящими для введения субъекту для лечения (включая предупреждение и/или облегчение) хронической и/или острой боли, в частности невоспалительной мышечно-скелетной боли, такой как боль в спине,фибромиалгия и миофасциальная боль, и, в частности, для ослабления ассоциированной мышечной гипералгезии или мышечной аллодинии. В частности, соединения формулы (I), более конкретно ротиготин,-6 017746 используют для изготовления фармацевтической композиции для предупреждения, облегчения и/или лечения фибромиалгии. Неограничивающие примеры видов боли, которые можно лечить соединениями по настоящему описанию, представляют собой хронические состояния, такие как мышечно-скелетная боль, включая боль в спине, фибромиалгию, миофасциальную боль, боль при менструации, боль при остеоартрите, боль при ревматоидном артрите, боль при желудочно-кишечном воспалении, боль при воспалении сердечной мышцы, боль при рассеянном склерозе, боль при неврите, боль при СПИДе, боль при химиотерапии, онкологическую боль, головную боль, ХБС (хронический болевой синдром), центральную боль, невропатическую боль, такую как невралгия тройничного нерва, боль при опоясывающем лишае, боль от ушиба,фантомную боль, боль при нарушении в височно-нижнечелюстном суставе, повреждение нерва, мигрень,постгерпетическую невралгию, невропатическую боль, имеющую место вследствие повреждений, ампутаций, инфекций, метаболических расстройств или дегенеративных заболеваний нервной системы, невропатическую боль, ассоциированную с диабетом, нарушением осязания, гипотиреозом, уремией, недостаточностью витаминов или алкоголизмом; и острая боль, такая как боль после повреждений, послеоперационная боль, боль при острой подагре или боль во время операций, таких как челюстная хирургия. В конкретном воплощении соединение формулы (I), например, ротиготин вводят для лечения невоспалительной мышечно-скелетной боли, такой как боль в спине, фибромиалгия (например, при ФМС) и миофасциальная боль (например, при МБС), и, в частности, для ослабления мышечной гипералгезии или мышечной аллодинии, ассоциированной с такими состояниями. В более конкретном воплощении состояние, подлежащее лечению, представляет собой фибромиалгию. В еще одном воплощении соединение формулы (I), например ротиготин, вводят для лечения невропатической боли. Если контекст не требует иного, термин "лечить", "процесс лечения" или "лечение" включает превентивное или профилактическое применение агента, например соединения формулы (I), у субъекта,имеющего риск возникновения боли, в том числе у которого прогнозируют возникновение боли, или имеющего состояние или синдром, такие как ФМС или МБС, характеризующиеся рецидивирующей болью, а также применение такого агента у субъекта, уже испытывающего боль, в качестве терапии для облегчения, ослабления, снижения интенсивности или устранения такой боли или причин ее возникновения. Стандартный способ лечения хронической боли представляет собой введение анальгетического агента при ожидании рецидива боли, в противоположность тому, чтобы допустить рецидив боли до того,как дать дополнительное лечение; см., например, Grahame-SmithAronson, eds., Oxford Textbook ofClinical Pharmacology and Drug Therapy, 2nd ed. Oxford University Press (1992), p. 460. Термин "субъект" относится к теплокровному животному, обычно млекопитающему, такому как,например, кошка, собака, лошадь, корова, свинья, мышь, крыса или примат, включая человека. В одном из воплощений субъектом является человек, например пациент, имеющий болевое состояние или имеющий риск возникновения болевого состояния, такого как фибромиалгия, миофасциальная боль или боль в спине. Термин "центральная боль" относится к боли, ассоциированной с патологическим изменением центральной нервной системы. В одном из воплощений соединение, например ротиготин, вводят субъекту, страдающему болью,например при видах боли, упомянутых выше, таких как фибромиалгия, миофасциальная боль или боль в спине, в анальгетически эффективном количестве. Термин "эффективное количество", как он использован здесь, означает количество соединения, эффективное для приведения к клинически определимому улучшению или подавлению симптомов, ассоциированных с медицинским состоянием. Улучшение таких симптомов может включать, в случае болевых симптомов, снижение интенсивности, сокращение частоты или полное прекращение боли в течение длительного периода времени. Анальгетически эффективное количество для такого субъекта эквивалентно терапевтически эффективному количеству, как описано здесь. Для введения замещенных 2-аминотетралинов формулы (I), в частности ротиготина, существует много доступных способов применения, которые специалист в данной области может выбрать и адаптировать в зависимости от потребностей, состояния и возраста субъекта, требуемой дозировки и желаемого интервала применения. Неограничивающим способом введения является парентеральный, трансдермальный или на слизистые оболочки. В конкретном воплощении путь введения замещенного 2-аминотетралина формулы (I), например ротиготина, представляет собой трансдермальное введение. Форма и фармацевтическая композиция, в которой вводят соединение, адаптируют для пути введения, и в случае трансдермального введения подходящая композиция может представлять собой, например, мазь, гель, крем, пасту, спрей, пленку, пластырь, повязку, припарку, примочку или устройство для ионофореза. Для иллюстрации, замещенные 2-аминотетралины формулы (I), например ротиготин, могут быть введены путем нанесения на кожу пациента повязки или пластыря, имеющих активное вещество, присутствующее в адгезивной полимерной матрице, к примеру самоклеющемся полисилоксане. Примеры подходящих трансдермальных препаратов можно найти в WO 99/49852, WO 02/89777 и WO 02/89778.-7 017746 Для цели этого изобретения эти документы включены в данное описание ссылкой. Такой способ введения делает возможным установление, по существу, постоянного уровня в плазме и поэтому постоянной дофаминергической стимуляции в течение всего интервала применения (WO 02/89778, Metman, ClinicalNeuropharmacology, 24:163, (2001. Дополнительно, постоянная доставка путем трансдермального введения может приводить к быстрому достижению желаемой дозы, особенно при сравнении с импульсным введением соединения. Если, с другой стороны, желательно введение в форме подкожного или внутримышечного депопрепарата, замещенные 2-аминотетралины формулы (I), например ротиготин, могут быть суспендированы, например, в виде кристаллов соли, такой как кристаллический гидрохлорид ротиготина, в гидрофобной безводной среде и инъецированы так, как описано в WO 02/15903, которая включена в данное описание ссылкой, или, кроме того, введены в форме микрокапсул, микрочастиц или имплантатов на основе биоразлагаемых полимеров, таких как описано, например, в WO 02/38646, которая включена в данное описание ссылкой. Другие лекарственные формы, подходящие для введения замещенного 2-аминотетралина формулы(I), например ротиготина, представляют собой трансмукозальные препараты, например сублингвальные спреи, ректальные препараты или аэрозоли для легочного введения. Подходящие дозировки замещенных 2-аминотетралинов формулы (I), в частности ротиготина, составляют в типичных случаях от около 0,05 до около 50 мг/сутки, например от около 0,1 до около 40 мг/сутки или от около 0,2 до около 20 мг/сутки, предпочтительно от около 4 до около 20 мг/сутки. Возможно введение постепенно возрастающих доз, то есть лечение можно начинать с низких доз, которые постепенно повышают до достижения поддерживающей дозы. Специалисту в данной области техники ясно, что интервал дозировки можно варьировать в зависимости от применяемого количества, способа применения и суточных потребностей пациента или субъекта. Таким образом, трансдермальная форма применения может быть предназначена, например, для введения один раз в сутки, один раз в трое суток или один раз в семь суток, в то время как подкожный или внутримышечный депо-препарат может сделать возможным введение инъекций, например, раз в неделю,раз в две недели или месячными циклами. Термин "трансдермальная терапевтическая система", или его сокращение "ТТС", как он использован здесь, относится к фармацевтической композиции в форме от одного до множества препаратов,представляющих собой накладку или пластырь, которые содержат активный агент, например соединение формулы (I), такое как ротиготин, и при нанесении на кожу субъекта доставляет по меньшей мере часть активного агента в/и через кожу, причем активный агент достигает кровеносной системы субъекта. ТТС,применяемую здесь, можно получать способами, известными в данной области техники, например, как описано в публикациях, индивидуально перечисленных ниже и включенных в данное описание ссылкой: патент США 6562363 (Mantelle et al.), патент США 6884434 (MullerPeck), публикация заявки на патент США 2003/0026830 от Lauterbach et al., публикация заявки на патент США 2003/0027793 отLauterbach et al., публикация заявки на патент США 2004/0081683 от Schacht et al., публикация заявки на патент США 2005/0019385 от Houze, публикация заявки на патент США 2005/0079206 отSchacht et al., публикация заявки на патент США 2006/0216336 от Wolff. Используемая здесь ТТС иллюстрирует тип резервуара или матрицы, содержащий один или более чем один слой. В типичных случаях этот ТТС имеет на одной стороне защитный слой и на противоположной стороне подкладочный слой, который можно удалять с обнажением адгезивной поверхности или слоя, который при использовании контактирует с поверхностью кожи. Активный агент может быть распределен, например, в виде раствора или дисперсии, в матрице, образованной адгезивным слоем, или он может присутствовать в отдельном резервуарном слое. Следующее описание иллюстративной ТТС матричного типа относится конкретно к ротиготину в качестве активного агента, но следует понимать, что его можно заменить, если желательно, другим соединением формулы (I) или его энантиомером, смесью энантиомеров, фармацевтически приемлемой солью, пролекарством или метаболитом. Такая ТТС может состоять из накладок от одной до множества такого же состава. В одном из воплощений этого изобретения ТТС матричного типа для введения ротиготина содержит три слоя:(1) гибкий защитный лист или слой, например, содержащий алюминированную полиэфирную фольгу, силиконизированную с ее внутренней стороны и покрытую пигментным слоем или прозрачной полиэфирной пленкой с ее внешней стороны;(2) матричный слой, который в типичных случаях является самоклеющимся и содержит ротиготин,распределенный в нем; подходящий матричный слой содержит адгезивный компонент, например содержащий один или более чем один силиконовый адгезив, и, возможно, компонент, улучшающий совместимость, например, содержащий полимер, такой как повидон, сополимер винилпирролидона/винилацетата или сополимер этилена/винилацетата, который обеспечивает повышенную концентрацию, гомогенность и/или стабильность дисперсии активного агента в матричном слое и/или усиливает когезию матричного слоя; и(3) удаляемый подкладочный слой, например, содержащий покрытую фторполимером полиэфир-8 017746 ную пленку. Защитный и подкладочный слои должны быть инертными по отношению к компонентам матричного слоя. Ротиготин может присутствовать в форме свободного основания или соли (например, соли гидрохлорид) или в обеих формах, но если, как в настоящем иллюстративном примере, адгезивная матрица имеет силиконовую основу, оказывается предпочтительным использовать ротиготин, который находится, по существу, весь, например по меньшей мере около 95 мол.%, по меньшей мере около 98 мол.% или по меньшей мере около 99 мол.%, в форме свободного основания. Матричный слой может быть любой подходящей толщины, но в типичных случаях является относительно тонким, имеющий суммарную массу от около 10 до около 100 г/м 2, например от около 20 до около 80 г/м 2 или от около 40 до около 60 г/м 2. Ротиготин присутствует в матричном слое при концентрации, иллюстративно, от около 5 до около 25 мас.%, например от около 6 до около 20 мас.%, от около 7 до около 15 мас.% или от около 8 до около 10 мас.%. В предпочтительном воплощении матричный слой, имеющий суммарную массу около 50 г/м 2 (то есть около 5 мг/см 2), содержит свободное основание ротиготина в концентрации около 9 мас.%. Иллюстративно, ротиготин присутствует в ТТС в количестве от около 0,05 до около 2,5 мг/см 2, например от около 0,1 до около 2 мг/см 2, от около 0,2 до около 1,5 мг/см 2, от около 0,3 до около 1 мг/см 2 или от около 0,4 до около 0,5 мг/см 2. В предпочтительном воплощении свободное основание ротиготина присутствует в количестве около 0,45 мг/см 2. Должно быть очевидно, что дозу ротиготина, присутствующую в ТТС, можно регулировать модификацией любого одного или более чем одного из следующего: масса матрицы, концентрация ротиготина в матрице и/или площадь поверхности ТТС. "Площадь поверхности" здесь относится к суммарной площади от одной до нескольких накладок, нанесенных в одно и то же время на кожу субъекта, более конкретно - к площади адгезивной матрицы в контакте с кожей. В одном из воплощений предложена серия накладок, имеющих, по существу, одинаковые состав матрицы, массу и концентрацию ротиготина,но различающихся по площади поверхности так, что они предоставляют диапазон доз ротиготина. В типичных случаях используемая здесь ТТС содержит в сумме от около 4 до около 20 мг свободного основания ротиготина. Иллюстративно, ТТС, имеющая площадь поверхности около 10 см 2, содержит около 4,5 мг свободного основания ротиготина; ТТС, имеющая площадь поверхности около 20 см 2,содержит около 9 мг свободного основания ротиготина; ТТС, имеющая площадь поверхности около 30 см 2, содержит около 13,5 мг свободного основания ротиготина и ТТС, имеющая площадь поверхности около 40 см 2, содержит около 18 мг свободного основания ротиготина. В адгезивной матрице на основе силикона свободное основание ротиготина может присутствовать в растворе до предела его растворимости в матрице, но в типичных случаях также присутствует в дискретных микрочастицах, распределенных по матрице. Эти микрочастицы могут быть любого подходящего размера, но в целом желательно, чтобы они были достаточно мелкими для получения, по существу, прозрачного, а не мутного или молочно-белого матричного слоя. Также в целом желательно, чтобы микрочастицы содержали свободное основание ротиготина в аморфной форме во избежание проблем, которые могут возникать из-за роста кристаллов. Применение агента, улучшающего совместимость, такого как повидон, может давать улучшенную физическую стабильность матричного слоя, например, подавлением кристаллизации ротиготина. Считают, без связи с теорией, что в ТТС, имеющей повидон в матричном слое, микрочастицы содержат стабильный аморфный комплекс повидона/свободного основания ротиготина и действуют в качестве микрорезервуаров ротиготина в пределах матрицы. В предпочтительном воплощении этого изобретения повидон присутствует в матричном слое в концентрации от около 1,5 до около 5 мас.%. В матричном слое может быть использован один или более чем один силиконовый адгезив. Аминорезистентные силиконовые адгезивы являются предпочтительными. Подходящие силиконовые адгезивы включают, без ограничения, силиконовые адгезивы высокой клейкости, такие как BIO-PSA Q7-4301 отDow Corning, и силиконовые адгезивы умеренной клейкости, такие как BIO-PSA Q7-4201 от Dow Corning. В одном из воплощений присутствует силиконовый адгезив как высокой клейкости, так и умеренной клейкости, например, в массовом соотношении от около 40:60 до около 60:40, иллюстративно около 50:50. В матричном слое возможно присутствуют другие ингредиенты, в том числе, например, один или более чем один антиоксидант и/или противомикробный консервант. Предпочтительное воплощение этого изобретения относится к 10-см 2 ротиготиновой накладке, содержащей матричный слой, имеющий следующий состав: свободное основание ротиготина 4,50 мг, повидон 1,00 мг, BIO-PSA Q7-4301 22,24 мг, BIO-PSA Q7-4201 22,23 мг, аскорбилпальмитат 0,01 мг,DLтокоферол 0,025 мг, метабисульфит натрия 0,00045 мг. Применение одной такой накладки дает наносимую дозу 4,5 мг. Применение двух, трех или четырех таких накладок дает наносимую дозу 9, 13,5 или 18 мг соответственно. Другое предпочтительное воплощение этого изобретения относится к 20-см 2 ротиготиновой на-9 017746 кладке, содержащей матричный слой, имеющий следующий состав: свободное основание ротиготина 9,00 мг, повидон 2,00 мг, BIO-PSA Q7-4301 44,47 мг, BIO-PSA Q7-4201 44,46 мг, аскорбилпальмитат 0,02 мг, DLтокоферол 0,05 мг, метабисульфит натрия 0,0009 мг. Применение одной такой накладки дает наносимую дозу 9 мг. Применение двух таких накладок дает наносимую дозу 18 мг. Другое предпочтительное воплощение этого изобретения относится к 30-см 2 ротиготиновой накладке, содержащей матричный слой, имеющий следующий состав: свободное основание ротиготина 13,50 мг, повидон 3,00 мг, BIO-PSA Q7-4301 66,71 мг, BIO-PSA Q7-4201 66,70 мг, аскорбилпальмитат 0,03 мг, DLтокоферол 0,075 мг, метабисульфит натрия 0,00135 мг. Применение одной такой накладки дает наносимую дозу 13,5 мг. В каждом случае подходящая пленка для защитного слоя представляет собой Scotchpak 1109. ТТС, описанная выше, является подходящей для высвобождения ротиготина в течение периода около 24 ч, но можно использовать ТТС с более продолжительными или короткими периодами высвобождения. Описанная выше ТТС, имеющая 24-часовой период высвобождения, является подходящей для введения суточной наносимой дозы ротиготина от около 0,9 до около 27 мг, более предпочтительно от около 4 до около 20 мг. "Наносимая доза" здесь представляет собой количество ротиготина, присутствующего в ТТС (состоящей либо из одной накладки, либо из нескольких накладок), вводимое субъекту в сутки. Как обычно имеет место в случае трансдермальных систем, не весь активный агент высвобождается из ТТС и доставляется субъекту. Иллюстративно, если доза, реально полученная субъектом, составляет около 44% наносимой дозы, то 4,5, 9, 13,5 или 18 мг наносимой дозы эквивалентны соответственно 2, 4, 6 или 8 мг полученной дозы. В различных воплощениях ТТС, нанесенную на кожу субъекта, можно удалить после периода высвобождения и нанести дополнительную ТТС с подходящим интервалом введения, например, от около двух раз в сутки до около одного раз в месяц или от около одного раза в сутки до около одного раза в неделю. В наиболее типичных случаях ТТС заменяют с интервалом от около 24 до около 48 ч. Для ТТС не является необходимым ее нанесение на область тела субъекта, где имеет место ощущение боли. Любую поверхность кожи, обычно подходящую для трансдермального введения лекарственного средства, можно использовать в качестве области для нанесения ТТС, включая, без ограничения, переднюю часть живота, бедро, боковую часть области таза, бок, плечо или верхнюю часть руки. Последовательные нанесения ТТС могут быть на одну и ту же область кожи или на разные области кожи. Может быть преимущественно выбирать разные области в последующие сутки, например правый бок в одни сутки и левый бок на следующие сутки, верх тела в один сутки и низ тела на следующий сутки и т.д. Варьированием или чередованием области нанесения ТТС обычно можно минимизировать кожное раздражение или другие местные реакции на ТТС. В предпочтительном воплощении этого изобретения ротиготин вводят в соответствии со способом по настоящему изобретению путем нанесения на кожу субъекта (а) стандартной ТТС, имеющей матричный слой, который состоит, по существу, из 4,5 мг свободного основания ротиготина, 1,0 мг повидона,22,24 мг BIO-PSA Q7-4301 или силиконового адгезива, по существу, идентичного ему, 22,23 мг BIOPSA Q7 4201 или силиконового адгезива, по существу, идентичного ему, 0,01 мг аскорбилпальмитата,0,025 мг DLтокоферола и 0,00045 мг метабисульфита натрия на 10 см 2, и имеющей суммарную площадь поверхности для высвобождения ротиготина от около 10 до около 40 см 2, или (б) ТТС, которая является, по существу, биоэквивалентной стандартной ТТС. "По существу, биоэквивалентная" ТТС в настоящем контексте представляет собой ТТС, которая проявляет при введении субъектам-людям в соответствии со стандартными принципами фармакокинетики (PK) биодоступность (при измерении, например, по параметрам PK, включающим максимальную концентрацию (Смакс) и площадь под суточной кривой (AUC0-24, составляющую от около 80 до около 125% от значения, проявляемого стандартной ТТС. Данные по PK для стандартной ТТС, определенной выше, могут быть определены сравнительным тестированием в исследовании PK, или их можно найти, например, в вышеуказанной публикации заявки на патент США 2006/0216336. Замещенное 2-аминотетралиновое соединение формулы (I), например ротиготин, можно использовать в отдельности или в фармацевтической композиции вместе с фармацевтически приемлемым носителем. В одном из воплощений настоящее описание содержит применение соединения формулы (I), например ротиготина, в комбинации с дополнительным активным агентом для введения субъекту, например человеку, нуждающемуся в этом. Дополнительный активный агент может быть эффективным для лечения (включая предупреждение и/или облегчение) хронической и/или острой боли, в частности, для системного лечения невоспалительной мышечно-скелетной боли, включая ее специфические проявления,такие как мышечная гипералгезия и/или аллодиния, имеющие место при фибромиалгии, миофасциальной боли или боли в спине. Соединение формулы (I), например ротиготин, и дополнительный активный агент можно вводить вместе, то есть в одной лекарственной форме, или можно вводить отдельно, то есть в раздельных лекарственных формах. При раздельном введении соединение формулы (I), например роти- 10017746 готин, и дополнительный активный агент можно вводить в одно и то же или в разное время. Терапевтическая комбинация, содержащая соединение формулы (I), например ротиготин, и дополнительный активный агент, как определено здесь, представляет собой дополнительное воплощение настоящего изобретения. В конкретном воплощении предложена фармацевтическая композиция, содержащая соединение формулы (I), например ротиготин, и дополнительный активный агент, эффективный для лечения (включая предупреждение и/или облегчение) хронической и/или острой боли, в частности, для системного лечения невоспалительной мышечно-скелетной боли, включая ее специфические проявления, такие как мышечная гипералгезия и/или аллодиния, имеющие место при фибромиалгии, миофасциальной боли или боли в спине."Дополнительным активным агентом", упомянутым выше, может быть, например, другое анальгетическое соединение, такое как опиоид, например фентанил; антагонист пептида, относящегося к гену кальцитонина (CGRP), например олцегепант; блокатор рецепторов N-метил-D-аспартата (NMDA), например декстрометорфан; каннабиноид; селективный ингибитор циклооксигеназы-2 (ЦОГ-2); антагонист брадикинина; ацетаминофен или НПВП. В других воплощениях "дополнительный активный агент" представляет собой, например, успокаивающее средство, антидепрессант, транквилизатор, нейропротекторный агент и так далее. Неограничивающие примеры опиоидных и неопиоидных анальгетиков, которые могут быть полезными в качестве дополнительного активного агента, включают ацетаминофен, алфентанил, аллилпродин,альфапродин, анилеридин, бензилморфин, безитрамид, бупренорфин, буторфанол, клонитазен, кодеин,циклазоцин, дезоморфин, декстроморамид, декстропропоксифен, дезоцин, диампромид, диаморфон, дигидрокодеин, дигидроморфин, дименоксадол, димефептанол, диметилтиамбутен, диоксафетилбутират,дипипанон, дипирон (метамизол), эптазоцин, этогептазин, этилметилтиамбутен, этилморфин, этонитазен,фентанил, героин, гидрокодон, гидроморфон, гидроксипетидин, изометадон, кетобемидон, леваллорфан,леворфанол, левофенацил-морфан, лофентанил, меперидин, мептазинол, метазоцин, метадон, метопон,морфин, мирофин, налбуфин, налорфин, нарцеин, никоморфин, норлеворфанол, норметадон, норморфин,норпипанон, опиум, оксикодон, оксиморфон, папаверетум, пентазоцин, фенадоксон, феназоцин, феноморфан, феноперидин, пиминодин, пиритрамид, прогептазин, промедол, проперидин, пропирам, пропоксифен, суфентанил, тилидин, трамадол, NO-напроксен, NCX-701, ALGPRX-4975, их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры НПВП, которые могут быть полезными в качестве дополнительного активного агента, включают производные салициловой кислоты (такие как салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунисал, олсалазин, салсалат и сульфасалазин), индол- и инденуксусные кислоты (такие как индометацин, этодолак и сулиндак), фенаматы (такие как этофенамовая,меклофенамовая, мефенамовая, флуфенамовая, нифлуминовая и толфенамовая кислоты), гетероарилуксусные кислоты (такие как ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фентиазак,фурофенак, ибуфенак, изоксепак, кеторолак, оксипинак, тиопинак, толметин, зидометацин и зомепирак),производные арилуксусной кислоты и пропионовой кислоты (такие как алминопрофен, беноксапрофен,буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), енольные кислоты (такие как оксикамовые производные ампироксикам, цинноксикам, дроксикам, лорноксикам, мелоксикам, пироксикам, судоксикам и теноксикам, и пиразолоновые производные аминопирин, антипирин, апазон, дипирон, оксифенбутазон и фенилбутазон),алканоны (такие как набуметон), нимесулид, проквазон, МКС-1094, ликофелон, их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры селективных ингибиторов ЦОГ-2, которые могут быть полезными в качестве дополнительного активного агента, включают целекоксиб, деракоксиб, валдекоксиб, парекоксиб, рофекоксиб, эторикоксиб, лумиракоксиб, РАС-10549, цимикоксиб, GW-406381, LAS-34475, CS-502,их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры блокаторов рецепторов NMDA (N-метил-D-аспартата), которые могут быть полезными в качестве дополнительного активного агента, включают амантадин, D AP5, аптиганел,СРР, дексанабинол, декстрометорфан, декстропропоксифен, 5,7-дихлорокинуреновую кислоту, гавестинел, ифендоприл, кетамин, кетобемидон, ликостинел, LY-235959, мемантин, метадон, МК 801, фенциклидин, ремацемид, сельфотел, тилетамин, их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры успокаивающих средств, которые могут быть полезными в качестве дополнительного активного агента, включают, без ограничения, ацильные уреиды, спирты, амиды, производные барбитуровой кислоты, производные бензодиазепинов, бромиды, карбаматы, производные хлоралов, производные квиназолона и пиперидиндионы. Конкретные примеры включают ацекарбромал,ацеталь, ацетофенон, альдол, аллобарбитал, валерат аммония, амобарбитал, апробарбитал, апроналид,барбитал, браллобарбитал, бромизовалум, бромоформ, бротизолам, бутабарбитал, буталбитал, буталлилонал, бутетал, бутоктамид, кальция бромлактобионат, капурид, карбоклорал, карбромал, карбубарб,карфимат, хлоралбетаин, хлоралформамид, хлоралгидрат, -хлоралозу, хлоргексадол, цинолазепам, кло- 11017746 метиазол, циклобарбитал, циклопентобарбитал, циприпедиум, дексмедетомидин, дихлоралфеназон, диэтилбромацетамид, доксефазепам, доксиламин, эктилмочевину, эналлилпропимал, эстазолам, этаквалон,этхлорвинол, этинамат, этодроксизин, этомидат, фебарбамат, флунитразепам, флуразепам, глутетимид,галоксазолам, гептабарбитал, гексапропимат, гексетал, гексобарбитал, бромисто-водородную кислоту,изовалерилдиэтиламид, лопразолам, лорметазепам, меклоквалон, ментилвалерат, мепарфинол, мефобарбитал, метаквалон, метитурал, метиприлон, мидазолам, наркобарбитал, неалбарбитал, ниапразин, ниметазепам, нитразепам, опиум, паральдегид, пентаэритритолхлорал, пентобарбитал, трет-пентиловый спирт, перлапин, феналлимал, фенобарбитал, фенилметилбарбитуровую кислоту, пиперидион, пропаллилонал, пропиомазин, проксибарбал, пиритилдион, квазепам, репосал, рилмазафон, секобарбитал,сульфонэтилметан, сульфонметан, талбутал, темазепам, тетрабарбитал, талидомид, триазолам, 2,2,2 трихлорэтанол, триклофос, триметозин, валдетамид, винбарбитал, винилбитал, залеплон, золпидем, зопиклон, их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры транквилизаторов, которые могут быть полезными в качестве дополнительного активного агента, включают, без ограничения, такие анксиолитики, как арилпиперазины,производные бензодиазепина и карбаматы. Конкретные примеры включают абекарнил, алпидем, алпразолам, бензоктамин, бромазепам, буспирон, камазепам, каптодиамин, хлордиазепоксид, хлормезанон,клобазам, хлоразепиновую кислоту, клотиазепам, клоксазолам, диазепам, эмилкамат, энципразин, этиллофлазепат, этифоксин, этизолам, флесиноксан, флудиазепам, флуоресон, флутазолам, флутопразепам,глутаминовую кислоту, галазепам, гидроксифенамат, гидроксизин, ипсапирон, кетазолам, лесопитрон,лоразепам, локсапин, медазепам, мепробамат, метаклазепам, мексазолам, нордазепам, оксазепам, оксазолам, пазинаклон, пиназепам, празепам, суриклон, тандоспирон, тофизопам, тибамат, валноктамид, их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры антидепрессантов, которые могут быть полезными в качестве дополнительного активного агента, включают, без ограничения, бициклические, трициклические и тетрациклические антидепрессанты, гидразиды, гидразины, фенилоксазолидиноны и пирролидоны. Конкретные примеры включают адиназолам, адрафинил, аминептин, амитриптилин, амитриптилиноксид, амоксапин,бефлоксатон, бупропион, бутацетин, бутриптилин, кароксазон, циталопрам, кломипрамин, котинин, демексиптилин, дезипрамин, дибензепин, диметакрин, диметазан, диоксадрол, дотиепин, доксепин, дулоксетин, этоперидон, фемоксетин, фенкамин, фенпентадиол, флуацизин, флуоксетин, флувоксамин, гематопорфирин, гиперицин, имипрамин, имипрамина N-оксид, индалпин, инделоксазин, иприндол, ипроклозид, ипрониазид, изокарбоксазид, левофацетоперан, лофепрамин, мапротилин, медифоксамин, мелитрацен, метапрамин, метралиндол, миансерин, милнакипран, минаприн, миртазапин, моклобемид, нефазодон, нефопам, ниаламид, номифенсин, нортриптилин, ноксиптилин, октамоксин, опипрамол, оксафлозан, окситриптан, оксипертин, пароксетин, фенелзин, пибералин, пизотилин, пролинтан, пропизепин,протриптилин, пирисукцидеанол, квинупрамин, ребоксетин, ритансерин, роксиндол, рубидиума хлорид,сертралин, цилпирид, тандоспирон, тиазесим, тозалинон, тианептин, тофенацин, толоксатон, транилципромин, тразодон, тримипрамин, триптофан, венлафаксин, вилоксазин, зимелдин, их фармацевтически приемлемые соли и их комбинации. Неограничивающие примеры нейропротекторных агентов, которые могут быть полезными в качестве дополнительного активного агента, включают аптиганел, цитиколин, дексанабинол, эбселен, ликостинел, лубелузол, ремацемид, репинотан, рилузол, ксалипроден, зиконотид, их фармацевтически приемлемые соли и их комбинации. В конкретном воплощении соединение формулы (I), например ротиготин, вводят в комбинации с декстрометорфаном. Комбинированное лечение может включать, например, одновременную или последовательную доставку двух активных агентов. Последовательное введение можно осуществлять с использованием единой лекарственной формы, например такой лекарственной формы, как пероральная таблетка, которая имеет два разных слоя с разными профилями высвобождения для двух активных ингредиентов. Обычный специалист в данной области техники должен понимать, что в контексте настоящего раскрытия подразумеваются различные другие формы введения и режимы нанесения, причем все эти формы являются объектом этого изобретения. Ротиготин и другие соединения по этому описанию структурно отличаются от агонистов дофамина,таких как прамипексол и ропинирол, ранее раскрытых в качестве полезных для лечения боли. Ротиготин, к примеру, является агонистом дофамина, не представляющим собой алкалоид споры- 12017746 ньи, связывающимся со всеми рецепторами дофамина при явном доминировании D3-рецептора. Он имеет более высокую аффинность к D1-рецептору, чем прамипексол и ропинирол, и является также агонистом 5-HT1A-рецептора и антагонистом 2 В-рецептора. Считают, без связи с теорией, что аффинность ротиготина к 5-НТ-1A-рецептору имеет особое значение, поскольку дисфункция в серотониновой (5-НТ) и норадреналиновой трансмиссии может влиять на боль у пациентов с фибромиалгией, см., например,Littlejohn et al., Current Pharmaceutical Design 12:3-9(2006). Соединения формулы (I), например ротиготин, могут обеспечивать меньшую вероятность эффектов усиления и возобновления симптомов в сравнении с другими дофаминергическими агентами, такими как, например, леводопа. В недавнем исследовании "синдрома беспокойных ног" (RLS) многие пациенты, получавшие длительное лечение прамипексолом, испытывали эффекты усиления, см. Нарре et al.,CNS Drugs 18(1):27-36 (2004). Эффекты усиления включают интенсификацию симптомов после длительного применения соединения. Эффекты возобновления включают повышенную частоту симптомов по мере снижения дозировки соединения. Как показывают следующие примеры, ротиготин, иллюстративное замещенное 2 аминотетралиновое соединение формулы (I), показывает дозозависимый антиноцицептивный эффект в животной модели невоспалительной мышечно-скелетной боли. Слова "содержат", "содержит" и "содержащий" при использовании здесь следует интерпретировать включительно, а не исключительно. Пояснения к графическим материалам. Фиг. 1 - дозозависимое влияние ротиготина (0,3, 1, 3 мг/кг) на динамику индуцированного формалином облизывания. На оси Y показано время облизывания в секундах (с). На оси X показано время в минутах (мин). Звездочкауказывает достоверное отличие от носителя (ANOVA с поправкой на множественные сравнения (Р 0,05). Фиг. 2 - дозозависимое влияние ротиготина (0,3, 1, 3 мг/кг) на две фазы индуцированного формалином облизывания. На оси Y показано время облизывания в секундах (с). На оси X показано время в минутах (мин). Фиг. 3 - % максимально возможного эффекта (МВЭ) ротиготина и метамизола на давление, вызывающее отдергивание. р 0,05 (ANOVA + критерий Бонферрони) при сравнении с забуференным фосфатами физиологическим раствором (PBS), максимальное давление (МД) +/-стандартная ошибка среднего(SEM). + р 0,05 (U-критерий Манна-Уитни) при сравнении с PBS, МД+/-SEM. Фиг. 4 - % МВЭ ротиготина и метамизола на силу хватки.р 0,01 (U-критерий Манна-Уитни) при сравнении с PBS, МД+/-SEM. Примеры. Пример 1. Формалиновая модель боли. Ротиготин (SPM 962 основание) оценивали на возможную анальгетическую активность в формалиновом тесте на мышах, в котором время облизывания задней лапы измеряли с 5-минутными интервалами в течение 30 мин после инъекции формалина в подошву. Ротиготин вводили внутрибрюшинно 10 мышам, имеющим происхождение из CD-1 (Crl.), весом 222 г (предоставленным от BioLasco Taiwan по лицензии Charles River Laboratories Technology). Ротиготин (3, 1 и 0,3 мг/кг) в носителе (5 мл/кг), содержащем 0,2% гидроксипропилметилцеллюлозы (НРМС) и 0,9% NaCl, и носитель в отдельности (5 мл/кг) в качестве контроля вводили каждый путем внутрибрюшинной инъекции за 30 мин до инъекции формалина (0,02 мл, 2%-ный раствор) в подошву. Сокращение времени индуцированного формалином облизывания задней лапы записывали через 5-минутные интервалы в течение периода от 0 до 30 мин после инъекции формалина. Сокращение времени облизывания на 50% или более (50%) указывает на значительную анальгетическую и противовоспалительную активность. Статистический анализ осуществляли с использованием однофакторного ANOVA (дисперсионный анализ) и критерия Дунетта для сравнения групп, получивших ротиготин, и контрольных групп, получивших носитель. Достоверность принимали при уровне Р 0,05. Наблюдение животных в отношении острых токсических симптомов и автономных эффектов осуществляли до инъекции формалина. Результаты суммированы в табл. 1. Ротиготин проявлял значительную дозозависимую анальгетическую активность в раннюю и позднюю фазы. Значительное сокращение времени индуцированного формалином облизывания задних лап для групп с ротиготином при сравнении с контрольным носителем наблюдали при всех трех дозах, по меньшей мере, в интервалы от 0 до 5 и от 15 до 20 мин. Значительное сокращение времени облизывания задних лап наблюдали в группах, получавших 1 и 3 мг/кг ротиготина,в интервалы от 10 до 15, от 20 до 25 и от 25 до 30 мин. Значительных центральных или автономных признаков не наблюдали. Пример 2. Модель мышечной механической гипералгезии с фактором некроза опухолей альфа(TNF). Животные, индукция мышечной боли. Взрослых самцов крыс Sprague Dawley (от Charles River Sulzfeld, Германия) с массой тела от 220 г до 300 г содержали группами (по 3 животного на клетку) в помещении при контролируемой температуре(21-22 С) и обращенным циклом свет-темнота (12 ч/12 ч) с кормом и водой без ограничений. Рекомбинантный крысиный фактор некроза опухолей альфа (TNF), полученный от RD Systems,Minneapolis, MN, США, разбавляли в 0,9%-ном NaCl и использовали в концентрации 1 мкг в 50 мкл. Инъекции для индукции мышечной боли осуществляли на крысах под краткосрочным галотановым наркозом с использованием игл калибра 30 g билатерально в икроножную и двуглавые плечевые мышцы. Всех крыс приучали к поведенческим тестам до инъекций и исходные величины записывали в течение трех суток тестирования. Поведенческие показатели: давление на мышцу (Randall-Selitto). Затем измеряли механические пороги отдергивания в ответ на давление на мышцу с использованием аналгезиметра (Ugo Basile, Comerio, Italy) в соответствии со способом Randall-Selitto. Крысам давали забраться в чехол и расслабиться. Задние конечности крыс располагали так, чтобы на икроножную мышцу оказывать возрастающее давление (максимум 250 g). Записывали давление, необходимое для того,чтобы вызвать отдергивание конечности. Вычисляли среднее от 3 испытаний для каждой задней конечности (интервал между стимулами 30 с). Три предварительных теста осуществляли в сутки -3, -2, -1,тестируя слева и справа последовательно. Показатели предварительного теста в эти 3 суток варьировали лишь минимально. Определяли и отбирали для анализа среднее от порогов отдергивания для каждой крысы в каждые из 3 суток предварительного тестирования. Только животных со значительным эффектом TNF включали для дальнейшего анализа. Крысам инъецировали TNF в икроножную мышцу. Через 18 ч крыс тестировали на гипералгезию при давлении до применения и на сроке от 15 до 60 мин после применения ротиготина. Поведенческие показатели: сила хватки. Силу хватки передних конечностей крысы тестировали цифровым измерителем силы хватки (серияDFIS, Chatillon, Greensboro, NC, США). Три предварительных теста осуществляли на сутки -3, -2, -1. Поскольку при тестировании силы хватки нельзя было наблюдать соответствующий эффект тренировки, исходный уровень вычисляли как среднее от 3 измерений предварительного тестирования и отбирали для последующего анализа. Эффект инъекции TNF вычисляли для каждого животного отдельно и только животных со значительным эффектом TNF включали в дальнейший анализ. Фаза 2. Крысам инъецировали TNF в двуглавую плечевую мышцу. Шесть часов спустя тестировали силу хватки передних конечностей цифровым измерителем силы хватки. Крыс размещали так, чтобы они хватали решетку передними лапами и осторожно оттаскивали их, так чтобы можно было записывать силу хватки. Вычисляли среднее от десяти испытаний. Протокол применения Предварительное исследование осуществляли, чтобы показать, что внутримышечная инъекция 1 мкг TNF в икроножную мышцу достаточна для индукции гипералгезии давления. Затем помещали крыс в группы по 10 и вводили внутрибрюшинно 0,3, 1,0 или 3,0 мг/кг ротиготина или носителя. Объем внутрибрюшинных инъекций составлял 0,5 мл (в зависимости от массы). Силу хватки снова тестировали на сроке от 15 до 60 мин после инъекции ротиготина.- 14017746 Представление данных и статистика. Данные показаны на графиках, представляющих среднее и SEM. Данные до и после лечения сравнивали с использованием ANOVA (дисперсионный анализ) и апостериорного теста Тьюки (Tukey). Средние для групп, получавших лечение, сравнивали с использованием однофакторного ANOVA и апостериорного критерия Бонферрони или U-критерия Манна-Уитни для сравнения групп, получавших лечение метамизолом или получавших носитель. Максимальные возможные эффекты (МВЭ) вычисляли для всех типов лечения. Включали только крыс, у которых пороги отдергивания были значительно снижены. Результаты. Пороги отдергивания при давлении, прилагаемом чрескожно на мышцу, заметно снижены после инъекции TNF у большинства крыс. Эта первичная мышечная гипералгезия сопровождает болезненность при пальпации, которую наблюдают клинически у пациентов с миалгией, такой как миофасциальная боль, фибромиалгия и боль в спине; см. McCain в Walls and и R. Melzack (Eds.); Textbook of Pain, NewYork: Churchill Livingstone (1994) p. 475-493). Болезненность при пальпации является главным критерием для диагноза мышечной боли у человека в клинических и экспериментальных условиях (Wolfe F., et al.,The American College of Rheumatology 1990 criteria for classification of fibromyalgia: report of the multicenter criteria committee. Arthritis Rheum 1990, 33:160-172; Arendt-Nielsen L. в TS Jensen, J.A. Turner and Z.Wiesenfeld-Hallin (Eds.), Proceedings of the 8th World Congress of Pain: IASP Press, Seattle, (1997), p. 393425). В табл. 2 показаны абсолютные величины порогов отдергивания при давлении без инъекции TNF. Пороги отдергивания оставались стабильными после инъекции забуференного фосфатом физиологического раствора (PBS). Значительно более высокие пороги отдергивания наблюдались с ротиготином, 1 мг/кг. Таблица 2 Влияние ротиготина на давление, вызывающее отдергивание, р 0,05 В табл. 3 показаны абсолютные величины порогов отдергивания при давлении с инъекцией TNF. Таблица 3 Влияние ротиготина на давление, вызывающее отдергивание Как показано в табл. 4 и на фиг. 3, процент максимально возможного эффекта (% МВЭ) значительно различается у носителя и ротиготина при 3 мг/кг и метамизола при 2 мг/кг. Носитель не оказывал никакого эффекта. Таблица 4 В табл. 5 показаны абсолютные величины силы хватки без инъекции TNF. Все величины силы хватки были постоянными после инъекции физиологического раствора.- 15017746 Таблица 5 Влияние ротиготина на силу хватки (без инъекции TNF) В табл. 6 показаны абсолютные величины силы хватки после инъекции TNF. Таблица 6 Влияние ротиготина на силу хватки (с инъекцией TNF) Как показано в табл. 7 и на фиг. 4, процент максимального возможного эффекта (% МВЭ) значительно отличался от носителя для метамизола (2 мг/кг). Носитель не оказывал никакого эффекта. Таблица 7% МВЭ ротиготина и метамизола на силу хватки (см. также фиг. 4)р 0,01 (U-критерий Манна-Уитни) при сравнении с PBS, МД+/-SEM На основании результатов этого исследования можно заключить, что ротиготин вызывает дозозависимое ослабление мышечной гипералгезии, индуцированной инъекцией TNF в мышцу. Пример 3. Параллельное рандомизированное двойное слепое контролируемое плацебо исследование с целью подтверждения концепции оценки эффективности и безопасности ротиготина у субъектов с признаками и симптомами, ассоциированными с фибромиалгическим синдромом. Это исследование с целью подтверждения концепции исследует эффективность и безопасность 2 доз ротиготина у взрослых мужчин и женщин с фибромиалгическим синдромом. Это исследование является рандомизированным двойным слепым, контролируемым плацебо, многоцентровым испытанием. Суммарная продолжительность лечения после достижения исходного уровня составляет 13 недель. Испытание состоит из 4-недельной фазы титрования, 8-недельной фазы поддержания, 1-недельной фазы деэскалации и 2-недельной фазы контролирования безопасности. Если субъекты отвечают критериям отбора, их рандомизируют для получения либо ротиготина 4 мг/24 ч, либо ротиготина 8 мг/24 ч, либо плацебо во время фазы поддержания. У субъектов, которым назначен ротиготин, проводят титрование при 2 мг/24 ч с недельными интервалами до достижения 4 мг/24 ч или 8 мг/24 ч. Все субъекты, завершившие 4-недельную фазу титрования, вступают в 8-недельную фазу поддержания. Подбор доз во время фазы поддержания недопустим. Фазу лечения определяют как объединенные фазы титрования и поддержания. Главной переменной в этом испытании является изменение в значении средней оценки боли по шкале Ликерта (Likert) от исходного уровня к последним 2 неделям фазы лечения. Вторичными переменными эффективности являются суммарная балльная оценка и сопутствующие вторичные оценки по опроснику о влиянии фибромиалгии (Fibromyalgia Impact Questionnaire, FIQ), суммарная оценка миалгии(численная оценка боли от пальпации 18 возможных болезненных точек), восприятие субъектом помех сну и общей активности и шкала общего впечатления пациента об изменениях (Global Impression ofChange, PGIC). Другие переменные включают Реестр-II Бека для оценки депрессии (Beck Depression Inventory-II, BDI-II), Госпитальную шкалу тревоги и депрессии (Hospital Anxiety and Depression, HADS),оценки по суб-шкалам депрессии и тревоги, употребление лекарственных средств (в том числе алкоголя) для избавления от боли, проверочный перечень симптомов фибромиалгии, присутствие импульсивных нарушений контроля, приступы сонливости, менструальную/сексуальную функцию и фармакокинетические оценки. Субъекты пользуются бумажным дневником утром и вечером для записей об интенсивно- 16017746 сти боли, о помехах сну и общей активности в результате боли и употреблении препаратов для купирования симптомов. Около 25 сайтов были выбраны для соответствия периоду времени для набора добровольцев. Для того чтобы рандомизировать 240 субъектов (по 80 субъектов на вариант лечения) было привлечено приблизительно 480 субъектов. Схема испытания. Переменные для оценки были следующие. Первичные переменные: изменение средней оценки суточной боли у субъекта от исходного уровня к последним 2 неделям фазы лечения с использованием 11-балльной шкалы Ликерта (0-10). Вторичные переменные (эффективность): изменение по опроснику о влиянии фибромиалгии (FIQ) у субъекта от исходного до конечного уровня (0-100); изменение суммарной оценки миалгии у субъекта от исходного до конечного уровня (0-54); изменение среднего для суточных помех сну у субъекта от исходного уровня до последних 2 недель фазы лечения с использованием 11-балльной шкалы Ликерта (010); изменение среднесуточных помех общей активности у субъекта от исходного уровня до последних 2 недель фазы лечения с использованием 11-балльной шкалы Ликерта (0-10); суммарное восприятие изменений боли от исходного до конечного уровня с использованием. Шкалы общего впечатления пациента об изменениях (PGIC); изменение в средней оценке утренней боли у субъекта от исходного уровня до последних 2 недель фазы лечения; изменение в средней оценке вечерней боли у субъекта от исходного уровня до последних 2 недель фазы лечения. Вторичные переменные (другие): изменение от исходного уровня в Реестре-II Бека для оценки депрессии (BDI-II) у субъекта; изменение от исходного уровня в Госпитальной шкале тревоги и депрессии(HADS) и субшкалах депрессии и тревоги у субъекта; употребление лекарственных средств (в том числе алкоголя) для избавления от боли; проверочный перечень изменений в симптомах фибромиалгии; присутствие импульсивных нарушений контроля (оцениваемых по Модифицированному Миннесотскому Интервью Джея об импульсивных нарушениях (Jay Modified Minnesota Impulsive Disorders Interview,MIDI); концентрации ротиготина в плазме. Вторичные переменные (безопасность): наблюдение и оценки нежелательных случаев (AEs); изменения лабораторных параметров (включая эндокринные параметры); изменения показателей жизненно важных функций (давление крови, пульс, температура, масса тела); изменения в результатах физического обследования; изменения в электрокардиограмме (ЭКГ) с 12 отведениями; наличие приступов сонливости; изменения в менструальной/сексуальной функции; отказы субъектов из-за AEs. Описание испытания. В целом, испытание состоит из фазы скрининга вплоть до конца фазы контролирования безопасности (см. табл. 8). Таблица 8 Описание испытания Субъектов, заполнявших дневник каждые сутки, начиная со скрининга (визит 1),используют для определения пригодности к рандомизации за 7 суток до исходного уровня (визит 2). Испытательное лечение. Субъектов, которые завершили фазу скрининга и вступают в фазу титрования во время визита 2(исходный уровень), рандомизируют в 1 из 3 различных групп лечения: ротиготин 4 мг/24 ч, ротиготин 8 мг/24 ч и плацебо. Используют два разных размера накладки (10 и 20 см 2). Активные накладки доставляют либо 2 мг/24 ч, либо 4 мг/24 ч ротиготина. Накладки с плацебо соответствуют по размеру и внешнему виду. Способы оценки параметров эффективности. Параметры эффективности оценивают с использованием, среди прочего, следующих рейтинговых шкал, опросников и оценок. Шкала Ликерта: для оценки состояния субъектов используют 11-балльную шкалу Ликерта. Субъекты заполняют дневник ежесуточно утром и вечером, как указано. Шкала боли: субъекты оценивают свою- 17017746 среднюю боль за последние 12 ч в баллах от 0 (нет боли) до 10 (сильнейшая боль, когда-либо испытанная) (утренний и вечерний дневник). Шкала сна: субъект оценивает качество сна в баллах от 0 (очень хороший сон) до 10 (очень плохой сон) (только утренний дневник), был ли сон достаточным (да/нет), и проснулся ли субъект отдохнувшим (да/нет). Шкала общей активности: субъект оценивает, как боль мешает общей активности за последние 12 ч в баллах от 0 (не мешала) до 10 (полностью мешала) (только вечерний дневник). Опросник по влиянию фибромиалгии (FIQ): FIQ представляет собой средство для самоконтроля,состоящее из 20 вопросов. Его заполняют в начале визита. Первый пункт содержит 11 вопросов, относящихся к физическим функциям; каждый вопрос оценивается по 4-балльной шкале типа Ликерта. Вопросы 12 и 13 требуют от субъекта отметить число суток, когда он/она чувствовал(а) себя хорошо, и число суток, когда он/она был(а) неспособен(на) к работе (включая работу по дому) из-за симптомов фибромиалгии. Вопросы 14-20 представляют собой горизонтальные линейные шкалы с 10 делениями, по которым субъект оценивает трудность в работе, боль, утомление, утреннюю усталость, тугоподвижность, тревогу и депрессию. Общее впечатление пациента об изменениях (PGIC): PGIC представляет собой 7-балльную категориальную рейтинговую шкалу для самоконтроля, по которой субъект оценивает изменения своей боли с начала испытания лекарства (от гораздо хуже [1 балл] до гораздо лучше [7 баллов]). Общая оценка миалгии: общая оценка миалгии основана на клинической оценке 18 болезненных точек, ассоциированных с фибромиалгией. Исследователь должен нажимать на каждую болезненную точку при достаточном давлении (4 кг/см 2) для побледнения кожи под ногтем пальца. Каждую точку оценивают по шкале от 0 до 3 (0 = нет боли, 1 = боль повторяется, 2 = фокальный ответ на боль, 3 = пациент вздрагивает или отдергивается), и общую оценку суммируют. Максимальная оценка миалгии составляет 54. Каждую попытку должен делать один и тот же клиницист для всех субъектов на протяжении всего испытания. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения, имеющего формулу (I) где n равен числу от 1 до 5;R2 представляет собой группу -ОА; каждый из R3 и R4 независимо представляет собой водород или группу -ОА; А представляет собой водород;R5 представляет собой С 1-3 алкил; где соединения формулы (I) могут присутствовать в виде чистых энантиомеров (R или S) или их любой смеси, включая рацематы, или их фармацевтически приемлемых солей, для изготовления фармацевтической композиции для предупреждения, облегчения и/или лечения хронической и/или острой боли, где боль выбрана из мышечно-скелетной боли, включая боль в спине, фибромиалгию, миофасциальную боль, боли при менструации, боли при остеоартрите, боли при ревматоидном артрите, боли при желудочно-кишечном воспалении, боли при воспалении сердечной мышцы, боли при рассеянном склерозе,боли при неврите, боли при СПИДе, боли при химиотерапии, онкологической боли, головной боли, ХБС(хронического болевого синдрома), центральной боли, невропатической боли, такой как невралгия тройничного нерва, боль при опоясывающем лишае, боль от ушиба, фантомная боль, боль при нарушении в височно-нижнечелюстном суставе, повреждение нерва, постгерпетическая невралгия или невропатическая боль, имеющая место вследствие повреждений, ампутаций, инфекций, метаболических расстройств,невропатической боли, ассоциированной с диабетом, нарушением осязания, гипотиреозом, уремией, недостаточностью витаминов или алкоголизмом и острой боли, такой как боль после повреждений, послеоперационная боль, боль при острой подагре или боль во время операций, таких как челюстная хирургия. 2. Применение соединения по п.1, где фармацевтическую композицию дают при невоспалительной мышечно-скелетной боли. 3. Применение соединения по п.2, где фармацевтическую композицию дают при фибромиалгии,миофасциальной боли или боли в спине.- 18017746 4. Применение соединения по п.3, где фармацевтическую композицию дают при фибромиалгии. 5. Применение соединения по любому из пп.1-4, где фармацевтическую композицию дают для ослабления мышечной гипералгезии или мышечной аллодинии. 6. Применение по любому из пп.1-5, где n равен 1, 2 или 3. 7. Применение по любому из пп.1-6, где R5 представляет собой С 3 алкил. 8. Применение по любому из пп.1-7, где R1 представляет собой 2-тиенил, R3 и R4, оба, представляют собой водород, R5 представляет собой С 3 алкил и n равен 2. 9. Применение по любому из пп.1-8, где соединение представляет собой (+/-)-5,6,7,8-тетрагидро-6[пропил[2-(2-тиенил)этил]амино]-1-нафтол или его фармацевтически приемлемую соль. 10. Применение по п.9, где соединение представляет собой чистый S-энантиомер (ротиготин) или гидрохлорид ротиготина. 11. Применение по любому из пп.1-10, где фармацевтическую композицию дают для парентерального, трансдермального или трансмукозального введения. 12. Применение по п.11, где фармацевтическую композицию дают для трансдермального введения. 13. Применение по любому из пп.1-12, где соединение общей формулы (I) вводят в дозе от 0,05 до 50 мг в сутки.
МПК / Метки
МПК: A61K 31/135, A61K 31/381, A61P 29/00
Метки: изготовления, лечения, боли, предупреждения, облегчения, применение, видов, лекарственного, средства, замещенных, разных, 2-аминотетралинов
Код ссылки
<a href="https://eas.patents.su/21-17746-primenenie-zameshhennyh-2-aminotetralinov-dlya-izgotovleniya-lekarstvennogo-sredstva-dlya-preduprezhdeniya-oblegcheniya-i-ili-lecheniya-raznyh-vidov-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Применение замещенных 2-аминотетралинов для изготовления лекарственного средства для предупреждения, облегчения и/или лечения разных видов боли</a>
Предыдущий патент: Трибуна
Следующий патент: Оранжерейный светильник, оранжерейная осветительная система и способ изменения характеристики излучения оранжерейного светильника
Случайный патент: Свеклоуборочная машина, прежде всего в форме самоходного уборочного комбайна












