Гетероциклилзамещенные фенилсульфамоилкарбоксамиды
Номер патента: 5677
Опубликовано: 28.04.2005
Авторы: Такасуги Джеймс Джан, Гуакларо Майкл Антони, Карлсен Марианна
Формула / Реферат
1. Гетероциклилзамещенные фенилсульфамоилкарбоксамиды формулы I
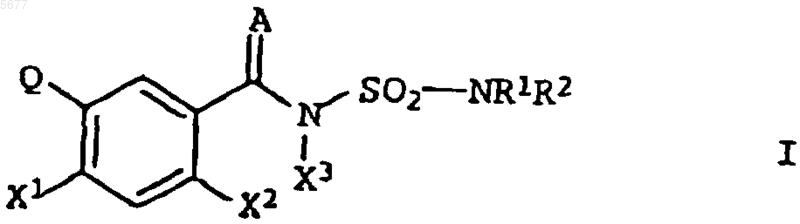
в которой A обозначает атом кислорода;
X1 обозначает атом водорода или галогена;
X2 обозначает атом галогена;
X3 обозначает атом водорода;
R1 и R2, каждый независимо друг от друга, обозначает атом водорода или C1-C10алкил, который может быть замещен одним заместителем, выбранным из цианогруппы, C1-C6алкоксикарбонила, 1,3-диоксоланила, фенила, тиенила или фурила; C2-C10алкенил; C3-C10алкинил; C3-C7циклоалкил; фенил, который может быть замещен одним или двумя заместителями, выбранными из галогена, C1-C6алкокси, C1-C6алкоксикарбонил, фенокси, фенил, нитро, C1-C6алкил-C1-C6галоалкил, C1-C6алкиламино или ди-C1-C6алкиламино; бензил, который может быть замещен галогеном или C1-C6алкокси; пиридил; нафтил; или
R1 и R2 вместе образуют группу -CH2-CH=CH-CH2-, -(CH2)4- или 
Q имеет значение, выбранное из Q1, Q5, Q7, Q10, Q21, Q22, Q27, Q32, Q38 или Q40
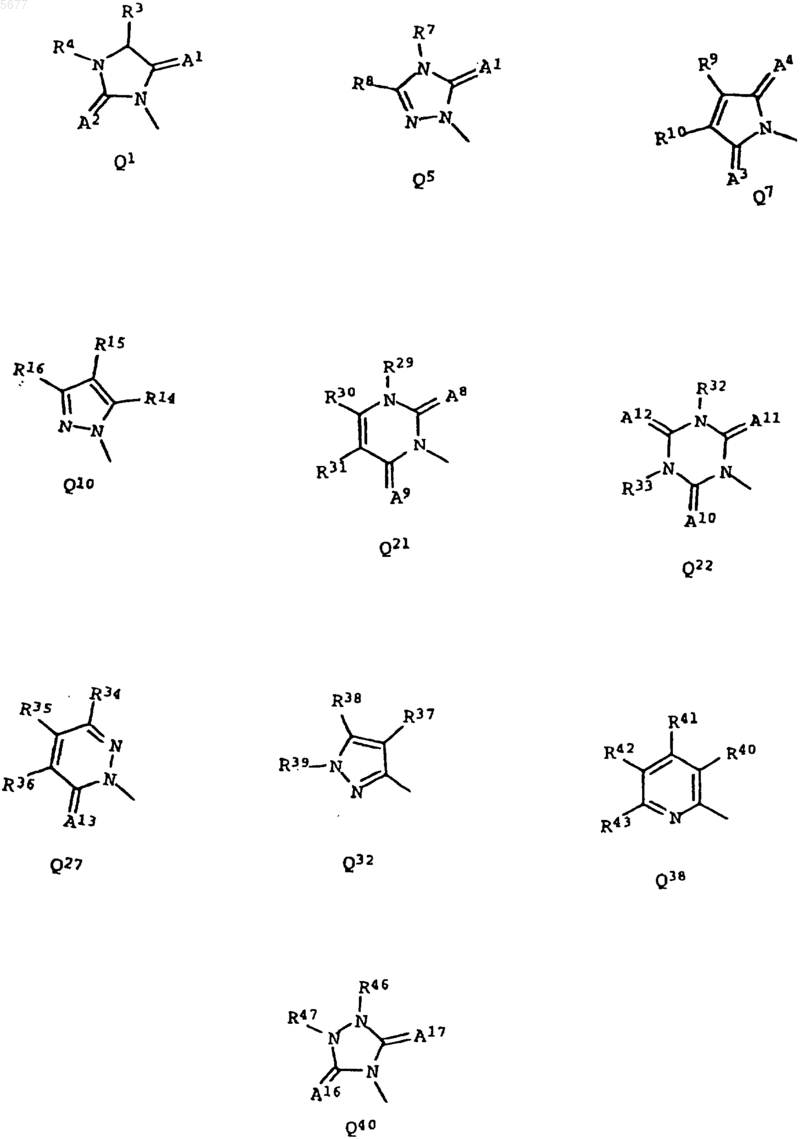
в которых A1 A2, A3, A4, A8, A9, A10, A11, A13, A16 каждый обозначает атом кислорода;
A12 обозначает серу,
A17 обозначает кислород или серу;
R3, R4 вместе образуют группу -CH2-CHF-CH2- или -CH2-O-CH2CH2-;
R7 обозначает C1-C6алкил или C1-C6галоалкил;
R8 обозначает C1-C6алкил или
R7 и R8 вместе образуют группу -(CH2)4-;
R9 и R10 вместе образуют группу -(CH2)4-;
R14 обозначает галоген;
R15 и R16 вместе образуют группу -(CH2)4-;
R29 обозначает водород, C1-C6алкил или амино;
R30 обозначает C1-C6галоалкил;
R31 обозначает водород;
R32 обозначает C1-C6алкил;
R33 обозначает C1-C6алкил;
R34 обозначает водород;
R35 обозначает C1-C6галоалкил;
R36 обозначает водород или C1-C6алкил;
R37 обозначает водород или C1-C6алкил;
R38 обозначает C1-C6галоалкил или C1-C6галоалкокси;
R39 обозначает C1-C6алкил;
R40 обозначает галоген;
R41 обозначает водород;
R42 обозначает C1-C6галоалкил;
R43 обозначает водород;
R46 и R47 вместе образуют группу -(CH2)-O-(CH2), -(CH2)4- или -(CH2)2-O-(CH2)- и
агротехнически приемлемые соли соединений I.
2. Соединение по п.1, где значения Q выбирают из Q5, Q7, Q21, Q22, Q27, Q32, Q38 или Q40.
3. 2-Хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-(диметилсульфамоил)-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(этил)пропилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-(втор-бутилсульфамоил)-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-(трет-бутилсульфамоил)-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(этил)метилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(метил)пропилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(диэтил)сульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-амино-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(метил)изопропилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(втор-бутил)метилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(метил)фенилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(метил)изопропилсульфамоил]-4-фторбензамид,
2-хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2H)-пиримидинил]-N-[(н-бутил)метилсульфамоил]-4-фторбензамид,
N'-{{2-хлор-4-фтор-5-[4-(дифторметил)-4,5-дигидро-3-метил-5-оксо-1H-1,2,4-триазол-1-ил]бензоил}}-N-изопропил-N-метилсульфамид,
N'-[2-хлор-4-фтор-5-(5,6,7,8-тетрагидро-3-оксо-1,2,4-триазоло[4,3-a]пиридин-2(3H)-ил)бензоил]-N-изопропил-N-метилсульфамид,
N'-[2-хлор-5-(3,5-диметил-2,6-диоксо-4-тиоксо-1,3,5-триазинан-1-ил)-4-фторбензоил]-N-изопропил-N-метилсульфамид,
N'-[2-хлор-4-фтор-5-(5-трифторметилпиридазон-3-он-2-ил)бензоил]-N-изопропил-N-метилсульфенамид,
4-хлор-3-[4-хлор-2-фтор-5-(N-метил-N-изопропил)сульфамоилкарбоксамидофенил]-5-дифторметокси-1-метил-1H-пиразол,
N'-{{2-хлор-5-[3-хлор-5-(трифторметил)-2-пиридинил]-4-фторбензоил}}-N-изопропил-N-метилсульфамид и
8-(5'-N-изопропил-N-метилсульфамоилкарбоксамидо-4'-хлор-2'-фторфенил)-4-оксо-7,9-диоксо-1,2,8-триаза(4,3,0)нонан.
4. Гербицидная композиция, включающая гербицидно эффективное количество по меньшей мере одного соединения формулы I или агротехнически приемлемой соли соединения I по п.1 и по меньшей мере один инертный жидкий и/или твердый носитель, а также, если необходимо, по меньшей мере одно поверхностно-активное вещество.
5. Композиция для десикации и/или дефолиации растений, включающая такое количество по меньшей мере одного соединения формулы I или агротехнически приемлемой соли соединения I по п.1, которое действует как десикант и/или дефолиант, и по меньшей мере один инертный жидкий и/или твердый носитель, а также, если необходимо, по меньшей мере одно поверхностно-активное вещество.
6. Способ борьбы с нежелательной растительностью, который включает воздействие гербицидно эффективным количеством по меньшей мере одного соединения формулы I или агротехнически приемлемой соли соединения I по п.1 на растения, окружающую их среду или семена.
7. Способ десикации/дефолиации растений, который включает воздействие таким количеством по меньшей мере одного соединения формулы I или агротехнически приемлемой соли соединения I по п.1 на растения, которое эффективно в качестве дефолианта и/или десиканта.
8. Способ по п.7, в котором обрабатывают хлопчатник.
Текст
005677 Сорные растения наносят огромный глобальный экономический ущерб из-за снижения урожайности и ухудшения качества собираемой сельскохозяйственной культуры. Во всем мире сельскохозяйственные культуры вынуждены конкурировать с сорняками сотен видов. Несмотря на техническую доступность гербицидов, сорные растения и в настоящее время все еще наносят вред сельскохозяйственным культурам. По этой причине продолжаются исследования с целью создать более эффективные и/или более селективные гербицидные средства. В заявке WO 98/06706 описаны применение некоторых п-трифторметилфенилурацилов как гербицидов и способ их получения. Кроме того, обладающие гербицидным действием арилурацилы и арилтиоурацил, у которых арильное кольцо представляет собой необязательно замещенную фенильную группу, описаны в заявке WO 96/08151. Однако ни в одной из этих заявок сульфамоилкарбоксамидная группа в качестве заместителя не упомянута. Таким образом, объектом настоящего изобретения является создание новых 3-фенилурацилов, которые проявляют высокую эффективность в борьбе с растениями нежелательных видов. Объект изобретения охватывает также создание новых соединений, которые действуют как десиканты/дефолианты. Объектом настоящего изобретения являются также разработка способа борьбы с растениями нежелательных видов и применяемые для этого композиции. Преимущество настоящего изобретения состоит в том, что такой способ борьбы с растениями нежелательных видов можно осуществлять в присутствии сельскохозяйственной культуры. Еще одним объектом настоящего изобретения является разработка способа получения обладающих гербицидным действием фенилсульфамоилкарбоксамидов и используемое для его осуществления промежуточное соединение. Эти и другие объекты и преимущества настоящего изобретения станут более очевидными из его подробного описания, приведенного ниже. При создании настоящего изобретения было установлено, что цели настоящего изобретения достигаются с помощью новых урацилзамещенных фенилсульфамоилкарбоксамидов формулы I в которой переменные фрагменты имеют следующие значения: А обозначает атом кислорода или серы; Х 1 обозначает атом водорода или галогена или С 1-С 4 алкил; Х 2 обозначает атом водорода, цианогруппу, CS-NH2, атом галогена, C1-С 4 алкил или С 1-С 4 галоалкил;X3 обозначает атом водорода, цианогруппу, С 1-С 6 алкил, С 1-С 6 алкоксиалкил, С 3-С 7 циклоалкил, С 3 С 6 алкенил, С 3-С 6 алкинил или необязательно замещенный бензил;R1 и R2, каждый независимо друг от друга, обозначает атом водорода или галогена, OR48, С 1 С 10 алкил, С 2-С 10 алкенил, С 3-С 10 алкинил, С 3-С 7 циклоалкил, фенил, бензил или С 5-С 7 циклоалкенил, принимая во внимание, что каждая из последних упомянутых 7 групп может быть замещена любым сочетанием от одного до шести атомов галогена, от одной до трех С 1-С 6 алкоксигрупп, одной или двух С 1 С 8 галоалкоксигрупп, одной или двух цианогрупп, одной или двух С 3-С 7 циклоалкильных групп, одной или двух групп C(О)R49, одной или двух групп CO-OR50, одной или двух групп CO-SR51, одной или двух групп CO-NR52R53, от одной до трех групп OR54, от одной до трех групп SR54, одним необязательно замещенным от 4- до 10-членным моноциклическим или конденсированным бициклическим гетероциклическим кольцом, одной или двумя необязательно замещенными фенильными группами или одной или двумя необязательно замещенными бензильными группами,или R1 и R2 совместно с атомом, с которыми они связаны, образуют от 3- до 7-членного гетероциклического кольца; в которых A1-A17, каждый независимо, обозначает атом кислорода или серы;R3 и R4, R7 и R8, R11 и R12, R18 и R19 или R46 и R47 совместно с атомами, с которыми они связаны, могут образовывать 4-7-членное кольцо, необязательно прерываемое атомом кислорода, серы или азота и необязательно замещенное одним или несколькими атомами галогена или C1-С 4 алкильными группами;R5 и R6, R9 и R10, R15 и R16, R20 и R21 или R30 и R31 совместно с атомами, с которыми они связаны,могут образовывать 4-7-членное кольцо, необязательно замещенное одним или несколькими атомами галогена или С 1-С 4 алкильными группами;R13, R14, R22, R23, R25 и R26, каждый независимо, обозначает атом водорода или галогена или С 1 С 6 алкил;R17, R28, R34, R37 и R40, каждый независимо, обозначает атом водорода или галогена, С 1-С 6 алкил; С 1 С 6 галоалкил, С 3-С 7 циклоалкил, С 2-С 6 алкенил, С 2-С 6 галоалкенил, С 3-С 6 алкинил, OR60 или SR61;R48, R49, R50, R51, R52, R53, R54, R55, R56, R57, R58, R59, R60 и R61, каждый независимо друг от друга, обозначает атом водорода, С 1-С 6 алкил, С 1-С 6 галоалкил, С 3-С 7 циклоалкил, С 2-С 6 алкенил, С 3-С 6 алкинил, необязательно замещенный фенил или необязательно замещенный бензил;n обозначает 0, 1 или 2; и агротехнически приемлемых солей соединений I. Более того, изобретение относится к применению соединений I в качестве гербицидов и/или для десикации/дефолиации растений, гербицидным композициям и композициям для десикации/дефолиации растений, которые в качестве действующих веществ включают соединения I, способам получения соединений I и гербицидных композиций и к композициям для десикации/дефолиации растений с использованием соединений I, способам борьбы с нежелательной растительностью и для десикации/дефолиации растений с использованием соединений I и новым промежуточным продуктам формулы II в которой Q, X1 и X2 имеют значения, указанные выше, при условии, что значения Q должны быть отличными от значений Q21. Предпочтительные соединения формул I и II могут быть очевидными из зависимых пунктов и из приведенного ниже описания. В зависимости от характера замещения соединения формулы I могут включать один или несколько хиральных центров, причем в этом случае они существуют в форме смесей энантиомеров или диастереоизомеров. По настоящему изобретению предлагаются как чистые энантиомеры или диастереоизомеры,так и их смеси. Агротехнически приемлемыми основными солями являются, в частности, соли тех катионов и кислотно-аддитивные соли тех кислот, соответственно катионы и анионы которых не оказывают отрицательного влияния на гербицидное действие соединений I. Таким образом, подходящими катионами являются, в частности, ионы щелочных металлов, предпочтительно натриевые и калиевые, щелочноземельных металлов, предпочтительно кальциевые, магниевые и бариевые, и переходных металлов,предпочтительно марганца, меди, цинка и железа, а также аммониевые ионы, которые могут нести от одного до четырех С 1-С 4 алкильных заместителей и/или по одному фенильному или бензильному заместителю, предпочтительно диизопропиламмониевые, тетраметиламмониевые, тетрабутиламмониевые,триметилбензиламмониевые и, кроме того, фосфониевые ионы, сульфониевые ионы, предпочтительно три(С 1-С 4 алкил)сульфониевые, и сульфоксониевые ионы, предпочтительно три(С 1-С 4 алкил)сульфоксониевые ионы. Анионы приемлемых кислотно-аддитивных солей представляют собой главным образом хлориды,бромиды, фториды, гидросульфаты, сульфаты, дигидрофосфаты, гидрофосфаты, фосфаты, нитраты, гидрокарбонаты, карбонаты, гексафторсиликаты, гексафторфосфаты, бензоаты и анионы С 1-С 4 алифатических кислот, предпочтительно формиаты, ацетаты, пропионаты и бутираты. Органические остатки, упомянутые в отношении заместителей X3 и с R1 по R61 или в качестве радикалов при фенильных кольцах или гетероциклах, представляют собой обобщающие понятия для отдельных перечней каждого из представителей групп, как при описании смысла понятия "атом галогена". Все углеводородные цепи, т.е. все алкильные, галоалкильные, алкенильные, алкинильные и фенилалкильные остатки, могут быть прямоцепочечными или разветвленными. Понятия "галоалкил", "галоалкокси" и "галоалкенил" в настоящем описании и формуле изобретения использованы для обозначения соответственно алкильной группы, алкоксигруппы или алкенильной группы, замещенной одним или несколькими атомами галогена. Атомы галогена могут быть одинаковыми или разными. Предпочтительные галоидированные заместители включают от одного до пяти связанных с ними одинаковых или разных атомов галогенов.-3 005677 4-10-Членные моноциклические или конденсированные бициклические гетероциклы, соответствующие вышеприведенной формуле I, включают, хотя ими их список не ограничен, бензимидазоловые,имидазоловые, имидазолин-2-тионовые, индоловые, изатовые ангидридные, морфолиновые, пиперазиновые, пиперидиновые, пуриновые, пиразоловые, пирроловые, пирролидиновые и 1,2,4-триазоловые кольца, где каждое кольцо необязательно замещено одной или несколькими группами, независимо выбранными из атомов галогена, циано-, нитро-, аминогрупп, гидроксильной, С 1-С 4 алкильных, С 1 С 4 галоалкильных, С 1-С 4 алкокси-, С 1-С 4 галоалкокси- и С 1-С 4 галоалкилсульфонильных групп. Когда фенил или бензил упоминается как необязательно замещенный, то в качестве необязательных заместителей каждый из них может содержать один или несколько из тех, которые обычно используют при создании пестицидных соединений и/или модификации таких соединений с целью оказать влияние на их строение/активность, стойкость, пенетрацию и другие свойства. Конкретные примеры таких заместителей включают, в частности, атомы галогенов, нитро-, циано-, тиоцианатную, цианатную, гидроксильную, алкильную, галоалкильную, алкокси-, галоалкокси-, амино-, алкиламино-, диалкиламино-,формильную, алкоксикарбонильную, карбоксильную, алканоильную, алкилтио-, алкилсульфинильную,алкилсульфонильную, карбамоильную, алкиламидную, фенильную, фенокси-, бензильную, бензилокси-,гетероциклильную, преимущественно фурильную, и циклоалкильную, преимущественно циклопропильную, группы. Численность заместителей, как правило, может составлять от нуля до трех. Когда любой из вышеперечисленных заместителей включает или содержит алкильную замещающую группу, она может быть линейной или разветвленной и может содержать до 12, предпочтительно до 6, а преимущественно до 4, углеродных атомов. 3-7-Членные гетероциклы, соответствующие вышеприведенной формуле I, включают, хотя ими их список не ограничен, имидазоловое и фталимидное кольца, где каждое кольцо необязательно замещено любым сочетанием от одного до трех атомов галогена, от одной до трех С 1-С 4 алкильных групп, от одной до трех С 1-С 4 галоалкильных групп, от одной до трех С 1-С 4 алкоксигрупп или от одной до трех С 1 С 4 галоалкоксигрупп. Урацилзамещенные фенилсульфамоилкарбоксамиды I проявляют неожиданный уровень гербицидного действия и неожиданную селективность в отношении сельскохозяйственных культур. Приведенные ниже радикалы имеют, например, следующие конкретные значения: атомы галогена: атомы фтора, хлора, брома или иода, предпочтительно фтора или хлора; С 1-С 4 алкил: СН 3, С 2H5, СН 2-C2H5, СН(СН 3)2, н-C4 Н 9, СН(СН 3)-С 2 Н 5, СН 2-СН(СН 3)2 или С(СН 3)3; С 1-С 6 алкил и алкильные остатки С 1-С 6 алкокси-С 1-С 6 алкила: метил, этил, н-пропил, 1-метилэтил, нбутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3 метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1 метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3 диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2 триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил или 1-этил-2-метилпропил, предпочтительно С 1-С 4 алкил, в частности метил или этил; С 1-С 3 цианоалкил: CH2CN, 1-цианоэтил, 2-цианоэтил, 1-цианопроп-1-ил, 2-цианопроп-1-ил, 3 цианопроп-1-ил или 1-(СН 2 СN)-эт-1-ил; С 1-С 6 галоалкил: С 1-С 6 алкил, как он приведен выше, который частично или полностью замещен фтором, хлором, бромом и/или иодом, например CH2F, CHF2, СF3, СН 2 Сl, СН(Сl)2, С(Сl)3, хлорфторметил, дихлорфторметил, хлордифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2 хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, С 2F5, 3-фторпропил,3-хлорпропил или CF2-C2F5, предпочтительно С 1-С 4 галоидалкил, в частности трифторметил или 1,2 дихлорэтил; С 2-С 6 алкенил: этенил, проп-1-ен-1-ил, проп-2-ен-1-ил, 1-метилэтенил, н-бутен-1-ил, н-бутен-2-ил,н-бутен-3-ил, 1-метилпроп-1-ен-1-ил, 2-метилпроп-1-ен-1-ил, 1-метилпроп-2-ен-1-ил, 2-метилпроп-2-ен 1-ил, н-пентен-1-ил, н-пентен-2-ил, н-пентен-3-ил, н-пентен-4-ил, 1-метилбут-1-ен-1-ил, 2-метилбут-1-ен 1-ил, 3-метилбут-1-ен-1-ил, 1-метилбут-2-ен-1-ил, 2-метилбут-2-ен-1-ил, 3-метилбут-2-ен-1-ил, 1-метилбут-3-ен-1-ил, 2-метилбут-3-ен-1-ил, 3-метилбут-3-ен-1-ил, 1,1-диметилпроп-2-ен-1-ил, 1,2-диметилпроп 1-ен-1-ил, 1,2-диметилпроп-2-ен-1-ил, 1-этилпроп-1-ен-2-ил, 1-этилпроп-2-ен-1-ил, н-гекс-1-ен-1-ил, нгекс-2-ен-1-ил, н-гекс-3-ен-1-ил, н-гекс-4-ен-1-ил, н-гекс-5-ен-1-ил, 1-метилпент-1-ен-1-ил, 2-метилпент 1-ен-1-ил, 3-метилпент-1-ен-1-ил, 4-метилпент-1-ен-1-ил, 1-метилпент-2-ен-1-ил, 2-метилпент-2-ен-1-ил,3-метилпент-2-ен-1-ил, 4-метилпент-2-ен-1-ил, 1-метилпент-3-ен-1-ил, 2-метилпент-3-ен-1-ил, 3-метилпент-3-ен-1-ил, 4-метилпент-3-ен-1-ил, 1-метилпент-4-ен-1-ил, 2-метилпент-4-ен-1-ил, 3-метилпент-4-ен 1-ил, 4-метилпент-4-ен-1-ил, 1,1-диметилбут-2-ен-1-ил, 1,1-диметилбут-3-ен-1-ил, 1,2-диметилбут-1-ен 1-ил, 1,2-диметилбут-2-ен-1-ил, 1,2-диметилбут-3-ен-1-ил, 1,3-диметилбут-1-ен-1-ил, 1,3-диметилбут-2 ен-1-ил, 1,3-диметилбут-3-ен-1-ил, 2,2-диметилбут-3-ен-1-ил, 2,3-диметилбут-1-ен-1-ил, 2,3-диметилбут 2-ен-1-ил, 2,3-диметилбут-3-ен-1-ил, 3,3-диметилбут-1-ен-1-ил, 3,3-диметилбут-2-ен-1-ил, 1-этилбут-1 ен-1-ил, 1-этилбут-2-ен-1-ил, 1-этилбут-3-ен-1-ил, 2-этилбут-1-ен-1-ил, 2-этилбут-2-ен-1-ил, 2-этилбут-3 ен-1-ил, 1,1,2-триметилпроп-2-ен-1-ил, 1-этил-1-метилпроп-2-ен-1-ил, 1-этил-2-метилпроп-1-ен-1-ил или 1-этил-2-метилпроп-2-ен-1-ил, предпочтительно С 3- или С 4 алкенил; С 2-С 6 галоалкенил: С 2-С 6 алкенил, как-4 005677 он упомянут выше, который частично или полностью замещен фтором, хлором, бромом и/или иодом,т.е., например, 2-хлораллил, 3-хлораллил, 2,3-дихлораллил, 3,3-дихлораллил, 2,3,4-трихлораллил, 2,3 дихлорбут-2-енил, 2-бромаллил, 3-бромаллил, 2,3-дибромаллил, 3,3-дибромаллил, 2,3,3-трибромаллил или 2,3-дибромбут-2-енил; С 3-С 6 алкинил: проп-1-ин-1-ил, проп-2-ин-3-ил, н-бут-1-ин-4-ил, н-бут-1-ин-4-ил, н-бут-2-ин-1-ил, нпент-1-ин-1-ил, н-пент-1-ин-3-ил, н-пент-1-ин-4-ил, н-пент-1-ин-5-ил, н-пент-2-ин-1-ил, н-пент-2-ин-4 ил, н-пент-2-ин-5-ил, 3-метилбут-1-ин-1-ил, 3-метилбут-1-ин-3-ил, 3-метилбут-1-ин-4-ил, н-гекс-1-ин-1 ил, н-гекс-1-ин-3-ил, н-гекс-1-ин-4-ил, н-гекс-1-ин-5-ил, н-гекс-1-ин-6-ил, н-гекс-2-ин-1-ил, н-гекс-2-ин 4-ил, н-гекс-2-ин-5-ил, н-гекс-2-ин-6-ил, н-гекс-3-ин-1-ил, н-гекс-3-ин-2-ил, 3-метилпент-1-ин-1-ил, 3 метилпент-1-ин-3-ил, 3-метилпент-1-ин-4-ил, 3-метилпент-1-ин-5-ил, 4-метилпент-1-ин-1-ил, 4-метилпент-2-ин-4-ил или 4-метилпент-2-ин-5-ил, предпочтительно С 3- или С 4 алкинил, в частности проп-2-ин 3-ил; фенил-С 1-С 6 алкил: например, бензил, 1-фенилэт-1-ил, 2-фенилэт-1-ил, 1-фенилпроп-1-ил, 2 фенилпроп-1-ил, 3-фенилпроп-1-ил, 1-фенилпроп-2-ил, 2-фенилпроп-2-ил, 1-фенилбут-1-ил, 2-фенилбут 1-ил, 3-фенилбут-1-ил, 4-фенилбут-1-ил, 1-фенилбут-2-ил, 2-фенилбут-2-ил, 1-фенилбут-3-ил, 2 фенилбут-3-ил, 1-фенил-2-метилпроп-3-ил, 2-фенил-2-метилпроп-3-ил, 3-фенил-2-метилпроп-3-ил или 2 бензилпроп-2-ил, предпочтительно фенил-С 1-С 4 алкил, в частности 2-фенилэт-1-ил; С 1-С 6 алкокси и алкоксиостатки С 1-С 6 алкокси-С 1-С 6 алкила: метокси, этокси, н-пропокси, 1 метилэтокси, н-бутокси, 1-метилпропокси, 2-метилпропокси, 1,1-диметилэтокси, н-пентокси, 1 метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2 диметилпропокси, 1-этилпропокси, н-гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4 метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3 диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2 триметилпропокси, 1-этил-1-метилпропокси или 1-этил-2-метилпропокси, предпочтительно С 1-С 6 алкокси, в частности ОСН 3, ОС 2 Н 5 или ОСН(СН 3)2; С 3-С 7 циклоалкил: циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; С 5-С 7 циклоалкенил: циклопент-1-енил, циклопент-2-енил, циклопент-3-енил, циклогекс-1-енил,циклогекс-2-енил, циклогекс-3-енил, циклогепт-1-енил, циклогепт-2-енил, циклогепт-3-енил, циклогепт 4-енил, циклоокт-1-енил, циклоокт-2-енил, циклоокт-3-енил или циклоокт-4-енил. 3-7-Членный гетероцикл представляет собой насыщенный, частично или полностью ненасыщенный или ароматический гетероцикл, включающий от одного до трех гетероатомов, выбранных из ряда, включающего от одного до трех атомов азота, один или два атома кислорода и один или два атома серы. Что касается применения соединений формулы I в качестве гербицидов и/или соединений, обладающих десикантным/дефолиантным действием, то различные переменные имеют следующие предпочтительные значения, которые в каждом случае должны быть конкретизированы индивидуально или в сочетании: Х 1 обозначает атом водорода или галогена, в частности водорода или хлора;X2 обозначает цианогруппу или атом галогена, в частности цианогруппу или атом хлора;Q обозначает Q5, Q7, Q21, Q22, Q27, Q32, Q38, Q39 или Q40; А 1 обозначает атом кислорода; А 3 и А 4, каждый независимо друг от друга, обозначает атом кислорода; А 8 и А 9, каждый независимо друг от друга, обозначает атом кислорода; А 10 и А 11, каждый независимо друг от друга, обозначает атом кислорода; А 12 обозначает атом серы; А 13 обозначает атом кислорода; А 15 обозначает атом серы;R7 и R8 совместно с атомами, с которыми они связаны, могут образовывать 4-7-членное кольцо, необязательно прерываемое атомом кислорода, серы или азота;R9 и R10, каждый независимо друг от друга, обозначает водородный атом, С 1-С 6 алкил, С 1-С 6 алкокси или совместно с атомами, с которыми они связаны, образуют 5- или 6-членное кольцо;R34 обозначает водородный атом или С 1-С 6 алкил;R46 и R47, каждый независимо друг от друга, обозначает С 1-С 6 галоалкил или совместно с атомами азота, с которыми они связаны, образуют 5- или 6-членное кольцо, необязательно прерываемое одним кислородным или серным кольцевым членом. Особенно предпочтительны соединения формулы Ia (AI,где Другими особенно предпочтительными являются те соединения I, которые отвечают формулам с Ibno Iz, I, I, I, I и I, в частности соединения с Ib.1 no Ib.443, которые отличаются от соответствующих соединений с Ia.1 no Ia.443 только тем, что R29 обозначает аминогруппу соединения с Iс.1 по Iс.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 только тем, что X1 обозначает водородный атом соединения с Id.1 no Id.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 только тем, что X1 обозначает водородный атом, a R29 обозначает аминогруппу соединения с Ie.1 no Ie.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем, что соединения с If.1 no If.443, которые отличаются от соответствующих соединений с Iа.1 по Ia.443 тем, что соединения с Ig.1 no Ig.443, которые отличаются от соответствующих соединений с Iа.1 по Ia.443 тем,что Q обозначает Q5, А 1 обозначает атом кислорода, а R7+R8 обозначают тетраметилен соединения с Ih.1 no Ih.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что X1 обозначает атом хлора, Q обозначает Q5, А 1 обозначает атом кислорода, а R7+R8 обозначают тетраметилен соединения с Ij.1 no Ij.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем, чтоQ обозначает Q22, А 10 и А 11 каждый обозначает атом кислорода, А 12 обозначает атом серы, а R32 и R33 каждый обозначает метил соединения с Ik.1 no Ik.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q22, A10, A11 и А 12 каждый обозначает атом кислорода, a R32 и R33 каждый обозначает метил соединения с Im.1 no Im.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q27, А 13 обозначает атом кислорода, R34 и R36 каждый обозначает водородный атом, а соединения с In.1 no In.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q27, А 13 обозначает атом кислорода, R34 обозначает водородный атом, R35 обозначает трифторметил, а R36 обозначает метил: соединения с Io.1 no Io.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q27, А 13 обозначает атом кислорода, R34 обозначает водородный атом, R35 обозначает соединения с Iр.1 по Iр.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q32, R37 обозначает атом хлора, R38 обозначает дифторметокси, а R39 обозначает метил соединения с Iq.1 no Iq.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q32, R37 обозначает атом брома, R38 обозначает дифторметокси, а R39 обозначает метил соединения с Ir.1 по Ir.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем, что соединения с Is.1 no Is.443, которые отличаются от соответствующих соединений с Iа.1 по Ia.443 тем, что соединения с It.1 no It.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем, что соединения с Iu.1 no Iu.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что X1 обозначает атом хлора, Q обозначает Q32, R37 обозначает атом брома, R38 обозначает трифторметил, а R39 обозначает метил соединения с Iv.1 no Iv.443, которые отличаются от соответствующих соединений с Iа.1 по Ia.443 тем,что Q обозначает Q32, R37 обозначает атом хлора, R38 обозначает SО 2-СН 3, а R39 обозначает метил соединения с Iw.1 no Iw.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q32, R37 обозначает атом брома, R38 обозначает SO2-СН 3, а R39 обозначает метил соединения с Ix.1 no Ix.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что X1 обозначает атом хлора, Q обозначает Q32, R37 обозначает атом брома, R38 обозначает SО 2-СН 3, а соединения с Iy.1 no Iy.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q38, R40 обозначает атом хлора, R41 и R43 каждый обозначает водородный атом, а R42 обозначает трифторметил соединения с Iz.1 no Iz.443, которые отличаются от соответствующих соединений с Iа.1 по Ia.443 тем, что соединения с I.1 no I.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q40, А 16 и А 17 каждый обозначает атом кислорода, а R46+R47 образуют цепь-СН 2 СН 2-О-СН 2 соединения с I.1 по I.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q40, А 16 обозначает атом серы, А 17 обозначает атом кислорода, a R46+R47 образуют цепь-СН 2 СН 2-О-СН 2 соединения с I.1 no I.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q40, А 16 и А 17 каждый обозначает атом серы, a R46+R47 образуют цепь -CH2CH2-O-CH2 соединения с I.1 по I.443, которые отличаются от соответствующих соединений с Iа.1 по Ia.443 тем,что Q обозначает Q40, А 16 обозначает атом кислорода, А 17 обозначает атом серы, а R46+R47 образуют цепь соединения с I.1 по I.443, которые отличаются от соответствующих соединений с Ia.1 по Ia.443 тем,что Q обозначает Q7, А 3 и А 4 каждый обозначает атом кислорода, а R9+R10 образуют тетраметиленовую цепь Предлагаемые в соответствии с изобретением урацилзамещенные фенилсульфамоилкарбоксамиды I могут быть получены различными путями, доступными и известными специалистам в данной области техники, предпочтительно по одному из способов, описанных ниже. А) Реакция производного бензойной кислоты II с сульфамидом III необязательно в присутствии агента сочетания, такого как N,N-карбонилдиимидазол (КДИ), или после превращения производного II в соответствующий хлорангидрид кислоты:N,N-карбонилдиимидазол (КДИ) вводят в раствор производного карбоновой кислоты формулы II в инертном растворителе, таком как тетрагидрофуран. Образовавшуюся смесь перемешивают при кипячении с обратным холодильником в течение периода времени достаточного для завершения реакции, а затем охлаждают до комнатной температуры. Добавляют необязательно замещенного сульфамида III, а затем диазабициклоундекана (ДБУ) и смесь перемешивают до завершения реакции. В результате осуществления стандартных обработок и методов выделения в очищенном виде получают продукт. Производные бензойной кислоты II (и соответствующие карбоксилаты, которые можно омылять простым путем с получением свободных кислот II) известны из литературы или могут быть получены аналогично методам, которые известны из литературы. Методы омыления эфиров до производных бензойной кислоты II специалисту в данной области техники достаточно хорошо известны, вследствие чего необходимость в подробностях отсутствует. В качестве примеров можно сослаться на работы Kocienski "Protecting Groups", Thieme Verlag 1994, Greene,Wuts "Protecting groups in Organic Synthesis", Wiley 1999, и Houben-Weyl, Methoden der OrganischenChemie, том E5, часть I (1985), cc. 223 и след. В дополнение к активации до имидазолонов приемлемы также другие методы. Для активации кислот приемлемы различные методы. Так, например, их можно превращать в хлорангидриды обработкой SOCl2, РОСl3, РСl5, СОСl2 или (СОСl)2. По другому варианту имидазол можно получать реакцией с N,N-карбонилдиимидазолом. Применяемые методы специалисту в данной области техники достаточно хорошо известны, например, из труда Houben-Weyl, Methoden der OrganischenChemie, том E5, (1985) часть I, cc. 587 и след. и том Е 5, (1985) часть II, сс. 934 и след. Способы получения производных бензойной кислоты II, где Q имеет значения, отличные от значений Q21, включают те способы, которые представлены в US 5872253 и US 5484763 и в совместной рассматриваемой заявке серийный номер 09/368340, поданной 4 августа 1999 г., которые включены в настоящее описание в качестве ссылок. Предшественники, необходимые для синтеза соединения I, у которых Q обозначает Q21, такие как 2 хлор-5-[3,6-дигидро-3-метил-2,6-диоксо-4-(трифторметил)-1(2 Н)-пиримидинил]-4-фторбензойная кислота (CAS120890-57-5), описаны, например, в ЕР-А 195346, WO 89/02891, WO 98/08151 и в упомянутой в них литературе или могут быть получены так, как в них изложено. Что касается сложных эфиров II, где Q обозначает Q5, А 1 обозначает атом кислорода, R7 обозначает дифторметил, R8 обозначает метил, X1 обозначает атом фтора или хлора, а X2 обозначает атом хлора, то следует обратиться к US 5035740 и GB-A-2253625, а в отношении соединений II, где Q обозначает Q5 и где R7 и R8 совместно с атомами, с которыми они связаны, образуют 6-членное кольцо, в частности метилового эфира 2-хлор-4-фтор-5-(5,6,7,8-тетрагидро-3-оксо-1,2,4-триазол[4,3-а]пиридин-2(3 Н)-ил) бензойной кислоты (CAS104799-37-3), можно сослаться на JP-A-61/069776. Такие соединения упомянуты также в WO 94/22860. Производные бензойной кислоты II, где Q обозначает Q21, А 10 и А 11 каждый обозначает атом кислорода. А 12 обозначает атом кислорода или серы, R32 и R33 каждый обозначает аминогруппу или алкил, X1-19 005677 обозначает атом фтора, а X2 обозначает атом хлора, известны из ЕР-А-584655 и WO 00/50409, например 2-хлор-5-(3,5-диметил-2,6-диоксо-4-тиоксо-1,3,5-триазинан-1-ил)-4-фторбензойная кислота (CAS289882-59-3) и метиловый эфир 2-хлор-5-(3,5-диметил-2,4,6-триоксо-1,3,5-триазинан-1-ил)-4-фторбензойной кислоты (САS154883-47-3). Производные бензойной кислоты II и ее эфиры, где Q обозначает Q27, известны из WO 97/07104,WO 96/39392, WO 99/14201 и WO 99/52878, например 2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон 2-ил)бензойная кислота (R34 обозначает водородный атом, R35 обозначает трифторметил, R36 обозначает водородный атом, X1 обозначает атом фтора, а X2 обозначает атом хлора) и 2-хлор-4-фтор-5-(4 трифторметил-5-трифторметил-3-пиридазинон-2-ил)бензойная кислота (CAS259141-58-7; R34 обозначает водородный атом, R35 обозначает трифторметил, R36 обозначает метил, X1 обозначает атом фтора, аX2 обозначает атом хлора). Производные бензойной кислоты II, где Q обозначает Q32, известны из ЕР-А-361114, WO 92/06962,WO 96/02515, US 6096689 и WO 98/38169, например 4-хлор-3-(4-хлор-2-фтор-5-карбоксифенил)-5 дифторметокси-1-метил-1H-пиразол (CAS129631-53-4; Q обозначает Q32, R37 обозначает атом хлора,R38 обозначает дифторметокси, R39 обозначает метил, X1 обозначает атом фтора, а X2 обозначает атом хлора), 4-хлор-3-(4-хлор-2-фтор-5-карбоксифенил)-5-трифторметил-1-метил-1H-пиразол (CAS142622-56-8; Q обозначает Q32, R37 обозначает атом хлора, R38 обозначает дифторметокси, R39 обозначает метил, X1 обозначает атом фтора, а X2 обозначает атом хлора), или могут быть получены аналогично тому, как в них изложено. Производные бензойной кислоты II, где Q обозначает Q33, известны из WO 95/02580, US 5783522 и(CAS188782-31-2), или могут быть получены аналогично тому, как в них изложено. Производные бензойной кислоты II, где Q обозначает Q39, известны из WO 99/59983 и DE-A19835943 или могут быть получены аналогично тому, как в них изложено. Производные бензойной кислоты II, где Q обозначает Q40, известны из WO 94/10173 и WO 00/01700 или могут быть получены аналогично тому, как в них изложено. Производные бензойной кислоты II, где Q обозначает Q5, могут быть получены в соответствии с US 5035740 следующим образом: Гидразины IV известны, например, из WO 97/07104 (X1 обозначает атом фтора) или могут быть получены по известному методу.-20 005677 Сульфамиды формулы III могут быть получены в соответствии с методами, которые известны, например, аналогично методу, изложенному в работах Hamprecht и др., опубликованной в Angew. Chemie 93, 151 (1981), и Houben-Weyl, Methoden der Organischen Chemie, том E11 (1985), cc. 1019 и след. Так, например, сульфамиды формулы III, где X3 обозначает водородный атом, могут быть получены реакцией S-хлорсульфонамида с амином HNR1R2 Сульфамиды формулы III, где X3 не обозначает водородный атом, могут быть получены реакцией сульфурилхлорида с амином HNR1R2 с получением сульфамоилхлоридного соединения Cl-SO2-NR1R2 и реакцией этого сульфамоилхлоридного соединения с амином X3-NH2: Б) Замещение галогенида радикалом QHal обозначает атом галогена, предпочтительно фтора, хлора или брома. Таким путем анилин формулы IV превращают в диазониевую соль, затем обрабатывают иодом и иодидом калия с получением соединения иода формулы V. В результате реакции соединений формулы V с ненасыщенным остатком QH, например с урацилом формулы Q21H в присутствии катализатора на основе меди(I), получают конечный продукт формулы Iа. Таким путем предлагаемые в соответствии с изобретением соединения I, где Q обозначает Q21, могут быть получены аналогично методу, описанному T.Maruyama, K. Fujiwara и M. Fukuhara в J. Chem. Soc., Perkin Trans. 1995 (7), cc. 733-734, где Hal обозначает атом иода, причем реакцию проводят с добавлением источника Cu(I). Однако в случае соответствующего выбора заместителей Hal, X1 и X2 приемлемы также методы, осуществляемые без применения переходных металлов. В этом отношении в качестве примера можно сослаться на заявку WO 96/39392, в которой описаны способы, приемлемые для получения соединений I, где Q обозначает Q27. Галоарильные предшественники V могут быть получены реакцией Зандмейера из соответствующих анилинов (см. также схему с соединением формулы V). Специалисту в данной области техники эти методы известны достаточно хорошо, вследствие чего в настоящем описании можно сослаться только на работу Houben-Weyl, Methoden der Org.Chemie, том 5/4, издание 4-е, 1960, cc. 438 и след. В) Реакция анилинового промежуточного продукта VI с оксазиноновым соединением формулы VII с получением соединения I, где А обозначает атом кислорода, X3 обозначает водородный атом, Q обозначает Q21, А 8 и А 9 каждый обозначает атом кислорода, a R29 обозначает водородный атом и необязательные последующие алкилирование и гидролиз:R29-Hal обозначает C1-С 6 алкил, C1-С 6 галоалкил, С 3-С 7 циклоалкил, С 2-С 6 алкенил, С 2-С 6 галоалкенил или С 3-С 6 алкинилгалогенид. Среди известных методов получения оксазиноновых соединений VII имеются те, которые описаны в WO 99/14216.-21 005677 Анилиновые производные формулы IV могут быть получены по обычным способам, таким как превращение соответствующим образом замещенной бензойной кислоты IX в соответствующий сульфамоилкарбоксамид Х (см. вышеприведенный способ А), который, в свою очередь, далее нитруют и восстанавливают Приемлемыми нитрующими реагентами являются, например, азотная кислота в разных концентрациях, включая концентрированную и дымящую азотную кислоту, смеси серной и азотной кислот, а также ацетилнитраты и алкилнитраты. Реакцию можно проводить либо без растворителя, в избытке нитрующего реагента, либо в инертном растворителе или разбавителе, причем подходящими материалами являются, например, вода, минеральные кислоты, органические кислоты, галоуглеводороды, такие как метиленхлорид, ангидриды, такие как уксусный ангидрид, и их смеси. Сульфамоилкарбоксамид Х и нитрующий реагент целесообразно использовать в приблизительно эквимолярных количествах; принимая во внимание выход продукта в пересчете на X, может оказаться целесообразным применять нитрующий реагент в избытке, достигающем 10-кратного количества от молярного в пересчете на количество X. Когда реакцию проводят без растворителя, в нитрующем реагенте,этот последний используют в еще большем избытке. Реакционная температура обычно составляет от -100 до 200 С, предпочтительно от -30 до 50 С. В дальнейшем нитрованные соединения XI можно восстанавливать до производных анилина VI. Восстановление обычно осуществляют проведением реакции нитросоединения с переходным металлом, таким как железо, цинк и олово, в кислых условиях или с комплексным гидридом, таким как алюмогидрид лития и боргидрид натрия, причем восстановление осуществляют в массе, растворителе или разбавителе. Примерами подходящих растворителей служат (в зависимости от выбранного восстановителя) вода,спирты, такие как метанол, этанол и изопропанол, и простые эфиры, такие как диэтиловый эфир, метилтрет-бутиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир. Если для восстановительных целей используют металл, процесс предпочтительнее проводить без растворителя, в неорганической кислоте, преимущественно в концентрированной или разбавленной соляной кислоте, или в жидкой органической кислоте, такой как уксусная кислота и пропионовая кислота. Однако кислоту можно разбавлять инертным растворителем, например одним из вышеупомянутых. В предпочтительном варианте восстановление комплексным гидридом проводят в растворителе, например в простом эфире или спирте. Нитрованное соединение XI и восстановитель часто используют в приблизительно эквимолярных количествах. Однако с целью оптимизировать протекание реакции может оказаться целесообразным применение избытка любого компонента, достигающем примерно 10-кратного молярного количества. Количество кислоты решающего значения не имеет, вследствие чего для восстановления исходного соединения настолько полно, насколько это возможно, целесообразно использовать, по меньшей мере,эквивалентное количество кислоты. Часто применяют избыток кислоты в пересчете на нитрованное соединение XI. Реакционная температура обычно составляет от -30 до 200 С, предпочтительно от 0 до 80 С. Для проведения процесса реакционную смесь, как правило, разбавляют водой, а продукт выделяют фильтрованием, кристаллизацией или экстракцией растворителем, который практически не смешивается с водой, например этилацетатом, диэтиловым эфиром или метиленхлоридом. При необходимости продукт VI можно очищать обычным путем. Нитрогруппу соединений XI можно также подвергать каталитической гидрогенизации водородом. Примерами приемлемых для этой цели катализаторов служат никель Ренея, палладий на угле, оксид палладия, платина и оксид платины. Обычно достаточное количество в пересчете на восстанавливаемое соединение XI составляет от 0,05 до 50 мол.%. Этой цели можно достичь с помощью растворителя или использовать инертный растворитель или разбавитель, например уксусную кислоту, смесь уксусной кислоты с водой, этилацетат, этанол или толу-22 005677 ол. После выделения катализатора реакционный раствор можно обрабатывать как обычно с получением продукта VI. Гидрогенизацию можно проводить под атмосферным или повышенным давлением водорода. Другие методы и реакционные условия приведены в литературе [см., например, работу HoubenWeyl, Methoden der Organischen Chemie, nitrogen compounds I, часть 1 (1971), том Х/1, сс. 463 и след.]. Из производных анилина VI могут быть получены не только предлагаемые в соответствии с изобретением соединения I, где Q обозначает О 21, но также соединения I, где Q обозначает Q7, Q22 или Q40. Для получения соединений I, где Q обозначает Q22, можно применять способы, описанные в WO 00/50409 и ЕР-А-584655, а для получения соединений I, где Q обозначает Q40, можно применять способы, описанные в WO 94/10173 и WO 00/01700. Однако производные анилина VI могут быть также превращены обычным путем (см., например,WO 97/07104 и работу Houben-Weyl, Methoden der Organischen Chemie, том E1, nitrogen compounds] в соответствующие гидразины, из которых можно получать соединения I, где Q обозначает Q5 или Q27. Другие способы получения предлагаемых в соответствии с изобретением соединений I приведены в работе BOger, Wakabayashi Peroxidizing herbicides, Springer Verlag 1999. Г) Реакция производного бензойной кислоты VIII с электрофильным реагентом аминирования в присутствии основания с получением соответствующего эфира N-аминоурацилбензойной кислоты, гидролиз этого эфира с получением бензойной кислоты II (где Q обозначает Q21, А 8 и А 9 каждый обозначает О, a R29 обозначает NH2) и превращение этого последнего в соединения I (где А обозначает О, Q обозначает Q21, А 8 и А 9 каждый обозначает О, R29 обозначает NH2) вышеописанным путем Примерами реагентов аминирования являются, в частности, 2,4-динитрофенилгидроксиламин и гидроксиламин O-мезитиленсульфонила. Примеры подходящих реакционных условий приведены в DEA-19652431. Во всех случаях вышеописанные способы целесообразно осуществлять под атмосферным давлением или под давлением, самопроизвольно создающимся над соответствующей реакционной смесью. Обработку реакционных смесей проводят, как правило, по методам, которые известны, например удалением растворителя, разделением остатка в смеси воды и приемлемого органического растворителя и обработкой органической фазы с получением продукта. Предлагаемые в соответствии с изобретением урацилзамещенные фенилсульфамоилкарбоксамиды I могут быть получены в виде смесей изомеров, которые, если необходимо, можно разделять на чистые изомеры по методам, которые обычно применяют для достижения этой цели, например путем кристаллизации или хроматографического разделения на оптически активные адсорбаты. Чистые оптически активные изомеры можно также получать, например, из соответствующих оптически активных исходных материалов. Соединения с кислотными заместителями С-Н можно превращать в их соли щелочных металлов известным путем реакцией с основанием, включающим соответствующий катион. Соли соединений I, металлические ионы которых не являются ионами щелочных металлов, обычно можно получать двойным разложением соответствующей соли щелочного металла в водном растворе. Из солей натрия по обычному методу можно получать соли других металлов, такие, как соли марганца, меди, цинка, железа, кальция, магния и бария, а также аммониевые и фосфониевые соли, используя гидроксиды аммония, фосфония, сульфония и сульфоксония. Соединения I и их агрономически эффективные соли приемлемы для применения в качестве гербицидов как в виде изомерных смесей, так и в виде чистых изомеров. Гербицидные композиции, содержащие соединения I, дают возможность получать очень хороший результат в борьбе с растительностью на-23 005677 площадях, на которых не возделывают культурные растения, в особенности при высоких нормах расхода. В посевах таких культур, как пшеница, рис, кукуруза, соя и хлопчатник, они эффективны против широколиственных сорняков и травянистых сорняков, практически не нанося вреда культурным растениям. Этого эффекта достигают прежде всего при низких нормах расхода. В зависимости от конкретного метода обработки соединения I или содержащие эти соединения гербицидные композиции можно, кроме того, применять для уничтожения нежелательной растительности в приведенном ниже ряде культурных растений. Так, например, для этой цели приемлемы следующие культуры: Allium сера, Ananas comosus, Arachis hypogaea, Asparagus officinalis, Beta vulgaris spp. altissima,Beta vulgaris spec. rapa, Brassica napus var. napus, Brassica napus var. napobrassica, Brassica rapa var. silvestris, Camellia sinensis, Carthamus tinctorius, Carya illinoinensis, Citrus limon, Citrus sinensis, Coffea arabicavinifera и Zea mays. Кроме того, соединения I можно также применять в культурах, которые благодаря селекции, включая методы генной инженерии, приобрели полную или частичную устойчивость к действию гербицидов. Более того, замещенные производные гидроксамовой кислоты I приемлемы также для десикации и/или дефолиации растений. В качестве десикантов они особенно эффективны для подсушивания надземных частей таких культурных растений, как картофель, рапс, подсолнечник и соя. Тем самым обеспечивается возможность полностью механизированной уборки урожая этих важных культур. Интерес с экономической точки зрения представляет также упрощение сбора урожая, что становится возможным благодаря сконцентрированному в определенный промежуток времени раскрытию или уменьшению прочности сцепления плодов с деревом в случае цитрусовых, маслин или других видов и сортов семечковых и косточковых плодов и орехов. Тот же механизм, т.е. создание благоприятных условий для образования разделительной ткани между плодами или листьями и побегами растения, играет важную роль также для легко регулируемой дефолиации культурных растений, в частности хлопчатника. Кроме того, сокращение времени созревания отдельных растений хлопчатника обеспечивает повышение качества волокон после уборки. Соединения I или их содержащие композиции можно применять путем опрыскивания, атомизации,опыливания, разбрасывания или полива в виде, например, предназначенных для прямого опрыскивания водных растворов, порошков, суспензий, в том числе высококонцентрированных водных, масляных или других суспензий или дисперсий, эмульсий, масляных дисперсий, паст, препаратов для опыливания,препаратов для разбрасывания или гранулятов. Формы применения зависят от намечаемых целей; во всех случаях при этом должно быть гарантировано максимально тонкое диспергирование предлагаемых в соответствии с изобретением действующих веществ. Приемлемыми являются, по существу, следующие инертные добавки: фракции перегонки нефти с температурами кипения от средних до высоких, такие, как керосин и дизельное топливо, а также каменноугольные масла и масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например парафины, тетрагидронафталин, алкилированные нафталины и их производные, алкилированные бензолы и их производные, спирты, такие как метанол, этанол, пропанол, бутанол и циклогексанол, кетоны, такие как циклогексанон, высокополярные растворители, например амины, такие как N-метилпирролидон, и вода. Водные препаративные формы можно готовить из эмульсионных концентратов, суспензий, паст,смачивающихся порошков или диспергируемых в воде гранулятов добавлением воды. Для приготовления эмульсий, паст или масляных дисперсий замещенные производные гидроксамовой кислоты как таковые или после их растворения в масле или растворителе с помощью смачивающего вещества, вещества для повышения клейкости, диспергатора или эмульгатора можно гомогенизировать в воде. Однако можно также готовить концентраты, пригодные для разбавления водой, включающие действующее вещество,смачивающее вещество, вещество для повышения клейкости, диспергатор или эмульгатор и, если целесообразно, растворитель или приемлемыми поверхностно-активными веществами являются соли щелочных металлов, щелочно-земельных металлов и аммониевые соли ароматических сульфокислот, например, лигно-, нафталин- и дибутилнафталинсульфоновой кислот, а также жирных кислот, алкил- и алкиларилсульфонаты, алкилсульфаты, сульфаты лаурилового эфира и сульфаты жирных спиртов и соли сульфированных гекса-, гепта- и октадеканолов, а также гликолевых эфиров жирных спиртов, продукты конденсации сульфированного нафталина и его производных с формальдегидом, продукты конденсации нафталина или нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфениловый-24 005677 эфир, оксиэтилированный изооктил-, октил- и нонилфенол, полигликолевые эфиры алкилфенила и трибутилфенила, алкилариловые неполные эфиры многоатомных спиртов, изотридециловый спирт, продукты конденсации жирных спиртов и этиленоксида, оксиэтилированное касторовое масло, полиоксиэтиленалкиловые эфиры и полиоксипропиленалкиловые эфиры, ацетат эфира лаурилового спирта и полигликоля, сложные эфиры сорбита, отработанный лигнинсульфитный щелок и метилцеллюлоза. Порошковые препараты, препараты для разбрасывания и опыливания можно готовить путем смешения или совместного измельчения действующих веществ с твердым носителем. Грануляты, например грануляты в оболочке, импрегнированные грануляты и гомогенные грануляты могут быть приготовлены за счет связывания действующих веществ с твердыми носителями. В качестве твердых носителей могут служить минеральные земли, в частности кремниевые кислоты, силикагели, силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля,сульфат кальция, сульфат магния, оксид магния, измельченные синтетические материалы, удобрения,такие как сульфат аммония, фосфат аммония и нитрат аммония, производные мочевины и продукты растительного происхождения, такие как мука зерновых, мука из коры деревьев, древесная мука и мука из ореховой скорлупы, целлюлозные порошки и другие твердые носители. Концентрацию действующих веществ I в готовых для применения препаратах можно варьировать в широких интервалах. Как правило, композиции содержат по меньшей мере одно действующее вещество в количестве приблизительно от 0,001 до 98 мас.%, предпочтительно от 0,01 до 95 мас.%. Степень чистоты применяемых действующих веществ обычно составляет от 90 до 100%, предпочтительно от 95 до 100% (в соответствии с данными ЯМР-спектрографии). Приготовление таких препаратов проиллюстрировано в следующих примерах композиций.I. 20 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I растворяют в смеси, включающей 80 маc.ч. алкилированного бензола, 10 маc.ч. продукта присоединения от 8 до 10 моль этиленоксида к 1 моль N-моноэтаноламида олеиновой кислоты, 5 маc.ч. додецилбензолсульфоната кальция и 5 маc.ч. продукта присоединения 40 моль этиленоксида к 1 моль касторового масла. Выливанием раствора в 100000 маc.ч. воды и ее тонким диспергированием получают водную дисперсию, которая содержит 0,02 мас.% действующего вещества.II. 20 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I растворяют в смеси, включающей 40 маc.ч. циклогексанона, 30 маc.ч. изобутанола, 20 маc.ч. продукта присоединения 7 моль этиленоксида к 1 моль изооктилфенола и 10 маc.ч. продукта присоединения 40 моль этиленоксида к 1 моль касторового масла. Выливанием раствора в 100000 маc.ч. воды и тонким ее диспергированием получают водную дисперсию, которая содержит 0,02 мас.% действующего вещества.III. 20 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I растворяют в смеси, включающей 25 маc.ч. циклогексанона, 65 маc.ч. фракции перегонки нефти с температурой кипения от 210 до 280 С и 10 маc.ч. продукта присоединения 40 моль этиленоксида к 1 моль касторового масла. Выливанием раствора в 100000 маc.ч. воды и ее тонким диспергированием получают водную дисперсию, которая содержит 0,02 мас.% действующего вещества.IV. 20 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I смешивают с 3 маc.ч. диизобутилнафталинсульфоната натрия, 17 маc.ч. натриевой соли лигносульфоновой кислоты из отработанного сульфитного щелока и 60 маc.ч. порошкообразного силикагеля и смесь измельчают в молотковой дробилке. Путем тонкого диспергирования смеси в 20000 маc.ч. воды получают смесь для опрыскивания,которая содержит 0,1 мас.% действующего вещества.V. 3 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I смешивают с 97 маc.ч. тонкодисперсного каолина. Таким путем получают препарат для опыливания, содержащий 3 мас.% действующего вещества.VI. 20 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I гомогенно смешивают с 2 маc.ч. додецилбензолсульфоната кальция, 8 маc.ч. полигликолевого эфира жирного спирта, 2 маc.ч. натриевой соли феноло-мочевино-формальдегидного продукта конденсации и 68 маc.ч. парафинового минерального масла. Получают стабильную масляную дисперсию.VII. 1 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I растворяют в смеси, включающей 70 маc.ч. циклогексанона, 20 маc.ч. оксиэтилированного изооктилфенола и 10 маc.ч. оксиэтилированного касторового масла. Получают стабильный эмульсионный концентрат.VIII. 1 маc.ч. урацилзамещенного фенилсульфамоилкарбоксамида I растворяют в смеси, включающей 80 маc.ч. циклогексанона и 20 маc. ч. Продукта Wettol ЕМ 31 (неионогенный эмульгатор на основе оксиэтилированного касторового масла, фирма BASF AG). В результате получают стабильный эмульсионный концентрат. Действующие вещества I и их содержащие гербицидные композиции можно применять в процессах пред- и послевсходовой обработки. Если некоторые культурные растения обладают пониженной толерантностью к действующим веществам, можно применять такую технику обработки, в которой гербицидные композиции распыляют с помощью распылительного оборудования так, чтобы они входили в минимально возможный контакт, если это происходит, с листьями чувствительных культурных расте-25 005677 ний, но попадали на листья растущих под ними нежелательных растений или на открытые участки почвы(метод направленного опрыскивания, метод ленточного опрыскивания). Нормы расхода действующего вещества в зависимости от намеченных мероприятий по подавлению нежелательной растительности, времени года, обрабатываемых растений и стадии роста составляют от 0,001 до 3,0, предпочтительно от 0,01 до 1 кг/га действующего вещества (ДВ). Для расширения спектра действия и достижения синергического эффекта производные замещенной гидроксамовой кислоты I можно смешивать и использовать совместно с многочисленными представителями других групп действующих гербицидных или регулирующих рост растений веществ. Так, например, приемлемыми компонентами смесей являются 1,2,4-тиадиазолы, 1,3,4-тиадиазолы, амиды, аминофосфорная кислота и ее производные, аминотриазолы, анилиды, (гет)арилоксиалкановые кислоты и их производные, бензойная кислота и ее производные, бензотиадиазиноны, 2-ароил-1,3-циклогександионы,гетариларилкетоны, бензилизоксазолидиноны, мета-СF3 фенилпроизводные, карбаматы, хинолинкарбоновая кислота и ее производные, хлорацетанилиды, производные циклогексан-1,3-диона, диазины, дихлорпропионовая кислота и ее производные, дигидробензофураны, дигидрофуран-3-оны, динитроанилины, динитрофенолы, дифениловые эфиры, дипиридилы, галокарбоновые кислоты и их производные,производные мочевины, 3-фенилурацилы, имидазолы, имидазолиноны, N-фенил-3,4,5,6-тетрагидрофталимиды, оксадиазолы, оксираны, фенолы, эфиры арилокси- и гетарилоксифеноксипропионовой кислот, фенилуксусная кислота и ее производные, фенилпропионовая кислота и ее производные, пиразолы,фенилпиразолы, пиридазины, пиридинкарбоновая кислота и ее производные, пиримидиловые эфиры,сульфонамиды, сульфонилмочевины, триазины, триазиноны, триазолиноны, триазолкарбоксамиды и урацилы. Более того, может оказаться целесообразным применение соединений формулы I индивидуально или в виде их сочетаний с другими гербицидами, в форме смеси с дополнительными другими средствами защиты растений, например с пестицидами или другими средствами борьбы против фитопатогенных грибов или бактерий. Интерес также представляет возможность смешения с растворами минеральных солей, предназначенных для компенсации недостатка питательных веществ и микроэлементов. Можно также добавлять нефитотоксичные масла и масляные концентраты. Примеры получения С целью еще больше упростить понимание сущности изобретения представлены следующие примеры, задача которых состоит в иллюстрации его более конкретных подробностей. Аббревиатурами ЯМР обозначен ядерно-магнитный резонанс, ВЭЖХ обозначена высокоэффективная жидкостная хроматография, ТЛХ обозначена тонкослойная жидкостная хроматография, ГЖХ обозначена газожидкостная хроматография, а ИК обозначена инфракрасная спектроскопия. Пример 1. Получение 2-хлор-4-фтор-5-нитробензойной кислоты. Раствор 24,4 г (0,142 моль) 2-хлор-4-фторбензойной кислоты в 150 мл концентрированной серной кислоты при 0 С обрабатывали добавлением по каплям при 10 С в течение 10-минутного периода 13,2 мл (20 мол.%, 0,284 моль) 90%-ной азотной кислоты, перемешивали в течение 2,5 ч при температуре от 0 до 10 С и выливали в один литр льда. Белое твердое вещество отфильтровывали. Фильтровальный пирог сушили на воздухе и перекристаллизовывали из этилацетата/гептана с получением указанного в заглавии соединения в виде не совсем белых игольчатых кристаллов. Вход: 18,0 г (58,1%); идентифицировали ЯМР-спектральным анализом. Пример 2. Получение 2-хлор-4-фтор-5-аминобензойной кислоты. Раствор 18,0 г (0,0824 моль) 2-хлор-4-фтор-5-нитробензойной кислоты в 75 мл уксусной кислоты кипятили с обратным холодильником. Несколькими порциями добавляли 18,4 г (0,328 моль) порошкообразного железа, образовавшуюся суспензию охлаждали до комнатной температуры и разбавляли водой и этилацетатом. Смесь фильтровали и фильтрат сохраняли. Органический слой промывали рассолом, сушили над безводным сульфатом магния и концентрировали под пониженным давлением с получением указанного в заглавии соединения в виде желтовато-коричневого твердого вещества. Выход: 9,00 г Смесь 8,30 г (0,04308 моль) 2-хлор-4-фтор-5-аминобензойной кислоты, 9,57 г (0,0460 моль) 2 диметиламино-4-(трифторметил)-6 Н-1,3-оксазин-6-она и уксусной кислоты в течение 3 ч перемешивали при температуре кипения с обратным холодильником, разбавляли водой со льдом и дважды экстрагировали этилацетатом. Объединенные органические слои промывали рассолом, сушили над безводным сульфатом магния и концентрировали под пониженным давлением с получением указанного в заглавии соединения в виде желтовато-коричневого твердого вещества. Выход: 14,0 г (92,1%); идентифицировали ЯМР и масс-спектральным анализами. Пример 4. Получение 3-(5-карбоксиметокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-метил-6 трифторметилпиримидин-2,4-диона. Смесь 13,3 г (0,0377 моль) 3-(5-карбокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-6-трифторметилпиримидин-2,4-диона, 13,0 г (0,0943 моль) карбоната калия, 5,87 мл (0,0943 моль) метилиодида и 150 мл диметилформамида перемешивали в течение ночи при комнатной температуре и разбавляли 500 мл воды. Образовавшуюся смесь 3 раза экстрагировали этилацетатом. Объединенные органические слои промывали три раза водой, водным 0,1 н. гидроксидом натрия и рассолом, сушили над безводным сульфатом магния и концентрировали под пониженным давлением с получением бежевого твердого вещества. Перекристаллизацией остатка из 250 мл этанола/воды в виде игольчатых кристаллов получали указанное в заглавии соединение. Выход: 11,5 г (80,4%); tпл: 172-173 С; идентифицировали ЯМР- и массспектральными анализами. Пример 5. Получение 3-(5-карбометокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-6-трифторметилпиримидин-2,4-диона. 2,97 г (18,4 ммоль) карбонилдиимидазола вводили в раствор 4,61 г (13,1 ммоль) 3-(5-карбокси-4 хлор-2-фторфенил)-1,2,3,4-дигидро-6-трифторметилпиримидин-2,4-диона в тетрагидрофуране и образовавшуюся смесь нагревали до температуры кипения, перемешивали в течение 2 мин и охлаждали до комнатной температуры. Добавляли 2,70 мл (66,6 ммоль) метанола и смесь перемешивали в течение ночи при комнатной температуре. В дальнейшем смесь концентрировали под пониженным давлением и полученный остаток растворяли в метиленхлориде. Органическую смесь промывали дважды соляной кислотой (10%-ной водной и 5%-ной водной) и водой. Органический слой концентрировали под пониженным давлением с получением коричневого твердого вещества, которое суспендировали в метиленхлориде с последующим фильтрованием. Фильтровальный пирог три раза промывали метиленхлоридом, отфильтровывали и сушили с получением указанного в заглавии соединения в виде белого твердого вещества,которое идентифицировали ЯМР-спектральным анализом. Выход: 4,27 г (89,0%). Пример 6. Получение 3-(5-карбометокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-амино-6-трифторметилпиримидин-2,4-диона. В суспензию 4,24 г (11,6 ммоль) 3-(5-карбометокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-6 трифторметилпиримидин-2,4-диона в безводном тетрагидрофуране вводили 1,60 г (11,6 ммоль) карбона-27 005677 та калия, а затем 3,04 г (14,1 ммоль) О-мезитиленсульфонилгидроксиламина (J.G. Krause, Synthesis, 1972. 140). Образовавшуюся смесь перемешивали в течение ночи при комнатной температуре и разбавляли водой. Смесь 4 раза экстрагировали этилацетатом. Объединенные экстракты сушили над безводным сульфатом магния и концентрировали под пониженным давлением с получением в виде пены указанного в заглавии соединения, которое идентифицировали ЯМР-спектральным анализом. Выход: 4,63 г (100%). Пример 7. Получение 3-(5-карбокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-амино-6-трифторметилпиримидин-2,4-диона. В раствор 1,53 г (4,01 ммоль) 3-(5-карбометокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-амино-6 трифторметилпиримидин-2,4-диона в безводном метиленхлориде вводили 16,0 мл (16,0 ммоль) 1 М трибромида бора в метиленхлориде. Образовавшуюся смесь перемешивали в течение ночи при комнатной температуре, а затем разбавляли водой. Водный слой отделяли и оставляли стоять при комнатной температуре в течение ночи. В результате фильтрования и сушки указанное в заглавии соединение получали в виде белого твердого вещества, которое идентифицировали ЯМР- и масс-спектральными анализами. Выход: 0,61 г (41,5%). Первоначальный органический слой концентрировали под пониженным давлением до стекловидного твердого вещества, которое растирали в порошок с водой, получая в виде желтовато-коричневого твердого вещества указанное в заглавии соединение, которое идентифицировали ЯМР- и массспектральными анализами. Выход: 0,310 г (21,1%); tпл: 150 С (с разложением). Пример 8. Получение 3-(5-карбокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-метил-6-трифторметилпиримидин-2,4-диона. 84,0 мл (0,0840 моль) 1 М трибромида бора в метиленхлориде по каплям вводили в смесь 10,7 г(0,0281 моль) 3-(5-карбометокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-метил-6-трифторметилпиримидин-2,4-диона и 150 мл метиленхлорида. Образовавшуюся смесь перемешивали в течение ночи при комнатной температуре и разбавляли водой со льдом. Органический слой сохраняли, а водный слой дважды экстрагировали этилацетатом. Экстракты объединяли с органическим слоем, промывали рассолом,сушили над безводным сульфатом магния и концентрировали под пониженным давлением с получением указанного в заглавии соединения в виде белого твердого вещества, которое идентифицировали ЯМР- и масс-спектральными анализами. Выход: 10,2 г (100%); tпл: 240-241 С. Пример 9. Получение S-хлорсульфонамида. 10,8 мл (0,287 моль) муравьиной кислоты в течение двухчасового периода по каплям вводили в 25,0 мл (0,287 моль) хлорсульфонилизоцианата, поддерживая температуру ниже 20 С. Образовавшуюся суспензию перемешивали в течение двух часов при 20 С и разбавляли 100 мл безводного толуола. Полученную смесь перемешивали в течение ночи при комнатной температуре и фильтровали. Фильтрат концентрировали под пониженным давлением с получением указанного в заглавии соединения в виде не совсем белого твердого вещества, которое идентифицировали ИК-спектральным анализом. Выход: 32,1 г Раствор 3,00 г (0,0260 моль) S-хлорсульфонамида в 10 мл тетрагидрофурана при 10 С по каплям вводили в 40 мл 2 М метиламина в тетрагидрофуране. Образовавшуюся смесь перемешивали в течение 1 ч при 0 С и в течение трех дней при комнатной температуре. Суспензию фильтровали и фильтрат концентрировали под пониженным давлением с получением желтого твердого вещества. Хроматографией на силикагеле (метиленхлорид/метанол в соотношении 9:1) указанное в заглавии соединение получали в-28 005677 виде не совсем белого твердого вещества, которое идентифицировали ЯМР- и масс-спектральными анализами. Выход: 1,36 г (47,4%). Примеры с 11 по 15. Получение N-замещенных сульфамидов. По существу аналогично примеру 10 и с соответствующей заменой исходного аминового материала получали следующие соединения: Раствор 96,0 г (0,486 моль) 2,4,5-трихлорфенола в 95 мл толуола при температуре от 40 до 55 С обрабатывали добавлением по каплям 67,4 г (0,476 моль) хлорсульфонилизоцианата. Образовавшуюся смесь перемешивали в течение 3 ч при температуре кипения, охлаждали до 40 С и реакцию гасили водой до прекращения выделения газа. Суспензию фильтровали и фильтровальный пирог сушили на воздухе с получением указанного в заглавии соединения в виде белого твердого вещества, которое идентифицировали ЯМР- и ИК-спектральными анализами. Выход: 118,5 г (90,0%). Пример 17. Получение N-метил-N-изопропилсульфамида. 2,50 мл (0,0181 моль) триэтиламина вводили в раствор 1,55 мл (0,0181 моль) метилпропаргиламина в ацетонитриле. В образовавшуюся смесь добавляли 5,00 г (0,0181 моль) O-2,4,5-трихлорфенилсульфамата. Полученную смесь перемешивали в течение 1 ч при комнатной температуре и фильтровали через силикагель с помощью метиленхлорида. Фильтрат концентрировали под пониженным давлением с получением белого твердого вещества. Хроматографией остатка на силикагеле (0,5% метанола/метиленхлорид) получали указанное в заглавии соединение, которое идентифицировали ЯМРспектральным анализом. Выход: 1,84 г (68,7%). Примеры с 18 по 53. Получение N-замещенных сульфамидов. По существу аналогично примеру 17 и с соответствующей заменой исходного аминового материала получали следующие сульфамидные соединения: В раствор 1,50 г (4,09 ммоль) 3-(5-карбокси-4-хлор-2-фторфенил)-1,2,3,4-дигидро-1-метил-6(трифторметил)пиримидин-2,4-диона в тетрагидрофуране вводили 1,00 г (6,14 ммоль) N,N'карбонилдиимидазола. Образовавшуюся смесь перемешивали в течение 1 ч при температуре кипения и охлаждали до комнатной температуры. Добавляли 0,760 г (6,14 ммоль) диметилсульфамида, а затем, по прошествии 10 мин, 0,930 мл (6,14 ммоль) диазабициклоундекана. Полученную смесь перемешивали в течение ночи при комнатной температуре, после чего концентрировали под пониженным давлением. Полученный остаток разделяли между этилацетатом и 2 н. соляной кислотой. Органический слой сохраняли, а водную фазу 3 раза экстрагировали этилацетатом. Экстракты объединяли с сохраненным органическим слоем, промывали 10%-ным бикарбонатом натрия, сушили над безводным сульфатом магния и концентрировали под пониженным давлением с получением первого остатка. Водную фазу подкисляли и экстрагировали этилацетатом. Органические слои сушили и концентрировали под пониженным давлением с получением второго остатка.
МПК / Метки
МПК: A01N 43/54, C07D 239/54
Метки: фенилсульфамоилкарбоксамиды, гетероциклилзамещенные
Код ссылки
<a href="https://eas.patents.su/30-5677-geterociklilzameshhennye-fenilsulfamoilkarboksamidy.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклилзамещенные фенилсульфамоилкарбоксамиды</a>
Предыдущий патент: Новая соль периндоприла и содержащие ее фармацевтические композиции
Следующий патент: Фунгицидная смесь на базе амидных соединений
Случайный патент: Холодильный аппарат с отделениями для хранения







