Ингибиторы cxcr1/2 в качестве адъювантов трансплантата островковых клеток поджелудочной железы
Номер патента: 21298
Опубликовано: 29.05.2015
Авторы: Аллегретти Марчелло, Даффонкьо Луиза, Пьемонти Лоренцо
Формула / Реферат
1. Применение ингибитора CXCR1 и/или CXCR2 для получения адъювантного лекарственного препарата для трансплантата островковых клеток поджелудочной железы для пациентов с диабетом типа 1.
2. Применение по п.1, в котором указанный ингибитор представляет собой соединение формулы I или его фармацевтически приемлемую соль

в которой R выбирают из линейного или разветвленного 4-(C1-C6)алкила, 4-трифторметансульфонилокси-группы и 3-бензоила, и R1 представляет собой линейный или разветвленный (C1-C6)алкил.
3. Применение по п.2, в котором фармацевтически приемлемую соль выбирают из лизиновой или натриевой соли.
4. Применение по любому из пп.1-3, в котором указанный лекарственный препарат улучшает приживление трансплантата островковых клеток поджелудочной железы и начальное функционирование трансплантата.
5. Применение по любому из пп.1-4, в котором указанный лекарственный препарат уменьшает частоту неблагоприятного результата для трансплантированных островковых клеток поджелудочной железы.
6. Применение по п.5, в котором указанный лекарственный препарат уменьшает скорость и частоту отторжения трансплантата островковых клеток поджелудочной железы.
7. Применение по п.6, в котором указанный лекарственный препарат увеличивает длительность периода жизнеспособности трансплантата.
8. Применение по любому из пп.1-7, в котором указанное соединение формулы I выбирают из R(-)-N-2-[(4-изобутилфенил)пропионил]метансульфонамида и R(-)-2-[(4'-трифторметансульфонилокси)фенил]пропионилметансульфонамида.
Текст
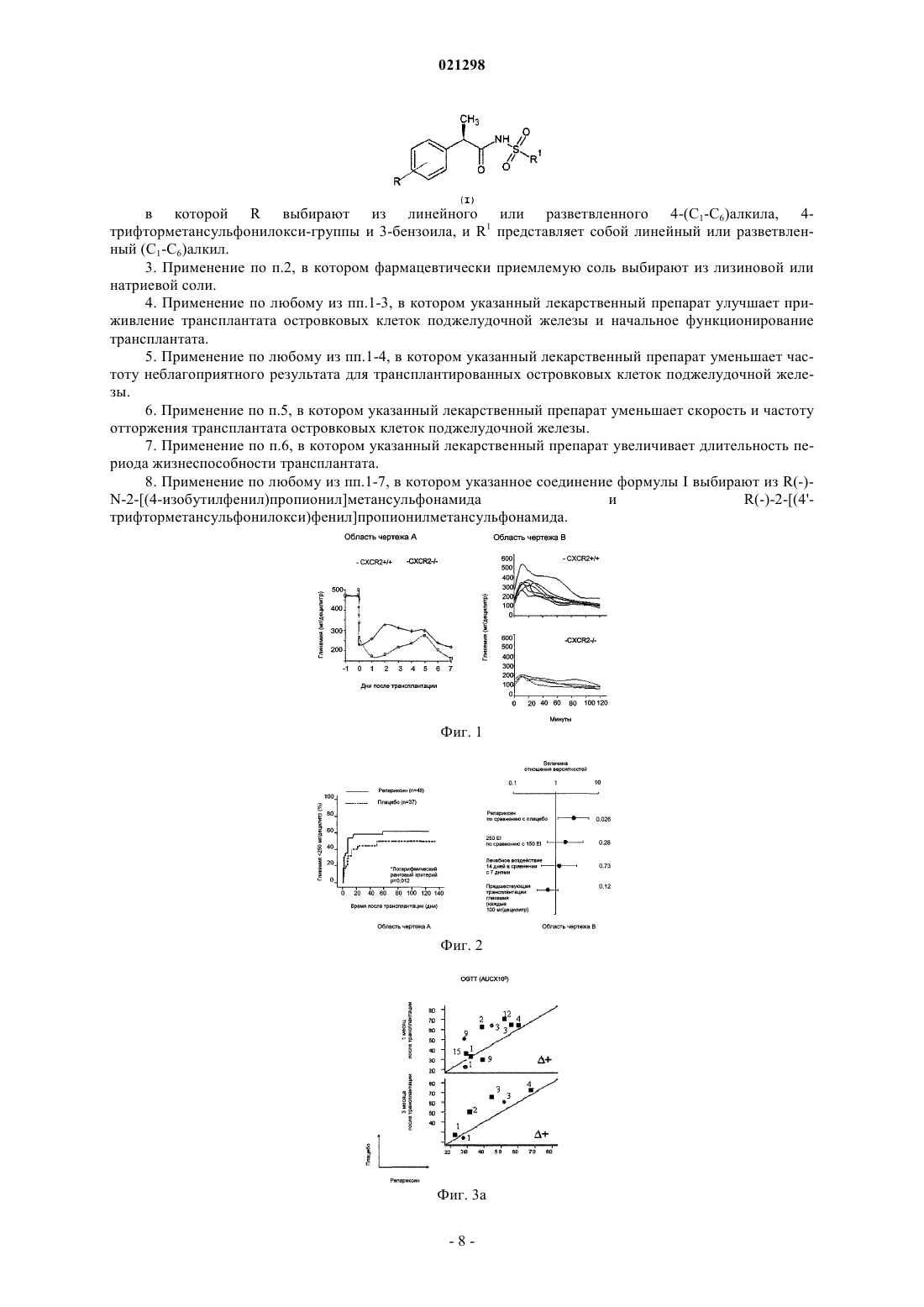
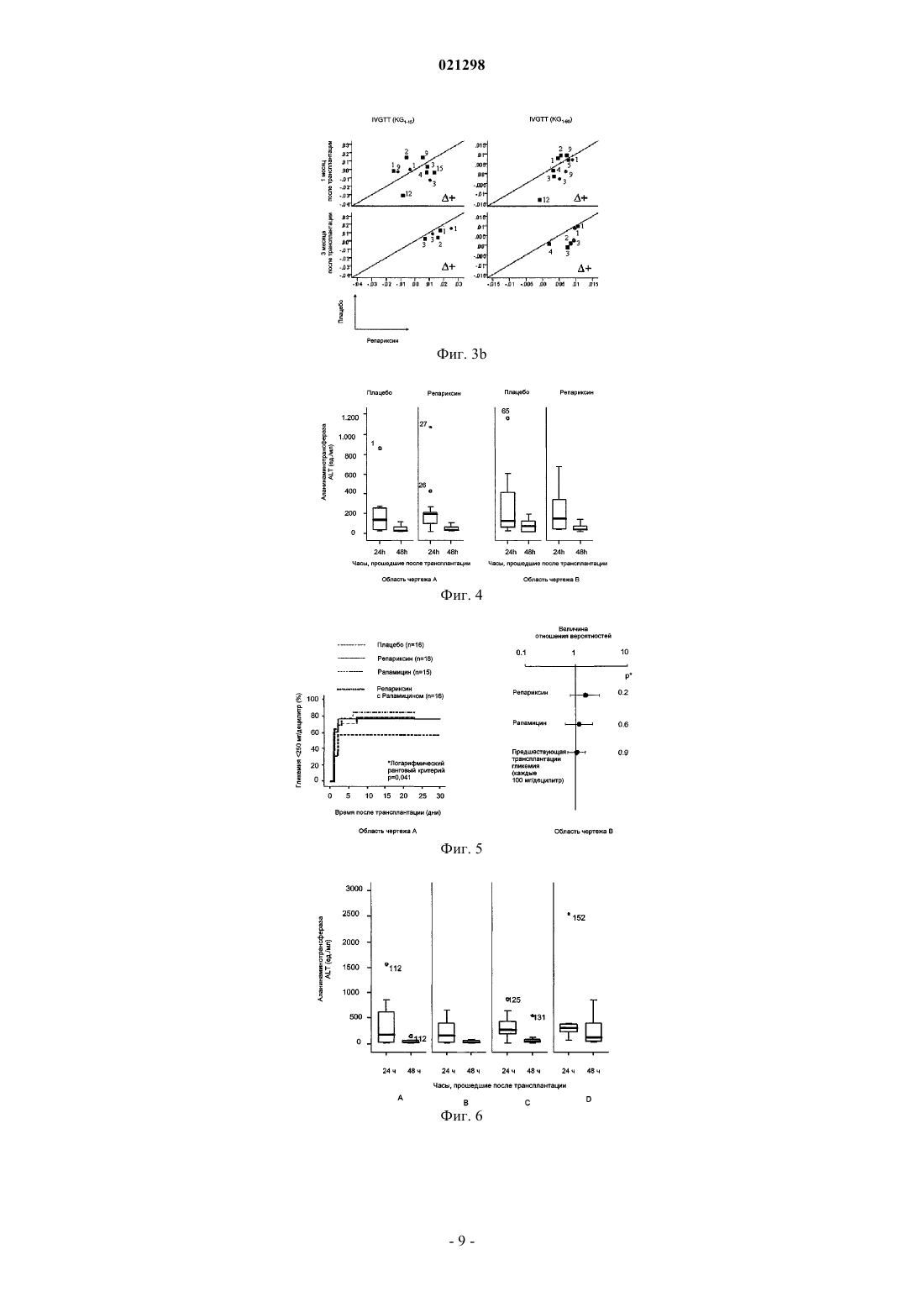
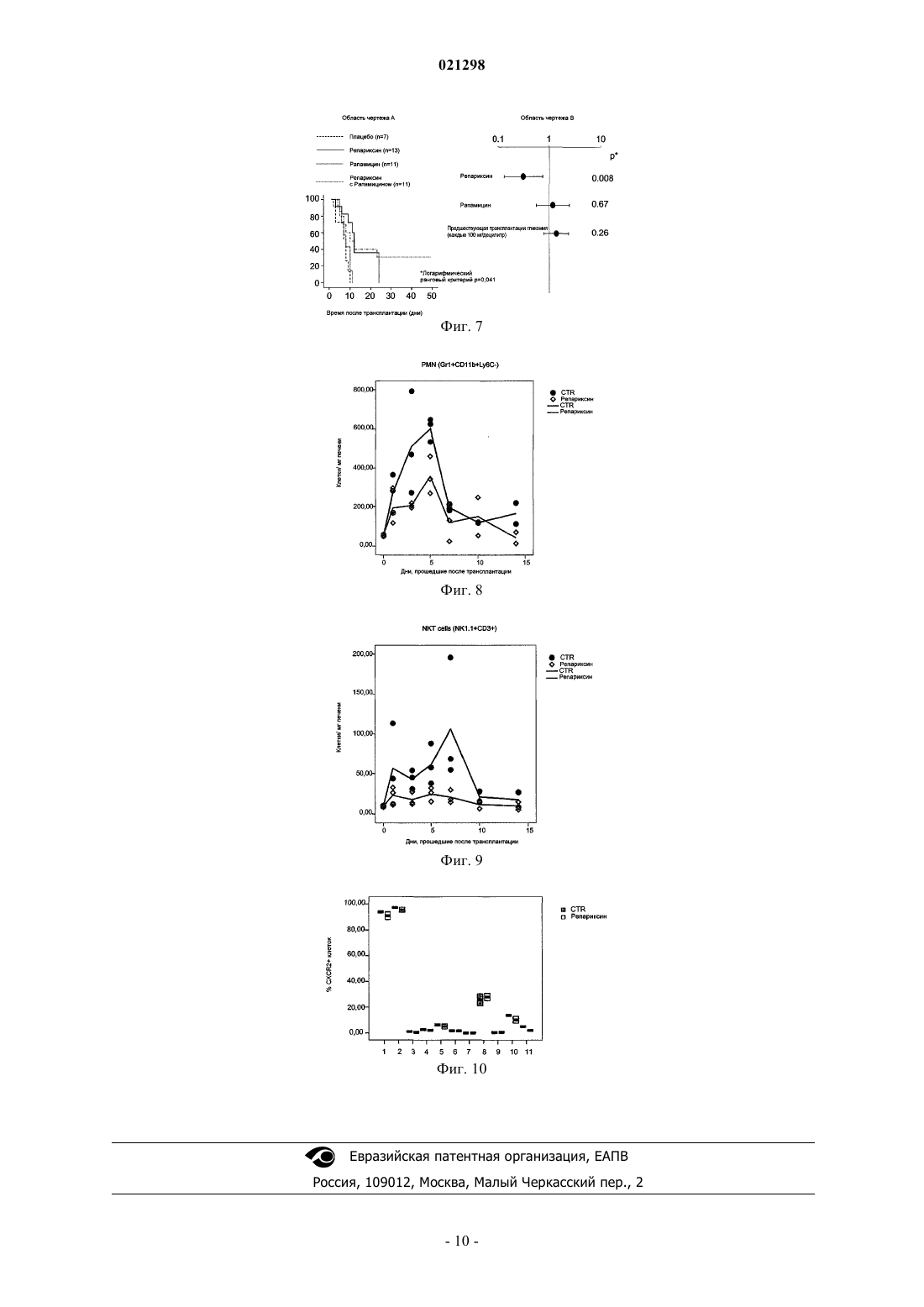
ИНГИБИТОРЫ CXCR1/2 В КАЧЕСТВЕ АДЪЮВАНТОВ ТРАНСПЛАНТАТА ОСТРОВКОВЫХ КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Изобретение относится к ингибиторам CXCR1 и/или CXCR2, которые применяют для получения лекарственного препарата для использования в качестве адъюванта трансплантата островковых клеток поджелудочной железы у пациентов с диабетом типа 1. А именно соединения, которые могут применяться в соответствии с изобретением, имеют нижеприведенную формулу (I), в которой R иR' представляют собой указанные в описании изобретения. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, пригодным для применения в качестве адъювантов трансплантата островковых клеток поджелудочной железы для пациентов с диабетом типа 1. Уровень техники изобретения Трансплантация ткани поджелудочной железы в виде цельной поджелудочной железы или в виде изолированных островковых клеток поджелудочной железы стала клиническим методом лечения инсулин-зависимого сахарного диабета типа 1. Трансплантация островковых клеток поджелудочной железы представляется в особенности приемлемой, поскольку она является менее инвазивным альтернативным вариантом в сравнении с трансплантацией цельной поджелудочной железы и связана с гораздо меньшим риском серьезных осложнений; вместе с тем, такая процедура все еще ограничена из-за слабой эффективности. Ранние методики трансплантации островковых клеток основывались на протоколах, которые были успешно апробированы при трансплантации паренхиматозных органов и включают введение иммуносупрессорных препаратов, таких как азатиоприн, циклоспорин и кортикостероиды. Такие методики оказались неэффективными в конкретном случае трансплантации островковых клеток поджелудочной железы и давали очень слабые результаты, с нарушением работоспособности большинства трансплантатов в течение одного года с момента трансплантации (Sulaiman and Shapiro, Diabetes, Obesity and Metabolism, 8,2006, 15-25). За последние годы разработка протокола Эдмонтон, который предусматривает введение новых специальных методов иммуносупрессии и методик получения островковых клеток, существенно улучшила клинический результат трансплантации островковых клеток поджелудочной железы. В соответствии с протоколом Эдмонтон островковые клетки поджелудочной железы выделяют из поджелудочной железы скончавшегося донора, очищают и затем трансплантируют реципиенту с помощью введения в воротную вену печени через катетер, размещенный в верхнем отделе брюшной полости; вскоре после их инфузии в печень клетки начинают выделять инсулин. С целью предотвращения отторжения применяют новый метод иммуносупрессии, называемый Сиролимус и Такролимус, и CD25 моноклональное антитело, Даклизумаб (Saphiro et. al., N. Engl. J. Med., 2000, 343(4): 230-238). К сожалению, все еще существуют некоторые дефекты трансплантации островковых клеток поджелудочной железы, которые не устранены, и это препятствует тому, чтобы эта процедура стала стандартным лечением для пациентов с диабетом типа 1. Первый недостаток, связанный с трансплантацией островковых клеток поджелудочной железы, заключается в том, что даже если протокол Эдмонтон существенно повышает долю успешных случаев, при этом все еще остается высоким процент раннего отторжения трансплантата из-за ряда комплексных явлений, таких как мгновенная опосредованная кровью воспалительная реакция (IBMIR), феномен ускоренного нарастания клеток зоны воспаления и аспецифический иммунитет. Известно, что внутрипеченочная инфузия островковых клеток у людей связана с немедленной, опосредованной кровью воспалительной реакцией, тромбозом и ишемией тканей печени с повышением содержания в крови ферментов печени (Barshes N.R. et. al., J. Am. Coll. Surg., 2005, 200(3): 353-361; Barshes N.R. et. al., J. Leukoc. Biol.,2005, 77(5): 587-97; Bertuzzi et. al., J. Clin. Endocrinol. Metab., 2004, 89(11): 5724-8; Bhargava R. et. al. Diabetes, 2004, 53(5): 1311-7; Contreras et. al., 2004, 53(11): 2894-14; Johansson et. al., Diabetes, 2005, 54(6): 1755-62). Потеря не более 50-75% островковых клеток во время приживления трансплантата в печени(Contreras et. al., см. выше), как полагают, является главным фактором, отвечающим за огромное количество требуемых островковых клеток, необходимых для достижения нормогликемии (Barshes et. al., см. выше). Кроме того, если даже трансплантация в начальной стадии является успешной и приводит к независимости реципиента от инсулина, существует мнение, что у трансплантированных островковых клеток поджелудочной железы в течение некоторого временем ослабляется способность к функционированию. Это важное явление ограничивает возможность достижения длительной независимости от инсулина трансплантированных пациентов, при этом только 14% пациентов обладают независимостью от инсулина спустя два года после трансплантации [Meloche R.M. World J. Gastroenterol. 2007; 13(47): 6347-6355]. Следующий недостаток заключается в том, что протокол Эдмонтон предусматривает обязательное использование комбинации иммуносупрессорных лекарственных препаратов; Сиролимус и Такролимус должны приниматься в течение всей жизни или на протяжении всего времени, когда трансплантированные островковые клетки поджелудочной железы продолжают функционировать. Однако же, эти лекарственные препараты имеют серьезные побочные эффекты, которые необходимо снижать. Осложнения,происходящие из-за иммуносупрессивной терапии, представляют собой второе, как правило, встречающееся серьезное неблагоприятное явление, о котором сообщается в связи с этим видом трансплантата. Таким образом, дальнейшие исследования все еще необходимы для увеличения долгосрочной жизнеспособности и функционирования трансплантата с целью осуществления контроля уровня содержания глюкозы в течение долгого времени и уменьшения недостатков иммуносупрессивной терапии.CXCL8 представляет собой хемокин, индуцируемый медиаторами воспаления, который непосредственно связан с начальной фазой восстановления тканей и который, как было показано, способствует ангиогенезу (Li et. al., J. Immunol., 2003, 170: 3369-3376) посредством индукции хемотаксиса, жизнеспособности и пролиферации эндотелиальных клеток, и действует в качестве аттрактанта нейтрофилов. Он оказывает свое воздействие посредством связывания с узнаваемыми им CXCR1 и CXCR2 рецепторами,сопряженными с G-белком. В последнее время в литературе высказано предположение, что CXCL8 может способствовать трансплантации посредством индукции реваскуляризации трансплантированной ткани (Movahedi et. al.,Diabetes, 2008, 57: 2128-36). Патент ЕР 1123276 раскрывает N-(2-арил-пропионил)сульфонамиды, в числе которых R(-)-2-[(4 изобутилфенил)пропионил]метансульфонамид (I), и их фармацевтически приемлемые соли для использования в качестве ингибиторов хемотаксической активности нейтрофилов и дегрануляции, вызванныхCXCL-8, в частности, для использования при лечении таких патологий, как псориаз, ревматоидный артрит, неспецифический язвенный колит, острая дыхательная недостаточность (ARDS), идиопатический фиброз и гломерулонефрит. Патент ЕР 1355641 раскрывает применение R(-)-2-[(4-изобутилфенил)пропионил]метансульфонамида и его фармацевтически приемлемых солей, в частности его лизиновой соли, для предотвращения и лечения ишемии/реперфузионного повреждения трансплантированных органов и функционального повреждения, являющегося результатом реакций отторжения после трансплантации паренхиматозных органов, в частности, почек, которые необходимо изымать у донора и сохранять перед трансплантацией. Такие повреждения, как полагают, ответственны за отсроченную функцию трансплантата, что приводит к необходимости диализа в случае трансплантации почки. Патент ЕР 1579859 раскрывает применение N-(2-арил-пропионил)сульфонамидов, в том числе R(-)2-[(4-изобутилфенил)пропионил]метансульфонамида и его лизиновой соли, для получения лекарственных препаратов для лечения повреждения спинного мозга. Описание чертежей Фиг. 1. Область чертежа А показывает гликемию не натощак (в мг/дл), измеренную со дня -1 до дня+7 после изотрансплантации 400 островковых клеток поджелудочной железы у нокаутных мутантных мышей (бледная линия) и мышей дикого немутантного типа (черная линия). Область чертежа В показывает результаты перорального теста на толерантность к глюкозе (Oral Glucose Tolerance Test (OGTT. Гликемию (в мг/дл) измеряли непосредственно перед введением глюкозы и спустя 10, 20, 30, 60 и 90 мин после введения глюкозы пероральным способом. Кривая изменения содержания глюкозы в крови представлена для каждого животного. Фиг. 2. Область чертежа А показывает гликемию в различные моменты протекания процесса после трансплантации для мышей, подвергнутых воздействию Репариксина (сплошная линия) или контрольных мышей (пунктирная линия). Область чертежа В представляет логарифмический ранговый критерий как результат многофакторного регрессионного анализа Кокса. Фиг. 3 а и 3b. Представлено в виде диаграммы разброса данных среднее значение, полученное в пероральном тесте на толерантность к глюкозе (OGTT) (фиг. 3a) и во внутривенном тесте на толерантность к глюкозе (Intravenous Glucose Tolerance Test (IVGTT (фиг. 3b) у мышей с трансплантацией в присутствии или в отсутствие Репариксина с применением островковых клеток поджелудочной железы, выделенных из одного и того же источника. Обозначения указывают показатель выделения. Квадраты и круги представляют, соответственно, мышей, подвергнутых трансплантации с использованием 250 или 150 IE. Верхняя и нижняя области чертежа представляют данные, соответственно, через 1 и 3 месяца после трансплантации. Сплошная линия представляет собой линию идентичности: круги выше линии идентичности представляют собой наблюдаемые результаты с более высокими значениями в группе, подвергаемой лечебному воздействию Репариксина, в сравнении с тем, что наблюдали в группе с воздействием плацебо (инертное вещество-наполнитель) (+). Фиг. 4. Представлены уровни циркулирующей в крови аланинаминотрансферазы (ALT) через 24 и 48 ч после трансплантации для животных, получающих лечебное воздействие Репариксином и воздействие плацебо, трансплантацию проводили со 150 (область чертежа А) или с 250 IE (область чертежа В). Фиг. 5. Область чертежа А представляет гликемию в различные моменты времени после трансплантации у мышей, подвергавшихся лечению Репариксином, Рапамицином, комбинацией Репариксин+Рапамицин или плацебо. Область чертежа В представляет логарифмический ранговый критерий как результат многофакторного регрессионного анализа Кокса. Фиг. 6. Показаны уровни циркулирующей в крови аланинаминотрансферазы (ALT) через 24 и 48 ч после трансплантации для мышей, подвергавшихся лечению воздействием плацебо (А), Репариксина (В),Рапамицина (С) или комбинацией Репариксин+Рапамицин (D). Фиг. 7. Область чертежа А показывает в процентах жизнеспособность трансплантата с течением времени после того, как трансплантат у мышей подвергали лечебному воздействию Репариксином, Рапамицином, комбинацией Репариксин+Рапамицин или плацебо. Область чертежа В представляет логарифмический ранговый критерий как результат многофакторного регрессионного анализа Кокса. Фиг. 8. Показано количество полиморфно-ядерных нейтрофилов (PMN), проэкстрагированных из печени с течением времени (дни) после трансплантации островковых клеток поджелудочной железы(выраженное как количество клеток на мг печеночной ткани) в контрольном опыте (жирная линия) или в опыте с мышами, подвергнутыми лечебному воздействию Репариксина (бледная линия). Фиг. 9. Показано количество клеток природных киллеров (NK-клеток), проэкстрагированных из печени с течением времени (дни) после трансплантации островковых клеток поджелудочной железы (выраженное как количество клеток на мг печеночной ткани) в контрольном опыте (жирная линия) или в опыте с мышами, подвергнутыми лечебному воздействию Репариксина (бледная линия). Фиг. 10. Показано процентное содержание CXCR2+ клеток в различных субпопуляциях лейкоцитов, проэкстрагированных из печени спустя 5 дней после аллогенной трансплантации островковых клеток поджелудочной железы. На оси абсцисс номера 1-11 обозначают нижеследующее 1) PMN (Gr1+ CD11b+ CD11c-); 2) PMN (Gr1+ CD11b+ Ly6c-); 3) Макрофаги (CD11b+ CD11c- Gr1-); 4) Дендритные клетки (CD11c+ CD11b+ Gr1-); 5) Лимфоциты (CD3+ CD4+); 6) Лимфоциты (CD3+ CD8+); 7) В лимфоциты (CD19+); 8) NKT-клетки (NK1.1+ CD3+); 9) NKT-клетки (NK1.1+ CD3-); 10) Лимфоциты (CD4+ TCRb+); 11) Лимфоциты (CD8+ TCRb+). Подробное описание изобретения Авторы настоящего изобретения неожиданно обнаружили, что противоположно существующему в предшествующем уровне техники мнению, агонисты CXCR1 и/или CXCR2 пагубны для жизнеспособности островковых клеток после трансплантации островковых клеток поджелудочной железы. Как будет описано в нижеприведенных примерах, островковые клетки поджелудочной железы демонстрируют улучшенные показатели функционирования и жизнеспособности в случае их трансплантации нокаутным по гену CXCR2 мышам BALB/C в сравнении с мышами дикого немутантного типа, при этом сохраняется лучшая толерантность к глюкозе и более низкая концентрация глюкозы в сравнении с контрольными мышами. Более того, эксперименты, осуществленные авторами настоящего изобретения, со всей очевидностью демонстрируют, что соединения, ингибирующие передачу сигналов через CXCR1 и/или CXCR2,способны эффективно улучшать жизнеспособность трансплантата и функционирование после трансплантации островковых клеток поджелудочной железы. Таким образом, первым объектом настоящего изобретения является применение ингибиторовCXCR1 и/или CXCR2 в качестве адъювантов трансплантата островковых клеток поджелудочной железы для пациентов с диабетом типа 1. Под ингибиторами CXCR1 и/или CXCR2, в соответствии с настоящим изобретением, подразумеваются соединения, которые способны предотвратить CXCL8-биологическую активность, происходящую из-за активации CXCR1 и/или CXCR2. Эти соединения могут быть конкурентными антагонистами или аллостерическими ингибиторами рецепторов. Предпочтительные соединения изобретения представляют собой соединения формулы I или их фармацевтически приемлемые соли где R выбирают из линейного или разветвленного 4-(C1-C6)алкила, 4-трифторметансульфонилоксигруппы или 3-бензоила, и R1 представляет собой линейный или разветвленный (C1-C6)алкил. В особенности предпочтительные соединения, в соответствии с настоящим изобретением, представляют собой R(-)2-[(4-изобутилфенил)пропионил]метансульфонамид (общеизвестный как Репертаксин или Репариксин, в дальнейшем в этом документе называемый как Репариксин), и R(-)-2-[(4'-трифторметансульфонилокси)фенил]пропионил-метансульфонамид (общеизвестный и в дальнейшем в этом документе называемый как Мераксин). Предпочтительные соли соединений изобретения представляют собой лизиновую и натриевую соль. В особенности предпочтительные соли соединений изобретения представляют собой лизиновую соль Репариксина и натриевую соль Мераксина. Как будет описано ниже, в модельных системах на животных соединения формулы I обладают способностью эффективно улучшать жизнеспособность трансплантата и функционирование после трансплантации островковых клеток поджелудочной железы. В деталях, данные, полученные на экспериментальных моделях трансплантации островковых клеток, демонстрируют со всей очевидностью эффект вышеуказанных соединений, представленных R(-)-2[(4-изобутилфенил)пропионил]метансульфонамидом, связанный с предохранением от потери активности и/или от разрушения трансплантированных -клеток. В соответствии с предпочтительным примером осуществления изобретения указанное соединение формулы I представляет собой Репариксин. В соответствии с дополнительным предпочтительным примером осуществления изобретения, указанное соединение формулы I представляет собой Мераксин. Соединения изобретения эффективны в поддержании приживления трансплантата после трансплантации островковых клеток поджелудочной железы при диабете типа 1. Более того, как это будет более очевидно из нижеприведенной экспериментальной части, внутривенное введение Репариксина животным в модельных системах со дня -1 до дня +6 после проведения сингенной или аллогенной трансплантации островковых клеток поджелудочной железы в результате приводит к более высокой сходимости по вероятности и к снижению среднего значения времени достижения нормальных уровней гликемии (уровень содержания глюкозы в крови, определенный не натощак,ниже чем 250 мг/мл) в сравнении с контрольными опытами. Таким образом, еще одним объектом настоящего изобретения является применение ингибиторовCXCR1 и/или CXCR2, предпочтительно соединений формулы I, более предпочтительно Репариксина или Мераксина, для улучшения приживления трансплантата и начального функционирования трансплантата и для уменьшения количества происходящих случаев преждевременного отторжения трансплантата после трансплантации островковых клеток поджелудочной железы пациентам с диабетом типа 1. Указанную трансплантацию предпочтительно осуществляют для печени или для костного мозга пациентов. Эксперименты по аллогенетической трансплантации островковых клеток поджелудочной железы показывали, что введение Репариксина как ингибитора CXCR1/CXCR2 существенно уменьшало вероятность проявления реакций отторжения у тех мышей, у которых успешно обеспечивалось первичное функционирование после трансплантации. Кроме того, результаты демонстрируют, что функционирование трансплантата поддерживается в течение более длительного времени в сравнении с контрольными опытами, при этом повышается среднее время выживания. Эффективность Репариксина в улучшении функционирования и жизнеспособности трансплантата была продемонстрирована при трансплантации островковых клеток поджелудочной железы как в случае печени, так и в случае костного мозга. Таким образом, следующим объектом настоящего изобретения является применение ингибиторовCXCR1 и/или CXCR2, предпочтительно соединений формулы (I), более предпочтительно Репариксина,для уменьшения вероятности проявления реакций отторжения трансплантата и для увеличения длительности срока жизнеспособности трансплантата. Соединения изобретения можно применять с этой целью индивидуально или в комбинированной терапии с одним или несколькими иммуносупрессорами, предпочтительно выбранными из Сиролимуса(также известного как Рапамицин) и Такролимуса. Однако, полученные данные, которые изложены в экспериментальной части, также говорят о том,что применение соединения изобретения в индивидуальном виде может быть вполне достаточным для ингибирования отторжения трансплантата. Безусловно, как показано в экспериментальной части, блокирование рецептора CXCR1/2 Репариксином существенно увеличивает период времени до наступления отторжения у мышей, у которых успешно обеспечивалось первичное функционирование после трансплантации, тогда как на это существенного влияния не оказывал Рапамицин. Кроме того, введение Репариксина в индивидуальном виде обеспечивало получение результатов, сравнимых с теми, которые получали при введении комбинации Репариксина с Рапамицином. Эти данные убедительно свидетельствуют в пользу того, что введение индивидуального Репариксина может быть достаточно эффективным для достижения цели снижения вероятности реакции отторжения трансплантата, без потребности или с уменьшенной потребностью в иммуносупрессивной терапии, что представляет собой существенное преимущество по показателям токсичности. Синтез соединений изобретения может быть осуществлен в соответствии с методиками, хорошо известными из уровня техники. Например, Репариксин может быть получен, как раскрыто в примере 1 патента ЕР 1123276 и в примере 1 патента ЕР 1355641, тогда как лизиновая соль может быть получена, как раскрыто в примерах 7 и 2, соответственно, вышеуказанных патентов. Например, Мераксин может быть получен в соответствии с примером 1 патента ЕР 1776336. Соединения, применяемые в соответствии с настоящим изобретением, входят в состав фармацевтических композиций готовых лекарственных форм, удобных для применения посредством перорального введения, таких как таблетки, капсулы, сиропы, предпочтительно в виде готовых лекарственных форм с контролируемым высвобождением, или для применения посредством парентерального введения, предпочтительно в форме стерильных растворов, удобных для внутривенного или внутримышечного введения. Готовые лекарственные формы могут быть получены в соответствии со стандартными способами,-4 021298 например, как описано (см. Remington The Science and Practice of Pharmacy, 21st ed. (Lippincott Williamsand Wilkins. Предпочтительно, чтобы количество Репариксина или его фармацевтически приемлемой соли в каждой из вышеуказанных лекарственных форм для введения было таким, чтобы обеспечить введение от 2 до 15 мг соединения или его соли на кг массы тела, тогда как количество Мераксина или его фармацевтически приемлемой соли должно быть таким, чтобы обеспечить введение от 10 до 20 мг соединения или его соли на кг массы тела. При любых обстоятельствах схема приема лекарства и количество вводимого лекарственного препарата будут определяться лечащим врачом в соответствии с потребностью пациента. Изобретение будет в дальнейшем проиллюстрировано подробнее в нижеприведенной экспериментальной части. Экспериментальная часть 1. Сингенная трансплантация островковых клеток нокаутным мышам С целью проверки того воздействия, которое может оказать активация CXCL8 пути передачи сигнала через CXCR1 и CXCR2 на жизнеспособность островковых клеток, функционирование островковых клеток после сингенной трансплантации островковых клеток внутрь печени анализировали у Balb/cCXCR2-/- мышей и у CXCR2+/+ мышей. CXCR1 не экспрессируется у мышей и, таким образом, у нокаутных по CXCR2 мышей в итоге прекращает существование путь передачи сигнала, индуцированный с помощью CXCL8. Гликемия не натощак на протяжении первой недели после трансплантации и толерантность к перорально введенной глюкозе на протяжении 4 недель после трансплантации принимались к рассмотрению в качестве индикаторов выполнения функций. Как представлено на фиг. 1, подвергнутые трансплантацииCXCR2 нокаутные мыши со всей очевидностью демонстрировали стабильно более лучшую толерантность к глюкозе, чем контрольные мыши дикого типа, что и было продемонстрировано существенным снижением концентрации циркулирующей в крови глюкозы на протяжении всего периода проведения анализа. Определение толерантности к перорально введенной глюкозе проводили, как описано ниже, в разделе 2. 2. Сингенная трансплантация островковых клеток мышам Островковые клетки от С 57 мышей возраста 12 недель трансплантировали в печень диабетических С 57 мышей (диабет, индуцированный аллоксаном, гликемия больше 450 мг/дл). Две различные критические массовые модели островковых клеток, 150 IE (Islet Equivalents, эквиваленты островковых клеток) и 250 IE, применяли. Репариксин вводили подкожно посредством непрерывной инфузии, начиная со дня -1 и до дня 6 или 13 после трансплантации островковых клеток в дозе 8 мг/кг/ч. Контрольные животные получали непрерывную подкожную инфузию инертной среды (плацебо). В первую очередь определяли способность к достижению уровня глюкозы в крови не натощак менее чем 200 мг/дл для двух следующих друг за другом измерений после проведения трансплантации островковых клеток. Как показано на фиг. 2, вероятность (сходимость по вероятности) и среднее значение времени достижения эугликемии (меньше 200 мг/дл) были 50% и 7 дней для мышей, подвергавшихся лечебному воздействию Репариксином, в сравнении с результатом 35,1% и 50 дней, полученном для мышей, подвергавшихся воздействию плацебо (логарифмический ранговый критерий р 0,012). Многофакторный регрессионный анализ Кокса, в котором в качестве независимых переменных учитывали лечение Репариксином, продолжительность лечения, количество трансплантированных островковых клеток и гликемию реципиента до проведения трансплантации, подтвердил, что результат существенно улучшался благодаря Репариксину (величина отношения вероятностей: 2,6; 95% CI: 1,1-6,1; р 0,021). Как и ожидалось, трансплантация 250 IE в результате привела к улучшению характеристик трансплантации (величина отношения вероятностей: 1,6; 95% CI: 0,6-4,3; р 0,28), в то время как гликемия, существовавшая до трансплантации, оказывала негативное влияние на результат (величина отношения вероятностей: 0,6, 95% CI: 0,3-1,1; р=0,12). Внутривенный тест на толерантность к глюкозе (IVGTT) и пероральный тест на толерантность к глюкозе (OGTT) проводили спустя 1 и 3 месяца после трансплантации для определения функциональности трансплантированных островковых клеток. IVGTT начинали проводить после 16-часового голодания; мышам давали глюкозу (0,5 г/кг) посредством инъекции в хвостовую вену. Образцы крови забирали спустя 0, 1, 5, 15, 20, 30 и 60 мин после инъекции и использовали для определения концентраций глюкозы. Исходя из результатов IVGTT определяли количественно толерантность к глюкозе, на основании константы элиминации глюкозы (KG; выраженную процентом элиминации глюкозы в минуту), как снижение концентрации циркулирующей в крови глюкозы с 1 по 15 мин (KG1-15) после внутривенного введения, с последующим логарифмическим преобразованием индивидуальных значений концентрации глюкозы в плазме. Аналогичный расчет проводили для итоговой, с 1 по 60 мин, скорости убывания концентрации глюкозы (KG1-60). Этот параметр указывает на скорость убывания концентрации глюкозы на протяжении всего теста. OGTT начинали проводить после 4-часового голодания; мышам давали глюкозу(1 г/кг) посредством перорального зондового питания. Образцы крови забирали спустя 0, 10, 20, 30, 60,90 и 120 мин после введения глюкозы и использовали для определения концентраций глюкозы. Площадь под кривой (AUC), отражающей изменение концентрации глюкозы во время проведения OGTT, рассчитывали с использованием метода трапеций (базовая линия равна 0 мин). Воздействия трансплантации островковых клеток на толерантность к глюкозе, определенную после IVGTT и OGTT, проиллюстрированы на фиг. 3. Данные представлены в виде диаграмм разброса значений. Каждая точка представляет собой среднюю величину определенного параметра для подвергнутых трансплантации мышей в присутствии или в отсутствие воздействия Репариксина, при условии одного и того же источника выделения островковых клеток; значки идентифицируют номер выделения, в то время как квадраты и круги, соответственно, представляют параметры для мышей, подвергнутых трансплантации с 250 или 150 IE. Верхняя и нижняя области чертежа, соответственно, представляют полученные данные спустя 1 и 3 месяца после трансплантации. Сплошная жирная линия представляет собой идентификационную линию: круги выше идентификационной линии представляют собой наблюдаемые результаты с более высокими значениями для группы, подвергаемой лечебному воздействию Репариксином, в сравнении с группой, подвергаемой воздействию плацебо (+). OGTT, проведенный спустя 1 и 3 месяца после трансплантации, показал, что у мышей, подвергнутых лечебному воздействию Репариксином, площадь под кривой (AUC),соответствующей изменению концентрации глюкозы, оставалась меньше, чем в случае контрольных мышей. В согласовании с этими данными, константы элиминации глюкозы с 1 по 15 мин (KG1-15) и с 1 по 60 мин (KG1-60) были существенно повышенными в случае мышей, подвергнутых лечебному воздействию Репариксином, в сравнении с контрольными мышами. Острое поражение печени количественно оценивали по уровням содержания циркулирующей в крови аланинаминотрансферазы (ALT) спустя 24 и 48 ч после трансплантации. На уровни содержанияALT не влияло лечение Репариксином в обоих случаях трансплантации мышей 150 или 250 IE (фиг. 4). Аналогично, не было замечено различий в уровнях содержания циркулирующих в крови лейкоцитов,эритроцитов и тромбоцитов (данные не приведены). 3. Аллогенная трансплантация островковых клеток мышам Островковые клетки Balb/c мышей возраста 12 недель трансплантировали в печень диабетических С 57 мышей (диабет, индуцированный аллоксаном, гликемия больше 450 мг/дл). В некоторых экспериментах островковые клетки поджелудочной железы от C57BL/6(B6) мышей возраста 12 недель трансплантировали в печень диабетических самок мышей NOD/LtJ (NOD) с целью определить наличие какойлибо аутоиммунной реакции. NOD мышей использовали в качестве реципиентов трансплантата островковых клеток после по крайней мере трех показаний содержания глюкозы в крови не натощак, превышающих 350 мг/дл. В обоих случаях 400 IE трансплантировали. Животных подвергали лечебному воздействию Репариксином в индивидуальном виде (5,28 мг/кг/ч непрерывной подкожной инфузией, начиная со дня -1 и до дня 7 после трансплантации), Рапамицина в индивидуальном виде (ежедневные интраперитонеальные инъекции, начиная с индукционной дозы 0,3 мг/кг со дня 0 с последующей поддерживающей дозой 0,15 мг/кг до дня 14), смеси Репариксин+Рапамицин или инертной среды (плацебо). Способность достижения основной первоначальной функции определяют как уровни глюкозы в крови не натощак, составляющие менее чем 250 мг/децилитр для 2 следующих друг за другом измерений после трансплантации островковых клеток, и период времени до отторжения определяют в связи с 2 следующими друг за другом показателями содержания глюкозы в крови не натощак, превышающими 300 мг/децилитр, что и было установлено в первую очередь. Рассматривая всех подвергнутых трансплантации мышей как находящихся в условиях аллоиммунной ситуации, вероятность и среднее время достижения основной первоначальной функции (гликемия меньше 250 мг/дл) были: 72% и 1 день для мышей, подвергнутых лечебному воздействию Репариксина в индивидуальном виде, 73% и 1 день для мышей, подвергнутых лечебному воздействию Рапамицина в индивидуальном виде, 69% и 1 день для мышей, подвергнутых лечебному воздействию смеси Репариксин+Рапамицин, 44% и 2 дня для мышей, подвергнутых воздействию плацебо (фиг. 5, логарифмический ранговый критерий р 0,041). Многофакторный регрессионный анализ Кокса, в котором в качестве независимых переменных учитывали лечение Репариксином, лечение Рапамицином и гликемию реципиента до проведения трансплантации, подтвердил, что результат существенно улучшался благодаря лечебному воздействию Репариксином (величина отношения вероятностей: 2,5; 95% CI: 0,79-2,99; р 0,202). Лечебное воздействие Рапамицином (величина отношения вероятностей: 1,1; 95% CI: 0,62-2,15; р 0,62) и гликемия до проведения трансплантации (величина отношения вероятностей: 1,03; 95% CI: 0,68-1,59; р 0,88) были менее существенными. Уровни содержания циркулирующей в крови ALT, измеренные спустя 24 и 48 ч после трансплантации, не подвергались изменению под воздействием Репариксина как в присутствии, так и в отсутствие Рапамицина (фиг. 6). Кроме того, лечение Репариксином существенно увеличивало период времени до отторжения у мышей, что способствовало достижению основной первоначальной функции после трансплантации (фиг. 7). Среднее время жизнеспособности было 120,6 дня (n=13) и 80,5 дня (n=7), соответственно, для мышей, подвергнутых воздействию Репариксином и подвергнутых воздействию плацебо в отсутствие Рапамицина. В присутствии Рапамицина среднее время жизнеспособности было 122 дня (n=11) и 80,6 дня (n=11), соответственно для опыта с Репариксином и для контрольных мышей. Данные были подтверждены с помощью многофакторного регрессионного анализа Кокса, включающего лечение Репариксином, лечение Рапамицином и гликемию реципиента до проведения трансплантации в качестве независимых переменных. Лечебное воздействие Репариксином, как было подтверждено, представляет собой существенный независимый фактор, защищающий трансплантат от потери жизнеспособности (величина отношения вероятностей: 0,252; 95% доверительный интервал: 0,099-0,64; р=0,004), в то время как лечебное воздействие Рапамицином (величина отношения вероятностей: 1,173; 95% доверительный интервал: 0,562-2,45; р=0,67) предшествующая трансплантации гликемия (величина отношения вероятностей: 1,002; 95% доверительный интервал: 0,604-1,661; р=0,99) были незначительными. 4. CXCR1/2 рецепторы, блокированные Репариксином, изменяют воспалительное состояние печени после аллогенной трансплантации островковых клеток Внутрипеченочную популяцию лейкоцитов анализировали в присутствии и в отсутствие лечебного воздействия Репариксина после аллогенной транстплантации островковых клеток в печень у мышей. Островковые клетки (400 EI) Balb/c мышей возраста 12 недель трансплантировали в печень диабетических С 57 мышей (диабет, индуцированный аллоксаном, гликемия больше 450 мг/дл) в присутствии Репариксина, вводимого с помощью подкожной непрерывной инфузии в течение 7 дней, начиная со дня -1,в дозе 8 мг/ч/кг, или при введении плацебо. Мышей умертвляли в день 0, +1, +3, +5, +7, +10, +14 после трансплантации островковых клеток и печень взвешивали в момент вскрытия. Суспензию с концентрацией одиночной клетки готовили из двух долей печени с известной массой и проводили анализ популяции внутрипеченочных лейкоцитов (intrahepatic leukocyte (IHL посредством проточной цитометрии. Клетки окрашивали поверхностно, используя флуоресцеинизотиоцианат (fluorescein isothiocyanate(преимущественно полиморфно-ядерные нейтрофилы (PMN, CD4+/TCR+ (преимущественно Т хелперные клетки), CD8+/TCR+ клетки (преимущественно цитолитические Т-лимфоциты (CTL, NK1.1+/CD3 клетки NK) естественные клетки-киллеры), NK1.1+/CD3+ клетки NKT) естественные Т-клеткикиллеры) и Gr-1-/CD11b+/CD11c- (преимущественно макрофаги), CD115+/CD11b+/Cd11c-(преимущественно моноциты), CD11c+/CD11b+/Gr1- (преимущественно дендритные клетки), CD19 (преимущественно В лимфоциты). Информацию об образцах получали на приборе для проведения проточной цитометрии FACSCalibur и данные анализировали с использованием программного обеспечения CELLQuest(Becton Dickinson Immunocytometry Systems, San Jose, CA). Во второй серии измерений при проведении экспериментов экспрессию CXCR2 и CXCR1 на популяции IHL определяли в момент времени, когда инфильтрация лейкоцитов достигала максимально высокой степени инфильтрации. Полученные результаты подтверждают, что лечебное воздействие Репариксина уменьшает рекрутинг и инфильтрацию лейкоцитов в печени после аллогенной трансплантации. А именно, PMN (фиг. 8) иNKT клетки (фиг. 9), которые представляют собой субпопуляцию лейкоцитов, экспрессирующихCXCR2, подвергаются существенному воздействию, что также можно увидеть на фиг. 10. 5. CXCR2/1 рецепторы, блокированные Репариксином, влияют на долгосрочный результат аллогенной трансплантации островковых клеток после трансплантации островковых клеток в костный мозг Островковые клетки (400 EI) Balb/c мышей возраста 12 недель трансплантировали в костный мозг диабетических С 57 мышей (диабет, индуцированный аллоксаном, гликемия больше 450 мг/дл) в присутствии Репариксина, вводимого посредством подкожной непрерывной инфузии в течение 7 дней, начиная со дня -1, в дозе 8 мг/ч/кг. Контрольной группе мышей вводили плацебо. Первичные конечные точки эксперимента соответствовали способности достижения основной начальной функции, определяемой как уровни содержания глюкозы в крови не натощак, составляющие менее чем 250 мг/дл для двух следующих друг за другом измерений после проведения трансплантации островковых клеток, и время отторжения, определяемое как результаты двух следующих друг за другом измерений уровней содержания глюкозы в крови не натощак, составляющие более чем 350 мг/дл. Полученные результаты подтверждают, что долгосрочный результат улучшался благодаря лечебному воздействию Репариксина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ингибитора CXCR1 и/или CXCR2 для получения адъювантного лекарственного препарата для трансплантата островковых клеток поджелудочной железы для пациентов с диабетом типа 1. 2. Применение по п.1, в котором указанный ингибитор представляет собой соединение формулы I или его фармацевтически приемлемую соль в которой R выбирают из линейного или разветвленного 4-(C1-C6)алкила, 4 трифторметансульфонилокси-группы и 3-бензоила, и R1 представляет собой линейный или разветвленный (C1-C6)алкил. 3. Применение по п.2, в котором фармацевтически приемлемую соль выбирают из лизиновой или натриевой соли. 4. Применение по любому из пп.1-3, в котором указанный лекарственный препарат улучшает приживление трансплантата островковых клеток поджелудочной железы и начальное функционирование трансплантата. 5. Применение по любому из пп.1-4, в котором указанный лекарственный препарат уменьшает частоту неблагоприятного результата для трансплантированных островковых клеток поджелудочной железы. 6. Применение по п.5, в котором указанный лекарственный препарат уменьшает скорость и частоту отторжения трансплантата островковых клеток поджелудочной железы. 7. Применение по п.6, в котором указанный лекарственный препарат увеличивает длительность периода жизнеспособности трансплантата. 8. Применение по любому из пп.1-7, в котором указанное соединение формулы I выбирают из R(-)N-2-[(4-изобутилфенил)пропионил]метансульфонамида и
МПК / Метки
МПК: A61K 31/18, A61P 37/06
Метки: островковых, трансплантата, поджелудочной, ингибиторы, железы, адъювантов, качестве, клеток
Код ссылки
<a href="https://eas.patents.su/11-21298-ingibitory-cxcr1-2-v-kachestve-adyuvantov-transplantata-ostrovkovyh-kletok-podzheludochnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы cxcr1/2 в качестве адъювантов трансплантата островковых клеток поджелудочной железы</a>
Предыдущий патент: Способ изготовления малоусадочного гибкого листа
Следующий патент: Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов
Случайный патент: Способ получения функциональных стеклянных поверхностей путем изменения композиции исходной поверхности