Комбинированное лечение вич-инфекций
Формула / Реферат
1. Фармацевтическая композиция, включающая аловудин и зидовудин в молярном соотношении в интервале от 1:100 до 1:350, где аловудин находится в количестве 2-4 мг и зидовудин находится в количестве 300-900 мг.
2. Фармацевтическая композиция по п.1, где данное соотношение находится в интервале от 1:150 до 1:250, предпочтительно от 1:150 до 1:200.
3. Фармацевтическая композиция по п.1 или 2, дополнительно включающая один или два дополнительных фармацевтических агента.
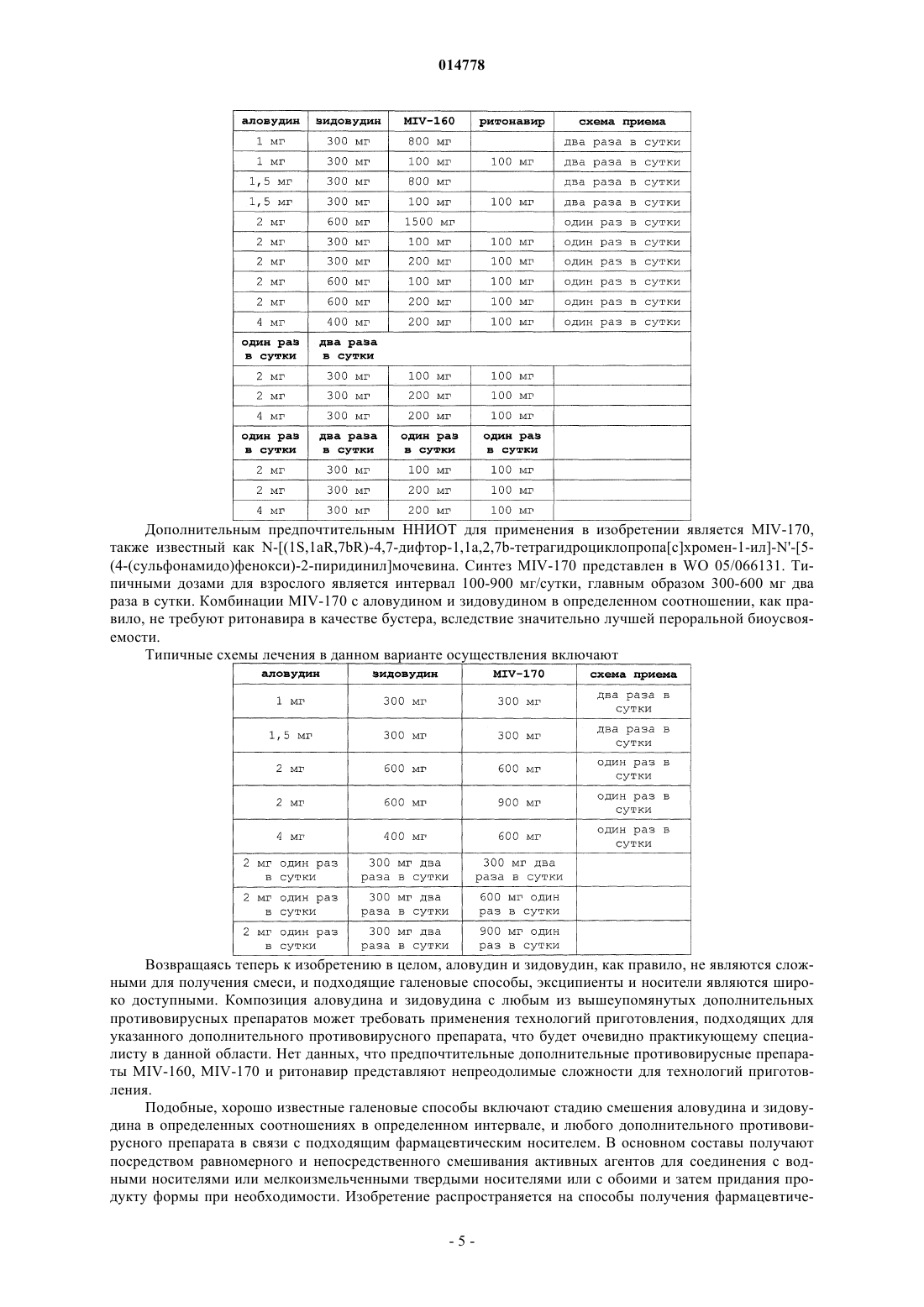
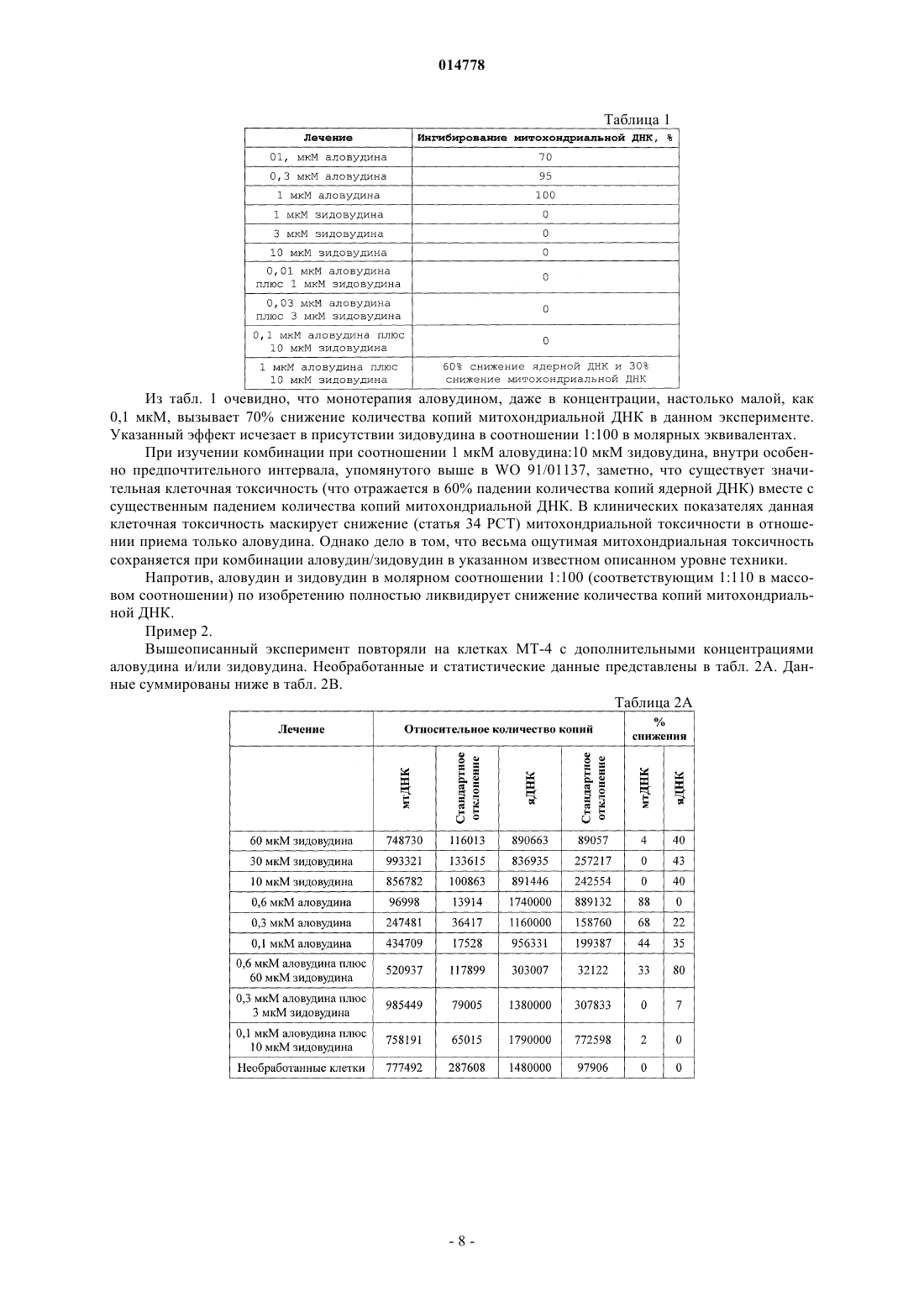
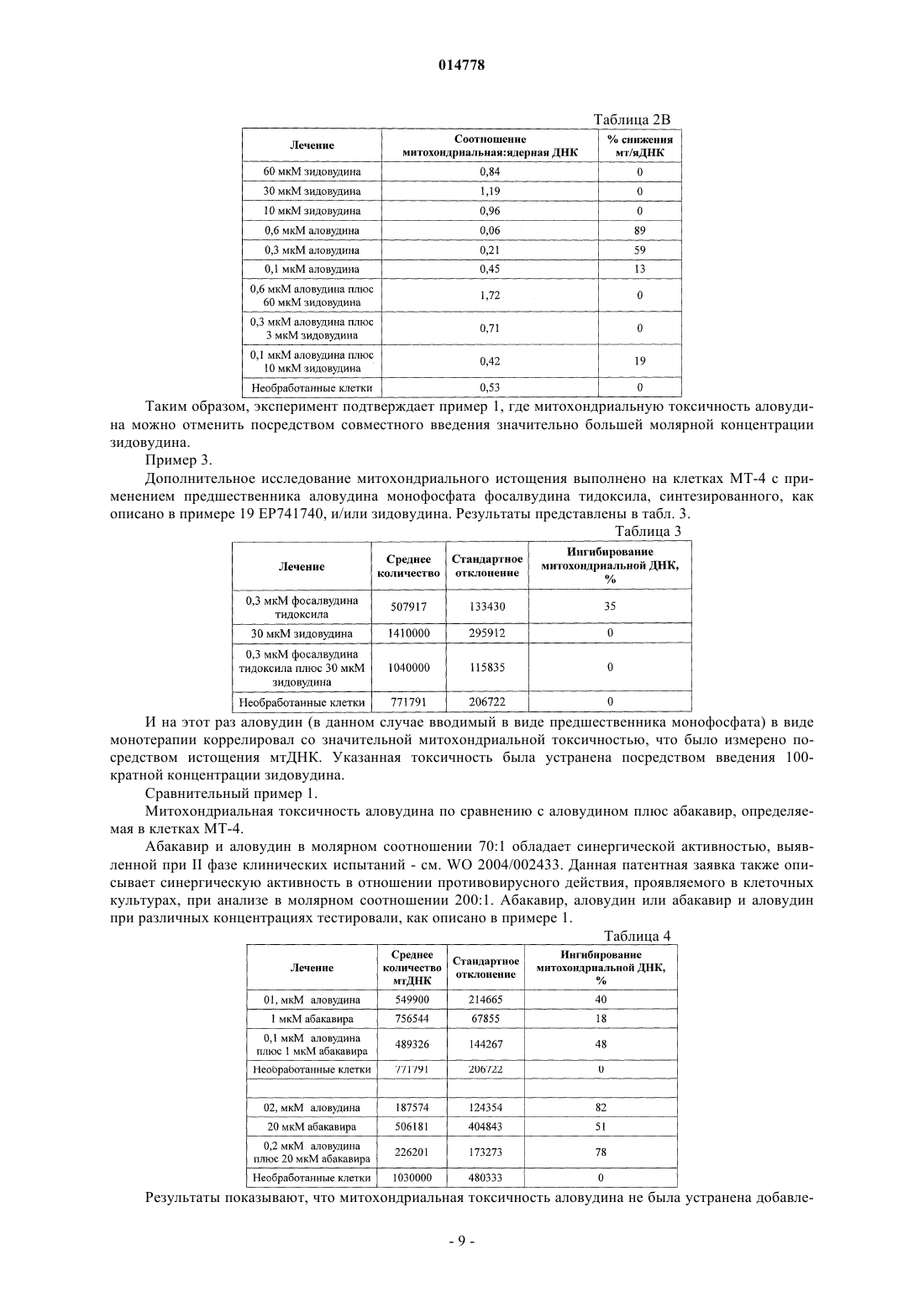
4. Фармацевтическая композиция по п.3, где дополнительный фармацевтический агент является противовирусным препаратом ВИЧ MIV-170; или дополнительный фармацевтический агент является противовирусным препаратом ВИЧ MIV-160, по отдельности или с бустерной дозой ритонавира.
5. Фармацевтическая композиция по любому из предшествующих пунктов, представленная единичной дозированной формой, вводимой один раз в сутки.
6. Фармацевтическая композиция по п.5, включающая 600 мг зидовудина.
7. Фармацевтическая композиция по любому из пп.1-5, где аловудин вводят в виде предшественника аловудина-монофосфата фосалвудина тидоксила.
8. Способ лечения или профилактики ВИЧ, включающий одновременное или последовательное введение аловудина и зидовудина в соотношении в интервале от 1:100 до 1:350.
9. Способ по п.8, где соотношение находится в интервале от 1:150 до 1:250, предпочтительно от 1:150 до 200.
10. Способ по п.8, дополнительно включающий одновременное или последовательное введение одного или двух дополнительных фармацевтических агентов.
11. Способ по п.10, где дополнительные фармацевтические агенты включают противовирусный препарат(ы) ВИЧ MIV-170 или MIV-160 по отдельности или с бустерной дозой ритонавира.
12. Способ по любому из пп.8-11, где аловудин и зидовудин представлены в единичной дозированной форме, вводимой один раз в сутки.
13. Способ по п.12, где единичная дозированная форма включает 2-4 мг аловудина и 300-900 мг зидовудина.
14. Способ по п.13, где единичная дозированная форма включает 600 мг зидовудина.
15. Способ по любому из пп.8-11, где доза аловудина составляет 2-4 мг один раз в сутки и доза зидовудина 300 мг два раза в сутки.
16. Способ по любому из пп.8-15, где аловудин вводят в виде предшественника аловудина монофосфата-фосалвудина тидоксила.
17. Набор из компонентов, включающий:
(i) фармацевтическую композицию, включающую аловудин; и
(ii) фармацевтическую композицию, включающую зидовудин;
характеризующийся тем, что аловудин и зидовудин присутствуют в наборе в молярном соотношении в интервале от 1:100 до 1:350.
Текст
Совместное введение аловудина и зидовудина в соотношениях, значительно превышающих известный уровень техники, полностью или в значительной степени отменяет митохондриальную токсичность аловудина в экспериментах по истощению митохондриальной ДНК. Таким образом,изобретение обеспечивает фармацевтические композиции, включающие аловудин и зидовудин в молярном соотношении в интервале от 1:100 до 1:350, и способы лечения и профилактики многократно резистентного ВИЧ, включающие одновременное или последовательное введение аловудина и зидовудина в определенном молярном соотношении. 014778 Область техники Настоящее изобретение относится к способам лечения ВИЧ и фармацевтическим композициям, где известные противовирусные ВИЧ препараты аловудин и зидовудин вводят в определенном соотношении, необязательно в сочетании с дополнительными противовирусными препаратами. Уровень техники Зидовудин, также известный как AZT или 2',3'-дидезокси-3'-азидотимидин, был первым нуклеозидным аналогом, запатентованным по применению для лечения ВИЧ. Зидовудин ингибирует вирусный фермент обратную транскриптазу, таким образом, блокируя вирусный цикл репликации и эффективно замедляя прогрессирование СПИДа. Когда зидовудин впервые был предложен и предписан как монотерапевтический препарат длительного использования, это было связано с различными патологическими процессами в тканях, характерными для симптомов митохондриальной дисфункции, включая скелетную мышечную миопатию, дилатационную кардиомиопатию и гепатотоксичность. Несмотря на то что его до сих пор широко применяют в сочетании с другими противовирусными препаратами ВИЧ, клиническое применение зидовудина ограничивают токсичность, в частности гематологическая токсичность, и развитие резистентности. Режим введения, принятого на сегодняшний день, состоит из двукратного суточного введения, как правило, 300 мг два раза в сутки (т.е. суточная взрослая доза 600 мг, принятая в виде отдельных 300 мг таблеток утром и вечером). Даже комбинацию стандартных лекарственных форм, таких как Комбивир (зидовудин плюс ламивудин) или Тризивир (зидовудин плюс ламивудин плюс абакавир) нужно применять два раза в сутки. Указанный режим дозирования неудобен даже при благоприятном стечении обстоятельств с точки зрения соблюдения пациентом схемы лечения. Однако для пациентов с ВИЧ он еще более неудобен, так как прописанный многим пациентам зидовудин необходимо принимать с дополнительными противовирусными лекарственными средствами ВИЧ, такими как ингибиторы протеаз и/или ненуклеозидные ингибиторы, или симптоматическими лекарственными средствами, такими как противогрибковые средства,противоцитомегаловирусные препараты, психотропные препараты или иммуностимуляторы. Указанные дополнительные фармацевтические средства часто принимают с разной периодичностью (раз в сутки,три раза в сутки и т.д.) по отношению к зидовудину, что приводит к очень сложным схемам приема таблеток с недостаточным соблюдением пациентом схемы лечения. Например, не редкость, когда пациенты с продвинутыми стадиями ВИЧ должны принимать пилюли в количестве, превышающем 15-20 таблеток в сутки, в разные моменты времени в течение суток, некоторые натощак и некоторые с приемом пищи, и при разном количестве таблеток в разный период времени. Несоблюдение схем лечения является критически важным в случае ВИЧ, когда вследствие плохой способности к репарации репродуктивной машины ВИЧ легко возникают мутированные формы, устойчивые к лекарственному средству. Селекция и размножение мутированных форм, устойчивых к лекарственному средству, значительно увеличивается, если минимальные уровни лекарственных препаратов ВИЧ в сыворотке и внутриклеточные уровни нуклеозидных трифосфатов падают ниже определенной пороговой величины. Указанное событие довольно быстро происходит у пациентов с ВИЧ, если не следовать предписанной схеме дозирования в точности. Аловудин (также известный как FLT или 2',3'-дидезокси-3'-фтортимидин) в начале 1990-х считали перспективным противовирусным препаратом ВИЧ в клинических разработках. Его испытания были остановлены после выявленной гематологической токсичности, зависимой от дозы, у инфицированных вирусом пациентов. На основании экспериментов на клеточных линиях, указанная гемопоэтическая токсичность объяснена за счет фрагментации ДНК и апоптоза (Sundseth et al. Antimicrob Ag Chemother,1996, 40(2): 331-335). Однако недавние исследования выявили, что токсичность аловудина является следствием ингибирования синтеза митохондриальной ДНК. Международная патентная заявка WO 91/01137, поданная до того, как первоначальные разработки аловудина были прекращены, описывает синергический противовирусный эффект сочетаний 3'фторсодержащих противовирусных препаратов, таких как FLT (теперь известный как МНН аловудин) и определенных 2',3'-дидезоксинуклеотидов, включая AZT (теперь известный как МНН зидовудин). В патентной заявке приводят пример комбинаций в соотношениях AZT:FLT 1:1 и 8:1 в экспериментах на животных и in vitro. Из патентной заявки становится понятно, что предпочтительным является введениеFLT и AZT в основном в эквивалентных количествах. Например, с. 5, строка 16 патентной заявки демонстрирует, что предпочтительный диапазон соотношения FLT к AZT, дающий синергический эффект, составляет от 10:1 до 1:20, с оптимальным диапазоном от 1:1 до 1:10 FLT:AZT. Табл. 1 WO 91/01137 показывает, что соотношение 1:1 FLT:AZT обладает наивысшим терапевтическим индексом IC50/IC50 относительно соотношения 1:8 FLT:AZT, что измерено посредством иммунофлуоресцентного исследования и сравнения терапевтического индекса, что измерено посредством ELISA. Международная патентная заявка WO 2004/002433 описывает альтернативную комбинацию аловудина и другого НИОТ под названием абакавир. Синергическую активность в отношении вирусной редукции определяли в клинических исследованиях на пациентах, инфицированных ВИЧ, где пациентам прописывали 7,5 мг аловудина 1 раз в сутки, в качестве дополнения к существующим противоретрови-1 014778 русным схемам лечения. План исследования и общие результаты описаны в Katlama et al. AIDS 2004 18(9): 1299-1304. В частности, отмечается, что пациентов, уже проходивших лечение зидовудином, исключали, так как было предположение, что близкое структурное сходство аловудина и зидовудина может привести к дополнительной гематологической токсичности. Абакавир, как правило, вводили 300 мг два раза в сутки или 600 мг один раз в сутки. Это соответствует молярному соотношению аловудина к абакавиру 1:70. Синергизм противовирусного препарата подтвержден в описании патента на клеточных культурах в молярном соотношении 1:200. Однако ни клеточную, ни митохондриальную токсичность комбинации не измеряли. Как представлено в настоящем описании в сравнительных примерах, уровни аловудин:абакавир в среднем молярном соотношении не могут изменять митохндриальную токсичность аловудина. Взаимодействие нуклеозидных ингибиторов обратной транскриптазы, в особенности в отношении митохондриальной токсичности, является сложным и малопонятным явлением. В весьма обширной серии исследований, доложенных Vidal et al. Antimicrob Ag Chemother, 2006, 50(11): 3824-3832, показано,что НИОТ тенофовир значительно увеличивает митохондриальную токсичность (что измеряется истощением мтДНК) диданозина (ДДИ). В соотношении 3 мкМ диданозина:30 мкМ тенофовира (т.е. 1:10 в молях) снижение мтДНК составляло приблизительно 80% и больше 90% при высоких молярных концентрациях. Напротив, тенофовир не влияет на митохондриальную токсичность зидовудина при тестировании 3, 40 и 200 мкМ зидовудина к 30 мкМ тенофовира (т.е. 1:10, приблизительно 1:1 и приблизительно 6,5:1). Краткое описание изобретения В настоящее время авторами обнаружено, что совместное введение аловудина и зидовудина при определенном интервале соотношений, достаточно отличном от известного из уровня техники, вызывает взаимодействие с неожиданно сниженной митохондриальной токсичностью, в то же время с сохранением синергического действия противовирусного препарата аловудина и зидовудина. В соответствии с первым аспектом изобретение относится к способу лечения или профилактики ВИЧ, включающему одновременное или последовательное введение аловудина и зидовудина в молярном соотношении в диапазоне от 1:100 до 1:350. Соответственно способ включает введение безопасного и эффективного количества аловудина и зидовудина нуждающемуся в этом субъекту, способствуя, таким образом, лечению или предотвращению ВИЧ. Связанный аспект изобретения относится к использованию аловудина и зидовудина в производстве лекарственных препаратов для одновременного или последовательного введения, в соответствии с которым лекарственные препараты находятся в поддерживаемой дозе в соотношениях от 1:100 до 1:350 аловудина к зидовудину. Связанный аспект относится к использованию аловудина и зидовудина при одновременном или последовательном введении для лечения или профилактики ВИЧ. Второй аспект изобретения относится к фармацевтической композиции, предназначенной для использования в указанном способе и включающей аловудин и зидовудин в молярном соотношении в диапазоне от 1:100 до 1:350. Таким образом, также обеспечен набор из компонентов, включающий фармацевтическую композицию, включающую аловудин, и фармацевтическую композицию, включающую зидовудин, характеризующийся тем, что аловудин и зидовудин присутствуют в наборе в молярном соотношении в диапазоне от 1:100 до 1:350. Соответственно набор из компонентов дополнительно включает инструкции, предписывающие одновременное или последовательное введение фармацевтической композиции, включающей аловудин, и фармацевтической композиции, включающей зидовудин, для лечения или профилактики ВИЧ. Комбинации по изобретению смягчают недостатки известного уровня техники лечения зидовудином и аловудином и комбинации зидовудин/аловудин, в особенности в отношении снижения митохондриальной токсичности, и таким образом, увеличивая безопасность, лучшее соблюдение пациентом схемы лечения, поддерживая постоянные минимальные суточные концентрации препарата и уменьшая образование мутированных форм, устойчивых к лекарственному средству. Несмотря на нежелание ограничиваться теорией, предварительные данные авторов свидетельствуют, что принятие определенного соотношения между аловудином и зидовудином позволяет зидовудину препятствовать механизмам митохондриального транспорта, таким образом, предохраняя активный метаболит аловудин трифосфат от негативного взаимодействия с особенно чувствительной митохондриальной ДНК полимеразой. Данный положительный эффект ранее не был описан в известном уровне техники комбинаций AZT/FLT, так как он был замаскирован клеточной токсичностью и уменьшением митохондриальной ДНК, вызванными последовательными эквимолярными количествами двух нуклеозидов. В отличие от прототипных комбинаций WO 91/01137, которые предлагали дозы аловудина от 0,1 до 1 мг/кг/сутки в сочетании с дозами зидовудина 1-10 мг/кг/сутки, настоящее изобретение предусматривает дозы аловудина в порядке от 0,005 до 0,05 мг/кг/сутки в сочетании с соответствующей дозой аловудина 1-10 мг/кг/сутки. Более поздние клинические исследования свидетельствуют, что соотношение 1:10,предпочитаемое в WO 91/01137, на основе эффективной дозы зидовудина, вызывает токсический уро-2 014778 вень аловудина и/или зидовудина. В композициях и способах изобретения с удобством применяют аловудин и зидовудин в соотношении в диапазоне от 1:150 до 1:250, так и внутри такого диапазона в интервале от 1:150 до 1:200. Как правило, максимальная суточная доза аловудина приблизительно составляет 4 мг/сутки для взрослого массой 70 кг. Таким образом, схемы дозирования в соответствии со способом по изобретению,как правило, включают дозу аловудина в интервале 2-4 мг в сутки и дозу зидовудина в интервале 300-900 мг в сутки. В частности, предпочтительные схемы для взрослого включают суточную дозу аловудина в интервале 2-3 мг/сутки, такую как 2 или 2,5 мг. В настоящее время предпочтительные схемы для взрослого составляют суточную дозу зидовудина в интервале 450-600 мг, главным образом 600 мг. Суточная доза из 2,5 мг аловудина и 600 мг зидовудина соответствует в молярном соотношении 1:218, принимая молекулярную массу аловудина за 244 и молекулярную массу зидовудина за 269. Совместное введение аловудина и зидовудина в определенном интервале соотношения можно проводить последовательно или главным образом последовательно, например вводить и аловудин, и зидовудин, как отдельную дозированную единицу, как правило, в виде капсулы или таблетки либо одной из них. Зидовудин, как правило, принимают два раза в сутки, например 300 мг два раза в сутки. Однако часто предпочтительней давать аловудин один раз в сутки, таким образом, удобное последовательное введение в варианте осуществления изобретения может включать 300-мг таблетку зидовудина и 2-, 3 или 4-мг таблетку аловудина утром и 300-мг таблетку зидовудина вечером (или наоборот). Для упрощения схемы дозирования таблеток альтернативный, но в настоящее время менее предпочитаемый вариант осуществления может включать введение 300-мг таблетки или капсулы зидовудина и 1-, 1,5- или 2-мг таблетки или капсулы, содержащей аловудин, сглатываемые вместе или в непосредственной последовательности утром и вечером. Последовательно вводимые лекарственные формы, такие как те, что описаны непосредственно в предыдущем абзаце, могут находиться в отдельных упаковках, таких как соответствующие картонные упаковки, каждая из которых содержит блистерную упаковку таблеток зидовудина или блистерную упаковку таблеток аловудина. Дополнительный пример может включать отдельные флаконы зидовудина и капсулы или таблетки аловудина. По меньшей мере один из флаконов или картонных упаковок, как правило, включает вкладыш или другую напечатанную инструкцию с рекомендацией совместного введения аловудина с зидовудином в определенном соотношении от 1:100 до 1:350. Однако удобным является общая картонная упаковка, содержащая как блистерную упаковку, содержащую аловудин, так и блистерную упаковку, содержащую зидовудин. В предпочтительной последовательно вводимой лекарственной форме соответствующие таблетки или капсулы аловудина и зидовудина находятся в одной и той же блистерной упаковке в пространственном расположении, обеспечивающем визуальную помощь в правильном дозировании соответствующих компонентов. Например, если предполагаемая доза аловудина составляет 2, 3 или 4 мг один раз в сутки и доза зидовудина составляет 300 мг два раза в сутки, один ряд таблеток аловудина в блистерной упаковке может быть расположен параллельно двум рядам, каждый из которых имеет такой же номер таблеток зидовудина. Таким образом, это облегчает пациенту решение о том, следует или нет принимать в данном случае и аловудин, и зидовудин или только зидовудин. Индивидуальный блистерный отсек на блистерной упаковке можно маркировать шкалой, такой как дни недели, для дополнительной помощи в соблюдении схемы лечения. Однако предпочтительно нахождение аловудина и зидовудина в общей стандартной лекарственной форме, такой как капсула или драже или более предпочтительно таблетка. Единичная дозированная форма может быть адаптирована для введения два раза в сутки, т.е. с половиной предполагаемой суточной дозой компонентов аловудина и зидовудин в каждой дозированной единице, предполагая, что в случае приема дозы вводят единственную таблетку или капсулу. Единичная дозированная форма в соответствии с данным вариантом осуществления включает капсулу или таблетку, содержащую 300 мг зидовудина и 1 или 1,25 мг аловудина. Если схема дозирования требует одновременного проглатывания множества идентичных единиц доз (как в случае комбинации лопинавира/ритонавира Kaletra, который, как правило, вводят в виде двух мягких таблеток, каждая из которых содержит 133 мг лопинавира и 33 мг ритонавира три раза в сутки), то соответствующим образом определяют количество аловудина и зидовудина в каждой единице дозы. Альтернативно, единичную дозированную форму адаптируют для приема один раз в сутки. Однократный суточный прием облегчает для больного соблюдение схемы лечения и в то же время уменьшает токсичность и обеспечивает синергическое действие противовирусного препарата. Таблетка или капсула,предназначенная для взрослого, таким образом, может включать 2-4 мг аловудина и 300-600 мг зидовудина. Предпочтительные единичные дозированные формы включают 2 мг аловудина и 300, 400, 500 мг или, главным образом, 600 мг зидовудина; 2,5 мг аловудина и 300, 400, 500 или, главным образом, 600 мг зидовудина; 3 мг аловудина и 300, 400, 500 мг или, главным образом, 600 мг зидовудина; или 4 мг алову-3 014778 дина и 300, 400, 500 мг или, главным образом, 600 мг зидовудина. Как принято в случае ВИЧ-терапии, где комбинированное лечение является больше правилом, чем исключением, способы и фармацевтические композиции по изобретению могут дополнительно содержать один или два дополнительных фармацевтических агента, в частности, дополнительные противовирусные препараты ВИЧ. Дополнительный противовирусный препарат ВИЧ или противовирусные препараты могут принадлежать к любым классам по механизму действия, таким как нуклеозидные ингибиторы обратной транскриптазы (НИОТ), ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ),ингибиторы протеаз (ИП), ингибиторы интеграз, ингибиторы слияния, ингибиторы созревания и т.п. Дополнительные противовирусные препараты ВИЧ, как правило, совместно вводят или совместно назначают в общепринятых для них дозах. Типичные НИОТ включают ставудин (d4T, Зерит), зальцитабин (ddC), диданозин (ddI, Видекс),абакавир (ABC, Зиаген), ламивудин (3 ТС, Эпивир), эмтрицитабин (FTC, Эмтрива), рацевир (рацемический FTC), адефовир (ADV), энтекавир (BMS 200475), аловудин (FLT), тенофовир дизопроксил фумарат(RVT, D-D4FC, DPC-817 от Pharmasset). Типичные ННИОТ включают делавирдин (Рескриптор), эфавиренц (DMP-266, Сустива), невирапинYM215389 (Yamanoushi). Типичные ингибиторы ВИЧ протеаз включают ВЕА-403 (Medivir), PA-457 (Panacos), KPC-2 (KuceraPharm.), 5 HGTV-43 (Enzo Biochem), ампренавир (VX-478, Агенераза), атазанавир (Реятаз), индинавира сульфат (МК-639, Криксиван), Лексива (фосампренавир кальция, GW-433908 или 908, VX-175), ритонавир (Норвир), лопинавир плюс ритонавир (АВТ-378, Калетра), типранавир, нелфинавира мезилат (Вирасепт), саквинавир (Инвираза, Фортоваза), AG1776 (JE-2147, KNI-764; Nippon Mining Holdings), AG-1859(Narhex), P(PL)-100 (P-1946; Procyon Biopharma), P-1946 (Procyon Biopharma), R-944 (Hoffmann-LaRoche),RO-0334649 (Hoffmann-LaRoche), TMC-114 (JohnsonJohnson), VX-385 (GW640385; GSK/Vertex), VX478 (Vertex/GSK). Другие ВИЧ противовирусные препараты включают ингибиторы входа, включая ингибиторы слияния, ингибиторы CD4 рецептора, ингибиторы CCR5 сорецептора и ингибиторы CXCR4 сорецептора или их фармацевтически пригодная соль либо предшественник. Примерами ингибиторов входа являютсяSchering-Plough), T-1249 (R724; Roche/Trimeris), TAK-220 (Takeda Chem. Ind.), TNX-355 (Tanox) и UK427857 (Pfizer). Примерами ингибиторов интеграз являются L-870810 (MerckCo.), c-2507 (MerckCo.) и S(RSC)-1838 (Shionogi/GSK). В настоящее время предпочтительным дополнительным противовирусным препаратом для применения в способах и фармацевтических композициях по изобретению является MIV-160, также известный как цис-1-(5-цианопиридин-2-ил)-3-(4,7-дифтор-1,1 а,2,7b-тетрагидроциклопропа[с]хромен-1 ил)мочевина. Синтез MIV-160 описан в WO 02/070516. Пригодные дозы для взрослых включают 2501500 мг, такие как 400 или 800 мг, как правило, один или два раза в сутки. Варианты осуществления изобретения, включающие MIV-160, удобно применять совместно с антагонистами цитохромов, в частности с ингибитором Сур 450 3 А 4, таким как сок грейпфрута, или более предпочтительно с ритонавиром. Ритонавир является ингибитором протеаз, уже зарегистрированным для лечения ВИЧ, с рекомендованной дозой для взрослого 600 мг два раза в сутки, но при использовании в качестве бустера в значительно меньшей дозе, как правило, 100 или 200 мг два раза в сутки. Применение бустера позволяет, как правило, снижать дозу MIV-160. Типичные варианты осуществления единичных доз в данном аспекте изобретения включают таблетки, содержащие Дополнительным предпочтительным ННИОТ для применения в изобретении является MIV-170,также известный как N-[(1S,1aR,7bR)-4,7-дифтор-1,1a,2,7b-тетрагидроциклопропа[с]хромен-1-ил]-N'-[5(4-(сульфонамидо)фенокси)-2-пиридинил]мочевина. Синтез MIV-170 представлен в WO 05/066131. Типичными дозами для взрослого является интервал 100-900 мг/сутки, главным образом 300-600 мг два раза в сутки. Комбинации MIV-170 с аловудином и зидовудином в определенном соотношении, как правило, не требуют ритонавира в качестве бустера, вследствие значительно лучшей пероральной биоусвояемости. Типичные схемы лечения в данном варианте осуществления включают Возвращаясь теперь к изобретению в целом, аловудин и зидовудин, как правило, не являются сложными для получения смеси, и подходящие галеновые способы, эксципиенты и носители являются широко доступными. Композиция аловудина и зидовудина с любым из вышеупомянутых дополнительных противовирусных препаратов может требовать применения технологий приготовления, подходящих для указанного дополнительного противовирусного препарата, что будет очевидно практикующему специалисту в данной области. Нет данных, что предпочтительные дополнительные противовирусные препараты MIV-160, MIV-170 и ритонавир представляют непреодолимые сложности для технологий приготовления. Подобные, хорошо известные галеновые способы включают стадию смешения аловудина и зидовудина в определенных соотношениях в определенном интервале, и любого дополнительного противовирусного препарата в связи с подходящим фармацевтическим носителем. В основном составы получают посредством равномерного и непосредственного смешивания активных агентов для соединения с водными носителями или мелкоизмельченными твердыми носителями или с обоими и затем придания продукту формы при необходимости. Изобретение распространяется на способы получения фармацевтиче-5 014778 ской композиции, включающие смешивание аловудина и зидовудина в определенном интервале характерных соотношений, и необязательно одного или двух дополнительных противовирусных препаратов,вместе или в связи с фармацевтически пригодным носителем или средой. Если производство фармацевтических составов включает тщательное перемешивание фармацевтических эксципиентов и активный ингредиент присутствует в форме соли, то часто предпочтительным является применение эксципиентов,которые являются неосновными по своей природе, т.е. или кислотными, или нейтральными. Составы для перорального введения по настоящему изобретению могут присутствовать в качестве отдельных форм, таких как капсулы, пилюли или таблетки, каждая из которых содержит заданное количество активного агента. Альтернативно, они могут присутствовать в качестве порошка или гранул; в качестве раствора или суспензии активного агента в водной жидкости или неводной жидкости; или в качестве жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле, в качестве шарика и т.д. По отношению к композициям для перорального введения (например, таблетки и капсулы) термин"приемлемый носитель" включает среды, такие как обычные эксципиенты, например связывающие агенты, такие как сироп, камедь, желатин, сорбит, трагакант, поливинилпирролидон (Повидон), метилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, сахароза и крахмал; наполнители и носители, например кукурузный крахмал, желатин, лактоза, сахароза, микрокристаллическая целлюлоза, каолин, маннит, дикальций фосфат, хлорид натрия и альгиновая кислота; и смазывающие вещества, такие как стеарат магния, стеарат натрия и другие стеараты металлов, стеарат глицерина, стеариновая кислота, кремнийорганическая жидкость, тальковый воск, масла и коллоидный диоксид кремния. Также можно использовать вкусовые вещества, такие как масло мяты перечной, винтергреневое масло, вишневый ароматизатор или т.п. Может быть желательным добавление подкрашивающего агента для придания лекарственной форме более простой идентификации. Таблетки также могут быть покрыты с помощью способов, хорошо известных в данной области. Таблетку можно получать посредством компрессии или прессования, необязательно с одним или несколькими вспомогательными ингредиентами. Компрессионные таблетки можно получить посредством компрессии в подходящем приборе активного агента в свободной текучей форме, такой как порошок или гранулы, необязательно смешивая со связывающим веществом, смазывающим веществом, инертным растворителем, консервантом, поверхностно-активным или диспергирующим агентом. Спрессованные таблетки могут быть получены посредством прессования в подходящем приборе смеси порошкообразного соединения, увлажненного инертным жидким растворителем. Таблетки могут быть необязательно покрыты или помечены и могут быть приготовлены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение активного агента. Другие составы, пригодные для перорального введения, включают таблетки для рассасывания,включающие активный агент в ароматизированном основании, как правило, сахарозе и камеди или трагаканте; пастилы, включающие активный агент в инертном основании, таком как желатин и глицерин или сахароза и камедь; и жидкости для полоскания рта, включающие активный агент в пригодном жидком носителе. Аловудин и/или зидовудин можно назначать в качестве свободного нуклеозида или их обычных фармацевтически приемлемых солей или гидроксидов. Обычные соли включают соли, полученные посредством добавления кислоты, такие как гидрохлорид, гидробромид, цитрат, тозилат и малеат, и соли,полученные из фосфорной или серной кислоты. В другом аспекте пригодные соли являются основными солями, такими как соли щелочных металлов, например натрия или калия, соли щелочно-земельных металлов, например кальция или магния, или органические аминовые соли, например триэтиламина. Примеры сольватов включают гидроксиды. Альтернативно, аловудин и/или зидовудин можно назначать в виде предшественника лекарственного средства, который высвобождает in vivo аловудин/зидовудин или аловудина/зидовудина монофосфат. Обычные нуклеозидные предшественники лекарственного средства, высвобождающие нуклеозид in vivo,включают 5'-алкил сложные эфиры, такой как ацетил, пивалоил, или стеароил, или 5'-амино сложные эфиры, такой как L-валил, L-изолейцил или L-лактил-L-валил эфир. Предшественники лекарственного средства, высвобождающие in vivo зидовудина монофосфат, включают фозивудин, такой как фозивудин тидоксил. Предшественники лекарственного средства, высвобождающие in vivo аловудин, включают аналоги фозивудина, описанные в ЕР 350287, ЕР 545966, ЕР 741740 и ЕР 763049, как фосалвудин тидоксил где n равно 11, m равно 9 и R представляет F (фосалвудин) или N3 (фозивудин). Ссылки на аловудин и зидовудин в настоящем описании и формуле изобретения также относятся к подобным солям, гидроксидам и предшественникам, где массовые количества (такие как суточные дозы), как правило, корректируют в сторону повышения в соответствии с увеличением молекулярной мас-6 014778 сы относительно свободного нуклеозида. В настоящее время зидовудин относится к дженерикам и общедоступен в своей фармацевтической категории от многих производителей во всем мире. Аловудин синтезируют удобным способом с использованием алюминия или железа, катализирующих ангидронуклеозидные реакции, описанные в ЕР 470355 или в его аналогах либо в WO 94/26762. Фозивудин и фосалвудин получают, как описано в патентах, упомянутых выше. Синтез MIV-160 и MIV-170 проводят, как указано выше. Подробное описание вариантов осуществления Здесь будут описаны различные аспекты изобретения посредством изображений со ссылками на следующие неограничивающие примеры. Митохондриальная токсичность, определяемая в экспериментах на клеточных линиях. Эксперименты, описанные ниже, проведены для разъяснения механизмов ингибирования синтеза митохондриальной ДНК, происходящее после введения аловудина, зидовудина или обоих. Несколько пригодных клеточных линий, которые поддерживают рост ВИЧ, являются легко доступными, включая клеточную линию СЕМ 174, полученную из Шведского института контроля инфекционных заболеваний(SMI) Швеция, МТ-4 (коммерчески доступная) и Hep G2 (коммерчески доступная). Коротко, 100 мкл клеток высевают в 96-луночный планшет в концентрации 1104 клеток/мл, культивируют при экспоненциальном росте в среде RPMI 1640 (от Gibco) с 10% эмбриональной телячьей сывороткой, инактивированной нагреванием (от Gibco), и пенициллином-стрептомицином (от Gibco). Среду меняют каждые 3 или 4 суток и пересевают клетки один раз в неделю в разведении 1:10. Все культуры стандартным образом проверяют на микоплазменную инфекцию и выращивают при 37 С во влажной атмосфере с 5% CO2. Все тестируемые лекарственные средства сначала разводили до 10 мМ в диметилсульфоксиде(ДМСО) перед дальнейшим разведением до нужной концентрации в среде для культивирования. Анализ митохондриальной ДНК выполняли с помощью способа Taqman, как описано ранее (Zhang, H. et al. Mol.Pharmacol., 1994, 46: 1063-1069), с модификациями, как и в кратком изложении ниже. В течение серии периодов времени клетки обрабатывали тестируемыми лекарственными средствами, такими как аловудин, фосалвудин, зидовудин, абакавир и т.п., или различными комбинациями аловудин/фосалвудин и зидовудин/абакавир. Различные соотношения показаны в соответствующих таблицах. После 14 суток воздействия лекарственного средства клетки собирали. Тотальную клеточную ДНК получали посредством набора QiAampDNA blood Mini kit (QIAGEN, Chatsworth, CA), следуя инструкциям протокола фирмы-производителяQiagene BloodBody Fluid Spin Protocol, и при условии амплификации ДНК. Пробы митохондриальной ДНК Taqman и человеческой ядерной ДНК получали в Applied Biosystems, в которых используется принцип внутреннего гашения пробы ДНК, с применением флуоресцентного резонансного переноса энергии (FRET) для получения спектральной реакции вследствие 5'3' экзонуклеазной активности ДНК Taq-полимеразы во время амплификации ДНК. Данный процесс применяют в исследовании на основе ПЦР с использованием технологии лазерного сканирования для излучения флуоресцентных красителей, присутствующих в сконструированных определенным образом пробахTaqMan: проба митохондриальной ДНК, соответствующая D-петле, 5'-флуоресцентная метка, 6-FAMACG CTG GAG CCG GAG-MGBNFQ; проба ядерной ДНК, соответствующая 18S рибосомальной РНК,5'-флуоресцентная метка, 6'-FAM-TCG AAC GTC TGC CC-MGBNFQ, совместно с парой праймеров для амплификации ДНК (прямой праймер митохондриальной ДНК: 5'-САС GCG ATA GCA TTG CGA-3' и обратный праймер митохондриальной ДНК: 5'-AGG ААТ САА AGA CAG ATA CTG CGA-3'. Прямой праймер ядерной ДНК: 5'-GCG GCG ACG АСС СА-3' и обратный праймер клеточной ядерной ДНК: 5'GGC GAC TAC CAT CGA AAG TTG-3') . Вышеописанное является полностью собранной системой детекции ПЦР в режиме реального времени при помощи ABI PRISM 7700 и реактивов TaqMan для флуоресцентного 5'-нуклеазного анализа. Клеточный рост контролировали посредством клеточной ядерной ДНК (16S рибосомальная ДНК). Результат митохондриального анализа вычисляют в виде процентов ингибирования митохондриальной ДНК и клеточной ядерной ДНК по сравнению с контролем (без воздействия лекарственного средства). Пример 1. Вышеописанное исследование проводили на клеточной линии МТ 4 из Т-лимфоцитов. Монотерапию аловудином или зидовудином или комбинированное лечение комбинациями аловудина и зидовудина проводили в молярных концентрациях, приведенных в табл. 1. Из табл. 1 очевидно, что монотерапия аловудином, даже в концентрации, настолько малой, как 0,1 мкМ, вызывает 70% снижение количества копий митохондриальной ДНК в данном эксперименте. Указанный эффект исчезает в присутствии зидовудина в соотношении 1:100 в молярных эквивалентах. При изучении комбинации при соотношении 1 мкМ аловудина:10 мкМ зидовудина, внутри особенно предпочтительного интервала, упомянутого выше в WO 91/01137, заметно, что существует значительная клеточная токсичность (что отражается в 60% падении количества копий ядерной ДНК) вместе с существенным падением количества копий митохондриальной ДНК. В клинических показателях данная клеточная токсичность маскирует снижение (статья 34 РСТ) митохондриальной токсичности в отношении приема только аловудина. Однако дело в том, что весьма ощутимая митохондриальная токсичность сохраняется при комбинации аловудин/зидовудин в указанном известном описанном уровне техники. Напротив, аловудин и зидовудин в молярном соотношении 1:100 (соответствующим 1:110 в массовом соотношении) по изобретению полностью ликвидирует снижение количества копий митохондриальной ДНК. Пример 2. Вышеописанный эксперимент повторяли на клетках МТ-4 с дополнительными концентрациями аловудина и/или зидовудина. Необработанные и статистические данные представлены в табл. 2 А. Данные суммированы ниже в табл. 2 В. Таблица 2 А Таким образом, эксперимент подтверждает пример 1, где митохондриальную токсичность аловудина можно отменить посредством совместного введения значительно большей молярной концентрации зидовудина. Пример 3. Дополнительное исследование митохондриального истощения выполнено на клетках МТ-4 с применением предшественника аловудина монофосфата фосалвудина тидоксила, синтезированного, как описано в примере 19 ЕР 741740, и/или зидовудина. Результаты представлены в табл. 3. Таблица 3 И на этот раз аловудин (в данном случае вводимый в виде предшественника монофосфата) в виде монотерапии коррелировал со значительной митохондриальной токсичностью, что было измерено посредством истощения мтДНК. Указанная токсичность была устранена посредством введения 100 кратной концентрации зидовудина. Сравнительный пример 1. Митохондриальная токсичность аловудина по сравнению с аловудином плюс абакавир, определяемая в клетках МТ-4. Абакавир и аловудин в молярном соотношении 70:1 обладает синергической активностью, выявленной при II фазе клинических испытаний - см. WO 2004/002433. Данная патентная заявка также описывает синергическую активность в отношении противовирусного действия, проявляемого в клеточных культурах, при анализе в молярном соотношении 200:1. Абакавир, аловудин или абакавир и аловудин при различных концентрациях тестировали, как описано в примере 1. Таблица 4 Результаты показывают, что митохондриальная токсичность аловудина не была устранена добавле-9 014778 нием НИОТ абакавира при низких или высоких молярных соотношениях (1:10 аловудин:абакавир или 1:100 аловудин или абакавир). Это предполагает, что синергизм, который был достигнут в отношении противовирусного действия, не имел общих механизмов с антагонизмом в митохондриальной токсичности. Все ссылки, включая патент и патентные заявки, на которые ссылаются в настоящем патенте, включены в настоящее описание в качестве ссылки в полном объеме, который возможен. Для всего содержания описания и формулы изобретения, следующей далее, если только иное не требуется по контексту, слово "включать" и вариации, такие как "включает" и "включающий", подразумевают включение обозначенного целого числа, или этапа, или группы целых чисел, но не исключая какого-либо другого целого числа, или этапа, или группы целых чисел, или этапов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая аловудин и зидовудин в молярном соотношении в интервале от 1:100 до 1:350, где аловудин находится в количестве 2-4 мг и зидовудин находится в количестве 300-900 мг. 2. Фармацевтическая композиция по п.1, где данное соотношение находится в интервале от 1:150 до 1:250, предпочтительно от 1:150 до 1:200. 3. Фармацевтическая композиция по п.1 или 2, дополнительно включающая один или два дополнительных фармацевтических агента. 4. Фармацевтическая композиция по п.3, где дополнительный фармацевтический агент является противовирусным препаратом ВИЧ MIV-170; или дополнительный фармацевтический агент является противовирусным препаратом ВИЧ MIV-160, по отдельности или с бустерной дозой ритонавира. 5. Фармацевтическая композиция по любому из предшествующих пунктов, представленная единичной дозированной формой, вводимой один раз в сутки. 6. Фармацевтическая композиция по п.5, включающая 600 мг зидовудина. 7. Фармацевтическая композиция по любому из пп.1-5, где аловудин вводят в виде предшественника аловудина-монофосфата фосалвудина тидоксила. 8. Способ лечения или профилактики ВИЧ, включающий одновременное или последовательное введение аловудина и зидовудина в соотношении в интервале от 1:100 до 1:350. 9. Способ по п.8, где соотношение находится в интервале от 1:150 до 1:250, предпочтительно от 1:150 до 200. 10. Способ по п.8, дополнительно включающий одновременное или последовательное введение одного или двух дополнительных фармацевтических агентов. 11. Способ по п.10, где дополнительные фармацевтические агенты включают противовирусный препарат(ы) ВИЧ MIV-170 или MIV-160 по отдельности или с бустерной дозой ритонавира. 12. Способ по любому из пп.8-11, где аловудин и зидовудин представлены в единичной дозированной форме, вводимой один раз в сутки. 13. Способ по п.12, где единичная дозированная форма включает 2-4 мг аловудина и 300-900 мг зидовудина. 14. Способ по п.13, где единичная дозированная форма включает 600 мг зидовудина. 15. Способ по любому из пп.8-11, где доза аловудина составляет 2-4 мг один раз в сутки и доза зидовудина 300 мг два раза в сутки. 16. Способ по любому из пп.8-15, где аловудин вводят в виде предшественника аловудина монофосфата-фосалвудина тидоксила. 17. Набор из компонентов, включающий:
МПК / Метки
МПК: A61P 31/18, A61K 31/7072
Метки: вич-инфекций, комбинированное, лечение
Код ссылки
<a href="https://eas.patents.su/11-14778-kombinirovannoe-lechenie-vich-infekcijj.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированное лечение вич-инфекций</a>