Фармацевтический препарат для лечения шока
Формула / Реферат
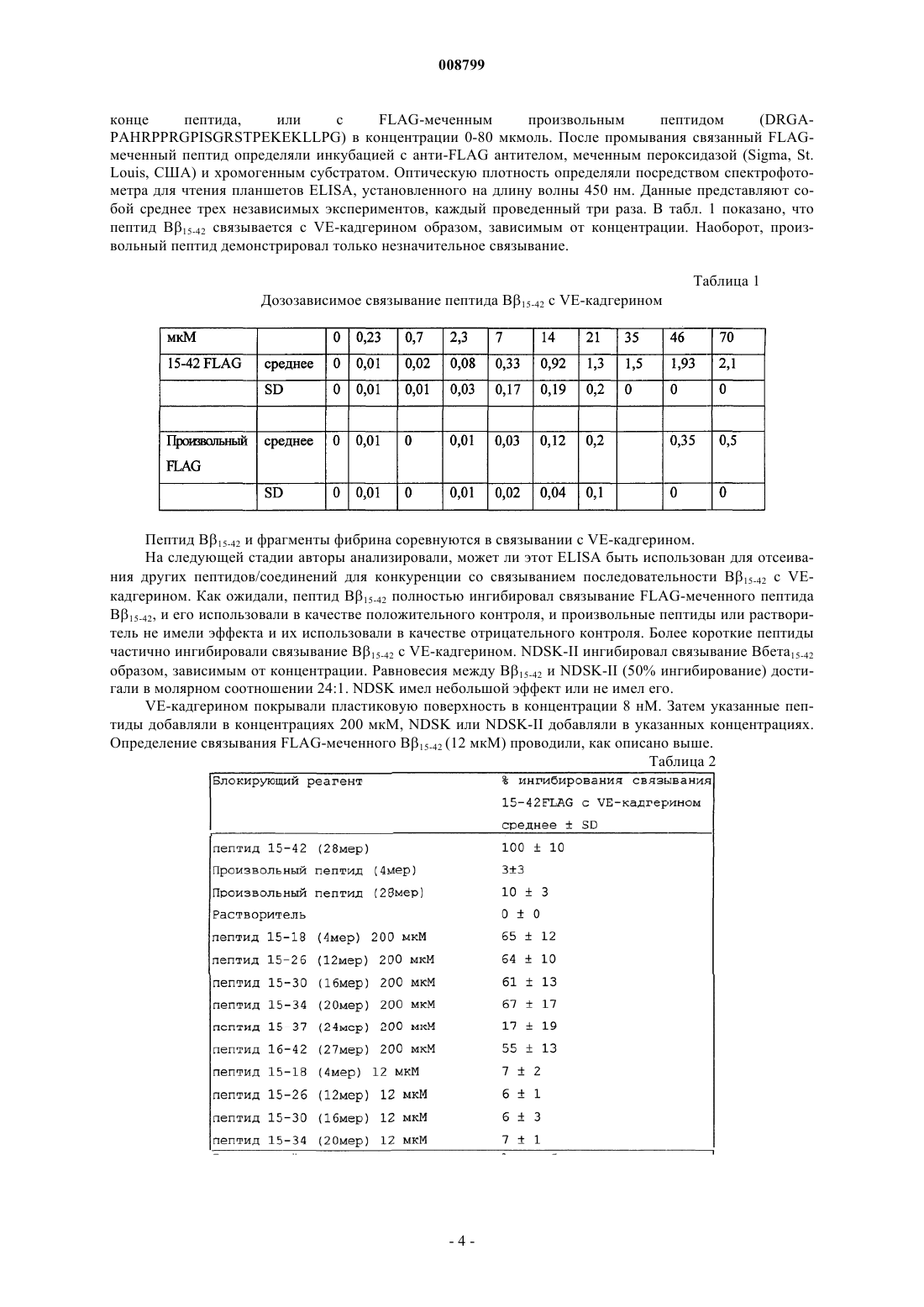
1. Применение пептида общей формулы I
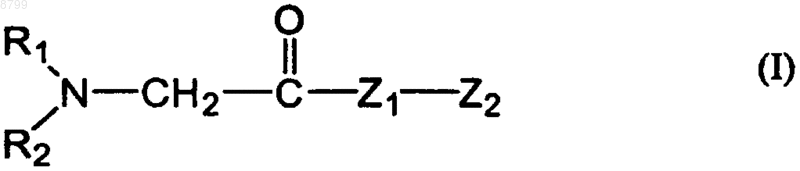
где R1 и R2, будучи одинаковыми или разными, обозначают водород, насыщенную или ненасыщенную углеводородную группу, включающую от 1 до 10, в частности от 1 до 3, атомов углерода,
Z1 обозначает гистидиновый или пролиновый остаток,
Z2 обозначает аргининовый остаток, пептидный фрагмент или белковый фрагмент, включающий исходный аргининовый остаток, в частности, содержащий от 2 до 30 аминокислот,
указанный пептид обладает биологическим свойством соответствия индуцибельному фрагменту Вb-цепи (т.е. Вb15-42) человеческого фибрина, связывающему VE-кадгерин, для получения фармацевтического препарата для лечения шока.
2. Применение по п.1, отличающееся тем, что пептид имеет общую формулу II
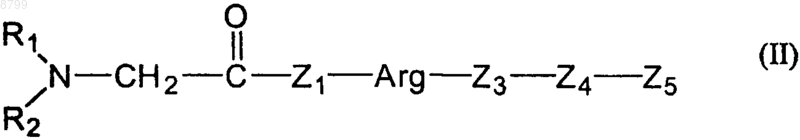
где Z1 обозначает гистидиновый или пролиновый остаток,
Arg обозначает аргининовый остаток,
Z3 обозначает пролиновый или валиновый остаток,
Z4 обозначает лейциновый или валиновый остаток,
Z5 обозначает пептидный фрагмент или белковый фрагмент, в частности, включающий от 2 до 30 аминокислот, или спиртовую группу, включающую от 1 до 10, в частности от 1 до 3, атомов углерода, или остаток органического или неорганического основания.
3. Применение по п.2, отличающееся тем, что Z5 представляет собой пептидный фрагмент, полученный из Аa-цепи фибрина.
4. Применение по п.2, отличающееся тем, что Z5 представляет собой пептидный фрагмент, полученный из Вb-цепи фибрина.
5. Применение по п.2, отличающееся тем, что
Z5 представляет собой пептидный фрагмент, включающий последовательность аминокислот Asp Lys Lys Arg Glu Glu Ala Pro Ser Leu Arg Pro Ala Pro Pro Ile Ser Gly Gly Gly Tyr Arg,
Z1 представляет собой гистидиновый остаток,
Arg представляет собой аргининовый остаток,
Z3 представляет собой пролиновый остаток и
Z4 представляет собой лейциновый остаток.
6. Применение по п.2, отличающееся тем, что
Z5 представляет собой пептидный фрагмент, включающий последовательность аминокислот Glu Arg His Gln Ser Ala Cys Lys Asp Ser Asp Trp Pro Phe Cys Ser Asp Glu Asp Trp Asn Tyr Lys,
Z1 представляет собой пролиновый остаток,
Arg представляет собой аргининовый остаток,
Z3 представляет собой валиновый остаток и
Z4 представляет собой валиновый остаток.
7. Применение пептида, который содержит N-концевую последовательность Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Tyr-Arg, указанный пептид обладает биологическим свойством соответствия индуцибельному фрагменту Bb-цепи (т.е. Вb15-42) человеческого фибрина, связывающему VE-кадгерин, для получения фармацевтического препарата для лечения шока.
8. Применение по п.7, отличающееся тем, что пептидом является Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Tyr-Arg.
9. Применение по любому из пп.1-8, где шок связан с одним или более из группы, включающей бактериальные токсины, диссеминированную внутрисосудистую васкулопатию, некротизирующий фасциит, геморрагический шок после вирусной инфекции, в частности, вызванной filovirus, arenaviridae, bunyaviridae, flavivirus, денге, острую геморрагическую дыхательную недостаточность, вызванную инфекционными агентами или аутоиммунными заболеваниями, органную недостаточность после повреждения органов, в частности инфаркта миокарда, сосудистое хирургическое вмешательство, фиксацию органов, геморрагический шок, инфаркт легких, инфаркт печени, инфаркт кишечника, хирургические вмешательства и инсульт и органную дисфункцию пересаженных органов.
Текст
008799 Предшествующий уровень техники Настоящее изобретение относится к фармацевтическому препарату для лечения шока. Шок представляет собой острое осложнение множества патологических состояний, характеризующееся неспособностью сердечно-сосудистой системы поддерживать адекватное перфузионное давление. Инфекционные агенты могут прямо или косвенно вызывать недостаточность сердечно-сосудистой системы. Бактерии, бактериальные токсины, вирусы и последние, но не менее важные, неадекватный клеточный или гуморальный ответ организма-хозяина, включая воспаление и коагуляцию, могут приводить к потере тонуса сосудов, потере сосудистой барьерной функции, потере сократимости миокарда и потере функции органов, которые отдельно или в комбинации приводят к шоку и к смерти пациента. Лечение бактериальной инфекции основывается на антибиотикотерапии, которая убивает бактерии, но это не лечит токсинемию и не исправляет неадекватный клеточный или гуморальный ответ. У грамотрицательных бактерий липополисахарид (ЛПС или эндотоксин) является ответственным за развитие грамотрицательного шока. Грамположительные бактерии могут вызывать множественную органную недостаточность и септический шок без эндотоксемии, но клеточная стенка грамположительных бактерий также содержит токсины, такие как липотейхоевая кислота (LTA) и пептидогликан (PepG). LTA и PepG действуют синергически на высвобождение цитокинов, таких как фактор некроза опухоли (ФНО)и интерферон (IFN), для индукции iNOS и, наконец, вызывают шок и органную недостаточность. Эндотоксемия, сепсис и септический шок ассоциированы с образованием избыточных количеств оксида азота (NO). Избыточная вазодилатация и гипореактивность сосудов на вазопрессорные агенты,ассоциированные с циркуляторным шоком, могут быть обращены ингибиторами индуцибельной изоформы NO синтазы (iNOS) (Southan and Szabo, Biochem. Pharmacol. 1996; 51:383-94, Thiemermann GenPharmacol. 1997; 29:159-66), однако ингибиторы iNOS не уменьшают повреждения органов, вызванного токсинами (Wray et al. Shock. 1998; 9:329-335). Лечение шока, вызванного вирусными инфекциями, является даже большей проблемой, так как противовирусные лекарственные средства не эффективны в отношении большинства инфекций. Лечение,имеющее целью устранить только инфекционный агент, является недостаточным у пациентов с шоком изза инфекционного агента, так как вторичные события, вызываемые инфекционным агентом, включающие воспалительную реакцию и нарушения в системе коагуляции, могут стать независимыми и привести к смерти пациента, независимо от вопроса, был ли причинный агент нейтрализован или нет. Специфическое лечение является недоступным, следовательно, употребляемые методики имеют цель облегчить симптомы,которые включают в себя механическую вентиляцию, замещение жидкости, применение кардиоактивных лекарственных средств, четкий контроль насыщения кислорода, гемоглобина, глюкозы и функции почек. Регуляция только воспалительной реакции, например, высокими дозами стероидов или ингибирование коагуляции антитромбином не дают улучшения выживаемости. Единственной молекулой, для которой до настоящего времени доказана заметная эффективность в уменьшении смертности, является активированный протеин С, который взаимодействует с коагуляцией/фибринолизом и процессами воспаления. Шок во время течения инфекции главным образом ассоциирован с явными или неявными изменениями фибриногена плазмы, сопровождаемыми образованием фибрина и повышением фрагментов фибрина. Такая активация свертывания крови, а также фибринолитических путей может привести к явному или неявному диссеминированному внутрисосудистому свертыванию (ДВС), приводящему к окклюзии сосудов и повреждению органа, питаемого этими сосудами, и из-за потребления факторов свертывания крови может привести к кровотечению. Сепсис является наиболее частой причиной ДВС. Важно что,фибриноген, фибрин и фрагменты фибрина не только играют роль в свертывании крови, но имеют несколько участков связывания для клеточных белков и белков матрикса, которые позволяют им взаимодействовать с лейкоцитами, тромбоцитами, эндотелиальными клетками и структурами матрикса. Это приводит к активации клеток, миграции клеток, высвобождению цитокинов и, наконец, к воспалительной реакции. Роль фибриногена или фибрина в воспалении является достаточно документированной(Altieri. Thromb. Haemost. 82:781-786; Herrick et al. Int. J. Biochem. Cell. Biol. 31:741-46). D-участок молекулы содержит много связывающих участков для молекул матрикса, эндотелиальных клеток, тромбоцитов и воспалительных клеток. Е-участок фибрина связывается с CD11c (Loike et al. Proc. Natl. Acad. Sci.USA. 88:1044-48). Авторами предложена новая роль для последовательности фибрина В 15-42 в воспалении(WO 02/48180). Такая последовательность также расположена в Е-участке фибрина и является активной только тогда, когда отщепляется фибринопептид. Фрагменты фибрина, содержащие такую последовательность на их свободном N-конце -цепи, связываются с эндотелием и вызывают воспаление, и пептид, соответствующий аминокислотам В 15-42-цепи фибрина, блокирует связывание фрагментов фибрина с эндотелиальной поверхностью и воспаление in vitro (WO 02/48180). In vivo такой пептид предотвращает воспаление миокарда и уменьшает размеры инфаркта миокарда в ситуациях ишемии/реперфузии (WO 02/48180).-1 008799 Фрагменты фибрина появляются в любой ситуации нарушенного образования фибрина и нарушенного фибринолиза. Особенно в ситуациях шока из-за инфекционного агента такое нарушенное образование фибрина и фибринолиз являются главной проблемой. Для множества заболеваний документирована прямая корреляция между исходом и нарушением образования фибрина/фибринолиза. Например, лихорадка денге (van Gorp et al. J. Med. Virol. 2002; 67:549-54, Mairuhu et al. Lancet Inf. Dis. 2003; 3:33-41). Респираторный дистресс-синдром взрослых (ARDS) представляет собой форму острого повреждения легких, которое характеризуется распространенным внесосудистым отложением фибрина (Idell. Am. J.Respir. Med. 2002; 1:383-91). Тромбоз легочных сосудов и диссеминированное внутрисосудистое свертывание также наблюдали в связи с ARDS. Причины устойчивости/мирового возникновения лихорадки денге (DF) и геморрагической лихорадки денге (DHF) как важной проблемы общественного здравоохранения являются комплексными,мера борьбы с переносчиками не была успешной для устранения DF/DHF. В настоящее время главными точками бюджетного финансирования исследований денге (оцененного как 15 млн долларов США в 2001 г.) являются молекулярная эпидемиология, иммунная патофизиология, испытание открытия второго поколения вакцин и новые или улучшенные подходы к борьбе с переносчиками инфекции. Несколько вакцин-кандидатов проходят клинические испытания в США и Таиланде, однако на мировом рынке все еще не существует лекарственного средства для лечения зараженных пациентов, хуже того, в настоящее время не развивается деятельность по исследованию и разработке коммерческой химиотерапии. Всемирная организация здравоохранения опубликовала стратегические направления для борьбы с DF/DHF, которые в качестве первоочередных задач включают в себя разработку противовирусных средств, направленных на протеазу или на другие, менее изученные ферменты; разработку антимедиаторов, направленных на причины повышенной сосудистой проницаемости или нарушенный гемостаз. Сущность изобретения Изобретение относится к применению пептида общей формулы (I) где R1 и R2, будучи одинаковыми или разными, обозначают водород, насыщенную или ненасыщенную углеводородную группу, включающую в себя от 1 до 10, в частности от 1 до 3, атомов углерода;Z1 обозначает гистидиновый или пролиновый остаток;Z2 обозначает аргининовый остаток, пептидный фрагмент или белковый фрагмент, содержащий исходный аргининовый остаток, в частности включающий в себя от 2 до 30 аминокислот. Указанный пептид обладает биологическим свойством соответствия индуцибельному фрагменту, Вцепи (т.е. В 15-42) человеческого фибрина, связывающему VE-кадгерин, для получения фармацевтического препарата для лечения шока. Предпочтительно используется пептид общей формулы (II) где Z1 обозначает гистидиновый или пролиновый остаток,Arg обозначает аргининовый остаток,Z3 обозначает пролиновый или валиновый остаток,Z4 обозначает лейциновый или валиновый остаток,Z5 обозначает пептидный фрагмент или белковый фрагмент, в частности, содержащий от 2 до 30 аминокислот, или спиртовую группу, включающую в себя от 1 до 10, в частности от 1 до 3, атомов углерода,или остаток органического или неорганического основания. Более того, предпочтительно используют пептид, в котором Z5 представляет собой пептидный фрагмент, полученный из альфа-цепи или В-цепи фибрина. Более того, предпочтительно используют пептид, в которомZ5 представляет собой пептидный компонент, содержащий аминокислотную последовательностьAsp Lys Lys Arg Glu Glu Ala Pro Ser Leu Arg Pro Ala Pro Pro Ile Ser Gly Gly Gly Tyr Arg,Z1 представляет собой гистидиновый остаток,Arg представляет собой аргининовый остаток,Z3 представляет собой пролиновый остаток,Z4 представляет собой лейциновый остаток. Более того, предпочтительно используют пептид, в которомZ5 представляет собой пептидный фрагмент, содержащий последовательность аминокислотGlu Arg His Gln Ser Ala Cys Lys Asp Ser Asp Trp Pro Phe Cys Ser Asp Glu Asp Trp Asn Tyr Lys,Z1 представляет собой пролиновый остаток,Arg представляет собой аргининовый остаток,-2 008799Z3 представляет собой валиновый остаток,Z4 представляет собой валиновый остаток. Кроме того, изобретение относится к применению пептида, который имеет N-концевую последовательность Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-SerGly-Gly-Gly-Tyr-Arg и биологическое свойство соответствия индуцируемому фрагменту, связывающемуVE-кадгерин на В-цепи (т.е. В 15-42) человеческого фибрина для получения фармацевтического препарата для лечения шока. Следующий предпочтительный вариант воплощения применения по изобретению отличается тем,что пептидом является Gly-His-Arg-Pro-Leu-Asp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-ProPro-Pro-Ile-Ser-Gly-Gly-Gly-Tyr-Arg. Было показано, что, в частности, шоковые состояния могут быть вылечены вышеупомянутыми пептидами, где шок ассоциирован с одной или более из группы, содержащей бактериальные токсины, диссеминированную сосудистую коагулопатию, некротизирующий фасциит, геморрагический шок после вирусной инфекции, в частности, вызываемой filovirus, arenaviridae, bunyaviridae, flavivirus, денге, острую геморрагическую дыхательную недостаточность, вызванную инфекционными агентами или аутоиммунными заболеваниями, органную недостаточность после повреждения органа, в частности инфаркта миокарда, сосудистое хирургическое вмешательство, фиксацию органов, геморрагический шок, инфаркт легкого, инфаркт печени, инфаркт кишечника, хирургические вмешательства и инсульт, и органную дисфункцию пересаженных органов. Подробное описание изобретения Пептиды и белки. Пептиды получали твердофазным пептидным синтезом и очищали ВЭЖХ с обратной фазой с использованием нуклеозильной колонки 100-10 С 18 (PiChem, Graz, Austria). Необходимо отметить, что 15-42-участок является на 100% подобным среди видов, когда делают поправку на замещения консервативных аминокислот. N-концевой дисульфидный узел фибриногена (NDSK), состоящий из аминокислот А 1-51, В 1-118 и 1-78, получали, как описано ранее (WO 02/48180). N-концевой дисульфидный узел фибрина (NDSK-II, в котором отсутствуют фибринопептиды А и В), состоящий из аминокислот А 17-51,В 15-118 и 1-78, получали обработкой NDSK тромбином (20 ед./1 мг NDSK) в течение 3 ч при 37 С. Остаточный тромбин нейтрализовали 10 мМ диизопропилфторфосфатом (Fluka, Milwaukee, WI) в течение 2 ч при 37 С. Затем все продукты диализировали в фосфатном буферном растворе (PBS).ELISA. Пептид B15-42 связывается с VE-кадгерином. Взаимодействие В-цепи (В 15-42) фибрина с эндотелиальными клетками вызывает морфологические изменения (Bunce et al. J. Clin. Invest. 89:842-50; Bach et al. Exp. Cell Res. 238:324-34; Chalupowiczet al. J. Cell Biol. 130:207-15; Hamaguchi et al. Blood. 81:2348-56; Francis et al. Blood cells 19:291-306), пролиферацию (Sporn et al. Blood. 86:1802-10), высвобождение фактора фон Виллебранда (Ribes et al. J. Clin.Vasc. Biol. 20:652-658). VE-кадгерин был идентифицирован как связывающий лиганд последовательности В 15-42, и были разработаны ELISA для демонстрации такого взаимодействия эндотелиальных клеток и/или VE-кадгерина с фибрином или фрагментами фибрина. Martinez et al. использовали противокюветные антитела к кадгерину для захвата кадгеринов из эндотелиальных клеток после инкубации с фибрином (Martinez et al. Ann NY Acad. Sci. 936:386-405), на монослои HUVEC (которые экспрессируют VEкадгерин) накладывали меченные радиоактивным лигандом фрагменты пептида В 15-42 (Bach et al. J. Biol.VE-кадгерин(Gorlatov и Medved. Biochemistry. 41:4107-16). Другие использовали ELISA для обнаружения фрагментов фибрина в крови, преимущественно с использованием антител к отдельным последовательностям в молекуле фибриногена, включая антитела против компонента В 15-42 (описано в Fareed et al.Clin. Chem. 8:1845-53). Авторы разработали модифицированный ELISA, работающий по таким же принципам, описанным другими, но целью рассмотренного здесь ELISA является не определить количество продуктов деградации фибрина, а обнаружить белки, пептиды или соединения, которые вмешиваются в связывание последовательности В 15-42 и VE-кадгерина. Принцип состоит в том, что VE-кадгерину как усеченному белку и как цельному белку или сшитому с другими белками, которые не вмешиваются в участок связывания В 15-42, позволяют взаимодействовать с В 15-42 последовательностью фибрина. В эту систему можно ввести любое другое дополнительное вещество и измерить, ингибирует ли это вещество связываниеVE-кадгерина/В 15-42. Подробно, 96-луночные планшеты с иммобилизованным белком (Exiqon, Vedbaek, DK) покрывали рекомбинантным человеческим сшитым белком VE-кадгерином FC (8 нМ/мл; RD Systems, Minneapolis) в PBS и оставляли на ночь при 4 С. Затем планшеты промывали и инкубировали с пептидом В 15-42(DRGAPAHRPPRGPISGRSTPEKEKLLPG) в концентрации 0-80 мкмоль. После промывания связанный FLAGмеченный пептид определяли инкубацией с анти-FLAG антителом, меченным пероксидазой (Sigma, St.Louis, США) и хромогенным субстратом. Оптическую плотность определяли посредством спектрофотометра для чтения планшетов ELISA, установленного на длину волны 450 нм. Данные представляют собой среднее трех независимых экспериментов, каждый проведенный три раза. В табл. 1 показано, что пептид В 15-42 связывается с VE-кадгерином образом, зависимым от концентрации. Наоборот, произвольный пептид демонстрировал только незначительное связывание. Таблица 1 Дозозависимое связывание пептида В 15-42 с VЕ-кадгерином Пептид В 15-42 и фрагменты фибрина соревнуются в связывании с VE-кадгерином. На следующей стадии авторы анализировали, может ли этот ELISA быть использован для отсеивания других пептидов/соединений для конкуренции со связыванием последовательности В 15-42 с VEкадгерином. Как ожидали, пептид В 15-42 полностью ингибировал связывание FLAG-меченного пептида В 15-42, и его использовали в качестве положительного контроля, и произвольные пептиды или растворитель не имели эффекта и их использовали в качестве отрицательного контроля. Более короткие пептиды частично ингибировали связывание В 15-42 с VE-кадгерином. NDSK-II ингибировал связывание Вбета 15-42 образом, зависимым от концентрации. Равновесия между В 15-42 и NDSK-II (50% ингибирование) достигали в молярном соотношении 24:1. NDSK имел небольшой эффект или не имел его.VE-кадгерином покрывали пластиковую поверхность в концентрации 8 нМ. Затем указанные пептиды добавляли в концентрациях 200 мкМ, NDSK или NDSK-II добавляли в указанных концентрациях. Определение связывания FLAG-меченного В 15-42 (12 мкМ) проводили, как описано выше. Таблица 2 Эффективность пептида b15-42 для лечения мышей, зараженных вирусом денге. Материалы и методы. Вирус. Вирус денге типа 2 (DEN-2), штамм Р 23085, получали из Государственной коллекции вирусов, Россия, Москва в форме инфицированной лиофилизированной суспензии головного мозга мышейICR. Полученный вирус денге подвергали пассажам в головном мозге новорожденных мышей ICR, как описано ранее (Atrasheuskaya et al. FEMS Immunology and Medical. Microbiology. 35, 33-423). 10% суспензия головного мозга служила в качестве запаса вируса и хранилась при -40 С. Титр вируса определяли серийными разведениями суспензии головного мозга. Суспензию головного мозга вносили интраперитонеально (и.п.) в группах из 10 мышей (4-недельные BALB/c) каждая и записывали смертность. Титр вируса рассчитывали, и он был 7,4lg LD50/мл. Все работы с инфекционным вирусом проводили в лаборатории с максимальным защитным уровнем биобезопасности-3 (BSL-3) НРЦ ВБ Вектор (Россия). Животные. Четырехнедельных инбредных самцов мышей BALB/c (гаплотип H-2d) получали из вивария Национального исследовательского центра вирусологии и биотехнологии Вектор. Животных помещали в отдельные клетки с неограниченным доступом к пище и воде. Анализы. Кровь брали у мышей под анестезией метоксифлураном из полости орбиты перед инфекцией и после воздействия DEN-2. Троих мышей использовали в каждой временной точке для получения крови. Циркулирующие тромбоциты (PLT), эритроциты (RBC), лейкоциты (WBC), гемоглобин (HGB) и гематокрит (НСТ) определяли с использованием анализатора гематологии Cell-Dyn 900 (Sequoia-Turnercorporation, США, СА). Часть собранной крови центрифугировали для получения сыворотки, которую хранили при -80 С до конца эксперимента. Уровни цитокинов в сыворотке измеряли с использованием наборов для иммуноферментного анализа, создаваемых RD Systems (Minneapolis, США) в соответствии с инструкциями производителя. Пределы обнаружения были следующие: ФНО- менее 5,1 пг/мл; интерлейкин(ИЛ)-1 - 3,0 пг/мл; ИЛ-6 - 3,1 пг/мл; ИФН - менее 20 пг/мл. Вирус денге в крови животных определяли ОТ-ПЦР, как описано ранее (Harris et al. J. Clin. Microbiol. 36, 2634-2639). Общую РНК из крови выделяли с использованием набора от Quiagen (Германия). Праймеры были следующие: верхний 5'AATATGCTGAAACGCGAGAGAAACCG (положение 136-161),нижний 5'AAGGAACGCCACCAAGGCCATG (положение 237-258), амплифицируя продукт 119 пн. Для количественной оценки вирусной нагрузки DEN-2 титровали на культуры клеток Vero E6, как описано ранее (Harris et al. J. Clin. Microbiol. 36, 2634-2639). В день 0 и 22 после инфицирования кровь выживших мышей анализировали на анти-DEN-2 антитела (IgG) посредством ELISA, как описано ранее (Ignatyev etal. J. Biotechnology. 44, 111-118). Схема эксперимента. Инбредных четырехнедельных мышей самцов BALB/c делили на 6 основных групп. Каждая группа содержала 50 мышей. Всех животных инфицировали интраперитонеально адаптированным для мышей штамма DEN-2 P23085 (как описано выше) с дозой 1 LD50 и исследовали ежедневно в отношении при-5 008799 знаков заболеваемости. Мышей из первых подгрупп всех основных групп (A1-F1) использовали для контроля смертности. Каждая подгруппа содержала 20 мышей. Животных из вторых подгрупп (А 2-F2) использовали для получения образцов сыворотки. Каждая подгруппа содержала 30 мышей. Описание группы, n=50 в каждой группе. Контрольная группа получала только вирус. Лечение пептидом В 15-42 проводили два раза в сутки, 4800 мкг/кг каждое внутрибрюшинной инъекцией от дня 3 после инфицирования до дня 8 после инфицирования. Образцы крови и сыворотки получали в выбранные временные точки: день 1, 3, 5, 7, 11, 22 после инфицирования. Статистический анализ проводили с использованием t-критерия Стьюдента или теста Хи-квадрат,p0,05 расценивали статистически значимыми. Таблица 3 Смертность и титр IgG, p0,05 между группами Грамотрицательный шок. Самцы крыс Wistar, весящие 230-280 г, содержались в виварии (Университет Дюссельдорфа) и получали стандартное питание и воду без ограничений. Все процедуры проводили в соответствии с руководствами AAALAC и Guide for the Care and Use of Laboratory Animals (Department of Health and HumanServices, National Institutes of Health, Publication No. 86-23). Кроме того, все эксперименты были одобрены этической и исследовательской коллегией Университета Дюссельдорфа и округа. Как описано ранее(Zacharowski et al. Crit. Care Med. 2000, Zacharowski et al. Crit. Care Med. 2001; 29:1599-1608), крыс анестезировали тиопентоном натрия (120 мг/кг и.п.) и анестезию поддерживали дополнительными дозами тиопентона натрия по требованию. Трахею катетеризировали для облегчения дыхания и ректальную температуру поддерживали на уровне 37 С с помощью гомотермического одеяла. Правую сонную артерию катетеризировали и соединяли с датчиком давления для измерения фазового и среднего артериального давления (САД) и частоты сердечных сокращений (ЧСС), которые отображались на регистрирующей системе (MacLab 8-e, ADI Instruments, Германия), встроенной в компьютер IBM. Правую яремную вену катетеризировали для введения лекарственных средств. Мочевой пузырь также катетеризировали для облегчения тока мочи и для-6 008799 предотвращения возможности развития острой почечной недостаточности. Все животные получали общее замещение жидкости 1,0 мл/кг/ч (0,9% хлорида натрия, физиологический раствор, в виде в/в инфузии в яремную вену) на протяжении эксперимента. После завершения хирургического вмешательства сердечно-сосудистым параметрам позволяли стабилизироваться в течение 15 мин и постоянно записывали в течение 6 ч. В такой модели индуцированной ЛПС полиорганной недостаточности период 6 ч является необходимым для достижения значительного повышения уровня АсТ и АлТ в сыворотке, тогда как значительное повышение уровня мочевины и креатинина в сыворотке уже можно наблюдать через 2 ч. Исследовали три группы. Крыс подвергали ложной операции: (симуляция). Крыс подвергали грамотрицательному шоку. Липополисахарид Е. coli, серотип 0,127:В 8(6 мг/кг в/в) вводили в течение 5 мин в/в, через 1 ч животные получали солевой раствор (2,4 мл/кг):(ЛПС+солевой раствор). Крыс подвергали грамотрицательному шоку. Липополисахарид от Е. coli, серотип 0,127:В 8 (6 мг/кг в/в) вводили в течение 5 мин в/в, животные получали В 15-42 (2,4 мг/кг): (ЛПС+В 15-42). Таблица 6 Выживаемость n=20 в каждой группе, р 0,05 Через 6 ч после индукции грамотрицательного шока собирали кровь из катетера, помещенного в правую сонную артерию. Образцы крови центрифугировали (1610g в течение 3 мин при комнатной температуре) для отделения плазмы. Следующие маркерные ферменты измеряли в плазме как биохимические индикаторы множественного органного повреждения/дисфункции: Повреждение печени оценивали, измеряя повышение уровня в плазме аланинаминотрансферазы(АлТ, специфического маркера повреждения паренхимы печени) и аспартатаминотрансферазы (АсТ, неспецифического маркера повреждения печени). Дисфункцию почек оценивали, измеряя повышение уровня в плазме мочевины (индикатора нарушенной экскреторной функции почек и/или повышенного катаболизма) и креатинина (индикатора сниженной скорости клубочковой фильтрации и, следовательно, дисфункции почек). Уровень в плазме глюкозы и амилазы измеряли как непрямые маркеры функции и повреждения поджелудочной железы. Кроме того, измеряли артериальное рО 2 как непрямой маркер функции/повреждения легких. Лабораторные значения приведены в табл. 7. Таблица 7 Лабораторные значения Биопсии органов (легкие, печень, сердце и почки) всех исследуемых групп брали в конце эксперимента и фиксировали в буферизованном растворе формальдегида (4% в фосфатном буферном растворе) при комнатной температуре и посылали в Вену. Стандартные окрашенные гематоксилином и эозином сечения не выявили различий. В сечениях, окрашенных на отложения фибрина с использованием кислого фукцина - оранжевого G, авторы обнаружили значительно повышенное количество фибриновых тромбов в контрольной группе, получавшей только ЛПС, по сравнению с животными, получавшими лечение ЛПС плюс В 15-42 (р 0,05). У животных, леченных симуляционно, не присутствовали фибриновые тромбы. Таблица 10 Среднее количество фибриновых тромбов в сосудах ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение пептида общей формулы I где R1 и R2, будучи одинаковыми или разными, обозначают водород, насыщенную или ненасыщенную углеводородную группу, включающую от 1 до 10, в частности от 1 до 3, атомов углерода,Z1 обозначает гистидиновый или пролиновый остаток,Z2 обозначает аргининовый остаток, пептидный фрагмент или белковый фрагмент, включающий исходный аргининовый остаток, в частности, содержащий от 2 до 30 аминокислот,указанный пептид обладает биологическим свойством соответствия индуцибельному фрагменту В-цепи(т.е. В 15-42) человеческого фибрина, связывающему VE-кадгерин, для получения фармацевтического препарата для лечения шока. 2. Применение по п.1, отличающееся тем, что пептид имеет общую формулу II где Z1 обозначает гистидиновый или пролиновый остаток,Arg обозначает аргининовый остаток,Z3 обозначает пролиновый или валиновый остаток,Z4 обозначает лейциновый или валиновый остаток,Z5 обозначает пептидный фрагмент или белковый фрагмент, в частности, включающий от 2 до 30 аминокислот, или спиртовую группу, включающую от 1 до 10, в частности от 1 до 3, атомов углерода,или остаток органического или неорганического основания. 3. Применение по п.2, отличающееся тем, что Z5 представляет собой пептидный фрагмент, полученный из А-цепи фибрина. 4. Применение по п.2, отличающееся тем, что Z5 представляет собой пептидный фрагмент, полученный из В-цепи фибрина. 5. Применение по п.2, отличающееся тем, чтоZ5 представляет собой пептидный фрагмент, включающий последовательность аминокислот AspLys Lys Arg Glu Glu Ala Pro Ser Leu Arg Pro Ala Pro Pro Ile Ser Gly Gly Gly Tyr Arg,Z1 представляет собой гистидиновый остаток,Arg представляет собой аргининовый остаток,Z3 представляет собой пролиновый остаток иZ4 представляет собой лейциновый остаток. 6. Применение по п.2, отличающееся тем, чтоZ5 представляет собой пептидный фрагмент, включающий последовательность аминокислот GluArg His Gln Ser Ala Cys Lys Asp Ser Asp Trp Pro Phe Cys Ser Asp Glu Asp Trp Asn Tyr Lys,Z1 представляет собой пролиновый остаток,Arg представляет собой аргининовый остаток,Z3 представляет собой валиновый остаток иZ4 представляет собой валиновый остаток. 7. Применение пептида, который содержит N-концевую последовательность Gly-His-Arg-Pro-LeuAsp-Lys-Lys-Arg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Tyr-Arg, указанный пептид обладает биологическим свойством соответствия индуцибельному фрагменту B-цепи (т.е. В 15-42) человеческого фибрина, связывающему VE-кадгерин, для получения фармацевтического препарата для лечения шока. 8. Применение по п.7, отличающееся тем, что пептидом является Gly-His-Arg-Pro-Leu-Asp-Lys-LysArg-Glu-Glu-Ala-Pro-Ser-Leu-Arg-Pro-Ala-Pro-Pro-Pro-Ile-Ser-Gly-Gly-Gly-Tyr-Arg. 9. Применение по любому из пп.1-8, где шок связан с одним или более из группы, включающей бактериальные токсины, диссеминированную внутрисосудистую васкулопатию, некротизирующий фасциит, геморрагический шок после вирусной инфекции, в частности, вызванной filovirus, arenaviridae,bunyaviridae, flavivirus, денге, острую геморрагическую дыхательную недостаточность, вызванную инфекционными агентами или аутоиммунными заболеваниями, органную недостаточность после повреждения органов, в частности инфаркта миокарда, сосудистое хирургическое вмешательство, фиксацию органов, геморрагический шок, инфаркт легких, инфаркт печени, инфаркт кишечника, хирургические вмешательства и инсульт и органную дисфункцию пересаженных органов.
МПК / Метки
МПК: A61P 7/00, A61K 38/36, A61P 9/00
Метки: лечения, шока, фармацевтический, препарат
Код ссылки
<a href="https://eas.patents.su/10-8799-farmacevticheskijj-preparat-dlya-lecheniya-shoka.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтический препарат для лечения шока</a>
Предыдущий патент: Новые бензамиды в качестве pparγ модуляторов
Следующий патент: Противокоррозионный пигмент
Случайный патент: Оптический диск