Липосомальная вакцинная композиция, применение липосомальной вакцинной композиции, способ приготовления липосомальной вакцинной композиции и способ лечения млекопитающего.
Формула / Реферат
1. Липосомальная вакцинная композиция, содержащая антиген или антигенную композицию, иммунологически активную сапониновую фракцию и стерин, характеризующаяся тем, что отношение сапониновая фракция : стерин составляет от 1:1 до 1:100 (по массе).
2. Вакцинная композиция по п.1, отличающаяся тем, что отношение сапониновая фракция : стерин составляет от 1:1 до 1:5 (по массе).
3. Вакцинная композиция по п.1, отличающаяся тем, что отношение сапониновая фракция: стерин составляет 1:2 (по массе).
4. Вакцинная композиция по любому из пп.1-3, отличающаяся тем, что иммунологически активная сапониновая фракция представляет собой QS21.
5. Вакцинная композиция по любому из пп.1-3, отличающаяся тем, что стерин представляет собой холестерин.
6. Вакцинная композиция по любому из пп.1-5, которая дополнительно содержит 3-деацилированный монофосфорил-липид А.
7. Вакцинная композиция по любому из пп.1-6, которая дополнительно содержит носитель, представляющий собой соль алюминия, или гидроксид алюминия, или эмульсию типа "масло в воде".
8. Вакцинная композиция по любому из пп.1-7, отличающаяся тем, что антиген или антигенная композиция получены на основе вируса иммунодефицита человека, вируса иммунодефицита кошачьих, вируса ветряной оспы, вируса простого герпеса типа 1, вируса простого герпеса типа 2, цитомегаловируса человека, вируса гепатита А, В, С или Е, респираторно-синцитиального вируса, папилломавируса человека, вируса гриппа, возбудителя меннингита Haemphilis influenzae типа b, Salmonella, Neisseria, Borrelia, Chlamydia, Bordetella, Plasmodium или Toxoplasma.
9. Вакцинная композиция по любому из пп.1-7, отличающаяся тем, что антиген или антигенная композиция получены из опухоли.
10. Вакцинная композиция по любому из пп.1-9, используемая в медицине.
11. Применение липосомальной композиции, содержащей иммунологически активную сапониновую фракцию и стерин, характеризующейся тем, что отношение сапониновая фракция : стерин составляет от 1:1 до 1:100 (по массе), для приготовления вакцины для превентивного и/или иммунотерапевтического лечения вирусных, бактериальных или паразитарных инфекций или рака.
12. Способ лечения млекопитающего, страдающего от вызванной патогенами или чувствительного к данной инфекции, отличающийся тем, что млекопитающему вводят безопасное и эффективное количество композиции по любому из пп.1-8.
13. Способ лечения млекопитающего, страдающего от рака или чувствительного к раковому заболеванию, отличающийся тем, что млекопитающему вводят безопасное и эффективное количество композиции по п.9.
14. Способ приготовления вакцинной композиции по любому из пп.1-9, заключающийся в том, что смешивают иммунологически активную сапониновую фракцию и стерин, в частности холестерин, с антигеном или антигенной композицией.
Текст
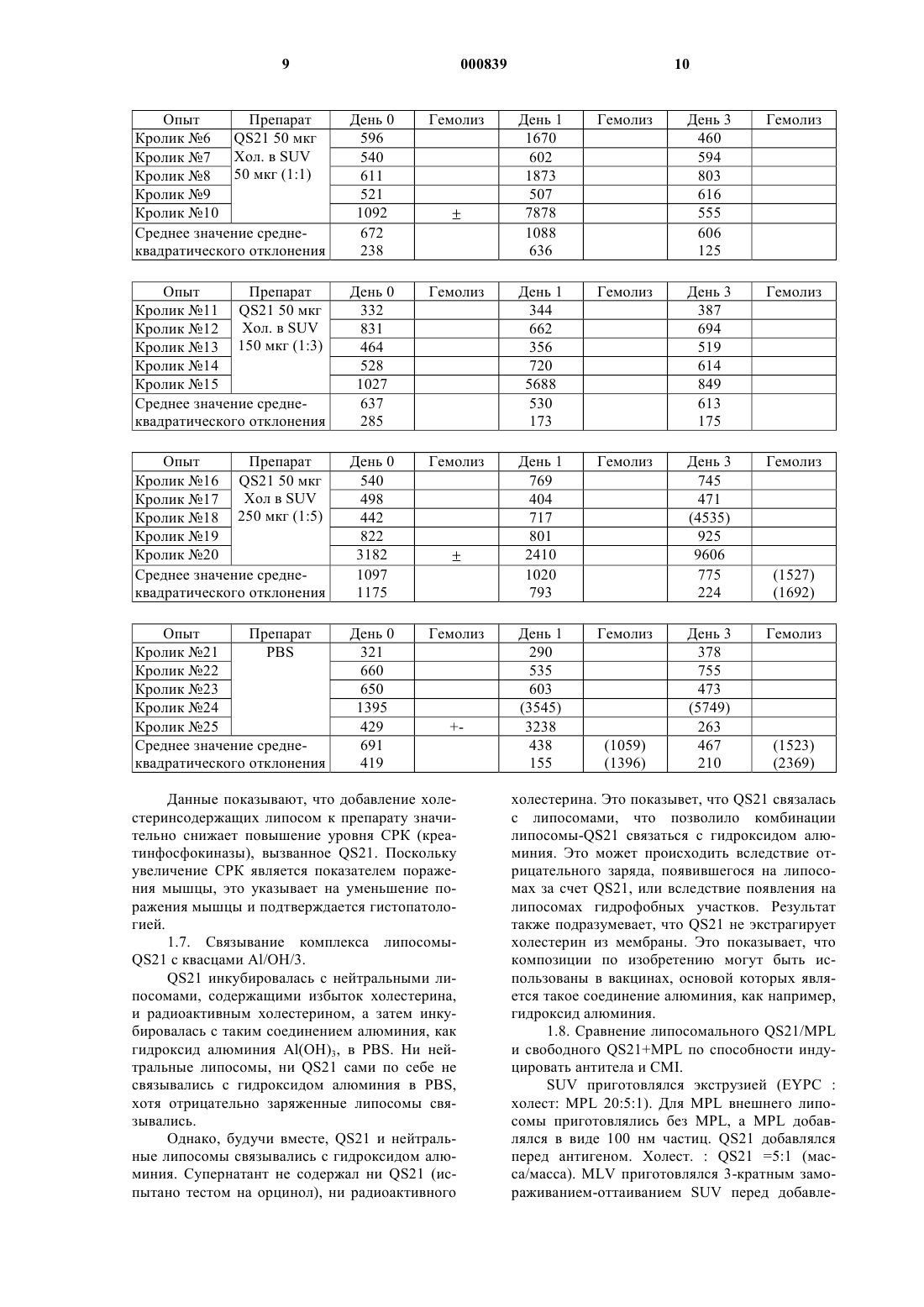
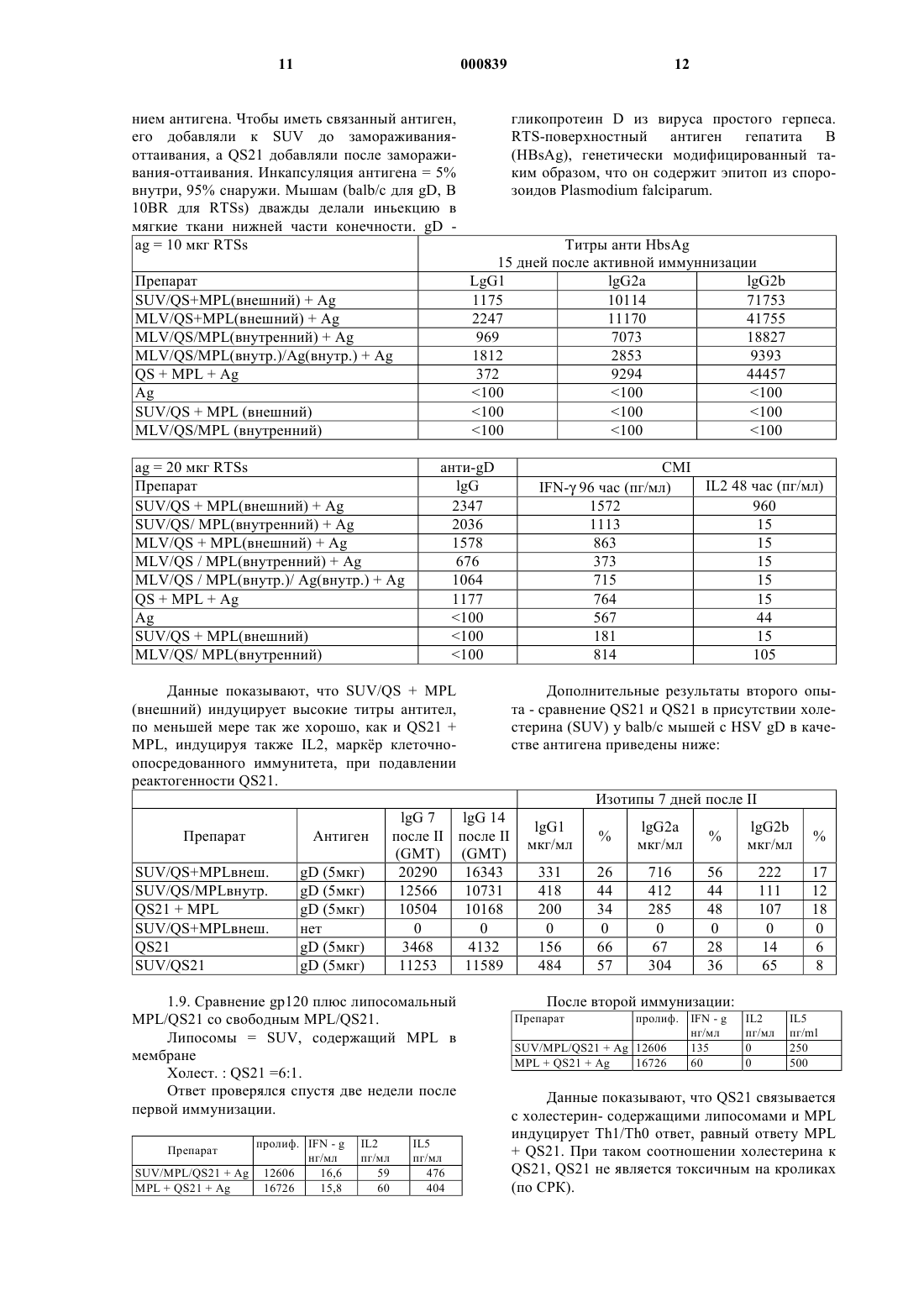
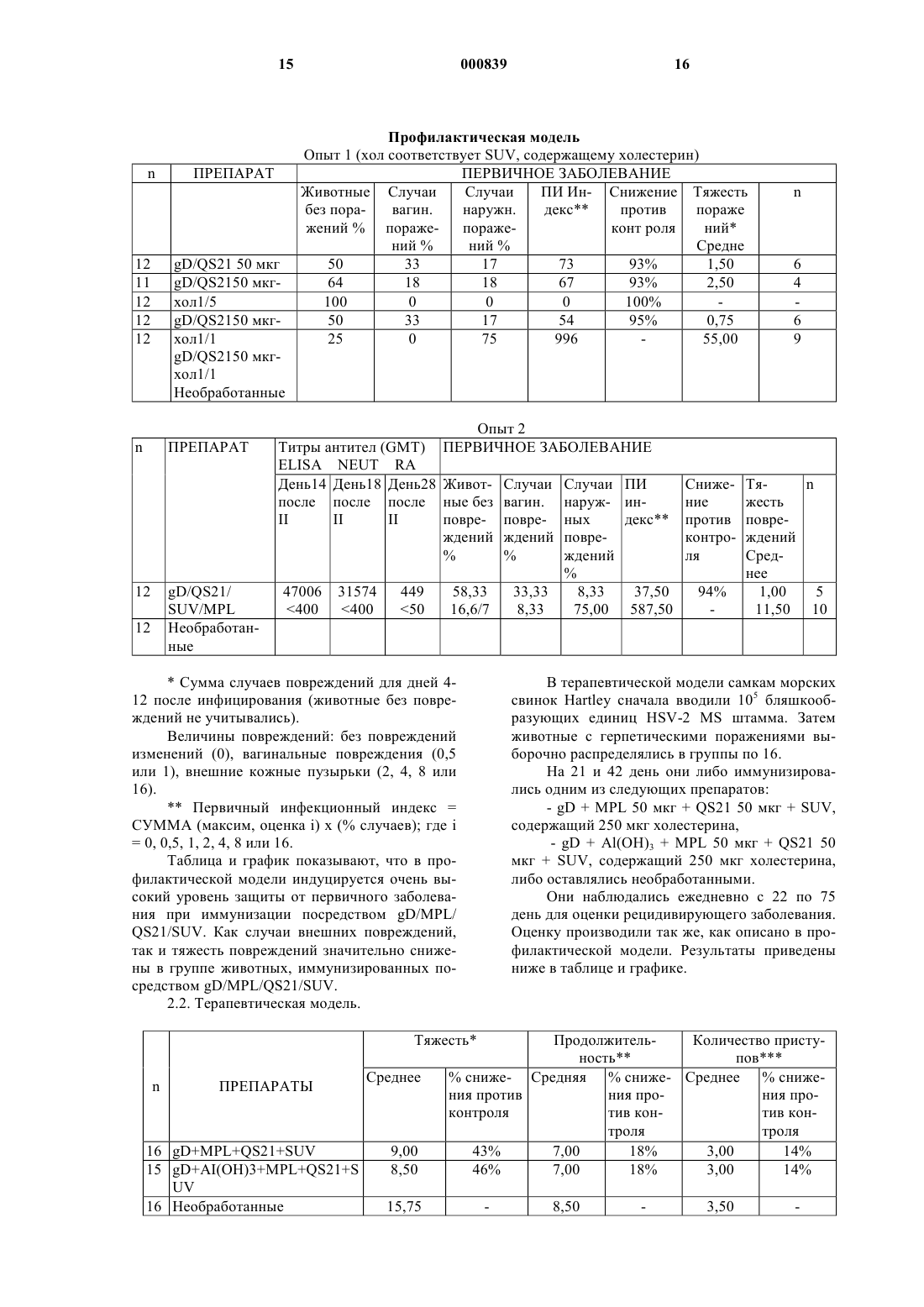
1 Настоящее изобретение относится к новым вакцинным препаратам, способам их получения и их применению в медицине. В частности, настоящее изобретение относится к вакцинам,содержащим антиген, иммунологически активную фракцию, полученную из коры QuillajaSaponaria Molina, а именно QS21, и стерин. Иммунологически активные сапониновые фракции, обладающие адъювантной активностью, полученные из коры южноамериканского дерева Quillaja Saponaria Molina известны из уровня техники. Например, QS21, известная также как QA21, очищенная посредством Hplc(жидкостная хроматография высокого разрешения) фракция из дерева Quillaja Saponaria Molina, и способ ее получения (как QA21) известны(патент США 5,057,540). QuiIIaia сапонин известен также в качестве адъюванта (Scott etal., Int. Archs. Allergy Appl. Immun,. 1985, 77,409). Однако, применение QS21 как адьюванта связано с определенными трудностями. Например, наблюдали, что при инъецировании QS21 как свободной молекулы млекопитающим в месте иньекции происходит некроз, то есть местное отмирание ткани. Неожиданно было обнаружено, что некроза в месте инъекции можно избежать путем применения препаратов, содержащих комбинацию QS21 и стерина. Предпочтительные стерины включают в себя (-ситостерин, стигмастерин, эргостерин, эргокальциферол и холестерин. Эти стерины хорошо известны из уровня техники, например, холестерин описан (Merck Index,11th Edn., page 341) как встречающийся в природе стерин, найденный в животном жире. В первом аспекте изобретения поэтому предлагается вакцинная композиция, содержащая антиген, иммунологически активную сапониновую фракцию и стерин. Предпочтительно композиции по изобретению содержат иммунологически активную сапониновую фракцию в по существу чистой форме. Предпочтительно композиции по изобретению содержат QS21 в по существу чистой форме, то есть QS21 имеет чистоту по меньшей мере 90%, предпочтительнее, по меньшей мере, 95% и наиболее предпочтительно 98%. Другие иммунологически активные сапониновые фракции, полезные в композициях по изобретению, включают в себяQA17/QS17. Композиции по изобретению, содержащие QS21 и холестерин, показывают уменьшение реактогенности по сравнению с композициями, в которых холестерин отсутствует, при сохранении адъювантного эффекта. В дополнение, известно, что QS21 расщепляется в основных условиях, когда рН составляет примерно 7 или больше. Дополнительное преимущество данных композиций состоит в том, что устойчивось QS21 к гидролизу, опосредованному основанием, повышается в препаратах, содержащих холестерин. 2 Предпочтительными композициями по изобретению являются композиции, которые образуют липосомную структуру. Соотношение QS21:стерин обычно составляет порядка от 1:100 до 1:1 по массе. Предпочтительно наличие избытка стерина, чтобы соотношение QS21:стерин составляло, по меньшей мере, 1:2 масса/масса. Обычно для введения человеку QS21 и стерин в вакцине будут присутствовать в диапазоне от примерно 1 мкг до примерно 100 мкг, предпочтительно от примерно 10 мкг до примерно 50 мкг на дозу. Липосомы предпочтительно содержат нейтральный липид, например фосфатидилхолин,который предпочтительно является некристаллическим при комнатной температуре, например фосфатидилхолин желтка яйца, диолеоилфосфатидилхолин или дилаурил-фосфатидилхолин. Липосомы могут также содержать заряженный липид, который повышает стабильность структуры липосома-QS21 для липосом, состоящих из насыщенных липидов. В этих случаях количество заряженного липида предпочтительно составляет 1-20 мас.%, наиболее предпочтительно 5-10%. Соотношение стерина к фосфолипиду составляет 1-50% (моль/моль),наиболее предпочтительно 20-25%. Предпочтительно композиции по изобретению содержат MPL (3-деацилированный монофосфорил-липид А, известный также как 3DMPL). Известно (GB 2 220 211 (Ribi, что 3DMPL представляет собой смесь 3-х типов де-Oацилированного монофосфорил-липида А с 4 мя, 5-ю или 6-ю ацилированными цепями и производится Ribi Immunochem, Montana. Предпочтительная форма описана (международная заявка 92/116556). Приемлемыми композициями по изобретению являются композиции, в которых липосомы первоначально приготовлены без MPL, a MPL добавляется потом, предпочтительно в виде частиц 100 нм. Поэтому MPL не содержится внутри пузырьковой мембраны (известен какMPL наружный). Композиции, в которых MPL содержится внутри пузырьковой мембраны (известен как MPL внутренний), также составляют аспект изобретения. Антиген может содержаться внутри пузырьковой мембраны или вне пузырьковой мембраны. Предпочтительно, растворимые антигены находятся снаружи, а гидрофобные или липидированные антигены находятся либо внутри, либо вне мембраны. Как правило, для вакцин по изобретению не требуется какой-либо специфический носитель, и они могут быть приготовлены в виде препарата в водном или другом фармацевтически приемлемом буфере. В некоторых случаях может быть полезным, чтобы вакцины по настоящему изобретению дополнительно содержали соль алюминия или гидроксид алюминия,или были представлены эмyльcией типа "маслoв вoдe" или в форме другого подходящего носи 3 теля, такого как, например, липосомы, микросферы или инкапсулированные антигенные частицы. Предпочтительно, чтобы вакцинные препараты содержали антиген или антигенную композицию, способную вызывать иммунный ответ против патогена человека и животных. В композициях по изобретению могут использоваться антиген или антигенные композиции,известные из уровня техники, включая полисахаридные антигены, антигены или антигенные композиции, полученные из ВИЧ-1, (такие какgp 120 или gp 160), любых вирусов иммунодефицита кошачьих, вирусов герпеса человека и животных, таких как gD или его производные,или непосредственного раннего белка, такого как ICP27 из HSV1 или SV2, цитомегаловируса(такого как gpl, II или III), или из вируса гепатита, такого как вирус гепатита В, например гепатита В поверхностный антиген или его производные, вирус гепатита А, вирус гепатита С,вирус гепатита Е, или из других вирусных патогенов, таких как респираторно-синцитиальный вирус (например HSRV F и G белки или их известные (патент США 5, 149, 650) иммуногенные фрагменты, или химерные полипептиды,содержащие иммуногенные фрагменты изHSRV белков F и G, например известный (патент США 5, 194, 595) FG гликопротеин), антигены, полученные из штаммов возбудителей менингита, таких как возбудители менингита А,В и С, Streptoccoccus Pneumonia, вируса папилломы человека, вируса гриппа, Haemophilus Influenza В (Hib), Эпстайна-Барр вируса (EpsteinBarr, EBV), или полученных из бактериальных патогенов, таких как Salmonella, Neisseria, Borrelia (например OspA или OspB или их производные) или Chlamydia, или Bordetella, например Р.69, РТ и FHA, или полученных из паразитов, таких как Plasmodium или Toxoplasma. Предпочтительным вакцинным антигеном являются HSV гликопротеин D (gD) или его производные. Он расположен на вирусной мембране и также найден в цитоплазме инфицированных клеток (Eisenberg R.J. et al; J of Virol 1980 35 428-435). Он содержит 393 аминокислоты, включая сигнальный пептид, и имеет молекулярную массу примерно 60 кДа. Из всех HSV гликопротеинов оболочки он, вероятно, характеризован наилучшим образом (Cohen et al J.Virology 60 157-166). Известно, что in vivo он играет главную роль в прикреплении вирусов к клеточным мембранам. Более того, было показано, что гликопротеин D способен вызывать нейтрализацию антител in vivo и защищать животных от летального исхода. Усеченная форма молекулы gD лишена С-терминальной якорной области и может продуцироваться в клетках млекопитающих в виде растворимого белка,который поступает в супернатант клеточной 4 культуры. Такие растворимые формы gD являются предпочтительными. Получение усеченных форм gD известно (ЕР 0 139 417). gD предпочтительно получают из HSV-2. Воплощением изобретения является усеченный HSV-2 гликопротеин D из 308 аминокислот, который содержит аминокислоты с 1-ой по 306-ю природного гликопротеина с добавлением аспарагина и глютамина по С-терминальному концу усеченного белка, лишенного своей мембранной якорной области. Эта форма белка содержит сигнальный пептид, который отщепляется, предоставляя возможность зрелому растворимому белку, состоящему из 283 аминокислот, секретироваться из клетки-хозяина. В другом аспекте изобретения предпочтительным вакцинным антигеном является поверхностный антиген гепатита В. Используемое в тексте выражение "поверхностный антиген гепатита В" или "HBsAg" включает в себя любой HBsAg антиген или его фрагмент, проявляющий антигенность HBV поверхностного антигена. Следует понимать,что, в дополнение к известной последовательности из 226 аминокислот HBsAg антигена (Tiollais et al, Nature, 317, 489, (1985) и ссылки), описываемый HBsAg может, при желании, содержать всю или часть пред-S последовательности,как описано выше и (ЕР-А-0 278 940). В частности, такой HBsAg может содержать полипептид,в состав которого входит аминокислотная последовательность, содержащая остатки 12-52 с последующими остатками 133-145, затем остатками 175-400 L-белка HBsAg относительно открытой рамки считывания на вирусе гепатита В серотипа ad (этот полипептид обозначается какL (ЕР 0 414 374. HBsAg в объеме изобретения может также включать в себя известный (ЕР 0 198 474 (Endotronics пред-S1-пред-S2-S полипептид или его известные (ЕР 0 304 578 (McCormic and Jones закрытые аналоги. Описываемый HBsAg может также относиться к мутантам, например известному (WO 91/14703; заявка на Европейский патент 0 511 855 А 1)"исчезающему мутанту", особенно HBsAg, в котором в положении 145 имеется замена глицина на аргинин. Обычно HBsAg будет в форме частиц. Частицы могут содержать, например, только S белок или могут быть составными частицами,например, (L, S), где L как определено выше,а S обозначает S-белок HBsAg. Вышеупомянутая частица находится преимущественно в той форме, в которой она экспрессируется в дрожжах. Препарат S-белка поверхностного антигена гепатита В известен (Harford et al (1983) in(1987) in Biotechnology, 5, page 479, ЕР 0 226 846, ЕР О 299 108 и ссылки в них). Препараты в объеме изобретения могут также содержать противоопухолевый антиген и 5 могут быть полезными для иммунотерапевтического лечения раковых заболеваний. Вакцинные препараты известны (Newet. al., патент США 4, 474, 757). Количество белка в каждой дозе вакцины подбирается как количество, которое вызывает иммунозащитный ответ без значительных вредных побочных эффектов в типичных вакцинах. Это количество будет изменяться в зависимости от того, какой специфический иммуноген используется и как он представлен. Обычно, предполагается, что каждая доза будет содержать 11000 мкг белка, предпочтительно 2-200 мкг,наиболее предпочтительно 4-40 мкг. Оптимальное количество для конкретной вакцины может быть установлено обычными опытами, включая наблюдение подходящих иммунных ответов у испытуемых. После первичной вакцинации субъекты могут получать одну или несколько повторных иммунизаций с соответствующими интервалами. Препараты по данному изобретению могут использоваться как для профилактических, так и для лечебных целей. Таким образом, согласно еще одному аспекту изобретения, предлагается применение вакцины по изобретению для лечения пациентов-людей. Изобретение предлагает способ лечения, при котором на пациента воздействуют эффективным количеством вакцины по настоящему изобретению. В частности, в изобретении предлагается способ лечения вирусных, бактериальных, паразитарных инфекций или рака,при котором на пациента воздействуют эффективным количеством вакцины по настоящему изобретению. Последующие примеры и данные иллюстрируют изобретение. Примеры 1.1. Способ получения липосом. Смесь липида (фосфатидилхолин либо из яичного желтка, либо синтетический) и холестерина в органическом растворителе высушивается под вакуумом (либо в потоке инертного газа). Затем добавляется водный раствор (забуференный фосфатом физиологический раствор) и сосуд взбалтывается до тех пор, пока весь липид не перейдет в суспензию. Затем эта суспензия подвергается микрофлюидизации до тех пор, пока размер липосом не уменьшится до 100 нм, и после этого стерильно фильтруется через 0,2 мкм фильтр. Эту стадию можно заменить экструзией или ультразвуковой обработкой. Обычно соотношение холестерин: фосфатидилхолин составляет 1:4 (масса/масса), а водный раствор добавляется для получения конечной концентрации холестерина от 5 до 50 мг/мл. 6 Если MPL в органическом растворе добавляется к липиду в органическом растворе, то конечные липосомы содержат MPL в мембране (обозначается как MPL внутренний). Липосомы имеют определнный размер,равный 100 нм, и обозначаются как SUV (для маленьких однослойных пузырьков). Если этот раствор повторно замораживается и оттаивает,пузырьки объединяются с образованием большой многослойной структуры (MLV) размером от 500 нм до 15 мкм. Сами по себе липосомы стабильны длительное время и не имеют тенденции к объединению. 1.2. Методика приготовления препарата. К липосомам добавляется QS21 в водном растворе. Затем эта смесь добавляется к раствору антигена, который может по желанию содержать MPL в форме 100 нм частиц. 1.3. Литическая активность QS21 ингибируется липосомами, содержащими холестерин. При добавлении QS21 к эритроцитам она лизирует их с высвобождением гемоглобина. Эта литическая активность может быть также измерена с использованием липосом, которые содержат холестерин в своей мембране и связанный флуоресцентный краситель, карбоксилфлуоресцеин - когда липосомы лизируются,краситель высвобождается, что может быть зарегистрировано с помощью флуоресцентной спектроскопии. Если флуоресцентные липосомы не содержат холестерина в своей мембране,лизис липосом не наблюдается. Если QS21 инкубируется с липосомами,содержащими холестерин, перед ее добавлением к эритроцитам, то лизис эритроцитов снижается в зависимости от соотношения холестерина и QS21. При соотношении 1:1 литической активности не обнаруживается. Если липосомы не содержат холестерин, то для ингибирования лизиса требуется тысячекратный избыток фосфолипида по отношению к QS21. То же самое остатся в силе при использовании флуоресцентных липосом для измерения литической активности. На графике, приведенном ниже, литическая активность 4 мкг QS21,обработанной липосомами без холестерина (1 мг лецитина желтка яйца на мл) или содержащими холестерин (1 мг лецитина, 500 мкг холестерина на мл) измерялась методом флуоресценции. Данные показывают, что QS21 связывается специфическим образом с холестерином в мембране, вызывая тем самым лизис (клеток или флуоресцентных липосом). Если QS21 сначала связывается с холестерином в липосомах, то он становится не литическим по отношению к клеткам или другим липосомам. Для этого необходимо соотношение как минимум 0,5:1xoлecт.:QS21 (масса/масса). Холестерин нерастворим в водных растворах и не образует стабильной суспензии. В присутствии фосфолипидов холестерин находится внутри фосфолипидного двойного слоя, который может образовывать стабильную суспензию пузырьков, называемых липосомами. Чтобы избежать необходимости добавления фосфолипидов, испытывалось растворимое производное. Себацат полиоксиэтанилхолестерина растворим в воде в концентрации 60 мг/мл, однако, даже при 2000-кратном избытке (масса/масса) по отношению к QS21 снижения литической активности QS21 не обнаруживалось. 1.4. Увеличение стабильности QS21 с помощью липосом, содержащих холестерин.QS21 очень чувствительна к гидролизу при рН выше 7. Гидролиз может быть отслежен измерением снижения пика, соответствующегоQS21 при HPLC (жидкостной хроматографии высокого разрешения) с обращенной фазой. Например, график, приведенный ниже, показывает, что при рН 9 и при температуре 37 С, 90%QS21 гидролизуется в течение 16 ч. Если к QS21 добавляются липосомы, содержащие холестерин, в соотношении 2:1 (холест.:QS21 масса/масса) при тех же условиях гидролиза QS21 не обнаруживается. При соотношении 1:1 10% Было сделано заключение, что когда QS21 связывается с липосомами, содержащими холестерин, она становится значительно менее чувствительной к опосредованному основанием гидролизу. Продукт гидролиза описан как не имеющий адьювантной активности при парентеральном введении, следовательно, вакцины,содержащие QS21, должны приготавливаться при кислом рН и храниться при 4 С для сохранения адьювантной композиции. Использование липосом может снять соблюдение этих условий. 1.5. Изучение реактогенности: Мышам инъецировали в большеберцовую мышцу 5 мкг QS21 (или дигитонина), добавленной к возрастающим количествам липосом (выраженных как мкг холестерина). Литическая активность выражается как мкг QS21 эквивалент, что означает количество QS21, необходимое для достижения такого же гемолиза, как в образце. Покраснение, некроз и токсичность в мышце в месте иньекции оценивали визуально после умерщвления мышей. ЛитиТоксичческая ПокрасПрепарат актив- нение Некроз ность ность ,мкг Данные показывают, что, когда литическая активность устраняется добавлением липосом,содержащих холестерин, токсичность благодаряQS21 также устраняется. 1.6. Внутримышечная реактогенность на кроликах. Значения в U.I. /л. Опыт Препарат Кролик 6 QS21 50 мкг Кролик 7 Хол. в SUV Кролик 8 50 мкг (1:1) Кролик 9 Кролик 10 Среднее значение среднеквадратического отклонения Опыт Препарат Кролик 11 QS21 50 мкг Хол. в SUV Кролик 12 Кролик 13 150 мкг (1:3) Кролик 14 Кролик 15 Среднее значение среднеквадратического отклонения Опыт Препарат Кролик 16 QS21 50 мкг Хол в SUV Кролик 17 Кролик 18 250 мкг (1:5) Кролик 19 Кролик 20 Среднее значение среднеквадратического отклонения Опыт ПрепаратPBS Кролик 21 Кролик 22 Кролик 23 Кролик 24 Кролик 25 Среднее значение среднеквадратического отклонения+ Данные показывают, что добавление холестеринсодержащих липосом к препарату значительно снижает повышение уровня СРК (креатинфосфокиназы), вызванное QS21. Поскольку увеличение СРК является показателем поражения мышцы, это указывает на уменьшение поражения мышцы и подтверждается гистопатологией. 1.7. Связывание комплекса липосомыQS21 с квасцами Al/OH/3.QS21 инкубировалась с нейтральными липосомами, содержащими избыток холестерина,и радиоактивным холестерином, а затем инкубировалась с таким соединением алюминия, как гидроксид алюминия Аl(ОН)3, в PBS. Ни нейтральные липосомы, ни QS21 сами по себе не связывались с гидроксидом алюминия в PBS,хотя отрицательно заряженные липосомы связывались. Однако, будучи вместе, QS21 и нейтральные липосомы связывались с гидроксидом алюминия. Супернатант не содержал ни QS21 (испытано тестом на орцинол), ни радиоактивного холестерина. Это показывет, что QS21 связалась с липосомами, что позволило комбинации липосомы-QS21 связаться с гидроксидом алюминия. Это может происходить вследствие отрицательного заряда, появившегося на липосомах за счет QS21, или вследствие появления на липосомах гидрофобных участков. Результат также подразумевает, что QS21 не экстрагирует холестерин из мембраны. Это показывает, что композиции по изобретению могут быть использованы в вакцинах, основой которых является такое соединение алюминия, как например,гидроксид алюминия. 1.8. Сравнение липосомального QS21/MPL и свободного QS21+MPL по способности индуцировать антитела и CMI.SUV приготовлялся экструзией (EYPC : холест: MPL 20:5:1). Для MPL внешнего липосомы приготовлялись без MPL, a MPL добавлялся в виде 100 нм частиц. QS21 добавлялся перед антигеном. Холест. : QS21 =5:1 (масса/масса). MLV приготовлялся 3-кратным замораживанием-оттаиванием SUV перед добавле 11 нием антигена. Чтобы иметь связанный антиген,его добавляли к SUV до замораживанияоттаивания, а QS21 добавляли после замораживания-оттаивания. Инкапсуляция антигена = 5% внутри, 95% снаружи. Мышам (balb/c для gD, В 10BR для RTSs) дважды делали иньекцию в мягкие ткани нижней части конечности. gD аg = 10 мкг RTSs Препарат 12 гликопротеин D из вируса простого герпеса.(HBsAg), генетически модифицированный таким образом, что он содержит эпитоп из спорозоидов Plasmodium falciparum. Титры анти HbsAg 15 дней после активной иммуннизации(внешний) индуцирует высокие титры антител,по меньшей мере так же хорошо, как и QS21 +MPL, индуцируя также IL2, маркр клеточноопосредованного иммунитета, при подавлении реактогенности QS21.IFN- 96 час (пг/мл) 1572 960 1113 15 863 15 373 15 715 15 764 15 567 44 181 15 814 105 Дополнительные результаты второго опыта - сравнение QS21 и QS21 в присутствии холестерина (SUV) у balb/c мышей с HSV gD в качестве антигена приведены ниже: Изотипы 7 дней после IIMPL/QS21 со свободным MPL/QS21. Липосомы = SUV, содержащий MPL в мембране Холест. : QS21 =6:1. Ответ проверялся спустя две недели после первой иммунизации. пролиф. IFN - g нг/мл+ QS21. При таком соотношении холестерина кQS21, QS21 не является токсичным на кроликах 13 Во втором опыте balb/c мыши иммунизировались в мягкие ткани нижних конечностейgp120 в присутствии QS21 или QS21 + SUV,содержащими холестерин. Измерялась цитотоксическая активность Т-лимфоцитов в клетках селезнки.CTL активность по меньшей мере такую же или лучше, чем один QS21. 2. Вакцины. 2.1. Препарат HBsAg L, S частиц.HBsAg L, S частицы могут быть приготовлены в виде препарата следующим образом. 1Q мкг HBsAg L, S частиц/дозу инкубировали 1 ч при комнатной температуре при перемешивании. Объм доводили с помощью воды для инъекций и раствора PBS, и окончательный объм составлял 70 мкл на дозу с водным раствором QS21 (10 мкг на дозу). рН поддерживался при 70,5. Подобные препараты могут быть приготовлены с использованием 1 и 50 мкг HBsAg L,S и также с использованием HBsAg S антигена. Эти препараты могут быть проверены вWoodchuck заместительной терапевтической модели с использованием Woodchuck антигенов в качестве модели.DQ QS21 (то есть QS21/холестерин или блокированная QS21) могут быть проверены в терапевтической модели Woodchuck, в которой 14 животные хронически инфицированы вирусом. Специфическая вакцина Woodchuck вируса гепатита может быть смешана с QS21 как таковой или DQ и без MPL или с ним, и введена животным каждый месяц в течение 6 месяцев. Эффективность вакцины может быть определена посредством клиренса вирусной ДНК. 2.2. Модель на морских свинках (HSV). 2.2.1. Профилактическая модель. Группе из 12 самок морских свинок Hartley либо делали внутримышечную инъекцию на день 0 и день 28 следующих препаратов. Первый опыт:SUV, содержащий 62,5 мкг холестерина,либо оставляли необработанными. У животных бралась кровь на 14 и 28 день после второй иммунизации, и проверялась сыворотка на титры gD-специфических ELISA(твердофазный иммуноферментный анализ) антител. Затем животным проводилось внутривлагалищное введение 105 бляшкообразующих единиц HSV-2- MS штамма. Они наблюдались ежедневно с 4 дня до 12 дня для оценки первичных герпетических повреждений. Наблюдались следующие показатели. Вагинальные повреждения:- покраснение от 1 до 2 дней без кровотечения = 0,5;- покраснение без кровотечения, продолжающееся по меньшей мере 3 дня = 1. Наружные герпетические пузырьки:-= 4 маленьким пузырькам или один большой пузырек 4= 4 большие повреждения 8 слившиеся большие повреждения =16;- слившиеся большие повреждения на наружной поверхности гениталий =32. Результаты приведены ниже в таблице. Профилактическая модель Опыт 1 (хол соответствует SUV, содержащему холестерин) ПЕРВИЧНОЕ ЗАБОЛЕВАНИЕ ПИ Ин- Снижение Тяжесть Случаи Животные Случаи пораже декс против наружн. вагин. без пораний конт роля поражежений % поражеСредне ний % ний % 50 33 17 73 93% 1,50 64 18 18 67 93% 2,50 100 0 0 0 100% 50 33 17 54 95% 0,75 25 0 75 996 55,00 Опыт 2 ПЕРВИЧНОЕ ЗАБОЛЕВАНИЕ Животные без повреждений Снижение против контроля 94%n Тяжесть повреждений Среднее 1,00 5 11,50 10 В терапевтической модели самкам морских свинок Hartley сначала вводили 105 бляшкообразующих единиц HSV-2 MS штамма. Затем животные с герпетическими поражениями выборочно распределялись в группы по 16. На 21 и 42 день они либо иммунизировались одним из следующих препаратов:- gD + MPL 50 мкг + QS21 50 мкг + SUV,содержащий 250 мкг холестерина,- gD + Аl(ОН)3 + MPL 50 мкг + QS21 50 мкг + SUV, содержащий 250 мкг холестерина,либо оставлялись необработанными. Они наблюдались ежедневно с 22 по 75 день для оценки рецидивирующего заболевания. Оценку производили так же, как описано в профилактической модели. Результаты приведены ниже в таблице и графике. Сумма случаев повреждений для дней 412 после инфицирования (животные без повреждений не учитывались). Величины повреждений: без повреждений изменений (0), вагинальные повреждения (0,5 или 1), внешние кожные пузырьки (2, 4, 8 или 16).Первичный инфекционный индекс = СУММА (максим, оценка i) x (% случаев); где i= 0, 0,5, 1, 2, 4, 8 или 16. Таблица и график показывают, что в профилактической модели индуцируется очень высокий уровень защиты от первичного заболевания при иммунизации посредством gD/MPL/QS21/SUV. Как случаи внешних повреждений,так и тяжесть повреждений значительно снижены в группе животных, иммунизированных посредством gD/MPL/QS21/SUV. 2.2. Терапевтическая модель. Тяжесть% сниже- Средняя % сниже- Среднее % снижения прония прония против тив контив конконтроля троля троля 43% 7,00 18% 3,00 14% 46% 7,00 18% 3,00 14% Сумма показателей поражений на 22-75 день после инфицирования.Количество дней с рецидивирующими поражениями у животных на 22-75 день после инфицирования.Количество приступов рецидивов на 22-75 день после инфицирования. Одному приступу предшествует и за ним следует день без повреждений, характеризующийся, по меньшей мере, двумя днями эритемы (величина появления = 0,5) или одним днм появления наружных пузырьков (величина=2). Иммунотерапия проводилась на 21 и 42 день. Результаты показали, что хороший уровень защиты был также получен в терапевтической модели инфекции HSV-2. Иммунизация посредством gD/MPL/QS21/SUV с гидроксидом алюминия, или без него оказывала заметный эффект на среднюю тяжесть рецидивирующего заболевания. Она также несколько снижала количество приступов и их продолжительность(см. таблицу). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Липосомальная вакцинная композиция,содержащая антиген или антигенную композицию, иммунологически активную сапониновую фракцию и стерин, характеризующаяся тем, что отношение сапониновая фракция : стерин составляет от 1:1 до 1:100 (по массе). 2. Вакцинная композиция по п.1, отличающаяся тем, что отношение сапониновая фракция : стерин составляет от 1:1 до 1:5 (по массе). 3. Вакцинная композиция по п.1, отличающаяся тем, что отношение сапониновая фракция: стерин составляет 1:2 (по массе). 4. Вакцинная композиция по любому из пп.1-3, отличающаяся тем, что иммунологически активная сапониновая фракция представляет собой QS21. 5. Вакцинная композиция по любому из пп.1-3, отличающаяся тем, что стерин представляет собой холестерин. 6. Вакцинная композиция по любому из пп.1-5, которая дополнительно содержит 3 деацилированный монофосфорил-липид А. 18 7. Вакцинная композиция по любому из пп.1-6, которая дополнительно содержит носитель, представляющий собой соль алюминия,или гидроксид алюминия, или эмульсию типа"масло в воде". 8. Вакцинная композиция по любому из пп.1-7, отличающаяся тем, что антиген или антигенная композиция получены на основе вируса иммунодефицита человека, вируса иммунодефицита кошачьих, вируса ветряной оспы, вируса простого герпеса типа 1, вируса простого герпеса типа 2, цитомегаловируса человека, вируса гепатита А, В, С или Е, респираторносинцитиального вируса, папилломавируса человека, вируса гриппа, возбудителя меннингитаHaemphilis influenzae типа b, Salmonella,Neisseria, Borrelia, Chlamydia, Bordetella,Plasmodium или Toxoplasma. 9. Вакцинная композиция по любому из пп.1-7, отличающаяся тем, что антиген или антигенная композиция получены из опухоли. 10. Вакцинная композиция по любому из пп.1-9, используемая в медицине. 11. Применение липосомальной композиции, содержащей иммунологически активную сапониновую фракцию и стерин, характеризующейся тем, что отношение сапониновая фракция : стерин составляет от 1:1 до 1:100 (по массе), для приготовления вакцины для превентивного и/или иммунотерапевтического лечения вирусных, бактериальных или паразитарных инфекций или рака. 12. Способ лечения млекопитающего,страдающего от вызванной патогенами или чувствительного к данной инфекции, отличающийся тем, что млекопитающему вводят безопасное и эффективное количество композиции по любому из пп.1-8. 13. Способ лечения млекопитающего,страдающего от рака или чувствительного к раковому заболеванию, отличающийся тем, что млекопитающему вводят безопасное и эффективное количество композиции по п.9. 14. Способ приготовления вакцинной композиции по любому из пп.1-9, заключающийся в том, что смешивают иммунологически активную сапониновую фракцию и стерин, в частности холестерин, с антигеном или антигенной композицией.
МПК / Метки
МПК: A61K 39/39
Метки: приготовления, композиции, липосомальная, лечения, млекопитающего, вакцинной, применение, композиция, вакцинная, способ, липосомальной
Код ссылки
<a href="https://eas.patents.su/10-839-liposomalnaya-vakcinnaya-kompoziciya-primenenie-liposomalnojj-vakcinnojj-kompozicii-sposob-prigotovleniya-liposomalnojj-vakcinnojj-kompozicii-i-sposob-lecheniya-mlekopitayushhego.html" rel="bookmark" title="База патентов Евразийского Союза">Липосомальная вакцинная композиция, применение липосомальной вакцинной композиции, способ приготовления липосомальной вакцинной композиции и способ лечения млекопитающего.</a>
Предыдущий патент: Cпособ конверсии газа в жидкость
Случайный патент: Подгузник одноразового использования