Способ получения производных 4-трифторметилсульфинилпиразола
Номер патента: 5077
Опубликовано: 28.10.2004
Авторы: Ле Бар Сильви, Шарро Филипп, Пельта Изабелль, Клавель Жан-Луи
Формула / Реферат
1. Способ получения соединения формулы (I)
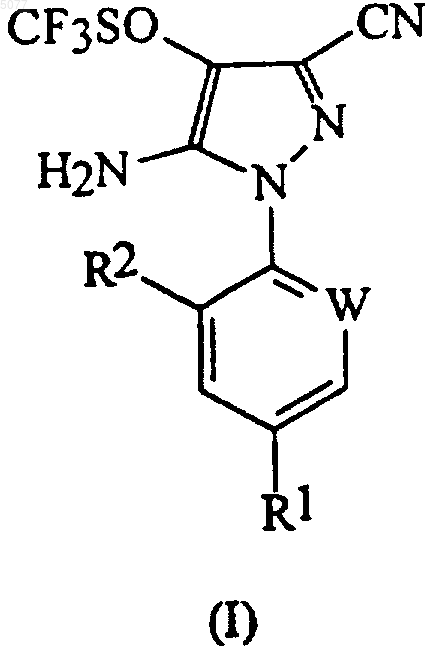
в которой W означает азот или -CR3; R1 означает галоген, галоC1-6алкил, галоC1-6алкокси, R4S(O)n- или -SF5; R2 означает водород или галоген; R3 означает галоген; R4 означает C1-6алкил или галоC1-6алкил и n означает 0, 1 или 2, включающий окисление соединения формулы (II)
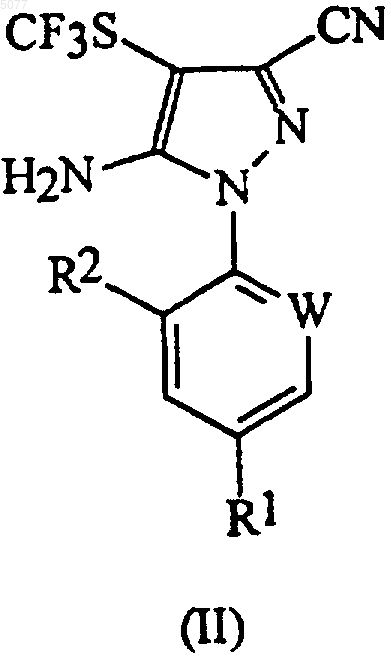
в которой радикалы R1, R2 и W имеют значения, указанные выше, трифторперуксусной кислотой в присутствии соединения, ингибирующего коррозию, - борной кислоты.
2. Способ по п.1, в котором трифторперуксусная кислота образуется in situ в результате взаимодействия трифторуксусной кислоты и пероксида водорода.
3. Способ по п.1 или 2, в котором количество используемого соединения, ингибирующего коррозию, составляет примерно 0,08-0,2 мол.экв.
4. Способ по любому из предшествующих пунктов, в котором количество используемой трифторуксусной кислоты составляет от 14 до 15 мол.экв.
5. Способ по любому из предшествующих пунктов, в котором количество используемого в реакции пероксида водорода составляет 1,3-1,5 экв.
6. Способ по любому из предшествующих пунктов, в котором реакцию осуществляют при температуре от 10 до 15шC.
7. Способ по любому из предшествующих пунктов, который дополнительно включает добавление хлорбензола в реакционную смесь по окончании реакции окисления и извлечение трифторуксусной кислоты перегонкой.
8. Способ по п.1, в котором соединение формулы (II) получают добавлением диоксида серы в смесь, содержащую дисульфид формулы (III)
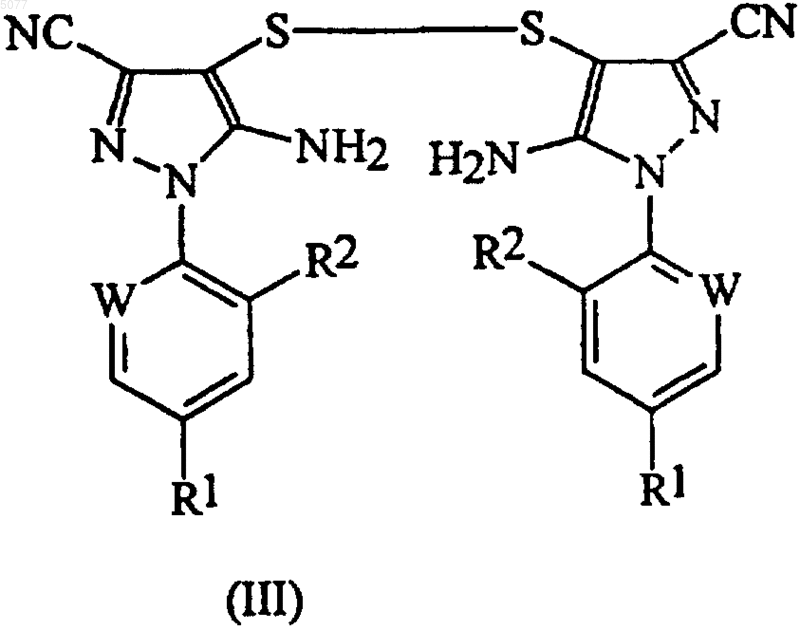
в которой радикалы R1, R2 и W имеют значения, определенные в п.1, соль муравьиной кислоты, трифторметилбромид и полярный растворитель.
9. Способ по п.8, в котором растворителем является N,N-диметилформамид.
10. Способ по п.8 или 9, в котором температура реакции в процессе введения диоксида серы составляет от 35 до 55шC.
11. Способ по пп.8, 9 или 10, в котором диоксид серы добавляют в течение времени от 0,5 до 2 ч.
12. Способ по любому из пп.8-11, в котором молярное отношение трифторметилбромид:дисульфид формулы (III) составляет от 3:1 до 5:1.
13. Способ по любому из пп.8-12, в котором количество использованного диоксида серы составляет 1,2-1,5 мол.экв. по отношению к дисульфиду формулы (III).
14. Способ по любому из пп.8-13, в котором количество использованной соли муравьиной кислоты относительно дисульфида формулы (III) составляет 4-6 мол.экв.
15. Способ по п.8, в котором дисульфид формулы (III)

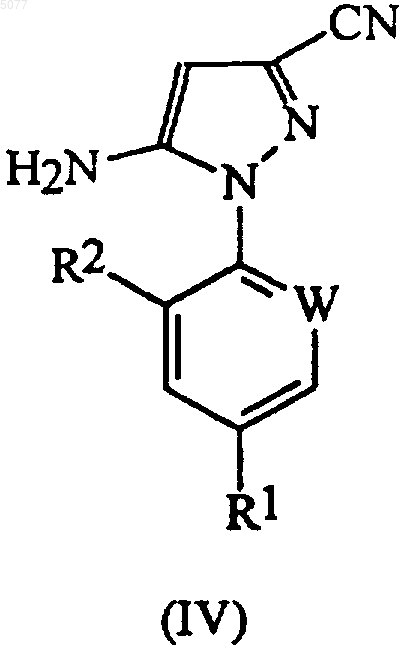
в которой W означает азот или -CR3; R1 означает галоген, галоC1-6алкил, галоC1-6алкокси, R4S(O)n- или -SF5; R2 означает водород или галоген, получают добавлением монохлорида серы (S2Cl2) к раствору соединения формулы (IV) в органическом растворителе
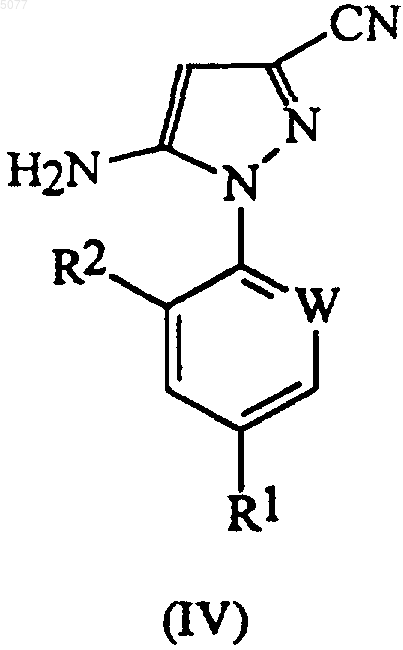
в которой радикалы R1, R2 и W имеют значения, определенные выше.
16. Способ по п.15, в котором растворитель выбирают из толуола, дихлорметана или дихлорэтана, таких алифатических или ароматических нитрилов, как ацетонитрил, пропионитрил, метилглутаронитрил и бензонитрил; или их смесей, необязательно в виде смеси с хлорбензолом.
17. Способ по п.15 или 16, в котором растворителем является ацетонитрил.
18. Способ по пп.15, 16 или 17, в котором монохлорид серы имеет чистоту 99,4-99,9% вес./вес.
19. Способ по любому из пп.15-18, в котором при использовании в качестве растворителя ацетонитрила содержание воды составляет <1000 ч/млн, содержание этанола <1500 ч/млн и содержание аммиака <100 ч/млн.
20. Способ по любому из пп.15-19, в котором продолжительность добавления монохлорида серы составляет 1-10 мин.
21. Способ по любому из пп.15-20, в котором температура реакции смеси в начале добавления монохлорида серы составляет от 5 до 25шC.
22. Способ по любому из пп.15-21, который дополнительно включает очистку дисульфида формулы (III)
a) нагреванием реакционной смеси, содержащей дисульфид, при пониженном давлении с удалением хлорида водорода;
b) нагреванием образующейся дегазированной реакционной смеси при атмосферном давлении с последующим охлаждением до примерно 30шC;
c) доведением величины pH реакционной смеси до 6,5-7 добавлением слабого основания и
d) охлаждением смеси до температуры примерно 5шC и выделением желательного дисульфида фильтрованием.
23. Способ получения соединения формулы (I)
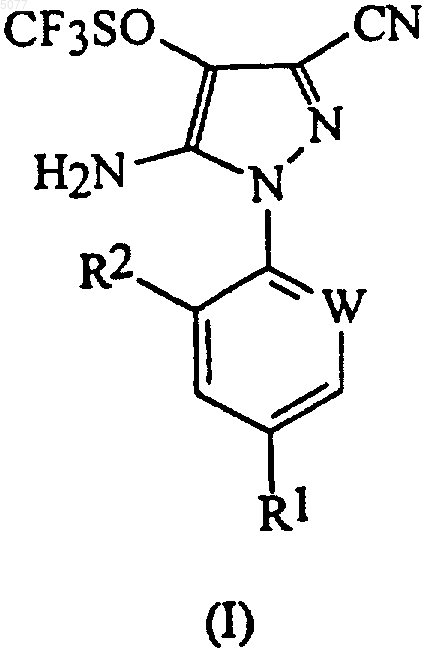
в которой W означает азот или -CR3; R1 означает галоген, галоC1-6алкил, галоC1-6алкокси, R4S(O)n- или -SF5; R2 означает водород или галоген; R3 означает галоген; R4 означает C1-6алкил или галоC1-6алкил; и n означает 0, 1 или 2, включающий
a) добавление монохлорида серы (S2Cl2) к раствору соединения формулы (IV) в органическом растворителе
в которой радикалы R1, R2 и W имеют значения, определенные выше, с образованием дисульфида формулы (III)
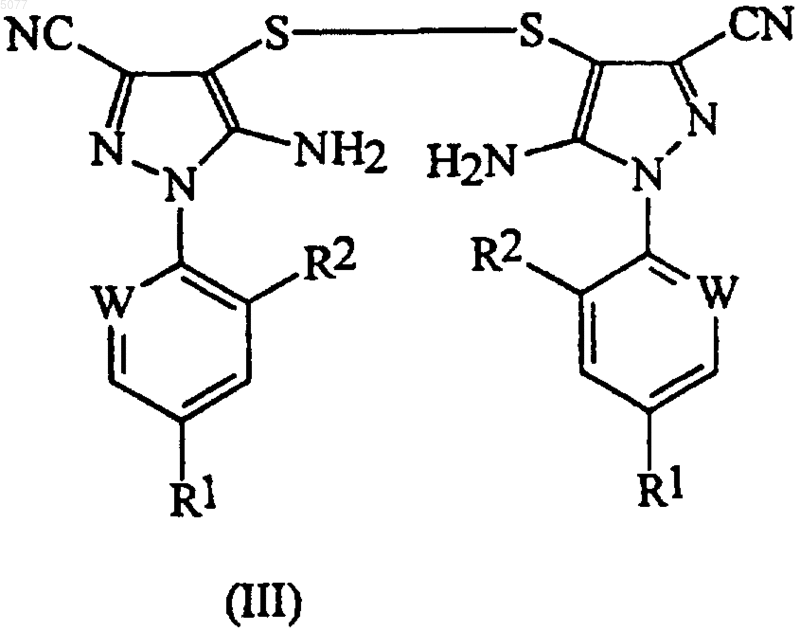
в которой радикалы R1, R2 и W имеют те же значения, что определены выше;
b) добавление диоксида серы к смеси, содержащей указанный дисульфид формулы (III), соль муравьиной кислоты, трифторметилбромид и полярный растворитель, с образованием соединения формулы (II)
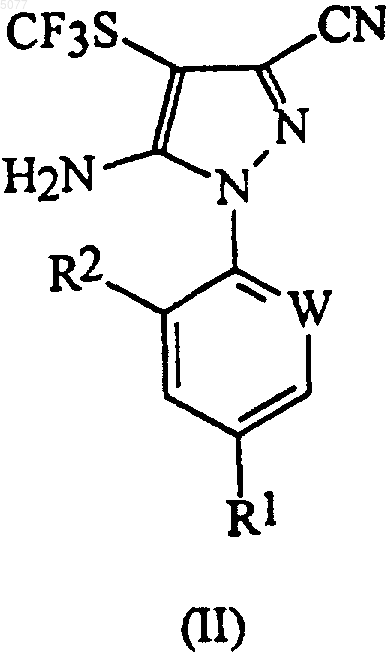
в которой радикалы R1, R2 и W имеют те же значения, что определены выше; и
c) окисление указанного соединения формулы (II) трифторперуксусной кислотой в присутствии соединения, ингибирующего коррозию, - борной кислоты.
24. Способ по любому из пп.1-7 или 23, в котором соединением формулы (I) является 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразол.
25. Способ по любому из пп.7-14 или 23, в котором соединением формулы (II) является 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилтиопиразол.
26. Способ по любому из пп.15-23, в котором соединением формулы (III) является 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-цианопиразол-4-ил дисульфид.
27. Способ по любому из предшествующих пунктов, в котором R1 означает трифторметил, трифторметокси или -SF5; W означает -CR3 и R2 и R3 означают хлор.
Текст
1 Настоящее изобретение относится к усовершенствованным способам получения таких пестицидов на основе 1-арилпиразола, как 5 амино-1-(2,6-дихлор-4-трифторметилфенил)-3 циано-4-трифторметилсульфинилпиразол, известный как Фипронил (Fipronil (Pesticide Manual 11thEdition, и промежуточных соединений, используемых при получении 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилтиопиразола и 5-амино-1-(2,6-дихлор-4 трифторметилфенил)-3-цианопиразол-4-ил дисульфида. В публикации европейского патента 295117 описано получение 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразола окислением 5-амино-1(2,6-дихлор-4-трифторметилфенил)-3-циано-4 трифторметилтиопиразола 3-хлорпербензойной кислотой. Известно, что трифторуксусная кислота и пероксид водорода (образующие трифторперуксусную кислоту in situ) используются для окисления сульфидов в сульфоксиды и/или сульфоны, и этот метод обычно используют для окисления сульфидов с недостатком электронов,таких как трифторметилсульфиды, которые не так легко окисляются, как другие сульфиды. Такие методы описаны в литературе, например,при получении некоторых пестицидов на основе 1-арилпиразола. Проблемой, возникающей при получении 5-амино-1-(2,6-дихлор-4-трифторметилфенил)3-циано-4-трифторметилсульфинилпиразола окислением 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилтиопиразола, является одновременное образование соответствующего сульфонового соединения 5 амино-1-(2,6-дихлор-4-трифторметилфенил)-3 циано-4-трифторметилсульфонилпиразола, которое трудно удалить из сульфоксида. В попытке достичь эффективного и направленного избирательного окисления с получением 5-амино 1-(2,6-дихлор-4-трифторметилфенил)-3-циано 4-трифторметилсульфинилпиразола в чистом виде использован ряд окислителей (включая, в числе других, ванадат натрия, вольфрамат натрия, перуксусную кислоту, пермуравьиную кислоту и пертрихлоруксусную кислоту), которые также могут быть использованы при высокотоннажных способах получения. Установлено, что вышеперечисленные способы неудовлетворительны в том или ином отношении. Авторами изобретения установлено, что смесь трифторуксусной кислоты и пероксида водорода (трифторперуксусной кислоты) дает отличные результаты как в отношении избирательности, так и выхода целевого продукта. Однако проблема использования смеси трифторуксусной кислоты и пероксида водорода в больших масштабах заключается в том, что она приводит к коррозии стеклянных облицовок реакторов, которая протекает быстро (обычно 300 мкм/год) даже при температурах окружаю 005077 2 щей среды, а при 80 С скорость коррозии возрастает до примерно 1430 мкм/год. Эта коррозия является результатом образования фторида водорода и поэтому не позволяет использовать указанную реакционную смесь в таких реакторах. Найдено, что добавление к реакционной смеси такого ингибирующего коррозию соединения, как борная кислота, приводит к ингибированию процесса коррозии и снижению скорости коррозии до уровня, который обычно составляет менее, чем 5 мкм/год. В европейском патенте 0374061 и публикации J-L. Clavel et al. в J. Chem. Soc. Perkin I(1992), 3371-3375, описаны получение 5-амино 1-(2,6-дихлор-4-трифторметилфенил)-3-цианопиразол-4-ил дисульфида и последующая конверсия этого дисульфида в пестицидно активный 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилтиопиразол путем взаимодействия с трифторметилбромидом в присутствии формиата натрия и диоксида серы в N,N-диметилформамиде в автоклаве при низком давлении (обычно 13 бар) при 60 С. Однако при осуществлении в большом масштабе реакция является очень экзотермической, что приводит к значительному увеличению давления в реакторе и сопряженной с этим опасностью работы оператора. Кроме того, необходимо вводить трифторметилбромид быстро (обычно в пределах 0,5 ч),потому что найдено, что смесь дисульфида,формиата натрия, диоксида серы и N,N-диметилформамида является нестабильной (обычно сопровождающейся разложением на 55% с образованием нежелательных побочных продуктов в течение 2 ч при 50 С). Данное требование быстрого введения трифторметилбромида несовместимо с экзотермическим характером реакции. Чтобы преодолеть указанные проблемы и разработать способ, который можно было бы использовать для высокотоннажного синтеза,предложены другие условия. В вышеописанных способах реакцию осуществляют, добавляя трифторметилбромид к смеси других компонентов. Разработан новый способ, в котором порядок введения реагентов другой. Европейская патентная публикация 0374061 описывает получение 5-амино-1-(2,6 дихлор-4-трифторметилфенил)-3-цианопиразол 4-ил дисульфида взаимодействием 5-амино-1(2,6-дихлор-4-трифторметилфенил)-3-циано-4 тиоцианатопиразола с основанием и последующей конверсией данного дисульфида в пестицидно активный 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилтиопиразол. Европейская патентная публикация 295117 описывает способ получения 1-арил 3,5-двузамещенных-пиразол-4-ил дисульфидов гидролизом соответствующих производных 4 тиоцианатопиразола с использованием соляной кислоты в этаноле, восстановлением с исполь 3 зованием боргидрида натрия в этаноле или обработкой водного раствора гидроксида натрия в условиях фазового превращения в присутствии хлороформа и бензилтриэтиламмонийхлорида. Получение вышеуказанных промежуточных соединений 5-амино-1-арил-3-циано-4-тиоцианатопиразола также описано в европейских патентных публикациях 0374061 и 295117, и их получают тиоцианированием соответствующих производных 5-амино-1-арил-3-цианопиразола с использованием щелочного металла или тиоцианата аммония в присутствии брома и метанола при низкой температуре. Вышеназванный двухстадийный способ получения промежуточных соединений 5-амино-1-арил-3-цианопиразол-4-ил дисульфида из 5-амино-1-арил-3-цианопиразолов сопряжен с несколькими проблемами, которые ограничивают его использование в высокотоннажном синтезе:i) стадию тиоцианирования обычно осуществляют при низких температурах;ii) смесь брома и метанола, используемая для проведения реакции тиоцианирования, может образовывать взрывоопасные смеси;iii) вышеперечисленные реакции включают гетерогенные смеси; иiv) трудно достичь полноты превращений в продукт на любой из стадий реакции. Для того чтобы решить указанные проблемы, предложены другие условия. Так, взрывоопасности реакции тиоцианирования можно избежать, заменив метанол смесью дихлорметана и воды, однако этот метод не эффективен в случае высокотоннажного синтеза. В альтернативном варианте, реакция тиоцианирования может быть успешно осуществлена с использованием щелочного металла или тиоцианата аммония в присутствии пероксида водорода и такой неорганической кислоты, как соляная кислота, в среде такого растворителя,как спирт, например метанол. Разработан усовершенствованный метод для проведения последующей стадии гидролиза, которая включает использование такого основания, как гидроксид щелочного металла, например гидроксид натрия, в присутствии формальдегида и такого растворителя, как водный раствор метанола,однако, полученный таким образом дисульфид является высокодисперсным порошком и трудно фильтруется. Кроме того, для того чтобы получить вышеназванный дисульфид в удовлетворительном количестве, необходимо подвергнуть исходный материал 5-амино-1-арил-3-цианопиразол дополнительной очистке перед использованием его в реакциях тиоцианирования и гидролиза. Поэтому можно видеть, что вышерассмотренный двухстадийный метод не эффективен при осуществлении в промышленном масштабе и,очевидно, предпочтительным будет одностадийный способ, лишенный указанных недостатков. 4 Настоящее изобретение относится к усовершенствованным или более экономичным способам получения пестицидов. Первой задачей настоящего изобретения является удобный способ получения пестицидов на основе 5-амино-1-арил-3-циано-4-трифторметилсульфинилпиразола с высоким выходом и высокой чистотой. Другой задачей настоящего изобретения является способ получения пестицидов на основе 5-амино-1-арил-3-циано-4-трифторметилсульфинилпиразола, который прост и безопасен в осуществлении и который приводит к минимальной коррозии реактора. Еще одной задачей настоящего изобретения является способ получения пестицидов на основе 5-амино-1-арил-3-циано-4-трифторметилсульфинилпиразола, который включает процедуру эффективного восстановления трифторуксуной кислоты. Еще одной задачей настоящего изобретения является удобный способ получения пестицидов на основе 5-амино-1-арил-3-циано-4-трифторметилтиопиразола и пестицидных промежуточных соединений, которые образуются с высоким выходом и высокой чистотой с улучшенной конверсией 5-амино-1-арил-3-цианопиразол-4-ил дисульфида. Еще одной задачей настоящего изобретения является способ получения пестицидов на основе 5-амино-1-арил-3-циано-4-трифторметилтиопиразола и пестицидных промежуточных соединений, который прост и безопасен в осуществлении, протекает при низких давлениях и температурах и в котором минимальны побочные реакции. Другой задачей настоящего изобретения является удобный способ получения пестицидных промежуточных соединений 5-амино-1-арил-3 цианопиразол-4-ил дисульфида, которые образуются с высоким выходом и высокой чистотой. Еще одной задачей настоящего изобретения является одностадийный способ получения пестицидных промежуточных соединений 5 амино-1-арил-3-цианопиразол-4-ил дисульфида из промежуточных соединений 5-амино-1-арил 3-цианопиразола. Еще одной задачей настоящего изобретения является способ получения пестицидных промежуточных соединений 5-амино-1-арил-3 цианопиразол-4-ил дисульфида, который прост и безопасен в осуществлении, предусматривает использование легкодоступных материалов,обеспечивает эффективное выделение продукта и не требует дополнительной очистки исходного 5-амино-1-арил-3-цианопиразола. Еще одной задачей настоящего изобретения является удобный способ получения пестицидов на основе 5-амино-1-арил-3-циано-4-трифторметилсульфинилпиразола трехстадийным способом, исходя из 5-амино-1-арил-3-цианопиразолов. 5 Указанные и другие задачи изобретения будут очевидны из следующего описания и полностью или частично достигаются настоящим изобретением. Согласно отличительной особенности настоящего изобретения разработан усовершенствованный способ (А) получения соединения формулы (I) в которой W означает азот или -CR3; R1 означает галоген, галоС 1-6 алкил, галоС 1-6 алкокси, R4S(O)nили -SF5; R2 означает водород или галоген; R3 означает галоген; R4 означает C1-6 алкил или галоС 1-6 алкил и n означает 0, 1 или 2, включающий окисление соединения формулы (II) в которой радикалы R1, R2 и W имеют значения,указанные выше, трифторперуксусной кислотой в присутствии соединения, ингибирующего коррозию, такого как борная кислота. В предпочтительном варианте осуществления изобретения трифторперуксусная кислоты образуется in situ в результате взаимодействия трифторуксусной кислоты и пероксида водорода. Соответственно, указанный вариант осуществления включает обработку соединения формулы (II), определенного выше, трифторуксусной кислотой и пероксидом водорода. Если специально не определено в настоящем описании, то термин "алкил" означает прямой или разветвленный цепочечный алкил, содержащий от 1 до 6 атомов углерода (предпочтительно от 1 до 3). Если специально не определено, то "галоалкил" и "галоалкокси" означают прямые или разветвленные цепочечные алкилы или алкоксигруппы соответственно, содержащие от 1 до 6 атомов углерода (предпочтительно от 1 до 3), замещенные 1 или большим числом атомов галогена, выбранных из фтора, хлора и брома. Когда R1 означает R4S(O)n- и n равно 0 или 1, то способ может протекать как окисление до соответствующего соединения, в котором n равно 1 или 2 соответственно. 6 Количество используемого ингибирующего коррозию соединения составляет обычно 0,08-0,22 мол.экв., предпочтительно примерно 0,08-0,1 мол.экв. Количество используемой трифторуксусной кислоты составляет обычно 14-15 мол.экв. Количество пероксида водорода влияет на ход реакции, поскольку избыток его приводит к образованию соответствующего сульфона соединения формулы (I), тогда как его недостаток приводит к неполному превращению, и в любом случае образуется загрязненный конечный продукт. Таким образом, количество пероксида водорода, используемого в реакции (обычно в виде 35%-ного водного раствора), обычно составляет 1,3-1,5 экв., предпочтительно примерно 1,31-1,35 экв. и более предпочтительно примерно 1,33 экв. Реакцию обычно осуществляют при температуре от 10 до 15 С, предпочтительно примерно при 12 С. Другая задача, связанная с использованием трифторуксусной кислоты и пероксида водорода, касается извлечения и рециркуляции дорогостоящей трифторуксусной кислоты, что важно для осуществления экономически эффективного способа. В одном из методов, разработанных в попытке решить указанную задачу, реакцию обрывают диоксидом серы и часть трифторуксусной кислоты удаляют перегонкой. Затем к остатку добавляют избыток этанола с получением этилтрифторацетата, который затем отгоняют. После этого продукт перекристаллизовывают из смеси этанол/вода. Установлено, что такой метод обладает двумя недостатками:i) смесь этанол/вода не обеспечивает образования достаточно чистого 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразола; иii) рециркуляция трифторуксусной кислоты, полученной кислотным гидролизом этилтрифторацетата, в большом масштабе является сложным процессом и сопровождается образованием большого количества нежелательного сульфата натрия, что, таким образом, ставит задачу утилизации отходов. Авторами изобретения разработан новый способ, который является техническим решением обеих указанных задач, и, таким образом,обеспечивает простой и эффективный способ получения 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразола с высокими показателями выхода и чистоты, и, помимо этого, обеспечивает эффективный метод восстановления трифторуксусной кислоты. В этом способе, когда взаимодействие трифторуксусной кислоты и пероксида водорода считают полным, избыток пероксида водорода обычно гасят диоксидом серы (или эквивалентным реагентом), добавляют хлорбензол и трифторуксусную кислоту извлекают перегонкой. Обычно трифторуксусную кислоту извле 7 кают азеотропной перегонкой при пониженном давлении. Затем к остатку добавляют такой спирт, как метанол, этанол или изопропанол(предпочтительно этанол), и нагревают примерно при 80 С до образования раствора, затем охлаждают примерно до 40 С, при этом кристаллизуется 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразол. Спирт выпаривают при 40 С при пониженном давлении, смесь охлаждают примерно до 0 С,фильтруют и продукт промывают и сушат под вакуумом. Установлено, что единственным промышленным растворителем, совместимым со смесью, является хлорбензол, который имеет точку кипения значительно выше, чем точка кипения трифторуксусной кислоты, и обеспечивает кристаллизацию 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразола с хорошими показателями выхода и качества. Таким образом, в предпочтительном аспекте способ настоящего изобретения, описанный выше, включает добавление хлорбензола в реакционную смесь по завершении реакции окисления и извлечение трифторуксусной кислоты перегонкой. В соответствии с другой отличительной особенностью настоящее изобретение относится к усовершенствованному способу (В) получения соединения формулы (II), определенного выше; причем указанный способ включает добавление диоксида серы к смеси, содержащей дисульфид формулы (III) в которой радикалы R1, R2 и W имеют значения,определенные выше; соль муравьиной кислоты,трифторметилбромид и полярный растворитель. Полярный растворитель обычно выбирают из таких соединений, как N,N-диметилформамид,N,N-диметилацетамид, N-метилпирролидинон,диметилсульфоксид, сульфолан, гексаметилфосфорамид, и таких простых эфиров, как диоксан, тетрагидрофуран и диметоксиэтан. Предпочтительно это N,N-диметилформамид, N,Nдиметилацетамид, N-метилпирролидинон, диметилсульфоксид или сульфолан, более предпочтительно N,N-диметилформамид. Преимущества осуществления способа с указанным порядком введения заключаются в следующем:i) смесь дисульфида формулы (III), формиата натрия, трифторметилбромида и полярно 005077 8 го растворителя (предпочтительно N,N-диметилформамида) стабильна, и поэтому диоксид серы может быть добавлен медленнее, без риска разложения, обеспечивая тем самым более удобный и безопасный способ;ii) новый способ является эффективным,так как отличается высокими выходами продукта и высокой степенью превращения дисульфида; иiii) скорость добавления диоксида серы можно регулировать, поэтому любое повышение температуры реакции и/или давления можно поддерживать на безопасном уровне, обеспечивая таким образом возможность безопасного осуществления высокотоннажного процесса(включая, например, типичные промышленные реакторы объемом примерно 15 м 3). Солью муравьиной кислоты обычно является соль щелочного металла или аммония,предпочтительно формиат натрия. Температура реакции в процессе добавления диоксида серы обычно составляет 35-55 С,предпочтительно примерно 35-50 С, наиболее предпочтительно примерно 43-47 С, что позволяет эффективно регулировать процесс выделения тепла в процессе экзотермической реакции. При температуре ниже 35 С реакция протекает слишком медленно для использования еe в промышленном способе. При температурах свыше 55 С выход и качество продукта снижаются. Диоксид серы обычно добавляют с такой скоростью, чтобы температура сохранялась в пределах вышеуказанного диапазона значений. В случае высокотоннажного производства обычно это осуществляют в течение 0,5-2 часового периода, предпочтительно в течение примерно 1-1,5 ч. Показано, что время добавления примерно 1-1,5 ч является оптимальным для минимизации образования побочных продуктов. Молярное отношение трифторметилбромид: дисульфид формулы (III) предпочтительно составляет от 3:1 до 5:1. Целесообразно использовать молярное отношение примерно 3:1. Количество используемого диоксида серы обычно составляет от 1,2 до 1,5 мол.экв. по отношению к дисульфиду формулы (III) и предпочтительно примерно 1,3 мол.экв. Когда используют только 1 экв., то выход продукта снижается и превращение дисульфида оказывается неполным, тогда как при избытке диоксида серы происходит деструкция в процессе выпаривания растворителя при последующей переработке. Количество используемой соли муравьиной кислоты обычно составляет 4-6 мол.экв. относительно дисульфида формулы (III), предпочтительно примерно 4,5-5,5 мол.экв. Совместное снижение количества диоксида серы и соли муравьиной кислоты можно осуществлять до тех пор, пока отношение диоксид серы:дисульфид составляет примерно 1,2:1, а отношение соль муравьиной кислоты:дисульфид составляет примерно 4,5:1. 9 Используя способ согласно вышеприведенному описанию, давление в реакторе обычно легко поддерживать в безопасном диапазоне от 3 до 6 бар. В соответствии с другой отличительной особенностью настоящее изобретение относится к способу (С) получения дисульфида формулы(III), определенной выше; указанный способ включает добавление монохлорида серы (S2Cl2) к раствору соединения формулы (IV) в органическом растворителе в которой радикалы R1, R2 и W имеют указанные выше значения. Реакцию предпочтительно осуществляют в среде растворителя, выбранного из толуола,дихлорметана или дихлорэтана или таких алифатических или ароматических нитрилов, как ацетонитрил, пропионитрил, метилглутаронитрил и бензонитрил; или их смесей, необязательно в виде смеси с хлорбензолом (который присутствует, когда используют раствор соединения формулы (IV), образующийся на предшествующей реакционной стадии). Ацетонитрил необязательно в присутствии хлорбензола является предпочтительным растворителем реакции. Реакция очень чувствительна к влиянию растворителя, и хотя удобным может быть использование толуола, поскольку с предыдущей реакционной стадии может быть использован толуольный раствор соединения (IV), но обычно в качестве побочного продукта образуется значительное количество моносульфида (V) когда применяют указанные условия. Более того, при использовании толуола продукт очень медленно фильтруется, хотя приемлемой скорости фильтрования можно достичь при добавлении к толуольному раствору части ацетонитрила. Когда реакцию осуществляют в предпочтительном растворителе, ацетонитриле, количество примеси моносульфида (V) снижается и ско 005077 10 рость фильтрования продукта (III) оказывается удовлетворительной. Монохлорид серы, используемый при осуществлении способа, обычно имеет чистоту 99,4-99,9% м/м. Качество используемого растворителя может влиять на ход реакции, поскольку присутствие некоторых примесей влияет на выход продукта (с образованием соединения (V) в качестве побочного продукта). Таким образом, когда в качестве растворителя используют ацетонитрил,предпочтительно, чтобы содержание воды составляло 1000 м.ч., содержание этанола 1500 м.ч. и содержание аммония 100 м.ч. Также предпочтительно избегать присутствия даже малого количества ацетонитрила или N,N-диметилформамида в смеси растворителей, так как, например, примерно 100 м.ч. ацетона в дихлорметане может отрицательно сказаться на выходе продукта. Порядок введения реагентов является важной отличительной особенностью реакции. Так,очень важно добавлять монохлорид серы к раствору соединения формулы (IV) (а не наоборот). Короткое время добавления монохлорида серы является предпочтительной отличительной особенностью способа. Так, если монохлорид серы добавляют в течение 1 мин, дисульфид (III) кристаллизуется примерно 15 с после завершения добавления (и всe соединение формулы (IV) расходуется). При продолжительности добавления 15 мин дисульфид (III) кристаллизуется в течение половины этого времени, и в результате дисульфид (III) кристаллизуется совместно с остающимся соединением формулы (IV). Промывание полученного таким образом загрязненного продукта большим избытком ацетонитрила не влияет на извлечение непрореагировавшего соединения формулы (IV). Время введения монохлорида серы предпочтительно составляет от 1 до 10 мин, более предпочтительно 1-5 мин. Температура реакции смеси в начале введения монохлорида серы предпочтительно составляет от 5 до 25 С, более предпочтительно от примерно 10 до 20 С. Если температура в начале введения составляет 30 С, то достигается более низкий выход вследствие образования трисульфида и тетрасульфида в качестве побочных продуктов. Поскольку реакция является экзотермической, то температура повышается в процессе реакции, и предпочтительно еe поддерживают примерно от 20 до 35 С. Молярное отношение соединение формулы(IV):монохлорид серы, используемое при проведении реакции, обычно составляет от 2:1 до 2:1,06, предпочтительно от примерно 2:1 до примерно 2:1,04. Использование большего избытка монохлорида серы приводит к образованию повышенного количества моносульфида(V) в качестве побочного продукта. Если используют более низкую дозировку монохлорида серы, то реакция протекает не до конца. 11 Другой отличительной особенностью способа настоящего изобретения является способ очистки продукта. Так, реакционную смесь, содержащую дисульфид формулы (III), сначала дегазируют с удалением хлорида водорода,обычно нагревая примерно до 40 С при пониженном давлении, обычно при примерно 0,2 атм. Затем еe нагревают примерно при 80 С в течение примерно 1 ч при атмосферном давлении. После охлаждения примерно до 30 С добавляют слабое основание (обычно аммиак), чтобы нейтрализовать любой остающийся хлорид водорода и получить рН примерно 6,5-7. Затем смесь охлаждают примерно до 5 С и продукт удаляют фильтрованием. Эта методика позволяет получать дисульфид формулы (I) с высоким выходом и чистотой простой операцией, подходящей для высокотоннажного производства. В формулах (I), (II), (III) и (IV) символы имеют следующие предпочтительные значения:R2 и R3 означают галоген (предпочтительно хлор). Особенно предпочтительным соединением формулы (I) является 5-амино-1-(2,6-дихлор-4 трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразол. Особенно предпочтительным соединением формулы (II) является 5-амино-1-(2,6-дихлор-4 трифторметилфенил)-3-циано-4-трифторметилтиопиразол. Особенно предпочтительным соединением формулы (III) является 5-амино-1-(2,6-дихлор-4 трифторметилфенил)-3-цианопиразол-4-ил дисульфид. Соединения формул (II), (III) и (IV) являются известными. В соответствии с другой отличительной особенностью настоящего изобретения способы(А), (В) и (С) могут быть объединены для получения соединения формулы (I), исходя из соединения формулы (IV). Вышеупомянутые способы (А), (В) и (С),будучи объединены друг с другом, образуют особенно подходящий и эффективный способ получения Фипронила (Fipronil). Следующие примеры поясняют настоящее изобретение без ограничения объема его притязаний. Пример 1. Получение 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилсульфинилпиразола. Трифторуксусную кислоту (1660 г, 14,5 моль) добавляют к перемешиваемому в стеклянном реакторе при 12 С раствору 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-циано-4-трифторметилтиопиразола (436 г, 1,03 моль) и борной кислоты (5 г, 0,08 моль). В течение 2 ч добавляют пероксид водорода (131,5 г 35% м/м, 1,35 12 моль), поддерживая температуру при 12 С, и смесь выдерживают при указанной температуре еще в течение 4-5 ч. Когда превращение достигает 97-98% или количество нежелательного 5 амино-1-(2,6-дихлор-4-трифторметилфенил)-3 циано-4-трифторметилсульфонилпиразола достигает 2% (по данным ВЭЖХ), добавляют диоксид серы, чтобы связать оставшийся пероксид водорода, и смесь поддерживают при 10-18 С в течение 0,5 ч. Добавляют хлорбензол (370 г),над смесью создают пониженное давление (от 0,17 до 0,04 атм) и нагревают при 47-50 С с азеотропной перегонкой. Получают гомогенную фракцию, содержащую восстановленную трифторуксусную кислоту. В процессе перегонки непрерывно вводят дополнительное количество хлорбензола (1625 г), чтобы поддерживать объем постоянным. В конце азеотропной перегонки содержимое реактора поддерживают при 4750 С при пониженном давлении (0,04 атм) и отгоняют гомогенную фракцию хлорбензола. После снятия вакуума реактор нагревают до 40 С, добавляют этанол (207 г) и хлорбензол(235 г) и смесь нагревают до 80 С при перемешивании, в результате чего получают раствор. При охлаждении до 40 С продукт кристаллизуется. В реакторе создают быстро снижающееся давление (от 0,13 до 0,03 атм) и этанол отгоняют при 40 С. Давление нормализуют, смесь охлаждают до 5 С в течение 3,5 ч и оставляют еще на 0,5 ч. Продукт отфильтровывают, промывают холодным хлорбензолом, затем холодным водным раствором этанола, затем водой и сушат под вакуумом при 135C, в результате чего получают указанное в заголовке соединение (407,5 г) с характерным выходом 89% и чистотой 95,5%. Пример 2. Получение 5-амино-3-циано-1(2,6-дихлор-4-трифторметилфенил)-4-трифторметилтиопиразола. Формиат натрия (76 г, 1,11 моль) добавляют к смеси 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-цианопиразол-4-ил дисульфида(643 г) в стеклянном реакторе. После продувания азотом при давлении 2 бара реактор закрывают и добавляют трифторметилбромид (101 г,0,682 моль). Реактор нагревают до 45 С, добавляют диоксид серы (19,5 г, 0,304 моль) в течение 1,5 ч и температуру в течение реакции поддерживают в диапазоне от 43 до 47 С ещe в течение 0,75 ч. Давление сбрасывают, осуществляя дегазацию в течение 1,5 ч и охлаждая реактор при 25-30 С в течение 1 ч после сброса давления. Когда внутреннее давление достигает атмосферного давления, смесь обрабатывают бикарбонатом натрия и N,N-диметилформамид частично выпаривают при нагревании при 5070 С и пониженном давлении. Остаток охлаждают до 40 С и при перемешивании медленно добавляют к воде при 20-25 С. Продукт фильтруют, промывают (горячей водой) и сушат под вакуумом при 100 С, в результате чего получа 13 ют указанное в заголовке соединение (182,3 г) с характерным выходом 95% и чистотой 96,6%. Пример 3. Получение 5-амино-1-(2,6 дихлор-4-трифторметилфенил)-3-цианопиразол 4-ил дисульфида. Ацетонитрил (837 г) добавляют к хлорбензольному раствору (627,8 г), который содержит 5-амино-1-(2,6-дихлор-4-трифторметилфенил)3-цианопиразол (366,6 г, 1,14 моль). Смесь нагревают при 50-64 С и пониженном давлении(0,5 атм) и сушат, отгоняя примерно 45 мл ацетонитрила. После охлаждения до 18 С быстро, в течение 1 мин добавляют монохлорид серы (77 г,0,57 моль). Температуру смеси повышают до 35 С и поддерживают при 35 С, охлаждая до окончания экзотермического выделения тепла,ещe в течение 0,3 ч. Затем смесь дегазируют(для удаления хлорида водорода), нагревая еe при 40 С при пониженном давлении, а затем нагревают при 80 С в течение 1 ч при атмосферном давлении. После охлаждения до 30 С добавляют аммиак, чтобы довести величину рН до 6,5-7, охлаждают до 5 С и продукт фильтруют, промывают смесью хлорбензол/ацетонитрил и сушат при 95 С под вакуумом, в результате чего получают указанное в заголовке соединение (365,2 г) с характерным выходом 89,4% и чистотой 98,4%. 14 2. Способ по п.1, в котором трифторперуксусная кислота образуется in situ в результате взаимодействия трифторуксусной кислоты и пероксида водорода. 3. Способ по п.1 или 2, в котором количество используемого соединения, ингибирующего коррозию, составляет примерно 0,08-0,2 мол.экв. 4. Способ по любому из предшествующих пунктов, в котором количество используемой трифторуксусной кислоты составляет от 14 до 15 мол.экв. 5. Способ по любому из предшествующих пунктов, в котором количество используемого в реакции пероксида водорода составляет 1,3-1,5 экв. 6. Способ по любому из предшествующих пунктов, в котором реакцию осуществляют при температуре от 10 до 15 С. 7. Способ по любому из предшествующих пунктов, который дополнительно включает добавление хлорбензола в реакционную смесь по окончании реакции окисления и извлечение трифторуксусной кислоты перегонкой. 8. Способ по п.1, в котором соединение формулы (II) получают добавлением диоксида серы в смесь, содержащую дисульфид формулы ФОРМУЛА ИЗОБРЕТЕНИЯ 11. Способ получения соединения формулы (I) в которой W означает азот или -CR3; R1 означает галоген, галоС 1-6 алкил, галоС 1-6 алкокси, R4S(O)n- или -SF5; R2 означает водород или галоген; R3 означает галоген; R4 означает C1-6 алкил или галоC1-6 алкил и n означает 0, 1 или 2,включающий окисление соединения формулы в которой радикалы R1, R2 и W имеют значения, определенные в п.1, соль муравьиной кислоты, трифторметилбромид и полярный растворитель. 9. Способ по п.8, в котором растворителем является N,N-диметилформамид. 10. Способ по п.8 или 9, в котором температура реакции в процессе введения диоксида серы составляет от 35 до 55 С. 11. Способ по пп.8, 9 или 10, в котором диоксид серы добавляют в течение времени от 0,5 до 2 ч. 12. Способ по любому из пп.8-11, в котором молярное отношение трифторметилбромид:дисульфид формулы (III) составляет от 3:1 до 5:1. 13. Способ по любому из пп.8-12, в котором количество использованного диоксида серы составляет 1,2-1,5 мол.экв. по отношению к дисульфиду формулы (III). 14. Способ по любому из пп.8-13, в котором количество использованной соли муравьиной кислоты относительно дисульфида формулы (III) составляет 4-6 мол.экв. 15 15. Способ по п.8, в котором дисульфид формулы (III) 16 давлении с последующим охлаждением до примерно 30 С;c) доведением величины рН реакционной смеси до 6,5-7 добавлением слабого основания иd) охлаждением смеси до температуры примерно 5 С и выделением желательного дисульфида фильтрованием. 23. Способ получения соединения формулы (I) в которой W означает азот или -CR3; R1 означает галоген, галоC1-6 алкил, галоС 1-6 алкокси, R4S(О)n- или -SF5; R2 означает водород или галоген, получают добавлением монохлорида серы (S2Cl2) к раствору соединения формулы (IV) в органическом растворителе в которой радикалы R1, R2 и W имеют значения, определенные выше. 16. Способ по п.15, в котором растворитель выбирают из толуола, дихлорметана или дихлорэтана, таких алифатических или ароматических нитрилов, как ацетонитрил, пропионитрил, метилглутаронитрил и бензонитрил; или их смесей, необязательно в виде смеси с хлорбензолом. 17. Способ по п.15 или 16, в котором растворителем является ацетонитрил. 18. Способ по пп.15, 16 или 17, в котором монохлорид серы имеет чистоту 99,4-99,9% вес./вес. 19. Способ по любому из пп.15-18, в котором при использовании в качестве растворителя ацетонитрила содержание воды составляет 1000 ч/млн, содержание этанола 1500 ч/млн и содержание аммиака 100 ч/млн. 20. Способ по любому из пп.15-19, в котором продолжительность добавления монохлорида серы составляет 1-10 мин. 21. Способ по любому из пп.15-20, в котором температура реакции смеси в начале добавления монохлорида серы составляет от 5 до 25 С. 22. Способ по любому из пп.15-21, который дополнительно включает очистку дисульфида формулы (III)a) нагреванием реакционной смеси, содержащей дисульфид, при пониженном давлении с удалением хлорида водорода;b) нагреванием образующейся дегазированной реакционной смеси при атмосферном в которой W означает азот или -CR3; R1 означает галоген, галоC1-6 алкил, галоС 1-6 алкокси, R4S(О)n- или -SF5; R2 означает водород или галоген; R3 означает галоген; R4 означаетC1-6 алкил или галоC1-6 алкил; и n означает 0, 1 или 2, включающий а) добавление монохлорида серы (S2Cl2) к раствору соединения формулы (IV) в органическом растворителе в которой радикалы R1, R2 и W имеют значения, определенные выше, с образованием дисульфида формулы (III) в которой радикалы R1, R2 и W имеют те же значения, что определены выше;b) добавление диоксида серы к смеси, содержащей указанный дисульфид формулы (III),соль муравьиной кислоты, трифторметилбромид и полярный растворитель, с образованием соединения формулы (II) в которой радикалы R1, R2 и W имеют те же значения, что определены выше; и с) окисление указанного соединения формулы (II) трифторперуксусной кислотой в присутствии соединения, ингибирующего коррозию, - борной кислоты. 24. Способ по любому из пп.1-7 или 23, в котором соединением формулы (I) является 5 18 амино-1-(2,6-дихлор-4-трифторметилфенил)-3 циано-4-трифторметилсульфинилпиразол. 25. Способ по любому из пп.7-14 или 23, в котором соединением формулы (II) является 5 амино-1-(2,6-дихлор-4-трифторметилфенил)-3 циано-4-трифторметилтиопиразол. 26. Способ по любому из пп.15-23, в котором соединением формулы (III) является 5 амино-1-(2,6-дихлор-4-трифторметилфенил)-3 цианопиразол-4-ил дисульфид. 27. Способ по любому из предшествующих пунктов, в котором R1 означает трифторметил, трифторметокси или -SF5; W означает -CR3 и R2 и R3 означают хлор.
МПК / Метки
МПК: C07D 231/44
Метки: производных, способ, 4-трифторметилсульфинилпиразола, получения
Код ссылки
<a href="https://eas.patents.su/10-5077-sposob-polucheniya-proizvodnyh-4-triftormetilsulfinilpirazola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 4-трифторметилсульфинилпиразола</a>
Предыдущий патент: Пищевая композиция для поверхностного обжаривания, включающая лецитин подсолнечника
Следующий патент: Способ получения олефинов
Случайный патент: Дозирующее устройство














