Способ получения r-(+)-6-карбоксамидо-3-n-метиламино-1,2,3,4-тетрагидрокарбазола
Номер патента: 4586
Опубликовано: 24.06.2004
Авторы: Найт Джон, Макги Каролина, Хартли Дэвид, Макинтайр Стивен, Брэкинридж Ян
Формула / Реферат
1. Способ получения R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, включающий операцию разделения энантиомерной смеси соединения тетрагидрокарбазола, отличающийся тем, что разделяют энантиомерную смесь соединения формулы I
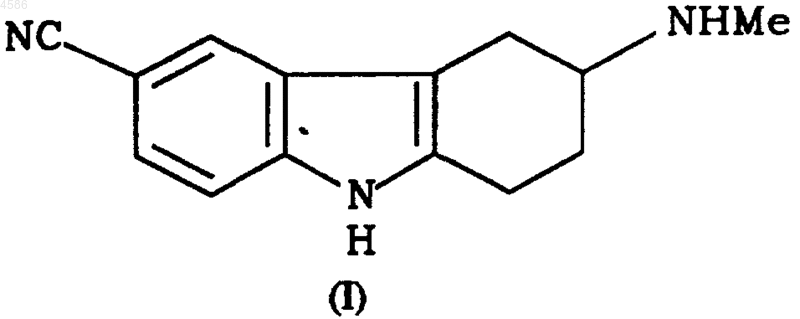
2. Способ по п.1, отличающийся тем, что разделение энантиомеров осуществляют обработкой смеси L-пироглутаминовой кислотой.
3. Способ по пп.1 и 2, отличающийся тем, что соединение формулы I содержит рацемическую смесь энантиомеров.
4. Способ получения R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или его сольвата, который включает гидролиз соединения тетрагидрокарбазола, отличающийся тем, что проводят гидролиз R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или его сольвата, возможно, с последующим образованием соли.
5. Способ получения R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или сольвата по пп.1-4, отличающийся тем, что он включает
а) разделение энантиомерной смеси 6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола для получения R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или его сольвата и
б) гидролиз R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или его сольвата, возможно, с последующим образованием соли.
6. Способ по пп.1-5, отличающийся тем, что 6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазол формулы I получают в результате реакции 4-цианофенилгидразина с 4-метиламиноциклогексаноном или его защищенным производным.
7. Способ по п.6, отличающийся тем, что защищенное производное 4-метиламиноциклогексанона является гидрохлоридом 4-метиламиноциклогексанон-(2'2'-диметилтриметилен)кеталя.
8. Способ по п.7, отличающийся тем, что гидрохлорид 4-метиламиноциклогексанон-(2'2'-диметилтриметилен)кеталя получают в результате реакции 1,4-циклогександионмоно-2'2'-диметилтриметиленкеталя с метиламином.
9. Способ по пп.1-8, отличающийся тем, что включает описанные операции (1)-(4), возможно, с последующим образованием соли.
10. Соединение формулы II
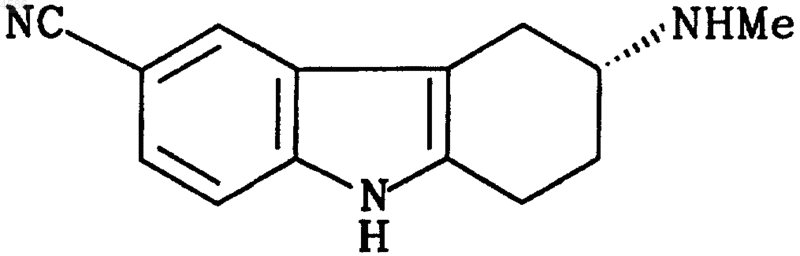
или его соль или сольват.
11. L-пироглутамат R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола.
12. Применение L-пироглутаминовой кислоты для разделения энантиомерной смеси соединения формулы
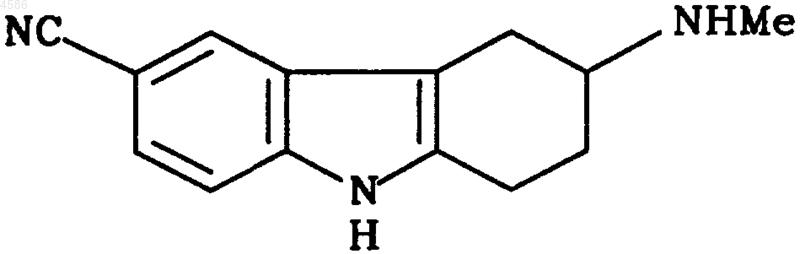
Текст
1 Настоящее изобретение относится к новому способу получения R-(+)-6-карбоксамидо-3N-метиламино-1,2,3,4-тетрагидрокарбазола. В патентной заявке WO-A-93/00086 описана группа производных тетрагидрокарбазола,которые обладают активностью в качестве рецепторных антагонистов 5HT1 и поэтому являются полезными для лечения мигрени. Описанные специфические соединения включают, в частности, гидрохлорид 3-метиламино-6-карбоксамидо-1,2,3,4-тетрагидрокарбазола. В WOA-93/00086 описан также способ получения гидрохлорида 3-метиламино-6-карбоксамидо-1,2,3,4-тетрагидрокарбазола, который содержит шесть стадий, использует 3-метиламино-6-циано-1,2,3,4-тетрагидрокарбазол и включает ряд операций по установлению и снятию защиты. В патентной заявке WO-A-94/14772 описаны энантиомеры некоторых производных карбазола, включая соединение, указанное выше. Описаны следующие энантиомеры:R-(+)-6-карбоксамидо-3-N-метиламино 1,2,3,4-тетрагидрокарбазол,S-(+)-6-карбоксамидо-3-N-метиламино 1,2,3,4-тетрагидрокарбазол,R-(-)-6-карбоксамидо-3-N-этиламино 1,2,3,4-тетрагидрокарбазол,S-(-)-6-карбоксамидо-3-N-этиламино 1,2,3,4-тетрагидрокарбазол,а также три их соли и сольвата. В настоящее время сукцинат R-(+)-6 карбоксамидо-3-N-метиламино-1,2,3,4 тетрагидрокарбазола проходит клинические испытания на предмет лечения мигрени. В патентной заявке WO-A-94/14772 описаны различные способы получения отдельных энантиомеров, а именно 1) разделение смеси энантиомеров в соединении или в его производном путем хроматографии, например в колонне хиральной жидкостной хроматографии высокого разрешения. 2) разделение диастереоизомеров хирального производного (в частности, хиральной соли) соединения, например, путем кристаллизации или хроматографии, или 3) алкилирование (+) или (-) энатиомера 3 амино-6-карбоксамидо-1,2,3,4-тетрагидрокарбазола или его соли. Вышеуказанные способы 1-3 можно использовать для получения желаемого энантиомера, однако, они обладают недостатками с точки зрения "увеличения масштаба" и получения соединения в промышленных количествах. В частности, было установлено, что разделение на конечной стадии синтеза и использование R-2 перролидон-5-карбоновой кислоты (известной также как D-пироглутаминовая кислота) для получения хиральной соли приводит к образованию промежуточного продукта с плохой растворимостью и поэтому дает низкий выход желаемого энатиомера, несмотря на тот факт, что 2 как предпочтительная оптически активная кислота для применения в способе согласно WOA-94/14772. В этой связи существует потребность в создании более эффективного способа, который легче применять в условиях промышленного производства. Нами разработан такой способ полученияR-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. Этот способ основан на разделении промежуточного соединения индолнитрила на относительно ранней стадии процесса. Мы установили, что данное промежуточное соединение имеет удивительно хорошую растворимость и обеспечивает получение желаемого энантиомера с высоким выходом. Действительно, хотя новый способ содержит на одну операцию больше, чем способ,описанный в WO-A-94/14772, он дает больший общий выход готового продукта. Кроме того,выполнение разделения промежуточного соединения нитрила обеспечивает выполнение последующих операций на нужной энантиометрической форме промежуточных соединений, что приводит к непосредственному получению соединения без необходимости применения хроматографии и т.п. Таким образом, первой задачей настоящего изобретения является способ получения R(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, который включает операцию разделения смеси энантиомеров соединения индолнитрита с формулой I Соединение с формулой I можно назвать 6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазол. Следует понимать, что соединение с формулой I может содержать различные отношения двух своих энантиомеров. В частности,оно может существовать в виде рацемической смеси. Установлено, что разделение смеси энантиомеров индолнитрила можно успешно осуществить с помощью L-пироглутаминовой кислоты. Действительно, установили, что применениеD-пироглутаминовой кислоты давало "ненужный" энантиомер, в то время как Lпироглутаминовая кислота дает желаемый энантиомер с хорошим выходом. Применение Lпироглутаминовой кислоты имеет также экономические преимущества, поскольку эта форма встречается в природе и, соответственно, обладает гораздо меньшей стоимостью, чем формаD. Реакцию с оптически активной кислотой для получения хиральной соли можно выполнять в соответствующем растворителе, например в спирте, в частности в метаноле или в этаноле, 3 при температуре от 0 до 100 С. Желаемый энантиомер получают путем кристаллизации, используя хорошо известные способы. Кристаллизация может начаться спонтанно, однако, в некоторых случаях может потребоваться применение затравки. Реакционную смесь желательно обработать уксусной кислотой, предпочтительно после начала кристаллизации. Установлено,что предпочтительным является проведение селективной кристаллизации желаемого энантиомера. Получающуюся L-пироглутаминовую соль можно предпочтительно перекристаллизовать из водного раствора метанола или более предпочтительно - из водного раствора этанола для повышения оптической чистоты продукта. Используя стандартные операции, хиральную соль можно легко превратить в свободное основание для получения(+)-6-циано-3-Nметиламино-1,2,3,4-тетрагидрокарбазола. Если требуется, данное соединение может реагировать непосредственно на месте с образованием соответствующего карбоксамидного соединения.(+)-6-Циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазол является новым соединением. В этой связи следующая задача настоящего изобретения заключается в получении (+)-6-циано 3-N-метиламино-1,2,3,4-тетрагидрокарбазола с формулой II а также его солей и сольватов. Предпочтительным вариантом решения данной задачи является L-пироглутамат (+)-6 циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. Соединение с формулой II можно превратить в желаемый R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазол, а также в его соль или сольват. Еще одной задачей настоящего изобретения является способ получения R-(+)-6 карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или сольвата, при этом указанный способ включает гидролиз R-(+)-6 циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или сольвата. Как очевидно для специалистов, нитрил можно подвергнуть гидролизу с образованием амида или карбоновой кислоты, в зависимости от применяемых условий. Поэтому для данного способа должны быть выбраны условия, обеспечивающие получение амида, но не карбоновой кислоты. Гидролиз проводят предпочтительно с применение уксусной кислоты и комплекса трифторида бора(ВF3)/уксусной кислоты. Другие средства гидролиза, которые могут быть использованы, 004586 4 включают перекись водорода в присутствии щелочи, в частности гидроксида натрия, в растворителе, например в спирте, или в муравьиной кислоте и в бромисто-водородной кислоте или в хлористо-водородной кислоте. 6-Циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазол, используемый в качестве исходного материала на операции разделения, можно получить способами, описанными, например, вWO-A-93/00086. Альтернативно и более предпочтительно 6-циано-3-N-метилами-но-1,2,3,4 тетрагидрокарбазол можно получить в результате реакции 4-цианофенилгидразина с формулой III или его соли, например гидрохлорида, с 4 метиламиноциклогексаноном или его защищенным производным. Предпочтительно используют производное кеталя 4-метиламиноциклогексанон(2',2'-диметилтриметилен)кеталь или его соль, например гидрохлорид Реакцию проводят предпочтительно в присутствии водного раствора кислоты. Указанное выше производное IV кеталя является соединением, поставляемым на рынок. Его можно получить, например, способом, описанным в WOA-94/14772, путем реакции соответствующего защищенного 1,4-циклогександиона, имеющего формулу V с метиламином. Реакцию предпочтительно проводят в пригодном растворителе, в частности в спирте, или их смеси, например промышленных метилированных спиртов или метанола с каталитической гидрогенизацией с использованием, например,палладия на древесном угле. 5 Полная последовательность синтеза от кетокеталя с формулой V до R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола представляется следующим образом: Следующие условия реакции для различных операций являются предпочтительными: 1) IMS, MeNH2, Н 2, Pd-C, затем ТГФ (тетрагидрофуран), НСl, 0-10 С, например 0-5 С или предпочтительно 5-10 С (выход: 77-94% от теоретического значения); 2) НСl (водный раствор), 80-90 С, предпочтительно 85-90 С с последующим снижением до 0-5 С, затем NaOH (водный раствор), ТГФ с последующим снижением до 0-5 С (выход: 6285% от теоретического значения); 3) МеОН, L-пироглутаминовая кислота (LПГК), АсОН, 50 С или предпочтительно обратное cтекание с последующим снижением до 05 С, затем перекристаллизация из водного раствора МеОН или предпочтительно EtOH, (выход: 14-30% от теоретического значения); 4) АсОН, ВF3(АсОН)2, 90-95 С, затемNaOH, BuOH, затем Nа 2 СО 3 или предпочтительно промывка водой, (выход: 70-100% от теоретического значения). В качестве дополнительной операции 5 соединение II, полученное на операции 4, можно легко превратить в соответствующую соль, на 004586 6 пример в соль янтарной кислоты, путем реакции с янтарной кислотой в спирте, в частности в этаноле, или в смеси спиртов, в частности этанола и бутанола. Реакцию предпочтительно проводят при температуре в диапазоне 60100 С, например 60-65 С, или предпочтительно 70-100 С с последующим снижением до 2025 С, (выход: 87-90% от теоретического значения). При желании или в случае необходимости соль, например сукцинат, можно перекристаллизовать, предпочтительно используя водный раствор этанола. Таким образом, в описанном варианте реализации настоящее изобретение обеспечивает способ получения R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазола,его соли или сольвата, включающий выполнение описанных выше операций 1-4 и, возможно,операцию 5 образования соли. Поскольку гидрохлорид аминокеталя, используемый на операции 2, представляет собой соединение, выпускаемое в промышленных масштабах, способ можно эффективно ограничить только операциями 2-4. Другой задачей настоящего изобретения является применение L-пироглутаминовой кислоты для разделения энантиомерной смеси соединения индолнитрила с формулой I Ниже приведены примеры реализации настоящего изобретения, которые не следует рассматривать как ограничения изобретения в какой-либо мере. Пример 1. Разделение рацемической смеси(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола (индолнитрил). а) Получение соли. Рацемический индолнитрил (1,72 моль,387 г) смешали с метанолом (1,94 л), полученную смесь перемешали и нагрели до обратного отекания с целью получения раствора. Во вторую колбу налили L-пироглутаминовую кислоту (0,5 моль-эквивалента, 110,9 г) и метанол(774 мл). Раствор рацемического индолнитрила охладили до 50 С и отфильтровали непосредственно в смесь L-пироглутаминовой кислоты, а затем дважды промыли метанолом (774 мл и 387 мл). Содержание воды в полученной смеси откорректировали таким образом, чтобы оно лежало в пределах 0,7-2% мас./об. Смесь нагрели до обратного стекания с целью получения раствора, а затем охладили до 25 С, произвели затравливание, и добавили уксусную кислоту(0,6 моль-эквивалента, 59 мл) в течение 30 мин при 25-28 С. Смесь выдержали при 25 С в течение 30 мин, а затем охладили до 0-3 С и выдержали в течение еще 2 ч. Полученную твердую фазу выделили путем фильтрации и высушили в 7 вакууме при температуре окружающей среды для получения промежуточного соединения R(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, пироглутамат (180,8 г). б) Перекристаллизация. Промежуточное соединение пироглутамат(147,4 г), полученное на операции а), смешали с водой (120,6 мл) и 96% этанолом (363 мл). Образовавшуюся суспензию перемешали и нагрели до обратного cтекания для получения раствора. Дополнительное количество 96% этанола(1,03 л) добавляли в раствор, полученный обратным cтеканием, в течение 30 мин, а затем произвели затравливание образовавшейся смеси. Смесь охладили до 0-5 С в течение 2 ч, а затем выдержали в течение последующих 1-2 ч. Твердую фазу выделили путем фильтрации и высушили в вакууме при температуре окружающей среды для получения R-(+)-6 карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, пироглутамат (123,2 г) с содержанием 98% согласно анализу способом жидкостной хроматографии высокого разрешения. Пример 2. Получение представительного количества сукцината R-(+)-6-карбоксамидо-3N-метиламино-1,2,3,4-тетрагидрокарбазола. 2.1. Получение гидрохлорида 4-метиламиноциклогексанон(2'2'-диметилтриметилен)кеталя(гидрохлорида аминокеталя). Операция 1. В реактор (RV2, номинальная емкость 100 л, рабочая емкость около 130 л) загрузили 5% палладий на древесном угле (паста с содержанием 50% по массе, 1,25 кг), а затем 1,4-циклогександионмоно-2-(2'2'-диметилтриметилен)кеталь(кетокеталь) (125 кг). После этого реактор продули азотом и добавили ПМС (промышленные метилированные спирты, 75 л). Затем реакционную смесь перемешали в течение 30 мин до полного растворения кетокеталя. В реактор добавили раствор метиламина в этаноле (33% мас./об., 2,6 моль-эквивалента, 15,5 л) и перемешивали полученную смесь под давлением водорода, равным одной атмосфере, при 2025 С до завершения реакции согласно газовой хроматографии (ГХ) (около 12-14 ч). Путем пропускания через фильтр 1 мкм отфильтровали катализатор во второй реактор (RV3, номинальная емкость 250 л, рабочая емкость около 300 л) с последующей промывкой ПМС (265 л) во второй реактор. Объединенный фильтрат и промывную жидкость сконцентрировали в вакууме при 35-40 С для удаления ПМС. Концентрат выдерживали в атмосфере азота при температуре 25 С до готовности второй порции раствора ПМС (см. ниже). Параллельно с данной фазой концентрации в реакторе RV2 провели повторную реакцию операции 1 в таком же объеме, как описано выше, и после завершения реакции (анализ ГХ, как указано выше) продукт реакции профильтровали непосредственно в RV3, а затем добавили 8 туда же концентрат из первой загрузки с промывной жидкостью. При этом объединенный фильтрат с промывной жидкостью также сконцентрировали в вакууме при 35-40 С для удаления ПМС. Остаток разбавили тетрагидрофураном(ТГФ) (250 л) и сконцентрировали раствор в вакууме при 35-40 С для удаления ПМС для удаления части (62,5 л) ТГФ. Дополнили раствор еще раз ТГФ (62,5 л) и повторно сконцентрировали для удаления 62,5 л. Затем раствор охладили до 0-5 С и обработали концентрированной соляной кислотой (1,2 моль-эквивалента, 12,5 л) с такой скоростью, чтобы постоянно поддерживать температуру ниже 10 С. Полученную смесь охладили до 0-5 С и выдержали в течение 1-2 ч. Твердую фазу собрали фильтрацией через 27-дюймовый нутч-фильтр,промыли путем вытеснения ТГФ (225 л) и высушили в вакууме при 40 С до постоянной массы (обычно в течение ночи), получив гидрохлорид аминокеталя в виде белого порошка (26,92 кг,скорректировано на содержание растворителя,85,5% от теоретического выхода, 107,7% по массе). 2.2. Получение 6-циано-3-N-метиламино 1,2,3,4-тетрагидрокарбазола (рацемического индолнитрила). В реактор (RV3, номинальная емкость 250 л, рабочая емкость около 300 л) загрузили гидрохлорид 4-цианофенилгидразина (26,24 кг) и гидрохлорид аминокеталя (1 моль-эквивалент,38,57 кг), а затем добавили воду (92 л) и концентрированную соляную кислоту (65,6 л). Реакционную смесь перемешали, нагрели до 8090 С в течение примерно 5 ч и контролировали способом протонного ЯМР (см. примечание ниже). После того как реакция считалась законченной, реакционную смесь охладили до 0-5 С и выдержали в течение 1 ч при данной температуре. Рацемический гидрохлорид индолнитрила профильтровали, используя 27-дюймовый нутчфильтр, и тщательно промыли водой (326 л или до тех пор, пока величина рН смывки не превысила 4,5). Затем влажный гидрохлорид индолнитрила снова загрузили в RV3 и добавили воду (164,5 л), а также ТГФ (66 л). рН откорректировали до 13 с помощью 6 М NaOH (около 33 л) и перемешивали реакционную смесь в течение 30 мин. Отобрали образец, отфильтровали твердую фазу и провели контроль с помощью протонного ЯМР (см. примечание ниже), чтобы убедиться в образовании свободного основания. Затем отогнали ТГФ в вакууме при температуре, меньшей 40 С, охладили водную реакционную смесь до 0-5 С и выдержали в течение 1 ч. Твердую фазу выделили путем фильтрации через 27-дюймовый нутч-фильтр, промыли водой путем вытеснения (233 л или до тех пор, пока величина рН смывки не превысила 9) и высушили в вакууме при 55-60 С до постоянной 9 массы, получив рацемический индолнитрил в виде серого порошка (25,13 кг, скорректировано на содержание воды, 72,2% от теоретического выхода, 65 мас.% относительно исходного гидрохлорида гидразина). Примечание: способы ЯМР IPC. Определение конечной точки реакции. Образец реакционной смеси отобрали из реактора и профильтровали в вакууме. Около 20 мг порошка растворили в 1-2 мл D6-ДМСО (диметилсульфоксид) и получили спектр ЯМР с помощью спектрометра ЯМР с частотой 360 МГц. Спектр проконтролировали на исчезновение сигналов, относящихся к гидрохлориду гидразина при 7,05 промиль (2 Н, дублет) и 7,7 промиль (2 Н, дублет). Характерные сигналы в ароматической области, относящиеся к рацемическому гидрохлориду индолнитрила, имели место при 7,9 промиль (1 Н, синглет) и 7,37,5 промиль (2 Н, мультиплет). Подтверждение образования свободного основания. Образец реакционной смеси отобрали из реактора и профильтровали в вакууме. Около 20 мг порошка растворили в 1-2 мл D6-ДМСО и получили спектр ЯМР с помощью спектрометра ЯМР с частотой 360 МГц. Сигнал N-метиловой группы рацемического индолнитрила сместился с начального сдвига 2,65 промиль (синглет) к сдвигу 2,38 промиль (синглет) для свободного основания - рацемического индолнитрила. Важно отметить, что сдвиг 2,38 промиль получается вследствие того, что смеси гидрохлорида и свободного основания проявляют N-метиловые сдвиги в пределах данного диапазона в результате установления равновесия в растворе ЯМР. 2.3. Получение пироглутамата R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. Рацемический индолнитрил (1 моль-эквивалент, 25,13 кг) и L-пироглутаминовую кислоту (0,5 моль-эквивалента, 7,3 кг) загрузили в реактор (RV3, номинальная емкость 250 л, рабочая емкость около 300 л), добавили метанол(250 л), и перемешанную смесь нагрели до обратного cтекания для получения раствора. Смесь охладили до 50 С, и добавили уксусную кислоту (0,6 моль-эквивалента, 3,8 л) примерно в течение 15 мин. Раствор затравили после добавления уксусной кислоты, выдержали при 5055 С в течение 30 мин, и перемешивали, охлаждая с постоянной скоростью, до 0-5 С в течение 2 ч. Суспензию выдержали при этой температуре в течение 2 ч. Твердую фазу отфильтровали через 27-дюймовый нутч-фильтр и промыли метанолом (125 л, 112,5 л). Полученную твердую фазу либо подвергали сушке в вакууме при комнатной температуре до постоянной массы (типичный выход: 47-50 мас.% от выхода материала около 94%), либо использовали увлажнение метанолом при перекристаллизации с 10 корректировкой на содержание метанола по протонному ЯМР. Перекристаллизация соли для удовлетворения оптическим требованиям. Твердую фазу (24,11 кг) загрузили в реактор (RV3, номинальная емкость 250 л, рабочая емкость около 300 л), добавили метанол (206 л) и воду (21,7 л). Смесь нагрели до обратного cтекания и перемешивали до полного растворения твердой фазы (обычно 30 мин). Смесь охладили до 55-60 С, ввели затравочные кристаллы, и выдержали смесь при 50-55 С в течение 30 мин,затем охладили до 0-5 С с постоянной скоростью в течение 1 ч и выдержали в течение 2 ч. Образовавшуюся твердую фазу отфильтровали через 27-дюймовый нутч-фильтр, промыли метанолом способом замещения (24 л) и высушили в вакууме при комнатной температуре до постоянной массы. Пироглутамат выделили в виде порошка от светлого до белого цвета (16,81 кг,скорректировано по содержанию метанола и воды, 69,7 мас.%). Продукт имел практически такие же ИК и ЯМР спектры, что и продукт в примере 3.2. 2.4. Получение R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазола. В реактор (RV2, номинальная емкость 100 л,рабочая емкость около 130 л) загрузили пироглутаматовую соль (1 моль-эквивалент, 22,0 кг),уксусную кислоту (55 л) и деминерализованную воду (5 моль-эквивалентов, 5,5 л), получив при перемешивании раствор темно-коричневого цвета. Добавили одной порцией комплекс бортрифторидуксусной кислоты (6 моль-эквивалентов, 52,8 л), и получили густой белый осадок. Перемешанную смесь нагрели до 90-95 С, и осадок повторно растворили при достижении температуры 95 С, получив раствор темнокоричневого цвета. Протекание реакции контролировали способом жидкостной хроматографии высокого разрешения по исчезновению пироглутамата и образованию R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, а также индолкарбоновой кислоты (в качестве побочного продукта). После окончания реакции (обычно время реакции составляет 6-8 ч), смесь охладили до 25-30 и влили в реакторRV3 (номинальная емкость 250 л, рабочая емкость около 300 л) с перемешанной охлажденной (0-4 С) водой (110 л), в течение последующих 10 мин, поддерживая температуру ниже 30 С (в этой точке может иметь место некоторое образование паров). Добавили н-бутанол(110 л) и охладили смесь до 5-10 С. Величину рН откорректировали до 7 и перенесли содержимое в резервуар из нержавеющей стали(MV1, номинальная емкость 600 л, рабочая емкость около 650 л) и дополнительно откорректировали величину рН до 12-14 путем добавления 6 М раствора гидроксида натрия, постоянно поддерживая примерно в течение 1 ч температуру ниже 30 С (около 330 л требуется для по 11 лучения рН 13). Выдержали смесь до оседания слоев, и разделили их. Затем экстрагировали водный слой н-бутанолом (1110 л, 155 л). Объединенный органический экстракт промыли раствором (2 х 44 л), содержащим около 10% по массе/объем. Смывки карбоната объединили и повторно экстрагировали н-бутанолом (44 л). Все органические экстракты объединили в реакторе RV3 и сконцентрировали в вакууме примерно до 130 л, поддерживая внутреннюю температуру ниже 50 С во всем объеме. Концентрат обработали древесным углем, промытым основанием (рН в пределах 6-8, 1,1 кг) и добавленным в виде суспензии в н-бутаноле (22 л), а перемешанную смесь нагрели и перемешали при обратном cтекании в течение 15 мин. Затем смесь охладили до 40-45 С, очистили, пропуская по частям через 1-микронный фильтр в сборник дистиллята реактора RV3 (т.е. RD3,емкость 100 л), и последовательно промыли 96% этанолом (8,8 л). Раствор R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, как требовалось, перенесли в ранее неиспользовавшийся барабан и отобрали образец для анализа способом жидкостной хроматографии высокого разрешения с целью определения содержания продукта (11,6 кг, 77,2% от теоретического значения, 52,7 мас.%). РастворR-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4 тетрагидрокарбазола передали непосредственно на следующую операцию для получения сукцината. 2.5. Получение R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазола, сукцината. В реактор (RV3, номинальная емкость 250 л, рабочая емкость около 300 л) загрузили этанол (98,5 л), деминерализованную воду (23,2 л) и янтарную кислоту (1 моль-эквивалент, 5,68 кг), смесь нагрели до 70C с перемешиванием до полного растворения янтарной кислоты (около 30 мин). Раствор R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазола (массовое содержание 11,59 кг) в растворе нбутанола/этанола (суммарная масса раствора: 143 кг) добавили в течение 30 мин, постоянно поддерживая внутреннюю температуру, равную 60-65 С, а затем последовательно промыли нагретой смесью (около 40 С) н-бутанола/этанола(2:1, 17,4 л). Посредине добавления произвели затравливание смеси R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазолом (сукцинатом). (Продукт может кристаллизоваться из раствора во время добавления раствора бутанола к раствору янтарной кислоты. В таком случае затравка не является необходимой; после окончания добавления перемешанную смесь нагревают до обратного отекания примерно в течение 20 мин, а затем охлаждают, как описано ниже. Выдержка при 55-60 является необязательной.) После окончания добавления горячую смесь охладили до 55-60 С и выдержали в тече 004586 12 ние 1 ч. Далее смесь дополнительно охладили до 25 С в течение 2 ч со скоростью 5 С за 20 мин с последующим перемешиванием суспензии при 25 С в течение 12-15 ч. Твердую фазу отфильтровали через 27-дюймовый нутч-фильтр и промыли замещением охлажденным (5 С) 96% этанолом (28,7 л). Мокрую массу высушили в вакууме при температуре окружающей среды до 30 ч для получения продукта - моногидрата сукцината R-(+)-6-карбоксамидо-3-Nметиламино-1,2,3,4-тетрагидрокарбазола в виде серого порошка (15,52 кг, 85,9% от теоретического значения, 133,9 мас.%). Продукт имел практически такие же ИК и ЯМР спектры, что и продукт в примере 3.5. Пример 3. Получение представительного количества сукцината R-(+)-6-карбоксамидо-3N-метиламино-1,2,3,4-тетрагидрокарбазола. 3.1. Получение полиглутамата R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. Рацемический индолнитрил (1 мольэквивалент, 21,57 кг) загрузили в 100-литровый реактор (рабочая емкость около 130 л), а затем добавили метанол (105 л). Смесь перемешали при 60-65 С до полного растворения рацемического индолнитрила (1 ч 31 мин). L-пироглутаматовую кислоту (0,5 моль-эквивалента, 6,26 кг) загрузили в 250-литровый реактор (рабочая емкость около 300 л), а затем добавили метанол(43,5 л). Раствор рацемического индолнитрила охладили до 50-55 С, очистили пропусканием через 1 мкм фильтр и перенесли в 250-литровый реактор. После этого последовательно промыли двумя порциями метанола (43,5 л, затем 21 л),нагревая каждую порцию перед промывкой до 50-55 С. От содержимого 250-литрового реактора отобрали образец для определения содержания воды в смеси, а затем добавили деминерализованную воду для получения смеси, содержащей 0,79% мас./об. (в пределах 0,7-2,0% по массе/объем). Перемешанную смесь в 250 литровом реакторе нагрели до обратного стекания для получения полного растворения. Смесь охладили до 24-26 С и при необходимости затравливали для обеспечения кристаллизации. Добавили уксусную кислоту (0,6 мольэквивалента, 3,48 кг), поддерживая внутреннюю температуру равной 23-28 С, при этом добавление проводили в течение 18 мин. Смесь выдержали при 20-25 С в течение 35 мин, охладили до 10-12 С в течение 40 мин, затем охладили до 5 С и перемешали при 0-5 С в течение 2 ч 55 мин. Материал отфильтровали и промыли метанолом (121 л, 111 л). Полученный порошок высушили в вакууме при температуре до 45 С(10,95 кг (откорректированное значение) 93,2%de материала, 50,8 мас.%). В альтернативном случае указанный порошок можно использовать увлажненным метанолом при кристалли 13 зации, откорректировав содержание метанола с помощью протонного ЯМР. 3.2. Перекристаллизация полиглутамата R(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. Неочищенный пироглутамат (21,73 кг),96% этанол (53 л) и деминерализованную воду(11,9 л) загрузили в 250-литровый реактор (рабочая емкость около 300 л). Смесь перемешали и нагрели до обратного стекания. В связи с отсутствием полного растворения добавили деминерализованную воду (1,7 л, максимальный предел - 2,8 л). Затем добавили к раствору этанол (152 л), поддерживая температуру более 75 С. Раствор затравливали в случае необходимости и выдерживали при 70-75 С в течение 15 мин. Смесь охладили до 10-12 С в течение 80 мин, а затем дополнительно охладили до 0-5 С и выдержали при этой температуре в течение 1 ч 55 мин. Полученную твердую фазу отфильтровали, промыли 96% этанолом (222 л) и высушили в вакууме при температуре не более 45 С до постоянной массы. Пироглутамат получили в форме порошка от серого до белого цвета (17,89 кг, откорректировано на содержание растворителя и воды, 26,5% от теоретического значения, 41,8 мас.% относительно исходной массы рацемического индолнитрила). Продукт имел следующие характеристики. Инфракрасный спектр: продукт получили в форме диска бромида калия с номинальной концентрацией 1%, и измерили ИК спектр в пределах от 4000 до 500 см-1 при 21 С на приборе Mattson 2020 Galaxy FTIR, получив следующие основные пики:(см-1) 3222; 3055-2440(NH2-); 2216 (-CN); 1688 (-С=O); 1643 (-С=O); 1563 (изгиб N-H); (вибрации ароматических СН); 1464 (С-Н деформации СН 2 и СН 3); 1275,1228 (растяжение -С-O); 805 (С-Н из плоской деформации). Протонный (1H) ЯМР: получили протонный (1H) ЯМР спектр продукта при 270 МГц в дейтерированном ДМСО со следующими основными пиками:(промиль) 11,5 (NH, индол); 7,9 (ароматический Н); 7,47 (NH, пироглутамат); 7,43 (ароматический Н); 7,34 (ароматический Н); 3,9 (пироглутамат); 3,7 (вода); 3,2, 3,15, 2,85,и 2,7 (тетрагидрокарбазол); 2,55 (СН 3); 2,5(5 мольэквивалентов, 1,48 л), и при перемешивании получили раствор темно-коричневого цвета. Добавили одной порцией комплекс бортрифторидуксусной кислоты (6 моль-эквивалентов, 004586 14 14,1 л), а затем последовательно промыли двумя порциями уксусной кислоты (23 л) и получили густой белый осадок. Перемешанную смесь нагрели до 90-95 С, и растворили осадок при достижении температуры 95 С, получив раствор темно-коричневого цвета. Протекание реакции контролировали способом жидкостной хроматографии высокого разрешения по исчезновению пироглутамата и образованию R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, а также индолкарбоновой кислоты (в качестве побочного продукта). После окончания реакции (6 ч 18 мин) смесь охладили до 25-30 С и влили в 250-литровый реактор (рабочая емкость около 300 л) с перемешанной охлажденной (0-4 С) деминерализованной водой (31 л),поддерживая температуру ниже 30 С во всем объеме, при этом добавление продолжали в течение 12 мин. Затем провели последовательную промывку деминерализованной водой (5 л). Добавили н-бутанол (29 л), и охладили смесь до 510 С. Величину рН откорректировали до 14 путем добавления примерно 6 М раствора (106 л) гидрохлорида натрия, постоянно поддерживая температуру ниже 30 С, при этом добавление продолжали в течение 61 мин. Температуру отрегулировали до 25-30 С, выдержали смесь до осаждения фаз, а затем разделили. Водную фазу экстрагировали далее н-бутанолом (129 л, 115 л) при 25-30 С во всем объеме. Объединенные органические экстракты промыли деминерализованной водой (512 л) при 25-3 0 С во всем объеме. Органический раствор сконцентрировали в вакууме примерно до 37 л, поддерживая внутреннюю температуру ниже 40-50 С во всем объеме. Концентрат обработали суспензией (60 г) древесного угля в н-бутаноле и нагревали перемешанную смесь при обратном отекании в течение 27 мин. Смесь охладили до 55-60 С,очистили пропусканием через 1-микронный фильтр, а затем последовательно промыли 96% этанолом (11,5 л) при 55-60 С и отобрали образец для анализа способом жидкостной хроматографии высокого разрешения с целью определения содержания продукта (3,76 кг, 92,4% от теоретического значения, 63,4% по массе). РастворR-(+)-6-карбоксамидо-3-N-метиламино 1,2,3,4-тетрагидрокарбазола передали непосредственно на следующую операцию для получения сукцината. 3.4. Получение сукцината R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. Раствор R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола в растворе нбутанола/этанола (1 моль-эквивалент, 8,77 кг в 114 л) в 100-литровом реакторе (рабочая емкость около 130 л) сконцентрировали в вакууме до 42 л, поддерживая внутреннюю температуру 70-100 С, а затем отрегулировали температуру в пределах 65-70 С. Добавили 96% этанол (11,5(пределы 3-4:1). Поскольку присутствовала твердая фаза, смесь нагрели до 85-90 С и перемешивали при этой температуре до полного растворения, а затем охладили до 65-70 С. В 250-литровом реакторе янтарную кислоту (1,1 моль-эквивалента, 4,65 кг в 114 л) растворили в смеси этанол/вода (3:1, 88 л) и нагрели до 4850 С. В этой точке проверили отсутствие выпадения осадка. Раствор R-(+)-6-карбоксамидо-3N-метиламино-1,2,3,4-тетрагидрокарбазола (при 65-70 С) очистили пропусканием через 1 микронный фильтр в раствор янтарной кислоты,находящейся в 250-литровом реакторе при температуре 48-50 С, при этом добавление продолжали в течение 60 мин, а затем последовательно промыли 96% эталоном (9 л) также при 65-70 С. В этот момент весь материал находился в растворе. Смесь охлаждали до 24-26 С в течение 60 мин, и, в случае необходимости,вносили затравку. Температуру н-бутанола (88 л) довели до 20-25 С и добавили его в кристаллизационную смесь в течение 30 мин, поддерживая температуру смеси 20-25 С. Затем смесь охладили до 8-10 С в течение 80 мин. После этого смесь охладили дополнительно в пределах от -2 до 2 С с последующим перемешиванием при данной температуре в течение 1 ч 40 мин. Твердую фазу отобрали фильтрацией, промыли замещением 96% этанолом (2 х 9 л) и высушили в вакууме при температуре не более 25 С, получив моногидрат сукцинатаR-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола в форме порошка от белого до серого цвета (12,23 кг (откорректировано), 89,4% от теоретического значения, 139,4% по массе). 3.5. Перекристаллизация моногидрата сукцината R-(+)-6-карбоксамидо-3-N-метиламино 1,2,3,4-тетрагидрокарбазола. Моногидрат сукцината(29,08 л) и 96% этанол (80 л) загрузили в 100 литровый реактор (рабочая емкость около 130 л),и нагрели смесь до 40 С, чтобы обеспечить полное растворение. Раствор очистили пропусканием через 1-микронный фильтр в 250 литровый реактор (рабочая емкость около 300 л), а затем последовательно промыли 96% эталоном (30 л) также при 40 С. Перемешанную смесь нагрели до обратного cтекания в течение 1 ч 20 мин, после чего произошло полное растворение. В случае необходимости смесь можно выдерживать при обратном cтекании до 1 ч,чтобы обеспечить полное растворение. Затем раствор охладили до 0-10 С в течение 2 ч 53 мин, при этом продукт начал кристаллизоваться из раствора, образуя вязкую массу. Далее смесь охладили до 0-5 С с последующим перемеши 004586 16 ванием при этой температуре в течение 1 ч 53 мин. Твердую фазу отобрали фильтрацией,промыли путем вытеснения 96% этанолом(1 х 22,5 л) и высушили в вакууме при температуре не более 25 С, получив моногидрат сукцината R-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола в форме порошка от белого до серого цвета (8,72 кг (откорректировано), 74,8 мас.%). Продукт имел следующие характеристики. Инфракрасный спектр: продукт получили в форме диска бромида калия с номинальной концентрацией 1% и измерили ИК спектр в пределах от 4000 до 500 см-1 при 21 С на прибореMattson 2020 Galaxy FTIR, получив следующие основные пики:(см-1) 3500-2000 (водная группа ОН, широкий); 3399 (N-H растяжение); 3180(ароматическое кольцо С-Н). Протонный (1 Н) ЯМР: получили протонный (1 Н) ЯМР спектр продукта при 500 МГц в дейтерированном ДМСО со следующими основными пиками:(промиль) 11,1 (циклическая группа NH); 8,05 (ароматический Н); 7,85 (один Н из NH2); 7,65, 7,3 (ароматический Н); 7,05 (один Н изR-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, включающий операцию разделения энантиомерной смеси соединения тетрагидрокарбазола, отличающийся тем, что разделяют энантиомерную смесь соединения формулы I 2. Способ по п.1, отличающийся тем, что разделение энантиомеров осуществляют обработкой смеси L-пироглутаминовой кислотой. 3. Способ по пп.1 и 2, отличающийся тем,что соединение формулы I содержит рацемическую смесь энантиомеров. 4. Способ полученияR-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или его сольвата, который включает гидролиз соединения тетрагидрокарбазола, отличающийся тем, что проводят гидролиз R-(+)-6-циано-3-N-метиламино-1,2,3,4-тет 17 рагидрокарбазола, его соли или его сольвата,возможно, с последующим образованием соли. 5. Способ полученияR-(+)-6-карбоксамидо-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или сольвата по пп.1-4, отличающийся тем, что он включает а) разделение энантиомерной смеси 6 циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола для полученияR-(+)-6-циано-3-Nметиламино-1,2,3,4-тетрагидрокарбазола,его соли или его сольвата и б) гидролиз R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола, его соли или его сольвата, возможно, с последующим образованием соли. 6. Способ по пп.1-5, отличающийся тем,что 6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазол формулы I получают в результате реакции 4-цианофенилгидразина с 4-метиламиноциклогексаноном или его защищенным производным. 7. Способ по п.6, отличающийся тем, что защищенное производное 4-метиламиноциклогексанона является гидрохлоридом 4-метиламиноциклогексанон-(2'2'-диметилтриметилен)кеталя. 18 8. Способ по п.7, отличающийся тем, что гидрохлорид 4-метиламиноциклогексанон-(2'2'диметилтриметилен)кеталя получают в результате реакции 1,4-циклогександионмоно-2'2'диметилтриметиленкеталя с метиламином. 9. Способ по пп.1-8, отличающийся тем,что включает описанные операции (1)-(4), возможно, с последующим образованием соли. 10. Соединение формулы II или его соль или сольват. 11. L-пироглутамат R-(+)-6-циано-3-N-метиламино-1,2,3,4-тетрагидрокарбазола. 12. Применение L-пироглутаминовой кислоты для разделения энантиомерной смеси соединения формулы
МПК / Метки
МПК: C07D 209/88
Метки: получения, способ, r-(+)-6-карбоксамидо-3-n-метиламино-1,2,3,4-тетрагидрокарбазола
Код ссылки
<a href="https://eas.patents.su/10-4586-sposob-polucheniya-r-6-karboksamido-3-n-metilamino-1234-tetragidrokarbazola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения r-(+)-6-карбоксамидо-3-n-метиламино-1,2,3,4-тетрагидрокарбазола</a>
Предыдущий патент: Композиция для изготовления строительных материалов
Следующий патент: Парентеральная цисплатиновая эмульсия
Случайный патент: Силовой или коммуникационный кабель с огнезащитным полимерным слоем














